Karbonat
| |
| İsimler | |
|---|---|
| Tercih edilen IUPAC adı
Karbonat | |
| Sistematik IUPAC adı
Trioksidokarbonat | |
| Tanımlayıcılar | |
CAS Numarası
|
|
3D model (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
| UNII | |
InChI
| |
GÜLÜMSEMELER
| |
| Özellikler | |
Kimyasal formül
|
CO2- 3 |
| Molar kütle | 60.008 g-mol-1 |
| Konjugat asit | Bikarbonat |
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |
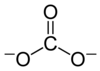
Karbonat, CO2- formülüne sahip çok atomlu bir iyon olan karbonat iyonunun varlığı ile karakterize edilen bir karbonik asit (H2CO3) tuzudur.
3. Karbonat kelimesi, karbonat grubu C(=O)(O-)2 içeren organik bir bileşik olan karbonat esterini de ifade edebilir. ⓘ
Bu terim aynı zamanda karbonasyonu tanımlamak için bir fiil olarak da kullanılır: karbonatlı su ve diğer gazlı içecekleri üretmek için sudaki karbonat ve bikarbonat iyonlarının konsantrasyonlarını yükseltme işlemi - ya basınç altında karbondioksit gazı eklenerek ya da karbonat veya bikarbonat tuzları suda çözülerek. ⓘ
Jeoloji ve mineralojide "karbonat" terimi hem karbonat minerallerini hem de karbonat kayasını (esas olarak karbonat minerallerinden oluşur) ifade edebilir ve her ikisinde de karbonat iyonu, CO2-
3. Karbonat mineralleri son derece çeşitlidir ve kimyasal olarak çökelmiş tortul kayaçlarda her yerde bulunur. En yaygın olanları kalsit veya kalsiyum karbonat, CaCO3, kireçtaşının ana bileşeni (aynı zamanda yumuşakça kabuklarının ve mercan iskeletlerinin ana bileşeni); dolomit, bir kalsiyum-magnezyum karbonat CaMg(CO3)2; ve siderit veya demir (II) karbonat, FeCO3, önemli bir demir cevheridir. Sodyum karbonat ("soda" veya "natron") ve potasyum karbonat ("potas") antik çağlardan beri temizlik, koruma ve cam üretimi için kullanılmaktadır. Karbonatlar, demir eritme, Portland çimentosu ve kireç üretimi için hammadde olarak, seramik sırlarının bileşiminde ve daha fazlası gibi endüstride yaygın olarak kullanılmaktadır. ⓘ
Yapı ve bağlanma
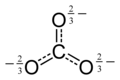
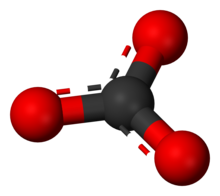
Karbonat iyonu en basit oksokarbon anyonudur. D3h moleküler simetriye sahip trigonal düzlemsel bir düzenlemede üç oksijen atomu ile çevrili bir karbon atomundan oluşur. Moleküler kütlesi 60,01 g/mol'dür ve toplam -2 resmi yük taşır. Hidrojenkarbonat (bikarbonat) iyonunun eşlenik bazıdır, HCO-
3'ün eşlenik bazı olan H
2CO
3, karbonik asit. ⓘ
Karbonat iyonunun Lewis yapısında negatif oksijen atomlarına iki (uzun) tek bağ ve nötr bir oksijen atomuna bir kısa çift bağ vardır. ⓘ
Bu yapı, üç bağın aynı uzunlukta ve üç oksijen atomunun eşdeğer olduğunu ima eden iyonun gözlemlenen simetrisi ile uyumsuzdur. İzoelektronik nitrat iyonu örneğinde olduğu gibi, simetri üç yapı arasında bir rezonans ile sağlanabilir:
Bu rezonans, kesirli bağlar ve delokalize yükler içeren bir model ile özetlenebilir:
Kimyasal özellikler
Metal karbonatlar genellikle ısındığında ayrışır, karbondioksiti uzun vadeli karbon döngüsünden kısa vadeli karbon döngüsüne salar ve geride metalin bir oksitini bırakır. Kireç taşının kireç fırınında kavrulmasıyla elde edilen sönmemiş kireç veya kalsiyum oksit CaO'nun Latince adı olan calx'ten sonra bu işleme kalsinasyon adı verilir. ⓘ
Karbonat tuzu, pozitif yüklü bir iyon olan M+
, M2+
veya M3+
iyonunun negatif yüklü oksijen atomları ile elektrostatik çekim oluşturarak birleşir ve iyonik bir bileşik oluşturur:
- 2 M+
+ CO2-
3 → M
2CO
3 ⓘ
- M2+
+ CO2-
3 → MCO
3 ⓘ
- 2 M3+
+ 3 CO2-
3 → M
2(CO
3)
3 ⓘ
Karbonat tuzlarının çoğu standart sıcaklık ve basınçta suda çözünmez ve çözünürlük sabitleri 1×10-8'den azdır. İstisnalar arasında lityum, sodyum, potasyum, rubidyum, sezyum ve amonyum karbonatların yanı sıra birçok uranyum karbonat bulunur. ⓘ
Sulu çözeltide karbonat, bikarbonat, karbondioksit ve karbonik asit dinamik bir denge içinde birlikte bulunur. Kuvvetli bazik koşullarda karbonat iyonu baskınken, zayıf bazik koşullarda bikarbonat iyonu yaygındır. Daha asit koşullarda, sulu karbondioksit, CO2(aq), su, H2O ile karbonik asit ile dengede olan ana formdur - denge güçlü bir şekilde karbondioksite doğrudur. Dolayısıyla sodyum karbonat baziktir, sodyum bikarbonat zayıf baziktir, karbondioksitin kendisi ise zayıf bir asittir. ⓘ
Karbonatlı su, CO2'nin basınç altında suda çözünmesiyle oluşur. CO2'nin kısmi basıncı düşürüldüğünde, örneğin bir kutu soda açıldığında, karbonat formlarının (karbonat, bikarbonat, karbondioksit ve karbonik asit) her biri için denge, çözeltideki CO2 konsantrasyonu CO2'nin o sıcaklık ve basınçtaki çözünürlüğüne eşit olana kadar değişir. Canlı sistemlerde bir enzim olan karbonik anhidraz, CO2 ve karbonik asidin birbirine dönüşümünü hızlandırır. ⓘ
Çoğu metalin karbonat tuzları suda çözünmemesine rağmen, aynı durum bikarbonat tuzları için geçerli değildir. Çözeltide karbonat, bikarbonat, karbondioksit ve karbonik asit arasındaki bu denge, değişen sıcaklık ve basınç koşullarına göre sürekli değişir. CaCO3 gibi çözünmeyen karbonatlarla metal iyonları söz konusu olduğunda, çözünmeyen bileşiklerin oluşumu ortaya çıkar. Bu, sert suyun neden olduğu boruların içindeki kireç birikiminin bir açıklamasıdır. ⓘ
İnorganik terminolojide karbonat
Karbonat anyonu için sistematik katkı maddesi IUPAC adı trioksidokarbonat(2-)'dir. Benzer şekilde, siyanür anyonu CN- nitridokarbonat(1-) olarak adlandırılır. Ancak, silikat(4-) (ortosilik asit) ile benzerlik gösteren karbonat(4-) (ortokarbonik asit) için aynı mantığı takip etmek, bu tür normal sıcaklık ve basınç koşulları altında hiçbir zaman tanımlanmadığından, sistematik katkı maddesi isimlendirmesinde hiçbir anlam ifade etmez. Ortokarbonik asit enerjik olarak ortosilik asitten çok daha az kararlıdır ve dört oksijen atomuna bağlı tek bir merkezi karbon atomunun enerjik olarak elverişsiz orbital konfigürasyonu nedeniyle normal koşullar altında var olamaz. ⓘ
Organik karbonatlar
Organik kimyada karbonat, biri çift bağlı olmak üzere üç oksijen atomuna bağlı bir karbon atomu içeren daha büyük bir molekül içindeki bir fonksiyonel grubu da ifade edebilir. Bu bileşikler organokarbonatlar veya karbonat esterleri olarak da bilinir ve ROCOOR′ veya RR′CO3 genel formülüne sahiptir. Önemli organokarbonatlar arasında dimetil karbonat, siklik bileşikler etilen karbonat ve propilen karbonat ve fosgen yerine geçen trifosgen bulunur. ⓘ
Tampon
Kanda bir tampon olarak şu şekilde çalışır: pH düşük olduğunda, hidrojen iyonlarının konsantrasyonu çok yüksektir, bu nedenle kişi CO2 solur. Bu, denklemin sola kaymasına neden olur, esasen H+ iyonlarının konsantrasyonunu azaltarak daha bazik bir pH'a neden olur. ⓘ
pH çok yüksek olduğunda, kandaki hidrojen iyonlarının konsantrasyonu çok düşüktür, bu nedenle böbrekler bikarbonat (HCO-
3). Bu da denklemin sağa kaymasına neden olarak hidrojen iyonlarının konsantrasyonunu artırır ve pH'ın daha asidik olmasına yol açar. ⓘ
Üç önemli tersinir reaksiyon yukarıdaki pH dengesini kontrol eder:
- H2CO3 ⇌ H+ + HCO-
3 ⓘ
- H2CO3 ⇌ CO2 + H2O ⓘ
- CO2(aq) ⇌ CO2(g) ⓘ
Solunan CO2(g), CO2(aq)'yi tüketir, bu da H2CO3'ü tüketir ve Le Châtelier prensibiyle ilk reaksiyonda yukarıda bahsedilen kaymaya neden olur. Aynı prensibe göre, pH çok yüksek olduğunda, böbrekler bikarbonat (HCO-
3) üre döngüsü (veya Krebs-Henseleit ornitin döngüsü) yoluyla üre olarak idrara. Bikarbonatın uzaklaştırılmasıyla, hücresel solunumla üretilen CO2(g)'den gelen karbonik asitten (H2CO3) daha fazla H+ üretilir. ⓘ
En önemlisi, aynı tampon okyanuslarda da çalışır. Kalsiyum karbonattan oluşan çok sayıda deniz organizması (özellikle mercan) nedeniyle iklim değişikliği ve uzun vadeli karbon döngüsünde önemli bir faktördür. Artan sıcaklıklar nedeniyle karbonatın çözünürlüğünün artması, deniz kalsit üretiminin azalmasına ve atmosferik karbondioksit konsantrasyonunun artmasına neden olur. Bu da Dünya sıcaklığını artırır. Tonaj olarak CO2-
3 jeolojik ölçektedir ve tamamı denizde yeniden çözünerek atmosfere salınabilir ve CO2 seviyelerini daha da artırabilir. ⓘ
Karbonat tuzları
- Karbonata genel bakış:
Dünya dışındaki varlık
Genel olarak kayalarda karbonatların varlığının sıvı suyun varlığı için güçlü bir kanıt olduğu düşünülmektedir. Gezegenimsi bulutsu NGC 6302'nin son gözlemleri, Dünya'dakine benzer bir sulu değişimin olası olmadığı uzayda karbonatlar için kanıtlar göstermektedir. Gözlemlere uyabilecek başka mineraller de önerilmiştir. ⓘ
Mars meteoritlerinde az miktarda bulunmasına rağmen, yakın zamana kadar Mars'ta uzaktan algılama veya yerinde görevler yoluyla karbonat yatakları bulunmamıştır. Gusev ve Meridiani Planum'da yeraltı suyu var olmuş olabilir. ⓘ