Karbondioksit

| |||
|
| |||
| İsimler | |||
|---|---|---|---|
Diğer isimler
| |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| 3DMet | |||
Beilstein Referans
|
1900390 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
989 | ||
| KEGG | |||
| MeSH | Karbon+dioksit | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 1013 (gaz), 1845 (katı) | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
CO2 | ||
| Molar kütle | 44.009 g-mol-1 | ||
| Görünüş | Renksiz gaz | ||
| Koku |
| ||
| Yoğunluk |
| ||
| Kritik nokta (T, P) | 304.128(15) K (30.978(15) °C), 7.3773(30) MPa (72.808(30) atm) | ||
Süblimasyon
koşullar |
1 atm'de (0,101325 MPa) 194,6855(30) K (-78,4645(30) °C) | ||
Suda çözünürlük
|
25 °C (77 °F), 100 kPa (0,99 atm) sıcaklıkta 1,45 g/L | ||
| Buhar basıncı | 5.7292(30) MPa, 56.54(30) atm (20 °C (293.15 K)) | ||
| Asitlik (pKa) | 6.35, 10.33 | ||
Manyetik duyarlılık (χ)
|
-20,5-10-6 cm3/mol | ||
| Termal iletkenlik | 0,01662 W-m-1-K-1 (300 K (27 °C; 80 °F)) | ||
Kırılma indisi (nD)
|
1.00045 | ||
| Viskozite |
| ||
Dipol moment
|
0 D | ||
| Yapı | |||
Kristal yapı
|
Trigonal | ||
Moleküler şekil
|
Doğrusal | ||
| Termokimya | |||
Isı kapasitesi (C)
|
37,135 J/K-mol | ||
Std molar
entropi (S |
214 J-mol-1-K-1 | ||
Std entalpi
oluşumu (ΔfH⦵298) |
-393,5 kJ-mol-1 | ||
| Farmakoloji | |||
ATC kodu
|
V03AN02 (WHO) | ||
| Tehlikeler | |||
| NFPA 704 (yangın elması) | |||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LCLo (yayınlanan en düşük)
|
90.000 ppm (insan, 5 dakika) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 5000 ppm (9000 mg/m3) | ||
REL (Önerilen)
|
TWA 5000 ppm (9000 mg/m3), ST 30.000 ppm (54.000 mg/m3) | ||
IDLH (Acil tehlike)
|
40,000 ppm | ||
| Güvenlik bilgi formu (SDS) | Sigma-Aldrich | ||
| İlgili bileşikler | |||
Diğer anyonlar
|
| ||
Diğer katyonlar
|
| ||
| |||
İlgili bileşikler
|
| ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Karbondioksit (kimyasal formülü CO2), kuru havadan yaklaşık %53 daha yüksek yoğunluğa sahip renksiz bir gaz olarak ortaya çıkan kimyasal bir bileşiktir. Karbondioksit molekülleri, iki oksijen atomuna kovalent olarak çift bağlanmış bir karbon atomundan oluşur. Dünya atmosferinde doğal olarak bir eser gaz olarak bulunur. Mevcut konsantrasyonu hacimce yaklaşık %0,04 (417 ppm) olup, sanayi öncesi 280 ppm seviyelerinden yükselmiştir. Suda karbonik asit (H2CO3) oluşumuna bağlı olarak asidik bir çözelti oluşturur. Doğal kaynaklar arasında volkanlar, orman yangınları, kaplıcalar, gayzerler yer alır ve su ve asitlerde çözünerek karbonat kayalarından kurtulur. Karbondioksit suda çözünebildiği için yeraltı sularında, nehirlerde ve göllerde, buzullarda, buzullarda ve deniz suyunda doğal olarak bulunur. Petrol ve doğal gaz yataklarında bulunur. Karbondioksit keskin ve asidik bir kokuya sahiptir ve ağızda sodalı su tadı oluşturur, ancak normalde karşılaşılan konsantrasyonlarda kokusuzdur. ⓘ
Karbon döngüsündeki mevcut karbonun kaynağı olarak atmosferik karbondioksit, Dünya'daki yaşam için birincil karbon kaynağıdır ve Prekambriyen'in sonlarından beri Dünya'nın sanayi öncesi atmosferindeki konsantrasyonu fotosentetik organizmalar ve jeolojik olaylar tarafından düzenlenmektedir. Bitkiler, algler ve siyanobakteriler fotosentez adı verilen ve atık ürün olarak oksijen üreten bir süreçte karbondioksit ve sudan karbonhidrat sentezlemek için güneş ışığından gelen enerjiyi kullanırlar. Buna karşılık, oksijen tüketilir ve CO2, solunum yoluyla enerji üretmek için organik bileşikleri metabolize ettiklerinde tüm aerobik organizmalar tarafından atık olarak salınır. Bitkiler fotosentez için CO2'ye ihtiyaç duyduğundan ve insanlar ve hayvanlar gıda için bitkilere bağımlı olduğundan, CO2 dünyadaki yaşamın devam etmesi için gereklidir. ⓘ
Balıkların solungaçları aracılığıyla suya ve insanlar da dahil olmak üzere hava soluyan kara hayvanlarının akciğerleri aracılığıyla havaya geri gönderilir. Karbondioksit, organik maddelerin çürümesi ve ekmek, bira ve şarap yapımında şekerlerin fermantasyonu süreçleri sırasında üretilir. Odun, turba ve diğer organik maddelerin ve kömür, petrol ve doğal gaz gibi fosil yakıtların yanması ile üretilir. Birçok büyük ölçekli oksidasyon işleminde, örneğin akrilik asit üretiminde (5 milyon ton/yıldan fazla) istenmeyen bir yan üründür. ⓘ
Örneğin kaynak ve yangın söndürücülerde inert gaz olarak, hava tabancalarında ve petrol geri kazanımında basınçlandırma gazı olarak, kimyasal hammadde olarak ve kahvenin kafeinsizleştirilmesinde ve süperkritik kurutmada süperkritik sıvı çözücü olarak kullanılan çok yönlü bir endüstriyel malzemedir. İçme suyuna ve bira ve köpüklü şarap gibi gazlı içeceklere efervesans katmak için eklenir. Kuru buz olarak bilinen CO2'nin donmuş katı formu, soğutucu olarak ve kuru buz püskürtmede aşındırıcı olarak kullanılır. Yakıtların ve kimyasalların sentezi için bir hammaddedir. ⓘ
Karbondioksit, Dünya atmosferindeki en önemli uzun ömürlü sera gazıdır. Sanayi Devrimi'nden bu yana, başta fosil yakıtların kullanımı ve ormansızlaşmadan kaynaklanan insan kaynaklı emisyonlar, atmosferdeki konsantrasyonunu hızla artırarak küresel ısınmaya yol açmıştır. Karbondioksit ayrıca suda kolayca çözünerek karbonik asit oluşturduğundan okyanus asitlenmesine de neden olur. ⓘ
| Karbondioksit | |
|---|---|
 
| |
| Diğer adları | Karbonik asit gazı |
| Moleküler formülü | CO2 |
| Moleküler ağırlığı | 44,8 g/mol |
| Katı hali | Kuru buz |
| Görünümü | Renksiz |
| CAS numarası | [124-38-9] |
| Özellikleri | |
| Yoğunluk ve faz | 1600 kg/m³, katı 1,98 kg/m³, 298 K de gaz |
| Suda çözünürlüğü | 1,45 kg/m³; |
| Buharlaşma gizli ısısı | 25,13 kJ/mol |
| Erime noktası | -78 °C (195 K), |
| Kaynama noktası | -57 °C (216 K), |
| Asitlik (pKa) | 6,35 ve 10,33 |
| Viskozite | 0,07 cP at -78 °C |
| Yapısı | |
| Moleküler şekli | Doğrusal |
| Kristal yapısı | quartz-like |
| Dipole moment | sıfır |
| Hazards | |
| MSDS | External MSDS |
| Main hazards | asphyxiant, irritant |
| NFPA 704 | (liquid) |
| R/S statement | R: As, Fb S: 9, 23, 36a (liquid) |
| RTECS number | FF6400000 |
| Supplementary data page | |
| Structure & properties | n, εr, etc. |
| Spectral data | UV, IR, NMR, MS |
| Benzer bileşikler | |
| Benzer oksitler | metanal Demir (iii) oksit |
| Benzer bileşikler | Karbon Metan Karbonmonoksit |
| Belirtilenlerin dışında, bilgiler maddelerin (25 °C, 100 kPa'daki) standard halleri için verilmiştir. | |
Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz halinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınma da önemli bir pay sahibidir, yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır. ⓘ
Solunumdaki yeri açısından hayati önem arz eder. Oksijen akciğerlere üst hava yollarını geçerek gelir ve alveolde hemoglobin ile taşınarak alveole getirilmiş olan karbondioksit ile yer değiştirir. Daha sonra karbondioksit oksijenin takip ettiği yolla dışarıya verilir. Bitkiler, gündüz CO2 alır, O2 verirler. Gece ise O2 alır, CO2 verirler. ⓘ
CO2 serbest gaz halinde volkanik bölgelerden çıkan gazlarda, suda çözünmüş olarak ise maden suyunda bulunur. Şehir ve dağlık bölgelerde değişmek üzere atmosfer havasında ortalama %0,03-0,04 nispetinde, egzozda ise %13 nispetinde bulunur. ⓘ
Laboratuvarda CO2, kızdırılmış kok kömürü üzerinden hava geçirilerek elde edilir. CO2 kanda belli seviyelerde bulunur ve vücudumuzun tampon sistemlerinden birini meydana getirir. Kanda artması halinde asidoz, azalması halinde ise alkaloz meydana gelir. Bu durumlar dolaylı olarak hidrojen iyonu konsantrasyonunu etkilemesi ile meydana getirir. Atardamar kanında, CO2 basıncı 120 mm Hg'ye varırsa; baş ağrısı, adale seğirmeleri, oryantasyon bozukluğu, (olmayan şeyleri gören) bir şuur bulanıklığı, konfüzyon, hatta koma görülebilir. ⓘ
Tarihçe

Karbondioksit, ayrı bir madde olarak tanımlanan ilk gazdır. Yaklaşık 1640 yılında Flaman kimyager Jan Baptist van Helmont, kapalı bir kapta odun kömürü yaktığında ortaya çıkan külün kütlesinin orijinal odun kömürünün kütlesinden çok daha az olduğunu gözlemledi. Yorumuna göre kömürün geri kalanı "gaz" ya da "vahşi ruh" (spiritus sylvestris) olarak adlandırdığı görünmez bir maddeye dönüşmüştü. ⓘ
Karbondioksitin özellikleri 1750'lerde İskoç doktor Joseph Black tarafından daha fazla incelenmiştir. Kireçtaşının (kalsiyum karbonat) ısıtılabileceğini ya da asitlerle muamele edilerek "sabit hava" adını verdiği bir gaz elde edilebileceğini buldu. Sabit havanın havadan daha yoğun olduğunu ve ne alevi ne de hayvan yaşamını desteklediğini gözlemledi. Black ayrıca kireç suyundan (doymuş sulu kalsiyum hidroksit çözeltisi) fokurdatıldığında kalsiyum karbonatın çökeldiğini buldu. Bu olguyu, karbondioksitin hayvan solunumu ve mikrobiyal fermantasyon tarafından üretildiğini göstermek için kullanmıştır. 1772'de İngiliz kimyager Joseph Priestley, karbondioksit üretmek için tebeşir üzerine sülfürik asit (ya da Priestley'in bildiği adıyla vitriol yağı) damlatma ve gazla temas eden bir kase suyu çalkalayarak gazı çözünmeye zorlama işlemini anlattığı Suya Sabit Hava Emdirme başlıklı bir makale yayınladı. ⓘ
Karbondioksit ilk kez 1823 yılında Humphry Davy ve Michael Faraday tarafından sıvılaştırılmıştır (yüksek basınçta). Katı karbondioksitin (kuru buz) ilk tanımı Fransız mucit Adrien-Jean-Pierre Thilorier tarafından yapılmıştır. Thilorier 1835 yılında basınçlı bir sıvı karbondioksit kabı açmış, ancak sıvının hızla buharlaşmasıyla oluşan soğumanın katı CO2'den oluşan bir "kar" meydana getirdiğini görmüştür. ⓘ
Kimyasal ve fiziksel özellikler
Yapı, bağlanma ve moleküler titreşimler
Bir karbondioksit molekülünün simetrisi, denge geometrisinde doğrusal ve sentrosimetriktir. Karbondioksitteki karbon-oksijen bağının uzunluğu 116,3 pm olup, tipik bir tek C-O bağının kabaca 140-pm uzunluğundan belirgin şekilde daha kısadır ve karboniller gibi diğer C-O çoklu bağlı fonksiyonel grupların çoğundan daha kısadır. Sentrosimetrik olduğu için molekülün elektrik dipol momenti yoktur. ⓘ

Doğrusal bir triatomik molekül olarak CO2, diyagramda gösterildiği gibi dört titreşim moduna sahiptir. Simetrik ve antisimetrik germe modlarında, atomlar molekülün ekseni boyunca hareket eder. Molekülün simetrisi nedeniyle dejenere olan, yani aynı frekansa ve aynı enerjiye sahip olan iki eğilme modu vardır. Bir molekül bir yüzeye dokunduğunda veya başka bir moleküle temas ettiğinde, etkileşim iki mod için farklı olduğundan iki bükülme modunun frekansı farklı olabilir. Titreşim modlarından bazıları kızılötesi (IR) spektrumunda gözlenir: 2349 cm-1 dalga sayısındaki (dalga boyu 4,25 μm) antisimetrik germe modu ve 667 cm-1 dalga sayısındaki (dalga boyu 15 μm) dejenere eğilme modu çifti. Simetrik germe modu bir elektrik dipolü oluşturmaz, bu nedenle IR spektroskopisinde gözlenmez, ancak Raman spektroskopisi ile 1388 cm-1'de (dalga boyu 7,2 μm) tespit edilir. ⓘ
Gaz fazında, karbondioksit molekülleri önemli ölçüde titreşime uğrar hareket eder ve sabit bir yapıya sahip değildir. Bununla birlikte, bir Coulomb patlama görüntüleme deneyinde, moleküler yapının anlık görüntüsü çıkarılabilir. Karbondioksit için böyle bir deney gerçekleştirilmiştir. Bu deneyin sonucu ve teorik sonuç ab initio potansiyel enerji yüzeyine dayalı hesaplamalar molekülün, gaz fazındaki hiçbir molekülün hiçbir zaman tam olarak doğrusal değildir. ⓘ
Sulu çözeltide
Karbondioksit suda çözünür ve suda tersinir olarak H
2CO
3 (karbonik asit), suda iyonlaşması tamamlanmadığı için zayıf bir asittir.
- CO
2 + H
2O ⇌ H
2CO
3 ⓘ
Karbonik asidin hidrasyon denge sabiti şöyledir (25 °C'de). Dolayısıyla, karbondioksitin büyük bir kısmı karbonik aside dönüşmez, CO2 molekülleri olarak kalır ve pH'ı etkilemez. ⓘ
Bağıl CO konsantrasyonları
2, H
2CO
3 ve deprotonlanmış formlar HCO-
3 (bikarbonat) ve CO2-
3(karbonat) pH'a bağlıdır. Bjerrum grafiğinde gösterildiği gibi, nötr veya hafif alkali suda (pH > 6.5), bikarbonat formu baskındır (>%50) ve deniz suyu pH'ında en yaygın (>%95) hale gelir. Çok alkali suda (pH > 10.4), baskın (>%50) form karbonattır. Tipik pH = 8.2-8.5 ile hafif alkali olan okyanuslar, litre başına yaklaşık 120 mg bikarbonat içerir. ⓘ
Diprotik olan karbonik asit, ilki bikarbonat (hidrojen karbonat olarak da adlandırılır) iyonuna (HCO3-) ayrışma için olmak üzere iki asit ayrışma sabitine sahiptir:
- H2CO3 ⇌ HCO3- + H+
- Ka1 = 2,5×10-4 mol/L; 25 °C'de pKa1 = 3,6.
Bu, aşağıdaki gibi tanımlanan gerçek birinci asit ayrışma sabitidir Burada payda sadece kovalent bağlı H2CO3 içerir ve hidratlı CO2(aq) içermez. Çok daha küçük olan ve sıklıkla alıntılanan 4,16×10-7 değeri, tüm çözünmüş CO2'nin karbonik asit olarak mevcut olduğu (yanlış) varsayımıyla hesaplanan görünür bir değerdir, bu nedenle . Çözünmüş CO2'nin çoğu CO2 molekülleri olarak kaldığından, Ka1(görünür) çok daha büyük bir paydaya ve gerçek Ka1'den çok daha küçük bir değere sahiptir. ⓘ
Bikarbonat iyonu, çözeltinin pH değerine bağlı olarak asit veya baz olarak hareket edebilen amfoterik bir türdür. Yüksek pH'da, karbonat iyonuna (CO32-) önemli ölçüde ayrışır:
- HCO3- ⇌ CO32- + H+
- Ka2 = 4,69×10-11 mol/L; pKa2 = 10,329 ⓘ
Organizmalarda karbonik asit üretimi karbonik anhidraz enzimi tarafından katalize edilir. ⓘ
CO2'nin kimyasal reaksiyonları
CO2, benzaldehit veya güçlü α,β-doymamış karbonil bileşikleriyle karşılaştırılabilir bir elektrofilik reaktiviteye sahip güçlü bir elektrofildir. Bununla birlikte, benzer reaktiviteye sahip elektrofillerin aksine, nükleofillerin CO2 ile reaksiyonları termodinamik olarak daha az tercih edilir ve genellikle yüksek oranda tersinir olarak bulunur. Grignard reaktifleri ve organolityum bileşikleri tarafından sağlanan karbanyonlar gibi sadece çok güçlü nükleofiller CO2 ile reaksiyona girerek karboksilatlar verir:
Metal karbondioksit komplekslerinde CO2, CO2'nin diğer kimyasallara dönüşümünü kolaylaştırabilen bir ligand görevi görür. ⓘ
CO2'nin CO'ya indirgenmesi normalde zor ve yavaş bir reaksiyondur:
- CO2 + 2 e- + 2H+ → CO + H2O ⓘ
Fotoototroflar (yani bitkiler ve siyanobakteriler) güneş ışığında bulunan enerjiyi kullanarak havadan ve sudan emilen CO2'den basit şekerleri fotosentezlemek için kullanır:
- n CO2 + n H
2O → (CH
2O)
n + n O
2 ⓘ
Bu reaksiyon için pH 7 civarındaki redoks potansiyeli standart hidrojen elektroduna karşı yaklaşık -0,53 V'tur. Nikel içeren karbon monoksit dehidrojenaz enzimi bu süreci katalize eder. ⓘ
Fiziksel özellikler

Karbondioksit renksizdir. Düşük konsantrasyonlarda gaz kokusuzdur; ancak yeterince yüksek konsantrasyonlarda keskin, asidik bir kokusu vardır. Standart sıcaklık ve basınçta karbondioksitin yoğunluğu 1,98 kg/m3 civarında olup havanın yaklaşık 1,53 katıdır. ⓘ
Karbondioksitin 0,51795(10) MPa (5,11177(99) atm) altındaki basınçlarda sıvı hali yoktur. Gaz, 1 atm (0,101325 MPa) basınçta 194,6855(30) K (-78,4645(30) °C) altındaki sıcaklıklarda doğrudan katıya dönüşür ve katı bu sıcaklığın üzerinde doğrudan gaza dönüşür. Katı haldeki karbondioksit genellikle kuru buz olarak adlandırılır. ⓘ

Sıvı karbondioksit yalnızca 0,51795(10) MPa (5,11177(99) atm) üzerindeki basınçlarda oluşur; karbondioksitin üçlü noktası 0,51795(10) MPa'da (5,11177(99) atm) 216,592(3) K'dir (-56,558(3) °C) (faz diyagramına bakın). Kritik nokta 7,3773(30) MPa'da (72,808(30) atm) 304,128(15) K'dir (30,978(15) °C). Yüksek basınçta gözlenen bir başka katı karbondioksit formu da amorf cam benzeri bir katıdır. Karbonya adı verilen bu cam formu, ısıtılmış CO2'nin bir elmas örs içinde aşırı basınçlarda (40-48 GPa veya yaklaşık 400.000 atmosfer) aşırı soğutulmasıyla üretilir. Bu keşif, karbondioksitin, silisyum dioksit (silika cam) ve germanyum dioksit gibi element ailesinin diğer üyelerine benzer bir cam halinde var olabileceği teorisini doğruladı. Ancak silika ve germanyum camlarının aksine, karbonyum camı normal basınçlarda kararlı değildir ve basınç serbest bırakıldığında gaza dönüşür. ⓘ
Kritik noktanın üzerindeki sıcaklık ve basınçlarda karbondioksit, süperkritik karbondioksit olarak bilinen süperkritik bir sıvı gibi davranır. ⓘ
İzolasyon ve üretim
Karbondioksit havadan damıtma yoluyla elde edilebilir, ancak bu yöntem verimsizdir. Endüstriyel olarak, karbondioksit ağırlıklı olarak geri kazanılmayan bir atık üründür ve çeşitli ölçeklerde uygulanabilen çeşitli yöntemlerle üretilir. ⓘ
Metan (doğal gaz), petrol damıtıkları (benzin, dizel, gazyağı, propan), kömür, odun ve genel organik madde gibi tüm karbon bazlı yakıtların yanması karbondioksit ve saf karbon durumu hariç su üretir. Örnek olarak, metan ve oksijen arasındaki kimyasal reaksiyon:
- CH
4 + 2 O
2 → CO
2 + 2 H
2O ⓘ
Demir, yüksek fırında kok kömürü ile oksitlerinden indirgenerek pik demir ve karbondioksit üretilir: Karbondioksit, buhar reformu yoluyla hidrojenin endüstriyel üretiminin ve amonyak üretiminde su gazı kaydırma reaksiyonunun bir yan ürünüdür. Bu süreçler su ve doğal gazın (çoğunlukla metan) reaksiyonu ile başlar. Bu, bira ve alkolsüz içeceklerin karbonatlanmasında kullanılan gıda sınıfı karbondioksitin önemli bir kaynağıdır ve kümes hayvanları gibi hayvanları bayıltmak için de kullanılır. 2018 yazında, birkaç amonyak tesisinin bakım için geçici olarak kapatılması nedeniyle Avrupa'da bu amaçlar için karbondioksit sıkıntısı ortaya çıkmıştır. ⓘ
Karbonatlar
Kireçtaşının termal ayrışması ile üretilir, CaCO
3 yaklaşık 850 °C'de (1.560 °F) ısıtılarak (kalsinasyon), birçok endüstriyel kullanıma sahip bir bileşik olan sönmemiş kireç (kalsiyum oksit, CaO) üretiminde kullanılır:
- CaCO
3 → CaO + CO
2 ⓘ
Asitler CO2'yi çoğu metal karbonattan serbest bırakır. Sonuç olarak, asitlendirilmiş suyun kireçtaşı veya dolomit üzerindeki etkisiyle üretildiği doğal karbondioksit kaynaklarından doğrudan elde edilebilir. Hidroklorik asit ve kalsiyum karbonat (kireçtaşı veya tebeşir) arasındaki reaksiyon aşağıda gösterilmiştir:
- CaCO
3 + 2 HCl → CaCl
2 + H
2CO
3 ⓘ
Karbonik asit (H
2CO
3) daha sonra su ve CO2'ye ayrışır:
- H
2CO
3 → CO
2 + H
2O ⓘ
Bu tür reaksiyonlara gaz açığa çıkarken köpürme veya kabarcıklanma ya da her ikisi de eşlik eder. Atık asit akışlarını nötralize etmek için kullanılabildikleri için endüstride yaygın kullanımları vardır. ⓘ
Fermantasyon
Karbondioksit, bira, viski ve diğer alkollü içeceklerin mayalanmasında ve biyoetanol üretiminde şekerin fermantasyonunun bir yan ürünüdür. Maya, alkol olarak da bilinen CO2 ve etanol üretmek için şekeri aşağıdaki gibi metabolize eder:
- C
6H
12O
6 → 2 CO
2 + 2 C
2H
5OH ⓘ
Tüm aerobik organizmalar karbonhidratları, yağ asitlerini ve proteinleri okside ettiklerinde CO2 üretirler. İlgili çok sayıda reaksiyon son derece karmaşıktır ve kolayca tanımlanamaz. Bakınız (hücresel solunum, anaerobik solunum ve fotosentez). Glikoz ve diğer monosakkaritlerin solunumu için denklem şöyledir:
- C
6H
12O
6 + 6 O
2 → 6 CO
2 + 6 H
2O ⓘ
Anaerobik organizmalar organik maddeleri ayrıştırarak metan ve karbondioksit ile diğer bileşiklerin izlerini üretir. Organik maddenin türü ne olursa olsun, gazların üretimi iyi tanımlanmış bir kinetik model izler. Karbondioksit, çöp sahalarındaki ayrışmadan kaynaklanan gazın yaklaşık %40-45'ini oluşturur ("çöp sahası gazı" olarak adlandırılır). Geri kalan %50-55'in çoğu metandır. ⓘ
Uygulamalar
Karbondioksit gıda endüstrisi, petrol endüstrisi ve kimya endüstrisi tarafından kullanılmaktadır. Bileşiğin çeşitli ticari kullanımları vardır ancak kimyasal olarak en büyük kullanım alanlarından biri gazlı içeceklerin üretimidir; soda, bira ve köpüklü şarap gibi gazlı içeceklerde ışıltıyı sağlar. ⓘ
Kimyasalların öncüsü
Kimya endüstrisinde, karbondioksit esas olarak üre üretiminde bir bileşen olarak tüketilir ve daha küçük bir kısmı metanol ve bir dizi başka ürün üretmek için kullanılır. Sodyum salisilat gibi bazı karboksilik asit türevleri Kolbe-Schmitt reaksiyonu ile CO2 kullanılarak hazırlanır. ⓘ
Kimyasal üretim için CO2 kullanan geleneksel süreçlere ek olarak, elektrokimyasal yöntemler de araştırma düzeyinde incelenmektedir. Özellikle, CO2'den (metanol gibi) yakıt üretimi için yenilenebilir enerjinin kullanılması, kolayca taşınabilen ve geleneksel yakma teknolojilerinde kullanılabilen ancak net CO2 emisyonu olmayan yakıtlarla sonuçlanabileceğinden caziptir. ⓘ
Tarım
Bitkiler fotosentez yapabilmek için karbondioksite ihtiyaç duyarlar. Seraların atmosferi, bitki büyüme hızını sürdürmek ve artırmak için ilave CO2 ile zenginleştirilebilir (eğer büyükse, zenginleştirilmelidir). Çok yüksek konsantrasyonlarda (atmosferik konsantrasyonun 100 katı veya daha fazla), karbondioksit hayvan yaşamı için toksik olabilir, bu nedenle konsantrasyonu birkaç saat boyunca 10.000 ppm (%1) veya daha yüksek bir seviyeye çıkarmak, bir seradaki beyaz sinekler ve örümcek akarları gibi zararlıları ortadan kaldıracaktır. ⓘ
Gıdalar

Karbondioksit, gıda endüstrisinde itici gaz ve asitlik düzenleyici olarak kullanılan bir gıda katkı maddesidir. AB (E numarası E290 olarak listelenmiştir), ABD ve Avustralya ve Yeni Zelanda'da (INS numarası 290 olarak listelenmiştir) kullanım için onaylanmıştır. ⓘ
Pop Rocks adı verilen bir şekerleme yaklaşık 4.000 kPa (40 bar; 580 psi) karbondioksit gazı ile basınçlandırılır. Ağza konulduğunda çözülür (tıpkı diğer sert şekerler gibi) ve gaz kabarcıklarını duyulabilir bir patlamayla serbest bırakır. ⓘ
Mayalayıcı maddeler karbondioksit üreterek hamurun kabarmasını sağlar. Ekmek mayası hamurdaki şekerlerin fermantasyonu ile karbondioksit üretirken, kabartma tozu ve karbonat gibi kimyasal mayalayıcılar ısıtıldıklarında veya asitlere maruz kaldıklarında karbondioksit açığa çıkarırlar. ⓘ
İçecekler
Karbondioksit, gazlı alkolsüz içecekler ve soda üretmek için kullanılır. Geleneksel olarak, bira ve köpüklü şarabın karbonatlanması doğal fermantasyon yoluyla gerçekleşir, ancak birçok üretici bu içecekleri fermantasyon sürecinden geri kazanılan karbondioksit ile karbonatlamaktadır. Şişelenmiş ve fıçı bira söz konusu olduğunda, kullanılan en yaygın yöntem geri dönüştürülmüş karbondioksit ile karbonatlamadır. İngiliz gerçek birası haricinde, fıçı bira genellikle soğuk oda veya mahzendeki fıçılardan bardaki dağıtım musluklarına bazen nitrojenle karıştırılan basınçlı karbondioksit kullanılarak aktarılır. ⓘ
Gazlı suyun tadı (ve diğer gazlı içeceklerdeki ilgili tat duyumları) gazın patlayan kabarcıklarından ziyade çözünmüş karbondioksitin bir etkisidir. Karbonik anhidraz 4 karbonik aside dönüşerek ekşi bir tada yol açar ve ayrıca çözünmüş karbondioksit somatosensoriyel bir tepkiye neden olur. ⓘ
Şarap yapımı

Kuru buz formundaki karbondioksit, yabani mayanın kendiliğinden fermantasyonunu önlemeye yardımcı olmak için toplandıktan sonra üzüm salkımlarını hızlı bir şekilde soğutmak için şarap yapımında soğuk ıslatma aşamasında sıklıkla kullanılır. Kuru buz kullanmanın su buzuna göre temel avantajı, üzüm şırasındaki şeker konsantrasyonunu ve dolayısıyla bitmiş şaraptaki alkol konsantrasyonunu azaltabilecek herhangi bir ilave su eklemeden üzümleri soğutmasıdır. Karbondioksit ayrıca Beaujolais şarabı üretiminde kullanılan karbonik maserasyon işlemi için hipoksik bir ortam yaratmak amacıyla da kullanılır. ⓘ
Karbondioksit bazen oksidasyonu önlemek için şarap şişelerini veya fıçı gibi diğer saklama kaplarını doldurmak için kullanılır, ancak şarabın içinde çözünerek daha önce durgun olan bir şarabı hafifçe köpüklü hale getirme sorunu vardır. Bu nedenle profesyonel şarap üreticileri tarafından bu işlem için nitrojen veya argon gibi diğer gazlar tercih edilmektedir. ⓘ
Çarpıcı hayvanlar
Karbondioksit genellikle kesimden önce hayvanları "sersemletmek" için kullanılır. Hayvanlar hemen bayıltılmadığından ve sıkıntı çekebileceğinden "bayıltma" yanlış bir isimlendirme olabilir. ⓘ
İnert gaz
Karbondioksit, taşınabilir basınçlı aletlerdeki pnömatik (basınçlı gaz) sistemler için en yaygın kullanılan sıkıştırılmış gazlardan biridir. Karbondioksit aynı zamanda kaynak için bir atmosfer olarak da kullanılır, ancak kaynak arkında çoğu metali oksitlemek için reaksiyona girer. Karbondioksitte yapılan kaynakların daha inert atmosferlerde yapılanlara göre daha kırılgan olduğuna dair önemli kanıtlara rağmen otomotiv endüstrisinde kullanımı yaygındır. MIG kaynağı için kullanıldığında, CO2 kullanımı bazen Metal Aktif Gaz için MAG kaynağı olarak adlandırılır, çünkü CO2 bu yüksek sıcaklıklarda reaksiyona girebilir. Gerçekten inert atmosferlere göre daha sıcak bir su birikintisi üretme eğilimindedir ve akış özelliklerini iyileştirir. Bununla birlikte, bunun nedeni su birikintisi bölgesinde meydana gelen atmosferik reaksiyonlar olabilir. Bu genellikle kaynak sırasında istenen etkinin tersidir, çünkü bölgeyi gevrekleştirme eğilimindedir, ancak nihai sünekliğin büyük bir endişe kaynağı olmadığı genel yumuşak çelik kaynağı için bir sorun olmayabilir. ⓘ
Karbondioksit, ucuz ve yanıcı olmadığı için basınçlı gaz gerektiren birçok tüketici ürününde kullanılır ve oda sıcaklığında yaklaşık 60 bar (870 psi; 59 atm) ulaşılabilir bir basınçta gazdan sıvıya faz geçişine uğrar, bu da belirli bir kaba normalde olduğundan çok daha fazla karbondioksit sığmasına izin verir. Can yelekleri genellikle hızlı şişirme için basınçlı karbondioksit kutuları içerir. Alüminyum CO2 kapsülleri ayrıca havalı tabancalar, paintball işaretleyicileri/silahları, bisiklet lastiklerini şişirmek ve karbonatlı su yapmak için sıkıştırılmış gaz kaynağı olarak satılmaktadır. Yüksek konsantrasyonlarda karbondioksit haşereleri öldürmek için de kullanılabilir. Sıvı karbondioksit, bazı gıda ürünlerinin ve teknolojik malzemelerin süperkritik kurutulmasında, taramalı elektron mikroskobu için numune hazırlanmasında ve kahve çekirdeklerinin kafeinsizleştirilmesinde kullanılır. ⓘ
Yangın söndürücü

Karbondioksit, alevin etrafındaki ortamı gazla doldurarak alevleri söndürmek için kullanılabilir. Kendisi alevi söndürmek için reaksiyona girmez, ancak oksijenin yerini alarak alevi aç bırakır. Bazı yangın söndürücüler, özellikle de elektrik yangınları için tasarlanmış olanlar, basınç altında sıvı karbondioksit içerir. Karbondioksit söndürücüler küçük yanıcı sıvı ve elektrik yangınlarında iyi sonuç verir, ancak sıradan yanıcı yangınlarda işe yaramaz, çünkü yanan maddeleri önemli ölçüde soğutmazlar ve karbondioksit dağıldığında atmosferik oksijene maruz kaldıklarında alev alabilirler. Genelde sunucu odalarında kullanılırlar. ⓘ
Karbondioksit ayrıca, belirli tehlikelerin yerel olarak uygulanması ve korunan bir alanın tamamen su altında bırakılması için sabit yangın koruma sistemlerinde bir söndürme maddesi olarak yaygın bir şekilde kullanılmaktadır. Uluslararası Denizcilik Örgütü standartları, gemi ambarları ve makine dairelerinin yangından korunması için karbondioksit sistemlerini tanımaktadır. Yeterince yüksek konsantrasyonlarda boğulmaya neden olabileceğinden, karbondioksit bazlı yangın koruma sistemleri birçok ölümle ilişkilendirilmiştir. CO2 sistemleri üzerine yapılan bir incelemede 1975 ile rapor tarihi (2000) arasında 72 ölüme ve 145 yaralanmaya neden olan 51 olay tespit edilmiştir. ⓘ
Çözücü olarak süperkritik CO2
Sıvı karbondioksit birçok lipofilik organik bileşik için iyi bir çözücüdür ve kahveden kafeini çıkarmak için kullanılır. Karbondioksit, organokloridler gibi daha geleneksel çözücülere daha az toksik bir alternatif olarak ilaç ve diğer kimyasal işleme endüstrilerinde dikkat çekmiştir. Bu nedenle bazı kuru temizleyiciler tarafından da kullanılmaktadır. Süperkritik karbondioksitin özellikleri nedeniyle bazı aerojellerin hazırlanmasında kullanılır. ⓘ
Tıbbi ve farmakolojik kullanımları
Tıpta, apne sonrası solunumun uyarılması ve oksijen seviyesinin stabilize edilmesi için oksijene %5'e kadar karbondioksit (atmosferik konsantrasyonun 130 katı) eklenir.
2/CO
2 kandaki denge. ⓘ
Karbondioksit %50'ye kadar oksijenle karıştırılarak solunabilir bir gaz haline getirilebilir; bu Carbogen olarak bilinir ve çeşitli tıbbi ve araştırma kullanımları vardır. ⓘ
Bir başka tıbbi kullanım alanı da volkanik akıntı sonrası oluşan karbondioksiti tedavi amaçlı kullanan kuru kaplıcalar olan mofette'lerdir. ⓘ
Enerji
Süperkritik CO2, Allam güç çevrimi motorunda çalışma sıvısı olarak kullanılır. ⓘ
Fosil yakıt geri kazanımı
Karbondioksit, petrolle karışabilir hale geldiğinde, genellikle süperkritik koşullar altında, üretim yapan petrol kuyularının içine veya bitişiğine enjekte edildiği geliştirilmiş petrol geri kazanımında kullanılır. Bu yaklaşım, birincil ekstraksiyona ek olarak kalıntı petrol doygunluğunu %7 ila %23 arasında azaltarak orijinal petrol geri kazanımını artırabilir. Hem bir basınçlandırma maddesi olarak işlev görür hem de yeraltındaki ham petrolün içinde çözündüğünde viskozitesini önemli ölçüde azaltır ve yüzey kimyasını değiştirerek petrolün rezervuardan çıkarma kuyusuna daha hızlı akmasını sağlar. Olgun petrol sahalarında, karbondioksiti enjeksiyon noktalarına taşımak için geniş boru ağları kullanılır. ⓘ
Geliştirilmiş kömür yatağı metan geri kazanımında, kömür damarının sıkışmış metanı serbest bırakmasını sağlamak için öncelikle suyun çıkarılmasına (basıncı düşürmek için) dayanan mevcut yöntemlerin aksine, karbondioksit metanın yerini almak üzere kömür damarına pompalanacaktır. ⓘ
Yakıta biyolojik dönüşüm
Enerji üretiminden elde edilen CO2'nin, daha sonra biyodizel yakıta dönüştürülebilecek alglerin büyümesini teşvik etmek için havuzlara köpürtülmesi önerilmiştir. Synechococcus elongatus siyanobakterisinin bir türü, fotosentez kullanarak CO2'den izobütiraldehit ve izobütanol yakıtlarını üretmek üzere genetik olarak tasarlanmıştır. ⓘ
Araştırmacılar, CO2'yi yakıtlara dönüştüren kimyasal reaksiyonlara güç sağlamak için bakterilerden izole edilen enzimleri kullanarak elektroliz adı verilen bir süreç geliştirdiler. ⓘ
Soğutucu akışkan

Sıvı ve katı karbondioksit, özellikle dondurma ve diğer dondurulmuş gıdaların taşınması ve depolanması sırasında kullanıldıkları gıda endüstrisinde önemli soğutucu akışkanlardır. Katı karbondioksit "kuru buz" olarak adlandırılır ve soğutma ekipmanının pratik olmadığı küçük sevkiyatlar için kullanılır. Katı karbondioksit, hava sıcaklığından bağımsız olarak normal atmosferik basınçta her zaman -78,5 °C'nin (-109,3 °F) altındadır. ⓘ
Sıvı karbondioksit (endüstri terminolojisinde R744 veya R-744), diklorodiflorometan (R12, bir kloroflorokarbon (CFC) bileşiği) kullanılmadan önce soğutucu akışkan olarak kullanılıyordu. CO2 bir rönesans yaşayabilir çünkü CFC'lerin ana ikamelerinden biri olan 1,1,1,2-tetrafloroetan (R134a, bir hidroflorokarbon (HFC) bileşiği) iklim değişikliğine CO2'den daha fazla katkıda bulunur. CO2'nin fiziksel özellikleri soğutma, soğutma ve ısıtma amaçları için son derece elverişlidir ve yüksek hacimsel soğutma kapasitesine sahiptir. CO2 sistemleri, 130 bara (1.900 psi; 13.000 kPa) kadar basınçlarda çalışma ihtiyacı nedeniyle, birçok sektörde seri üretim için zaten geliştirilmiş olan mekanik olarak oldukça dayanıklı rezervuarlar ve bileşenler gerektirir. Otomobil iklimlendirmesinde, 50°'den yüksek enlemler için tüm sürüş koşullarının %90'ından fazlasında CO2 (R744), HFC'lerin (örn. R134a) kullanıldığı sistemlerden daha verimli çalışır. Çevresel avantajları (GWP 1, ozon tabakasını inceltmez, toksik değildir, yanıcı değildir), onu diğerlerinin yanı sıra otomobillerde, süpermarketlerde ve ısı pompalı su ısıtıcılarında mevcut HFC'lerin yerini alacak geleceğin çalışma sıvısı haline getirebilir. Coca-Cola CO2 bazlı içecek soğutucuları üretmiştir ve ABD Ordusu CO2 soğutma ve ısıtma teknolojisiyle ilgilenmektedir. ⓘ
Minör kullanımlar

Karbondioksit, en eski lazer türlerinden biri olan karbondioksit lazerde lasing ortamıdır. ⓘ
Karbondioksit, suya sürekli gaz ekleyerek ve böylece pH'ın yükselmesini önleyerek yüzme havuzlarının pH'ını kontrol etme aracı olarak kullanılabilir. Bunun avantajları arasında (daha tehlikeli) asitlerin kullanılmasından kaçınılması da yer almaktadır. Benzer şekilde, resif akvaryumlarının bakımında da kullanılır; kalsiyum reaktörlerinde, kalsiyum karbonatın suda daha serbestçe çözünmesini sağlamak için kalsiyum karbonat üzerinden geçirilen suyun pH'ını geçici olarak düşürmek için yaygın olarak kullanılır, burada bazı mercanlar tarafından iskeletlerini oluşturmak için kullanılır. ⓘ
Nükleer enerji üretimi için İngiliz gelişmiş gaz soğutmalı reaktörde birincil soğutucu olarak kullanılır. ⓘ
Karbondioksit indüksiyonu, laboratuvar araştırma hayvanlarının ötenazisi için yaygın olarak kullanılmaktadır. CO2 uygulama yöntemleri arasında hayvanların doğrudan CO2 içeren kapalı, önceden doldurulmuş bir odaya yerleştirilmesi veya kademeli olarak artan bir CO2 konsantrasyonuna maruz bırakılması yer alır. Amerikan Veteriner Hekimler Birliği'nin 2020 karbondioksit indüksiyonu kılavuzunda, küçük kemirgenlerin insancıl ötenazisi için dakikada hazne veya kafes hacminin %30 ila %70'i arasında bir yer değiştirme oranının ideal olduğu belirtilmektedir. CO2 yüzdeleri, sıkıntıyı en aza indirmek için belirlenen optimum yüzdelere göre farklı türler için değişiklik gösterir. ⓘ
Karbondioksit ayrıca çeşitli ilgili temizlik ve yüzey hazırlama tekniklerinde de kullanılır. ⓘ
Dünya atmosferinde


Dünya atmosferindeki karbondioksit bir eser gazdır ve 2020 yılı sonu itibariyle küresel ortalama konsantrasyonu hacim olarak milyonda 415 parça (veya kütle olarak milyonda 630 parça) düzeyindedir. Atmosferik CO2 konsantrasyonları mevsimlere göre hafif dalgalanmalar gösterir; Kuzey Yarımküre'de ilkbahar ve yaz aylarında bitkiler gazı tükettikçe düşer ve kuzey sonbahar ve kış aylarında bitkiler uykuya daldıkça veya ölüp çürüdükçe yükselir. Konsantrasyonlar bölgesel bazda da değişir, en çok yere yakın bölgelerde ve havada çok daha küçük değişimler gösterir. Kentsel alanlarda konsantrasyonlar genellikle daha yüksektir ve iç mekanlarda arka plan seviyelerinin 10 katına ulaşabilir. CO2 emisyonları aynı zamanda stratosferin 1980'den bu yana 400 metre daralmasına yol açmıştır, bu da uydu operasyonlarını, GPS sistemlerini ve radyo iletişimini etkileyebilir. ⓘ
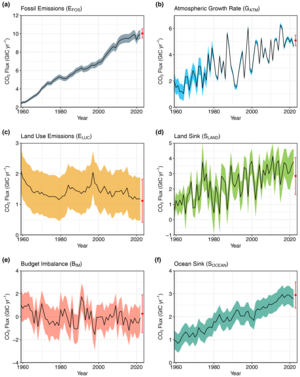
Karbondioksit konsantrasyonu insan faaliyetleri nedeniyle artmıştır. Fosil yakıtların çıkarılması ve yakılması, litosferde milyonlarca yıldır tutulan karbonun kullanılması, sanayileşme çağının başlangıcından 2020 yılına kadar atmosferdeki CO2 konsantrasyonunun yaklaşık %50 artmasına neden olmuştur. İnsan faaliyetlerinden kaynaklanan CO2'nin çoğu kömür, petrol ve doğal gazın yakılmasından salınmaktadır. Diğer büyük antropojenik kaynaklar arasında çimento üretimi, ormansızlaşma ve biyokütle yakılması yer almaktadır. İnsan faaliyetleri yılda 30 milyar tondan fazla CO2 (9 milyar ton fosil karbon) yayarken, volkanlar sadece 0,2 ila 0,3 milyar ton CO2 yaymaktadır. İnsan faaliyetleri CO2'nin yüz binlerce yıldır görülmeyen seviyelerin üzerine çıkmasına neden olmuştur. Şu anda, fosil yakıtların yakılmasıyla açığa çıkan karbondioksitin yaklaşık yarısı atmosferde kalmakta ve bitki örtüsü ve okyanuslar tarafından emilmemektedir. ⓘ
Görünür ışığa karşı şeffaf olan karbondioksit, kızılötesi aktif iki titreşim frekansında kızılötesi radyasyonu emen ve yayan bir sera gazıdır (yukarıdaki "Yapı ve bağlanma" bölümüne bakınız). Dünya yüzeyinden gelen ışık emisyonu, görünür bölgede en yoğun olan çok daha sıcak Güneş'ten gelen ışık emisyonunun aksine, 200 ila 2500 cm-1 arasındaki kızılötesi bölgede en yoğundur. Atmosferik CO2'nin titreşim frekanslarında kızılötesi ışığın emilmesi, enerjiyi yüzeyin yakınında hapsederek yüzeyi ve alt atmosferi ısıtır. Üst atmosfere daha az enerji ulaşır, dolayısıyla bu emilim nedeniyle daha soğuktur. ⓘ
CO2 ve metan, azot oksit ve ozon gibi diğer uzun ömürlü sera gazlarının atmosferik konsantrasyonlarındaki artışlar, kızılötesi radyasyon emilimini ve yayılımını güçlendirerek 20. yüzyılın ortalarından bu yana ortalama küresel sıcaklıkta artışa neden olmuştur. Karbondioksit, tüm bu diğer gazların toplamından daha büyük bir genel ısınma etkisine sahip olduğu için en büyük endişe kaynağıdır. Ayrıca, bu faaliyetin Dünya'nın hızlı karbon döngüsü üzerinde yarattığı dengesizlik nedeniyle, çıkarılan ve yakılan fosil karbonun kümülatif miktarı ile artan bir atmosferik ömre sahiptir. Bu da, bugüne kadar transfer edilen fosil karbonun bir kısmının (tahminen %20-35'i), bu karbon transfer faaliyetleri azalmaya başladıktan sonra binlerce yıl boyunca atmosferde yüksek CO2 seviyeleri olarak kalacağı anlamına gelmektedir.
Artan CO2 konsantrasyonları sadece küresel yüzey sıcaklığında artışa yol açmakla kalmaz, aynı zamanda artan küresel sıcaklıklar da karbondioksit konsantrasyonlarının artmasına neden olur. Bu da yörünge döngüleri gibi diğer süreçlerin neden olduğu değişimler için pozitif bir geri besleme oluşturur. Beş yüz milyon yıl önce CO2 konsantrasyonu bugünkünden 20 kat daha fazlaydı, Jura döneminde 4-5 kata düştü ve daha sonra yavaşça azaldı ve özellikle 49 milyon yıl önce hızlı bir azalma meydana geldi. ⓘ
Yerel karbondioksit konsantrasyonları, güçlü kaynakların yakınında, özellikle de çevredeki arazi tarafından izole edilmiş olanlarda yüksek değerlere ulaşabilir. İtalya, Toskana'da Rapolano Terme yakınlarındaki Bossoleto kaplıcasında, yaklaşık 100 m (330 ft) çapında çanak şeklinde bir çukurda yer alan CO2 konsantrasyonları gece boyunca %75'in üzerine çıkarak böcekleri ve küçük hayvanları öldürmeye yetmektedir. Gün doğumundan sonra gaz konveksiyon yoluyla dağılır. CO2 ile doymuş derin göl suyunun bozulmasıyla ortaya çıkan yüksek CO2 konsantrasyonlarının 1984 yılında Kamerun'daki Monoun Gölü'nde 37 ölüme ve 1986 yılında Kamerun'daki Nyos Gölü'nde 1700 ölüme neden olduğu düşünülmektedir. ⓘ
Okyanuslarda

Karbondioksit okyanusta çözünerek karbonik asit (H2CO3), bikarbonat (HCO3-) ve karbonat (CO32-) oluşturur. Okyanuslarda atmosferdekinin yaklaşık elli katı kadar karbondioksit çözünmüş halde bulunmaktadır. Okyanuslar muazzam bir karbon yutağı görevi görür ve insan faaliyetleri sonucu salınan CO2'nin yaklaşık üçte birini alır. ⓘ
Atmosferdeki karbondioksit konsantrasyonu arttıkça, okyanuslara karbondioksit alımının artması okyanusların pH değerinde ölçülebilir bir düşüşe neden olmakta ve bu da okyanus asitlenmesi olarak adlandırılmaktadır. PH'daki bu düşüş, başta okyanuslardaki kireçlenen organizmalar olmak üzere okyanuslardaki biyolojik sistemleri etkilemektedir. Bu etkiler ototroflardan heterotroflara kadar besin zincirini kapsar ve kokolitoforlar, mercanlar, foraminiferler, ekinodermler, kabuklular ve yumuşakçalar gibi organizmaları içerir. Normal koşullar altında, karbonat iyonu aşırı doygun konsantrasyonlarda olduğu için kalsiyum karbonat yüzey sularında stabildir. Ancak okyanus pH'ı düştükçe bu iyonun konsantrasyonu da düşer ve karbonat aşırı doygun hale geldiğinde kalsiyum karbonattan yapılmış yapılar çözünmeye karşı savunmasız kalır. Mercanlar, kokolitofor algler, koralin algler, foraminiferler, kabuklu deniz hayvanları ve pteropodlar yüksek CO
2. ⓘ
Suyun sıcaklığı arttıkça gaz çözünürlüğü azalır (hem basıncın 300 bar'ı hem de sıcaklığın 393 K'yi aştığı durumlar hariç, sadece derin jeotermal bacaların yakınında bulunur) ve bu nedenle okyanus sıcaklıkları yükseldikçe atmosferden alım oranı azalır. ⓘ
Atmosfere salınan toplamın yaklaşık %30'u olan okyanus tarafından alınan CO2'nin çoğu, bikarbonat ile dengede karbonik asit oluşturur. Bu kimyasal türlerin bazıları, döngüden karbonu uzaklaştıran fotosentetik organizmalar tarafından tüketilir. Atmosferdeki CO2 artışı deniz suyunun alkalinitesinin azalmasına yol açmıştır ve bu durumun suda yaşayan organizmaları olumsuz etkileyebileceği endişesi vardır. Özellikle, azalan alkalinite ile kabuk oluşturmak için karbonatların kullanılabilirliği azalmaktadır, ancak artan CO2 içeriği altında bazı türler tarafından kabuk üretiminin arttığına dair kanıtlar vardır. ⓘ
ABD Ulusal Okyanus ve Atmosfer İdaresi (NOAA) Mayıs 2008 tarihli "Okyanus Asitlenmesi için Bilimin Durumu Bilgi Formu "nda şunları belirtmektedir:
Okyanuslar, fosil yakıtların yakılmasıyla açığa çıkan karbondioksitin (CO2) yaklaşık %50'sini emerek okyanus pH'ını düşüren kimyasal reaksiyonlara yol açmıştır. Bu durum, "okyanus asitleşmesi" olarak bilinen bir süreçle sanayi çağının başlangıcından bu yana hidrojen iyonunda (asitlik) yaklaşık %30'luk bir artışa neden olmuştur. Giderek artan sayıda çalışma, deniz organizmaları üzerinde aşağıdakiler de dahil olmak üzere olumsuz etkiler olduğunu göstermiştir:
- Resif oluşturan mercanların iskeletlerini üretme hızı azalırken, çok sayıda denizanası çeşidinin üretimi artmaktadır.
- Deniz yosunlarının ve serbest yüzen zooplanktonların koruyucu kabuklarını muhafaza etme kabiliyeti azalır.
- Ticari balıklar ve kabuklu deniz hayvanları da dahil olmak üzere larval deniz canlılarının hayatta kalması azalır. ⓘ
Ayrıca, Hükümetlerarası İklim Değişikliği Paneli (IPCC), İklim Değişikliği 2007: Sentez Raporunda:
1750'den bu yana antropojenik karbon alımı, pH'da ortalama 0.1 birimlik bir düşüşle okyanusun daha asidik hale gelmesine yol açmıştır. Artan atmosferik CO2 konsantrasyonları daha fazla asitleşmeye yol açmaktadır ... Gözlemlenen okyanus asitleşmesinin deniz biyosferi üzerindeki etkileri henüz belgelenmemiş olsa da, okyanusların giderek asitleşmesinin deniz kabuğu oluşturan organizmalar (örneğin mercanlar) ve bunlara bağlı türler üzerinde olumsuz etkileri olması beklenmektedir. ⓘ
Bazı deniz kalsifiye organizmaları (mercan resifleri dahil) NOAA, OSPAR Komisyonu, Kuzeybatı Ağa Bağlı Okyanus Gözlem Sistemleri Birliği ve IPCC dahil olmak üzere büyük araştırma kurumları tarafından seçilmiştir, çünkü en güncel araştırmaları okyanus asitlenmesinin onları olumsuz etkilemesinin beklenmesi gerektiğini göstermektedir. ⓘ
Karbondioksit ayrıca hidrotermal bacalar yoluyla da okyanuslara karışmaktadır. Mariana Çukuru'ndaki Kuzeybatı Eifuku yanardağında bulunan Champagne hidrotermal bacası neredeyse saf sıvı karbondioksit üretmektedir ve 2004 yılı itibariyle dünyada bilinen sadece iki yerden biridir, diğeri ise Okinawa Çukuru'ndadır. Okinawa Çukuru'nda bir denizaltı sıvı karbondioksit gölünün bulunduğu 2006 yılında rapor edilmiştir. ⓘ
Biyolojik rolü
Karbondioksit, metabolizmalarının bir parçası olarak şekerleri, yağları ve amino asitleri oksijenle parçalayarak enerji elde eden organizmalarda hücresel solunumun bir son ürünüdür. Buna tüm bitkiler, algler ve hayvanlar ile aerobik mantarlar ve bakteriler dahildir. Omurgalılarda karbondioksit kan yoluyla vücut dokularından deriye (örneğin amfibiler) veya solungaçlara (örneğin balıklar) gider, buradan suda çözülür veya akciğerlere gider ve buradan dışarı atılır. Aktif fotosentez sırasında bitkiler atmosferden solunum sırasında saldıklarından daha fazla karbondioksit emebilirler. ⓘ
Fotosentez ve karbon fiksasyonu

Karbon fiksasyonu, atmosferik karbondioksitin bitkiler, algler ve (siyanobakteriler) tarafından glikoz gibi enerji açısından zengin organik moleküllere dahil edildiği ve böylece fotosentez yoluyla kendi besinlerini oluşturdukları biyokimyasal bir süreçtir. Fotosentez, diğer organik bileşiklerin oluşturulabileceği şekerleri üretmek için karbondioksit ve su kullanır ve bir yan ürün olarak oksijen üretilir. ⓘ
Genellikle RuBisCO olarak kısaltılan ribuloz-1,5-bifosfat karboksilaz oksijenaz, karbon fiksasyonunun ilk ana adımında yer alan enzimdir, soldaki şemada gösterildiği gibi CO2 ve ribuloz bifosfattan iki molekül 3-fosfogliserat üretir. ⓘ
RuBisCO'nun Dünya'da en bol bulunan tek protein olduğu düşünülmektedir. ⓘ
Fototroflar fotosentez ürünlerini iç besin kaynağı olarak ve polisakkaritler, nükleik asitler ve proteinler gibi daha karmaşık organik moleküllerin biyosentezi için hammadde olarak kullanırlar. Bunlar hem kendi büyümeleri için hem de bizim gibi hayvanlar da dahil olmak üzere diğer organizmaları besleyen besin zincirlerinin ve ağlarının temeli olarak kullanılır. Bazı önemli fototroflar olan kokolitoforlar sert kalsiyum karbonat pulları sentezler. Küresel olarak önemli bir kokolitofor türü olan Emiliania huxleyi'nin kalsit pulları, daha önce atmosferik olan karbonun jeolojik zaman ölçeklerinde sabit kalabildiği kireçtaşı gibi birçok tortul kayanın temelini oluşturmuştur.

Bitkiler ortam koşullarına kıyasla 1.000 ppm CO2 konsantrasyonlarında yüzde 50'ye kadar daha hızlı büyüyebilir, ancak bu iklimde herhangi bir değişiklik ve diğer besin maddelerinde herhangi bir sınırlama olmadığını varsayar. Yüksek CO2 seviyeleri, mahsullerin hasat edilebilir verimine yansıyan büyüme artışına neden olur; buğday, pirinç ve soya fasulyesi, FACE deneylerinde yüksek CO2 altında verimde %12-14 artış gösterir. ⓘ
Artan atmosferik CO2 konsantrasyonları, bitkilerde daha az stoma gelişmesine neden olarak su kullanımının azalmasına ve su kullanım verimliliğinin artmasına yol açar. FACE kullanılarak yapılan çalışmalar, CO2 zenginleştirmesinin mahsul bitkilerinde mikro besin konsantrasyonlarının azalmasına yol açtığını göstermiştir. Otçulların aynı miktarda protein elde etmek için daha fazla yiyecek yemesi gerekeceğinden, bunun ekosistemlerin diğer bölümleri üzerinde zincirleme etkileri olabilir. ⓘ
Fenilpropanoidler ve flavonoidler gibi ikincil metabolitlerin konsantrasyonu yüksek CO2 konsantrasyonlarına maruz kalan bitkilerde de değişebilir. ⓘ
Bitkiler solunum sırasında da CO2 yayar ve bu nedenle C3 fotosentezi kullanan bitkilerin ve alglerin çoğu gün boyunca sadece net emicidir. Büyüyen bir orman her yıl tonlarca CO2 emecek olsa da, olgun bir orman solunumdan ve ölü örneklerin (örneğin düşen dallar) ayrışmasından, büyüyen bitkilerde fotosentezde kullanılan kadar CO2 üretecektir. Uzun zamandır süregelen karbon nötr oldukları görüşünün aksine, olgun ormanlar karbon biriktirmeye devam edebilir ve değerli karbon yutakları olarak kalarak Dünya atmosferinin karbon dengesinin korunmasına yardımcı olabilir. Ayrıca, yeryüzündeki yaşam için çok önemli olan fitoplanktonların fotosentezi, üst okyanusta çözünmüş CO2 tüketir ve böylece atmosferden CO2 emilimini teşvik eder. ⓘ
Zehirlilik

Temiz havadaki karbondioksit içeriği (deniz seviyesi ile 10 kPa seviyesi, yani yaklaşık 30 km (19 mil) yükseklik arasında ortalama olarak) konuma bağlı olarak %0,036 (360 ppm) ile %0,041 (412 ppm) arasında değişir. ⓘ
CO2 boğucu bir gazdır ve Kimyasalların Test Edilmesi için OECD Kılavuzları kullanılarak Birleşmiş Milletler Avrupa Ekonomik Komisyonu'nun Kimyasalların Sınıflandırılması ve Etiketlenmesine ilişkin Küresel Uyumlaştırılmış Sistem standartlarına uygun olarak toksik veya zararlı olarak sınıflandırılmamıştır. 1'e (10.000 ppm) kadar olan konsantrasyonlarda, bazı insanları uykulu hissettirir ve ciğerlerde tıkanıklık hissi verir. 7 ila %10'luk (70.000 ila 100.000 ppm) konsantrasyonlar, yeterli oksijen varlığında bile boğulmaya neden olabilir ve birkaç dakika ila bir saat içinde baş dönmesi, baş ağrısı, görme ve işitme bozukluğu ve bilinç kaybı şeklinde kendini gösterir. Akut karbondioksite maruz kalmanın fizyolojik etkileri, boğulmanın bir alt kümesi olan hiperkapni terimi altında toplanır. ⓘ
Havadan daha ağır olduğu için, gazın nispeten yüksek konsantrasyonlarda yerden sızdığı yerlerde (yüzey altı volkanik veya jeotermal aktivite nedeniyle), rüzgarın dağıtıcı etkileri olmadan, ortalama zemin seviyesinin altındaki korunaklı / cepli yerlerde toplanabilir ve burada bulunan hayvanların boğulmasına neden olabilir. Daha sonra leşlere çekilen leş yiyenler de öldürülür. Nyiragongo Yanardağı'ndan yayılan CO2 emisyonları nedeniyle Goma şehri yakınlarında da aynı şekilde çocuklar öldürülmüştür. Bu fenomen için Swahili dilinde kullanılan terim 'mazuku'dur. ⓘ

İnsanlarda, kan asidifikasyonunun (asidoz) etkilerini dengelemek için değiştirilmiş solunum ve böbrek bikarbonat üretimi de dahil olmak üzere artan CO2 konsantrasyonlarına adaptasyon meydana gelir. Bazı çalışmalar, adaptasyonun fizyolojik ve geri döndürülebilir olması nedeniyle kapalı hava alanları (örneğin denizaltı) için yüzde 2,0 solunan konsantrasyonların kullanılabileceğini öne sürmüştür, çünkü performansta veya normal fiziksel aktivitede bozulma beş gün boyunca bu maruz kalma seviyesinde gerçekleşmez. Yine de, diğer çalışmalar çok daha düşük seviyelerde bile bilişsel işlevlerde azalma olduğunu göstermektedir. Ayrıca, devam eden solunum asidozu ile adaptasyon veya telafi edici mekanizmalar bu durumu tersine çeviremeyecektir. ⓘ
1'in altında
1'in altındaki seviyelerde uzun süreli sürekli CO2 maruziyetinin insanlar ve hayvanlar üzerindeki sağlık etkilerine ilişkin çok az çalışma vardır. Amerika Birleşik Devletleri'nde mesleki CO2 maruziyet sınırları sekiz saatlik bir süre için %0,5 (5000 ppm) olarak belirlenmiştir. Bu CO2 konsantrasyonunda, Uluslararası Uzay İstasyonu mürettebatı baş ağrısı, uyuşukluk, zihinsel yavaşlık, duygusal tahriş ve uyku bozukluğu yaşamıştır. Hayvanlarda %0,5 CO2'de yapılan çalışmalar, sekiz haftalık maruziyetten sonra böbrek kireçlenmesi ve kemik kaybı olduğunu göstermiştir. İnsanların 2,5 saatlik seanslar halinde maruz kaldığı bir çalışmada, %0,1 (1000 ppm) CO2 kadar düşük konsantrasyonlarda, muhtemelen CO2'nin serebral kan akışında neden olduğu artışlar nedeniyle bilişsel yetenekler üzerinde önemli olumsuz etkiler görülmüştür. Başka bir çalışmada, 500 ppm ile karşılaştırıldığında 1000 ppm'de temel aktivite seviyesinde ve bilgi kullanımında bir düşüş gözlemlenmiştir. Ancak literatürün gözden geçirilmesiyle, karbondioksit kaynaklı bilişsel bozulma olgusu üzerine yapılan çalışmaların çoğunun üst düzey karar verme üzerinde küçük bir etkiye sahip olduğu ve çalışmaların çoğunun yetersiz çalışma tasarımları, çevresel konfor, maruz kalma dozlarındaki belirsizlikler ve kullanılan farklı bilişsel değerlendirmelerle karıştırıldığı tespit edilmiştir. Benzer şekilde, motosiklet kasklarındaki CO2 konsantrasyonunun etkileri üzerine yapılan bir çalışma, motosiklet sürücülerinin öz raporlarının dikkate alınmaması ve ölçümlerin mankenler kullanılarak yapılması nedeniyle şüpheli bir metodolojiye sahip olmakla eleştirilmiştir. Ayrıca, normal motosiklet koşullarına ulaşıldığında (otoyol veya şehir hızları gibi) veya vizör yükseltildiğinde CO2 konsantrasyonu güvenli seviyelere (%0,2) düşmüştür. ⓘ
Havalandırma

Kötü havalandırma, kapalı alanlardaki aşırı CO2 konsantrasyonlarının ana nedenlerinden biridir. Kararlı durum koşullarında (doluluk ve havalandırma sistemi çalışması CO2 konsantrasyonunun stabilize olması için yeterince uzun olduğunda) dış ortam konsantrasyonlarının üzerindeki karbondioksit farkı bazen kişi başına havalandırma oranlarını tahmin etmek için kullanılır. Daha yüksek CO2 konsantrasyonları, yolcu sağlığı, konforu ve performans düşüşü ile ilişkilidir. ASHRAE Standart 62.1-2007 havalandırma oranları, ortam dış ortam koşullarının üzerinde 2.100 ppm'ye kadar iç ortam konsantrasyonlarına neden olabilir. Dolayısıyla, dış ortam konsantrasyonu 400 ppm ise, bu endüstri konsensüsü standardını karşılayan havalandırma oranlarıyla iç ortam konsantrasyonları 2.500 ppm'ye ulaşabilir. Kötü havalandırılan alanlardaki konsantrasyonlar bundan daha da yüksek bulunabilir (3.000 veya 4.000 ppm aralığı). ⓘ
Yetersiz havalandırma nedeniyle gaz maruziyetine karşı özellikle savunmasız olan madenciler, karbondioksit ve nitrojen karışımlarını "kara rutubet", "boğucu rutubet" veya "stythe" olarak adlandırmaktadır. Daha etkili teknolojiler geliştirilmeden önce, madenciler çalışırken yanlarında kafesli bir kanarya getirerek maden kuyularında tehlikeli seviyelerde kara rutubet ve diğer gazları sık sık izlerlerdi. Kanarya boğucu gazlara karşı insanlardan daha duyarlıydı ve bilinci kapandığında ötmeyi bırakıp tüneğinden düşerdi. Davy lambası aynı zamanda daha az parlak yanarak yüksek seviyedeki kara nemi (batar ve zemine yakın bir yerde toplanır) tespit edebilirken, bir başka boğucu gaz ve patlama riski olan metan lambanın daha parlak yanmasını sağlıyordu. ⓘ
Şubat 2020'de Moskova'daki bir partide, soğutmak için bir yüzme havuzuna kuru buz (donmuş CO2) eklendiğinde üç kişi boğularak ölmüştür. Benzer bir kaza 2018 yılında bir kadının arabasında taşıdığı büyük miktarda kuru buzdan yayılan CO2 dumanından ölmesiyle meydana gelmiştir. ⓘ
İnsan fizyolojisi
İçerik
| Kan bölmesi | (kPa) | (mm Hg) |
|---|---|---|
| Venöz kan karbondioksit | 5.5–6.8 | 41–51 |
| Alveolar pulmoner gaz basınçları |
4.8 | 36 |
| Arteriyel kan karbondioksit | 4.7–6.0 | 35–45 |
Vücut, kişi başına günde yaklaşık 2,3 pound (1,0 kg) karbondioksit üretir ve 0,63 pound (290 g) karbon içerir. İnsanlarda bu karbondioksit venöz sistem yoluyla taşınır ve akciğerler yoluyla dışarı atılır, bu da arterlerde daha düşük konsantrasyonlara neden olur. Kandaki karbondioksit içeriği genellikle kısmi basınç olarak verilir; bu, karbondioksitin tek başına hacmi kaplaması durumunda sahip olacağı basınçtır. İnsanlarda kandaki karbondioksit içeriği yandaki tabloda gösterilmiştir. ⓘ
Kan içinde taşınma
CO2 kanda üç farklı şekilde taşınır. (Kesin yüzdeler arteriyel veya venöz kan olmasına göre değişir).
- Çoğu (yaklaşık %70 ila %80) bikarbonat iyonlarına dönüştürülür HCO-
3 kırmızı kan hücrelerindeki karbonik anhidraz enzimi tarafından, CO2 + H
2O → H
2CO
3 → H+
+ HCO-
3. - 5-10'u plazma içinde çözülür
- 5-10'u karbamino bileşikleri olarak hemoglobine bağlanır ⓘ
Kırmızı kan hücrelerinde oksijen taşıyan ana molekül olan hemoglobin hem oksijen hem de karbondioksit taşır. Ancak hemoglobine bağlanan CO2, oksijenle aynı bölgeye bağlanmaz. Bunun yerine, dört globin zincirindeki N-terminal grupları ile birleşir. Bununla birlikte, hemoglobin molekülü üzerindeki allosterik etkiler nedeniyle, CO2'nin bağlanması, belirli bir kısmi oksijen basıncı için bağlanan oksijen miktarını azaltır. Bu, Haldane Etkisi olarak bilinir ve karbondioksitin dokulardan akciğerlere taşınmasında önemlidir. Tersine, CO2'nin kısmi basıncındaki bir artış veya daha düşük bir pH, Bohr etkisi olarak bilinen hemoglobinden oksijenin boşaltılmasına neden olacaktır. ⓘ
Solunumun düzenlenmesi
Karbondioksit, kan akışının yerel otoregülasyonunun aracılarından biridir. Konsantrasyonu yüksekse, kılcal damarlar o dokuya daha fazla kan akışına izin verecek şekilde genişler. ⓘ
Bikarbonat iyonları kan pH'ını düzenlemek için çok önemlidir. Bir kişinin nefes alma hızı, kanındaki CO2 seviyesini etkiler. Çok yavaş veya sığ nefes almak solunum asidozuna neden olurken, çok hızlı nefes almak hiperventilasyona yol açar ve bu da solunum alkalozuna neden olabilir. ⓘ
Vücut metabolizma için oksijene ihtiyaç duysa da, düşük oksijen seviyeleri normalde solunumu uyarmaz. Bunun yerine, solunum daha yüksek karbondioksit seviyeleri tarafından uyarılır. Sonuç olarak, düşük basınçlı hava veya hiç oksijen içermeyen bir gaz karışımı (saf nitrojen gibi) solumak, hava açlığı yaşamadan bilinç kaybına yol açabilir. Bu durum özellikle yüksek irtifa savaş pilotları için tehlikelidir. Uçuş görevlilerinin kabin basıncının düşmesi durumunda yolculara başkalarına yardım etmeden önce kendilerine oksijen maskesi takmalarını söylemelerinin nedeni de budur; aksi takdirde kişi bilincini kaybetme riskiyle karşı karşıya kalır. ⓘ
Solunum merkezleri 40 mm Hg'lik bir arteriyel CO2 basıncını korumaya çalışır. Kasıtlı hiperventilasyon ile arteriyel kanın CO2 içeriği 10-20 mm Hg'ye düşürülebilir (kanın oksijen içeriği çok az etkilenir) ve solunum dürtüsü azalır. Bu nedenle kişi hiperventilasyon yaptıktan sonra, hiperventilasyon yapmadan olduğundan daha uzun süre nefesini tutabilir. Bu durum, nefes alma ihtiyacı baskın hale gelmeden önce bilinç kaybına neden olma riski taşır, bu nedenle hiperventilasyon özellikle serbest dalıştan önce tehlikelidir. ⓘ
Karbonik asit
Karbondioksitin su ile kimyasal reaksiyonu sonucu meydana gelen zayıf bir asittir: (CO2 + H2O → H2CO3). Gazoz ve soda yapımında kullanılır. Karbonik asit basınç altında şişelere konur, bir kısmı çözünür, bir kısmı ise sıvının üzerinde kalır. Kapak açılınca kaynama sesi vererek dışarı çıkar. Çözünmüş kısım ise gazoza, sodaya tat verir. ⓘ
CO2 yangın söndürme aracında da kullanılır. Bugün birçok yerde bulunması mecburi olan bu araçların aslını basınçla doldurulmuş CO2 meydana getirir. Kafi miktarda CO2 bulunan yerde yanma olayı devam edemez. Çelik tüplerde 50 Atmosfer basınç altında CO2 saklanır. Tüp içinde basınç sebebiyle sıvı halde bulunur. Musluğu açıldığında CO2 hızla buharlaşır ve yanmakta olan cismin üzerini örter, hava ile temasını keser. Böylece yanma olayı durur. ⓘ
Kuru buz
Kuru buz (veya karbondioksit karı), katı karbondioksittir. Katı sudan çok daha yoğundur ve donma noktası da çok daha düşüktür. Gaz sıkıştırılarak dışarı ısı vermesi sağlanır ve bu ısı kondansatörler yardımıyla depolanır. Daha sonra birden basınç düşürülünce, madde, alması gereken ısıyı geri alamaz ve buz halinde kalır. ⓘ
Oda koşullarında (~1 atm) kuru buzda katı-gaz faz geçişi, süblimleşme olur. Adının kuru buz olmasının sebebi de budur. Kuru buz, ılık veya sıcak suya konulursa, havada sisli bir ortam elde edebilirlerdi. Bunun sebebi, kuru buzun süblimleşirken ortamdaki ısıyı almasıdır. Bu, hava içerisinde bulunan su moleküllerini soğutur ve sonuçta ağır hareket eden yoğun bir sis bulutu ortaya çıkar. Aynı şey, sıvı azot için de geçerlidir. ⓘ
Kuru buz elde etmek için yapılması gereken ilk iş, CO2 gazını sıvı hale dönüştürmektir. Bunun için de yüksek basınç ve düşük sıcaklık gerekir. Bir tüp içinde sıvı halde bulunan CO2, tüp eğilerek dışarı döküldüğünde, gürültü ile etrafa dağılır ve sıvı halden gaz haline geçer. Bu değişim için gerekli enerjinin tamamını dışarıdan alamaz (olay çok hızlı cereyan eder) ve bir miktarını kendi içinden alır. Böylece gaz halindeki CO2 kendini soğutarak donar. Buna karbondioksit karı denir. Bu olaydan faydalanılarak istenildiği anda -80 °C'lik soğuk ortam elde edilebilir. Dewar kapları bu karın asetonla karıştırılmasıyla meydana getirilen özel termoslardır. Bu termosların dışarıyla ısı alış verişi olmadığından -80 °C'lik ortam elde edilmiş olur. ⓘ




![{\displaystyle K_{\mathrm {h} }={\frac {\rm {[H_{2}CO_{3}]}}{\rm {[CO_{2}(aq)]}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)
![{\displaystyle K_{a1}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81950791f8b36374241d6fa82828522bd875668a)
![{\displaystyle K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]+[CO_{2}(aq)]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4cac9482fd21cb58444f2621f245d7b1d835485)