CRISPR
| Cascade (antiviral savunma için CRISPR-ilişkili kompleks) ⓘ | |
|---|---|
 CRISPR RNA (yeşil) ve faj DNA'sına (kırmızı) bağlı CRISPR Cascade proteini (camgöbeği) | |
| Tanımlayıcılar | |
| Organizma | |
| Sembol | CRISPR |
| PDB | 4QYZ |
| Üzerine bir serinin parçası ⓘ |
| CRISPR |
|---|
| Genom düzenleme: CRISPR/Cas |
|
Varyantlar: Anti-CRISPR - CIRTS - CRISPeYCRISPR-Cas10 - CRISPR-Cas13 - CRISPR-BEST CRISPR-Display - CRISPR-Gold - CRISPRa - CRISPRi Easi-CRISPR - FACE |
| Enzim |
|
Cas9 - FokI - EcoRI - PstI - SmaI HaeIII - ERT2 - Cas12a (Cpf1) - xCas9 |
| Uygulamalar |
| KAMERA - ICE - Genética dirigida |
| diğer Genom düzenleme yöntemi: |
| Prime düzenleme - Pro-AG - RESCUE - TALEN - ZFN - LEAPER |
| Üzerine bir serinin parçası ⓘ |
| Genetik mühendisliği |
|---|
 |
| Genetiği değiştirilmiş organizmalar |
|
| Tarihçe ve yönetmelik |
|
| Süreç |
|
| Uygulamalar |
|
| Tartışmalar |
|
CRISPR (/ˈkrɪspər/) (kümelenmiş düzenli aralıklı kısa palindromik tekrarların kısaltması) bakteri ve arkea gibi prokaryotik organizmaların genomlarında bulunan bir DNA dizileri ailesidir. Bu diziler, daha önce prokaryotu enfekte etmiş olan bakteriyofajların DNA parçalarından türetilmiştir. Sonraki enfeksiyonlar sırasında benzer bakteriyofajlardan gelen DNA'yı tespit etmek ve yok etmek için kullanılırlar. Dolayısıyla bu diziler prokaryotların antiviral (yani anti-faj) savunma sisteminde kilit bir rol oynar ve bir tür edinilmiş bağışıklık sağlar. CRISPR, dizilenmiş bakteri genomlarının yaklaşık %50'sinde ve dizilenmiş arkeaların yaklaşık %90'ında bulunur. ⓘ

Cas9 (veya "CRISPR-associated protein 9"), CRISPR dizilerini, CRISPR dizisine tamamlayıcı olan belirli DNA şeritlerini tanımak ve parçalamak için bir kılavuz olarak kullanan bir enzimdir. Cas9 enzimleri CRISPR dizileri ile birlikte, organizmalar içindeki genleri düzenlemek için kullanılabilen CRISPR-Cas9 olarak bilinen bir teknolojinin temelini oluşturur. Bu düzenleme süreci, temel biyolojik araştırmalar, biyoteknolojik ürünlerin geliştirilmesi ve hastalıkların tedavisi dahil olmak üzere çok çeşitli uygulamalara sahiptir. CRISPR-Cas9 genom düzenleme tekniğinin geliştirilmesi, 2020 yılında Emmanuelle Charpentier ve Jennifer Doudna'ya verilen Nobel Kimya Ödülü ile tanınmıştır. ⓘ
CRISPR, (ing. Clustered Regularly Interspaced Short Palindromic Repeats) DNA dizilimleri kümesidir. ⓘ
Düzenli aralıklarla bölünmüş palindromik tekrar kümeleri (CRISPR), kısa tekrarı baz dizileri içeren prokaryot DNA segmentleridir. Her tekrarı daha önce maruz kalınan bakteriyofaj veya plazmid kaynaklı kısa "aralayıcı DNA" segmentleri takip etmektedir. ⓘ
CRISPR, bakterilerin kendilerini virüslerden kaynaklanan saldırılara karşı korumak için kullandıkları bir savunma sistemi olarak işlev görmektedir. ⓘ
CRISPR Gen teknolojisi insan geleceği için önemli olsa da bazı ülkeler karşı çıkmaktadır. ⓘ
CRISPR Gen teknolajisi tarım alanında büyük ölçüde katkıda bulunmaktadır. ⓘ
Tarih
Tekrarlanan diziler
Kümelenmiş DNA tekrarlarının keşfi dünyanın üç yerinde birbirinden bağımsız olarak gerçekleşti. Daha sonra CRISPR olarak adlandırılacak olan şeyin ilk tanımı Osaka Üniversitesi araştırmacısı Yoshizumi Ishino ve meslektaşları tarafından 1987 yılında yapılmıştır. Hedefleri olan Escherichia coli genomundan "iap" geniyle (alkalin fosfatazın izozim dönüşümü) birlikte bir CRISPR dizisinin bir kısmını yanlışlıkla klonladılar. Tekrarların organizasyonu olağandışıydı. Tekrarlanan diziler tipik olarak, aralarına farklı diziler serpiştirilmeden ardışık olarak düzenlenir. Kesintiye uğramış kümelenmiş tekrarların işlevini bilmiyorlardı. ⓘ
1993 yılında Hollanda'daki Mycobacterium tuberculosis araştırmacıları, bu bakterideki kesintiye uğramış doğrudan tekrarlar (DR) kümesi hakkında iki makale yayınladı. Farklı M. tuberculosis suşları arasında doğrudan tekrarlara müdahale eden dizilerin çeşitliliğini fark ettiler ve bu özelliği, bugün hala kullanılmakta olan spoligotipleme olarak adlandırılan bir tipleme yöntemi tasarlamak için kullandılar. ⓘ
İspanya'daki Alicante Üniversitesi'nden Francisco Mojica, Haloferax ve Haloarcula türlerinin arkeal organizmalarında gözlemlenen tekrarları ve bunların işlevlerini inceledi. Mojica'nın danışmanı o zamanlar kümelenmiş tekrarların hücre bölünmesi sırasında replike DNA'nın yavru hücrelere doğru şekilde ayrılmasında bir rolü olduğunu tahmin ediyordu çünkü aynı tekrar dizilerine sahip plazmidler ve kromozomlar Haloferax volcanii'de bir arada bulunamıyordu. Kesilen tekrarların transkripsiyonu da ilk kez kaydedildi; bu CRISPR'nin ilk tam karakterizasyonuydu. 2000 yılına gelindiğinde Mojica bilimsel literatürü taradı ve öğrencilerinden biri kendi geliştirdiği bir programla yayınlanmış genomlarda bir araştırma yaptı. Aynı aileye ait 20 mikrop türünde kesintili tekrarlar tespit ettiler. Bu diziler aralıklı olduğu için Mojica başlangıçta bu dizileri "kısa düzenli aralıklı tekrarlar" (SRSR) olarak adlandırdı. 2001 yılında, başka kesintili tekrarlar arayan Mojica ve Ruud Jansen, bilimsel literatürde dizileri tanımlamak için kullanılan çok sayıda kısaltmadan kaynaklanan karışıklığı gidermek için CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) kısaltmasını önerdi. 2002 yılında Tang ve arkadaşları, Archaeoglobus fulgidus genomundan CRISPR tekrar bölgelerinin uzun RNA moleküllerine kopyalandığını ve bunların daha sonra birim uzunluktaki küçük RNA'lara ve ayrıca 2, 3 veya daha fazla spacer-tekrar biriminden oluşan bazı uzun formlara işlendiğini göstermiştir. ⓘ
2005 yılında yoğurt araştırmacısı Rodolphe Barrangou, Streptococcus thermophilus'un yinelemeli faj mücadelelerinden sonra artan faj direnci geliştirdiğini ve bu gelişmiş direncin ek CRISPR spacer dizilerinin dahil edilmesinden kaynaklandığını keşfetti. O dönemde Barrangou'nun çalıştığı Danimarkalı gıda şirketi Danisco, daha sonra yoğurt üretiminde kullanılmak üzere faja dirençli S. thermophilus suşları geliştirdi. Danisco daha sonra "küresel süt kültürü pazarının yaklaşık yüzde 50'sine sahip olan" DuPont tarafından satın alındı ve teknoloji ana akım haline geldi. ⓘ
CRISPR ile ilişkili sistemler
CRISPR anlayışına önemli bir katkı, Jansen'in prokaryot tekrar kümesine CRISPR-ilişkili sistemleri veya cas genlerini oluşturan bir dizi homolog genin eşlik ettiğini gözlemlemesiyle geldi. Başlangıçta dört cas geni (cas 1-4) tanınmıştır. Cas proteinleri helikaz ve nükleaz motifleri göstererek CRISPR lokuslarının dinamik yapısında bir rol oynadığını düşündürmüştür. Bu yayında CRISPR kısaltması bu modelin evrensel adı olarak kullanılmıştır. Bununla birlikte, CRISPR işlevi esrarengiz kalmıştır. ⓘ

2005 yılında üç bağımsız araştırma grubu, bazı CRISPR ara parçalarının faj DNA'sından ve plazmidler gibi ekstrakromozomal DNA'dan türediğini göstermiştir. Gerçekte, ara parçalar daha önce hücreye saldırmaya çalışan virüslerden toplanan DNA parçalarıdır. Ara parçaların kaynağı, CRISPR/cas sisteminin bakterilerde adaptif bağışıklıkta bir rolü olabileceğine dair bir işaretti. Bu fikri öne süren üç çalışma da başlangıçta yüksek profilli dergiler tarafından reddedildi, ancak sonunda başka dergilerde yayınlandı. ⓘ
Mikrobiyal bağışıklıkta CRISPR-Cas'ın rolünü öneren ilk yayın, Mojica ve Alicante Üniversitesi'ndeki işbirlikçileri tarafından, ökaryotik hücreler tarafından kullanılan RNA girişim sistemine benzer bir mekanizmada hedef tanımada ara parçaların RNA transkripti için bir rol öngörmüştür. Koonin ve meslektaşları, proteinlerinin öngörülen işlevine göre farklı CRISPR-Cas alt tipleri için etki mekanizmaları önererek bu RNA girişim hipotezini genişletti. ⓘ
Çeşitli gruplar tarafından yapılan deneysel çalışmalar CRISPR-Cas bağışıklığının temel mekanizmalarını ortaya çıkardı. 2007 yılında, CRISPR'ın adaptif bir bağışıklık sistemi olduğuna dair ilk deneysel kanıt yayımlandı. Streptococcus thermophilus'taki bir CRISPR bölgesi, enfekte eden bir bakteriyofajın DNA'sından ara parçalar aldı. Araştırmacılar, dizisi test edilen fajlarda bulunanlarla eşleşen ara parçaları ekleyip silerek S. thermophilus'un farklı faj türlerine karşı direncini manipüle etti. 2008 yılında Brouns ve Van der Oost, E. coli'de tekrarlar içindeki CRISPR RNA öncüsünü, protein kompleksine bağlı kalan CRISPR RNA (crRNA) adı verilen olgun ara parça içeren RNA moleküllerine kesen bir Cas proteinleri kompleksi (Cascade olarak adlandırılır) tanımladı. Dahası, Cascade, crRNA ve bir helikaz/nükleazın (Cas3), bakteriyel bir konakçıya bir DNA virüsünün enfeksiyonuna karşı bağışıklık sağlamak için gerekli olduğu bulunmuştur. Bir anti-virüs CRISPR tasarlayarak, crRNA'nın iki yöneliminin (sense/antisense) bağışıklık sağladığını ve crRNA kılavuzlarının dsDNA'yı hedeflediğini gösterdiler. O yıl Marraffini ve Sontheimer, S. epidermidis'in bir CRISPR dizisinin konjugasyonu önlemek için RNA'yı değil DNA'yı hedeflediğini doğruladı. Bu bulgu, daha sonra Pyrococcus furiosus'ta yabancı RNA'yı hedef alan bir CRISPR-Cas sistemi bulunmasına rağmen, CRISPR-Cas bağışıklığının önerilen RNA-girişim benzeri mekanizması ile çelişiyordu. 2010 yılında yapılan bir çalışma, CRISPR-Cas'ın S. thermophilus'ta faj ve plazmid DNA'nın her iki ipliğini de kestiğini göstermiştir. ⓘ
Cas9
Araştırmacılar, Streptococcus pyogenes'ten Cas9 proteinine dayanan daha basit bir CRISPR sistemi üzerinde çalıştılar. Cas9 endonükleaz, iki küçük molekül içeren dört bileşenli bir sistemdir: crRNA ve trans-aktive edici CRISPR RNA (tracrRNA). Jennifer Doudna ve Emmanuelle Charpentier, iki RNA molekülünü Cas9 ile birleştirildiğinde kılavuz RNA tarafından belirlenen DNA hedefini bulup kesebilen bir "tek kılavuz RNA" haline getirerek Cas9 endonükleazını daha yönetilebilir iki bileşenli bir sistem olarak yeniden tasarladı. Bu katkı o kadar önemliydi ki 2020 yılında Nobel Kimya Ödülü'ne layık görüldü. Kılavuz RNA'nın nükleotid dizisini manipüle ederek, yapay Cas9 sistemi, bölünme için herhangi bir DNA dizisini hedefleyecek şekilde programlanabilir. Virginijus Šikšnys ile birlikte Gasiūnas, Barrangou ve Horvath'tan oluşan bir başka ortak çalışma grubu, S. thermophilus CRISPR sisteminden Cas9'un da crRNA'sının dizisini değiştirerek seçtikleri bir bölgeyi hedeflemek üzere yeniden programlanabileceğini gösterdi. Bu gelişmeler, modifiye CRISPR-Cas9 sistemiyle genomları düzenleme çabalarını körükledi. ⓘ
Feng Zhang ve George Church liderliğindeki gruplar eş zamanlı olarak ilk kez CRISPR-Cas9 kullanarak insan hücre kültürlerinde genom düzenleme açıklamalarını yayınladı. O zamandan beri fırıncı mayası (Saccharomyces cerevisiae), fırsatçı patojen Candida albicans, zebra balığı (Danio rerio), meyve sinekleri (Drosophila melanogaster) dahil olmak üzere çok çeşitli organizmalarda kullanılmıştır, karıncalar (Harpegnathos saltator ve Ooceraea biroi), sivrisinekler (Aedes aegypti), nematodlar (Caenorhabditis elegans), bitkiler, fareler (Mus musculus domesticus), maymunlar ve insan embriyoları. ⓘ
CRISPR, bilim insanlarının belirli genleri hedeflemesine ve etkinleştirmesine veya susturmasına olanak tanıyan programlanabilir transkripsiyon faktörleri yapmak için modifiye edilmiştir. ⓘ
CRISPR-Cas9 sisteminin, ilk olarak 2015 yılında Çinli bilim insanları P. Liang ve Y. Xu tarafından yayınlanan bir makalede tanımlanan İnsan tripronükleer zigotlarında etkili gen düzenlemeleri yaptığı gösterilmiştir. Liang ve Y. Xu. Sistem, 54 embriyodan 28'inde mutant Beta-Hemoglobin'in (HBB) başarılı bir şekilde bölünmesini sağlamıştır. 28 embriyodan 4'ü, bilim insanları tarafından verilen bir donör şablonu kullanılarak başarılı bir şekilde rekombine edildi. Bilim insanları, bölünmüş ipliğin DNA rekombinasyonu sırasında, homolog endojen dizi HBD'nin eksojen donör şablonla rekabet ettiğini gösterdi. İnsan embriyosundaki DNA onarımı, türetilmiş kök hücrelere kıyasla çok daha karmaşık ve özeldir. ⓘ
Cas12a
2015 yılında, Cas12a nükleazı (eski adıyla Cpf1) Francisella novicida bakterisinin CRISPR/Cpf1 sisteminde karakterize edilmiştir. Orijinal adı, 2012 yılında oluşturulan bir TIGRFAMs protein ailesi tanımından gelmektedir ve CRISPR-Cas alt tipinin Prevotella ve Francisella soylarındaki yaygınlığını yansıtmaktadır. Cas12a, Cas9'dan birkaç temel farklılık göstermiştir: Cas9 tarafından üretilen 'künt' kesimin aksine çift sarmallı DNA'da 'kademeli' bir kesime neden olmak, 'T zengini' bir PAM'a dayanmak (Cas9'a alternatif hedefleme bölgeleri sağlamak) ve başarılı hedefleme için yalnızca bir CRISPR RNA (crRNA) gerektirmek. Buna karşın Cas9 hem crRNA hem de transaktive edici bir crRNA (tracrRNA) gerektirir. ⓘ
Bu farklılıklar Cas12a'ya Cas9'a göre bazı avantajlar sağlayabilir. Örneğin, Cas12a'nın küçük crRNA'ları, Cas9'un sgRNA'larına kıyasla daha fazlası tek bir vektörde paketlenebildiğinden, çoğullanmış genom düzenleme için idealdir. Ayrıca, Cas12a tarafından bırakılan yapışkan 5′ çıkıntılar, geleneksel Restriksiyon Enzimi klonlamasından çok daha hedefe özgü olan DNA montajı için kullanılabilir. Son olarak Cas12a, DNA'yı PAM bölgesinden 18-23 baz çifti aşağıya doğru keser. Bu, onarımdan sonra tanıma dizisinde herhangi bir bozulma olmadığı anlamına gelir ve böylece Cas12a birden fazla DNA bölünmesi turuna olanak tanır. Buna karşın, Cas9 PAM bölgesinin yalnızca 3 baz çifti yukarısını kestiğinden, NHEJ yolu tanıma dizisini yok eden indel mutasyonlarıyla sonuçlanır ve böylece daha fazla kesme turunu önler. Teorik olarak, tekrarlanan DNA bölünme turları, istenen genomik düzenlemenin gerçekleşmesi için artan bir fırsata neden olmalıdır. Cas9 ile karşılaştırıldığında Cas12a'nın ayırt edici bir özelliği, hedefini kestikten sonra Cas12a'nın hedefe bağlı kalması ve daha sonra diğer ssDNA moleküllerini ayrım gözetmeksizin kesmesidir. Bu özelliğe "kollateral bölünme" veya "trans bölünme" aktivitesi denir ve çeşitli teşhis teknolojilerinin geliştirilmesi için kullanılmıştır. ⓘ
Cas13
2016 yılında, Leptotrichia shahii bakterisinden Cas13a nükleazı (eski adıyla C2c2) karakterize edilmiştir. Cas13, RNA güdümlü bir RNA endonükleazıdır, yani DNA'yı değil, yalnızca tek sarmallı RNA'yı parçalar. Cas13, crRNA'sı tarafından bir ssRNA hedefine yönlendirilir ve hedefe bağlanır ve onu parçalar. Cas12a'ya benzer şekilde, Cas13 hedefe bağlı kalır ve daha sonra diğer ssRNA moleküllerini ayrım gözetmeksizin parçalar. Bu ikincil bölünme özelliğinden çeşitli tanı teknolojilerinin geliştirilmesi için yararlanılmıştır. ⓘ
Lokus yapısı
Tekrarlar ve ara parçalar
CRISPR dizisi, AT bakımından zengin bir lider dizisinden ve ardından benzersiz ara parçalarla ayrılmış kısa tekrarlardan oluşur. CRISPR tekrarlarının boyutu tipik olarak 28 ila 37 baz çifti (bps) arasında değişir, ancak 23 bp kadar az ve 55 bp kadar çok olabilir. Bazıları RNA'da bir kök-döngü ('saç tokası') gibi ikincil bir yapının oluşumunu ima eden ikili simetri gösterirken, diğerleri yapılandırılmamış olarak tasarlanmıştır. Farklı CRISPR dizilerindeki ara parçaların boyutu tipik olarak 32 ila 38 bp'dir (aralık 21 ila 72 bp). Yeni ara parçalar, faj enfeksiyonuna karşı bağışıklık tepkisinin bir parçası olarak hızla ortaya çıkabilir. Bir CRISPR dizisinde genellikle 50 birimden daha az tekrar-aralayıcı dizisi vardır. ⓘ
CRISPR RNA yapıları
Cas genleri ve CRISPR alt tipleri
Küçük cas gen kümeleri genellikle CRISPR tekrar-ayırıcı dizilerinin yanında bulunur. Toplu olarak 93 cas geni, kodlanan proteinlerin sekans benzerliğine dayalı olarak 35 aile içinde gruplandırılmıştır. 35 aileden 11'i Cas1'den Cas9'a kadar olan protein ailelerini içeren cas çekirdeğini oluşturur. Tam bir CRISPR-Cas lokusu, cas çekirdeğine ait en az bir gene sahiptir. ⓘ
CRISPR-Cas sistemleri iki sınıfa ayrılır. Sınıf 1 sistemler yabancı nükleik asitleri parçalamak için birden fazla Cas proteininden oluşan bir kompleks kullanır. Sınıf 2 sistemler aynı amaç için tek bir büyük Cas proteini kullanır. Sınıf 1, tip I, III ve IV'e; sınıf 2 ise tip II, V ve VI'ya ayrılır. 6 sistem tipi 19 alt tipe ayrılmıştır. Her tip ve çoğu alt tip, neredeyse yalnızca kategoride bulunan bir "imza gen" ile karakterize edilir. Sınıflandırma ayrıca mevcut cas genlerinin tamamlayıcılığına da dayanmaktadır. Çoğu CRISPR-Cas sistemi bir Cas1 proteinine sahiptir. Cas1 proteinlerinin filogenisi genellikle sınıflandırma sistemiyle uyumludur, ancak modül karıştırma nedeniyle istisnalar mevcuttur. Birçok organizma, uyumlu olduklarını ve bileşenleri paylaşabileceklerini düşündüren birden fazla CRISPR-Cas sistemi içerir. CRISPR/Cas alt tiplerinin dağınık dağılımı, CRISPR/Cas sisteminin mikrobiyal evrim sırasında yatay gen transferine tabi olduğunu göstermektedir. ⓘ
| Büyük ve küçük CRISPR-cas tipleri için + İmza genleri ve varsayılan işlevleri. ⓘ | |||||
| Sınıf | Cas tipi | Cas alt tipi | İmza protein | Fonksiyon | Referans |
|---|---|---|---|---|---|
| 1 | I | — | Cas3 | Tek sarmallı DNA nükleaz (HD alanı) ve ATP bağımlı helikaz | |
| I-A | Cas8a, Cas5 | Cas8, PAM dizisini tanıyarak istilacı DNA'nın hedeflenmesinde önemli olan interferans modülünün bir alt birimidir. Cas5, crRNA'ların işlenmesi ve stabilitesi için gereklidir | |||
| I-B | Cas8b | ||||
| I-C | Cas8c | ||||
| I-D | Cas10d | nükleik asit polimerazların ve nükleotid siklazların palmiye alanına homolog bir alan içerir | |||
| I-E | Cse1, Cse2 | ||||
| I-F | Csy1, Csy2, Csy3 | Belirlenmemiş | |||
| I-G | GSU0054 | ||||
| III | — | Cas10 | Cas10d ve Cse1'in homoloğu. CRISPR hedef RNA'yı bağlar ve interferans kompleksinin stabilitesini destekler | ||
| III-A | Csm2 | Belirlenmemiş | |||
| III-B | Cmr5 | Belirlenmemiş | |||
| III-C | Cas10 veya Csx11 | ||||
| III-D | Csx10 | ||||
| III-E | |||||
| III-F | |||||
| IV | — | Csf1 | |||
| IV-A | |||||
| IV-B | |||||
| IV-C | |||||
| 2 | II | — | Cas9 | RuvC ve HNH nükleazları birlikte DSB'ler üretir ve ayrı ayrı tek iplikli kırılmalar üretebilir. Adaptasyon sırasında işlevsel ara parçaların edinilmesini sağlar. | |
| II-A | Csn2 | Halka şeklinde DNA bağlayıcı protein. Tip II CRISPR sisteminde primed adaptasyonda rol oynar. | |||
| II-B | Cas4 | Ara diziler oluşturmak için cas1 ve cas2 ile çalışan endonükleaz | |||
| II-C | Csn2 veya Cas4'ün yokluğu ile karakterize edilir | ||||
| V | — | Cas12 | Nükleaz RuvC. HNH'den yoksundur. | ||
| V-A | Cas12a (Cpf1) | ||||
| V-B | Cas12b (C2c1) | ||||
| V-C | Cas12c (C2c3) | ||||
| V-D | Cas12d (CasY) | ||||
| V-E | Cas12e (CasX) | ||||
| V-F | Cas12f (Cas14, C2c10) | ||||
| V-G | Cas12g | ||||
| V-H | Cas12h | ||||
| V-I | Cas12i | ||||
| V-K | Cas12k (C2c5) | ||||
| V-U | C2c4, C2c8, C2c9 | ||||
| VI | — | Cas13 | RNA güdümlü RNaz | ||
| VI-A | Cas13a (C2c2) | ||||
| VI-B | Cas13b | ||||
| VI-C | Cas13c | ||||
| VI-D | Cas13d |
Mekanizma
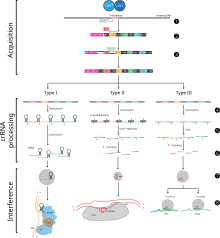
(1) Edinim, istilacı DNA'nın Cas1 ve Cas2 tarafından tanınması ve bir protospacer'ın bölünmesi ile başlar.
(2) Protospacer, lider dizisine bitişik doğrudan tekrara bağlanır ve
(3) tek iplikli uzatma CRISPR'yi onarır ve doğrudan tekrarı çoğaltır. crRNA işleme ve girişim aşamaları üç ana CRISPR sisteminin her birinde farklı şekilde gerçekleşir.
(4) Birincil CRISPR transkripti, crRNA'lar üretmek için cas genleri tarafından parçalanır.
(5) Tip I sistemlerde Cas6e/Cas6f, doğrudan tekrardaki saç tokası halkaları tarafından oluşturulan ssRNA ve dsRNA'nın birleşme noktasında parçalanır. Tip II sistemler, Cas9 ve RNaseIII tarafından parçalanan dsRNA oluşturmak için trans-aktive edici (tracr) bir RNA kullanır. Tip III sistemler, bölünme için doğrudan tekrarda saç tokası ilmekleri gerektirmeyen bir Cas6 homoloğu kullanır.
(6) Tip II ve tip III sistemlerde olgun crRNA'lar üretmek için 5' veya 3' ucunda ikincil kırpma gerçekleştirilir.
(7) Olgun crRNA'lar Cas proteinleri ile birleşerek interferans kompleksleri oluştururlar.
(8) Tip I ve tip II sistemlerde, istilacı DNA'nın bozulması için protein ve PAM dizisi arasındaki etkileşimler gereklidir. Tip III sistemler başarılı bir degradasyon için bir PAM gerektirmez ve tip III-A sistemlerde baz eşleşmesi, tip III-B sistemler tarafından hedeflenen DNA yerine crRNA ve mRNA arasında gerçekleşir. ⓘ





CRISPR-Cas bağışıklığı bakteri ve arkelerin doğal bir sürecidir. CRISPR-Cas, hücreye giren yabancı nükleik asitleri parçalayarak bakteriyofaj enfeksiyonunu, konjugasyonu ve doğal dönüşümü önler. ⓘ
Spacer edinimi
Bir mikrop bir bakteriyofaj tarafından istila edildiğinde, bağışıklık tepkisinin ilk aşaması faj DNA'sını yakalamak ve onu bir ara parça şeklinde bir CRISPR lokusuna yerleştirmektir. Cas1 ve Cas2, CRISPR-Cas bağışıklık sistemlerinin her iki türünde de bulunur, bu da spacer ediniminde yer aldıklarını gösterir. Mutasyon çalışmaları bu hipotezi doğrulayarak cas1 veya cas2'nin çıkarılmasının CRISPR bağışıklık tepkisini etkilemeden ara parça edinimini durdurduğunu göstermiştir. ⓘ
Çoklu Cas1 proteinleri karakterize edilmiş ve yapıları çözülmüştür. Cas1 proteinleri farklı amino asit dizilimlerine sahiptir. Bununla birlikte, kristal yapıları benzerdir ve tüm saflaştırılmış Cas1 proteinleri, DNA'ya diziden bağımsız bir şekilde bağlanan metale bağımlı nükleazlar/integrazlardır. Temsili Cas2 proteinleri karakterize edilmiştir ve ya (tek iplikçikli) ssRNA- ya da (çift iplikçikli) dsDNA- spesifik endoribonükleaz aktivitesine sahiptir. ⓘ
E. coli'nin I-E sisteminde Cas1 ve Cas2, bir Cas2 dimerinin iki Cas1 dimerini köprülediği bir kompleks oluşturur. Bu komplekste Cas2, istilacı DNA'nın çift sarmallı parçalarını bağlayarak enzimatik olmayan bir iskele rolü üstlenirken, Cas1 DNA'nın tek sarmallı yanlarını bağlar ve bunların CRISPR dizilerine entegrasyonunu katalize eder. Yeni ara parçalar genellikle CRISPR'nin başına lider dizinin yanına eklenir ve viral enfeksiyonların kronolojik bir kaydını oluşturur. E. coli'de, lider diziye bağlanan entegrasyon konak faktörü (IHF) adı verilen histon benzeri bir protein, bu entegrasyonun doğruluğundan sorumludur. IHF ayrıca Pectobacterium atrosepticum'un tip I-F sisteminde entegrasyon verimliliğini artırır. ancak diğer sistemlerde farklı konak faktörleri gerekli olabilir ⓘ
Protospacer bitişik motifler (PAM)
Faj genomlarının ara parça olarak çıkarılan bölgelerinin (protospacer olarak adlandırılır) biyoinformatik analizi, bunların rastgele seçilmediğini, bunun yerine protospacer bitişik motifler (PAM) olarak adlandırılan kısa (3-5 bp) DNA dizilerine bitişik bulunduğunu ortaya koymuştur. CRISPR-Cas sistemlerinin analizi, PAM'lerin tip I ve tip II için önemli olduğunu, ancak edinim sırasında tip III sistemler için önemli olmadığını göstermiştir. Tip I ve tip II sistemlerde, protospacer'lar bir PAM dizisine bitişik pozisyonlarda eksize edilir, spacer'ın diğer ucu bir cetvel mekanizması kullanılarak kesilir, böylece CRISPR dizisindeki spacer boyutunun düzenliliği korunur. PAM dizisinin korunması CRISPR-Cas sistemleri arasında farklılık gösterir ve evrimsel olarak Cas1 ve lider dizisi ile bağlantılı görünmektedir. ⓘ
Yeni ara parçalar bir CRISPR dizisine yönlü bir şekilde eklenir, tercihen meydana gelir, ancak yalnızca lider dizisine bitişik değildir. E. coli'den tip I-E sisteminin analizi, lider dizisine bitişik ilk doğrudan tekrarın kopyalandığını ve yeni edinilen ara parçanın birinci ve ikinci doğrudan tekrarlar arasına yerleştirildiğini göstermiştir. ⓘ
PAM dizisi, tip I-E sistemlerinde ara parça eklenmesi sırasında önemli görünmektedir. Bu dizi, protospacer'ın ilk nt'sine bitişik güçlü bir şekilde korunmuş bir son nükleotid (nt) içerir. Bu nt, ilk doğrudan tekrarda son baz haline gelir. Bu, ara parça edinme makinesinin, ara parça yerleştirme sırasında doğrudan tekrarın sondan ikinci konumunda ve PAM'de tek sarmallı çıkıntılar oluşturduğunu göstermektedir. Ancak, tüm CRISPR-Cas sistemleri bu mekanizmayı paylaşmıyor gibi görünmektedir, çünkü diğer organizmalardaki PAM'ler son konumda aynı düzeyde koruma göstermemektedir. Bu sistemlerde, edinim sırasında doğrudan tekrarın ve protospacer'ın en ucunda küt bir uç oluşması muhtemeldir. ⓘ
Ekleme varyantları
Sulfolobus solfataricus CRISPR'lerinin analizi, altı CRISPR lokusundan biri, lider diziye en yakın yerleştirmenin aksine, CRISPR dizisi boyunca rastgele yeni ara parçalar yerleştirdiğinden, kanonik ara parça yerleştirme modelinde daha fazla karmaşıklık ortaya çıkardı. ⓘ
Çoklu CRISPR'ler aynı faj için birçok ara parça içerir. Bu fenomene neden olan mekanizma E. coli'nin tip I-E sisteminde keşfedilmiştir. Ara parçaların zaten fajı hedeflediği, hatta protospacer ile uyumsuzlukların olduğu durumlarda ara parça ediniminde önemli bir artış tespit edilmiştir. Bu 'priming', hem edinim hem de girişimde yer alan Cas proteinlerinin birbirleriyle etkileşime girmesini gerektirir. Priming mekanizmasından kaynaklanan yeni edinilmiş ara parçalar her zaman priming ara parça ile aynı iplikçik üzerinde bulunur. Bu gözlem, edinim mekanizmasının yeni bir protospacer bulmak için priming işleminden sonra yabancı DNA boyunca kaydığı hipotezine yol açmıştır. ⓘ
Biyogenez
Daha sonra girişim adımı sırasında Cas nükleazını hedefe yönlendiren CRISPR-RNA (crRNA), CRISPR dizisinden üretilmelidir. crRNA başlangıçta CRISPR dizisinin çoğunu kapsayan tek bir uzun transkriptin parçası olarak transkribe edilir. Bu transkript daha sonra crRNA'ları oluşturmak için Cas proteinleri tarafından parçalanır. CrRNA'ları üretme mekanizması CRISPR/Cas sistemleri arasında farklılık gösterir. Tip I-E ve tip I-F sistemlerinde, sırasıyla Cas6e ve Cas6f proteinleri, crRNA'yı çevreleyen özdeş tekrarların eşleştirilmesiyle oluşturulan kök döngüleri tanır. Bu Cas proteinleri eşleştirilmiş bölgenin kenarındaki uzun transkripti keserek eşleştirilmiş tekrar bölgesinin küçük bir kalıntısı ile birlikte tek bir crRNA bırakır. ⓘ
Tip III sistemler de Cas6 kullanır, ancak tekrarları stem-loop üretmez. Bunun yerine bölünme, tekrar dizisinin hemen yukarısında bölünmeye izin vermek için daha uzun transkriptin Cas6'nın etrafına sarılmasıyla gerçekleşir. ⓘ
Tip II sistemlerde Cas6 geni bulunmaz ve bunun yerine bölünme için RNaseIII kullanılır. Fonksiyonel tip II sistemler, trans-aktive edici crRNA (tracrRNA) olarak bilinen tekrar dizisine tamamlayıcı olan ekstra bir küçük RNA kodlar. TracrRNA ve birincil CRISPR transkriptinin transkripsiyonu, baz eşleşmesi ve tekrar dizisinde dsRNA oluşumu ile sonuçlanır, bu da daha sonra crRNA'lar üretmek için RNaseIII tarafından hedeflenir. Diğer iki sistemden farklı olarak crRNA tam spacer içermez, bunun yerine bir ucundan kesilir. ⓘ
CrRNA'lar Cas proteinleri ile birleşerek yabancı nükleik asitleri tanıyan ribonükleotid kompleksleri oluşturur. CrRNA'lar kodlayan ve kodlamayan iplikler arasında bir tercih göstermez, bu da RNA güdümlü bir DNA hedefleme sisteminin göstergesidir. Tip I-E kompleksi (genellikle Cascade olarak adlandırılır) tek bir crRNA'ya bağlı beş Cas proteini gerektirir. ⓘ
Girişim
Tip I sistemlerdeki girişim aşaması sırasında PAM dizisi crRNA-tamamlayıcı iplik üzerinde tanınır ve crRNA tavlaması ile birlikte gereklidir. Tip I sistemlerde crRNA ve protospacer arasındaki doğru baz eşleşmesi, Cascade'de DNA degradasyonu için Cas3'ü işe alan konformasyonel bir değişikliği işaret eder. ⓘ
Tip II sistemler, girişim adımı için tek bir çok işlevli protein olan Cas9'a güvenir. Cas9 işlev görmek için hem crRNA hem de tracrRNA'ya ihtiyaç duyar ve çift HNH ve RuvC/RNaseH benzeri endonükleaz alanlarını kullanarak DNA'yı parçalar. Tip II sistemlerde PAM ile faj genomu arasında baz eşleşmesi gereklidir. Ancak PAM, crRNA ile aynı iplikçikte tanınır (tip I sistemlerin ters iplikçiği). ⓘ
Tip III sistemler, tip I gibi, crRNA'lara bağlanan altı veya yedi Cas proteinine ihtiyaç duyar. S. solfataricus ve P. furiosus'tan analiz edilen tip III sistemlerin her ikisi de faj DNA genomu yerine fajların mRNA'sını hedefler, bu da bu sistemleri RNA tabanlı faj genomlarını hedefleme konusunda benzersiz bir şekilde yetenekli kılabilir. Tip III sistemlerin, kompleksteki farklı bir Cas proteini olan Cas10'u kullanarak RNA'ya ek olarak DNA'yı da hedeflediği bulunmuştur. DNA bölünmesinin transkripsiyona bağlı olduğu gösterilmiştir. ⓘ
Girişim sırasında kendini yabancı DNA'dan ayırt etme mekanizması crRNA'larda yerleşiktir ve bu nedenle muhtemelen her üç sistem için de ortaktır. Her bir ana tipin kendine özgü olgunlaşma süreci boyunca, tüm crRNA'lar bir veya her iki ucunda bir spacer dizisi ve tekrarın bir kısmını içerir. CRISPR-Cas sisteminin kromozomu hedeflemesini engelleyen kısmi tekrar dizisidir, çünkü spacer dizisinin ötesinde baz eşleşmesi kendi kendine sinyal verir ve DNA bölünmesini önler. RNA güdümlü CRISPR enzimleri tip V restriksiyon enzimleri olarak sınıflandırılır. ⓘ
Evrim
| CRISPR ilişkili protein Cas2 (adaptasyon RNaz) ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Thermus thermophilus'tan varsayımsal bir protein olan tt1823'ün kristal yapısı | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | CRISPR_Cas2 | ||||||||
| Pfam | PF09827 | ||||||||
| InterPro | IPR019199 | ||||||||
| CDD | cd09638 | ||||||||
| |||||||||
| CRISPR-ilişkili protein CasA/Cse1 (Tip I efektör DNaz) ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||
| Sembol | CRISPR_Cse1 | ||||||||
| Pfam | PF09481 | ||||||||
| InterPro | IPR013381 | ||||||||
| CDD | cd09729 | ||||||||
| |||||||||
| CRISPR ilişkili protein CasC/Cse3/Cas6 (Tip I efektör RNaz) ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Thermus thermophilus'tan crispr-ilişkili bir proteinin kristal yapısı | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | CRISPR_assoc | ||||||||
| Pfam | PF08798 | ||||||||
| Pfam Klanı | CL0362 | ||||||||
| InterPro | IPR010179 | ||||||||
| CDD | cd09727 | ||||||||
| |||||||||
CRISPR-Cas sisteminin adaptör ve efektör modüllerindeki cas genlerinin iki farklı atasal modülden evrimleştiğine inanılmaktadır. Cas1 benzeri integrazı ve potansiyel olarak adaptasyon modülünün diğer bileşenlerini kodlayan casposon adı verilen transpozon benzeri bir element, muhtemelen bağımsız bir doğuştan gelen bağışıklık sistemi olarak işlev gören atasal efektör modülünün yanına yerleştirilmiştir. Adaptör modülünün yüksek oranda korunmuş cas1 ve cas2 genleri atasal modülden evrimleşirken, çeşitli sınıf 1 efektör cas genleri atasal efektör modülünden evrimleşmiştir. Bu çeşitli sınıf 1 efektör modülü cas genlerinin evrimi, duplikasyon olayları gibi çeşitli mekanizmalar tarafından yönlendirilmiştir. Öte yandan, her bir sınıf 2 efektör modülü tipi, mobil genetik unsurların birbirini takip eden bağımsız eklemelerinden ortaya çıkmıştır. Bu hareketli genetik unsurlar, efektör modülünün tüm gerekli görevlerini yerine getiren büyük proteinler üreten tek gen efektör modüllerini oluşturmak için çoklu gen efektör modüllerinin yerini almıştır. CRISPR-Cas sistemlerinin spacer bölgeleri doğrudan yabancı mobil genetik elementlerden alınmıştır ve bu nedenle uzun vadeli evrimlerinin izlenmesi zordur. Bu ara bölgelerin rastgele olmayan evriminin, çevreye ve içerdiği belirli yabancı mobil genetik unsurlara büyük ölçüde bağlı olduğu bulunmuştur. ⓘ
CRISPR/Cas, bakterileri belirli fajlara karşı bağışıklayabilir ve böylece bulaşmayı durdurabilir. Bu nedenle Koonin, CRISPR/Cas'ı Lamarckçı bir kalıtım mekanizması olarak tanımlamıştır. Ancak bir eleştirmen buna itiraz ederek, "[Lamarck'ı] teorisine sadece yüzeysel olarak benzeyen şeylerle değil, bilime yaptığı iyi katkılarla hatırlamalıyız. Gerçekten de CRISPR ve diğer fenomenleri Lamarckçı olarak düşünmek, evrimin gerçekte nasıl basit ve zarif bir şekilde işlediğini gizlemekten başka bir işe yaramaz". Ancak daha yeni çalışmalar yapıldıkça, CRISPR-Cas sistemlerinin edinilmiş ara bölgelerinin gerçekten de bir tür Lamarckçı evrim olduğu ortaya çıkmıştır, çünkü bunlar edinilen ve daha sonra aktarılan genetik mutasyonlardır. Öte yandan, sistemi kolaylaştıran Cas gen mekanizmasının evrimi klasik Darwinci evrim yoluyla gelişmektedir. ⓘ
Birlikte Evrim
CRISPR dizilerinin analizi, konakçı ve viral genomların birlikte evrimleştiğini ortaya koymuştur. Cas9 proteinleri patojenik ve kommensal bakterilerde yüksek oranda zenginleşmiştir. CRISPR/Cas aracılı gen düzenlemesi, özellikle ökaryotik konakçılarla etkileşim sırasında endojen bakteriyel genlerin düzenlenmesine katkıda bulunabilir. Örneğin, Francisella novicida, F. novicida'nın konakçı tepkisini azaltması ve virülansı teşvik etmesi için kritik olan bir bakteriyel lipoproteini kodlayan endojen bir transkripti bastırmak için benzersiz, küçük, CRISPR/Cas-ilişkili bir RNA (scaRNA) kullanır. ⓘ
CRISPR evriminin temel modeli, fajları bakteriyel bağışıklık tepkisinden kaçınmak için genomlarını mutasyona uğratmaya yönlendiren ve hem faj hem de konak popülasyonlarında çeşitlilik yaratan yeni dahil edilmiş ara parçalardır. Bir faj enfeksiyonuna direnmek için, CRISPR ara parçasının dizisi, hedef faj geninin dizisine mükemmel bir şekilde karşılık gelmelidir. Fajlar, ara parçadaki nokta mutasyonları göz önüne alındığında konakçılarını enfekte etmeye devam edebilir. PAM'de de benzer sıkılık gereklidir, aksi takdirde bakteri suşu faja duyarlı kalır. ⓘ
Oranlar
124 S. thermophilus suşu üzerinde yapılan bir çalışma, tüm ara parçaların %26'sının benzersiz olduğunu ve farklı CRISPR lokuslarının farklı ara parça edinme oranları gösterdiğini ortaya koymuştur. Bazı CRISPR lokusları diğerlerinden daha hızlı evrimleşerek suşların filogenetik ilişkilerinin belirlenmesine olanak sağlamıştır. Karşılaştırmalı bir genomik analiz, E. coli ve S. enterica'nın S. thermophilus'tan çok daha yavaş evrimleştiğini göstermiştir. İkincisinin 250 bin yıl önce farklılaşan suşları hala aynı ara parça tamamlayıcısını içeriyordu. ⓘ
İki asit madeni drenaj biyofilminin metagenomik analizi, analiz edilen CRISPR'lerden birinin diğer biyofilme kıyasla kapsamlı delesyonlar ve ara parça eklemeleri içerdiğini göstermiş, bu da bir toplulukta diğerinden daha yüksek bir faj aktivitesi/yaygınlığı olduğunu düşündürmüştür. Ağız boşluğunda, zamansal bir çalışma, bir birey içinde 17 ay boyunca ara parçaların %7-22'sinin paylaşıldığını, %2'den azının ise bireyler arasında paylaşıldığını belirlemiştir. ⓘ
Aynı ortamdan tek bir suş, CRISPR sistemine özgü PCR primerleri kullanılarak izlenmiştir. Spacer varlığı/yokluğuna ilişkin geniş düzey sonuçlar önemli çeşitlilik göstermiştir. Bununla birlikte, bu CRISPR 17 ay içinde 3 ara parça eklemiştir, bu da önemli CRISPR çeşitliliğine sahip bir ortamda bile bazı lokusların yavaş geliştiğini göstermektedir. ⓘ
CRISPR'ler, insan mikrobiyom projesi için üretilen metagenomlardan analiz edilmiştir. Çoğu vücut bölgesine özgü olsa da, bir vücut bölgesi içindeki bazıları bireyler arasında yaygın olarak paylaşılmaktadır. Bu lokuslardan biri streptokok türlerinden kaynaklanmış ve %50'si benzersiz olan ≈15.000 spacer içermiştir. Ağız boşluğunda hedeflenen çalışmalara benzer şekilde, bazıları zaman içinde çok az evrim göstermiştir. ⓘ
CRISPR evrimi, ara parça edinme oranlarını doğrudan incelemek için S. thermophilus kullanılarak kemostatlarda incelenmiştir. Bir hafta içinde, S. thermophilus suşları tek bir faj ile karşılaştığında üç adede kadar ara parça edinmiştir. Aynı aralıkta faj, popülasyonda sabit hale gelen tek nükleotid polimorfizmleri geliştirdi, bu da hedeflemenin bu mutasyonların olmadığı faj replikasyonunu önlediğini düşündürdü. ⓘ
Bir başka S. thermophilus deneyi, fajların yalnızca bir hedefleme ara parçasına sahip konakçılarda enfekte ve replike olabileceğini göstermiştir. Bir diğeri ise hassas konakların yüksek faj titrelerinin bulunduğu ortamlarda var olabileceğini göstermiştir. Kemostat ve gözlemsel çalışmalar, CRISPR ve faj (birlikte) evriminde birçok nüans olduğunu göstermektedir. ⓘ
Tanımlama
CRISPR'ler bakteriler ve arkeler arasında yaygın olarak bulunur ve bazı dizi benzerlikleri gösterir. En dikkat çekici özellikleri, tekrar eden ara parçaları ve doğrudan tekrarlarıdır. Bu özellik, CRISPR'leri uzun DNA dizilerinde kolayca tanımlanabilir hale getirir, çünkü tekrar sayısı yanlış pozitif eşleşme olasılığını azaltır. ⓘ
Metagenomik verilerde CRISPR'lerin analizi daha zordur, çünkü CRISPR lokusları tekrarlayan yapıları nedeniyle veya suş varyasyonu nedeniyle tipik olarak bir araya gelmez, bu da birleştirme algoritmalarını karıştırır. Birçok referans genomun mevcut olduğu durumlarda, CRISPR dizilerini çoğaltmak ve ara parça içeriğini analiz etmek için polimeraz zincir reaksiyonu (PCR) kullanılabilir. Ancak bu yaklaşım, yalnızca özel olarak hedeflenmiş CRISPR'ler ve güvenilir polimeraz zincir reaksiyonu (PCR) primerleri tasarlamak için halka açık veri tabanlarında yeterli temsile sahip organizmalar için bilgi sağlar. Dejenere tekrara özgü primerler, CRISPR aralayıcılarını doğrudan çevresel örneklerden çoğaltmak için kullanılabilir; iki veya üç aralayıcı içeren amplikonlar daha sonra uzun CRISPR dizilerini yeniden yapılandırmak için hesaplamalı olarak birleştirilebilir. ⓘ
Alternatif, CRISPR dizilerini shotgun metagenomik verilerden çıkarmak ve yeniden yapılandırmaktır. Bu, özellikle ikinci nesil dizileme teknolojilerinde (örn. 454, Illumina), kısa okuma uzunlukları tek bir okumada iki veya üçten fazla tekrar biriminin görünmesini engellediğinden, hesaplama açısından daha zordur. Ham okumalarda CRISPR tanımlaması, tamamen de novo tanımlama kullanılarak veya contiglerden (birlikte DNA'nın bir konsensüs bölgesini temsil eden örtüşen DNA segmentleri) kısmen monte edilmiş CRISPR dizilerindeki doğrudan tekrar dizileri ve bireysel okumalardaki doğrudan tekrarları tanımlamak için bir kanca olarak yayınlanmış genomlardan doğrudan tekrar dizileri kullanılarak elde edilmiştir. ⓘ
Fajlar tarafından kullanım
Bakterilerin faj enfeksiyonuna karşı savunma yapmasının bir başka yolu da kromozomal adalara sahip olmasıdır. Faj tarafından indüklenebilir kromozomal ada (PICI) olarak adlandırılan kromozomal adaların bir alt tipi, faj enfeksiyonu üzerine bakteriyel bir kromozomdan çıkarılır ve faj replikasyonunu inhibe edebilir. PICI'ler belirli stafilokokal ılıman fajlar tarafından indüklenir, eksize edilir, replike edilir ve son olarak küçük kapsidler halinde paketlenir. PICI'ler faj üremesini engellemek için çeşitli mekanizmalar kullanır. İlk mekanizmada PICI tarafından kodlanan Ppi, faj TerS ile spesifik olarak bağlanarak veya etkileşime girerek faj olgunlaşmasını farklı şekilde bloke eder, böylece faj DNA paketlemesinden sorumlu faj TerS/TerL kompleks oluşumunu engeller. İkinci mekanizmada PICI CpmAB, faj kapsid morfogenetik proteinini SaPI boyutlu kapsidin %95'ini oluşturacak şekilde yönlendirir ve faj DNA'sı genomunun sadece 1/3'ünü bu küçük kapside paketleyebilir ve dolayısıyla yaşayamayan faj haline gelir. Üçüncü mekanizma, virion ve lizis proteinlerinin üretiminden sorumlu olan LtrC'yi hedef alan iki proteini, PtiA ve PtiB'yi içerir. Bu interferans mekanizması, bir modülatör protein olan PtiM tarafından modüle edilir, interferansa aracılık eden proteinlerden biri olan PtiA'ya bağlanır ve böylece gerekli interferans seviyesine ulaşılır. ⓘ
Bir çalışma, özellikle Vibrio cholerae serogrup O1'i hedef alan litik ICP1 fajının, V. cholera PICI benzeri bir elementi hedef alan bir CRISPR/Cas sistemi edindiğini göstermiştir. Sistemde 2 CRISPR lokusu ve 9 Cas geni bulunmaktadır. Yersinia pestis'te bulunan I-F sistemi ile homolog gibi görünmektedir. Dahası, bakteriyel CRISPR/Cas sistemi gibi, ICP1 CRISPR/Cas da yeni diziler edinebilir, bu da faj ve konağın birlikte evrimleşmesine olanak tanır. ⓘ
Bazı arkeal virüslerin bir veya iki ara parça içeren mini-CRISPR dizileri taşıdığı gösterilmiştir. Virüs kaynaklı CRISPR dizileri içindeki ara parçaların diğer virüsleri ve plazmidleri hedef aldığı gösterilmiştir, bu da mini-CRISPR dizilerinin heterotipik süperenfeksiyon dışlama mekanizmasını temsil ettiğini ve virüsler arası çatışmalara katıldığını düşündürmektedir. ⓘ
Uygulamalar
CRISPR gen düzenleme
CRISPR teknolojisi gıda ve tarım endüstrilerinde probiyotik kültürlerin mühendisliğini yapmak ve endüstriyel kültürleri (örneğin yoğurt için) enfeksiyonlara karşı bağışıklamak için uygulanmıştır. Ayrıca mahsullerde verimi, kuraklığa toleransı ve besin değerini arttırmak için de kullanılmaktadır. ⓘ
2014 yılı sonuna kadar CRISPR'den bahseden yaklaşık 1000 araştırma makalesi yayınlanmıştır. Teknoloji, insan hücre dizileri ve hücrelerindeki genleri işlevsel olarak etkisiz hale getirmek, Candida albicans üzerinde çalışmak, biyoyakıt yapımında kullanılan mayaları değiştirmek ve mahsul türlerini genetik olarak değiştirmek için kullanılmıştır. Hsu ve meslektaşları, genetik dizileri manipüle etme yeteneğinin biyoyakıt üretimini olumlu yönde etkileyebilecek tersine mühendisliğe izin verdiğini belirtiyor CRISPR, sivrisinekleri değiştirmek için de kullanılabilir, böylece sıtma gibi hastalıkları bulaştıramazlar. Cas12a kullanan CRISPR tabanlı yaklaşımlar, son zamanlarda çok sayıda bitki türünün başarılı bir şekilde modifikasyonunda kullanılmıştır. ⓘ
Temmuz 2019'da CRISPR, genetik bozukluğu olan bir hastayı deneysel olarak tedavi etmek için kullanıldı. Hasta, orak hücre hastalığı olan 34 yaşında bir kadındı. ⓘ
Şubat 2020'de, farelerde entegre viral DNA'nın %60-80'inin çıkarılması ve bazılarının hem yeni bir anti-retroviral tedavi olan LASER ART hem de CRISPR içeren düzenlemelerden sonra virüsten tamamen arındırılmasıyla HIV tedavilerinde ilerleme kaydedildi. ⓘ
Mart 2020'de CRISPR ile modifiye edilmiş virüs, Leber konjenital amorozunu tedavi etmek amacıyla bir hastanın gözüne enjekte edildi. ⓘ
Gelecekte, CRISPR gen düzenlemesi potansiyel olarak yeni türler yaratmak veya yakın akraba türlerden soyu tükenmiş türleri canlandırmak için kullanılabilir. ⓘ
Gen-hastalık ilişkilerine yönelik iddiaların CRISPR temelli yeniden değerlendirmeleri, potansiyel olarak önemli anomalilerin keşfedilmesine yol açmıştır. ⓘ
Teşhis aracı olarak CRISPR

CRISPR ile ilişkili nükleazlar, hedef olmayan dizilerin yüksek bir arka planında nükleik asit dizilerini spesifik olarak hedefleme yetenekleri nedeniyle moleküler test için bir araç olarak yararlı olduklarını göstermiştir. 2016 yılında Cas9 nükleaz, yeni nesil dizileme kütüphanelerindeki istenmeyen nükleotid dizilerini yok etmek için kullanılırken, yalnızca 250 pikogram başlangıç RNA girdisi gerektirmiştir. 2017'den itibaren CRISPR ile ilişkili nükleazlar, tek molekül hassasiyetine kadar nükleik asitlerin doğrudan tanısal testi için de kullanıldı. CRISPR çeşitliliği, Martins ve arkadaşları (2019) tarafından ksantomonadlarda olduğu gibi bakterilerdeki filogeniyi ve çeşitliliği ayırt etmek için bir analiz hedefi olarak kullanılmaktadır. Patojenin CRISPR'lerinin moleküler tiplendirilmesi yoluyla bitki patojenlerinin erken tespiti, Shen ve diğerleri, 2020 tarafından gösterildiği gibi tarımda kullanılabilir. ⓘ
CRISPR tabanlı teşhislerin ek enzimatik süreçlere bağlanmasıyla, nükleik asitlerin ötesindeki moleküllerin tespiti mümkündür. Birleştirilmiş bir teknolojiye örnek olarak SHERLOCK tabanlı IN vitro Transkripsiyon Profili (SPRINT) verilebilir. SPRINT, hasta numunelerindeki metabolitler veya çevresel numunelerdeki kirleticiler gibi çeşitli maddeleri yüksek verimle veya taşınabilir bakım noktası cihazlarıyla tespit etmek için kullanılabilir. CRISPR/Cas platformları, COVID-19'a neden olan SARS-CoV-2 virüsünün tespiti ve inaktivasyonu için de araştırılmaktadır. ⓘ
Cas9 Enzimi
Moleküler bir makas görevini gerçekleştiren Cas9, genomun belirli yerlerinden iki DNA iplikçiğini kesmektedir. Böylece DNA parçaları eklenmektedir ve çıkarılabilmektedir. ⓘ
Rehber RNA (İng. guide RNA - gRNA)
Uzun bir RNA iskeletin içindeki yaklaşık 20 bazlık bir RNA dizilimidir. Uzun RNA iskeleti DNA'ya bağlanarak Cas9'un genomun doğru noktasına gitmesine rehberlik etmektedir. Bu sayede Cas9 enzimi genomdaki doğru noktaları kesmektedir. ⓘ
Genomdaki hedef DNA dizilimin bütünleyici RNA bazlarına sahip olan rehber RNA, DNA'daki belirli bir dizilimi bulup bağlanmak için tasarlanmaktadır. Cas9 enzimi ise rehber RNA'yı izlemektedir. Kısaca rehber RNA Cas9'a rehberlik ederek DNA'daki ilgili yere gitmesini ve DNA'nın iki iplikçiğinde kesik oluşturmasını sağlamaktadır. Kesik oluştuğu sırada hücre DNA'nın hasar aldığını fark ederek onu onarmaya çalışmaktadır. Bilim insanları DNA onarım mekanizmasını kullanarak, ilgilendikleri hücrenin genleriyle ilgili değişiklik çalışmaları yapmaktadır. ⓘ
CRISPR ve Evrim
CRISPR-Cas9 teknolojisi ile insan genomu düzenlenebilir ve istenmeyen genetik hastalıklar ortadan kalkabilmektedir. ⓘ
Yapılan çalışmalar, CRISPR-Cas9 teknolojisinin birçok tıbbi hastalığın (kanser, hepatit B, talesemi, lösemi, orak hücreli anemi vb.) tedavisinde umut vadettiğini göstermektedir. Yapılan çalışmalar genellikle somatik hücrelerin genomlarının düzenlenmesi üzerine yapılmaktadır. Ancak son yıllarda üreme hücrelerinin genomları üzerinde çalışmalar yapılması da tartışılmaktadır. ⓘ
Bilim insanları evrimin temel mekanizmalarından biri olan seçilimle birlikte çeşitliliğe müdahale etmenin genetik düzenlemelerden geçtiğine inanmaktadır. CRISPR-Cas9 teknolojisi ile istenmeyen kalıtsal hastalık genlerini genomumuzdan kesip atılabilir veya düzenlenebilir. Bu sayede biyolojik sınırlar çevremize göre daha uyumlu bir şekilde belirlenebilir. ⓘ
Tartışmalar
Üreme hücrelerinin düzenlenmesinde CRISPR-Cas9 teknolojisinin kullanılma fikri bazı etik tartışmalara yol açmaktadır. Üreme hücrelerinde yapılacak değişikliklerin nesilden nesle aktarılma durumu ciddi bir etik boyut olarak görülmektedir. ⓘ
CRISPR-Cas9 teknolojisinin kullanılmasın da erken gelişim süreçlerini anlamak ve tüp bebek işlemlerinde embriyoların kültür durumlarının düzeltilmesine yardımcı olabileceğine yönelik çalışmalar sürdürülmektedir. ⓘ
CRISPR-Cas9 teknolojisi dikkatle takip edilmesi gereken etkili bir genom düzenleme yöntemidir. Bilim insanlarının insan eşey hücre öncüllerini kalıcı olarak değiştirmesi gibi bir durum söz konusu olduğundan bu konudaki tartışmalar sürmektedir. Çalışmaların etik ilkelere bağlı kalarak yapılması amaçlanmaktadır. ⓘ
Lulu ve Nana Olayı

CRISPR teknolojisinin kullanımına yönelik tartışmalar süregelirken 2018 yılında He Jiankui, CRISPR teknolojisini insan embriyosunda kullanılmasıyla insanlık tarihinin ilk genetik tasarımlı bebekleri olan Lulu ve Nana´nın dünyaya geldiğini duyurmuştur. HIV’i hücre içerisine almakla görevli CCR5 yüzey reseptörünü, CRISPR-CAS9 teknolojisi ile insan embriyolarında işlevsiz hâle getiren He Jiankui, 26 Kasım 2018 tarihinde YouTube aracılığıyla HIV'e dirençli ikiz bebeklerin sağlıklı bir şekilde dünyaya geldiğini iddia etmiştir. Kısa bir süre sonra yetkili makamlarca da doğrulanan bu deney, yaşadığımız yüzyılın bilim dünyasında sarsıcı etkiler bırakan her yönüyle etik ihlallerine tanık olduğumuz bir deney olarak büyük tartışmalara yol açmıştır. 29 Kasım 2018'de Çinli yetkililer, Çin yasalarını ihlal ettiği gerekçesiyle He Jiankui'nin tüm araştırma faaliyetlerini askıya almıştır. ⓘ









