Bakteriyofaj



Bakteriyofaj (/bækˈtɪərioʊfeɪdʒ/), gayri resmi olarak faj (/ˈfeɪdʒ/) olarak da bilinir, bakterileri ve arkeleri enfekte eden ve çoğaltan bir virüstür. Bu terim "bakteri" ve Yunanca φαγεῖν (fajin) sözcüklerinden türetilmiştir ve "yutmak" anlamına gelmektedir. Bakteriyofajlar, bir DNA veya RNA genomunu kapsülleyen proteinlerden oluşur ve basit veya ayrıntılı yapılara sahip olabilirler. Genomları dört gen kadar az sayıda (örneğin MS2) ve yüzlerce gen kadar çok sayıda gen kodlayabilir. Fajlar, genomlarının sitoplazmaya enjekte edilmesini takiben bakteri içinde çoğalırlar. ⓘ
Bakteriyofajlar biyosferdeki en yaygın ve çeşitli varlıklar arasındadır. Bakteriyofajlar her yerde bulunan virüslerdir ve bakterilerin bulunduğu her yerde bulunurlar. Gezegende 1031'den fazla bakteriyofaj olduğu tahmin edilmektedir; bu sayı, bakteriler de dahil olmak üzere Dünya'daki diğer tüm organizmaların toplamından daha fazladır. Virüsler, dünya okyanuslarının su sütununda en bol bulunan biyolojik varlıktır ve prokaryotlardan sonra biyokütlenin ikinci en büyük bileşenidir; yüzeydeki mikrobiyal matlarda mililitre başına 9x108 viryon bulunmuştur ve deniz bakterilerinin %70'ine kadarı fajlar tarafından enfekte edilmiş olabilir. ⓘ
Fajlar 20. yüzyılın sonlarından beri eski Sovyetler Birliği ve Orta Avrupa'nın yanı sıra Fransa'da antibiyotiklere alternatif olarak kullanılmaktadır. Birçok bakterinin çoklu ilaca dirençli türlerine karşı olası bir tedavi olarak görülmektedirler (bkz. faj tedavisi). Fajların bağışıklık sistemi ile hem faj kodlu proteinlerin bakteriyel ekspresyonu yoluyla dolaylı olarak hem de doğuştan gelen bağışıklığı ve bakteriyel klirensi etkileyerek doğrudan etkileşime girdiği bilinmektedir. ⓘ

Ökaryotları (hayvan, bitki ve mantarları) enfekte eden virüsler gibi fajlarda da büyük bir yapısal ve işlevsel çeşitlilik vardır. Tipik olarak proteinden oluşan bir kabuk ve içinde yer alan genetik malzemeden oluşurlar. Genetik malzeme DNA veya RNA olabilir, ama genelde 5 - 500 kilo baz çifti uzunluğunda çift sarmallı DNA'dan oluşur. Bakteriyofajlar genelde 20 ila 200 nm arası büyüklükte olurlar. ⓘ
Sınıflandırma
Bakteriyofajlar biyosferde bol miktarda bulunur, farklı genomlara ve yaşam tarzlarına sahiptir. Fajlar, Uluslararası Virüs Taksonomisi Komitesi (ICTV) tarafından morfoloji ve nükleik aside göre sınıflandırılmaktadır. ⓘ


| Sipariş | Aile | Morfoloji | Nükleik asit | Örnekler |
|---|---|---|---|---|
| Belfryvirales | Turriviridae | Zarflı, izometrik | Doğrusal dsDNA | |
| Caudovirales | Ackermannviridae | Zarfsız, kontraktil kuyruk | Doğrusal dsDNA | |
| Autographiviridae | Zarfsız, kontraktil olmayan kuyruk (kısa) | Doğrusal dsDNA | ||
| Chaseviridae | Doğrusal dsDNA | |||
| Demerecviridae | Doğrusal dsDNA | |||
| Drexlerviridae | Doğrusal dsDNA | |||
| Guenliviridae | Doğrusal dsDNA | |||
| Herelleviridae | Zarfsız, kontraktil kuyruk | Doğrusal dsDNA | ||
| Myoviridae | Zarfsız, kontraktil kuyruk | Doğrusal dsDNA | T4, Mu, P1, P2 | |
| Siphoviridae | Zarfsız, kontraktil olmayan kuyruk (uzun) | Doğrusal dsDNA | λ, T5, HK97, N15 | |
| Podoviridae | Zarfsız, kontraktil olmayan kuyruk (kısa) | Doğrusal dsDNA | T7, T3, Φ29, P22 | |
| Rountreeviridae | Doğrusal dsDNA | |||
| Salasmaviridae | Doğrusal dsDNA | |||
| Schitoviridae | Doğrusal dsDNA | |||
| Zobellviridae | Doğrusal dsDNA | |||
| Halopanivirales | Sphaerolipoviridae | Zarflı, izometrik | Doğrusal dsDNA | |
| Simuloviridae | Zarflı, izometrik | Doğrusal dsDNA | ||
| Matshushitaviridae | Zarflı, izometrik | Doğrusal dsDNA | ||
| Haloruvirales | Pleolipoviridae | Zarflı, pleomorfik | Dairesel ssDNA, dairesel dsDNA veya doğrusal dsDNA | |
| Kalamavirales | Tectiviridae | Zarfsız, izometrik | Doğrusal dsDNA | |
| Ligamenvirales | Lipothrixviridae | Zarflı, çubuk şeklinde | Doğrusal dsDNA | Acidianus filamentöz virüs 1 |
| Rudiviridae | Zarfsız, çubuk şeklinde | Doğrusal dsDNA | Sulfolobus islandicus çubuk şekilli virüs 1 | |
| Mindivirales | Cystoviridae | Zarflı, küresel | Doğrusal dsRNA | Φ6 |
| Norzivirales | Atkinsviridae | Zarfsız, izometrik | Doğrusal ssRNA | |
| Duinviridae | Zarfsız, izometrik | Doğrusal ssRNA | ||
| Fiersviridae | Zarfsız, izometrik | Doğrusal ssRNA | MS2, Qβ | |
| Solspiviridae | Zarfsız, izometrik | Doğrusal ssRNA | ||
| Petitvirales | Microviridae | Zarfsız, izometrik | Dairesel ssDNA | ΦX174 |
| Primavirales | Tristromaviridae | Zarflı, çubuk şeklinde | Doğrusal dsDNA | |
| Timlovirales | Blumeviridae | Zarfsız, izometrik | Doğrusal ssRNA | |
| Steitzviridae | Zarfsız, izometrik | Doğrusal ssRNA | ||
| Tubulavirales | Inoviridae | Zarfsız, ipliksi | Dairesel ssDNA | M13 |
| Paulinoviridae | Zarfsız, ipliksi | Dairesel ssDNA | ||
| Plectroviridae | Zarfsız, ipliksi | Dairesel ssDNA | ||
| Vinavirales | Corticoviridae | Zarfsız, izometrik | Dairesel dsDNA | PM2 |
| Durnavirales | Picobirnaviridae (teklif) | Zarfsız, izometrik | Doğrusal dsRNA | |
| Atanmamış | Ampullaviridae | Zarflı, şişe şeklinde | Doğrusal dsDNA | |
| Autolykiviridae | Zarfsız, izometrik | Doğrusal dsDNA | ||
| Bicaudaviridae | Zarfsız, limon şeklinde | Dairesel dsDNA | ||
| Clavaviridae | Zarfsız, çubuk şeklinde | Dairesel dsDNA | ||
| Finnlakeviridae | Zarfsız, izometrik | Dairesel ssDNA | FLiP | |
| Fuselloviridae | Zarfsız, limon şeklinde | Dairesel dsDNA | ||
| Globuloviridae | Zarflı, izometrik | Doğrusal dsDNA | ||
| Guttaviridae | Zarfsız, oval | Dairesel dsDNA | ||
| Halspiviridae | Zarfsız, limon şeklinde | Doğrusal dsDNA | ||
| Plasmaviridae | Zarflı, pleomorfik | Dairesel dsDNA | ||
| Portogloboviridae | Zarflı, izometrik | Dairesel dsDNA | ||
| Thaspiviridae | Zarfsız, limon şeklinde | Doğrusal dsDNA | ||
| Spiraviridae | Zarfsız, çubuk şeklinde | Dairesel ssDNA |
Picobirnaviridae üyelerinin bakterileri enfekte ettiği, ancak memelileri enfekte etmediği öne sürülmüştür. ⓘ
Leviviricetes sınıfının atanmamış birçok cinsi de bulunmaktadır: Doğrusal ssRNA genomları içeren Chimpavirus, Hohglivirus, Mahrahvirus, Meihzavirus, Nicedsevirus, Sculuvirus, Skrubnovirus, Tetipavirus ve Winunavirus ve doğrusal bir dsDNA genomu içeren Caudovirales takımının atanmamış cinsi Lilyvirus. ⓘ
Tarihçe

1896 yılında Ernest Hanbury Hankin, Hindistan'daki Ganj ve Yamuna nehirlerinin sularında bulunan bir maddenin koleraya karşı belirgin bir antibakteriyel etkiye sahip olduğunu ve çok ince bir porselen filtreden geçebildiğini bildirmiştir. 1915 yılında Londra'daki Brown Enstitüsü'nün yöneticisi İngiliz bakteriyolog Frederick Twort, bakterileri enfekte eden ve öldüren küçük bir madde keşfetti. Bu maddenin aşağıdakilerden biri olması gerektiğine inanıyordu:
- bakterinin yaşam döngüsündeki bir aşama
- bakterilerin kendileri tarafından üretilen bir enzim veya
- bakteriler üzerinde büyüyen ve onları yok eden bir virüs ⓘ
Twort'un araştırmaları I. Dünya Savaşı'nın başlaması, finansman sıkıntısı ve antibiyotiklerin keşfi nedeniyle kesintiye uğradı. ⓘ
Bağımsız olarak, Paris'teki Pasteur Enstitüsü'nde çalışan Fransız-Kanadalı mikrobiyolog Félix d'Hérelle, 3 Eylül 1917'de "dizanteri basilinin görünmez, antagonistik bir mikrobunu" keşfettiğini duyurdu. d'Hérelle için keşfinin niteliği konusunda hiçbir soru işareti yoktu: "Bir anda anlamıştım: açık lekelerime neden olan şey aslında görünmez bir mikroptu... bakteriler üzerinde parazit olan bir virüs." D'Hérelle bu virüse bakteriyofaj, yani bakteri yiyen (Yunanca "yutmak" anlamına gelen phagein kelimesinden) adını verdi. Ayrıca dizanteriden muzdarip bir adamın bakteriyofajlar tarafından sağlığına kavuşturulduğu dramatik bir olayı da kaydetmiştir. D'Herelle bakteriyofajlar üzerine çok sayıda araştırma yapmış ve faj terapisi kavramını ortaya atmıştır. ⓘ
Faj araştırmaları için verilen Nobel ödülleri
1969 yılında Max Delbrück, Alfred Hershey ve Salvador Luria, virüslerin replikasyonu ve genetik yapılarına ilişkin keşifleri nedeniyle Nobel Fizyoloji veya Tıp Ödülüne layık görülmüştür. Özellikle Hershey'in 1952'deki Hershey-Chase deneyine katkıda bulunan çalışması, yaşamın genetik materyalinin protein değil DNA olduğuna dair ikna edici kanıtlar sağlamıştır. Delbrück ve Luria, bakterilerdeki mutasyonların rastgele meydana geldiğini ve dolayısıyla Lamarckçı ilkelerden ziyade Darwinci ilkeleri izlediğini istatistiksel olarak gösteren Luria-Delbrück deneyini gerçekleştirmiştir. ⓘ
Kullanım Alanları
Faj tedavisi

Fajların antibakteriyel ajanlar olduğu keşfedilmiş ve 1920'ler ve 1930'lar boyunca eski Sovyet Cumhuriyeti Gürcistan'da (bakteriyofajların ortak kaşifi Félix d'Herelle'in yardımıyla Giorgi Eliava tarafından öncülük edilmiştir) bakteriyel enfeksiyonların tedavisinde kullanılmıştır. Kızıl Ordu'daki askerlerin tedavisi de dahil olmak üzere yaygın bir kullanıma sahiptiler. Ancak, çeşitli nedenlerle Batı'da genel kullanım için terk edildiler:
- Antibiyotikler keşfedildi ve geniş çapta pazarlandı. Yapılması, depolanması ve reçete edilmesi daha kolaydı.
- Fajlarla ilgili tıbbi denemeler yapıldı, ancak fajlarla ilgili temel bir anlayış eksikliği bu denemelerin geçerliliği konusunda soru işaretleri yarattı.
- Sovyetler Birliği'ndeki araştırmaların yayınlanması çoğunlukla Rusça veya Gürcüce dillerindeydi ve uzun yıllar boyunca uluslararası alanda takip edilmedi. ⓘ
Fajların kullanımı Soğuk Savaş'ın sona ermesinden bu yana Rusya, Gürcistan ve Orta ve Doğu Avrupa'nın başka yerlerinde devam etmiştir. İlk düzenlenmiş, randomize, çift kör klinik çalışma Haziran 2009'da Journal of Wound Care'de rapor edilmiş ve insan hastalarda bacaktaki enfekte venöz ülserleri tedavi etmek için bir bakteriyofaj kokteylinin güvenlik ve etkinliğini değerlendirmiştir. FDA çalışmayı Faz I klinik araştırma olarak onaylamıştır. Çalışmanın sonuçları bakteriyofajların terapötik uygulamasının güvenli olduğunu göstermiş, ancak etkinliğini göstermemiştir. Yazarlar, standart yara bakımının bir parçası olan bazı kimyasalların (örneğin laktoferrin veya gümüş) kullanımının bakteriyofaj canlılığına müdahale etmiş olabileceğini açıklamıştır. Bundan kısa bir süre sonra, Batı Avrupa'da yapılan bir başka kontrollü klinik çalışma (Pseudomonas aeruginosa'nın neden olduğu kulak enfeksiyonlarının tedavisi) Ağustos 2009'da Clinical Otolaryngology dergisinde rapor edilmiştir. Çalışma, bakteriyofaj preparatlarının insanlarda kronik kulak enfeksiyonlarının tedavisi için güvenli ve etkili olduğu sonucuna varmıştır. Ayrıca, enfekte yanıklar ve yaralar ve kistik fibrozisle ilişkili akciğer enfeksiyonları gibi çeşitli hastalıklar için bakteriyofajların etkinliğini değerlendiren çok sayıda hayvan ve diğer deneysel klinik çalışmalar yapılmıştır. Öte yandan, Inoviridae fajlarının pnömoni ve kistik fibrozda yer alan biyofilmleri karmaşıklaştırdığı ve bakterileri hastalığı ortadan kaldırmaya yönelik ilaçlardan koruduğu, böylece kalıcı enfeksiyonu teşvik ettiği gösterilmiştir. ⓘ
Bu arada, bakteriyofaj araştırmacıları antibiyotik direncinin üstesinden gelmek için tasarlanmış virüsler geliştirmekte ve biyofilm matrisini, faj yapısal proteinlerini ve bakteri hücre duvarının parçalanmasından sorumlu enzimleri kodlamaktan sorumlu faj genlerini tasarlamaktadır. Küçük boyutlu ve kısa kuyruklu T4 fajlarının insan vücudundaki E. coli'yi tespit etmede yardımcı olabileceğini gösteren sonuçlar elde edilmiştir. ⓘ
Bir faj kokteylinin terapötik etkinliği, çoklu ilaca dirençli (MDR) A. baumannii'nin nazal enfeksiyonu olan bir fare modelinde değerlendirilmiştir. Faj kokteyli ile tedavi edilen fareler, enfeksiyondan sonraki yedi gün içinde tedavi edilmeyenlere göre 2,3 kat daha yüksek bir hayatta kalma oranı göstermiştir. 2017 yılında MDR A. baumannii nedeniyle pankreası zarar gören bir hastaya çeşitli antibiyotikler verilmiş, buna rağmen hastanın sağlığı dört aylık bir süre boyunca kötüleşmeye devam etmiştir. Etkili antibiyotikleri olmayan hastaya, MDR A. baumannii'ye karşı etkili olduğu kanıtlanmış dokuz farklı faj içeren bir faj kokteyli kullanılarak faj tedavisi uygulanmıştır. Bu tedaviye başladıktan sonra hastanın aşağı yönlü klinik gidişatı tersine döndü ve hasta sağlığına kavuştu. ⓘ
D'Herelle "bakteriyofajların bakterilerin geliştiği her yerde bulunduğunu çabucak öğrendi: kanalizasyonlarda, borulardan atık akışını yakalayan nehirlerde ve nekahat dönemindeki hastaların dışkılarında." Bu nehirler arasında Hindistan'ın Ganj Nehri de dahil olmak üzere geleneksel olarak iyileştirici güçlere sahip olduğu düşünülen nehirler de yer almaktadır. ⓘ
Diğer nehirler
Gıda endüstrisi - Fajlar, gıda ürünlerini güvenli hale getirmek ve bozulma bakterilerini önlemek için giderek daha fazla kullanılmaktadır. Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA) ve Amerika Birleşik Devletleri Tarım Bakanlığı (USDA) 2006 yılından bu yana çeşitli bakteriyofaj ürünlerini onaylamıştır. LMP-102 (Intralytix) yemeye hazır (RTE) kümes hayvanları ve et ürünlerinin tedavisi için onaylanmıştır. Aynı yıl FDA, Listeria monocytogenes bakterilerini öldürmek için peynirde bakteriyofaj kullanan LISTEX'i (Micreos tarafından geliştirilmiş ve üretilmiştir) genel olarak güvenli kabul edilen (GRAS) statüsü vermek için onaylamıştır. Temmuz 2007'de aynı bakteriyofajın tüm gıda ürünlerinde kullanımı onaylanmıştır. 2011 yılında USDA, LISTEX'in temiz etiket işleme yardımcısı olduğunu ve USDA'ya dahil edildiğini onayladı. Gıda güvenliği alanındaki araştırmalar, litik fajların çeşitli gıda ürünlerindeki diğer gıda kaynaklı patojenleri kontrol etmek için uygun bir seçenek olup olmadığını görmek için devam etmektedir. ⓘ
Teşhis - 2011 yılında FDA, in vitro teşhis amaçlı kullanım için ilk bakteriyofaj bazlı ürünü onaylamıştır. KeyPath MRSA/MSSA Kan Kültürü Testi, pozitif kan kültürlerinde Staphylococcus aureus'u tespit etmek ve metisilin direncini veya duyarlılığını belirlemek için bir bakteriyofaj kokteyli kullanır. Test, standart mikrobiyal tanımlama ve duyarlılık testi yöntemleri için iki ila üç güne kıyasla yaklaşık beş saat içinde sonuç verir. FDA tarafından onaylanan ilk hızlandırılmış antibiyotik duyarlılık testidir. ⓘ
Biyolojik silahlar ve toksinlerle mücadele - Batı'daki devlet kurumları birkaç yıldır Gürcistan ve eski Sovyetler Birliği'nden şarbon ve botulizm gibi biyolojik silahlar ve toksinlerle mücadelede fajlardan yararlanma konusunda yardım istiyor. ABD'deki araştırma grupları arasında gelişmeler devam etmektedir. Diğer kullanım alanları arasında bitkileri ve sebze ürünlerini çürümeden ve bakteriyel hastalıkların yayılmasından korumak için bahçecilikte sprey uygulaması yer almaktadır. Bakteriyofajlar için diğer uygulamalar, örneğin hastanelerde çevresel yüzeyler için biyositler ve klinik ortamlarda kullanılmadan önce kateterler ve tıbbi cihazlar için önleyici tedavilerdir. Fajların kuru yüzeylere, örneğin üniformalara, perdelere ve hatta ameliyat dikişlerine uygulanmasına yönelik teknoloji artık mevcuttur. Clinical Otolaryngology'de bildirilen klinik deneyler, otitisli evcil köpeklerin veteriner tedavisinde başarı göstermektedir. ⓘ
SEPTIC bakteri algılama ve tanımlama yöntemi, faj enfeksiyonu sırasında iyon emisyonunu ve dinamiklerini kullanır ve algılama için yüksek özgüllük ve hız sunar. ⓘ
Faj görüntüleme, bir yüzey proteinine bağlı değişken bir peptide sahip bir faj kütüphanesini içeren fajların farklı bir kullanımıdır. Her faj genomu, yüzeyinde görüntülenen proteinin varyantını kodlar (dolayısıyla adı) ve peptit varyantı ile kodlayan gen arasında bir bağlantı sağlar. Kütüphanedeki varyant fajlar, nötralize etmek için immobilize bir moleküle (örneğin botulizm toksini) bağlanma afiniteleri yoluyla seçilebilir. Bağlanan, seçilen fajlar, duyarlı bir bakteri suşunu yeniden enfekte ederek çoğaltılabilir, böylece daha fazla çalışma için içlerinde kodlanan peptitleri geri almalarına izin verir. ⓘ
Antimikrobiyal ilaç keşfi - Faj proteinleri genellikle antimikrobiyal aktiviteye sahiptir ve peptidomimetikler, yani peptidleri taklit eden ilaçlar için öncü olabilir. Faj-ligand teknolojisi, bakterilerin ve bakteriyel bileşenlerin (örneğin endotoksin) bağlanması ve bakterilerin parçalanması gibi çeşitli uygulamalar için faj proteinlerini kullanır. ⓘ
Temel araştırma - Bakteriyofajlar, evrim ve ekoloji ilkelerini incelemek için önemli model organizmalardır. ⓘ
Zararlılar
Süt endüstrisi
Ortamda bulunan bakteriyofajlar peynirin fermente olmamasına neden olabilir. Bunu önlemek için karışık suşlu starter kültürler ve kültür rotasyon rejimleri kullanılabilir. Kültür mikroplarının genetik mühendisliği - özellikle Lactococcus lactis ve Streptococcus thermophilus - faj direncini artırmak için genetik analiz ve modifikasyon için çalışılmıştır. Bu çalışmalar özellikle plazmid ve rekombinant kromozomal modifikasyonlara odaklanmıştır. ⓘ
Çoğaltma

Bakteriyofajların yaşam döngüsü ya litik bir döngü ya da lizojenik bir döngü olma eğilimindedir. Buna ek olarak, bazı fajlar psödolizojenik davranışlar sergiler. ⓘ
T4 fajı gibi litik fajlarda, bakteri hücreleri kırılarak açılır (lize edilir) ve virionun hemen replikasyonundan sonra yok edilir. Hücre yok olur olmaz, faj dölleri enfekte edecek yeni konakçılar bulabilir. Litik fajlar faj terapisi için daha uygundur. Bazı litik fajlar, hücre dışı faj konsantrasyonları yüksekse, tamamlanmış faj dölünün hemen hücreden dışarı atılmayacağı, lizis inhibisyonu olarak bilinen bir fenomene maruz kalır. Bu mekanizma, ılıman fajın uykuya geçmesi ile aynı değildir ve genellikle geçicidir. ⓘ
Buna karşılık, lizojenik döngü konak hücrenin hemen parçalanmasıyla sonuçlanmaz. Lizojenik döngüden geçebilen fajlar ılıman fajlar olarak bilinir. Viral genomları konak DNA'sı ile bütünleşir ve nispeten zararsız bir şekilde onunla birlikte çoğalır, hatta bir plazmid olarak yerleşebilir. Virüs, belki de besin maddelerinin tükenmesi nedeniyle konak koşulları kötüleşene kadar uykuda kalır, daha sonra endojen fajlar (profajlar olarak bilinir) aktif hale gelir. Bu noktada üreme döngüsünü başlatarak konak hücrenin parçalanmasına neden olurlar. Lizojenik döngü konak hücrenin hayatta kalmaya ve üremeye devam etmesini sağladığından, virüs hücrenin tüm yavrularında çoğaltılır. Lizojenik döngüyü ve litik döngüyü takip ettiği bilinen bir bakteriyofaj örneği, E. coli'nin faj lambda'sıdır. ⓘ
Bazen profajlar, lizojenik dönüşüm adı verilen bir olguda, bakteriyel genoma yeni işlevler ekleyerek uykudayken konakçı bakteriye fayda sağlayabilir. Corynebacterium diphtheriae veya Vibrio cholerae'nin zararsız suşlarının bakteriyofajlar tarafından sırasıyla difteri veya koleraya neden olan oldukça öldürücü suşlara dönüştürülmesi buna örnek olarak verilebilir. Bu toksin kodlayan profajları hedef alarak belirli bakteriyel enfeksiyonlarla mücadele stratejileri önerilmiştir. ⓘ
Bakteriyofajların litik veya lizogenik hayat döngüleri olabilir, bazılarında her ikisi de olur. T4 fajı gibi öldürücü fajlarda görülen litik döngüde virionun çoğalmasının hemen ardından konak hücre parçalanır ve ölür. Hücre ölür ölmez virionların kendilerine yeni bir konak bulmaları gerekir. ⓘ
Bağlanma ve penetrasyon

Bakteriyel hücreler polisakkaritlerden oluşan bir hücre duvarı ile korunmaktadır ve bu duvar bakteriyel hücreleri hem bağışıklık sistemi hem de antibiyotiklere karşı koruyan önemli virülans faktörleridir. Bakteriyofajlar bir konakçı hücreye girmek için bakteri yüzeyindeki lipopolisakkaritler, teikoik asitler, proteinler ve hatta flagella gibi spesifik reseptörlere bağlanır. Bu özgüllük, bir bakteriyofajın yalnızca bağlanabileceği reseptörleri taşıyan belirli bakterileri enfekte edebileceği anlamına gelir ve bu da fajın konak aralığını belirler. Polisakkarit parçalayıcı enzimler, sıkı bir şekilde programlanmış faj enfeksiyon sürecinin ilk adımında konakçılarının kapsüler dış tabakasını enzimatik olarak parçalayan viryonla ilişkili proteinlerdir. Konak büyüme koşulları da fajın konaklara bağlanma ve onları istila etme yeteneğini etkiler. Faj viryonları bağımsız olarak hareket etmediğinden, kan, lenfatik dolaşım, sulama, toprak suyu vb. gibi çözelti içindeyken doğru reseptörlerle rastgele karşılaşmalarına güvenmek zorundadırlar. ⓘ
Miyovirüs bakteriyofajları, genetik materyallerini hücreye enjekte etmek için hipodermik şırınga benzeri bir hareket kullanır. Uygun reseptörle temas ettikten sonra kuyruk lifleri esneyerek taban plakasını hücre yüzeyine yaklaştırır. Bu, geri dönüşümlü bağlanma olarak bilinir. Tamamen bağlandıktan sonra, geri dönüşümsüz bağlanma başlatılır ve kuyruk, muhtemelen kuyrukta bulunan ATP'nin yardımıyla kasılarak genetik materyali bakteri zarından enjekte eder. Enjeksiyon, şaftın yana doğru giderek bir tür bükülme hareketi yapması, hücreye yaklaşarak kasılması ve tekrar yukarı itilmesi yoluyla gerçekleştirilir. Podovirüsler miyovirüslerdeki gibi uzun bir kuyruk kılıfından yoksundur, bu nedenle genetik materyallerini yerleştirmeden önce hücre zarının bir kısmını bozmak için küçük, diş benzeri kuyruk liflerini enzimatik olarak kullanırlar. ⓘ

Protein ve nükleik asit sentezi
Dakikalar içinde bakteriyel ribozomlar viral mRNA'yı proteine çevirmeye başlar. RNA tabanlı fajlar için, RNA replikaz sürecin başlarında sentezlenir. Proteinler bakteriyel RNA polimerazı modifiye eder, böylece tercihen viral mRNA'yı kopyalar. Konakçının normal protein ve nükleik asit sentezi bozulur ve bunun yerine viral ürünler üretmeye zorlanır. Bu ürünler hücre içinde yeni viryonların, yeni viryonların bir araya gelmesine katkıda bulunan yardımcı proteinlerin veya hücre lizisine katılan proteinlerin bir parçası haline gelir. 1972'de Walter Fiers (Gent Üniversitesi, Belçika) bir genin ve 1976'da bakteriyofaj MS2'nin viral genomunun tam nükleotid dizisini oluşturan ilk kişidir. Bazı dsDNA bakteriyofajları, faj enfeksiyonu sırasında protein çevirisini modüle ettiği düşünülen ribozomal proteinleri kodlar. ⓘ
Viryon birleşimi
T4 fajı örneğinde, yeni virüs partiküllerinin inşası, faj morfogenezi sırasında katalitik olarak hareket eden yardımcı proteinlerin yardımını içerir. Önce taban plakaları bir araya getirilir, kuyruklar daha sonra bunların üzerine inşa edilir. Ayrı olarak inşa edilen baş kapsidler, kuyruklarla kendiliğinden birleşecektir. Faj T4 virionunun montajı sırasında, faj genleri tarafından kodlanan morfogenetik proteinler karakteristik bir sırayla birbirleriyle etkileşime girer. Viral enfeksiyon sırasında üretilen bu proteinlerin her birinin miktarında uygun bir dengenin korunması, normal faj T4 morfogenezi için kritik görünmektedir. DNA, kafalar içinde verimli bir şekilde paketlenir. Tüm süreç yaklaşık 15 dakika sürer. ⓘ
Viryonların serbest bırakılması
Fajlar hücre lizisi, ekstrüzyon ya da birkaç vakada tomurcuklanma yoluyla salınabilir. Kuyruklu fajlar tarafından lizis, endolizin adı verilen ve hücre duvarı peptidoglikanına saldırıp parçalayan bir enzimle gerçekleştirilir. Tamamen farklı bir faj türü olan filamentöz faj, konak hücrenin sürekli olarak yeni virüs partikülleri salgılamasını sağlar. Salınan virionlar serbest olarak tanımlanır ve kusurlu olmadıkça yeni bir bakteriyi enfekte edebilir. Tomurcuklanma bazı Mycoplasma fajları ile ilişkilidir. Virion salınımının aksine, lizojenik döngü sergileyen fajlar konağı öldürmez, bunun yerine profaj olarak uzun süreli sakinler haline gelirler. ⓘ
İletişim
2017 yılında yapılan bir araştırma, Φ3T bakteriyofajının kısa bir viral protein ürettiğini ve bu proteinin diğer bakteriyofajlara konak bakteriyi öldürmek yerine uykuda kalmaları için sinyal verdiğini ortaya koydu. Arbitrium, bu proteine onu keşfeden araştırmacılar tarafından verilen isimdir. ⓘ
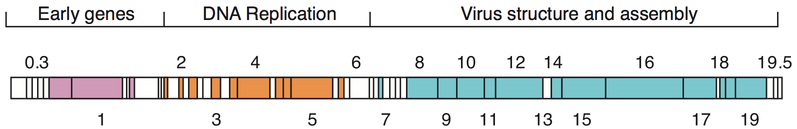
Genom yapısı
Ortamdaki milyonlarca farklı faj göz önüne alındığında, faj genomları çeşitli biçimlerde ve boyutlarda olabilir. MS2 gibi RNA fajları sadece birkaç kilobazlık en küçük genomlara sahiptir. Bununla birlikte, T4 gibi bazı DNA fajları yüzlerce gen içeren büyük genomlara sahip olabilir; kapsidin boyutu ve şekli genomun boyutuyla birlikte değişir. En büyük bakteriyofaj genomları 735 kb boyutuna ulaşır.
Bakteriyofaj genomları oldukça mozaik olabilir, yani birçok faj türünün genomu çok sayıda bireysel modülden oluşuyor gibi görünmektedir. Bu modüller diğer faj türlerinde farklı düzenlemelerde bulunabilir. Mikobakteriyel konaklara sahip bakteriyofajlar olan mikobakteriyofajlar, bu mozaikliğin mükemmel örneklerini sağlamıştır. Bu mikobakteriyofajlarda genetik çeşitlilik, bölgeye özgü rekombinasyon ve gayrimeşru rekombinasyonun (bakteriyel konak genetik dizilerinin faj genomu ediniminin sonucu) tekrarlanan örneklerinin sonucu olabilir. Bakteri virüslerinin genomlarını şekillendiren evrimsel mekanizmalar farklı aileler arasında değişiklik gösterir ve nükleik asit tipine, virion yapısının özelliklerine ve viral yaşam döngüsünün moduna bağlıdır.
Bazı deniz roseobacter fajları genomik DNA'larında deoksitimidin (dT) yerine deoksiüridin (dU) içerir. Bu alışılmadık bileşenin, istilacı faj içindeki dizileri tanıyıp parçalayarak onları etkisiz hale getirmek üzere evrimleşen restriksiyon endonükleazları ve CRISPR/Cas sistemleri gibi bakteriyel savunma mekanizmalarından kaçmak için bir mekanizma olduğuna dair bazı kanıtlar vardır. Diğer fajların alışılmadık nükleotidler kullandığı uzun zamandır bilinmektedir. Takahashi ve Marmur 1963 yılında genomunda dT yerine dU bulunan bir Bacillus fajını tanımlamış, 1977 yılında ise Kirnos ve arkadaşları adenin (A) yerine 2-aminoadenin (Z) içeren bir siyanofaj tanımlamıştır. ⓘ
Sistem biyolojisi
Sistem biyolojisi alanı, genellikle hesaplama araçları ve modelleme kullanarak bir organizma içindeki karmaşık etkileşim ağlarını araştırır. Örneğin, bakteriyel bir konakçı hücreye giren bir faj genomu, çok sayıda konakçı geninin ifadesini veya konakçının metabolizmasını etkileyecek yüzlerce faj proteinini ifade edebilir. Tüm bu karmaşık etkileşimler bilgisayar modellerinde tanımlanabilir ve simüle edilebilir. ⓘ
Örneğin, Pseudomonas aeruginosa'nın ılıman faj PaP3 ile enfeksiyonu, konakçının genlerinin %38'inin (2160/5633) ifadesini değiştirmiştir. Bu etkilerin çoğu muhtemelen dolaylıdır, dolayısıyla asıl zorluk bakteri ve faj arasındaki doğrudan etkileşimleri belirlemektir. ⓘ
Faj ve konakçıları arasındaki protein-protein etkileşimlerini haritalamak için çeşitli girişimlerde bulunulmuştur. Örneğin, bakteriyofaj lambda'nın konakçısı E. coli ile düzinelerce etkileşime girdiği bulunmuştur. Yine, bu etkileşimlerin çoğunun önemi belirsizliğini korumaktadır, ancak bu çalışmalar büyük olasılıkla birkaç anahtar etkileşim ve rolü henüz tanımlanmamış birçok dolaylı etkileşim olduğunu göstermektedir. ⓘ
Çevre içinde
Metagenomik, daha önce mümkün olmayan bakteriyofajların su içinde tespit edilmesine olanak sağlamıştır. ⓘ
Ayrıca bakteriyofajlar, özellikle yüzey suyu ve yeraltı suyu etkileşimlerinin meydana geldiği nehir sistemlerinde hidrolojik izleme ve modellemede kullanılmıştır. Fajların kullanımı, yeraltı sularından geçerken önemli ölçüde daha az emildikleri ve çok düşük konsantrasyonlarda kolayca tespit edildikleri için daha geleneksel boya işaretleyicisine tercih edilir. Kirlenmemiş su, ml başına yaklaşık 2×108 bakteriyofaj içerebilir. ⓘ
Bakteriyofajların doğal ortamlarda yatay gen transferine, esas olarak transdüksiyon yoluyla, ancak aynı zamanda transformasyon yoluyla da büyük ölçüde katkıda bulunduğu düşünülmektedir. Metagenomik tabanlı çalışmalar, çeşitli ortamlardan elde edilen viromların, çoklu ilaç direnci sağlayabilecek olanlar da dahil olmak üzere antibiyotik direnç genlerini barındırdığını ortaya koymuştur. ⓘ
İnsanlarda
Fajlar insanları enfekte etmese de, geniş mikrobiyomumuz göz önüne alındığında insan vücudunda sayısız faj partikülü bulunmaktadır. Faj popülasyonumuz, "sağlıklı bağırsak fajomu" (HGP) ve "hastalıklı insan fajomu" (DHP) dahil olmak üzere insan fajomu olarak adlandırılmıştır. Sağlıklı bir insanın aktif fajomunun (yani, replike olmayan, entegre profajın aksine aktif olarak replike olan) düzinelerce ila binlerce farklı virüs içerdiği tahmin edilmektedir. Bakteriyofajların ve bakterilerin insan bağırsak mikrobiyomunda hem antagonist hem de faydalı bir şekilde etkileşime girdiğine dair kanıtlar vardır. ⓘ
Ön çalışmalar, yaygın bakteriyofajların sağlıklı bireylerin ortalama %62'sinde bulunduğunu, ülseratif kolit (UC) ve Crohn hastalığı (CD) olan hastalarda ise prevalanslarının ortalama %42 ve %54 oranında azaldığını göstermiştir. Fajların bolluğu yaşlılarda da azalabilir. ⓘ
İnsan bağırsağında dünya çapında bulunan en yaygın fajlar crAsfajlardır. CrAssphages doğumdan hemen sonra anneden çocuğa aktarılır ve yerel olarak aktarılabileceklerini düşündüren bazı kanıtlar vardır. Her insan kendine özgü crAssphage kümeleri geliştirir. CrAss benzeri fajlar insanların yanı sıra primatlarda da mevcut olabilir. ⓘ
Yaygın olarak incelenen bakteriyofaj
Sayısız faj arasında, mikrobiyal genetiğin ilk günlerinde keşfedilen tarihsel olarak önemli bazı fajlar da dahil olmak üzere sadece birkaçı ayrıntılı olarak incelenmiştir. Bunlar, özellikle de T-fajı, gen yapısı ve işlevinin önemli ilkelerinin keşfedilmesine yardımcı olmuştur.
- 186 faj
- λ faj
- Φ6 faj
- Φ29 faj
- ΦX174
- Bakteriyofaj φCb5
- G4 faj
- M13 fajı
- MS2 fajı (23-28 nm boyutunda)
- N4 faj
- P1 fajı
- P2 fajı
- P4 faj
- R17 fajı
- T2 faj
- T4 fajı (169 kbp genom, 200 nm uzunluğunda)
- T7 faj
- T12 fajı ⓘ
Faj terapisi
Faj terapisinin avantaj ve dezavantajları
Fajların antibiyotiklere göre bazı avantaj ve dezavantajları vardır.(Tablo 1) Bunlar içinde en önemlileri; fajın uygulanma biçiminden bağımsız olarak nerede ihtiyaç varsa oraya göç etmesi ve orada çoğalması, antibiyotik direncinden bağımsız olarak aktivite göstermesi, biyofilm üzerine etkin olması, etki spektrumunun dar olması ve faj terapisi öncesi etken/faj ilişkisinin tanımlanmış olması olarak sıralanabilir. ⓘ
Faj terapisinin güvenilirliği: Günümüze kadar yapılan çalışmalarda faj terapisinin, minör etkileri dışında, hiçbir yan etkisi bildirilmemiştir. ⓘ
| Bakteriyofajlar | Antibiyotikler | Yorum ⓘ | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Etki spektrumu oldukça dar ve oldukça spesifiktir. | Etki spektrumu geniştir. | Faj tedavisi öncesi bakterinin tanımlanması ve faj duyarlılığının tespit edilmesi gerekliliği sebebiyle, yüksek spesifikte fajın dezavantajları arasında sayılabilir. Antibiyotiklerde etki spektrumu geniş olabilir ancak mikrobiyal etkiyi büyük ölçüde etkiler. | |||||||||||||||||||||||||||||||||
| Enfeksiyonun olduğu yerde replike olur ve nerede ihtiyaç varsa orada çoğalır. | Vücutta metabolize edilir ve eliminasyona uğrar. | Fajlar geometrik şekilde çoğaldıklarından enfeksiyonun olduğu yere az sayıda enjekte edilmesi yeterli olacaktır.
Antibiyotiklerin enfeksiyon bölgesinde her zaman konsantre olmaması sebebiyle yüksek doz ve belirli aralıklarla uygulanması gerekir. | |||||||||||||||||||||||||||||||||
| Hızlı bakterisit etki gösterir. | Bakterisit / Bakteriyostatik etki gösterebilir. | Hızlı bakterisit etki sebebiyle fajlar akut vakalarda hızlı etki gösterebilirler.
Bakteriyostatik antibiyotik etkileri bakterilerde direnç gelişimine neden olabilir. | |||||||||||||||||||||||||||||||||
| Şu ana kadar gözlemlenmiş bir yan etkisi bulunmamaktadır. | Birçok yan etkisi vardır. | Faj tarafından parçalanan bakterilerden salınan endotoksinlere bağlı olarak çok az yan etki bildirilmiştir. | |||||||||||||||||||||||||||||||||
| Faja dirençli bakteriler aynı görevdeki fajlara karşı duyarlı kalabilir. | Antibiyotik direnci sadece hedeflenen bakteriyle sınırlı kalmaz. | "Doğada bir bakteri varsa, onu enfekte eden faj da mutlaka vardır." varsayımı dolayısıyla, bir faja karşı dirençli olan bakteriler için yeni fajlar kolaylıkla izole edilebilinir.
Antibiyotik direnci özellikle hareketli genetik araçlarla aktarılabilinir. | |||||||||||||||||||||||||||||||||
| Faj seçimi hızlı bir faliyet olup günler, haftalar içinde yapılabilir. Oldukça düşük maliyetlidir. | Yeni antibiyotik geliştirilmesi oldukça uzun zaman ve maliyet ister. | Doğada istenen konağa karşı kullanılacak fajın izolasyonu oldukça kolay ve düşük maliyetlidir. Fakat doğru fajın seçilip terapide kullanılacak hale getirilebilinmesi için uzmana ihtiyaç vardır. Bakterinin kültürü ne kadar zorsa faj izolasyonu da o derecede zordur. | |||||||||||||||||||||||||||||||||
| İnsan vücudundaki faj aktivitesi azaltıcı etkenlere maruz kalabilir. | Aktivite azaltıcı etkenlerden korunmak için standardizasyonları oldukça iyi yapılmıştır. | Antibiyotiklerin kullanım kolaylığının yanında fajların bu özelliği dezavantaj olarak kalmaktadır. Ancak ileri teknolojilerle faj preparasyonlarının kapsül haline getirilmesi ve azaltıcı etkenlerden korunması etkili yöntemler arasında gösterilmektedir. | |||||||||||||||||||||||||||||||||
Faj direnci: Bakteriyofaj ve konağı olan bakterilerin (Devam edecek.) ⓘ