DNA

| Bir serinin parçası ⓘ |
| Genetik |
|---|
 |
|
Deoksiribonükleik asit (/diːˈɒksɪˌraɪboʊnjuːˌkliːɪk, -ˌkleɪ-/ (![]() dinle); DNA), bilinen tüm organizmaların ve birçok virüsün gelişimi, işleyişi, büyümesi ve üremesi için genetik talimatlar taşıyan bir çift sarmal oluşturmak üzere birbiri etrafında sarılan iki polinükleotid zincirinden oluşan bir polimerdir. DNA ve ribonükleik asit (RNA) nükleik asitlerdir. Proteinler, lipidler ve kompleks karbonhidratlar (polisakkaritler) ile birlikte nükleik asitler, bilinen tüm yaşam formları için gerekli olan dört ana makromolekül türünden biridir. ⓘ
dinle); DNA), bilinen tüm organizmaların ve birçok virüsün gelişimi, işleyişi, büyümesi ve üremesi için genetik talimatlar taşıyan bir çift sarmal oluşturmak üzere birbiri etrafında sarılan iki polinükleotid zincirinden oluşan bir polimerdir. DNA ve ribonükleik asit (RNA) nükleik asitlerdir. Proteinler, lipidler ve kompleks karbonhidratlar (polisakkaritler) ile birlikte nükleik asitler, bilinen tüm yaşam formları için gerekli olan dört ana makromolekül türünden biridir. ⓘ
İki DNA ipliği, nükleotid adı verilen daha basit monomerik birimlerden oluştuğu için polinükleotid olarak bilinir. Her nükleotid dört azot içeren nükleobazdan (sitozin [C], guanin [G], adenin [A] veya timin [T]) biri, deoksiriboz adı verilen bir şeker ve bir fosfat grubundan oluşur. Nükleotidler, bir nükleotidin şekeri ile diğerinin fosfatı arasındaki kovalent bağlarla (fosfo-diester bağı olarak bilinir) bir zincir halinde birbirine bağlanır ve bu da dönüşümlü bir şeker-fosfat omurgası ile sonuçlanır. İki ayrı polinükleotid ipliğinin azotlu bazları, baz eşleştirme kurallarına göre (A ile T ve C ile G) hidrojen bağlarıyla birbirine bağlanarak çift iplikli DNA'yı oluşturur. Tamamlayıcı azotlu bazlar pirimidinler ve pürinler olmak üzere iki gruba ayrılır. DNA'da pirimidinler timin ve sitozindir; pürinler ise adenin ve guanindir. ⓘ
Çift sarmallı DNA'nın her iki ipliği de aynı biyolojik bilgiyi depolar. Bu bilgi, iki iplik ayrıldığında kopyalanır. DNA'nın büyük bir kısmı (insanlar için %98'den fazlası) kodlama yapmaz, yani bu bölümler protein dizileri için kalıp görevi görmez. DNA'nın iki ipliği birbirine zıt yönlerde ilerler ve bu nedenle antiparaleldir. Her bir şekere dört tip nükleobazdan (ya da bazdan) biri bağlanır. Genetik bilgiyi kodlayan, omurga boyunca uzanan bu dört nükleobazın dizilimidir. RNA iplikleri, transkripsiyon adı verilen bir süreçte şablon olarak DNA iplikleri kullanılarak oluşturulur; burada DNA bazları, RNA'nın urasil (U) yerine kullandığı timin (T) hariç, karşılık gelen bazlarla değiştirilir. Genetik kod altında, bu RNA iplikleri, çeviri adı verilen bir süreçte proteinler içindeki amino asitlerin sırasını belirler. ⓘ
Ökaryotik hücrelerde DNA, kromozom adı verilen uzun yapılar halinde organize edilir. Tipik hücre bölünmesinden önce, bu kromozomlar DNA replikasyonu sürecinde çoğaltılır ve her yavru hücre için eksiksiz bir kromozom seti sağlar. Ökaryotik organizmalar (hayvanlar, bitkiler, mantarlar ve protistler) DNA'larının çoğunu hücre çekirdeğinde nükleer DNA olarak, bir kısmını da mitokondride mitokondriyal DNA olarak veya kloroplastlarda kloroplast DNA'sı olarak depolar. Buna karşılık prokaryotlar (bakteriler ve arkeler) DNA'larını yalnızca sitoplazmada, dairesel kromozomlarda depolar. Ökaryotik kromozomlar içinde, histonlar gibi kromatin proteinleri DNA'yı sıkıştırır ve düzenler. Bu sıkıştırıcı yapılar DNA ve diğer proteinler arasındaki etkileşimleri yönlendirerek DNA'nın hangi kısımlarının kopyalanacağını kontrol etmeye yardımcı olur. ⓘ
Özellikler

DNA, nükleotid adı verilen ve her biri genellikle tek bir harfle sembolize edilen tekrar eden birimlerden oluşan uzun bir polimerdir: A, T, C veya G. DNA'nın yapısı uzunluğu boyunca dinamiktir, sıkı ilmekler ve diğer şekillerde kıvrılabilir. Tüm türlerde birbirlerine hidrojen bağlarıyla bağlı iki sarmal zincirden oluşur. Her iki zincir de aynı eksen etrafında sarılır ve 34 ångström (3,4 nm) ile aynı aralığa sahiptir. Zincir çifti 10 Å (1,0 nm) yarıçapa sahiptir. Başka bir çalışmaya göre, farklı bir çözelti içinde ölçüldüğünde, DNA zinciri 22-26 Å (2,2-2,6 nm) genişliğinde ve bir nükleotid birimi 3,3 Å (0,33 nm) uzunluğunda ölçülmüştür. Her bir nükleotid çok küçük olmasına rağmen, bir DNA polimeri çok uzun olabilir ve kromozom 1'de olduğu gibi yüz milyonlarca nükleotid içerebilir. Kromozom 1 yaklaşık 220 milyon baz çifti ile en büyük insan kromozomudur ve düzleştirildiğinde 85 mm uzunluğunda olacaktır. ⓘ
DNA genellikle tek bir iplikçik olarak değil, bunun yerine sıkıca bir arada tutulan bir çift iplikçik olarak bulunur. Bu iki uzun iplikçik birbirinin etrafında çift sarmal şeklinde sarılır. Nükleotid, hem molekülün omurgasının bir parçasını (zinciri bir arada tutan) hem de bir nükleobazı (sarmaldaki diğer DNA ipliği ile etkileşime giren) içerir. Bir şekere bağlı bir nükleobaza nükleozit, bir şekere ve bir veya daha fazla fosfat grubuna bağlı bir baza ise nükleotit denir. Birden fazla bağlı nükleotid içeren bir biyopolimer (DNA'da olduğu gibi) polinükleotid olarak adlandırılır. ⓘ
DNA sarmalının omurgası değişen fosfat ve şeker gruplarından oluşur. DNA'daki şeker, pentoz (beş karbonlu) bir şeker olan 2-deoksiribozdur. Şekerler, bitişik şeker halkalarının üçüncü ve beşinci karbon atomları arasında fosfodiester bağları oluşturan fosfat grupları ile birleştirilir. Bunlar 3′-uç (üç asal uç) ve 5′-uç (beş asal uç) karbonlar olarak bilinir; asal sembolü bu karbon atomlarını deoksiribozun glikozidik bir bağ oluşturduğu bazınkilerden ayırmak için kullanılır. Bu nedenle, herhangi bir DNA ipliğinin normalde bir ucunda ribozun 5′ karbonuna bağlı bir fosfat grubu (5′ fosforil), diğer ucunda ise ribozun 3′ karbonuna bağlı serbest bir hidroksil grubu (3′ hidroksil) bulunur. Şeker-fosfat omurgası boyunca 3′ ve 5′ karbonlarının yönelimi, her DNA ipliğine yönlülük (bazen polarite olarak adlandırılır) kazandırır. Bir nükleik asit çift sarmalında, bir sarmaldaki nükleotidlerin yönü diğer sarmaldaki yönlerinin tersidir: sarmallar antiparaleldir. DNA ipliklerinin asimetrik uçlarının beş asal uç (5′ ) ve üç asal uç (3′) yönlülüğüne sahip olduğu, 5′ ucunun bir terminal fosfat grubuna ve 3′ ucunun bir terminal hidroksil grubuna sahip olduğu söylenir. DNA ve RNA arasındaki önemli bir fark şekerdir; DNA'daki 2-deoksiribozun yerini RNA'da ilgili pentoz şekeri riboz alır. ⓘ
DNA çift sarmalı temel olarak iki kuvvet tarafından stabilize edilir: nükleotidler arasındaki hidrojen bağları ve aromatik nükleobazlar arasındaki baz istifleme etkileşimleri. DNA'da bulunan dört baz adenin (A), sitozin (C), guanin (G) ve timindir (T). Bu dört baz, adenozin monofosfat için gösterildiği gibi tam nükleotidi oluşturmak üzere şeker-fosfata bağlanır. Adenin timin ile, guanin ise sitozin ile eşleşerek A-T ve G-C baz çiftlerini oluşturur. ⓘ
Bazlar iki tip olarak sınıflandırılırlar: adenin ve guanin, pürin türevleridir, bunlar beş ve altı üyeli halkaların kaynaşmasından oluşmuş heterosiklik bileşiklerdir; sitozin ve timin ise pirimidin türevleridir, bunlar altı üyeli bir halkadan oluşur. Bir diğer baz olan urasil (U), sitozinin yıkımı sonucu seyrek olarak DNA'da bulunabilir. Kimyasal olarak DNA'ya benzeyen RNA'da timin yerine urasil bulunur. ⓘ
Nükleobaz sınıflandırması
Nükleobazlar iki tipte sınıflandırılır: kaynaşmış beş ve altı üyeli heterosiklik bileşikler olan pürinler, A ve G ve altı üyeli halkalar olan pirimidinler, C ve T. Beşinci bir pirimidin nükleobazı olan urasil (U), genellikle RNA'da timin yerini alır ve halkasında bir metil grubu bulunmaması nedeniyle timin'den farklıdır. RNA ve DNA'ya ek olarak, nükleik asitlerin özelliklerini incelemek veya biyoteknolojide kullanmak için birçok yapay nükleik asit analoğu oluşturulmuştur. ⓘ
Kanonik olmayan bazlar
DNA'da modifiye bazlar meydana gelir. Bunlardan ilki 1925 yılında Mycobacterium tuberculosis genomunda bulunan 5-metilsitozindir. Bakteriyel virüslerde (bakteriyofajlar) bu kanonik olmayan bazların bulunmasının nedeni, bakterilerde bulunan kısıtlama enzimlerinden kaçınmaktır. Bu enzim sistemi, en azından kısmen, bakterileri virüslerin enfeksiyonundan koruyan moleküler bir bağışıklık sistemi olarak işlev görür. Daha yaygın ve modifiye DNA bazları olan sitozin ve adenin bazlarının modifikasyonları, bitki ve hayvanlarda gen ifadesinin epigenetik kontrolünde hayati rol oynar. ⓘ
DNA'da bulunan kanonik olmayan bazların listesi
DNA'da bir dizi kanonik olmayan bazın oluştuğu bilinmektedir. Bunların çoğu kanonik bazlar artı urasilin modifikasyonlarıdır. ⓘ
- Modifiye Adenozin
- N6-carbamoyl-methyladenine
- N6-methyadenine
- Modifiye Guanin
- 7-Deazaguanine
- 7-Metilguanin
- Modifiye Sitozin
- N4-Metilsitozin
- 5-Karboksilsitozin
- 5-Formilsitozin
- 5-Glikozilhidroksimetilsitozin
- 5-Hidroksisitozin
- 5-Metilsitozin
- Modifiye Timidin
- α-Glutamitimidin
- α-Putrescinylthymine
- Urasil ve modifikasyonlar
- Baz J
- Urasil
- 5-Dihidroksipentaurasil
- 5-Hidroksimetildeoksiürasil
- Diğerleri
- Deoxyarchaeosine
- 2,6-Diaminopurine (2-Aminoadenine) ⓘ

Oluklar

İki sarmal iplik DNA omurgasını oluşturur. Bu iplikler arasındaki boşluklar takip edilerek iki tane hayali boşluk veya oyuk daha bulunabilir. Bu oyuklar baz çiftlerine bitişiktir ve onlara bağlanmak için bir yer oluşturabilirler. Bu oyuklar birbirlerinin tam karşısında olmadıkları için büyüklükleri aynı değildir. Bunlardan büyük oyuk (majör oyuk) olarak adlandırılanı 22 Å genişliğinde, küçük (minör) oyuk ise 12 Å genişliğindedir. Küçük oyuğun darlığı nedeniyle bazların kenarlarına erişmek büyük oyuktan daha kolaydır. Bu nedenle, DNA'daki belli baz dizilerine bağlanan, transkripsiyon faktörü gibi proteinler büyük oyuktan bazların kenarlarına temas ederler. Hücredeki DNA'nın bazı bölgelerinde bu durum farklı olabilir (aşağıda "Alternatif çifte sarmal yapılar" bölümüne bakınız) ama oralarda dahi, eğer DNA normal B biçimini alacak şekilde burulsaydı görülecek büyüklük farklılıklarına göre adlandırılır. ⓘ
Baz eşleşmesi
Bir DNA çift sarmalında, bir iplikçikteki her nükleobaz türü diğer iplikçikteki sadece bir nükleobaz türü ile bağlanır. Buna tamamlayıcı baz eşleşmesi denir. Pürinler pirimidinlerle hidrojen bağları oluşturur; adenin sadece timinle iki hidrojen bağı kurar ve sitozin sadece guaninle üç hidrojen bağı kurar. Çift sarmal boyunca birbirine bağlanan iki nükleotidin bu düzenlemesine (altı karbonlu halkadan altı karbonlu halkaya) Watson-Crick baz çifti denir. Yüksek GC içeriğine sahip DNA, düşük GC içeriğine sahip DNA'dan daha kararlıdır. Hoogsteen baz çifti (6 karbonlu halkanın 5 karbonlu halkaya hidrojenle bağlanması) baz eşleşmesinin nadir bir varyasyonudur. Hidrojen bağları kovalent olmadığından, nispeten kolay bir şekilde kırılabilir ve yeniden birleştirilebilirler. Böylece, bir çift sarmaldaki iki DNA ipliği, mekanik bir güçle ya da yüksek sıcaklıkla bir fermuar gibi birbirinden ayrılabilir. Bu baz çifti tamamlayıcılığının bir sonucu olarak, bir DNA sarmalının çift sarmal dizisindeki tüm bilgiler, DNA replikasyonunda hayati önem taşıyan her bir iplikçikte çoğaltılır. Tamamlayıcı baz çiftleri arasındaki bu tersine çevrilebilir ve spesifik etkileşim, organizmalarda DNA'nın tüm işlevleri için kritik öneme sahiptir.

|

|
ssDNA vs. dsDNA
Yukarıda belirtildiği gibi, çoğu DNA molekülü aslında kovalent olmayan bağlarla sarmal bir şekilde birbirine bağlanmış iki polimer iplikten oluşur; bu çift iplikli (dsDNA) yapı büyük ölçüde G,C yığınları için en güçlü olan hortum içi baz istifleme etkileşimleri ile korunur. İki iplikçik, erime olarak bilinen bir süreçle birbirinden ayrılarak iki tek iplikli DNA (ssDNA) molekülü oluşturabilir. Erime yüksek sıcaklık, düşük tuz ve yüksek pH'da gerçekleşir (düşük pH da DNA'yı eritir, ancak DNA asit depürinasyonu nedeniyle kararsız olduğundan, düşük pH nadiren kullanılır). ⓘ
dsDNA formunun kararlılığı sadece GC içeriğine (% G,C baz çifti) değil aynı zamanda dizilime (istifleme dizilime özgü olduğundan) ve uzunluğa (daha uzun moleküller daha kararlıdır) da bağlıdır. Stabilite çeşitli yollarla ölçülebilir; yaygın bir yol, çift sarmal moleküllerin %50'sinin tek sarmal moleküllere dönüştüğü sıcaklık olan erime sıcaklığıdır (Tm değeri olarak da adlandırılır); erime sıcaklığı iyonik güce ve DNA konsantrasyonuna bağlıdır. Sonuç olarak, DNA'nın iki ipliği arasındaki ilişkinin gücünü belirleyen hem GC baz çiftlerinin yüzdesi hem de bir DNA çift sarmalının toplam uzunluğudur. Yüksek GC içeriğine sahip uzun DNA sarmalları daha güçlü etkileşen iplikçiklere sahipken, yüksek AT içeriğine sahip kısa sarmallar daha zayıf etkileşen iplikçiklere sahiptir. Biyolojide, bazı promotörlerdeki TATAAT Pribnow kutusu gibi DNA çift sarmalının kolayca ayrılması gereken kısımları, yüksek AT içeriğine sahip olma eğilimindedir, bu da ipliklerin ayrılmasını kolaylaştırır. ⓘ
Laboratuvarda bu etkileşimin gücü, hidrojen bağlarının yarısını kırmak için gerekli olan erime sıcaklığı Tm bulunarak ölçülebilir. Bir DNA çift sarmalındaki tüm baz çiftleri eridiğinde, iplikler ayrılır ve çözeltide tamamen bağımsız iki molekül olarak bulunur. Bu tek sarmallı DNA moleküllerinin tek bir ortak şekli yoktur, ancak bazı konformasyonlar diğerlerinden daha kararlıdır. ⓘ
Sense ve antisense
Bir DNA dizisi, proteine çevrilen bir mesajcı RNA kopyasınınkiyle aynıysa "duyu" dizisi olarak adlandırılır. Karşı sarmaldaki diziye ise "antisense" dizisi denir. Hem duyu hem de antisens dizileri aynı DNA ipliğinin farklı kısımlarında bulunabilir (yani her iki iplik hem duyu hem de antisens dizileri içerebilir). Hem prokaryotlarda hem de ökaryotlarda antisens RNA dizileri üretilir, ancak bu RNA'ların işlevleri tam olarak açık değildir. Bir öneri, antisens RNA'ların RNA-RNA baz eşleşmesi yoluyla gen ifadesinin düzenlenmesinde rol oynadığıdır. ⓘ
Prokaryotlar ve ökaryotlardaki birkaç DNA dizisi ve daha fazlası plazmidler ve virüslerde, üst üste binen genlere sahip olarak duyu ve antisens iplikleri arasındaki ayrımı bulanıklaştırır. Bu durumlarda, bazı DNA dizileri çift görev yaparak bir iplik boyunca okunduğunda bir proteini, diğer iplik boyunca ters yönde okunduğunda ise ikinci bir proteini kodlar. Bakterilerde bu örtüşme gen transkripsiyonunun düzenlenmesinde rol oynayabilirken, virüslerde örtüşen genler küçük viral genom içinde kodlanabilecek bilgi miktarını artırır. ⓘ
Üst üste binme
Süper burulma (İngilizce supercoiling) tabir edilen bir süreç ile DNA bir halat gibi burulabilir. "Gevşek" hâlinde DNA'daki bir iplik, her 10,4 baz çiftinde bir, çift sarmalın ekseni etrafında bir tam dönüş yapar. Ama, eğer DNA burulursa iplikler daha sıkı veya daha gevşek sarılı olabilir. Eğer DNA sarmalı sarılma yönünde burulursa buna pozitif süper burulma denir ve bazlar birbirlerine daha sıkı şekilde tutunurlar. Eğer DNA ters yönde burulursa, buna negatif süperburulma denir ve bazlar birbirlerinden daha kolay ayrışırlar. Doğadaki çoğu DNA molekülü az derecede negatif süper burguludur, bundan topoizomeraz adlı enzimler sorumludur. Bu enzimlerin bir işlevi transkripsiyon ve DNA ikileşmesi gibi süreçler sırasında DNA ipliklerine etki eden burulmayı bertaraf etmektir. ⓘ

Alternatif DNA yapıları
DNA, A-DNA, B-DNA ve Z-DNA formlarını içeren birçok olası konformasyonda bulunur, ancak işlevsel organizmalarda yalnızca B-DNA ve Z-DNA doğrudan gözlemlenmiştir. DNA'nın benimsediği konformasyon hidrasyon seviyesine, DNA dizisine, üst üste sarma miktarına ve yönüne, bazların kimyasal modifikasyonlarına, metal iyonlarının türüne ve konsantrasyonuna ve çözeltideki poliaminlerin varlığına bağlıdır. ⓘ
A-DNA X-ışını kırınım desenlerinin ve ayrıca B-DNA'nın ilk yayınlanan raporlarında, DNA'nın yönlendirilmiş lifleri için yalnızca sınırlı miktarda yapısal bilgi sağlayan Patterson işlevlerine dayalı analizler kullanılmıştır. Alternatif bir analiz 1953 yılında Wilkins ve arkadaşları tarafından yüksek oranda hidratlanmış DNA liflerinin in vivo B-DNA X-ışını kırınım-saçılma desenleri için Bessel fonksiyonlarının kareleri cinsinden önerilmiştir. Aynı dergide James Watson ve Francis Crick, DNA X-ışını kırınım desenlerinin moleküler modelleme analizini sunarak yapının bir çift sarmal olduğunu öne sürmüşlerdir. ⓘ
B-DNA formu, hücrelerde bulunan koşullar altında en yaygın olanı olmasına rağmen, iyi tanımlanmış bir konformasyon değil, hücrelerde bulunan yüksek hidrasyon seviyelerinde meydana gelen ilgili DNA konformasyonları ailesidir. Bunlara karşılık gelen X-ışını kırınımı ve saçılma modelleri, önemli derecede düzensizliğe sahip moleküler parakristallerin karakteristiğidir. ⓘ
B-DNA ile karşılaştırıldığında, A-DNA formu sığ, geniş bir küçük oluk ve daha dar, daha derin bir büyük oluk ile daha geniş bir sağ-elli spiraldir. A formu, fizyolojik olmayan koşullar altında kısmen kurutulmuş DNA örneklerinde ortaya çıkarken, hücre içinde DNA ve RNA ipliklerinin hibrit eşleşmelerinde ve enzim-DNA komplekslerinde üretilebilir. Bazların metilasyonla kimyasal olarak değiştirildiği DNA segmentleri, konformasyonda daha büyük bir değişikliğe uğrayabilir ve Z formunu benimseyebilir. Burada iplikler, daha yaygın olan B formunun tersine, sol elli bir spiral şeklinde sarmal eksen etrafında döner. Bu olağandışı yapılar spesifik Z-DNA bağlayıcı proteinler tarafından tanınabilir ve transkripsiyonun düzenlenmesinde rol oynayabilir. ⓘ
Alternatif DNA kimyası
Ekzobiyologlar uzun yıllar boyunca bir gölge biyosferin, yani Dünya'da şu anda bilinen yaşamdan radikal biçimde farklı biyokimyasal ve moleküler süreçler kullanan mikrobiyal bir biyosferin varlığını öne sürmüşlerdir. Bu önerilerden biri de DNA'da fosfor yerine arsenik kullanan yaşam formlarının varlığıydı. Araştırma tartışmalı olsa da 2010 yılında GFAJ-1 bakterisinde bu olasılığa dair bir rapor açıklandı ve kanıtlar bakterinin arseniğin DNA omurgasına ve diğer biyomoleküllere dahil edilmesini aktif olarak engellediğini gösteriyor. ⓘ
Kuadrupleks yapılar
Doğrusal kromozomların uçlarında telomer adı verilen özelleşmiş DNA bölgeleri bulunur. Bu bölgelerin ana işlevi, normalde DNA'yı kopyalayan enzimler kromozomların aşırı 3′ uçlarını kopyalayamadığından, hücrenin telomeraz enzimini kullanarak kromozom uçlarını kopyalamasına izin vermektir. Bu özel kromozom başlıkları aynı zamanda DNA uçlarının korunmasına yardımcı olur ve hücredeki DNA onarım sistemlerinin bunları düzeltilmesi gereken hasarlar olarak görmesini engeller. İnsan hücrelerinde telomerler genellikle basit bir TTAGGG dizisinin birkaç bin tekrarını içeren tek sarmallı DNA uzunluklarıdır. ⓘ

Bu guanin bakımından zengin diziler, diğer DNA moleküllerinde bulunan olağan baz çiftleri yerine, dört bazlı birimlerin istiflenmiş setlerinden oluşan yapılar oluşturarak kromozom uçlarını stabilize edebilir. Burada, guanin tetrad olarak bilinen dört guanin bazı düz bir plaka oluşturur. Bu düz dört bazlı birimler daha sonra birbirlerinin üzerine yığılarak kararlı bir G-dörtlü yapı oluşturur. Bu yapılar, bazların kenarları arasındaki hidrojen bağı ve her dört bazlı birimin merkezindeki bir metal iyonunun şelasyonu ile stabilize edilir. Bazların etrafında katlanmış tek bir iplikçikten veya her biri merkezi yapıya bir baz katkıda bulunan birkaç farklı paralel iplikçikten gelen merkezi dört baz seti ile başka yapılar da oluşturulabilir. ⓘ
Bu yığılmış yapılara ek olarak, telomerler ayrıca telomer döngüleri veya T döngüleri adı verilen büyük döngü yapıları oluşturur. Burada tek sarmallı DNA, telomer bağlayıcı proteinler tarafından stabilize edilen uzun bir daire şeklinde kıvrılır. T döngüsünün en sonunda, tek sarmallı telomer DNA, telomer sarmalı tarafından çift sarmallı DNA'nın bir bölgesine tutulur ve çift sarmallı DNA'yı bozarak iki sarmaldan birine baz eşleşmesi yapar. Bu üç sarmallı yapıya yer değiştirme döngüsü veya D döngüsü denir. ⓘ
|
|
| Tek dal | Birden fazla şube |
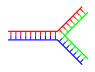
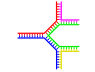
Dallanmış DNA
DNA'da yıpranma, tamamlayıcı bir çift DNA sarmalının sonunda tamamlayıcı olmayan bölgeler bulunduğunda meydana gelir. Bununla birlikte, üçüncü bir DNA ipliği eklenirse ve önceden var olan çift ipliğin yıpranmış bölgeleriyle hibridize olabilen bitişik bölgeler içeriyorsa dallanmış DNA oluşabilir. Dallanmış DNA'nın en basit örneği sadece üç DNA ipliği içerse de, ilave iplikler ve çoklu dallar içeren kompleksler de mümkündür. Dallanmış DNA nanoteknolojide geometrik şekiller oluşturmak için kullanılabilir, aşağıdaki teknolojide kullanım bölümüne bakınız. ⓘ
Yapay bazlar
Birkaç yapay nükleobaz sentezlenmiş ve Hachimoji DNA adı verilen sekiz bazlı DNA analoğuna başarıyla dahil edilmiştir. S, B, P ve Z olarak adlandırılan bu yapay bazlar birbirleriyle öngörülebilir bir şekilde bağ kurabiliyor (S-B ve P-Z), DNA'nın çift sarmal yapısını koruyabiliyor ve RNA'ya kopyalanabiliyor. Bunların varlığı, Dünya'da evrimleşen dört doğal nükleobaz hakkında özel bir şey olmadığının bir göstergesi olarak görülebilir. Öte yandan DNA, sadece DNA'nın transkripti olarak hareket etmeyen, aynı zamanda hücrelerdeki birçok görevi moleküler makineler olarak yerine getiren RNA ile sıkı bir ilişki içindedir. Bu amaçla bir yapıya katlanmak zorundadır. Tüm olası yapıların oluşturulabilmesi için ilgili RNA için en az dört bazın gerekli olduğu gösterilmiştir, daha yüksek bir sayı da mümkündür ancak bu doğal en az çaba ilkesine aykırı olacaktır. ⓘ
Asitlik
DNA'nın fosfat grupları ona fosforik aside benzer asidik özellikler verir ve güçlü bir asit olarak kabul edilebilir. Normal bir hücresel pH'da tamamen iyonize olur ve fosfat grupları üzerinde negatif yükler bırakan protonları serbest bırakır. Bu negatif yükler DNA'yı hidrolize edebilecek nükleofilleri iterek DNA'yı hidroliz yoluyla parçalanmaktan korur. ⓘ
Makroskopik görünüm

Hücrelerden çıkarılan saf DNA beyaz, lifli kümeler oluşturur. ⓘ
Kimyasal modifikasyonlar ve değiştirilmiş DNA paketlemesi

|

|

|
| sitozin | 5-metilsitozin | timin |
Baz modifikasyonları ve DNA paketlenmesi
Genlerin ifadesi, DNA'nın kromozomlarda, kromatin adı verilen bir yapıda nasıl paketlendiğinden etkilenir. Baz modifikasyonları paketlemeye dahil olabilir, gen ifadesinin düşük olduğu veya hiç olmadığı bölgeler genellikle sitozin bazlarının yüksek düzeyde metilasyonunu içerir. DNA paketlenmesi ve bunun gen ifadesi üzerindeki etkisi, DNA'nın kromatin yapısında etrafına sarıldığı histon protein çekirdeğinin kovalent modifikasyonları veya kromatin yeniden şekillendirme kompleksleri tarafından gerçekleştirilen yeniden şekillendirme yoluyla da meydana gelebilir (bkz. Kromatin yeniden şekillendirme). Ayrıca, DNA metilasyonu ve histon modifikasyonu arasında çapraz konuşma vardır, böylece kromatin ve gen ifadesini koordineli olarak etkileyebilirler. ⓘ
Bir örnek olarak, sitozin metilasyonu kromozomların X-inaktivasyonu için önemli olan 5-metilsitozin üretir. Ortalama metilasyon seviyesi organizmalar arasında farklılık gösterir - Caenorhabditis elegans solucanında sitozin metilasyonu bulunmazken, omurgalılar daha yüksek seviyelere sahiptir ve DNA'larının %1'i 5-metilsitozin içerir. 5-metilsitozinin önemine rağmen, bir timin bazı bırakmak için deamine olabilir, bu nedenle metillenmiş sitozinler özellikle mutasyonlara eğilimlidir. Diğer baz modifikasyonları arasında bakterilerde adenin metilasyonu, beyinde 5-hidroksimetilsitozin varlığı ve kinetoplastidlerde "J-baz" üretmek için urasilin glikozilasyonu yer alır. ⓘ
Hasar

DNA, DNA dizilimini değiştiren birçok mutajen türü tarafından zarar görebilir. Mutajenler arasında oksitleyici ajanlar, alkilleyici ajanlar ve ayrıca ultraviyole ışık ve X ışınları gibi yüksek enerjili elektromanyetik radyasyon bulunur. Üretilen DNA hasarının türü mutajenin türüne bağlıdır. Örneğin, UV ışığı pirimidin bazları arasında çapraz bağlar olan timin dimerleri üreterek DNA'ya zarar verebilir. Öte yandan, serbest radikaller veya hidrojen peroksit gibi oksidanlar, özellikle guanozin baz modifikasyonları ve çift iplikçik kırılmaları dahil olmak üzere çoklu hasar biçimleri üretir. Tipik bir insan hücresi oksidatif hasara uğramış yaklaşık 150.000 baz içerir. Bu oksidatif lezyonlar arasında en tehlikelileri çift sarmal kırılmalarıdır, çünkü bunların onarılması zordur ve nokta mutasyonları, eklemeler, DNA dizisinden silmeler ve kromozomal translokasyonlar üretebilir. Bu mutasyonlar kansere neden olabilir. DNA onarım mekanizmalarındaki doğal sınırlar nedeniyle, eğer insanlar yeterince uzun yaşasaydı, sonunda hepsi kanser geliştirirdi. Reaktif oksijen türleri üreten normal hücresel süreçler, hücresel suyun hidrolitik faaliyetleri vb. nedeniyle doğal olarak oluşan DNA hasarları da sıklıkla meydana gelir. Bu hasarların çoğu onarılsa da, herhangi bir hücrede onarım süreçlerinin etkisine rağmen bazı DNA hasarları kalabilir. Bu kalan DNA hasarları memeli postmitotik dokularında yaşla birlikte birikir. Bu birikim, yaşlanmanın altında yatan önemli bir neden olarak görünmektedir. ⓘ
Birçok mutajen iki komşu baz çifti arasındaki boşluğa yerleşir, buna interkalasyon denir. İnterkalatörlerin çoğu aromatik ve düzlemsel moleküllerdir; örnekler arasında etidyum bromür, akridinler, daunomisin ve doksorubisin bulunur. Bir interkalatörün baz çiftleri arasına sığması için bazların ayrılması ve çift sarmalın çözülmesiyle DNA ipliklerinin bozulması gerekir. Bu durum hem transkripsiyonu hem de DNA replikasyonunu engelleyerek toksisiteye ve mutasyonlara neden olur. Sonuç olarak, DNA interkalatörleri kanserojen olabilir ve talidomid durumunda bir teratojen olabilir. Benzo[a]piren diol epoksit ve aflatoksin gibi diğerleri, replikasyonda hatalara neden olan DNA eklentileri oluşturur. Bununla birlikte, DNA transkripsiyonunu ve replikasyonunu inhibe etme yetenekleri nedeniyle, diğer benzer toksinler de hızla büyüyen kanser hücrelerini inhibe etmek için kemoterapide kullanılır. ⓘ
Biyolojik işlevler

DNA genellikle ökaryotlarda doğrusal kromozomlar, prokaryotlarda ise dairesel kromozomlar şeklinde bulunur. Bir hücredeki kromozom seti o hücrenin genomunu oluşturur; insan genomu 46 kromozom halinde düzenlenmiş yaklaşık 3 milyar baz çifti DNA'ya sahiptir. DNA tarafından taşınan bilgi, gen adı verilen DNA parçaları dizisinde tutulur. Genlerdeki genetik bilginin aktarımı tamamlayıcı baz eşleşmesi yoluyla sağlanır. Örneğin, transkripsiyonda, bir hücre bir gendeki bilgiyi kullandığında, DNA dizisi, DNA ve doğru RNA nükleotidleri arasındaki çekim yoluyla tamamlayıcı bir RNA dizisine kopyalanır. Genellikle, bu RNA kopyası daha sonra RNA nükleotidleri arasındaki aynı etkileşime bağlı olan çeviri adı verilen bir süreçte eşleşen bir protein dizisi yapmak için kullanılır. Alternatif olarak, bir hücre DNA replikasyonu adı verilen bir süreçte genetik bilgisini basitçe kopyalayabilir. Bu işlevlerin ayrıntıları başka makalelerde ele alınmaktadır; burada odak noktası DNA ile genomun işlevine aracılık eden diğer moleküller arasındaki etkileşimlerdir. ⓘ
Genler ve genomlar
Genomik DNA, DNA yoğunlaşması adı verilen süreçte, hücrenin mevcut küçük hacimlerine sığacak şekilde sıkı ve düzenli bir şekilde paketlenir. Ökaryotlarda DNA, mitokondri ve kloroplastlarda az miktarda olmak üzere hücre çekirdeğinde bulunur. Prokaryotlarda DNA, sitoplazmada nükleoid adı verilen düzensiz şekilli bir cisim içinde tutulur. Bir genomdaki genetik bilgi genler içinde tutulur ve bir organizmadaki bu bilginin tamamına genotip denir. Bir gen, kalıtımın bir birimidir ve bir organizmada belirli bir özelliği etkileyen bir DNA bölgesidir. Genler, transkribe edilebilen bir açık okuma çerçevesi ve açık okuma çerçevesinin transkripsiyonunu kontrol eden promotörler ve güçlendiriciler gibi düzenleyici diziler içerir. ⓘ
Birçok türde, genomun toplam dizisinin yalnızca küçük bir kısmı protein kodlar. Örneğin, insan genomunun sadece yaklaşık %1,5'i protein kodlayan ekzonlardan oluşurken, insan DNA'sının %50'sinden fazlası kodlamayan tekrarlayan dizilerden oluşur. Ökaryotik genomlarda bu kadar çok kodlamayan DNA bulunmasının nedenleri ve türler arasında genom boyutu veya C-değerindeki olağanüstü farklılıklar, "C-değeri muamması" olarak bilinen uzun süredir devam eden bir bulmacayı temsil etmektedir. Bununla birlikte, protein kodlamayan bazı DNA dizileri, gen ifadesinin düzenlenmesinde rol oynayan işlevsel kodlamayan RNA moleküllerini kodlayabilir. ⓘ

Bazı kodlamayan DNA dizileri kromozomlarda yapısal roller oynar. Telomerler ve sentromerler tipik olarak az sayıda gen içerir ancak kromozomların işlevi ve stabilitesi için önemlidir. İnsanlarda bol miktarda bulunan kodlamayan DNA formu, mutasyonla devre dışı bırakılmış genlerin kopyaları olan psödogenlerdir. Bu diziler genellikle sadece moleküler fosillerdir, ancak zaman zaman gen çoğalması ve farklılaşması süreci yoluyla yeni genlerin oluşturulması için ham genetik materyal olarak hizmet edebilirler. ⓘ
Transkripsiyon ve çeviri
Bir gen, genetik bilgi içeren ve bir organizmanın fenotipini etkileyebilen bir DNA dizisidir. Bir gen içinde, bir DNA ipliği boyunca bazların dizilişi bir mesajcı RNA dizisini tanımlar, bu da daha sonra bir veya daha fazla protein dizisini tanımlar. Genlerin nükleotid dizileri ile proteinlerin amino-asit dizileri arasındaki ilişki, topluca genetik kod olarak bilinen çeviri kuralları tarafından belirlenir. Genetik kod, üç nükleotid dizisinden (örneğin ACT, CAG, TTT) oluşan kodon adı verilen üç harfli 'kelimelerden' oluşur. ⓘ
Transkripsiyonda, bir genin kodonları RNA polimeraz tarafından mesajcı RNA'ya kopyalanır. Bu RNA kopyası daha sonra, haberci RNA'yı amino asitleri taşıyan transfer RNA'ya baz eşleştirmesi yaparak RNA dizisini okuyan bir ribozom tarafından çözülür. 3 harfli kombinasyonlarda 4 baz olduğundan, 64 olası kodon (43 kombinasyon) vardır. Bunlar yirmi standart amino asidi kodlar ve çoğu amino aside birden fazla olası kodon verir. Ayrıca kodlama bölgesinin sonunu gösteren üç 'stop' veya 'nonsense' kodonu vardır; bunlar TAG, TAA ve TGA kodonlarıdır (mRNA üzerinde UAG, UAA ve UGA). ⓘ

Replikasyon
Hücre bölünmesi bir organizmanın büyümesi için gereklidir, ancak bir hücre bölündüğünde, genomundaki DNA'yı kopyalaması gerekir, böylece iki yavru hücre ebeveynleriyle aynı genetik bilgiye sahip olur. DNA'nın çift sarmallı yapısı, DNA replikasyonu için basit bir mekanizma sağlar. Burada iki iplik ayrılır ve ardından her bir ipliğin tamamlayıcı DNA dizisi DNA polimeraz adı verilen bir enzim tarafından yeniden oluşturulur. Bu enzim, tamamlayıcı baz eşleşmesi yoluyla doğru bazı bularak ve onu orijinal iplikçiğe bağlayarak tamamlayıcı iplikçiği oluşturur. DNA polimerazlar bir DNA sarmalını yalnızca 5′ ila 3′ yönünde uzatabildiğinden, çift sarmalın antiparalel sarmallarını kopyalamak için farklı mekanizmalar kullanılır. Bu şekilde, eski iplikçikteki baz yeni iplikçikte hangi bazın görüneceğini belirler ve hücre DNA'sının mükemmel bir kopyasını elde eder. ⓘ
Hücre dışı nükleik asitler
Çoğu hücre ölümüyle açığa çıkan çıplak hücre dışı DNA (eDNA) çevrede neredeyse her yerde bulunur. Topraktaki konsantrasyonu 2 μg/L kadar yüksek olabilir ve doğal su ortamlarındaki konsantrasyonu 88 μg/L kadar yüksek olabilir. eDNA için çeşitli olası işlevler önerilmiştir: yatay gen transferinde rol oynayabilir; besin sağlayabilir; ve iyonları veya antibiyotikleri almak veya titre etmek için bir tampon görevi görebilir. Hücre dışı DNA, çeşitli bakteri türlerinin biyofilmlerinde işlevsel bir hücre dışı matris bileşeni olarak görev yapar. Biyofilmdeki belirli hücre tiplerinin bağlanmasını ve dağılmasını düzenlemek için bir tanıma faktörü olarak hareket edebilir; biyofilm oluşumuna katkıda bulunabilir; ve biyofilmin fiziksel gücüne ve biyolojik strese karşı direncine katkıda bulunabilir. ⓘ
Hücresiz fetal DNA annenin kanında bulunur ve gelişmekte olan fetüs hakkında çok sayıda bilgiyi belirlemek için sıralanabilir. ⓘ
Çevresel DNA adı altında eDNA, doğa bilimlerinde ekoloji için bir araştırma aracı olarak, türlerin sudaki, havadaki veya karadaki hareketlerini ve varlığını izlemek ve bir bölgenin biyolojik çeşitliliğini değerlendirmek için artan bir kullanım görmüştür. ⓘ
Nötrofil hücre dışı tuzakları
Nötrofil hücre dışı tuzakları (NET'ler), bir tür beyaz kan hücresi olan nötrofillerin konak hücrelere en az zarar verirken hücre dışı patojenleri öldürmesine olanak tanıyan, esas olarak DNA'dan oluşan hücre dışı lif ağlarıdır. ⓘ
Proteinlerle etkileşimler
DNA'nın tüm işlevleri onun proteinlerle olan etkileşimine bağlıdır. Bu protein etkileşimlerinin bazıları özgül-dışıdır (non-spesifiktir), bazılarında ise protein ancak belli bir DNA dizisine bağlanabilir. Enzimler de DNA'ya bağlanabilir ve bunlar arasında DNA baz disini transkripsiyon ve DNA ikilemesi için kopyalayan polimerazlar özellikle çok önemlidir. ⓘ
DNA bağlayıcı proteinler

DNA'yı bağlayan yapısal proteinler, spesifik olmayan DNA-protein etkileşimlerinin iyi anlaşılmış örnekleridir. Kromozomlar içinde DNA, yapısal proteinlerle kompleksler halinde tutulur. Bu proteinler DNA'yı kromatin adı verilen kompakt bir yapı halinde organize eder. Ökaryotlarda bu yapı, DNA'nın histon adı verilen küçük temel proteinlerden oluşan bir komplekse bağlanmasını içerirken, prokaryotlarda birden fazla protein türü söz konusudur. Histonlar, yüzeyinin etrafına sarılmış iki tam çift sarmallı DNA dönüşü içeren nükleozom adı verilen disk şeklinde bir kompleks oluşturur. Bu spesifik olmayan etkileşimler, DNA'nın asidik şeker-fosfat omurgasına iyonik bağlar yapan histonlardaki temel kalıntılar aracılığıyla oluşur ve bu nedenle baz dizisinden büyük ölçüde bağımsızdır. Bu temel amino asit kalıntılarının kimyasal modifikasyonları metilasyon, fosforilasyon ve asetilasyonu içerir. Bu kimyasal değişiklikler, DNA ile histonlar arasındaki etkileşimin gücünü değiştirerek DNA'yı transkripsiyon faktörleri için daha fazla veya daha az erişilebilir hale getirir ve transkripsiyon oranını değiştirir. Kromatindeki diğer spesifik olmayan DNA bağlayıcı proteinler, bükülmüş veya çarpıtılmış DNA'ya bağlanan yüksek hareketlilik grubu proteinlerini içerir. Bu proteinler nükleozom dizilerinin bükülmesinde ve kromozomları oluşturan daha büyük yapılar halinde düzenlenmesinde önemlidir. ⓘ
DNA bağlayıcı proteinlerin farklı bir grubu, özellikle tek sarmallı DNA'yı bağlayan DNA bağlayıcı proteinlerdir. İnsanlarda replikasyon proteini A, bu ailenin en iyi anlaşılan üyesidir ve DNA replikasyonu, rekombinasyon ve DNA onarımı dahil olmak üzere çift sarmalın ayrıldığı süreçlerde kullanılır. Bu bağlayıcı proteinlerin tek sarmallı DNA'yı stabilize ettiği ve kök döngüler oluşturmasını veya nükleazlar tarafından parçalanmasını önlediği görülmektedir. ⓘ

Buna karşılık, diğer proteinler belirli DNA dizilerine bağlanmak üzere evrimleşmiştir. Bunlar arasında en yoğun olarak incelenenler, transkripsiyonu düzenleyen proteinler olan çeşitli transkripsiyon faktörleridir. Her bir transkripsiyon faktörü belirli bir DNA dizisine bağlanır ve bu dizilerin promotörlerine yakın olduğu genlerin transkripsiyonunu etkinleştirir veya engeller. Transkripsiyon faktörleri bunu iki şekilde yapar. İlk olarak, transkripsiyondan sorumlu RNA polimerazı ya doğrudan ya da diğer aracı proteinler aracılığıyla bağlayabilirler; bu, polimerazı promotörde konumlandırır ve transkripsiyona başlamasına izin verir. Alternatif olarak, transkripsiyon faktörleri promotördeki histonları modifiye eden enzimleri bağlayabilir. Bu da DNA şablonunun polimeraza erişilebilirliğini değiştirir. ⓘ
Bu DNA hedefleri bir organizmanın genomu boyunca ortaya çıkabildiğinden, bir tür transkripsiyon faktörünün aktivitesindeki değişiklikler binlerce geni etkileyebilir. Sonuç olarak, bu proteinler genellikle çevresel değişikliklere veya hücresel farklılaşma ve gelişime verilen tepkileri kontrol eden sinyal iletim süreçlerinin hedefleridir. Bu transkripsiyon faktörlerinin DNA ile etkileşimlerinin özgüllüğü, proteinlerin DNA bazlarının kenarlarına birden fazla temas kurarak DNA dizisini "okumalarına" izin vermesinden kaynaklanır. Bu baz etkileşimlerinin çoğu, bazların en erişilebilir olduğu ana olukta gerçekleşir. ⓘ

DNA modifiye edici enzimler
Nükleazlar ve ligazlar
Nükleazlar, fosfodiester bağlarının hidrolizini katalize ederek DNA ipliklerini kesen enzimlerdir. DNA ipliklerinin uçlarındaki nükleotidleri hidrolize eden nükleazlar ekzonükleazlar olarak adlandırılırken, endonükleazlar ipliklerin içini keser. Moleküler biyolojide en sık kullanılan nükleazlar, DNA'yı belirli dizilerde kesen restriksiyon endonükleazlarıdır. Örneğin, solda gösterilen EcoRV enzimi 6 bazlı 5′-GATATC-3′ dizisini tanır ve yatay çizgide bir kesim yapar. Doğada bu enzimler, faj DNA'sını bakteri hücresine girdiğinde sindirerek, kısıtlama modifikasyon sisteminin bir parçası olarak hareket ederek bakterileri faj enfeksiyonuna karşı korur. Teknolojide, bu diziye özgü nükleazlar moleküler klonlama ve DNA parmak izinde kullanılır. ⓘ
DNA ligaz adı verilen enzimler kesilmiş veya kırılmış DNA ipliklerini yeniden birleştirebilir. Ligazlar, replikasyon çatalında üretilen kısa DNA segmentlerini DNA şablonunun tam bir kopyasına birleştirdiklerinden, geciken iplik DNA replikasyonunda özellikle önemlidir. Ayrıca DNA onarımında ve genetik rekombinasyonda da kullanılırlar. ⓘ
Topoizomerazlar ve helikazlar
Topoizomerazlar hem nükleaz hem de ligaz aktivitesine sahip enzimlerdir. Bu proteinler DNA'daki süper sarılma miktarını değiştirir. Bu enzimlerin bazıları DNA sarmalını keserek ve bir bölümün dönmesine izin vererek çalışır, böylece süper sarılma seviyesini azaltır; enzim daha sonra DNA kırılmasını kapatır. Bu enzimlerin diğer türleri bir DNA sarmalını kesebilir ve daha sonra sarmalı yeniden birleştirmeden önce ikinci bir DNA ipliğini bu kırılmadan geçirebilir. Topoizomerazlar, DNA replikasyonu ve transkripsiyon gibi DNA'yı içeren birçok işlem için gereklidir. ⓘ
Helikazlar bir tür moleküler motor olan proteinlerdir. Bazlar arasındaki hidrojen bağlarını kırmak ve DNA çift sarmalını tek iplikçiklere ayırmak için nükleozit trifosfatlardaki kimyasal enerjiyi, çoğunlukla adenozin trifosfatı (ATP) kullanırlar. Bu enzimler, enzimlerin DNA bazlarına erişmesi gereken çoğu işlem için gereklidir. ⓘ
Polimerazlar
Polimerazlar, nükleosid trifosfatlardan polinükleotid zincirleri sentezleyen enzimlerdir. Ürünlerinin dizilimi, şablon olarak adlandırılan mevcut polinükleotid zincirleri temel alınarak oluşturulur. Bu enzimler, büyüyen polinükleotid zincirinin sonundaki 3′ hidroksil grubuna tekrar tekrar bir nükleotid ekleyerek işlev görür. Sonuç olarak, tüm polimerazlar 5′ ila 3′ yönünde çalışır. Bu enzimlerin aktif bölgesinde, gelen nükleozit trifosfat şablonla baz çifti oluşturur: bu da polimerazların şablonlarının tamamlayıcı ipliğini doğru bir şekilde sentezlemesini sağlar. Polimerazlar kullandıkları şablon türüne göre sınıflandırılır. ⓘ
DNA replikasyonunda, DNA'ya bağımlı DNA polimerazlar DNA polinükleotid zincirlerinin kopyalarını oluşturur. Biyolojik bilgiyi korumak için, her bir kopyadaki baz dizisinin şablon iplikçikteki baz dizisine tam olarak tamamlayıcı olması esastır. Birçok DNA polimerazın bir düzeltme okuma aktivitesi vardır. Burada polimeraz, eşleşmeyen nükleotidler arasında baz eşleşmesi olmaması nedeniyle sentez reaksiyonunda zaman zaman meydana gelen hataları fark eder. Bir uyumsuzluk tespit edilirse, 3′ ila 5′ eksonükleaz aktivitesi aktive edilir ve yanlış baz çıkarılır. Çoğu organizmada DNA polimerazlar, DNA kıskacı veya helikazlar gibi çok sayıda aksesuar alt birim içeren replizom adı verilen büyük bir kompleks içinde işlev görür. ⓘ
RNA'ya bağımlı DNA polimerazlar, bir RNA ipliğinin dizisini DNA'ya kopyalayan özel bir polimeraz sınıfıdır. Bunlar arasında retrovirüsler tarafından hücrelerin enfeksiyonunda rol oynayan viral bir enzim olan ters transkriptaz ve telomerlerin replikasyonu için gerekli olan telomeraz bulunur. Örneğin, HIV ters transkriptaz, AIDS virüsünün replikasyonu için bir enzimdir. Telomeraz alışılmadık bir polimerazdır çünkü yapısının bir parçası olarak kendi RNA şablonunu içerir. Kromozomların uçlarındaki telomerleri sentezler. Telomerler komşu kromozomların uçlarının birleşmesini önler ve kromozom uçlarını hasardan korur. ⓘ
Transkripsiyon, bir DNA ipliğinin dizisini RNA'ya kopyalayan DNA'ya bağımlı bir RNA polimeraz tarafından gerçekleştirilir. Bir genin transkripsiyonuna başlamak için, RNA polimeraz promotör adı verilen bir DNA dizisine bağlanır ve DNA ipliklerini ayırır. Daha sonra gen dizisini, terminatör adı verilen bir DNA bölgesine ulaşana kadar bir mesajcı RNA transkriptine kopyalar, burada durur ve DNA'dan ayrılır. İnsan DNA'sına bağımlı DNA polimerazlarda olduğu gibi, insan genomundaki genlerin çoğunu kopyalayan enzim olan RNA polimeraz II, çoklu düzenleyici ve aksesuar alt birimlere sahip büyük bir protein kompleksinin parçası olarak çalışır. ⓘ
Genetik rekombinasyon
|

|

Bir DNA sarmalı genellikle DNA'nın diğer bölümleriyle etkileşime girmez ve insan hücrelerinde farklı kromozomlar çekirdekte "kromozom bölgeleri" adı verilen ayrı alanları işgal eder. Farklı kromozomların bu fiziksel ayrımı, DNA'nın bilgi için istikrarlı bir depo olarak işlev görebilmesi için önemlidir, çünkü kromozomların etkileşime girdiği birkaç zamandan biri, genetik rekombinasyon meydana geldiğinde cinsel üreme sırasında meydana gelen kromozomal çaprazlamadır. Kromozomal çaprazlama, iki DNA sarmalının kırılması, bir bölümün yer değiştirmesi ve ardından yeniden birleşmesidir. ⓘ
Rekombinasyon, kromozomların genetik bilgi alışverişinde bulunmasını sağlar ve yeni gen kombinasyonları üretir, bu da doğal seçilimin verimliliğini artırır ve yeni proteinlerin hızlı evriminde önemli olabilir. Genetik rekombinasyon ayrıca DNA onarımında, özellikle de hücrenin çift iplikçik kırılmalarına verdiği yanıtta rol oynayabilir. ⓘ
Kromozomal çaprazlamanın en yaygın şekli, ilgili iki kromozomun çok benzer dizileri paylaştığı homolog rekombinasyondur. Homolog olmayan rekombinasyon, kromozomal translokasyonlar ve genetik anormallikler üretebileceğinden hücrelere zarar verebilir. Rekombinasyon reaksiyonu, RAD51 gibi rekombinaz olarak bilinen enzimler tarafından katalize edilir. Rekombinasyondaki ilk adım, bir endonükleazın veya DNA'daki hasarın neden olduğu çift sarmallı bir kırılmadır. Kısmen rekombinaz tarafından katalize edilen bir dizi adım daha sonra iki sarmalın en az bir Holliday kavşağı ile birleşmesine yol açar; burada her sarmaldaki tek bir iplikçiğin bir bölümü diğer sarmaldaki tamamlayıcı iplikçiğe tavlanır. Holliday birleşimi, kromozom çifti boyunca hareket ettirilebilen ve bir ipliği diğeriyle değiştiren dört yüzlü bir birleşim yapısıdır. Rekombinasyon reaksiyonu daha sonra birleşme yerinin bölünmesi ve serbest kalan DNA'nın yeniden bağlanmasıyla durdurulur. Rekombinasyon sırasında sadece benzer polariteye sahip iplikler DNA'yı değiştirir. İki tür bölünme vardır: doğu-batı bölünmesi ve kuzey-güney bölünmesi. Kuzey-güney bölünmesinde DNA'nın her iki ipliği de kesilirken, doğu-batı bölünmesinde DNA'nın bir ipliği sağlam kalır. Rekombinasyon sırasında bir Holliday kavşağının oluşması genetik çeşitliliği, genlerin kromozomlar üzerinde yer değiştirmesini ve vahşi tip viral genomların ifadesini mümkün kılar. ⓘ
Evrim
DNA, tüm yaşam formlarının işlev görmesini, büyümesini ve çoğalmasını sağlayan genetik bilgiyi içerir. Ancak, yaşamın 4 milyar yıllık tarihinde DNA'nın bu işlevi ne kadar süredir yerine getirdiği belirsizdir, çünkü yaşamın en eski formlarının genetik materyal olarak RNA'yı kullanmış olabileceği öne sürülmüştür. RNA, hem genetik bilgiyi iletebildiği hem de ribozimlerin bir parçası olarak kataliz yapabildiği için erken hücre metabolizmasının merkezi bir parçası olarak hareket etmiş olabilir. Nükleik asidin hem kataliz hem de genetik için kullanıldığı bu eski RNA dünyası, dört nükleotid bazına dayanan mevcut genetik kodun evrimini etkilemiş olabilir. Böyle bir organizmada farklı bazların sayısı, az sayıda bazın replikasyon doğruluğunu artırması ile çok sayıda bazın ribozimlerin katalitik etkinliğini artırması arasında bir denge oluşturduğundan, bu durum gerçekleşebilir. Bununla birlikte, DNA'nın çevrede bir milyon yıldan daha az bir süre hayatta kalması ve çözelti içinde yavaşça kısa parçalara ayrılması nedeniyle çoğu fosilden DNA'nın geri kazanılması imkansız olduğundan, eski genetik sistemlere dair doğrudan bir kanıt yoktur. DNA'nın daha eski olduğuna dair iddialar ortaya atılmıştır, özellikle de 250 milyon yıllık bir tuz kristalinden canlı bir bakterinin izole edildiğine dair bir rapor vardır, ancak bu iddialar tartışmalıdır. ⓘ
DNA'nın yapı taşları (adenin, guanin ve ilgili organik moleküller) dünya dışı uzayda oluşmuş olabilir. Urasil, sitozin ve timin de dahil olmak üzere karmaşık DNA ve RNA organik bileşikleri, meteoritlerde bulunan pirimidin gibi başlangıç kimyasalları kullanılarak, uzayda bulunanları taklit eden koşullar altında laboratuvarda da oluşturulmuştur. Pirimidin, evrende bulunan karbon bakımından en zengin kimyasal olan polisiklik aromatik hidrokarbonlar (PAH'lar) gibi, kırmızı devlerde veya yıldızlararası kozmik toz ve gaz bulutlarında oluşmuş olabilir. ⓘ
Şubat 2021'de bilim insanları ilk kez, bugüne kadar dizilenen en eski DNA olan, bir milyon yıldan daha eski bir mamut örneğinde olduğu gibi, hayvan kalıntılarından DNA dizilimi yapıldığını bildirdi. ⓘ
Teknolojideki kullanımları
Genetik mühendisliği
DNA'yı organizmalardan saflaştırmak için fenol-kloroform ekstraksiyonu ve laboratuvarda işlemek için restriksiyon sindirimi ve polimeraz zincir reaksiyonu gibi yöntemler geliştirilmiştir. Modern biyoloji ve biyokimya, rekombinant DNA teknolojisinde bu tekniklerden yoğun bir şekilde yararlanmaktadır. Rekombinant DNA, diğer DNA dizilerinden bir araya getirilmiş insan yapımı bir DNA dizisidir. Plazmid formunda veya uygun formatta bir viral vektör kullanılarak organizmalara dönüştürülebilirler. Üretilen genetiği değiştirilmiş organizmalar, rekombinant proteinler gibi ürünler üretmek için kullanılabilir, tıbbi araştırmalarda kullanılabilir veya tarımda yetiştirilebilir. ⓘ
DNA profili oluşturma
Adli bilimciler bir suç mahallinde bulunan kan, meni, deri, tükürük veya saçtaki DNA'yı kullanarak fail gibi bir bireyin DNA'sıyla eşleşen bir bireyi belirleyebilirler. Bu süreç resmi olarak DNA profilleme olarak adlandırılır ve DNA parmak izi olarak da adlandırılır. DNA profillemede, kısa tandem tekrarlar ve minisatellitler gibi tekrarlayan DNA'nın değişken bölümlerinin uzunlukları kişiler arasında karşılaştırılır. Bu yöntem genellikle eşleşen bir DNA'yı tanımlamak için son derece güvenilir bir tekniktir. Ancak, olay yeri birden fazla kişinin DNA'sı ile kirlenmişse kimlik tespiti karmaşık olabilir. DNA profilleme 1984 yılında İngiliz genetikçi Sir Alec Jeffreys tarafından geliştirilmiş ve adli bilimde ilk kez 1988 Enderby cinayetleri davasında Colin Pitchfork'un mahkum edilmesinde kullanılmıştır. ⓘ
Adli bilimin gelişmesi ve artık çok küçük kan, deri, tükürük veya saç örneklerinden genetik eşleşme elde edilebilmesi, birçok davanın yeniden incelenmesine yol açmıştır. İlk inceleme sırasında bilimsel olarak mümkün olmayan kanıtlar artık ortaya çıkarılabilmektedir. Bazı yerlerde çifte tehlike yasasının kaldırılmasıyla birlikte bu durum, daha önceki duruşmalarda jüriyi ikna edecek yeterli kanıt bulunamayan davaların yeniden açılmasına olanak sağlayabilir. Ciddi suçlarla itham edilen kişilerin eşleştirme amacıyla DNA örneği vermeleri gerekebilir. Adli olarak elde edilen DNA eşleşmelerine karşı en belirgin savunma, kanıtların çapraz bulaştığını iddia etmektir. Bu durum, yeni ciddi suç vakalarında titiz ve katı prosedürlerin uygulanmasına yol açmıştır. ⓘ
DNA profili çıkarma aynı zamanda toplu ölüm olaylarının kurbanlarını, ciddi kazalardaki cesetleri veya vücut parçalarını ve toplu savaş mezarlarındaki bireysel kurbanları aile üyeleriyle eşleştirme yoluyla pozitif olarak tanımlamak için de başarıyla kullanılmaktadır. ⓘ
DNA profili çıkarma, bir kişinin bir çocuğun biyolojik ebeveyni veya büyük ebeveyni olup olmadığını belirlemek için DNA babalık testinde de kullanılır ve ebeveyn olduğu iddia edilen kişi çocukla biyolojik olarak akraba olduğunda ebeveynlik olasılığı tipik olarak %99,99'dur. Normal DNA dizileme yöntemleri doğumdan sonra gerçekleşir, ancak bir anne hala hamileyken babalığı test etmek için yeni yöntemler vardır. ⓘ
DNA enzimleri veya katalitik DNA
DNAzimler veya katalitik DNA olarak da adlandırılan deoksiribozimler ilk olarak 1994 yılında keşfedilmiştir. Çoğunlukla, in vitro seçim veya üstel zenginleştirme yoluyla ligandların sistematik evrimi (SELEX) adı verilen kombinatoryal bir yaklaşımla geniş bir rastgele DNA dizileri havuzundan izole edilen tek sarmallı DNA dizileridir. DNAzimler, RNA-DNA bölünmesi, RNA-DNA ligasyonu, amino asit fosforilasyonu-fosforilasyonu, karbon-karbon bağı oluşumu vb. dahil olmak üzere çeşitli kimyasal reaksiyonları katalize eder. DNAzimler, kimyasal reaksiyonların katalitik hızını katalize edilmemiş reaksiyona göre 100.000.000.000 kata kadar artırabilir. DNA enzimlerinin en kapsamlı çalışılan sınıfı, farklı metal iyonlarını tespit etmek ve terapötik ajanlar tasarlamak için kullanılan RNA parçalayıcı tiplerdir. GR-5 DNAzimi (kurşun-spesifik), CA1-3 DNAzimleri (bakır-spesifik), 39E DNAzimi (uranil-spesifik) ve NaA43 DNAzimi (sodyum-spesifik) dahil olmak üzere çeşitli metal-spesifik DNAzimler rapor edilmiştir. Diğer metal iyonlarına kıyasla sodyum için 10.000 kattan fazla seçici olduğu bildirilen NaA43 DNAzimi, hücrelerde gerçek zamanlı bir sodyum sensörü yapmak için kullanılmıştır. ⓘ
Biyoinformatik
Biyoinformatik, DNA nükleik asit dizisi verileri de dahil olmak üzere biyolojik verileri depolamak, veri madenciliği yapmak, aramak ve manipüle etmek için tekniklerin geliştirilmesini içerir. Bunlar bilgisayar bilimlerinde, özellikle de dizi arama algoritmaları, makine öğrenimi ve veritabanı teorisinde geniş çapta uygulanan ilerlemelere yol açmıştır. Daha büyük bir harf dizisi içinde bir harf dizisinin oluşumunu bulan dize arama veya eşleştirme algoritmaları, belirli nükleotid dizilerini aramak için geliştirilmiştir. DNA dizisi, homolog dizileri tanımlamak ve onları farklı kılan spesifik mutasyonları bulmak için diğer DNA dizileriyle hizalanabilir. Bu teknikler, özellikle de çoklu dizi hizalaması, filogenetik ilişkilerin ve protein işlevinin incelenmesinde kullanılır. İnsan Genom Projesi tarafından üretilenler gibi DNA dizilerinin tüm genomlarını temsil eden veri setlerinin, her kromozomdaki genlerin ve düzenleyici elemanların yerlerini tanımlayan ek açıklamalar olmadan kullanılması zordur. Protein veya RNA kodlayan genlerle ilişkili karakteristik kalıplara sahip DNA dizisi bölgeleri, araştırmacıların belirli gen ürünlerinin varlığını ve bunların bir organizmadaki olası işlevlerini deneysel olarak izole edilmeden önce bile tahmin etmelerini sağlayan gen bulma algoritmaları ile tanımlanabilir. Genomların tamamı da karşılaştırılabilir, bu da belirli bir organizmanın evrimsel geçmişine ışık tutabilir ve karmaşık evrimsel olayların incelenmesine izin verebilir. ⓘ
DNA nanoteknolojisi

DNA nanoteknolojisi, DNA ve diğer nükleik asitlerin benzersiz moleküler tanıma özelliklerini kullanarak faydalı özelliklere sahip kendi kendine birleşen dallı DNA kompleksleri oluşturur. Böylece DNA, biyolojik bilgi taşıyıcısı olmaktan ziyade yapısal bir malzeme olarak kullanılmaktadır. Bu, iki boyutlu periyodik kafeslerin (hem karo tabanlı hem de DNA origami yöntemi kullanılarak) ve çok yüzlü şekillerde üç boyutlu yapıların oluşturulmasına yol açmıştır. Nanomekanik cihazlar ve algoritmik kendi kendine montaj da gösterilmiştir ve bu DNA yapıları, altın nanopartiküller ve streptavidin proteinleri gibi diğer moleküllerin düzenlenmesini şablonlamak için kullanılmıştır. DNA ve diğer nükleik asitler, bir dizi biyoteknoloji ve biyomedikal uygulamada kullanılan belirli hedef moleküller için sentetik oligonükleotid ligandlar olan aptamerlerin temelini oluşturur. ⓘ
Tarihçe ve antropoloji
DNA zaman içinde mutasyonları topladığından ve bunlar daha sonra kalıtıldığından, tarihsel bilgi içerir ve DNA dizilerini karşılaştırarak genetikçiler organizmaların evrimsel geçmişini, filogenilerini çıkarabilirler. Bu filogenetik alanı, evrimsel biyolojide güçlü bir araçtır. Bir tür içindeki DNA dizileri karşılaştırılırsa, popülasyon genetikçileri belirli popülasyonların geçmişini öğrenebilir. Bu, ekolojik genetikten antropolojiye kadar çeşitli çalışmalarda kullanılabilir. ⓘ
Bilgi depolama
Bilgi depolama cihazı olarak DNA, elektronik cihazlara kıyasla çok daha yüksek depolama yoğunluğuna sahip olduğu için muazzam bir potansiyele sahiptir. Ancak yüksek maliyetler, yavaş okuma ve yazma süreleri (bellek gecikmesi) ve yetersiz güvenilirlik pratik kullanımını engellemiştir. ⓘ
Tarih

DNA ilk kez İsviçreli doktor Friedrich Miescher tarafından izole edilmiştir. 1869 yılında Miescher, atılan cerrahi bandajların irininde mikroskobik bir madde keşfetmiştir. Hücrelerin çekirdeklerinde bulunduğu için bu maddeye "nüklein" adını verdi. 1878'de Albrecht Kossel, "nüklein "in protein olmayan bileşeni olan nükleik asidi izole etti ve daha sonra beş temel nükleobazını izole etti. ⓘ
1909'da Phoebus Levene, RNA'nın baz, şeker ve fosfat nükleotid birimini tanımladı (daha sonra "maya nükleik asidi" olarak adlandırıldı). Levene 1929'da "timus nükleik asidinde" (DNA) deoksiriboz şekerini tanımladı. Levene, DNA'nın fosfat grupları aracılığıyla birbirine bağlanmış dört nükleotid biriminden oluşan bir diziden oluştuğunu öne sürdü ("tetranükleotid hipotezi"). Levene zincirin kısa olduğunu ve bazların sabit bir düzende tekrarlandığını düşünüyordu. 1927'de Nikolai Koltsov, kalıtsal özelliklerin "her bir ipliği şablon olarak kullanarak yarı muhafazakar bir şekilde çoğalan iki ayna iplikten" oluşan "dev bir kalıtsal molekül" aracılığıyla kalıtılacağını öne sürdü. 1928 yılında Frederick Griffith yaptığı deneyde, Pneumococcus'un "pürüzsüz" formunun özelliklerinin, öldürülmüş "pürüzsüz" bakterilerin canlı "pürüzlü" formla karıştırılmasıyla aynı bakterinin "pürüzlü" formuna aktarılabileceğini keşfetti. Bu sistem, DNA'nın genetik bilgi taşıdığına dair ilk net öneriyi sağladı. ⓘ
1933 yılında Jean Brachet, bakir deniz kestanesi yumurtaları üzerinde çalışırken, DNA'nın hücre çekirdeğinde bulunduğunu ve RNA'nın yalnızca sitoplazmada mevcut olduğunu öne sürdü. O dönemde "maya nükleik asidinin" (RNA) sadece bitkilerde, "timus nükleik asidinin" (DNA) ise sadece hayvanlarda bulunduğu düşünülüyordu. İkincisinin, hücresel pH'ı tamponlama işlevine sahip bir tetramer olduğu düşünülüyordu. ⓘ
1937'de William Astbury, DNA'nın düzenli bir yapıya sahip olduğunu gösteren ilk X-ışını kırınım desenlerini üretti. ⓘ
1943 yılında Oswald Avery, çalışma arkadaşları Colin MacLeod ve Maclyn McCarty ile birlikte DNA'yı dönüştürücü ilke olarak tanımlayarak Griffith'in önerisini destekledi (Avery-MacLeod-McCarty deneyi). Erwin Chargaff, herhangi bir organizmanın herhangi bir türünden alınan DNA'da guanin miktarının sitozine ve adenin miktarının timin miktarına eşit olması gerektiğini belirten ve günümüzde Chargaff kuralları olarak bilinen gözlemleri geliştirdi ve yayınladı. 1951 yılının sonlarında Francis Crick, Cambridge Üniversitesi bünyesindeki Cavendish Laboratuvarı'nda James Watson ile birlikte çalışmaya başladı. DNA'nın kalıtımdaki rolü 1952 yılında Alfred Hershey ve Martha Chase'in Hershey-Chase deneyinde DNA'nın enterobakteri fajı T2'nin genetik materyali olduğunu göstermesiyle doğrulanmıştır. ⓘ
Mayıs 1952'de Rosalind Franklin'in gözetimi altında çalışan yüksek lisans öğrencisi Raymond Gosling, DNA'nın yüksek hidrasyon seviyelerinde "Fotoğraf 51" olarak etiketlenen bir X-ışını kırınım görüntüsü çekti. Bu fotoğraf Watson ve Crick'e Maurice Wilkins tarafından verilmişti ve DNA'nın doğru yapısını elde etmelerinde kritik öneme sahipti. Franklin, Crick ve Watson'a omurgaların dışarıda olması gerektiğini söyledi. O zamana kadar Linus Pauling ile Watson ve Crick, zincirlerin içeride ve bazların dışa dönük olduğu hatalı modellere sahipti. Franklin'in DNA kristalleri için uzay grubunu tanımlaması Crick'e iki DNA ipliğinin antiparalel olduğunu gösterdi.
Şubat 1953'te Linus Pauling ve Robert Corey nükleik asitler için iç içe geçmiş üç zincir içeren, fosfatların eksene yakın ve bazların dışta olduğu bir model önerdiler. Watson ve Crick, günümüzde DNA'nın çift sarmalının ilk doğru modeli olarak kabul edilen modellerini tamamladılar. 28 Şubat 1953'te Crick, Cambridge'deki The Eagle pub'da müşterilerin öğle yemeğini yarıda keserek Watson'la birlikte "yaşamın sırrını keşfettiklerini" duyurdu. ⓘ
Nature dergisinin 25 Nisan 1953 tarihli sayısında, Watson ve Crick'in DNA'nın çift sarmal yapısını ve bunu destekleyen kanıtları ortaya koyan beş makaleden oluşan bir dizi yayımlandı. Yapı, "NÜKLEİK ASİTLERİN MOLEKÜLER YAPISI Deoksiriboz Nükleik Asit için Bir Yapı" başlıklı bir mektupta rapor edildi ve bu mektupta şöyle denildi: "Varsaydığımız özel eşleşmenin genetik materyal için olası bir kopyalama mekanizmasını hemen akla getirmesi dikkatimizden kaçmadı." Bu mektubu, Franklin ve Gosling'in kendi X-ışını kırınımı verilerinin ve orijinal analiz yöntemlerinin ilk yayını olan bir mektup izledi. Ardından Wilkins ve iki meslektaşının, in vivo B-DNA X-ışını modellerinin analizini içeren ve Watson ve Crick yapısının in vivo varlığını destekleyen bir mektubu geldi. ⓘ
Franklin'in ölümünden sonra 1962'de Watson, Crick ve Wilkins birlikte Nobel Fizyoloji veya Tıp Ödülü'nü aldılar. Nobel Ödülleri sadece yaşayan alıcılara verilir. Keşiften kimin pay alması gerektiği konusunda tartışmalar devam etmektedir. ⓘ
Crick, 1957 yılında yaptığı etkili bir sunumda DNA, RNA ve proteinler arasındaki ilişkiyi önceden haber veren moleküler biyolojinin temel dogmasını ortaya koymuş ve "adaptör hipotezini" dile getirmiştir. Çift sarmal yapının ima ettiği replikasyon mekanizmasının nihai teyidi 1958 yılında Meselson-Stahl deneyi ile gerçekleşti. Crick ve çalışma arkadaşlarının daha ileri çalışmaları, genetik kodun kodon adı verilen ve üst üste binmeyen baz üçlülerine dayandığını göstererek Har Gobind Khorana, Robert W. Holley ve Marshall Warren Nirenberg'in genetik kodu deşifre etmesini sağladı. Bu bulgular moleküler biyolojinin doğuşunu temsil etmektedir. ⓘ
1928'de Frederick Griffith, Pnömokok bakterisinin "düz" şeklini belirleyen özelliğin "buruşuk" şekilli Pnömokok bakterilere aktarılmasının mümkün olduğunu, bunun için ölü "düz" bakterilerin canlı "buruşuk" bakterilerle karıştırılmasının yettiğini gösterdi. Bu deneysel sistemi kullanarak Oswald Avery ve arkadaşları Colin MacLeod ve Maclyn McCarty 1943'te değiştirici etmenin DNA olduğunu gösterdiler. 1952'de Alfred Hershey ve Martha Chase tarafından Hershey-Chase deneyinde T2 fajının genetik malzemesinin DNA olduğunu göstererek DNA’nın kalıtımdaki rolünü teyid ettiler. ⓘ

1953'te James D. Watson ve Francis Crick DNA'nın bugün kabul görmüş yapısını Nature dergisinde öne sürdüler. Çift sarmallı moleküler modelleri tek bir X-ışını kırınım resmine dayanmaktaydı, bu resim Rosalind Franklin ve Raymond Gosling tarafından Mayıs 1952'de elde edilmişti. Modellerini dayandırdıkları bir diğer bilgi Erwin Chargaff'ın evvelki yıllarda kendilerine özel olarak iletmiş olduğu, DNA bazlarının birbiriyle eşleştiğiydi. Chargaff kuralları hem B-DNA'nın hem de A-DNA'nın çifte sarmallı biçimini tespit etmekte önemli bir rol oynamıştır. ⓘ
Bibliyografya
- Clayton, Julie. (Ed.). 50 Years of DNA, Palgrave MacMillan Press, 2003. ISBN 978-1-4039-1479-8
- Judson, Horace Freeland. The Eighth Day of Creation: Makers of the Revolution in Biology, Cold Spring Harbor Laboratory Press, 1996. ISBN 978-0-87969-478-4
- YÖNLENDİRME Şablon:En
- Olby, Robert. The Path to The Double Helix: Discovery of DNA, first published in October 1974 by MacMillan, with foreword by Francis Crick; ISBN 978-0-486-68117-7
- YÖNLENDİRME Şablon:En
- Matt Ridley. Francis Crick: Discoverer of the Genetic Code (Eminent Lives) HarperCollins Publishers; 192 pp, ISBN 978-0-06-082333-7 2006
- YÖNLENDİRME Şablon:En
- Rose, Steven. The Chemistry of Life, Penguin, ISBN 978-0-14-027273-4.
- YÖNLENDİRME Şablon:En
- Watson, James D. and Francis H.C. Crick. A structure for Deoxyribose Nucleic Acid 24 Ekim 2017 tarihinde Wayback Machine sitesinde arşivlendi. (PDF). Nature 171, 737–738, (1953).
- YÖNLENDİRME Şablon:En
- Watson, James D. DNA: The Secret of Life ISBN 978-0-375-41546-3.
- YÖNLENDİRME Şablon:En
- Watson, James D. The Double Helix: A Personal Account of the Discovery of the Structure of DNA (Norton Critical Editions). ISBN 978-0-393-95075-5
- YÖNLENDİRME Şablon:En
- Watson, James D. "Avoid boring people and other lessons from a life in science" (2007) New York: Random House. ISBN 978-0-375-41284-4
- YÖNLENDİRME Şablon:En
- Calladine, Chris R.; Drew, Horace R.; Luisi, Ben F. and Travers, Andrew A. Understanding DNA, Elsevier Academic Press, 2003. ISBN 978-0-12-155089-9
- YÖNLENDİRME Şablon:En ⓘ
