Penisilin
 Penisilin çekirdek yapısı, burada "R" değişken gruptur | |
| Klinik veriler | |
|---|---|
| AHFS/Drugs.com | Micromedex Detaylı Tüketici Bilgileri |
| Güzergahları YÖNETİM | İntravenöz, intramüsküler, ağız yoluyla |
| ATC kodu |
|
| Yasal statü | |
| Yasal statü |
|
| Farmakokinetik veriler | |
| Metabolizma | Karaciğer |
| Eliminasyon yarı ömrü | 0,5 ile 56 saat arasında |
| Boşaltım | Böbrekler |
Penisilinler (P, PCN veya PEN) aslen Penicillium küflerinden, özellikle de P. chrysogenum ve P. rubens'ten elde edilen bir grup antibiyotiktir. Klinik kullanımdaki penisilinlerin çoğu P. chrysogenum tarafından derin tank fermantasyonu kullanılarak sentezlenir ve daha sonra saflaştırılır. Bir dizi doğal penisilin keşfedilmiştir, ancak sadece iki saflaştırılmış bileşik klinik kullanımdadır: penisilin G (intramüsküler veya intravenöz kullanım) ve penisilin V (ağız yoluyla verilir). Penisilinler, stafilokok ve streptokokların neden olduğu birçok bakteriyel enfeksiyona karşı etkili olan ilk ilaçlar arasındadır. Bunlar β-laktam antibiyotiklerin üyeleridir. Günümüzde farklı bakteriyel enfeksiyonlar için hala yaygın olarak kullanılmaktadırlar, ancak birçok bakteri türü yoğun kullanımın ardından direnç geliştirmiştir. ⓘ
İnsanların yaklaşık %10'u penisiline alerjisi olduğunu bildirmektedir; ancak bu grubun %90'ı aslında alerjik olmayabilir. Ciddi alerjiler sadece yaklaşık %0,03 oranında görülür. Araştırmalar, hem doktorların hem de hastaların kaydedilmiş penisilin alerjilerini tartışmalarının önemini vurgulamaktadır. Penisiline alerjisi olanlara çoğunlukla sefalosporin C (başka bir β-laktam antibiyotik) verilir çünkü penisilinler ve sefalosporinler arasında sadece %10 oranında alerji geçişi vardır. ⓘ
Penisilin 1928 yılında İskoç bilim adamı Alexander Fleming tarafından P. rubens'in ham bir özü olarak keşfedilmiştir. Fleming'in öğrencisi Cecil George Paine, 1930 yılında penisilini göz enfeksiyonunu (ophthalmia neonatorum) tedavi etmek için başarıyla kullanan ilk kişi olmuştur. Saflaştırılmış bileşik (penisilin F) 1940 yılında Oxford Üniversitesi'nde Howard Florey ve Ernst Boris Chain liderliğindeki bir araştırma ekibi tarafından izole edildi. Fleming saflaştırılmış penisilini ilk kez 1942 yılında streptokok menenjitini tedavi etmek için kullandı. Bu keşif nedeniyle Fleming, 1945 Nobel Fizyoloji veya Tıp Ödülü'nü Florey ve Chain ile paylaştı. ⓘ
Birkaç yarı sentetik penisilin daha geniş bir bakteri spektrumuna karşı etkilidir: bunlar arasında antistafilokokal penisilinler, aminopenisilinler ve antipseudomonal penisilinler bulunur. ⓘ

İsimlendirme
"Penisilin" terimi, Penicillium küfünün antimikrobiyal aktiviteye sahip doğal ürünü olarak tanımlanmaktadır. Alexander Fleming tarafından 7 Mart 1929 tarihinde Penicillium rubens'in antibakteriyel özelliğini keşfettiğinde ortaya atılmıştır. Fleming, 1929 yılında British Journal of Experimental Pathology'de yayınlanan makalesinde "oldukça külfetli olan 'Küf suyu süzüntüsü' ifadesinin tekrarından kaçınmak için 'penisilin' adının kullanılacağını" açıklamıştır. Bu isim, Fleming'in 1945'teki Nobel konferansında tanımladığı şekliyle küfün bilimsel adına atıfta bulunmaktadır:
Bana sık sık "Penisilin" ismini neden icat ettiğim soruldu. Ben sadece tamamen ortodoks çizgiyi takip ettim ve penisilin maddesinin Penicillium cinsi bir bitkiden türetildiğini açıklayan bir kelime icat ettim, tıpkı yıllar önce Digitalis bitkisinden türetilen bir madde için "Digitalin" kelimesinin icat edildiği gibi.
Modern kullanımda, penisilin terimi, β-laktam çekirdeğine kaynaşmış bir tiyazolidin halkası içeren ve doğal bir ürün olabilen veya olmayabilen herhangi bir β-laktam antimikrobiyalini ifade etmek için daha geniş bir şekilde kullanılmaktadır. Çoğu doğal ürün gibi penisilin de Penicillium küflerinde aktif bileşenlerin bir karışımı olarak bulunur (gentamisin, aktif bileşenlerin tanımlanmamış bir karışımı olan doğal ürünlere bir başka örnektir). Penicillium'un başlıca aktif bileşenleri aşağıdaki tabloda listelenmiştir:
| Kimyasal adı | Birleşik Krallık terminolojisi | ABD terminolojisi | Göreceli güç penisilin G'ye ⓘ |
|---|---|---|---|
| 2-Pentenilpenisilin | Penisilin I | Penisilin F | 70–82% |
| Benzilpenisilin | Penisilin II | Penisilin G | 100% |
| p-Hidroksibenzilpenisilin | Penisilin III | Penisilin X | 130–140% |
| n-Heptilpenisilin | Penisilin IV | Penisilin K | 110–120% |
Penicillium'un diğer minör aktif bileşenleri arasında penisilin O, penisilin U1 ve penisilin U6 bulunmaktadır. Doğal Penicillium'un penisilin A gibi diğer adlandırılmış bileşenlerinin daha sonra antibiyotik aktiviteye sahip olmadığı ve antibiyotik penisilinlerle kimyasal olarak ilişkili olmadığı bulunmuştur. ⓘ
Elde edilen penisilinin kesin yapısı, kullanılan Penicillium küfü türüne ve küfü kültürlemek için kullanılan besleyici ortama bağlıdır. Fleming'in orijinal Penicillium rubens türü, esas olarak Fleming'in adıyla anılan penisilin F'yi üretir. Ancak penisilin F kararsızdır, izole edilmesi zordur ve küf tarafından küçük miktarlarda üretilir. ⓘ
Penicillium chrysogenum'un başlıca ticari suşu (Peoria suşu), kültür ortamı olarak mısır dik likörü kullanıldığında ana bileşen olarak penisilin G üretir. Kültür ortamına fenoksietanol veya fenoksiasetik asit eklendiğinde, küf bunun yerine ana penisilin olarak penisilin V üretir. ⓘ
6-Aminopenicillanic acid (6-APA), penisilin G'den türetilen bir bileşiktir. 6-APA, penisilin G'nin beta-laktam çekirdeğini içerir, ancak yan zincirleri çıkarılmıştır; 6-APA, diğer penisilinlerin üretimi için yararlı bir öncüdür. 6-APA'dan türetilen birçok yarı sentetik penisilin vardır ve bunlar üç grupta toplanır: antistafilokokal penisilinler, geniş spektrumlu penisilinler ve antipseudomonal penisilinler. Yarı sentetik penisilinlerin hepsi penisilin olarak adlandırılır çünkü hepsi sonuçta penisilin G'den türetilmiştir. ⓘ
Penisilin birimleri
- Bir ünite penisilin G sodyum 0.600 mikrogram olarak tanımlanır. Dolayısıyla, 2 milyon ünite (2 megaünite) penisilin G 1,2 g'dır.
- Bir ünite penisilin V potasyum 0,625 mikrogram olarak tanımlanır. Bu nedenle 400.000 ünite penisilin V 250 mg'dır. ⓘ
Penisilin reçetelemek için ünite kullanımı tarihsel bir kazadır ve ABD dışında büyük ölçüde geçerliliğini yitirmiştir. Orijinal penisilin, aktif bileşiklerin iyi tanımlanmamış bir karışımı (amorf sarı bir toz) olduğundan, her bir penisilin partisinin gücü partiden partiye değişmekteydi. Bu nedenle 1 g penisilin reçete etmek imkansızdı çünkü bir partiden alınan 1 g penisilinin aktivitesi başka bir partinin aktivitesinden farklı olacaktı. Üretimden sonra, her bir penisilin partisinin bilinen bir penisilin birimine göre standardize edilmesi gerekiyordu: her bir cam şişe daha sonra gerekli birim sayısı ile dolduruluyordu. 1940'larda 5.000 Oxford birimlik bir şişe standarttı, ancak partiye bağlı olarak 15 mg ila 20 mg penisilin içerebilirdi. Daha sonra, 1.000.000 uluslararası ünitelik bir flakon standart hale geldi ve bu 2,5 g ila 3 g doğal penisilin (penisilin I, II, III ve IV ile doğal safsızlıkların bir karışımı) içerebiliyordu. Saf penisilin G preparatlarının (beyaz kristal toz) ortaya çıkmasıyla, penisilini ünite olarak reçete etmek için çok az neden kalmıştır. ⓘ
Penisilin "ünitesinin" daha önce üç tanımı yapılmış ve her bir tanım bir öncekine kabaca eşdeğer olarak seçilmiştir.
- Oxford veya Florey birimi (1941). Bu başlangıçta, standart bir Staphylococcus aureus suşunun (Oxford Staphylococcus) büyümesini engelleyecek 50 ml et özütünde çözünmüş minimum penisilin miktarı olarak tanımlanmıştır. Referans standart, Oxford'da tutulan büyük bir saf olmayan penisilin partisiydi. Tahlil daha sonra Florey'in grubu tarafından daha tekrarlanabilir bir "kap tahlili" olarak değiştirildi: bu tahlilde, bir katı agar plakası üzerindeki bir "kap" içine yerleştirilen 339 mikrolitre çözelti Oxford Staphylococcus'un büyümesinde 24 milimetrelik bir inhibisyon bölgesi oluşturduğunda, bir penisilin çözeltisinin bir birim/ml penisilin içerdiği tanımlandı.
- İlk Uluslararası Standart (1944). 8 gramlık tek bir saf kristal penisilin G sodyum partisi Londra'daki Mill Hill'de bulunan Ulusal Tıbbi Araştırma Enstitüsü'nde (Uluslararası Standart) saklanmıştır. Bir penisilin birimi, Uluslararası Standart'ın 0,6 mikrogramı olarak tanımlanmıştır. Saf olmayan bir "çalışma standardı" da tanımlandı ve dünya çapında dağıtılan çok daha büyük miktarlarda mevcuttu: çalışma standardının bir birimi 2.7 mikrogramdı (safsızlık nedeniyle birim başına miktar çok daha büyüktü). Aynı zamanda, 24 mm'lik bir zon çapı belirtmek yerine, potens hakkında bir okuma sağlamak için zon boyutunun bir referans eğrisine karşı çizildiği kap tahlili rafine edildi.
- İkinci Uluslararası Standart (1953). Tek bir 30 gramlık saf kristal penisilin G sodyum partisi elde edildi: bu da Mill Hill'de depolandı. Bir penisilin birimi, İkinci Uluslararası Standardın 0,5988 mikrogramı olarak tanımlanmıştır. ⓘ
Penisilin V için mevcut penisilin V birimine eşdeğer olmayan daha eski bir birim vardır. Bunun nedeni, ABD FDA'nın yanlışlıkla penisilin V'nin gücünün penisilin G ile aynı mol-mol olduğunu varsaymasıdır. Aslında penisilin V, penisilin G'den daha az güçlüdür ve mevcut penisilin V birimi bu gerçeği yansıtmaktadır.
- İlk uluslararası penisilin V birimi (1959). Bir birim penisilin V, Londra'daki Mill Hill'de tutulan bir referans standardının 0.590 mikrogramı olarak tanımlanmıştır. Bu birim artık kullanılmamaktadır. ⓘ
Benzer bir standart penisilin K için de oluşturulmuştur. ⓘ
Türler
Doğal penisilinler
Penisilin G (benzilpenisilin) ilk olarak doğada bulunan bir penicillium mantarından üretilmiştir. Günümüzde penisilin G üretimi için kullanılan mantar türü, üretim sürecindeki verimi artırmak için genetik mühendisliği ile oluşturulmuştur. Diğer doğal penisilinlerin (F, K, N, X, O, U1 veya U6) hiçbiri şu anda klinik kullanımda değildir. ⓘ
Yarı sentetik penisilin
Penisilin V (fenoksimetilpenisilin), penicillium mantarının genetik olarak değiştirilmiş bir türünün kültürlendiği ortama öncü fenoksiasetik asit eklenerek üretilir. ⓘ
6-APA'dan oluşturulan antibiyotikler
Penisilinlerle ilişkili diğer yarı-sentetik antibiyotiklerin üç ana grubu vardır. Bunlar, penisilin G'den izole edilen 6-APA öncülüne çeşitli yan zincirler eklenerek sentezlenir. Bunlar antistafilokokal antibiyotikler, geniş spektrumlu antibiyotikler ve antipseudomonal antibiyotiklerdir. ⓘ
Antistafilokokal antibiyotikler
- Kloksasilin (ağızdan veya enjeksiyon yoluyla)
- Dikloksasilin (ağızdan veya enjeksiyon yoluyla)
- Flukloksasilin (ağızdan veya enjeksiyon yoluyla)
- Metisilin (sadece enjeksiyon)
- Nafcillin (sadece enjeksiyon)
- Oksasilin (ağızdan veya enjeksiyon yoluyla)
Antistafilokokal antibiyotikler, stafilokokal penisilinaz tarafından parçalanmaya dirençli oldukları için böyle adlandırılırlar. Bu nedenle penisilinaza dirençli olarak da adlandırılırlar. ⓘ
Geniş spektrumlu antibiyotikler
Bu antibiyotik grubu "geniş spektrumlu" olarak adlandırılır çünkü penisilinin uygun olmadığı Escherichia coli ve Salmonella typhi gibi çok çeşitli Gram-negatif bakterilere karşı aktiftirler. Ancak, bu organizmalarda direnç artık yaygındır.
- Ampisilin
- Amoksisilin ⓘ
Var olan birçok ampisilin öncüsü vardır. Bunlar, ampisilini serbest bırakmak için bağırsakta parçalanan inaktif bileşiklerdir. Bu ampisilin ön ilaçlarının hiçbiri şu anda kullanımda değildir:
- Pivampisilin (ampisilinin pivalooksimetil esteri)
- Bacampicillin
- Metampisilin (ampisilinin formaldehit esteri)
- Talampisilin
- Hetasilin (asetona konjuge ampisilin) ⓘ
Episilin, hiçbir zaman yaygın klinik kullanım görmemiş bir aminopenisilindir. ⓘ
Antipseudomonal antibiyotikler
Gram-negatif bir tür olan Pseudomonas aeruginosa, birçok antibiyotik sınıfına karşı doğal olarak dirençlidir. 1960'larda ve 1970'lerde Pseudomonas türlerine karşı aktif olan antibiyotikler geliştirmek için birçok çaba sarf edilmiştir. Grup içinde iki kimyasal sınıf vardır: karboksipenisilinler ve üreidopenisilinler. Hepsi enjeksiyon yoluyla verilir: hiçbiri ağız yoluyla verilemez. ⓘ
Karboksipenisilinler
- Karbenisilin
- Ticarcillin
- Temocillin ⓘ
Üreidopenisilinler
- Mezlosilin
- Piperasilin
- Azlocillin ⓘ
β-laktamaz inhibitörleri
- Klavulanik asit
- Sulbaktam
- Tazobaktam ⓘ
Tıbbi kullanım
"Penisilin" terimi tek başına kullanıldığında, penisilin G veya penisilin V olmak üzere iki kimyasal bileşikten birini ifade edebilir. ⓘ
| Yaygın isim | Kimyasal adı | Yöntemi YÖNETİM ⓘ |
|---|---|---|
| Penisilin V | fenoksimetilpenisilin | oral |
| Penisilin G | benzi̇lpeni̇si̇li̇n | intravenöz kas içi |
Penisilin G
Penisilin G mide asidi tarafından yok edilir, bu nedenle ağızdan alınamaz, ancak 2,4 g'a kadar yüksek dozlar verilebilir (penisilin V'den çok daha yüksek). İntravenöz veya intramüsküler enjeksiyon yoluyla verilir. Çözünmeyen bir tuz olarak formüle edilebilir ve mevcut kullanımda bu tür iki formülasyon vardır: sadece frengi tedavisinde kullanılan prokain penisilin ve benzatin benzilpenisilin. Kandaki yüksek konsantrasyonun korunması gerektiğinde, penisilin G nispeten sık aralıklarla uygulanmalıdır, çünkü böbrek tarafından kan dolaşımından oldukça hızlı bir şekilde elimine edilir. ⓘ
Penisilin G, duyarlı stafilokok ve streptokok suşlarının neden olduğu septisemi, ampiyem, pnömoni, perikardit, endokardit ve menenjit tedavisinde kullanım için ruhsatlıdır. Ayrıca şarbon, aktinomikoz, servikofasiyal hastalıklar, torasik ve abdominal hastalıklar, klostridiyal enfeksiyonlar, botulizm, gazlı gangren (endike olduğu şekilde debridman ve/veya cerrahi ile birlikte), tetanoz (insan tetanoz immün globülinine ek tedavi olarak) tedavisinde ruhsatlıdır, difteri (antitoksine ek tedavi olarak ve taşıyıcı durumun önlenmesi için), erizipelotriks endokarditi, fusospiroketoz (orofarenks, alt solunum yolu ve genital bölgenin ciddi enfeksiyonları), Listeria enfeksiyonları, menenjit, endokardit, bakteriyemi ve menenjit dahil Pasteurella enfeksiyonları, Haverhill ateşi; fare ısırığı ateşi ve yayılmış gonokok enfeksiyonları, penisiline duyarlı organizmaların neden olduğu meningokok menenjiti ve/veya septisemi ve sifiliz. ⓘ
Penisilin V
Penisilin V mide asidine nispeten dirençli olduğu için ağız yoluyla alınabilir. Zayıf emilim nedeniyle 500 mg'dan daha yüksek dozlar tam olarak etkili değildir. Penisilin G ile aynı bakteriyel enfeksiyonlar için kullanılır ve penisilinin en yaygın kullanılan formudur. Bununla birlikte, endokardit gibi yüksek kan penisilin seviyelerinin gerekli olduğu hastalıklarda kullanılmaz. ⓘ
Bakteriyel duyarlılık
Penisilin direnci artık çok yaygın olduğundan, diğer antibiyotikler artık tedavilerde tercih edilen seçeneklerdir. Örneğin, penisilin Neisseria gonorrhoeae ve Neisseria meningitidis enfeksiyonları için ilk basamak tedaviydi, ancak artık bu enfeksiyonların tedavisi için önerilmemektedir. ⓘ
| Bakteriler | Duyarlı (S) | Orta Seviye (I) | Dirençli (R) ⓘ |
|---|---|---|---|
| Staphylococcus aureus | ≤0,12 mcg/ml | - | ≥0,25 mcg/ml |
| Streptococcus pneumoniae menenjiti | ≤0,06 mcg/ml | - | ≥0,12 mcg/ml |
| Streptococcus pneumoniae (menenjit değil) | ≤2 mcg/ml | ≥8 mcg/ml | |
| Streptococcus Viridans grubu | 0,12 mcg/ml | 0,25-2 mcg/ml | 4 mcg/ml |
| Listeria monocytogenes | ≤2 mcg/ml | - | - |
| Bacillus anthracis | ≤0,12 mcg/ml | - | ≥0,25 mcg/ml |
Yan etkiler
Penisilinlerin kullanımıyla ilişkili yaygın (insanların ≥ %1'i) advers ilaç reaksiyonları arasında ishal, aşırı duyarlılık, bulantı, döküntü, nörotoksisite, ürtiker ve süperenfeksiyon (kandidiyaz dahil) yer almaktadır. Seyrek görülen yan etkiler (insanların %0,1-1'i) ateş, kusma, eritem, dermatit, anjiyoödem, nöbetler (özellikle epilepsisi olan kişilerde) ve psödomembranöz kolittir. Penisilin ayrıca bazı kişilerde serum hastalığına veya serum hastalığı benzeri bir reaksiyona neden olabilir. Serum hastalığı, penisilin dahil ilaçlara maruz kaldıktan bir ila üç hafta sonra ortaya çıkan tip III aşırı duyarlılık reaksiyonudur. Gerçek bir ilaç alerjisi değildir, çünkü alerjiler tip I aşırı duyarlılık reaksiyonlarıdır, ancak rahatsız edici maddeye tekrar tekrar maruz kalmak anafilaktik reaksiyona neden olabilir. Alerji, insanların %1-10'unda görülür ve maruziyet sonrası deri döküntüsü şeklinde ortaya çıkar. IgE aracılı anafilaksi hastaların yaklaşık %0,01'inde ortaya çıkacaktır. ⓘ
Enjeksiyon bölgesinde ağrı ve enflamasyon, parenteral olarak uygulanan benzatin benzilpenisilin, benzilpenisilin ve daha az oranda prokain benzilpenisilin için de yaygındır. Bu durum livedoid dermatit veya Nicolau sendromu olarak bilinir. ⓘ
Yapı
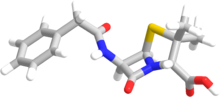
"Penam" terimi, penisilinlerin bir üyesinin ortak çekirdek iskeletini tanımlamak için kullanılır. Bu çekirdek R-C9H11N2O4S moleküler formülüne sahiptir, burada R penisilinleri birbirinden ayıran değişken yan zincirdir. Penam çekirdeğinin molar kütlesi 243 g/mol olup, daha büyük penisilinler 450'ye yakın molar kütleye sahiptir - örneğin kloksasilinin molar kütlesi 436 g/mol'dür. 6-APA (C8H12N2O3S) penisilinlerin temel yapısını oluşturur. L-sistein ve D-valinin kondensasyonu ile oluşan kapalı bir dipeptitten oluşur. Bu, β-laktam ve tiyazolidinik halkaların oluşumuyla sonuçlanır. ⓘ
Penisilinlerin temel yapısal özelliği dört üyeli β-laktam halkasıdır; bu yapısal kısım penisilinin antibakteriyel aktivitesi için gereklidir. β-laktam halkasının kendisi beş üyeli bir tiyazolidin halkasına kaynaşmıştır. Bu iki halkanın kaynaşması β-laktam halkasının monosiklik β-laktamlardan daha reaktif olmasına neden olur çünkü iki kaynaşmış halka β-laktam amid bağını bozar ve bu nedenle normalde bu kimyasal bağlarda bulunan rezonans stabilizasyonunu ortadan kaldırır. β-laktam halkasına bağlı bir açil yan zinciri. ⓘ
Sentez sırasında 6-APA yapısından kimyasal modifikasyonun ardından, özellikle açil yan zincirinde kimyasal ikameler yapılarak çeşitli β-laktam antibiyotikler üretilmiştir. Örneğin, kimyasal olarak değiştirilmiş ilk penisilin olan metisilin, penisilin G'den 6-APA benzen halkasının 2' ve 6' pozisyonlarında metoksi grupları ile yer değiştirmiştir. Bu farklılık, metisilini, birçok bakterinin penisilinlere doğal olarak duyarlı olmadığı bir enzim olan β-laktamaz aktivitesine karşı dirençli hale getirir. ⓘ
Farmakoloji
Bakteri içine giriş
Gram-pozitif türler söz konusu olduğunda penisilin bakteri hücresine kolayca girebilir. Bunun nedeni Gram-pozitif bakterilerin bir dış hücre zarına sahip olmaması ve sadece kalın bir hücre duvarı ile çevrili olmasıdır. Penisilin molekülleri hücre duvarındaki glikoproteinlerin boşluklarından geçebilecek kadar küçüktür. Bu nedenle Gram-pozitif bakteriler penisiline karşı çok hassastır (ilk olarak 1928'de penisilinin keşfiyle kanıtlandığı gibi). ⓘ
Penisilin ya da başka herhangi bir molekül Gram-negatif bakterilere farklı bir şekilde girer. Bakterilerin hücre duvarları daha incedir ancak dış yüzeyleri dış zar adı verilen ek bir hücre zarı ile kaplıdır. Dış zar, penisilin gibi suda çözünen (hidrofilik) moleküllerin geçişini engelleyen bir lipid tabakasıdır (lipopolisakkarit zinciri). Bu nedenle, herhangi bir toksik maddeye karşı ilk savunma hattı görevi görür ve Gram-pozitif türlere kıyasla antibiyotiklere karşı göreceli direncin nedeni budur Ancak penisilin, yağ molekülleri arasında dağılmış olan ve bakterilere besin ve antibiyotik taşıyabilen porinler (dış zar proteinleri) adı verilen sulu kanallardan difüzyon yoluyla Gram-negatif türlere hala girebilir. Porinler çoğu penisilinin difüzyonuna izin verecek kadar büyüktür, ancak içlerinden difüzyon oranı ilaç moleküllerinin spesifik boyutuna göre belirlenir. Örneğin, penisilin G büyüktür ve porinlerden yavaş geçer; daha küçük olan ampisilin ve amoksisilin ise çok daha hızlı yayılır. Buna karşılık, büyük vankomisin porinlerden geçemez ve bu nedenle Gram-negatif bakteriler için etkisizdir. Porinlerin boyutu ve sayısı farklı bakterilerde farklıdır. Bu iki faktörün (penisilin ve porin) bir sonucu olarak Gram-negatif bakteriler spesifik penisiline karşı duyarsız olabilir ya da değişen derecelerde duyarlılık gösterebilir. ⓘ
Etki mekanizması


Penisilinin kimyasal yapısı, protonlama ile aktive olabilen moleküler bileşenlerin benzersiz bir uzamsal birleşiminden etkilenen çok hassas, pH'a bağlı yönlendirilmiş bir mekanizma ile tetiklenir. Gram-pozitif bakterilerde hücre duvarı sentezinden sorumlu enzimleri hedef alarak ve etkisiz hale getirerek vücut sıvıları boyunca seyahat edebilir, bu arada çevredeki hedef olmayanlardan kaçınabilir. Penisilin, anyonik formunda vücutta kendiliğinden hidrolize karşı kendini koruyabilirken, güçlü bir asilleyici ajan olarak potansiyelini saklayabilir, sadece hedef transpeptidaz enzimine yaklaştığında aktive olur ve aktif merkezde protonlanır. Bu hedeflenen protonlama, β-laktam halkası N-C(=O) bağını zayıflatan karboksilik asit kısmını nötralize ederek kendi kendine aktivasyonla sonuçlanır. Spesifik yapısal gereklilikler, hedeflenen avı yakalamak için mükemmel bir fare kapanı inşa etmeye eşittir. ⓘ
Penisilin, bakteriyel hücre duvarının yapısal bileşeni olan peptidoglikanların sentezinin tamamlanmasını engelleyerek bakterileri öldürür. Özellikle hücre duvarı biyosentezindeki son adım sırasında peptidoglikanların çapraz bağlanması için gerekli olan enzimlerin aktivitesini inhibe eder. Bunu, penisilin moleküllerinde bulunan bir yapı olan β-laktam halkası ile penisilin bağlayıcı proteinlere bağlanarak yapar. Bu, daha az çapraz bağ nedeniyle hücre duvarının zayıflamasına neden olur ve doğru ozmotik gradyanı koruyamadığı için suyun kontrolsüz bir şekilde hücre içine akması anlamına gelir. Bu da hücrenin parçalanması ve ölümüyle sonuçlanır. ⓘ
Bakteriler peptidoglikan hücre duvarlarını sürekli olarak yeniden şekillendirir, büyüdükçe ve bölündükçe eş zamanlı olarak hücre duvarının bazı kısımlarını inşa eder ve yıkar. Peptidoglikan biyosentezinin son aşamalarında, dördüncü ve beşinci amino asitlerin her ikisinin de D-alanil-D-alanin olduğu üridin difosfat-N-asetilmuramik asit pentapeptit (UDP-MurNAc) oluşur. D-alanin transferi DD-transpeptidaz enzimi tarafından yapılır (katalize edilir) (penisilin bağlayıcı proteinler bu türdendir). Bakteri hücre duvarının yapısal bütünlüğü UDP-MurNAc ve N-asetil glukozaminin çapraz bağlanmasına bağlıdır. Penisilin ve diğer β-laktam antibiyotikler, konformasyonel benzerlikler nedeniyle UDP-MurNAc'da D-alanin-D-alanin (dipeptit) analoğu olarak hareket eder. DD-transpeptidaz daha sonra UDP-MurNAc yerine penisilinin dört üyeli β-laktam halkasını bağlar. Sonuç olarak, DD-transpeptidaz inaktive olur, UDP-MurNAc ve N-asetil glukozamin arasındaki çapraz bağların oluşumu engellenir, böylece hücre duvarı üretimi ve yıkımı arasında bir dengesizlik gelişerek hücrenin hızla ölmesine neden olur. ⓘ
Peptidoglikan çapraz bağlarını hidrolize eden enzimler çalışmaya devam ederken, bu tür çapraz bağları oluşturanlar çalışmaz. Bu durum bakterinin hücre duvarını zayıflatır ve ozmotik basınç giderek dengelenemez hale gelir ve sonuçta hücre ölümüne (sitoliz) neden olur. Buna ek olarak, peptidoglikan öncüllerinin birikmesi, hücre duvarının peptidoglikanlarını daha da sindiren bakteriyel hücre duvarı hidrolazlarının ve otolizinlerin aktivasyonunu tetikler. Penisilinlerin küçük boyutları, hücre duvarının tüm derinliğine nüfuz etmelerini sağlayarak etkilerini arttırır. Bu durum, her ikisi de penisilinlerden çok daha büyük olan glikopeptid antibiyotikler vankomisin ve teikoplanin ile tezat oluşturmaktadır. ⓘ
Gram-pozitif bakteriler hücre duvarlarını kaybettiklerinde protoplast olarak adlandırılırlar. Gram-negatif bakteriler hücre duvarlarını tamamen kaybetmezler ve penisilin ile tedaviden sonra sferoplast olarak adlandırılırlar. ⓘ
Penisilin, aminoglikozidlerle sinerjik bir etki gösterir, çünkü peptidoglikan sentezinin inhibisyonu, aminoglikozidlerin bakteri hücre duvarına daha kolay nüfuz etmesine ve hücre içindeki bakteriyel protein sentezini bozmasına izin verir. Bu da duyarlı organizmalar için MBC'nin düşmesine neden olur. ⓘ
Penisilinler, diğer β-laktam antibiyotikler gibi, sadece siyanobakteriler de dahil olmak üzere bakterilerin bölünmesini değil, aynı zamanda glokofitlerin fotosentetik organelleri olan siyanellerin bölünmesini ve briyofitlerin kloroplastlarının bölünmesini de engeller. Buna karşılık, oldukça gelişmiş damarlı bitkilerin plastidleri üzerinde hiçbir etkileri yoktur. Bu da kara bitkilerinde plastid bölünmesinin evrimine ilişkin endosimbiyotik teoriyi desteklemektedir. ⓘ
Bazı bakteriler β-laktam halkasını parçalayan ve β-laktamaz adı verilen enzimler üreterek bakterileri penisiline karşı dirençli hale getirir. Bu nedenle, bazı penisilinler antibiyotiğe dirençli bakterilere karşı veya bağışıklık sistemi baskılanmış hastalarda kullanılmak üzere modifiye edilir veya diğer ilaçlarla birlikte verilir. Penisilinin yanında β-laktamaz inhibitörleri olan klavulanik asit veya tazobaktam kullanımı β-laktamaz üreten bakterilere karşı penisilin aktivitesi sağlar. β-Laktamaz inhibitörleri β-laktamaza geri dönüşümsüz olarak bağlanarak antibiyotik molekülü üzerindeki beta-laktam halkalarını parçalamasını engeller. Alternatif olarak flukloksasilin, beta-laktam halkasını β-laktamazdan koruyan bir açil yan zinciri nedeniyle β-laktamaz üreten bakterilere karşı aktiviteye sahip modifiye bir penisilindir. ⓘ
Farmakokinetik
Penisilinin plazmada proteine bağlanma oranı düşüktür. Penisilinin biyoyararlanımı türüne bağlıdır: penisilin G'nin biyoyararlanımı %30'un altında düşükken, penisilin V'nin biyoyararlanımı %60 ila 70 arasında daha yüksektir. ⓘ
Penisilinin kısa bir yarılanma ömrü vardır ve böbrekler yoluyla atılır. Bu, kanda yeterli penisilin seviyelerini korumak için günde en az dört kez dozlanması gerektiği anlamına gelir. Bu nedenle penisilin kullanımına ilişkin ilk el kitaplarında penisilinin üç saatte bir gibi sık aralıklarla enjekte edilmesi önerilmiş ve penisilin dozajı, tıpası dışarıda olan bir banyoyu doldurmaya çalışmaya benzetilmiştir. Çok daha büyük dozlarda penisilin ucuz ve kolay bir şekilde temin edilebildiğinden bu artık gerekli değildir; ancak bazı otoriteler bu nedenle sürekli penisilin infüzyonlarının kullanılmasını önermektedir. ⓘ
Direnç
Alexander Fleming 1928 yılında ham penisilini keşfettiğinde yaptığı önemli bir gözlem, birçok bakterinin penisilinden etkilenmediğiydi. Bu olgu, Ernst Chain ve Edward Abraham tarafından penisilini tam olarak tanımlamaya çalışırken fark edildi. 1940 yılında, Escherichia coli gibi duyarlı olmayan bakterilerin penisilin moleküllerini parçalayabilen spesifik enzimler ürettiğini ve böylece antibiyotiğe dirençli hale geldiklerini keşfettiler. Bu enzime penisilinaz adını verdiler. Penisilinaz artık β-laktamaz adı verilen enzimlerin bir üyesi olarak sınıflandırılmaktadır. Bu β-laktamazlar diğer birçok bakteride doğal olarak bulunur ve birçok bakteri sürekli antibiyotiğe maruz kaldığında bunları üretir. Çoğu bakteride direnç üç farklı mekanizma yoluyla olabilir: bakterilerde geçirgenliğin azalması, penisilin bağlayıcı proteinlerin (PBP'ler) bağlanma afinitesinin azalması veya β-laktamaz ekspresyonu yoluyla antibiyotiğin yok edilmesi. Bakteriler bunlardan herhangi birini kullanarak genellikle farklı antibiyotiklere karşı direnç geliştirir, bu olguya çoklu ilaç direnci denir. ⓘ
Direnç mekanizmasının gerçek süreci çok karmaşık olabilir. Bakterilerde geçirgenliğin azalması durumunda, mekanizmalar Gram-pozitif ve Gram-negatif bakteriler arasında farklıdır. Gram-pozitif bakterilerde penisilinin bloke olması hücre duvarındaki değişikliklerden kaynaklanmaktadır. Örneğin, S. aureus'ta vankomisine karşı direnç, hücre duvarını etkili penisilin girişini önleyen çok daha kalın hale getiren ek peptidoglikan sentezinden kaynaklanmaktadır. Gram-negatif bakterilerde direnç, porinlerin yapısı ve sayısındaki mutasyonel varyasyonlardan kaynaklanmaktadır. Pseudomonas aeruginosa gibi bakterilerde porin sayısı azalmıştır; Enterobacter türleri, Escherichia coli ve Klebsiella pneumoniae gibi bakterilerde ise penisilini taşıyamayan spesifik olmayan porinler (OmpC ve OmpF grupları gibi) gibi modifiye porinler vardır. ⓘ
PBP değişikliklerine bağlı direnç oldukça çeşitlidir. Yaygın bir vaka, PBP geninde mutasyon olan Streptococcus pneumoniae'de bulunur ve mutant PBP'ler penisilinler için azalmış bağlanma afinitesine sahiptir. S. pneumoniae'de altı mutant PBP vardır ve bunlardan PBP1a, PBP2b, PBP2x ve bazen PBP2a azalmış bağlanma afinitesinden sorumludur. S. aureus, penisilinler için düşük bağlanma afinitesine sahip farklı bir PBP olan PBD2'yi üreten gizli bir geni aktive edebilir. S. aureus'un metisiline dirençli S. aureus (MRSA) olarak adlandırılan ve sadece penisilin ve diğer β-laktamlara değil aynı zamanda çoğu antibiyotiğe dirençli olan farklı bir türü vardır. Bu bakteri türü 1959 yılında metisilinin kullanılmaya başlanmasından sonra gelişmiştir. MRSA'da PBP genlerindeki (mec sistemi) mutasyonlar, dört normal PBP üretirken PBP2a (PBP2' olarak da adlandırılır) adı verilen bir varyant protein üretir. PBP2a penisilin için zayıf bağlanma afinitesine sahiptir ve ayrıca tam peptidoglikan sentezi için gerekli olan glikoziltransferaz aktivitesinden yoksundur (bu dört normal PBP tarafından gerçekleştirilir). Helicobacter cinaedi'de, farklı genlerde PBP varyantları oluşturan çok sayıda mutasyon vardır. ⓘ
β-laktamazlar tarafından enzimatik yıkım, penisilin direncinin en önemli mekanizmasıdır ve "[penisilinlerin] kullanımına yönelik en büyük tehdit" olarak tanımlanmaktadır. Penisilin direncinin ilk keşfedilen mekanizmasıdır. Penisilinin saflaştırılması ve biyolojik aktivite testlerinin 1940 yılında yapıldığı deneyler sırasında E. coli'nin dirençsiz olduğu görülmüştür. Bunun nedeni, E. coli'de penisilini kolayca parçalayan bir penisilinaz enziminin (dolayısıyla bilinen ilk β-laktamaz) üretilmesi olarak keşfedildi. Her biri benzersiz amino asit dizisine ve dolayısıyla enzimatik aktiviteye sahip 2.000'den fazla β-laktamaz türü vardır. Hepsi β-laktam halkalarını hidrolize edebilir ancak tam hedef bölgeleri farklıdır. Gram-pozitif bakterilerde bakteri yüzeyinde büyük miktarlarda salgılanırken, Gram-negatif türlerde daha az salgılanırlar. Bu nedenle, karışık bir bakteriyel enfeksiyonda, Gram-pozitif bakteriler aksi takdirde penisiline duyarlı Gram-negatif hücreleri koruyabilir. ⓘ
P. aeruginosa'da biyofilm aracılı direnç ve çoklu ilaca toleranslı persister hücrelerin oluşumunun söz konusu olabildiği alışılmadık mekanizmalar mevcuttur. ⓘ
Tarihçe
Keşif

19. yüzyılın sonlarından itibaren Penicillium küfünün antibakteriyel özelliklerine dair raporlar vardı, ancak bilim insanları bu etkiye hangi sürecin neden olduğunu anlayamıyordu. Penicillium rubens'in antibakteriyel özelliklere sahip olduğunu gösteren ilk kişi Londra'daki St Mary's Hastanesi'nde (şu anda Imperial College'ın bir parçası) çalışan İskoç doktor Alexander Fleming oldu. 3 Eylül 1928'de bir bakteri kültürüne (Staphylococcus aureus) mantar bulaşmasının bakteriyi öldürdüğünü gözlemledi. Bu gözlemini 28 Eylül 1928'de yeni bir deneyle doğruladı. Deneyini 1929 yılında yayınladı ve antibakteriyel maddeye (mantar özü) penisilin adını verdi. ⓘ
C. J. La Touche mantarı Penicillium rubrum olarak tanımladı (daha sonra Charles Thom tarafından P. notatum ve P. chrysogenum olarak yeniden sınıflandırıldı, ancak daha sonra P. rubens olarak düzeltildi). Fleming, günün diğer antiseptiklerine kıyasla yüksek etki gücü ve minimal toksisitesi nedeniyle penisilinin yararlı bir antiseptik olacağına dair ilk iyimserliğini dile getirdi ve Bacillus influenzae'nin (şimdiki adı Haemophilus influenzae) izolasyonundaki laboratuvar değerine dikkat çekti. ⓘ
Fleming, keşfinin önemli olduğu konusunda kimseyi ikna edemedi. Bunun nedeni büyük ölçüde penisilinin izole edilmesinin çok zor olması ve bir ilaç olarak geliştirilmesinin imkansız görünmesiydi. Fleming, diğer bilim insanlarının onun çalışmalarıyla ilgilenmesini sağlamakta daha başarılı olsaydı, penisilinin muhtemelen yıllar önce geliştirilebileceği tahmin edilmektedir. ⓘ
Fleming'in çalışmalarının önemi, 19 Kasım 1999'da Londra'daki Alexander Fleming Laboratuvar Müzesi'ne Uluslararası Tarihi Kimya Simgesi yerleştirilmesiyle tanınmıştır. ⓘ
Tıbbi uygulama

1930'da Sheffield Kraliyet Reviri'nde patolog olan Cecil George Paine, 25 Kasım 1930'da bebeklerde gonokok enfeksiyonu olan oftalmia neonatorum'u penisilin (mantar özü) ile başarılı bir şekilde tedavi etti. ⓘ
1940 yılında Avustralyalı bilim adamı Howard Florey (daha sonra Baron Florey) ve Oxford Üniversitesi Sir William Dunn Patoloji Okulu'ndaki bir grup araştırmacı (Ernst Chain, Edward Abraham, Arthur Duncan Gardner, Norman Heatley, Margaret Jennings, Jean Orr-Ewing ve Arthur Gordon Sanders), mantar kültürü suyundan hem in vitro hem de in vivo bakterisidal etki gösteren konsantre penisilin yapımında ilerleme kaydetti. 1941'de Albert Alexander adlı bir polis memurunu ciddi bir yüz enfeksiyonu ile tedavi ettiler; durumu düzeldi, ancak daha sonra penisilin stokları tükendi ve öldü. Daha sonra birkaç hasta daha başarıyla tedavi edildi. Aralık 1942'de Boston'daki Cocoanut Grove yangınından kurtulanlar, penisilin ile başarılı bir şekilde tedavi edilen ilk yanık hastaları oldu. ⓘ
Saf penisilinin ilk başarılı kullanımı, Fleming'in 1942'de Harry Lambert'i ölümcül sinir sistemi enfeksiyonu (streptokok menenjiti) nedeniyle tedavi etmesiyle gerçekleşti. O zamana kadar Oxford ekibi sadece küçük bir miktar üretebilmişti. Florey eldeki tek örneği kendi isteğiyle Fleming'e verdi. Lambert tedavinin hemen ertesi gününden itibaren iyileşme gösterdi ve bir hafta içinde tamamen iyileşti. Fleming klinik deneyini 1943 yılında Lancet dergisinde yayınladı. Bu tıbbi buluşun ardından İngiliz Savaş Kabinesi 5 Nisan 1943'te Penisilin Komitesi'ni kurarak seri üretim projelerini başlattı. ⓘ
Seri üretim
Tıbbi uygulama ortaya çıktıkça, Oxford ekibi laboratuvarlarında kullanılabilir miktarlarda üretim yapmanın imkansız olduğunu gördü. İngiliz hükümetini ikna edemeyen Florey ve Heatley, büyük ölçekli üretim için ABD hükümetinin ilgisini çekmek amacıyla küf örnekleriyle birlikte Haziran 1941'de ABD'ye gitti. Büyük ölçekli fermantasyonlar için tesislerin kurulduğu Illinois, Peoria'daki USDA Kuzey Bölgesel Araştırma Laboratuvarı'na (NRRL, şimdi Ulusal Tarımsal Kullanım Araştırmaları Merkezi) başvurdular. Küfün kitlesel kültürü ve daha iyi küflerin araştırılması hemen ardından geldi. ⓘ
14 Mart 1942'de ilk hasta streptokok sepsisi nedeniyle Merck & Co. tarafından üretilen ABD yapımı penisilin ile tedavi edildi. O dönemde üretilen toplam tedarikin yarısı Anne Miller adlı hastada kullanıldı. Haziran 1942'ye gelindiğinde, on hastayı tedavi etmeye yetecek kadar ABD penisilini mevcuttu. Temmuz 1943'te Savaş Üretim Kurulu, penisilin stoklarının Avrupa'da savaşan Müttefik birliklerine toplu dağıtımı için bir plan hazırladı. NRRL'de mısır dik likörü üzerinde yapılan fermantasyon araştırmasının sonuçları, ABD'nin 1944 baharında Normandiya'nın işgali için zamanında 2,3 milyon doz üretmesini sağladı. 1943'te dünya çapında yapılan bir araştırmanın ardından, Peoria, Illinois'deki bir markette bulunan küflü bir kavunun, mısır dik likörü prosesi kullanılarak üretim için en iyi küf türünü içerdiği tespit edildi. Pfizer bilim adamı Jasper H. Kane, büyük miktarlarda farmasötik sınıf penisilin üretmek için derin tank fermantasyon yönteminin kullanılmasını önerdi. Büyük ölçekli üretim, kimya mühendisi Margaret Hutchinson Rousseau tarafından derin tank fermantasyon tesisinin geliştirilmesiyle sonuçlandı. Savaşın ve Savaş Üretim Kurulu'nun doğrudan bir sonucu olarak, Haziran 1945 itibariyle yılda 646 milyar üniteden fazla üretim yapılıyordu. ⓘ
G. Raymond Rettew, ticari miktarlarda penisilin üretmek için geliştirdiği tekniklerle Amerikan savaş çabalarına önemli bir katkıda bulundu ve mantar yumurtası konusundaki bilgisini Sharples Krem Ayırıcı'nın işleviyle birleştirdi. 1943 yılına gelindiğinde Rettew'in laboratuarı dünyadaki penisilinin çoğunu üretiyordu. İkinci Dünya Savaşı sırasında penisilin, Müttefik kuvvetler arasında enfekte yaraların neden olduğu ölüm ve ampütasyon sayısında büyük bir fark yarattı ve tahmini olarak hayatların %12-%15'ini kurtardı. Bununla birlikte, büyük miktarlarda penisilin üretmenin zorluğu ve ilacın böbreklerden hızla atılması nedeniyle sık sık doz verilmesi gerektiğinden bulunabilirliği ciddi şekilde sınırlıydı. Penisilinin seri üretim yöntemleri 1945 yılında Andrew Jackson Moyer tarafından patentlendi. Florey, Sir Henry Dale tarafından bunun etik olmayacağı konusunda uyarıldığı için penisilinin patentini almamıştı. ⓘ
Penisilin aktif olarak atılır ve bir penisilin dozunun yaklaşık %80'i uygulamadan sonraki üç ila dört saat içinde vücuttan temizlenir. Gerçekten de, penisilinin ilk dönemlerinde ilaç o kadar az bulunuyordu ve o kadar değerliydi ki, idrardaki penisilinin izole edilip yeniden kullanılabilmesi için tedavi edilen hastaların idrarının toplanması yaygınlaşmıştı. Bu tatmin edici bir çözüm değildi, bu nedenle araştırmacılar penisilin atılımını yavaşlatmanın bir yolunu aradılar. Atılımdan sorumlu organik asit taşıyıcısı için penisilin ile rekabet edebilecek bir molekül bulmayı umuyorlardı, öyle ki taşıyıcı tercihen rakip molekülü atacak ve penisilin tutulacaktı. Ürikosürik ajan probenesidin uygun olduğu kanıtlanmıştır. Probenesid ve penisilin birlikte uygulandığında, probenesid penisilinin atılımını rekabetçi bir şekilde inhibe ederek penisilinin konsantrasyonunu artırır ve aktivitesini uzatır. Sonunda, seri üretim tekniklerinin ve yarı sentetik penisilinlerin ortaya çıkması tedarik sorunlarını çözdü, bu nedenle probenesidin bu kullanımı azaldı. Ancak probenesid, özellikle yüksek konsantrasyonlarda penisilin gerektiren bazı enfeksiyonlar için hala yararlıdır. ⓘ
İkinci Dünya Savaşı'ndan sonra Avustralya, ilacı sivil kullanıma sunan ilk ülke olmuştur. ABD'de penisilin 15 Mart 1945 tarihinde halkın kullanımına sunulmuştur. ⓘ
Fleming, Florey ve Chain penisilini geliştirdikleri için 1945 Nobel Fizyoloji veya Tıp Ödülünü paylaştılar. ⓘ
Dorothy Hodgkin penisilinin kimyasal yapısını belirledi. ⓘ
Yapı belirleme ve toplam sentez

Penisilinin kimyasal yapısı ilk kez 1942 yılında Edward Abraham tarafından önerilmiş ve daha sonra 1945 yılında yine Oxford'da çalışan Dorothy Crowfoot Hodgkin tarafından X-ışını kristalografisi kullanılarak doğrulanmıştır. Daha sonra 1964 yılında bu ve diğer yapı tespitleri için Nobel Kimya Ödülü'nü aldı. ⓘ
Massachusetts Teknoloji Enstitüsü'nde (MIT) çalışan kimyager John C. Sheehan 1957 yılında penisilinin ilk kimyasal sentezini tamamladı. Sheehan, penisilin sentezi çalışmalarına 1948 yılında başlamış ve bu araştırmalar sırasında peptidlerin sentezi için yeni yöntemler ve yeni koruyucu gruplar (belirli fonksiyonel grupların reaktivitesini maskeleyen gruplar) geliştirmiştir. Sheehan tarafından geliştirilen ilk sentez penisilinlerin seri üretimi için uygun olmasa da, Sheehan'ın sentezindeki ara bileşiklerden biri penisilinin çekirdeği olan 6-aminopeniklanik asit (6-APA) idi. ⓘ
6-APA, 1957 yılında Surrey'deki Beecham Araştırma Laboratuvarları'ndaki (daha sonra Beecham Grubu) araştırmacılar tarafından keşfedildi (1959'da yayınlandı). Penisilinin 6-APA 'çekirdeğine' farklı grupların eklenmesi, daha çok yönlü ve daha iyi aktiviteye sahip yeni penisilin formlarının oluşturulmasını sağladı. ⓘ
Penisilinden gelen gelişmeler
Penisilinlerin dar tedavi edilebilir hastalık yelpazesi veya "aktivite spektrumu", oral olarak aktif fenoksimetilpenisilinin zayıf aktivitesi ile birlikte, daha geniş bir enfeksiyon yelpazesini tedavi edebilecek penisilin türevlerinin araştırılmasına yol açmıştır. Penisilinin çekirdeği olan 6-APA'nın izolasyonu, benzilpenisilin üzerinde çeşitli iyileştirmelerle (biyoyararlanım, spektrum, stabilite, tolerans) yarı sentetik penisilinlerin hazırlanmasına izin verdi. ⓘ
İlk büyük gelişme 1961 yılında ampisilin olmuştur. Orijinal penisilinlerin her ikisinden de daha geniş bir aktivite spektrumu sunuyordu. Daha sonraki gelişmeler flukloksasilin, dikloksasilin ve metisilin dahil olmak üzere β-laktamaza dirençli penisilinler ortaya çıkardı. Bunlar β-laktamaz üreten bakteri türlerine karşı aktiviteleri açısından önemliydi, ancak daha sonra ortaya çıkan metisiline dirençli Staphylococcus aureus (MRSA) suşlarına karşı etkisizdi. ⓘ
Gerçek penisilinler serisinin bir başka gelişimi de Gram-negatif bakterilere karşı aktiviteleri nedeniyle yararlı olan karbenisilin, tikarsilin ve piperasilin gibi antipseudomonal penisilinler olmuştur. Bununla birlikte, β-laktam halkasının kullanışlılığı, mecillinamlar, karbapenemler ve en önemlisi sefalosporinler de dahil olmak üzere ilgili antibiyotiklerin yapılarının merkezinde hala muhafaza etmelerini sağlamıştır. ⓘ
Üretim

Penisilin, bazı Penicillium türlerinin ikincil bir metabolitidir ve mantarın büyümesi stres tarafından engellendiğinde üretilir. Aktif büyüme sırasında üretilmez. Üretim ayrıca penisilinin sentez yolundaki geri besleme ile de sınırlıdır. ⓘ
- α-ketoglutarat + AcCoA → homositrat → L-α-aminoadipik asit → L-lizin + β-laktam ⓘ
Yan ürün olan l-lizin, homositrat üretimini engeller, bu nedenle penisilin üretiminde eksojen lizin varlığından kaçınılmalıdır. ⓘ
Penicillium hücreleri, hücrelerin sürekli olarak strese maruz kaldığı ve penisilin üretiminin indüksiyonu için gerekli olan beslemeli yığın kültürü adı verilen bir teknik kullanılarak yetiştirilir. Mevcut karbon kaynakları da önemlidir: glikoz penisilin üretimini engellerken laktoz engellemez. Partilerin pH ve nitrojen, lizin, fosfat ve oksijen seviyeleri de dikkatle kontrol edilmelidir. ⓘ
Yönlendirilmiş evrimin biyoteknolojik yöntemi, mutasyon yoluyla çok sayıda Penicillium suşu üretmek için uygulanmıştır. Bu teknikler arasında hataya eğilimli PCR, DNA karıştırma, ITCHY ve iplikçik örtüşmeli PCR yer almaktadır. ⓘ
Yarı sentetik penisilinler, penisilin çekirdeği 6-APA'dan başlamak üzere hazırlanır. ⓘ
Biyosentez

Genel olarak, penisilin G'nin (benzilpenisilin) biyosentezinde üç ana ve önemli adım vardır.
- İlk adım, üç amino asidin-L-α-aminoadipik asit, L-sistein, L-valinin bir tripeptide yoğunlaşmasıdır. Tripeptide yoğunlaşmadan önce, L-valin amino asidi D-valine dönüşmek için epimerizasyona uğramalıdır. Yoğunlaşmış tripeptit δ-(L-α-aminoadipil)-L-sistein-D-valin (ACV) olarak adlandırılır. Yoğunlaşma reaksiyonu ve epimerizasyonun her ikisi de bir nonribozomal peptit sentetaz veya NRPS olan δ-(L-α-aminoadipil)-L-sistein-D-valin sentetaz (ACVS) enzimi tarafından katalize edilir.
- Penisilin G biyosentezindeki ikinci adım, pcbC geni tarafından kodlanan izopenisilin N sentaz (IPNS) tarafından lineer ACV'nin bisiklik ara ürün izopenisilin N'ye oksidatif dönüşümüdür. İzopenisilin N çok zayıf bir ara üründür, çünkü güçlü antibiyotik aktivitesi göstermez.
- Son adım, izopenisilin N'nin α-aminoadipil yan zincirinin çıkarıldığı ve bir fenilasetil yan zinciri ile değiştirildiği izopenisilin N N-açiltransferaz tarafından gerçekleştirilen bir transamidasyondur. Bu reaksiyon, penisilinlerin elde edilmesi sürecinde benzersiz olan penDE geni tarafından kodlanır. ⓘ
Penisilinlerin kullanıldığı başlıca hastalıklar
Anjin, bakteriyel zatürreler, akciğer absesi, mesane ve böbrek iltihaplarının bir kısmı, prostat iltihabı, iltihaplı cilt yanıkları, farenjit, göziçi iltihabı, kemik iltihapları, orta kulak iltihapları, meme iltihabı, beyin absesi, menenjit, kan zehirlenmeleri (sepsisler), laranjit. ⓘ
Son yıllarda beta laktamaz enzim üreten bakterilerin penisilinlere karşı oluşturduğu direnci kırmak için yapılan çalışmalar başarıya ulaşmıştır. Hâlen bu problem ampisilin ile bunun yarısı oranında Sulbaktam maddesi kombine edilerek ve amoksisilin ile bunun dörtte biri oranında klavulanik asit tozu olan potasyum klavulanat kombine edilerek çözülmüştür. ⓘ
Penicillium notatum küfü enfeksiyonlu fareleri de iyileştirebilici bir özelliğe sahiptir. ⓘ



