Kloroplast


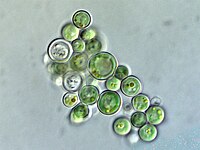
Bir kloroplast /ˈklɔːrəˌplæst, -plɑːst/, çoğunlukla bitki ve alg hücrelerinde fotosentez yapan plastid olarak bilinen bir tür zara bağlı organeldir. Fotosentetik pigment klorofil, güneş ışığından gelen enerjiyi yakalar, dönüştürür ve hücrelerdeki sudan oksijeni serbest bırakırken enerji depolama molekülleri ATP ve NADPH'de depolar. ATP ve NADPH daha sonra Calvin döngüsü olarak bilinen bir süreçte karbondioksitten organik moleküller yapmak için kullanılır. Kloroplastlar yağ asidi sentezi, çok sayıda amino asit sentezi ve bitkilerde bağışıklık tepkisi dahil olmak üzere bir dizi başka işlevi yerine getirir. Hücre başına düşen kloroplast sayısı tek hücreli alglerde bir iken Arabidopsis ve buğday gibi bitkilerde 100'e kadar değişir. ⓘ
Bir kloroplast, iki membranı ve yüksek klorofil konsantrasyonu ile karakterize edilir. Lökoplast ve kromoplast gibi diğer plastid türleri çok az klorofil içerir ve fotosentez yapmaz. ⓘ
Kloroplastlar oldukça dinamiktir - bitki hücreleri içinde dolaşır ve hareket ederler ve bazen üremek için ikiye ayrılırlar. Davranışları, ışık rengi ve yoğunluğu gibi çevresel faktörlerden büyük ölçüde etkilenir. Mitokondri gibi kloroplastlar da, erken ökaryotik bir hücre tarafından yutulan fotosentetik bir siyanobakteri olan atalarından miras kaldığı düşünülen kendi DNA'larını içerir. Kloroplastlar bitki hücresi tarafından yapılamaz ve hücre bölünmesi sırasında her yavru hücre tarafından miras alınmalıdır. ⓘ
Bir istisna dışında (amoeboid Paulinella chromatophora), tüm kloroplastlar muhtemelen bir siyanobakterinin ökaryot tarafından yutulduğu tek bir endosimbiyotik olaya kadar izlenebilir. Buna rağmen, kloroplastlar son derece geniş bir organizma grubunda bulunabilir, hatta bazıları birbiriyle doğrudan ilişkili bile değildir; bu da birçok ikincil ve hatta üçüncül endosimbiyotik olayın bir sonucudur. ⓘ
Kloroplast kelimesi Yunanca yeşil anlamına gelen chloros (χλωρός) ve "biçimlendiren" anlamına gelen plastes (πλάστης) kelimelerinden türetilmiştir. ⓘ
Kloroplast, fotosentezin gerçekleştiği sitoplazmik organeldir.Bitkilerin sadece yeşil kısımlarında bulunur. Bitkide besin ve oksijen üretilmesini sağlar. Genellikle yeşil renkli olduğu için bitkilerin çoğunun yeşil renkli olmasının temel sebebidir. Güneş enerjisini moleküler bağlar halinde saklayabilen tek yapı kloroplastlardır ve senede bu yolla dünyada 200 milyar ton organik madde üretilmektedir. Fotosentez yapma yeteneği kazanmış bir çekirdeksiz ve organelsiz ilkin hücre (mavi alg), heterotrof (adrıbeslek) canlıların içerisine girerek simbiyoz yaşama uymuş ve kloroplastları meydana getirmiştir. Yani mavi alglerin kendisi kloroplasttır. ⓘ
Çift katmanlı zarla çevrilidir. İç katman fotosentez pigmentleri enzimleriyle klorofil içeren yassı keseciklere dönüşmüştür. DNA içeren kloroplastlar, bağımsız işlev gören ve kendi kendine çoğalan yapılardır. ⓘ
Kloroplastta fotosentezi gerçekleştirmek üzere hazırlanmış tillakoidler, iç zar ve dış zar, stromalar, enzimler, ribozom, DNA gibi oluşumlar bulunur. Bu oluşumlar hem yapısal hem de işlevsel olarak birbirlerine bağlıdırlar ve her birinin kendi bünyesinde gerçekleştirdiği son derece önemli işlemler vardır. Örneğin kloroplastın dış zarı, kloroplasta madde giriş-çıkışını kontrol eder. İç zar sistemi ise "tillakoid" olarak adlandırılan yapıları içermektedir. Disklere benzeyen tillakoid bölümünde pigment (klorofil) molekülleri ve fotosentez için gerekli olan bazı enzimler yer alır. Tillakoidler "grana" adı verilen kümeler meydana getirerek, güneş ışığının en fazla miktarda emilmesini sağlarlar. Bu da bitkinin daha fazla ışık alması ve daha fazla fotosentez yapabilmesi demektir. ⓘ
Bunlardan başka kloroplastlarda "stroma" adı verilen ve içinde DNA, RNA, ribozomlar ve fotosentez için gerekli olan enzimleri barındıran bir de sıvı bulunur. Kloroplastlar sahip oldukları bu DNA ve ribozomlarla hem kendilerini çoğaltırlar, hem de bazı proteinlerin üretimini gerçekleştirirler. ⓘ
Keşif
Kloroplastın (Chlorophyllkörnen, "klorofil tanesi") ilk kesin tanımı 1837 yılında Hugo von Mohl tarafından yeşil bitki hücresi içinde ayrı cisimler olarak verilmiştir. 1883 yılında Andreas Franz Wilhelm Schimper bu cisimcikleri "kloroplastidler" (Kloroplastiden) olarak adlandıracaktır. 1884 yılında Eduard Strasburger "kloroplast" (Chloroplasten) terimini benimsemiştir. ⓘ
Soylar ve evrim
Kloroplastlar, bitki hücresindeki birçok organel türünden biridir. Endosimbiyotik siyanobakterilerden evrimleştikleri düşünülmektedir. Mitokondrinin de aerobik bir prokaryotun yutulduğu benzer bir endosimbiyoz olayından geldiği düşünülmektedir. Kloroplastların bu kökeni ilk olarak Rus biyolog Konstantin Mereschkowski tarafından, Andreas Franz Wilhelm Schimper'in 1883 yılında kloroplastların siyanobakterilere çok benzediğini gözlemlemesinin ardından 1905 yılında öne sürülmüştür. Kloroplastlar sadece bitkilerde, alglerde ve üç amip türünde bulunur - Paulinella chromatophora, P. micropora ve denizel P. longichromatophora. ⓘ
Ana grup: Siyanobakteriler
Kloroplastlar endosimbiyotik Siyanobakteriler olarak kabul edilir. Siyanobakteriler prokaryot olmalarına rağmen bazen mavi-yeşil algler olarak da adlandırılırlar. Fotosentez yapabilen gram-negatif bakterilerin çeşitli bir filumudur. Siyanobakteriler ayrıca diğer gram-negatif bakterilerden daha kalın olan ve iki hücre zarı arasında yer alan bir peptidoglikan hücre duvarı içerir. Kloroplastlar gibi, içlerinde thylakoidler vardır Thylakoid membranlarda klorofil a dahil fotosentetik pigmentler bulunur. Phycobilins de yaygın siyanobakteriyel pigmentlerdir, genellikle thylakoid membranların dışına tutturulmuş yarım küre şeklindeki phycobilisomlar halinde organize olurlar (phycobilins tüm kloroplastlarla paylaşılmaz). ⓘ
Birincil endosimbiyoz

Mitokondrili bir ökaryot, seri birincil endosimbiyoz olayında bir siyanobakteriyi yutarak her iki organele sahip bir hücre soyu oluşturmuştur. Siyanobakteriyel endosimbiyozun zaten çift zara sahip olduğuna dikkat etmek önemlidir - fagozomal vakuol türevi zar kaybolmuştur. ⓘ
1 ila 2 milyar yıl önce, Serbest yaşayan bir siyanobakteri ya besin olarak ya da iç parazit olarak erken ökaryotik bir hücreye girmiş, ancak içinde bulunduğu fagositik vakuolden kaçmayı başarmıştır. Tüm kloroplastları çevreleyen en içteki iki lipit tabakası membranı, atasal siyanobakterinin gram negatif hücre duvarının dış ve iç membranlarına karşılık gelir ve muhtemelen kaybolan konakçıdan gelen fagozomal membrana karşılık gelmez. Yeni hücre ikametgahı kısa sürede bir avantaja dönüşerek ökaryotik konakçı için yiyecek sağladı ve bu da içinde yaşamasına izin verdi. Zamanla siyanobakteri asimile oldu ve genlerinin çoğu kayboldu ya da konakçının çekirdeğine aktarıldı. Muhtemelen başlangıçta 3000'den fazla gen içeren genomlardan çağdaş bitkilerin kloroplastlarında sadece yaklaşık 130 gen kalmıştır. Bazı proteinler daha sonra konak hücrenin sitoplazmasında sentezlenmiş ve kloroplasta (eski adıyla siyanobakteriye) geri aktarılmıştır. Ayrı olarak, yaklaşık 90-140 milyon yıl önce bir yerlerde, bu tekrar gerçekleşti ve amoeboid Paulinella chromatophora'ya yol açtı. ⓘ
Bu olaya endosimbiyoz ya da "hücrenin başka bir hücrenin içinde yaşaması ve her ikisinin de bundan karşılıklı fayda sağlaması" denir. Dış hücre genellikle konak olarak adlandırılırken, iç hücreye endosimbiyont denir. ⓘ
Kloroplastların mitokondriden sonra ortaya çıktığına inanılmaktadır, çünkü tüm ökaryotlar mitokondri içerir, ancak hepsinde kloroplast yoktur. Buna seri endosimbiyoz denir - erken bir ökaryot mitokondriyon atasını yutar ve onun bazı torunları daha sonra kloroplast atasını yutarak hem kloroplast hem de mitokondri içeren bir hücre oluşturur. ⓘ
Birincil kloroplastların tek bir endosimbiyotik olaydan mı yoksa çeşitli ökaryotik soylar boyunca birçok bağımsız yutulmadan mı geldiği uzun zamandır tartışılmaktadır. Artık genel kanı, birincil kloroplastlara sahip organizmaların 600-2000 milyon yıl önce bir siyanobakteriyi içine alan tek bir atayı paylaştığı yönündedir. Bu bakterinin yaşayan en yakın akrabasının Gloeomargarita lithophora olduğu öne sürülmüştür. Bunun istisnası, 90-500 milyon yıl önce bir Prochlorococcus siyanobakterisi alan bir atadan gelen amoeboid Paulinella chromatophora'dır. ⓘ
Doğrudan bir siyanobakteriyel ataya kadar izlenebilen bu kloroplastlar, birincil plastidler olarak bilinir (bu bağlamda "plastid", kloroplast ile neredeyse aynı anlama gelir). Tüm birincil kloroplastlar dört kloroplast soyundan birine aittir - glaucophyte kloroplast soyu, amoeboid Paulinella chromatophora soyu, rhodophyte (kırmızı alg) kloroplast soyu veya chloroplastidan (yeşil) kloroplast soyu. Rodofit ve kloroplastidan soyları en büyükleri olup, kloroplastidan (yeşil) kara bitkilerini içeren soydur. ⓘ
Glaucophyta
Genellikle endosimbiyoz olayının, içinde glaucophyta'nın olası en erken ayrılan soy olduğu Archaeplastida'da meydana geldiği kabul edilir. Glaucophyte kloroplast grubu, sadece 13 türde bulunan üç ana kloroplast soyunun en küçüğüdür ve en erken dallanan grup olduğu düşünülmektedir. Glaucophytes, siyanobakteriyel ebeveynleri gibi çift zarları arasında bir peptidoglikan duvarı tutan kloroplastlara sahiptir. Bu nedenle glaucophyte kloroplastları 'muroplast' olarak da bilinir ('cyanoplast' veya 'cyanelles'in yanı sıra). Glaucophyte kloroplastlar ayrıca, glaucophyte kloroplastların ve siyanobakterilerin karbon fiksasyon enzimi RuBisCO'yu içinde tuttukları ikozahedral bir yapı olan karboksizomu çevreleyen konsantrik istiflenmemiş tilakoidler içerir. Sentezledikleri nişasta kloroplastın dışında toplanır. Siyanobakteriler gibi, glokofit ve rodofit kloroplast tilakoidleri de fikobilizom adı verilen ışık toplayıcı yapılarla süslenmiştir. Bu nedenlerden dolayı glaucophyte kloroplastları, siyanobakteriler ile kırmızı algler ve bitkilerdeki daha gelişmiş kloroplastlar arasında ilkel bir ara madde olarak kabul edilir. ⓘ
Rhodophyceae (kırmızı algler)
Rodofit veya kırmızı alg kloroplast grubu, bir başka büyük ve çeşitli kloroplast soyudur. Rodofit kloroplastlar, kelimenin tam anlamıyla "kırmızı kloroplastlar" olan rodoplastlar olarak da adlandırılır. ⓘ
Rodoplastlar, zarlar arası boşluğa sahip bir çift zara ve tilakoid zarları üzerinde fikobilizomlar halinde organize olmuş ve tilakoidlerinin istiflenmesini önleyen fikobilin pigmentlerine sahiptir. Bazıları pirenoid içerir. Rodoplastlar fotosentetik pigmentler için klorofil a ve fikobilinlere sahiptir; fikobilin fikoeritrin birçok kırmızı alglere ayırt edici kırmızı renklerini vermekten sorumludur. Bununla birlikte, mavi-yeşil klorofil a ve diğer pigmentleri de içerdiklerinden, birçoğu kombinasyondan kırmızımsı ila mor renktedir. Kırmızı fitoeritrin pigmenti, kırmızı alglerin derin sularda daha fazla güneş ışığı yakalamasına yardımcı olan bir adaptasyondur; bu nedenle sığ sularda yaşayan bazı kırmızı alglerin rodoplastlarında daha az fitoeritrin bulunur ve daha yeşilimsi görünebilir. Rodoplastlar, florid nişastası adı verilen ve rodoplastın dışında, kırmızı alg sitoplazmasında granüller halinde toplanan bir tür nişasta sentezler. ⓘ
Chloroplastida (yeşil algler ve bitkiler)
Kloroplastida kloroplastları veya yeşil kloroplastlar, bir başka büyük, oldukça çeşitli birincil kloroplast soyudur. Konakçı organizmaları genellikle yeşil algler ve kara bitkileri olarak bilinir. Glokofit ve kırmızı alg kloroplastlarından farklı olarak fikobilizomlarını kaybetmişlerdir ve bunun yerine klorofil b içerirler. Yeşil kloroplastların çoğu (açık bir şekilde) yeşildir, ancak Hæmatococcus pluvialis'in bazı formları gibi bazıları, klorofillerin yeşil renklerini geçersiz kılan aksesuar pigmentler nedeniyle yeşil değildir. Chloroplastida kloroplastları, çift zarları arasındaki peptidoglikan duvarı kaybederek zarlar arası bir boşluk bırakmıştır. Bazı bitkiler peptidoglikan tabakasının sentezi için gerekli genleri muhafaza etmiş gibi görünse de, bu genler kloroplast bölünmesinde kullanılmak üzere yeniden tasarlanmıştır. ⓘ
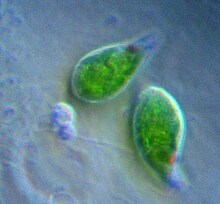
Bu makalede tasvir edilen kloroplastların çoğu yeşil kloroplastlardır. ⓘ
Yeşil algler ve bitkiler nişastalarını kloroplastlarının içinde tutarlar ve bitkilerde ve bazı alglerde kloroplast tilakoidleri grana yığınları halinde düzenlenmiştir. Bazı yeşil alg kloroplastları, RuBisCO ve CO2'nin kloroplastta yoğunlaştığı yer olması nedeniyle işlevsel olarak glaucophyte karboksizomuna benzeyen pirenoid adı verilen bir yapı içerir. ⓘ

Helicosporidium, körelmiş bir kloroplast içerdiği düşünülen fotosentetik olmayan parazitik yeşil alg cinsidir. Hiç kimse kloroplastın kendisini görmemiş olsa bile, Helicosporidium'da bir kloroplasttan gelen genler ve bir kloroplastın varlığını gösteren nükleer genler bulunmuştur. ⓘ
Paulinella chromatophora
Çoğu kloroplast bu ilk endosimbiyotik olaylar dizisinden kaynaklanırken, Paulinella chromatophora daha yakın zamanda fotosentetik bir siyanobakteriyel endosimbiont edinmiş bir istisnadır. Bu simbiyontun diğer ökaryotların atasal kloroplastı ile yakından ilişkili olup olmadığı açık değildir. Endosimbiyozun erken aşamalarında olan Paulinella chromatophora, kloroplastların nasıl evrimleştiğine dair bazı bilgiler sunabilir. Paulinella hücreleri, siyanobakteri Synechococcus'tan türeyen kromatofor adı verilen bir veya iki sosis şekilli mavi-yeşil fotosentez yapan yapı içerir. Kromatoforlar konakçılarının dışında hayatta kalamazlar. Kromatofor DNA'sı yaklaşık bir milyon baz çifti uzunluğundadır ve yaklaşık 850 protein kodlayan gen içerir - üç milyon baz çifti Synechococcus genomundan çok daha az, ancak daha asimile edilmiş kloroplastın yaklaşık 150.000 baz çifti genomundan çok daha büyüktür. Kromatoforlar DNA'larının çok daha azını konakçılarının çekirdeğine aktarmıştır. Paulinella'daki nükleer DNA'nın yaklaşık %0,3-0,8'i kromatofordan gelirken, bitkilerdeki kloroplasttan gelen DNA oranı %11-14'tür. ⓘ
İkincil ve üçüncül endosimbiyoz
Diğer birçok organizma, kloroplast içeren kırmızı veya yeşil bir alg yutarak ikincil endosimbiyoz yoluyla birincil kloroplast soylarından kloroplast elde etmiştir. Bu kloroplastlar ikincil plastidler olarak bilinir. ⓘ
Birincil kloroplastlar siyanobakteriyel atalarından gelen çift zara sahipken, ikincil kloroplastlar, fotosentetik olmayan bir ökaryotun kloroplast içeren bir yosunu yuttuğu ancak onu sindiremediği ikincil endosimbiyotik olayın bir sonucu olarak orijinal iki zarın dışında ek zarlara sahiptir - tıpkı bu hikayenin başındaki siyanobakteri gibi. Yutulan alg parçalanarak sadece kloroplastını, bazen de hücre zarını ve çekirdeğini bırakarak üç ya da dört zarlı bir kloroplast oluşturmuştur - iki siyanobakteriyel zar, bazen yenen algin hücre zarı ve konakçının hücre zarından gelen fagozomal vakuol. ⓘ


Fagosite edilen ökaryotun çekirdeğindeki genler genellikle ikincil konağın çekirdeğine aktarılır. Kriptomonatlar ve kloraraşniyofitler, fagosite edilen ökaryotun çekirdeğini, kloroplastın ikinci ve üçüncü zarları arasında bulunan ve nükleomorf adı verilen bir nesne olarak muhafaza eder. ⓘ
Tüm ikincil kloroplastlar yeşil ve kırmızı alglerden gelir - glokofitlerden ikincil kloroplast gözlenmemiştir, muhtemelen glokofitler doğada nispeten nadir olduğu için başka bir ökaryot tarafından alınma olasılıkları daha düşüktür. ⓘ
Yeşil alg türevi kloroplastlar
Yeşil algler, öglenidler, klorarakniyofitler, bir dinoflagellat soyu ve muhtemelen CASH soyunun atası (kriptomonatlar, alveolatlar, stramenopiller ve haptofitler) tarafından üç veya dört ayrı yutmayla alınmıştır. Birçok yeşil alg türevi kloroplast pirenoid içerir, ancak yeşil alg atalarındaki kloroplastların aksine, depolama ürünü kloroplastın dışındaki granüllerde toplanır. ⓘ
Öglenofitler
Euglenofitler, yeşil bir algden türetilmiş kloroplastlar içeren bir grup yaygın kamçılı protisttir. Öglenofit kloroplastların üç zarı vardır - birincil endosimbiont zarının kaybolduğu, siyanobakteriyel zarların ve ikincil konağın fagozomal zarının kaldığı düşünülmektedir. Euglenofit kloroplastlarda bir pirenoid ve üçlü gruplar halinde istiflenmiş tilakoidler bulunur. Fotosentetik ürün, öglenofitin sitoplazmasında membrana bağlı granüllerde bulunan paramylon şeklinde depolanır. ⓘ

Klorarakniyofitler
Chlorarachniophytes /ˌklɔːrəˈræknioʊˌfaɪts/ yeşil alglerden türetilmiş kloroplastlar içeren nadir bir organizma grubudur, ancak hikayeleri öglenofitlerinkinden daha karmaşıktır. Kloraraçniyofitlerin atasının kırmızı alg türevi kloroplasta sahip bir ökaryot olduğu düşünülmektedir. Daha sonra ilk kırmızı alg kloroplastını kaybettiği ve daha sonra yeşil bir alg yutarak ikinci yeşil alg türevi kloroplastını verdiği düşünülmektedir. ⓘ
Chlorarachniophyte kloroplastları, kloroplast zarlarının bir çift zar halinde kaynaştığı hücre zarı dışında dört zarla sınırlanmıştır. Tilakoidleri üçerli gevşek yığınlar halinde düzenlenmiştir. Chlorarachniophytes, sitoplazmada depoladıkları, genellikle sitoplazmaya doğru çıkıntı yapan kloroplast pirenoidinin etrafında toplanan chrysolaminarin adı verilen bir polisakkarit formuna sahiptir. ⓘ
Chlorarachniophyte kloroplastları, türedikleri yeşil alg tamamen parçalanmadığı için dikkate değerdir - çekirdeği hala ikinci ve üçüncü kloroplast zarları arasında bulunan bir nükleomorf olarak devam eder - yeşil alglerin sitoplazmasına karşılık gelen periplastid boşluk. ⓘ
Prasinofit türevi dinofit kloroplast
Lepidodinium viride ve yakın akrabaları, orijinal peridinin kloroplastını kaybetmiş ve yerine yeşil alg türevi bir kloroplast (daha spesifik olarak bir prasinofit) koymuş dinofitlerdir (aşağıya bakınız). Lepidodinium, rodoplast soyundan gelmeyen bir kloroplasta sahip olan tek dinofittir. Kloroplast iki zarla çevrilidir ve nükleomorfu yoktur - tüm nükleomorf genleri dinofit çekirdeğine aktarılmıştır. Bu kloroplasta yol açan endosimbiyotik olay, üçüncül endosimbiyozdan ziyade seri ikincil endosimbiyozdur - endosimbiont, birincil kloroplast içeren (ikincil bir kloroplast yapan) yeşil bir algdir. ⓘ
Kırmızı alg türevi kloroplastlar
Kriptofitler
Kriptofitler veya kriptomonadlar, kırmızı alg türevi bir kloroplast içeren bir alg grubudur. Kriptofit kloroplastlar, yüzeysel olarak klorarakniyofitlerinkine benzeyen bir nükleomorf içerir. Kriptofit kloroplastlar, en dışta kaba endoplazmik retikulum ile sürekli olan dört zara sahiptir. Kırmızı alg sitoplazmasına karşılık gelen yerde, orijinal çift zarın dışındaki periplastid alanda bulunan granüllerde depolanan sıradan nişastayı sentezlerler. Kriptofit kloroplastlarının içinde bir pirenoid ve ikişerli yığınlar halinde tilakoidler bulunur. ⓘ
Kloroplastlarında fikobilizom yoktur, ancak fikobilin pigmentleri vardır ve bu pigmentleri tilakoid membranlarının dışına sabitlemek yerine tilakoid boşluklarında tutarlar. ⓘ
Kriptofitler, kırmızı alg bazlı kloroplastların yayılmasında kilit bir rol oynamış olabilir. ⓘ

Haptofitler
Haptofitler, kriptofitlere veya heterokontofitlere benzer ve onlarla yakından ilişkilidir. Kloroplastlarında nükleomorf bulunmaz, tilakoidleri üçlü yığınlar halindedir ve kloroplastın tamamen dışında, haptofitin sitoplazmasında depoladıkları krizolaminarin şekeri sentezlerler. ⓘ
Heterokontofitler (stramenopiller)

Stramenopiller olarak da bilinen heterokontofitler, çok büyük ve çeşitli bir ökaryot grubudur. Diyatomlar ve kahverengi algler, altın algler ve sarı-yeşil algleri içeren fotoototrofik soy Ochrophyta, kırmızı alg türevi kloroplastlar da içerir. ⓘ
Heterokont kloroplastlar, bir pirenoid, üçlü tilakoid içeren ve bazı istisnalar dışında, endoplazmik retikuluma bağlı en dıştaki epiplastid membran olan dört katmanlı plastidik zarfa sahip olan haptofit kloroplastlara çok benzer. Haptofitler gibi heterokontofitler de şekeri sitoplazmadaki krizolaminarin granüllerinde depolar. Heterokontofit kloroplastlar klorofil a ve birkaç istisna dışında klorofil c içerir, ancak aynı zamanda onlara birçok renk veren karotenoidlere de sahiptir. ⓘ
Apikompleksanlar, kromeridler ve dinofitler
Alveolatlar, hem ototrofik hem de heterotrofik üyelerden oluşan tek hücreli ökaryotların önemli bir kladıdır. En dikkat çekici ortak özellik kortikal (dış bölge) alveollerin (keseler) varlığıdır. Bunlar, zarın hemen altında sürekli bir katman halinde paketlenmiş ve onu destekleyen, tipik olarak esnek bir pelikül (ince deri) oluşturan düzleştirilmiş keseciklerdir (keseler). Dinoflagellatlarda genellikle zırh plakaları oluştururlar. Birçok üye kırmızı alg türevi bir plastid içerir. Bu çeşitli grubun dikkate değer bir özelliği fotosentezin sık sık kaybolmasıdır. Bununla birlikte, bu heterotrofların çoğunluğu fotosentetik olmayan bir plastidi işlemeye devam eder. ⓘ
- Apikompleksanlar
Apicomplexans bir grup alveolattır. Helicosproidia gibi parazittirler ve fotosentetik olmayan bir kloroplasta sahiptirler. Bir zamanlar helicosproidia ile ilişkili oldukları düşünülüyordu, ancak artık helicosproida'nın CASH soyunun bir parçası olmaktan ziyade yeşil algler olduğu bilinmektedir. Apikompleksanlar arasında sıtma paraziti Plasmodium da bulunmaktadır. Birçok apikompleksan, atalarından miras aldıkları apikoplast adı verilen kırmızı alg türevi körelmiş bir kloroplast bulundurur. Cryptosporidium gibi diğer apikompleksanlar ise kloroplastı tamamen kaybetmiştir. Apikompleksanlar fotosentetik olmamalarına rağmen enerjilerini sitoplazmalarında bulunan amilopektin granüllerinde depolarlar. ⓘ
Apikoplastlar tüm fotosentetik işlevlerini kaybetmişlerdir ve fotosentetik pigmentler ya da gerçek tilakoidler içermezler. Dört membranla sınırlanmışlardır, ancak membranlar endoplazmik retikuluma bağlı değildir. Apikompleksanların fotosentetik olmayan kloroplastlarını hala etrafta tutmaları, kloroplastın fotosentez dışında önemli işlevleri nasıl yerine getirdiğini göstermektedir. Bitki kloroplastları bitki hücrelerine şekerin yanı sıra birçok önemli şey sağlar ve apikoplastlar da farklı değildir - yağ asitleri, izopentenil pirofosfat, demir-kükürt kümeleri sentezler ve hem yolunun bir kısmını gerçekleştirirler. Bu da apikoplastı apikompleksanlarla ilişkili hastalıkları tedavi edecek ilaçlar için cazip bir hedef haline getirmektedir. En önemli apikoplast işlevi izopentenil pirofosfat sentezidir - aslında, bir şey bu apikoplast işlevine müdahale ettiğinde apikompleksanlar ölür ve apikompleksanlar izopentenil pirofosfat açısından zengin bir ortamda yetiştirildiklerinde organeli terk ederler. ⓘ
- Kromeridler
Chromerida, Avustralya mercanlarında yeni keşfedilen ve apikompleksanların bazı yakın fotosentetik akrabalarını içeren bir alg grubudur. İlk üye olan Chromera velia 2001 yılında keşfedilmiş ve ilk kez izole edilmiştir. Apikompleksanlara benzer bir yapıya sahip olan Chromera velia'nın keşfi, apikompleksanlar ve dinofitlerin evrimsel tarihinde önemli bir bağlantı sağlamaktadır. Plastidleri dört zara sahiptir, klorofil c'den yoksundur ve yatay bir transfer olayından elde edilen RuBisCO'nun tip II formunu kullanır. ⓘ
- Dinofitler
Dinoflagellatlar, yaklaşık yarısı (en azından kısmen) fotosentetik olan bir başka çok büyük ve çeşitli protist grubudur. ⓘ
Çoğu dinofit kloroplastı ikincil kırmızı alg türevi kloroplastlardır. Diğer birçok dinofit kloroplastını kaybetmiş (fotosentetik olmayan bir dinoflagellat türü haline gelmiştir) ya da üçüncül endosimbiyoz (kırmızı alg türevi kloroplast içeren başka bir ökaryotik alg tarafından yutulma) yoluyla değiştirmiştir. Diğerleri ise orijinal kloroplastlarını yeşil alg türevi bir kloroplast ile değiştirmiştir. ⓘ
Çoğu dinofit kloroplastı form II RuBisCO, en azından fotosentetik pigmentler klorofil a, klorofil c2, beta-karoten ve en az bir dinofite özgü ksantofil (peridinin, dinoxanthin veya diadinoxanthin) içerir ve bu da çoğuna altın-kahverengi bir renk verir. Tüm dinofitler sitoplazmalarında nişasta depolar ve çoğunda üçlü yığınlar halinde düzenlenmiş tilakoidlere sahip kloroplastlar bulunur. ⓘ

En yaygın dinofit kloroplastı, kloroplastlarında klorofil a ve klorofil c2 ile birlikte karotenoid pigment peridinin ile karakterize edilen peridinin tipi kloroplasttır. Peridinin başka hiçbir kloroplast grubunda bulunmaz. Peridinin kloroplastı, kırmızı alg endosimbiontunun orijinal hücre zarını kaybetmiş olan üç zarla (bazen iki) sınırlanmıştır. En dıştaki zar endoplazmik retikuluma bağlı değildir. Bir pirenoid içerirler ve üçlü yığılmış tilakoidlere sahiptirler. Nişasta kloroplastın dışında bulunur. Bu kloroplastların önemli bir özelliği, kloroplast DNA'larının oldukça azalmış ve birçok küçük halkaya parçalanmış olmasıdır. Genomun çoğu çekirdeğe göç etmiştir ve kloroplastta sadece fotosentezle ilgili kritik genler kalmıştır. ⓘ
Peridinin kloroplastının dinofitlerin "orijinal" kloroplastı olduğu düşünülmektedir; bu kloroplast diğer birçok dinofit soyunda kaybolmuş, indirgenmiş, değiştirilmiş veya şirketleşmiştir. ⓘ
Fukoksantin içeren (haptofit türevi) dinofit kloroplastları

Fukoksantin dinofit soyları (Karlodinium ve Karenia dahil) orijinal kırmızı alg türevi kloroplastlarını kaybetmiş ve bunun yerine bir haptofit endosimbiontundan türetilen yeni bir kloroplast kullanmıştır. Karlodinium ve Karenia muhtemelen farklı heterokontofitler almıştır. Haptofit kloroplastı dört zara sahip olduğundan, üçüncül endosimbiyozun haptofitin hücre zarını ve dinofitin fagozomal vakuolünü ekleyerek altı zarlı bir kloroplast oluşturması beklenirdi. Ancak haptofit büyük ölçüde küçülmüş, birkaç zarı ve çekirdeği alınmış, geriye sadece kloroplastı (orijinal çift zarı ile) ve muhtemelen etrafında bir veya iki ek zar kalmıştır. ⓘ
Fukoksantin içeren kloroplastlar, fukoksantin pigmentine (aslında 19′-hekzanoiloksi-fukoksantin ve/veya 19′-bütanoiloksi-fukoksantin) sahip olmaları ve peridinin içermemeleri ile karakterize edilir. Fukoksantin ayrıca haptofit kloroplastlarında da bulunur ve bu da atalara dair kanıt sağlar. ⓘ

Diyatom türevi dinofit kloroplastları
Kryptoperidinium ve Durinskia gibi bazı dinofitlerin diyatom (heterokontofit) türevi bir kloroplastı vardır. Bu kloroplastlar beş zarla sınırlandırılmıştır (diatom endosimbiontunun tamamının mı yoksa sadece içindeki kırmızı alg türevi kloroplastın mı kloroplast olarak sayıldığına bağlı olarak). Diyatome endosimbiontu nispeten çok az küçültülmüştür - orijinal mitokondrilerini hala korumaktadır ve endoplazmik retikulum, ribozomlar, bir çekirdek ve tabii ki kırmızı alg türevi kloroplastlara sahiptir - pratik olarak tam bir hücre, hepsi de konağın endoplazmik retikulum lümeninin içindedir. Ancak diyatome endosimbiontu kendi besinini depolayamaz; bunun yerine depolama polisakkariti dinofit konağın sitoplazmasındaki granüllerde bulunur. Diyatom endosimbiontunun çekirdeği mevcuttur, ancak muhtemelen nükleomorf olarak adlandırılamaz çünkü genom azalması belirtisi göstermez ve hatta genişlemiş olabilir. Diyatomlar dinoflagellatlar tarafından en az üç kez yutulmuştur. ⓘ
Diyatom endosimbiontu tek bir zarla sınırlanmıştır, içinde dört zarlı kloroplastlar bulunur. Diyatom endosimbiontunun diyatom atası gibi, kloroplastlar da üçlü tilakoidlere ve pirenoidlere sahiptir. ⓘ
Bu cinslerin bazılarında, diatom endosimbiontunun kloroplastları dinofitteki tek kloroplast değildir. Orijinal üç membranlı peridinin kloroplastı, bir göz lekesine dönüştürülmüş olarak hala mevcuttur. ⓘ
Kleptoplasti
Bazı dinoflagellatlar (örneğin Dinophysis) gibi bazı miksotrofik protist gruplarında, kloroplastlar yakalanan bir algden ayrılır ve geçici olarak kullanılır. Bu klepto kloroplastlar sadece birkaç günlük bir ömre sahip olabilir ve daha sonra değiştirilir. ⓘ
Kriptofit türevi dinofit kloroplast
Dinophysis cinsinin üyeleri bir kriptofitten alınmış fikobilin içeren bir kloroplasta sahiptir. Bununla birlikte, kriptofit bir endosimbiyon değildir - sadece kloroplast alınmış gibi görünmektedir ve kloroplast nükleomorfundan ve en dıştaki iki zarından sıyrılmış, geriye sadece iki zarlı bir kloroplast kalmıştır. Kriptofit kloroplastlar kendilerini korumak için nükleomorflarına ihtiyaç duyar ve hücre kültüründe tek başına yetiştirilen Dinophysis türleri hayatta kalamaz, bu nedenle Dinophysis kloroplastının bir kleptoplast olması mümkündür (ancak doğrulanmamıştır) - eğer öyleyse, Dinophysis kloroplastları yıpranır ve Dinophysis türleri eskilerinin yerine yeni kloroplastlar elde etmek için sürekli olarak kriptofitleri yutmalıdır. ⓘ
Kloroplast DNA'sı
Kloroplastlar, diğer plastid türleri gibi, hücre çekirdeğindekinden ayrı bir genom içerir. Kloroplast DNA'sının (cpDNA) varlığı 1959 yılında biyokimyasal olarak tanımlanmış ve 1962 yılında elektron mikroskobu ile doğrulanmıştır. Kloroplastın ribozom içerdiğinin ve protein sentezi yaptığının keşfedilmesi, kloroplastın genetik olarak yarı otonom olduğunu ortaya koymuştur. Kloroplast DNA'sı ilk kez 1986 yılında dizilenmiştir. O zamandan bu yana, çeşitli türlerden yüzlerce kloroplast DNA'sı dizilenmiştir, ancak bunlar çoğunlukla kara bitkileri ve yeşil alglere aittir - glaucophytes, kırmızı algler ve diğer alg grupları son derece az temsil edilmektedir ve potansiyel olarak "tipik" kloroplast DNA yapısı ve içeriği görüşlerinde bazı önyargılar ortaya çıkarmaktadır. ⓘ
Moleküler yapı

proteinler
Birkaç istisna dışında, çoğu kloroplastın tüm kloroplast genomu, tipik olarak 120.000-170.000 baz çifti uzunluğunda tek bir büyük dairesel DNA molekülünde birleştirilmiştir. Yaklaşık 30-60 mikrometre kontur uzunluğuna sahip olabilirler ve yaklaşık 80-130 milyon daltonluk bir kütleye sahiptirler. ⓘ
Genellikle dairesel bir molekül olarak düşünülse de, kloroplast DNA moleküllerinin daha sık doğrusal bir şekil aldığına dair bazı kanıtlar vardır. ⓘ
Ters çevrilmiş tekrarlar
Birçok kloroplast DNA'sı, uzun bir tek kopya bölümünü (LSC) kısa bir tek kopya bölümünden (SSC) ayıran iki ters çevrilmiş tekrar içerir. Belirli bir ters çevrilmiş tekrar çifti nadiren tamamen aynı olsa da, görünüşe göre uyumlu evrimin bir sonucu olarak her zaman birbirlerine çok benzerler. ⓘ
Ters çevrilmiş tekrarların uzunluğu çılgınca değişir; her biri 4.000 ila 25.000 baz çifti uzunluğundadır ve dört kadar az veya 150'den fazla gen içerir. Bitkilerdeki ters çevrilmiş tekrarlar, her biri 20.000-25.000 baz çifti uzunluğunda olmak üzere bu aralığın üst ucunda olma eğilimindedir. ⓘ
Ters çevrilmiş tekrar bölgeleri kara bitkileri arasında yüksek oranda korunur ve az sayıda mutasyon biriktirir. Benzer ters çevrilmiş tekrarlar siyanobakterilerin ve diğer iki kloroplast soyunun (glaucophyta ve rhodophyceae) genomlarında da mevcuttur, bu da kloroplasttan önce var olduklarını düşündürmektedir, ancak bazı kloroplast DNA'ları o zamandan beri ters çevrilmiş tekrarları kaybetmiş veya ters çevirmiştir (onları doğrudan tekrarlar haline getirmiştir). Ters çevrilmiş tekrarların kloroplast genomunun geri kalanını stabilize etmeye yardımcı olması mümkündür, çünkü ters çevrilmiş tekrar segmentlerinin bir kısmını kaybeden kloroplast DNA'ları daha fazla yeniden düzenlenme eğilimindedir. ⓘ
Nükleoidler
Yeni kloroplastlar DNA'larının 100'e kadar kopyasını içerebilir, ancak kloroplastlar yaşlandıkça kloroplast DNA kopyalarının sayısı yaklaşık 15-20'ye düşer. Genellikle birkaç özdeş kloroplast DNA halkası içerebilen nükleoidler halinde paketlenirler. Her kloroplastta birçok nükleoid bulunabilir. İlkel kırmızı alglerde kloroplast DNA nükleoidleri kloroplastın merkezinde kümelenirken, yeşil bitkiler ve yeşil alglerde nükleoidler stroma boyunca dağılmıştır. ⓘ
Kloroplast DNA'sı gerçek histonlarla ilişkili olmasa da, kırmızı alglerde her bir kloroplast DNA halkasını bir nükleoid içine sıkıca paketleyen benzer proteinler bulunmuştur. ⓘ
DNA onarımı
Yosun Physcomitrella patens'in kloroplastlarında, DNA uyumsuzluk onarım proteini Msh1, kloroplast genom stabilitesini korumak için rekombinasyonel onarım proteinleri RecA ve RecG ile etkileşime girer. Arabidopsis thaliana bitkisinin kloroplastlarında RecA proteini, muhtemelen DNA hasarının rekombinasyonel onarımını içeren bir süreçle kloroplastın DNA'sının bütünlüğünü korur. ⓘ
DNA replikasyonu

Kloroplast DNA (cpDNA) replikasyon mekanizması kesin olarak belirlenmemiştir, ancak iki ana model önerilmiştir. Bilim insanları 1970'lerden beri elektron mikroskobu aracılığıyla kloroplast replikasyonunu gözlemlemeye çalışmaktadır. Mikroskopi deneylerinin sonuçları, kloroplast DNA'sının bir çift yer değiştirme döngüsü (D-loop) kullanarak çoğaldığı fikrine yol açmıştır. D-loop dairesel DNA boyunca hareket ederken, Cairns replikasyon ara maddesi olarak da bilinen bir teta ara formunu benimser ve replikasyonu yuvarlanan bir daire mekanizması ile tamamlar. Transkripsiyon belirli orijin noktalarında başlar. Çoklu replikasyon çatalları açılarak replikasyon makinelerinin DNA'yı transkribe etmesine izin verir. Replikasyon devam ettikçe çatallar büyür ve sonunda birleşir. Yeni cpDNA yapıları ayrılarak yavru cpDNA kromozomlarını oluşturur. ⓘ
İlk mikroskopi deneylerine ek olarak, bu model cpDNA'da görülen deaminasyon miktarlarıyla da desteklenmektedir. Deaminasyon, bir amino grubu kaybolduğunda meydana gelir ve genellikle baz değişiklikleriyle sonuçlanan bir mutasyondur. Adenin deamine edildiğinde hipoksantin haline gelir. Hipoksantin sitozine bağlanabilir ve XC baz çifti çoğaldığında GC'ye dönüşür (dolayısıyla A → G baz değişimi). ⓘ

cpDNA'da birkaç A → G deaminasyon gradyanı vardır. DNA tek sarmallı olduğunda deaminasyon olaylarına duyarlı hale gelir. Replikasyon çatalları oluştuğunda, kopyalanmayan iplik tek sarmallıdır ve bu nedenle A → G deaminasyon riski altındadır. Bu nedenle, deaminasyondaki gradyanlar, replikasyon çatallarının büyük olasılıkla mevcut olduğunu ve başlangıçta açıldıkları yönü gösterir (en yüksek gradyan büyük olasılıkla başlangıç bölgesine en yakındır, çünkü en uzun süre boyunca tek sarmallıydı). Bu mekanizma bugün hala önde gelen teoridir; ancak ikinci bir teori cpDNA'nın çoğunun aslında doğrusal olduğunu ve homolog rekombinasyon yoluyla replike olduğunu öne sürer. Ayrıca, genetik materyalin yalnızca küçük bir kısmının dairesel kromozomlarda tutulduğunu, geri kalanının ise dallanmış, doğrusal veya diğer karmaşık yapılarda olduğunu iddia etmektedir. ⓘ
cpDNA replikasyonu için rekabet eden modellerden biri, çoğu cpDNA'nın doğrusal olduğunu ve bakteriyofaj T4'ün doğrusal ve dairesel DNA yapılarına benzer homolog rekombinasyon ve replikasyon yapılarına katıldığını ileri sürer. Mısır gibi bazı bitkilerin doğrusal cpDNA'ya sahip olduğu ve daha fazla türün bilim insanlarının henüz anlayamadığı karmaşık yapılar içerdiği tespit edilmiştir. cpDNA üzerinde orijinal deneyler yapıldığında, bilim insanları doğrusal yapılar fark ettiler; ancak bu doğrusal formları kırık dairelere atfettiler. Eğer cpDNA deneylerinde görülen dallanmış ve karmaşık yapılar gerçekse ve birleştirilmiş dairesel DNA'nın ya da kırık dairelerin eserleri değilse, o zaman bir D-döngüsü replikasyon mekanizması bu yapıların nasıl replike olacağını açıklamak için yetersizdir. Aynı zamanda, homolog rekombinasyon plastomlarda görülen çoklu A --> G gradyanlarını genişletmez. Deaminasyon gradyanını açıklamadaki başarısızlık ve dairesel cpDNA'ya sahip olduğu gösterilen çok sayıda bitki türü nedeniyle, baskın teori çoğu cpDNA'nın dairesel olduğu ve büyük olasılıkla bir D döngü mekanizması yoluyla çoğaldığı yönündedir. ⓘ
Gen içeriği ve protein sentezi
Kloroplast genomu, çoğunlukla protein boru hattı ve fotosentez ile ilgili çeşitli şeyleri kodlayan yaklaşık 100 gen içerir. Prokaryotlarda olduğu gibi, kloroplast DNA'sındaki genler operonlar halinde düzenlenir. Prokaryotik DNA moleküllerinin aksine, kloroplast DNA molekülleri intronlar içerir (bitki mitokondriyal DNA'ları da içerir, ancak insan mtDNA'ları içermez). ⓘ
Kara bitkileri arasında kloroplast genomunun içeriği oldukça benzerdir. ⓘ
Kloroplast genomunun indirgenmesi ve gen aktarımı
Zamanla, kloroplast genomunun birçok parçası, endosimbiyotik gen transferi adı verilen bir süreçle konağın nükleer genomuna aktarılmıştır. Sonuç olarak, kloroplast genomu serbest yaşayan siyanobakterilerinkine kıyasla büyük ölçüde azalmıştır. Kloroplastlar 60-100 gen içerebilirken, siyanobakterilerin genomlarında genellikle 1500'den fazla gen bulunur. Yakın zamanda, genomu olmayan bir plastid bulunmuş, bu da kloroplastların endosimbiyotik gen transferi sürecinde genomlarını kaybedebileceğini göstermiştir. ⓘ
Endosimbiyotik gen transferi, birçok CASH soyundaki kayıp kloroplastları bilmemizin yoludur. Bir kloroplast sonunda kaybolsa bile, eski konakçısının çekirdeğine bağışladığı genler varlığını sürdürür ve kayıp kloroplastın varlığına dair kanıt sağlar. Örneğin, diyatomlar (bir heterokontofit) artık kırmızı alg türevi bir kloroplasta sahipken, diyatom çekirdeğindeki birçok yeşil alg geninin varlığı, diyatom atasının bir noktada yeşil alg türevi bir kloroplasta sahip olduğuna ve daha sonra bunun yerini kırmızı kloroplastın aldığına dair kanıt sağlar. ⓘ
Kara bitkilerinde, çekirdeklerindeki DNA'nın yaklaşık %11-14'ü, Arabidopsis'te %18'e kadar, yaklaşık 4.500 protein kodlayan gene karşılık gelen kloroplasta kadar izlenebilir. Yakın zamanda kara bitkilerinde kloroplast DNA'sından nükleer genoma birkaç gen aktarımı olmuştur. ⓘ
Kloroplastlarda bulunan yaklaşık 3000 proteinin yaklaşık %95'i nükleer genler tarafından kodlanır. Kloroplastın protein komplekslerinin çoğu, hem kloroplast genomundan hem de konakçının nükleer genomundan gelen alt birimlerden oluşur. Sonuç olarak, protein sentezi kloroplast ve çekirdek arasında koordine edilmelidir. Kloroplast çoğunlukla nükleer kontrol altındadır, ancak kloroplastlar retrograd sinyalizasyon adı verilen çekirdekteki gen ifadesini düzenleyen sinyaller de verebilir. ⓘ
Protein sentezi
Kloroplastlar içindeki protein sentezi iki RNA polimeraza dayanır. Biri kloroplast DNA'sı tarafından kodlanır, diğeri ise nükleer kökenlidir. İki RNA polimeraz, kloroplast genomu içindeki farklı promotör türlerini tanıyabilir ve bunlara bağlanabilir. Kloroplastlardaki ribozomlar bakteriyel ribozomlara benzer. ⓘ
Protein hedefleme ve içe aktarma
Pek çok kloroplast geni çekirdeğe taşındığı için, başlangıçta kloroplastta çevrilecek olan pek çok protein artık bitki hücresinin sitoplazmasında sentezlenmektedir. Bu proteinler kloroplasta geri yönlendirilmeli ve en az iki kloroplast zarından geçirilmelidir. ⓘ
İlginçtir ki, aktarılan genlerin protein ürünlerinin yaklaşık yarısı kloroplasta geri hedeflenmemiştir bile. Birçoğu hücre bölünmesine katılma, protein yönlendirme ve hatta hastalık direnci gibi yeni işlevler üstlenerek eksaptasyon haline geldi. Birkaç kloroplast geni mitokondriyal genomda yeni evler bulmuştur; birkaç tRNA geni hâlâ mitokondriyonda çalışsa da çoğu işlevsiz psödogenler haline gelmiştir. Aktarılan bazı kloroplast DNA protein ürünleri salgı yoluna yönlendirilir, ancak birçok ikincil plastid, konağın hücre zarından türetilen en dıştaki bir zarla sınırlanır ve bu nedenle topolojik olarak hücrenin dışındadır, çünkü sitozolden kloroplasta ulaşmak için hücre zarının geçilmesi gerekir, bu da hücre dışı boşluğa giriş anlamına gelir. Bu durumlarda, kloroplast hedefli proteinler başlangıçta salgı yolu boyunca ilerler. ⓘ
Bir kloroplast edinen hücre zaten mitokondriye (ve peroksizomlara ve salgı için bir hücre zarına) sahip olduğundan, yeni kloroplast konağı, kloroplast proteinlerinin yanlış organele gönderilmesini önlemek için benzersiz bir protein hedefleme sistemi geliştirmek zorundaydı. ⓘ

Her durumda olmasa da çoğu durumda, nükleer kodlu kloroplast proteinleri, protein öncüsünün N terminaline eklenen bölünebilir bir transit peptit ile çevrilir. Bazen transit dizisi proteinin C-terminusunda veya proteinin fonksiyonel kısmında bulunur. ⓘ
Taşıma proteinleri ve membran translokonları
Bir kloroplast polipeptidi sitozoldeki bir ribozom üzerinde sentezlendikten sonra, kloroplast proteinlerine özgü bir enzim fosforile olur veya geçiş dizilerinde birçoğuna (hepsine değil) bir fosfat grubu ekler. Fosforilasyon, birçok proteinin polipeptidi bağlamasına yardımcı olarak erken katlanmasını önler. Bu önemlidir çünkü kloroplast proteinlerinin aktif formlarını almalarını ve kloroplast işlevlerini yanlış yerde (sitozolde) yerine getirmelerini önler. Aynı zamanda, kloroplast tarafından tanınabilmeleri için yeterli şekli korumaları gerekir. Bu proteinler ayrıca polipeptidin kloroplast içine alınmasına da yardımcı olur. ⓘ
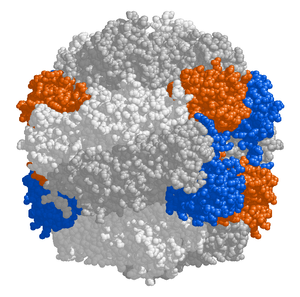
Buradan, stromaya bağlanan kloroplast proteinleri iki protein kompleksinden geçmelidir - dış kloroplast zarındaki TOC kompleksi veya translokon ve iç kloroplast zarındaki TIC translokon veya translokon. Kloroplast polipeptit zincirleri muhtemelen aynı anda iki kompleksten geçer, ancak TIC kompleksi de zarlar arası boşlukta kaybolan preproteinleri geri alabilir. ⓘ
Yapı
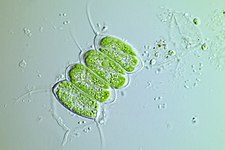
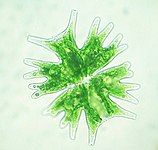
Kara bitkilerinde kloroplastlar genellikle mercek şeklinde, 3-10 μm çapında ve 1-3 μm kalınlığındadır. Mısır fidesi kloroplastları ≈20 µm3 hacmindedir. Kloroplast şekillerinde daha fazla çeşitlilik, genellikle bir ağ (örneğin Oedogonium), bir fincan (örneğin Chlamydomonas), hücrenin kenarlarında şerit benzeri bir spiral (örneğin Spirogyra) veya hücre kenarlarında hafifçe bükülmüş bantlar (örneğin Sirogonium) şeklinde olabilen tek bir kloroplast içeren algler arasında mevcuttur. Bazı alglerin her hücresinde iki kloroplast bulunur; bunlar Zygnema'da yıldız şeklindedir veya Desmidiales takımında hücrenin yarısının şeklini alabilir. Bazı alglerde kloroplast, çekirdek ve diğer organeller için ceplerle birlikte hücrenin çoğunu kaplar, örneğin bazı Chlorella türlerinde hücrenin çoğunu kaplayan fincan şeklinde bir kloroplast vardır. ⓘ
Tüm kloroplastlar en az üç membran sistemine sahiptir - dış kloroplast membranı, iç kloroplast membranı ve tilakoid sistem. İkincil endosimbiyoz ürünü olan kloroplastlar bu üçünü çevreleyen ek zarlara sahip olabilir. Dış ve iç kloroplast zarlarının içinde, bir kloroplastın hacminin çoğunu oluşturan ve içinde tilakoid sistemin yüzdüğü yarı jel benzeri bir sıvı olan kloroplast stroması bulunur. ⓘ

(lameller veya perdeler)
(DNA halkaları)
Dış ve iç kloroplast membranları hakkında bazı yaygın yanlış anlamalar vardır. Kloroplastların çift zarla çevrili olması, genellikle endosimbiyotik siyanobakterilerin torunları olduklarının kanıtı olarak gösterilir. Bu genellikle dış kloroplast zarının, atasal siyanobakteriyi çevrelemek için bir kesecik oluşturmak üzere konakçının hücre zarının katlanmasının bir ürünü olduğu şeklinde yorumlanır - ki bu doğru değildir - her iki kloroplast zarı da siyanobakterinin orijinal çift zarıyla homologdur. ⓘ
Kloroplast çift zarı sıklıkla mitokondriyal çift zarla da karşılaştırılır. Bu geçerli bir karşılaştırma değildir - iç mitokondri zarı proton pompalarını çalıştırmak ve ATP enerjisi üretmek için oksidatif fosforilasyonu gerçekleştirmek için kullanılır. Buna benzer olarak kabul edilebilecek tek kloroplast yapısı iç tilakoid sistemdir. Öyle olsa bile, "giriş-çıkış" açısından, kloroplast H+ iyon akışının yönü mitokondrideki oksidatif fosforilasyona kıyasla ters yöndedir. Ayrıca işlev açısından metabolit geçişini düzenleyen ve bazı maddeleri sentezleyen iç kloroplast zarının mitokondride karşılığı yoktur. ⓘ
Dış kloroplast zarı
Dış kloroplast zarı, küçük moleküllerin ve iyonların kolayca difüze olabildiği yarı gözenekli bir zardır. Bununla birlikte, daha büyük proteinler için geçirgen değildir, bu nedenle hücre sitoplazmasında sentezlenen kloroplast polipeptitleri, TOC kompleksi veya dış kloroplast membranındaki translokon tarafından dış kloroplast membranı boyunca taşınmalıdır. ⓘ
Kloroplast membranları bazen sitoplazmaya doğru çıkıntı yaparak bir stromül veya stroma içeren tübül oluşturur. Stromüller kloroplastlarda çok nadirdir ve sırasıyla taç yapraklar ve köklerdeki kromoplastlar ve amiloplastlar gibi diğer plastidlerde çok daha yaygındır. Membranlar arası taşıma için kloroplastın yüzey alanını artırmak için var olabilirler, çünkü genellikle dallanmış ve endoplazmik retikulum ile karışmışlardır. İlk kez 1962 yılında gözlemlendiklerinde, bazı bitki biyologları stromüllerin daralmış bölgelere sahip garip şekilli kloroplastlar veya bölünen kloroplastlar olduğunu iddia ederek yapıları yapay olarak reddetmiştir. Bununla birlikte, stromüllerin bitki hücresi plastidlerinin işlevsel, ayrılmaz özellikleri olduğuna, yalnızca yapay olmadığına dair giderek artan sayıda kanıt bulunmaktadır. ⓘ
Membranlar arası boşluk ve peptidoglikan duvar
Genellikle, dış ve iç kloroplast membranları arasında yaklaşık 10-20 nanometre kalınlığında ince bir intermembran boşluk bulunur. ⓘ
Glaucophyte alg kloroplastları, kloroplast membranları arasında bir peptidoglikan tabakasına sahiptir. Bu, siyanobakteriyel atalarının iki hücre zarı arasında bulunan peptidoglikan hücre duvarına karşılık gelir. Bu kloroplastlara muroplast denir (Latince "mura "dan gelir, "duvar" anlamına gelir). Diğer kloroplastlar siyanobakteriyel duvarı kaybederek iki kloroplast zarf zarı arasında bir zarlar arası boşluk bırakmıştır. ⓘ
İç kloroplast zarı
İç kloroplast membranı stromayı sınırlar ve materyallerin kloroplast içine ve dışına geçişini düzenler. Dış kloroplast zarındaki TOC kompleksinden geçtikten sonra, polipeptitler iç kloroplast zarında bulunan TIC kompleksinden (iç kloroplast zarındaki translokon) geçmelidir. ⓘ
İç kloroplast zarı, materyallerin geçişini düzenlemenin yanı sıra yağ asitlerinin, lipitlerin ve karotenoidlerin sentezlendiği yerdir. ⓘ
Periferik retikulum
Bazı kloroplastlar, kloroplast periferik retikulum adı verilen bir yapı içerir. Genellikle C4 bitkilerinin kloroplastlarında bulunur, ancak bazı C3 angiospermlerinde ve hatta bazı gymnospermlerde de bulunmuştur. Kloroplast periferik retikulumu, kloroplastın iç stromal sıvısına uzanan iç kloroplast membranı ile sürekli olan membranöz tüpler ve veziküllerden oluşan bir labirentten oluşur. Amacının, kloroplastın stroması ile hücre sitoplazması arasındaki çapraz membran taşınımı için yüzey alanını artırmak olduğu düşünülmektedir. Bazen gözlenen küçük veziküller, tylakoidler ve zarlar arası boşluk arasında malzeme taşımak için taşıma vezikülleri olarak hizmet edebilir. ⓘ
Stroma
İç kloroplast zarı içindeki ve tilakoid boşluğun dışındaki protein bakımından zengin, alkali, sulu sıvıya stroma denir ve bu sıvı orijinal siyanobakterinin sitozolüne karşılık gelir. Kloroplast DNA'sının nükleoidleri, kloroplast ribozomları, plastoglobuli içeren thylakoid sistem, nişasta granülleri ve birçok protein içinde yüzer halde bulunabilir. CO2'yi G3P'ye sabitleyen Calvin döngüsü stromada gerçekleşir. ⓘ
Kloroplast ribozomları
Kloroplastlar, proteinlerinin küçük bir kısmını sentezlemek için kullandıkları kendi ribozomlarına sahiptir. Kloroplast ribozomları sitoplazmik ribozomların yaklaşık üçte ikisi büyüklüğündedir (yaklaşık 17 nm'ye karşılık 25 nm). Kloroplast DNA'sından kopyalanan mRNA'ları alır ve bunları proteine çevirirler. Bakteriyel ribozomlara benzemekle birlikte, kloroplast translasyonu bakterilerdekinden daha karmaşıktır, bu nedenle kloroplast ribozomları kloroplasta özgü bazı özellikler içerir. ⓘ
Birkaç Chlorophyta ve öglenid kloroplastındaki küçük alt birim ribozomal RNA'lar, çoğu kloroplast ve prokaryotta translasyonun başlatılması için gerekli olduğu düşünülen Shine-Dalgarno dizi tanıma motiflerinden yoksundur. Bu tür bir kayıp diğer plastidlerde ve prokaryotlarda da nadiren görülür. 23S'nin 3' kuyruğuna homolojisi olan ek bir 4.5S rRNA "yüksek" bitkilerde bulunur. ⓘ
Plastoglobuli
Plastoglobuli (tekil plastoglobulus, bazen plastoglobule(s) olarak yazılır), yaklaşık 45-60 nanometre çapında küresel lipid ve protein kabarcıklarıdır. Bir lipit tek tabakası ile çevrilidirler. Plastoglobuli tüm kloroplastlarda bulunur, ancak kloroplast oksidatif stres altında olduğunda veya yaşlanıp gerontoplasta dönüştüğünde daha yaygın hale gelir. Plastoglobuller ayrıca bu koşullar altında daha büyük bir boyut varyasyonu sergiler. Etiyoplastlarda da yaygındırlar, ancak etiyoplastlar kloroplastlara dönüştükçe sayıları azalır. ⓘ
Plastoglubuli hem yapısal proteinler hem de lipid sentezi ve metabolizmasında rol oynayan enzimler içerir. Plastokinon, E vitamini, karotenoidler ve klorofiller dahil olmak üzere birçok lipit türü içerirler. ⓘ
Plastoglobulusların bir zamanlar stromada serbestçe yüzdüğü düşünülüyordu, ancak şimdi ya bir tilakoide ya da bir tilakoide bağlı başka bir plastoglobulusa kalıcı olarak bağlı oldukları düşünülmektedir; bu, bir plastoglobulusun içeriğini tilakoid ağ ile değiştirmesine izin veren bir konfigürasyondur. Normal yeşil kloroplastlarda, plastoglobulusların büyük çoğunluğu tekil olarak oluşur ve doğrudan ana tilakoidlerine bağlanır. Yaşlı veya stresli kloroplastlarda, plastoglobuluslar bağlantılı gruplar veya zincirler halinde oluşma eğilimindedir, yine de her zaman bir tilakoide demirlenir. ⓘ
Plastoglobuluslar, tilakoid membranın lipid çift tabakasının katmanları arasında bir kabarcık oluştuğunda veya mevcut plastoglubulustan tomurcuklandığında oluşur; ancak bunlar asla ayrılmaz ve stromaya doğru süzülmez. Pratik olarak tüm plastoglobuluslar, tilakoid disklerin veya tabakaların oldukça kavisli kenarlarında veya yakınında oluşur. Ayrıca stromal thylakoidlerde granal olanlardan daha yaygındırlar. ⓘ
Nişasta granülleri
Nişasta granülleri kloroplastlarda çok yaygındır, tipik olarak organel hacminin %15'ini kaplar, ancak amiloplastlar gibi diğer bazı plastidlerde organelin şeklini bozacak kadar büyük olabilirler. Nişasta granülleri basitçe stromadaki nişasta birikimleridir ve bir zarla sınırlandırılmamıştır. ⓘ
Nişasta granülleri, kloroplast şeker sentezledikçe gün boyunca ortaya çıkar ve büyür ve geceleri solunumu beslemek ve floeme şeker ihracatını sürdürmek için tüketilir, ancak olgun kloroplastlarda bir nişasta granülünün tamamen tüketilmesi veya yeni bir granülün birikmesi nadirdir. ⓘ
Nişasta granülleri, farklı kloroplast soyları arasında bileşim ve konum bakımından farklılık gösterir. Kırmızı alglerde nişasta granülleri kloroplasttan ziyade sitoplazmada bulunur. C4 bitkilerinde, şeker sentezlemeyen mezofil kloroplastlar nişasta granüllerinden yoksundur. ⓘ
RuBisCO
Kloroplast stroması birçok protein içerir, ancak en yaygın ve önemli olanı RuBisCO'dur ve muhtemelen gezegendeki en bol protein de budur. RuBisCO, CO2'yi şeker moleküllerine sabitleyen enzimdir. C3 bitkilerinde RuBisCO tüm kloroplastlarda bol miktarda bulunurken, C4 bitkilerinde Calvin döngüsünün gerçekleştirildiği demet kılıfı kloroplastlarıyla sınırlıdır. ⓘ
Pirenoidler
Bazı hornwort ve alglerin kloroplastları pirenoid adı verilen yapılar içerir. Yüksek bitkilerde bulunmazlar. Pirenoidler, kabaca küresel ve yüksek derecede kırılgan cisimler olup, bunları içeren bitkilerde nişasta birikiminin bir bölgesidir. İki yarım küre nişasta plakası ile çevrili, elektronlara karşı opak bir matristen oluşurlar. Pirenoidler olgunlaştıkça nişasta birikir. Karbon yoğunlaştırma mekanizmalarına sahip alglerde RuBisCO enzimi pirenoidlerde bulunur. CO2 az olduğunda pirenoidlerin etrafında nişasta da birikebilir. Pirenoidler yeni pirenoidler oluşturmak için bölünebilir veya "de novo" üretilebilir. ⓘ
Tilakoid sistem

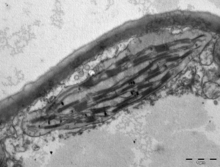
(Üstte) Bir marul kloroplastının 10 nm kalınlığında STEM tomografik kesiti. Grana yığınları, "stroma lamelleri" olarak adlandırılan yığılmamış stromal tilakoidler ile birbirine bağlanır. Tilakoidlerle ilişkili yuvarlak kapanımlar plastoglobüllerdir. Ölçek çubuğu = 200 nm. Bkz.
(Altta) STEM tarafından tomografik rekonstrüksiyonların segmentasyonundan oluşturulan büyük ölçekli 3D model. grana = sarı; stroma lamelleri = yeşil; plastoglobüller = mor; kloroplast zarfı = mavi. Bkz. ⓘ
Thylakoidler (bazen thylakoïds olarak da yazılır), fotosentezin ışık reaksiyonlarının gerçekleştiği membranları içeren birbirine bağlı küçük keselerdir. Thylakoid kelimesi Yunanca "çuval" anlamına gelen thylakos kelimesinden gelmektedir. ⓘ
Kloroplast stroması içinde asılı duran thylakoid sistemi, klorofilin bulunduğu ve fotosentezin ışık reaksiyonlarının gerçekleştiği thylakoid adı verilen membranöz çuvalların oldukça dinamik bir koleksiyonudur. Çoğu vasküler bitki kloroplastında, tilakoidler grana adı verilen yığınlar halinde düzenlenmiştir, ancak bazı C4 bitki kloroplastlarında ve bazı alg kloroplastlarında, tilakoidler serbest yüzer. ⓘ
Tilakoid yapı

Işık mikroskobu kullanarak, grana olarak adlandırılan küçük yeşil granülleri görmek zar zor mümkündür. Elektron mikroskobu ile tilakoid sistemi daha ayrıntılı olarak görmek mümkün hale geldi ve granayı oluşturan düz tilakoid yığınları ile farklı granaları birbirine bağlayan uzun stromal tilakoidlerden oluştuğu ortaya çıktı. Transmisyon elektron mikroskobunda, tilakoid membranlar 8,5 nanometre kalınlığında değişen açık ve koyu bantlar olarak görünür. ⓘ
Uzun bir süre boyunca, tilakoid membran sisteminin üç boyutlu yapısı bilinmiyor ya da tartışılıyordu. Birçok model önerilmiştir; en yaygın olanı, granum tilakoid yığınlarının sarmal stromal tilakoidler tarafından sarıldığı sarmal modeldir. Bitki tilakoid membranlarının ilk elektron tomografi çalışmasına dayanan 'çatallanma modeli' olarak bilinen bir başka model, stromal membranları, granum-stroma düzeneğini oluşturan çoklu paralel disklere çatallanan grana sütunlarına dik geniş lamelli tabakalar olarak tasvir eder. Sarmal model birkaç ek çalışma ile desteklenmiştir, ancak nihayetinde 2019'da hem sarmal hem de çatallanma modellerinden gelen özelliklerin yeni keşfedilen sol elli sarmal membran bağlantıları ile birleştirildiği belirlenmiştir. Muhtemelen kolaylık sağlamak için, tilakoid sistem hala yaygın olarak granaların stromal tilakoid tüpleri ile birbirine bağlandığı eski "hub and spoke" modelleri ile tasvir edilmektedir. ⓘ
Grana, krepleri andıran düzleştirilmiş dairesel granal tilakoid yığınlarından oluşur. Her bir granum iki ila yüz arasında tilakoid içerebilir, ancak 10-20 tilakoid içeren granalar en yaygın olanıdır. Grananın etrafını saran çok sayıda paralel sağ elli sarmal stromal tilakoidler, aynı zamanda perdeler veya lameller tilakoidler olarak da bilinir. Heliksler ~20°'lik bir açıyla yükselir ve her bir granal tilakoide köprü benzeri bir yarık kavşakta bağlanır. ⓘ
Stroma lamelleri grana sütunlarına dik büyük tabakalar halinde uzanır. Bu tabakalar sağ elli helikslere ya doğrudan ya da sol elli heliks membran yüzeyleri oluşturan çatallanmalar yoluyla bağlanır. Sol elli sarmal yüzeyler, sağ elli sarmallara benzer bir eğim açısına (~20°), ancak ¼ eğime sahiptir. Granum başına yaklaşık 4 sol elli sarmal bağlantı bulunur, bu da ağı minimum yüzey ve bükülme enerjileriyle birleştiren farklı yarıçap ve eğime sahip sağ ve sol elli sarmal membran yüzeylerinin eğim dengeli bir dizisiyle sonuçlanır. Tilakoid sistemin farklı kısımları farklı membran proteinleri içerirken, tilakoid membranlar süreklidir ve çevreledikleri tilakoid boşluk tek bir sürekli labirent oluşturur. ⓘ
Tilakoid bileşimi
Tilakoid membranlara gömülü olan önemli protein kompleksleri fotosentezin ışık reaksiyonlarını gerçekleştirir. Fotosistem II ve fotosistem I, ışık enerjisini emen ve elektronlara enerji vermek için kullanan klorofil ve karotenoidler ile ışık hasat kompleksleri içerir. Tilakoid membrandaki moleküller enerjilenmiş elektronları kullanarak hidrojen iyonlarını tilakoid boşluğa pompalayarak pH'ı düşürür ve asidik hale getirir. ATP sentaz, hidrojen iyonları bir baraj türbini gibi stromaya geri akarken ATP enerjisi üretmek için tilakoid boşluktaki hidrojen iyonlarının konsantrasyon gradyanını kullanan büyük bir protein kompleksidir. ⓘ
İki tip tilakoid vardır - grana içinde düzenlenmiş olan granal tilakoidler ve stroma ile temas halinde olan stromal tilakoidler. Granal tilakoidler yaklaşık 300-600 nanometre çapında krep şeklinde dairesel disklerdir. Stromal tilakoidler, grana etrafında spiral çizen helikoid tabakalardır. Granal tilakoidlerin düz üst ve alt kısımları yalnızca nispeten düz fotosistem II protein kompleksini içerir. Bu, sıkıca istiflenmelerini sağlayarak, granal membran adı verilen sıkıca yapışmış membranın birçok katmanıyla grana oluşturarak, ışık yakalama için stabiliteyi ve yüzey alanını artırır. ⓘ
Buna karşın, fotosistem I ve ATP sentaz stromaya doğru çıkıntı yapan büyük protein kompleksleridir. Sıkıştırılmış granal membranlara sığamazlar ve bu nedenle stromal tilakoid membranda bulunurlar - granal tilakoid disklerin ve stromal tilakoidlerin kenarları. Bu büyük protein kompleksleri stromal tilakoid tabakaları arasında ara parça görevi görebilir. ⓘ
Bir kloroplasttaki tilakoid sayısı ve toplam tilakoid alanı ışığa maruz kalmaktan etkilenir. Gölgeli kloroplastlar, daha küçük ve daha az grana ve daha az tilakoid alana sahip olan parlak ışığa maruz kalan kloroplastlardan daha fazla tilakoid membran alanı ile daha büyük ve daha fazla grana içerir. Tilakoid kapsamı ışığa maruz kaldıktan veya ışıktan uzaklaştırıldıktan sonra dakikalar içinde değişebilir. ⓘ
Pigmentler ve kloroplast renkleri
Kloroplast tilakoid membranlarına gömülü fotosistemlerin içinde ışık enerjisini emen ve aktaran çeşitli fotosentetik pigmentler bulunur. Bulunan pigment türleri çeşitli kloroplast gruplarında farklıdır ve çok çeşitli kloroplast renklerinden sorumludur. ⓘ
Klorofiller
Klorofil a, siyanobakteriyel atalarının yanı sıra tüm kloroplastlarda bulunur. Klorofil a, çoğu siyanobakteriye ve kloroplastlara renklerini vermekten kısmen sorumlu olan mavi-yeşil bir pigmenttir. Aksesuar pigmentler klorofil b, klorofil c, klorofil d ve klorofil f gibi diğer klorofil formları da mevcuttur. ⓘ
Klorofil b sadece bitkilerin kloroplastlarında, yeşil alglerde, yeşil alglerin ikincil endosimbiyozu yoluyla elde edilen ikincil kloroplastlarda ve birkaç siyanobakteride bulunan zeytin yeşili bir pigmenttir. Çoğu bitki ve yeşil alg kloroplastını yeşil yapan a ve b klorofilleridir. ⓘ
Klorofil c, kırmızı alglerin kloroplastlarında bulunmamasına rağmen, çoğunlukla kırmızı alg kaynaklı ikincil endosimbiyotik kloroplastlarda bulunur. Klorofil c bazı yeşil alglerde ve siyanobakterilerde de bulunur. ⓘ
Klorofil d ve f sadece bazı siyanobakterilerde bulunan pigmentlerdir. ⓘ
Karotenoidler

Klorofillere ek olarak, fotosistemlerde karotenoidler adı verilen bir başka sarı-turuncu pigment grubu da bulunur. Yaklaşık otuz fotosentetik karotenoid vardır. Fazla enerjinin aktarılmasına ve dağıtılmasına yardımcı olurlar ve parlak renkleri, bazı kara bitkilerinin yapraklarının renk değiştirdiği sonbaharda olduğu gibi bazen klorofil yeşilini geçersiz kılar. β-karoten, klorofil a gibi neredeyse tüm kloroplastlarda bulunan parlak kırmızı-turuncu bir karotenoiddir. Ksantofiller, özellikle turuncu-kırmızı zeaksantin de yaygındır. Sadece belirli kloroplast gruplarında bulunan birçok başka karotenoid formu da mevcuttur. ⓘ
Fikobilinler
Fikobilinler, siyanobakterilerde ve glaucophyte, kırmızı alg ve cryptophyte kloroplastlarında bulunan üçüncü bir pigment grubudur. Phycobilinler her renkte bulunur, ancak phycoerytherin birçok kırmızı algleri kırmızı yapan pigmentlerden biridir. Fikobilinler genellikle fikobilizom adı verilen yaklaşık 40 nanometre genişliğinde nispeten büyük protein kompleksleri halinde organize olurlar. Fotosistem I ve ATP sentaz gibi, fikobilizomlar da stromaya girerek kırmızı alg kloroplastlarında tilakoid istiflenmesini önler. Kriptofit kloroplastlar ve bazı siyanobakteriler, fikobilin pigmentlerini fikobilizomlar halinde organize etmezler ve bunun yerine onları tilakoid boşluklarında tutarlar. ⓘ
| Fotosentetik pigmentler Kloroplast grupları arasında çeşitli pigmentlerin varlığına ilişkin tablo. Renkli hücreler pigment varlığını temsil eder. ⓘ | |||||||||
| Klorofil a | Klorofil b | Klorofil c | Klorofil d ve f | Ksantofiller | α-karoten | β-karoten | Fikobilinler | ||
| Kara bitkileri | |||||||||
| Yeşil algler | |||||||||
| Euglenophytes ve Klorarakniyofitler |
|||||||||
| Çok hücreli kırmızı algler | |||||||||
| Tek hücreli kırmızı algler | |||||||||
| Haptophytes ve Dinofitler |
|||||||||
| Kriptofitler | |||||||||
| Glaucophytes | |||||||||
| Siyanobakteriler | |||||||||
C4 bitkilerinde özelleşmiş kloroplastlar

Fotosentez sürecinde karbondioksiti şeker moleküllerine sabitlemek için kloroplastlar RuBisCO adı verilen bir enzim kullanır. RuBisCO karbondioksit ve oksijen arasında ayrım yapmakta zorlanır, bu nedenle yüksek oksijen konsantrasyonlarında RuBisCO yanlışlıkla şeker öncüllerine oksijen eklemeye başlar. Bunun sonucunda ATP enerjisi boşa harcanır ve CO2 açığa çıkar, üstelik hiç şeker üretilmez. Bu büyük bir sorundur, çünkü O2 fotosentezin ilk ışık reaksiyonları tarafından üretilir ve RuBisCO'yu kullanan Calvin döngüsünde hat boyunca sorunlara neden olur. ⓘ
C4 bitkileri bunu çözmek için ışık reaksiyonlarını ve Calvin döngüsünü mekansal olarak ayıran bir yol geliştirmiştir. Işık enerjisini ATP ve NADPH'de depolayan ışık reaksiyonları, bir C4 yaprağının mezofil hücrelerinde yapılır. Depolanan enerjiyi RuBisCO kullanarak şeker yapmak için kullanan Calvin döngüsü, bir yapraktaki bir damarı çevreleyen bir hücre tabakası olan demet kılıfı hücrelerinde yapılır. ⓘ
Sonuç olarak, C4 mezofil hücrelerindeki ve demet kılıf hücrelerindeki kloroplastlar fotosentezin her aşaması için özelleşmiştir. Mezofil hücrelerinde, kloroplastlar ışık reaksiyonları için özelleşmiştir, bu nedenle RuBisCO'dan yoksundurlar ve ATP ve NADPH'nin yanı sıra oksijen yapmak için kullandıkları normal grana ve tilakoidlere sahiptirler. CO2'yi dört karbonlu bir bileşikte depolarlar, bu yüzden sürece C4 fotosentezi denir. Dört karbonlu bileşik daha sonra demet kılıfı kloroplastlarına taşınır ve burada CO2'yi bırakarak mezofile geri döner. Demet kılıfı kloroplastları ışık reaksiyonlarını gerçekleştirmez, böylece içlerinde oksijen birikmesini önler ve RuBisCO aktivitesini bozar. Bu nedenle, grana yığınları halinde organize edilmiş tilakoidlerden yoksundurlar - ancak demet kılıf kloroplastları, oksijen üretmeden Calvin döngüsüne güç sağlamak için ATP sentezlemenin ışık güdümlü bir yöntemi olan döngüsel elektron akışını gerçekleştirdikleri stromada hala serbest yüzen tilakoidlere sahiptir. Fotosistem II'den yoksundurlar ve sadece döngüsel elektron akışı için gerekli olan tek protein kompleksi olan fotosistem I'e sahiptirler. Demet kılıf kloroplastlarının görevi Calvin döngüsünü gerçekleştirmek ve şeker yapmak olduğundan, genellikle büyük nişasta taneleri içerirler. ⓘ
Her iki kloroplast türü de büyük miktarlarda kloroplast periferik retikulumu içerir; bu retikulum, maddeleri içlerine ve dışlarına taşımak için daha fazla yüzey alanı elde etmek için kullanılır. Mezofil kloroplastları, demet kılıf kloroplastlarından biraz daha fazla periferik retikuluma sahiptir. ⓘ
Konum
Bir bitkide dağılım
Çok hücreli bir bitkideki tüm hücreler kloroplast içermez. Bir bitkinin tüm yeşil kısımları kloroplast içerir - kloroplastlar veya daha spesifik olarak, içlerindeki klorofil, bir bitkinin fotosentetik kısımlarını yeşil yapan şeydir. Kloroplast içeren bitki hücreleri genellikle parankima hücreleridir, ancak kloroplastlar kollenkima dokusunda da bulunabilir. Kloroplast içeren bir bitki hücresi klorenkima hücresi olarak bilinir. Bir kara bitkisinin tipik bir klorenkima hücresi yaklaşık 10 ila 100 kloroplast içerir. ⓘ

Kaktüsler gibi bazı bitkilerde kloroplastlar gövdede bulunur, ancak çoğu bitkide kloroplastlar yapraklarda yoğunlaşmıştır. Bir milimetrekarelik yaprak dokusu yarım milyon kloroplast içerebilir. Bir yaprak içinde, kloroplastlar çoğunlukla yaprağın mezofil tabakalarında ve stomaların koruyucu hücrelerinde bulunur. Palisade mezofil hücreleri hücre başına 30-70 kloroplast içerebilirken, stoma bekçi hücreleri hücre başına sadece 8-15 civarında ve çok daha az klorofil içerir. Kloroplastlar ayrıca bir yaprağın demet kını hücrelerinde, özellikle de Kalvin döngüsünü demet kını hücrelerinde gerçekleştiren C4 bitkilerinde bulunabilir. Genellikle bir yaprağın epidermisinde bulunmazlar. ⓘ
Hücresel konum
Kloroplast hareketi

Bitki ve alg hücrelerinin kloroplastları, mevcut ışığa en iyi şekilde uyacak şekilde kendilerini yönlendirebilirler. Düşük ışık koşullarında, ışığı emmek için yüzey alanını en üst düzeye çıkaracak şekilde bir tabaka halinde yayılırlar. Yoğun ışık altında, bitki hücresinin hücre duvarı boyunca dikey sütunlar halinde dizilerek veya yanlara dönerek sığınak ararlar, böylece ışık onlara kenarlarından vurur. Bu, maruziyeti azaltır ve onları fotooksidatif hasardan korur. Kloroplastları birbirlerinin arkasına sığınabilecekleri veya yayılabilecekleri şekilde dağıtma yeteneği, kara bitkilerinin birkaç büyük kloroplast yerine çok sayıda küçük kloroplasta sahip olacak şekilde evrimleşmesinin nedeni olabilir. Kloroplast hareketi, bitkilerde bulunabilecek en yakından düzenlenmiş uyaran-tepki sistemlerinden biri olarak kabul edilir. Mitokondrilerin de hareket ederken kloroplastları takip ettiği gözlemlenmiştir. ⓘ
Yüksek bitkilerde kloroplast hareketi, bitki fototropizminden de sorumlu olan mavi ışık fotoreseptörleri olan fototropinler tarafından yönetilir. Bazı alglerde, yosunlarda, eğrelti otlarında ve çiçekli bitkilerde kloroplast hareketi mavi ışığa ek olarak kırmızı ışıktan da etkilenir, ancak çok uzun kırmızı dalga boyları hareketi hızlandırmak yerine engeller. Mavi ışık genellikle kloroplastların sığınak aramasına neden olurken, kırmızı ışık ışık emilimini en üst düzeye çıkarmak için onları dışarı çeker. ⓘ
Suda yaşayan çiçekli bir bitki olan Vallisneria gigantea üzerinde yapılan çalışmalar, kloroplastların ışığa maruz kaldıktan sonraki beş dakika içinde hareket edebildiklerini, ancak başlangıçta net bir yönlülük göstermediklerini göstermiştir. Mikrofilament izleri boyunca hareket edebilirler ve mikrofilament ağının, hareket ettikten sonra kloroplastları çevreleyen bir bal peteği yapısı oluşturacak şekilde şekil değiştirmesi, mikrofilamentlerin kloroplastları yerine sabitlemeye yardımcı olabileceğini düşündürmektedir. ⓘ
İşlev ve kimya
Koruyucu hücre kloroplastları
Çoğu epidermal hücrenin aksine, bitki stomalarının koruyucu hücreleri nispeten iyi gelişmiş kloroplastlar içerir. Bununla birlikte, tam olarak ne yaptıkları tartışmalıdır. ⓘ
Bitki doğuştan gelen bağışıklık
Bitkiler özelleşmiş bağışıklık hücrelerinden yoksundur; tüm bitki hücreleri bitki bağışıklık tepkisine katılır. Kloroplastlar, çekirdek, hücre zarı ve endoplazmik retikulum ile birlikte patojen savunmasında kilit oyunculardır. Bir bitki hücresinin bağışıklık tepkisindeki rolü nedeniyle, patojenler sıklıkla kloroplastı hedef alır. ⓘ
Bitkilerin iki ana bağışıklık tepkisi vardır: enfekte olmuş hücrelerin kendilerini kapattığı ve programlanmış hücre ölümüne uğradığı aşırı duyarlı tepki ve enfekte olmuş hücrelerin bitkinin geri kalanını bir patojenin varlığı konusunda uyaran sinyaller saldığı sistemik kazanılmış direnç. Kloroplastlar, fotosentetik sistemlerine kasıtlı olarak zarar vererek ve reaktif oksijen türleri üreterek her iki tepkiyi de uyarır. Yüksek seviyelerdeki reaktif oksijen türleri aşırı duyarlı tepkiye neden olur. Reaktif oksijen türleri ayrıca hücre içindeki patojenleri doğrudan öldürür. Daha düşük seviyelerdeki reaktif oksijen türleri ise sistemik edinilmiş direnci başlatarak bitkinin geri kalanında savunma molekülü üretimini tetikler. ⓘ
Bazı bitkilerde, kloroplastların bir enfeksiyon sırasında enfeksiyon bölgesine ve çekirdeğe yaklaştığı bilinmektedir. ⓘ
Kloroplastlar hücresel sensörler olarak hizmet edebilir. Bir hücrede patojenden kaynaklanabilecek stresi tespit ettikten sonra, kloroplastlar savunma sinyalleri olarak hizmet edebilecek salisilik asit, jasmonik asit, nitrik oksit ve reaktif oksijen türleri gibi moleküller üretmeye başlar. Hücresel sinyaller olarak, reaktif oksijen türleri kararsız moleküllerdir, bu nedenle muhtemelen kloroplastı terk etmezler, bunun yerine sinyallerini bilinmeyen bir ikinci haberci moleküle iletirler. Tüm bu moleküller kloroplasttan gelen ve çekirdekteki gen ifadesini düzenleyen retrograd sinyalleri başlatır. ⓘ
Savunma sinyallerine ek olarak, kloroplastlar peroksizomların yardımıyla önemli bir savunma molekülü olan jasmonatın sentezlenmesine yardımcı olur. Kloroplastlar bir bitki hücresindeki tüm yağ asitlerini sentezler - bir yağ asidi olan linoleik asit, jasmonatın öncüsüdür. ⓘ
Fotosentez
Kloroplastın ana işlevlerinden biri, ışığın kimyasal enerjiye dönüştürülerek daha sonra şeker şeklinde gıda üretilmesi süreci olan fotosentezdeki rolüdür. Fotosentezde su (H2O) ve karbondioksit (CO2) kullanılır ve ışık enerjisi kullanılarak şeker ve oksijen (O2) üretilir. Fotosentez iki aşamaya ayrılır: oksijen üretmek için suyun bölündüğü ışık reaksiyonları ve karbondioksitten şeker molekülleri oluşturan karanlık reaksiyonlar veya Calvin döngüsü. Bu iki aşama, enerji taşıyıcıları olan adenozin trifosfat (ATP) ve nikotinamid adenin dinükleotid fosfat (NADP+) ile birbirine bağlıdır. ⓘ
Işık reaksiyonları
Işık reaksiyonları tilakoid membranlar üzerinde gerçekleşir. Işık enerjisini alırlar ve karanlık reaksiyonları beslemek için bir NADP+ formu olan NADPH ve ATP'de depolarlar. ⓘ
Enerji taşıyıcıları
ATP, bir hücrede enerji depolayan ve çoğu hücresel aktiviteye güç veren adenozin difosfatın (ADP) fosforlanmış versiyonudur. ATP enerjilendirilmiş form, ADP ise (kısmen) tükenmiş formdur. NADP+ yüksek enerjili elektronları taşıyan bir elektron taşıyıcısıdır. Işık reaksiyonlarında indirgenir, yani elektron alır ve NADPH haline gelir. ⓘ
Fotofosforilasyon
Mitokondri gibi kloroplastlar da ATP enerjisi üretmek için bir H+ veya hidrojen iyonu gradyanında depolanan potansiyel enerjiyi kullanır. İki fotosistem, sudan alınan elektronlara enerji vermek için ışık enerjisini yakalar ve bunları bir elektron taşıma zincirine bırakır. Fotosistemler arasındaki moleküller elektronların enerjisini kullanarak hidrojen iyonlarını tilakoid boşluğa pompalar ve bir konsantrasyon gradyanı oluşturarak tilakoid sistemin içinde stromadakinden daha fazla hidrojen iyonu (bin kata kadar) bulunur. Tilakoid boşluktaki hidrojen iyonları daha sonra ATP sentaz yoluyla stromaya geri akarak konsantrasyon gradyanlarından aşağı doğru yayılır. ATP sentaz, adenozin difosfatı fosforile ederek adenozin trifosfat veya ATP'ye dönüştürmek için akan hidrojen iyonlarından gelen enerjiyi kullanır. Kloroplast ATP sentaz stromaya doğru çıkıntı yaptığından, ATP karanlık reaksiyonlarda kullanılmak üzere orada sentezlenir. ⓘ
NADP+ indirgenmesi
Elektronlar genellikle NADP+'yi elektronlarla yükleyerek NADPH'ye indirgemek için elektron taşıma zincirlerinden çıkarılır. ATP sentaz gibi, NADP+'yi indirgeyen enzim olan ferredoksin-NADP+ redüktaz da ürettiği NADPH'yi karanlık reaksiyonlar için gerekli olan stromaya salar. ⓘ
NADP+ indirgenmesi elektron taşıma zincirlerinden elektronları çıkardığı için, bunların yerine konması gerekir; bu da elektronları hidrojen atomlarından elde etmek için su moleküllerini (H2O) bölen fotosistem II'nin işidir. ⓘ
Döngüsel fotofosforilasyon
Fotosistem II yeni elektronlar elde etmek ve enerji vermek için suyu fotolize ederken, fotosistem I elektron taşıma zincirinin sonunda tükenmiş elektronları yeniden enerjilendirir. Normalde, yeniden enerjilendirilen elektronlar NADP+ tarafından alınır, ancak bazen daha fazla ATP üretmek için daha fazla hidrojen iyonunu tilakoid boşluğa taşımak üzere daha fazla H+ pompalayan elektron taşıma zincirlerine geri akabilirler. Elektronlar geri dönüştürüldüğü için bu döngüsel fotofosforilasyon olarak adlandırılır. Döngüsel fotofosforilasyon, NADPH'den daha fazla ATP'ye ihtiyaç duyan C4 bitkilerinde yaygındır. ⓘ
Karanlık reaksiyonlar
Karanlık reaksiyonlar olarak da bilinen Calvin döngüsü, CO2'yi G3P şeker moleküllerine sabitleyen ve ışık reaksiyonlarında yapılan ATP ve NADPH'den gelen enerji ve elektronları kullanan bir dizi biyokimyasal reaksiyondur. Calvin döngüsü kloroplastın stromasında gerçekleşir. ⓘ
"Karanlık reaksiyonlar" olarak adlandırılsa da, çoğu bitkide karanlık reaksiyonlar ışık reaksiyonlarının ürünlerine bağlı olduğu için ışıkta gerçekleşir. ⓘ
Karbon fiksasyonu ve G3P sentezi
Kalvin döngüsü, CO2'yi beş karbonlu Ribuloz bisfosfat (RuBP) moleküllerine sabitlemek için RuBisCO enzimini kullanarak başlar. Sonuç, hemen 3-fosfogliserik asit veya 3-PGA adı verilen üç karbonlu moleküllere parçalanan kararsız altı karbonlu moleküllerdir. Işık reaksiyonlarında üretilen ATP ve NADPH, 3-PGA'yı gliseraldehit-3-fosfat veya G3P şeker moleküllerine dönüştürmek için kullanılır. G3P moleküllerinin çoğu daha fazla ATP'den gelen enerji kullanılarak RuBP'ye geri dönüştürülür, ancak üretilen her altı molekülden biri döngüyü terk eder - karanlık reaksiyonların son ürünü. ⓘ
Şekerler ve nişastalar
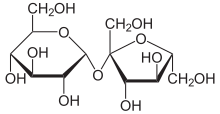
Gliseraldehit-3-fosfat ikiye katlanarak glukoz ve fruktoz gibi daha büyük şeker molekülleri oluşturabilir. Bu moleküller işlenir ve onlardan, genellikle sofra şekeri olarak bilinen bir disakkarit olan daha büyük sükroz yapılır, ancak bu işlem kloroplastın dışında, sitoplazmada gerçekleşir. ⓘ
Alternatif olarak, kloroplasttaki glikoz monomerleri, kloroplastta bulunan nişasta tanelerinde biriken nişastayı yapmak için birbirine bağlanabilir. Yüksek atmosferik CO2 konsantrasyonları gibi koşullar altında, bu nişasta taneleri çok büyüyerek grana ve tilakoidleri bozabilir. Nişasta granülleri tilakoidlerin yerini alır, ancak onları sağlam bırakır. Suya doymuş kökler de muhtemelen kloroplasttan (ya da daha doğru bir ifadeyle bitki hücresinden) daha az sükroz ihraç edilmesi nedeniyle kloroplastlarda nişasta birikmesine neden olabilir. Bu durum bitkinin serbest fosfat kaynağını tüketerek dolaylı olarak kloroplast nişasta sentezini uyarır. Düşük fotosentez oranlarıyla bağlantılı olsa da, nişasta tanelerinin kendileri fotosentezin verimliliğine önemli ölçüde müdahale etmeyebilir ve sadece fotosentezi baskılayan başka bir faktörün yan etkisi olabilir. ⓘ
Fotorespirasyon
Oksijen konsantrasyonu çok yüksek olduğunda fotorespirasyon meydana gelebilir. RuBisCO oksijen ve karbondioksiti çok iyi ayırt edemez, bu nedenle yanlışlıkla RuBP'ye CO2 yerine O2 ekleyebilir. Bu süreç fotosentezin verimliliğini azaltır; ATP ve oksijen tüketir, CO2 açığa çıkarır ve hiç şeker üretmez. Calvin döngüsü tarafından sabitlenen karbonun yarısına kadarını israf edebilir. Farklı soylarda, kloroplast içindeki oksijene göre karbondioksit konsantrasyonunu yükselten ve fotosentezin verimliliğini artıran çeşitli mekanizmalar gelişmiştir. Bu mekanizmalara karbondioksit yoğunlaştırma mekanizmaları veya CCM'ler denir. Bunlar arasında Crassulacean asit metabolizması, C4 karbon fiksasyonu ve pirenoidler bulunur. C4 bitkilerindeki kloroplastlar, belirgin bir kloroplast dimorfizmi sergiledikleri için dikkate değerdir. ⓘ
pH
Tilakoid membran boyunca H+ gradyanı nedeniyle, tilakoidin iç kısmı asidiktir ve pH değeri 4 civarındadır, stroma ise hafif baziktir ve pH değeri 8 civarındadır. Calvin döngüsü için en uygun stroma pH'ı 8,1'dir ve pH 7,3'ün altına düştüğünde reaksiyon neredeyse durur. ⓘ
Sudaki CO2 karbonik asit oluşturabilir, bu da izole edilmiş kloroplastların pH'ını bozarak fotosentezde CO2 kullanılmasına rağmen fotosentezi engelleyebilir. Ancak canlı bitki hücrelerindeki kloroplastlar bundan çok fazla etkilenmez. ⓘ
Kloroplastlar K+ ve H+ iyonlarını ışık güdümlü bir taşıma sistemi kullanarak kendi içlerine ve dışlarına pompalayabilirler. ⓘ
Işık varlığında, tilakoid lümenin pH'ı 1,5 pH birimine kadar düşebilirken, stromanın pH'ı yaklaşık bir pH birimi yükselebilir. ⓘ
Amino asit sentezi
Kloroplastlar, sistein ve metiyonin gibi sülfür içerenler hariç, bir bitki hücresinin amino asitlerinin neredeyse tamamını stromalarında tek başlarına yaparlar. Sistein kloroplastta (proplastid de) yapılır, ancak muhtemelen ihtiyaç duyulan yere ulaşmak için membranları geçmekte zorlandığı için sitozol ve mitokondride de sentezlenir. Kloroplastın metiyonin öncüllerini yaptığı bilinmektedir ancak organelin yolun son ayağını gerçekleştirip gerçekleştirmediği ya da bunun sitozolde mi gerçekleştiği belirsizdir. ⓘ
Diğer azot bileşikleri
Kloroplastlar bir hücrenin tüm pürin ve pirimidinlerini (DNA ve RNA'da bulunan azotlu bazlar) yapar. Ayrıca nitriti (NO2-) amonyağa (NH3) dönüştürerek bitkiye amino asitlerini ve nükleotidlerini yapmak için azot sağlarlar. ⓘ
Diğer kimyasal ürünler
Plastid, bitkilerde çeşitli ve karmaşık lipid sentezinin yapıldığı yerdir. Lipidin çoğunluğunu oluşturmak için kullanılan karbon, piruvatın dekarboksilasyon ürünü olan asetil-CoA'dan gelir. Piruvat, glikolizde üretildikten sonra membrandan pasif difüzyon yoluyla sitozolden plastide girebilir. Piruvat ayrıca sitozolde piruvat veya PGA'dan yapılan bir metabolit olan fosfoenolpiruvattan da plastidde yapılır. Sitozoldeki asetat, plastiddeki lipid biyosentezi için kullanılamaz. Plastidde üretilen yağ asitlerinin tipik uzunluğu 16 veya 18 karbon olup, 0-3 cis çift bağ içerir. ⓘ
Asetil-CoA'dan yağ asitlerinin biyosentezi öncelikle iki enzim gerektirir. Asetil-CoA karboksilaz, sentezin hem ilk adımında hem de uzatma adımlarında kullanılan malonil-CoA'yı oluşturur. Yağ asidi sentaz (FAS), sentezlenirken açil zincirini tutan açil taşıyıcı protein (ACP) dahil olmak üzere büyük bir enzim ve kofaktör kompleksidir. Sentezin başlaması, ketobütiril-ACP üretmek için malonil-ACP'nin asetil-CoA ile yoğunlaşması ile başlar. NADPH kullanımını içeren 2 indirgeme ve bir dehidrasyon butiril-ACP'yi oluşturur. Yağ asidinin uzaması, tekrarlanan malonil-ACP yoğunlaştırma, indirgeme ve dehidrasyon döngülerinden gelir. ⓘ
Diğer lipidler metil-eritritol fosfat (MEP) yolundan türetilir ve gibberelinler, steroller, absisik asit, fitol ve sayısız ikincil metabolitten oluşur. ⓘ
Farklılaşma, çoğalma ve kalıtım
Kloroplastlar, plastid adı verilen bitki hücresi organelinin özel bir türüdür, ancak bu iki terim bazen birbirinin yerine kullanılır. Çeşitli işlevleri yerine getiren başka birçok plastid türü vardır. Bir bitkideki tüm kloroplastlar, zigotta veya döllenmiş yumurtada bulunan farklılaşmamış proplastidlerden türemiştir. Proplastidler genellikle yetişkin bir bitkinin apikal meristemlerinde bulunur. Kloroplastlar normalde kök ucu meristemlerindeki proplastidlerden gelişmez, bunun yerine nişasta depolayan amiloplastların oluşumu daha yaygındır. ⓘ
Sürgünlerde, sürgün apikal meristemlerinden gelen proplastidler, gerekli ışığa maruz kalırsa yaprak olgunlaştıkça fotosentetik yaprak dokularında kademeli olarak kloroplastlara dönüşebilir. Bu süreç, iç plastid membranının invajinasyonlarını içerir ve iç stromaya doğru çıkıntı yapan membran tabakaları oluşturur. Bu zar tabakaları daha sonra katlanarak tilakoid ve grana oluşturur. ⓘ
Anjiyosperm sürgünleri kloroplast oluşumu için gerekli ışığa maruz kalmazsa, proplastidler kloroplast haline gelmeden önce bir etiyoplast aşamasına geçebilir. Etioplast, klorofil içermeyen ve stromalarında prolamellar cisim olarak adlandırılan bir tüp kafesi oluşturan iç zar invajinasyonlarına sahip bir plastiddir. Etiyoplastlar klorofilden yoksun olsa da, stoklanmış sarı bir klorofil öncüsüne sahiptirler. Işığa maruz kaldıktan birkaç dakika sonra prolamellar cisim, tylakoid yığınları halinde yeniden organize olmaya başlar ve klorofil üretilmeye başlar. Etiyoplastın kloroplasta dönüştüğü bu süreç birkaç saat sürer. Gymnospermler kloroplast oluşturmak için ışığa ihtiyaç duymazlar. ⓘ
Ancak ışık, bir proplastidin kloroplasta dönüşeceğini garanti etmez. Bir proplastidin kloroplasta ya da başka bir tür plastide dönüşüp dönüşmeyeceği çoğunlukla çekirdek tarafından kontrol edilir ve büyük ölçüde içinde bulunduğu hücre türünden etkilenir. ⓘ

Plastidler arası dönüşüm
Plastid farklılaşması kalıcı değildir, aslında birçok ara dönüşüm mümkündür. Kloroplastlar, çiçeklerde ve olgun meyvelerde görülen parlak renklerden sorumlu pigment dolu plastidler olan kromoplastlara dönüştürülebilir. Nişasta depolayan amiloplastlar da kromoplastlara dönüştürülebilir ve proplastidlerin doğrudan kromoplastlara dönüşmesi mümkündür. Kromoplastlar ve amiloplastlar da kloroplastlara dönüşebilir, tıpkı bir havuç ya da patates aydınlatıldığında olduğu gibi. Bir bitki yaralanırsa veya başka bir şey bitki hücresinin meristematik duruma dönmesine neden olursa, kloroplastlar ve diğer plastidler tekrar proplastidlere dönüşebilir. Kloroplast, amiloplast, kromoplast, proplast, vb. mutlak durumlar değildir-ara formlar yaygındır. ⓘ
Bölünme
Fotosentetik bir hücredeki kloroplastların çoğu doğrudan proplastidlerden veya etiyoplastlardan gelişmez. Aslında, tipik bir sürgün meristematik bitki hücresi sadece 7-20 proplastid içerir. Bu proplastidler, olgun bir fotosentetik bitki hücresinde bulunan 30-70 kloroplastı oluşturmak için bölünen kloroplastlara farklılaşır. Eğer hücre bölünürse, kloroplast bölünmesi iki yavru hücre arasında bölünecek ilave kloroplastları sağlar. ⓘ
Tek hücreli alglerde kloroplast bölünmesi yeni kloroplastların oluşmasının tek yoludur. Proplastid farklılaşması yoktur - bir alg hücresi bölündüğünde, kloroplastı da onunla birlikte bölünür ve her yavru hücre olgun bir kloroplast alır. ⓘ
Hızla bölünen küçük bir kloroplast grubu yerine, bir hücredeki neredeyse tüm kloroplastlar bölünür. Kloroplastların belirli bir S-fazı yoktur - DNA replikasyonları senkronize değildir veya konak hücrelerininkiyle sınırlı değildir. Kloroplast bölünmesi hakkında bildiklerimizin çoğu Arabidopsis ve kırmızı alg Cyanidioschyzon merolæ gibi organizmaların incelenmesinden gelmektedir. ⓘ

Bölünme süreci, FtsZ1 ve FtsZ2 proteinleri filamentler halinde bir araya geldiğinde ve bir protein ARC6'nın yardımıyla kloroplastın stroması içinde Z halkası adı verilen bir yapı oluşturduğunda başlar. Min sistemi, Z halkasının yerleşimini yöneterek kloroplastın az ya da çok eşit şekilde bölünmesini sağlar. MinD proteini FtsZ'nin bağlanmasını ve filamentler oluşturmasını engeller. Başka bir protein ARC3 de işin içinde olabilir, ancak bu çok iyi anlaşılmamıştır. Bu proteinler kloroplastın kutuplarında aktiftir ve orada Z halkası oluşumunu önler, ancak kloroplastın merkezine yakın MinE onları inhibe ederek Z halkasının oluşmasına izin verir. ⓘ
Ardından, iki plastid-bölünen halka veya PD halkaları oluşur. İç plastid-bölünme halkası, kloroplastın iç zarının iç tarafında bulunur ve ilk olarak oluşur. Dış plastid bölünme halkası, dış kloroplast membranının etrafına sarılmış olarak bulunur. Yaklaşık 5 nanometre genişliğinde, 6,4 nanometre aralıklı sıralar halinde düzenlenmiş filamentlerden oluşur ve kloroplastı sıkıştırmak için küçülür. Bu, kloroplast daralmasının başladığı zamandır.
Cyanidioschyzon merolæ gibi birkaç türde, kloroplastlar, kloroplastın zarlar arası boşluğunda bulunan üçüncü bir plastid bölen halkaya sahiptir. ⓘ
Daralma aşamasının sonlarında, dynamin proteinleri dış plastid bölünme halkasının etrafında toplanarak kloroplastı sıkıştırmak için kuvvet sağlamaya yardımcı olur. Bu arada, Z halkası ve iç plastid bölünme halkası parçalanır. Bu aşamada, stromada yüzen birçok kloroplast DNA plazmidi bölünür ve oluşan iki yavru kloroplasta dağıtılır. ⓘ
Daha sonra dinaminler, kloroplastı iki yavru kloroplasta bölmek için dış plastid bölme halkasının altına, kloroplastın dış zarıyla doğrudan temas edecek şekilde göç eder. ⓘ
Dış plastid bölünme halkasının bir kalıntısı iki yavru kloroplast arasında yüzer halde kalır ve dynamin halkasının bir kalıntısı yavru kloroplastlardan birine bağlı kalır. ⓘ
Kloroplast bölünmesinde yer alan beş veya altı halkadan sadece dış plastid bölen halka tüm daralma ve bölünme aşaması boyunca mevcuttur - Z halkası önce oluşurken, dış plastid bölen halka oluşana kadar daralma başlamaz. ⓘ
Düzenleme
Tek bir kloroplast içeren alg türlerinde, kloroplast bölünmesinin düzenlenmesi, her yavru hücrenin bir kloroplast almasını sağlamak için son derece önemlidir - kloroplastlar sıfırdan yapılamaz. Hücreleri birden fazla kloroplast içeren bitkiler gibi organizmalarda koordinasyon daha gevşek ve daha az önemlidir. Kloroplast ve hücre bölünmesinin bir şekilde senkronize olması muhtemeldir, ancak bunun mekanizmaları çoğunlukla bilinmemektedir. ⓘ
Işığın kloroplast bölünmesi için bir gereklilik olduğu gösterilmiştir. Kloroplastlar düşük kaliteli yeşil ışık altında büyüyebilir ve bazı daralma aşamalarında ilerleyebilir, ancak bölünmeyi tamamlamakta yavaştırlar - bölünmeyi tamamlamak için parlak beyaz ışığa maruz kalmaları gerekir. Yeşil ışık altında yetiştirilen ıspanak yapraklarının çok sayıda büyük dambıl şeklinde kloroplast içerdiği gözlemlenmiştir. Beyaz ışığa maruz kalmak bu kloroplastları bölünmeye teşvik edebilir ve dambıl şeklindeki kloroplast popülasyonunu azaltabilir. ⓘ
Kloroplast kalıtımı
Mitokondri gibi kloroplastlar da genellikle tek bir ebeveynden kalıtılır. Biparental kloroplast kalıtımı - plastid genlerinin her iki ebeveyn bitkiden de kalıtıldığı - bazı çiçekli bitkilerde çok düşük seviyelerde görülür. ⓘ
Kloroplastların veya genlerinin gamet veya zigot içinde seçici olarak yok edilmesi ve bir ebeveynden gelen kloroplastların embriyodan dışlanması dahil olmak üzere birçok mekanizma biparental kloroplast DNA kalıtımını önler. Ebeveyn kloroplastları, her yavruda yalnızca bir tür bulunacak şekilde sıralanabilir. ⓘ
Çam ağaçları gibi Gymnospermler çoğunlukla kloroplastları babadan aktarırken, çiçekli bitkiler genellikle kloroplastları anneden miras alır. Çiçekli bitkilerin bir zamanlar kloroplastları yalnızca anneden miras aldığı düşünülüyordu. Ancak, artık angiospermlerin kloroplastları babadan miras aldığına dair belgelenmiş birçok vaka vardır. ⓘ
Kloroplastları maternal olarak aktaran kapalı tohumlu bitkilerin paternal kalıtımı önlemek için birçok yolu vardır. Çoğu, plastid içermeyen sperm hücreleri üretir. Bu çiçekli bitkilerde baba tarafından kalıtımı engelleyen, embriyo içindeki farklı kloroplast replikasyon oranları gibi belgelenmiş başka birçok mekanizma vardır. ⓘ
Kapalı tohumlu bitkiler arasında, babadan geçen kloroplast kalıtımı, aynı türden ebeveynlerin yavrularına kıyasla melezlerde daha sık görülür. Bu durum, uyumsuz hibrit genlerin baba mirasını önleyen mekanizmalara müdahale edebileceğini düşündürmektedir. ⓘ
Transplastomik bitkiler
Son zamanlarda, kloroplastlar genetiği değiştirilmiş ürün geliştiricilerinin dikkatini çekmiştir. Çiçekli bitkilerin çoğunda kloroplastlar erkek ebeveynden miras alınmadığından, bu plastitlerdeki transgenler polenle yayılamaz. Bu da plastid transformasyonunu, biyolojik olarak muhafaza edilen genetiği değiştirilmiş bitkilerin yaratılması ve yetiştirilmesi için değerli bir araç haline getirmekte ve böylece önemli ölçüde daha düşük çevresel riskler oluşturmaktadır. Dolayısıyla bu biyolojik muhafaza stratejisi, konvansiyonel ve organik tarımın bir arada var olabilmesi için uygundur. Bu mekanizmanın güvenilirliği henüz tüm ilgili ürün türleri için incelenmemiş olsa da, tütün bitkilerindeki son sonuçlar umut vericidir ve transplastomik bitkilerin 1.000.000'da 3 oranında başarısız bir muhafaza oranını göstermektedir. ⓘ
Yapısı
Klorofil ve diğer pigmentler bu iç membran sistemine yerleşmiş olarak bulunurlar. Fotosentezin ışık reaksiyonları ile buna bağlı elektron taşınım reaksiyonları granada gerçekleşir. Stromada ise fotosentetik karbon çemberi (Calvin çemberi) enzimleri, ribozomlar ve kloroplasta ait DNA yerleşmiştir. Bundan başka yine stromada çeşitli granüller, lipid damlacıkları, primer nişasta taneleri ve veziküller de bulunabilir. ⓘ
Görevi
Işık enerjisinin emilimini CO2 alınımı CO2'den karbonhidrat oluşumu ve O2 oluşumu olayları hep kloroplastta gerçekleşir. ⓘ
Işıktan faydalanarak Adenozin trifosfat'nin fosfat bağlarındaki enerjiyi, hücrede kullanılabilecek enerjiye çevirir. Adenozin trifosfat'ı kullanarak karbonun hücre için gerekli organik maddelere dönüştürülmesini sağlar. Bitkiye yeşil rengi verir. ⓘ
Ve aynı zamanda Dünya havasını temizler. ⓘ
İç bağlantılar
- Endosimbiyoz Kuramı ⓘ