Eter
| Simetrik ve asimetrik Eterler ⓘ | |
| Simetrik eter | Asimetrik eter |
| Dimetil eter | Etil metil eter |
| Su ve Eterde oksijenin diğer atomlarala yaptığı açı. | |
| Eterde oksijenin yaptığı açı. | Su molekülünde oksijenin yaptığı açı. |
Eterler, iki organik kısmın bir oksijen atomu üzerinden birbirine bağ yapmış organik moleküllerdir. Eterlerin genel formülü R-O-R’ şeklindedir. Buradaki R ve R’ aynı olabileceği gibi farklı organik kısımlar da olabilirler. Eterler, aynı karbon sayılı alkoller ile izomerdir. Bütün eterlerin alkol izomeri olmasına karşın bütün alkollerin eter izomeri yoktur. Bunun nedeni de en küçük eterin iki karbonlu olmasıdır. Eterlerin izomeri olan alkollere göre kaynama noktaları daha düşüktür. Bu da molekülleri arasında hidrojen bağı bulunmamasıdır. Eterler homolog sıra oluştururlar ve yükseltgenemezler. 2 mol mono alkolden 1 mol su çekilmesi ile simetrik eter elde edilir. Oksijenin organik kısımlarla yaptığı bağların arasındaki açı, su molekülünde hidrojenle yaptığı açıdan biraz daha büyüktür. ⓘ

Yapı ve bağlar
Eterler bükülmüş C-O-C bağlarına sahiptir. Dimetil eterde bağ açısı 111° ve C-O mesafeleri 141 pm'dir. C-O bağları etrafında dönme engeli düşüktür. Eterler, alkoller ve sudaki oksijen bağları benzerdir. Değerlik bağı teorisi dilinde, oksijendeki hibridizasyon sp3'tür. ⓘ
Oksijen karbondan daha elektronegatiftir, bu nedenle eterlerin alfa hidrojenleri basit hidrokarbonlarınkinden daha asidiktir. Ancak karbonil gruplarının (ketonlar veya aldehitlerdeki gibi) alfa hidrojenlerinden çok daha az asidiktirler. ⓘ
Eterler ROR tipinde simetrik veya ROR' tipinde simetrik olmayan olabilir. İlkine örnek olarak dietil eter, dimetil eter, dipropil eter vb. verilebilir. Simetrik olmayan eterlere örnek olarak anizol (metoksibenzen) ve dimetoksietan verilebilir. ⓘ
Vinil- ve asetilenik eterler
Vinil ve asetilenik eterler, alkil veya aril eterlerden çok daha az yaygındır. Genellikle enol eterler olarak adlandırılan vinileterler, organik sentezlerde önemli ara ürünlerdir. Asetilenik eterler özellikle nadirdir. Di-tert-butoksiasetilen bu nadir bileşik sınıfının en yaygın örneğidir. ⓘ
İsimlendirme
IUPAC İsimlendirme sisteminde, eterler "alkoksialkan" genel formülü kullanılarak adlandırılır, örneğin CH3-CH2-O-CH3 metoksietandır. Eter daha karmaşık bir molekülün parçasıysa, bir alkoksi sübstitüenti olarak tanımlanır, bu nedenle -OCH3 bir "metoksi-" grubu olarak kabul edilir. Daha basit alkil radikali önde yazılır, bu nedenle CH3-O-CH2CH3 metoksi(CH3O)etan(CH2CH3) olarak verilir. ⓘ
Önemsiz isim
Basit eterler için IUPAC kurallarına genellikle uyulmaz. Basit eterlerin (diğer bir deyişle, başka fonksiyonel grup içermeyen veya çok az içerenlerin) önemsiz isimleri, "eter" ile takip edilen iki sübstitüentin bir bileşimidir. Örneğin, etil metil eter (CH3OC2H5), difenileter (C6H5OC6H5). Diğer organik bileşiklerde olduğu gibi, çok yaygın eterler, isimlendirme kuralları resmileştirilmeden önce isimler almıştır. Dietil eter basitçe eter olarak adlandırılır, ancak bir zamanlar tatlı vitriol yağı olarak adlandırılırdı. Metil fenil eter anizoldür, çünkü başlangıçta anasonda bulunurdu. Aromatik eterler furanları içerir. Asetaller (α-alkoksi eterler R-CH(-OR)-O-R) karakteristik özelliklere sahip başka bir eter sınıfıdır. ⓘ
Polieterler
Polieterler genellikle ana zincirlerinde eter bağları içeren polimerlerdir. Poliol terimi genellikle hidroksil grubu gibi bir veya daha fazla fonksiyonel uç gruba sahip polieter poliolleri ifade eder. "Oksit" terimi veya diğer terimler, uç gruplar artık polimer özelliklerini etkilemediğinde yüksek molar kütleli polimer için kullanılır. ⓘ
Taç eterler siklik polieterlerdir. Brevetoksin ve ciguatoksin gibi dinoflagellatlar tarafından üretilen bazı toksinler son derece büyüktür ve siklik veya merdiven polieterler olarak bilinir. ⓘ
| Düşük ila orta molar kütleye sahip polimerlerin adı | Yüksek molar kütleye sahip polimerlerin adı | Hazırlık | Tekrarlayan ünite | Ticari isim örnekleri |
|---|---|---|---|---|
| Paraformaldehit | Polioksimetilen (POM) veya poliasetal veya poliformaldehit | Formaldehitin basamaklı büyüme polimerizasyonu | -CH2O- | DuPont'tan Delrin |
| Polietilen glikol (PEG) | Polietilen oksit (PEO) veya polioksietilen (POE) | Etilen oksidin halka açılma polimerizasyonu | -CH2CH2O- | Dow'dan Carbowax |
| Polipropilen glikol (PPG) | Polipropilen oksit (PPOX) veya polioksipropilen (POP) | propi̇len oksi̇di̇n anyoni̇k halka açilmali poli̇merleşmesi̇ | -CH2CH(CH3)O- | Covestro'dan Arcol |
| Politetrametilen glikol (PTMG) veya Politetrametilen eter glikol (PTMEG) | Politetrahidrofuran (PTHF) | Tetrahidrofuranın asit katalizli halka açılma polimerizasyonu | -CH 2CH 2CH 2CH 2O- |
Invista'dan Terathane ve BASF'den PolyTHF |
Fenil eter polimerleri, ana zincirlerinde aromatik döngüler içeren aromatik polieterlerin bir sınıfıdır: polifenil eter (PPE) ve poli(p-fenilen oksit) (PPO). ⓘ
İlgili bileşikler
C-O-C bağlarına sahip birçok bileşik sınıfı eter olarak kabul edilmez: Esterler (R-C(=O)-O-R′), hemiasetaller (R-CH(-OH)-O-R′), karboksilik asit anhidritleri (RC(=O)-O-C(=O)R′). ⓘ
Fiziksel özellikler
Eterler, benzer alkanlarınkine benzer kaynama noktalarına sahiptir. Basit eterler genellikle renksizdir. ⓘ
| Bazı alkil eterler hakkında seçilmiş veriler ⓘ | |||||
|---|---|---|---|---|---|
| Eter | Yapı | m.p. (°C) | b.p. (°C) | 1 litre H2O'da çözünürlük | Dipol moment (D) |
| Dimetil eter | CH3-O-CH3 | −138.5 | −23.0 | 70 g | 1.30 |
| Dietil eter | CH3CH2-O-CH2CH3 | −116.3 | 34.4 | 69 g | 1.14 |
| Tetrahidrofuran | O(CH2)4 | −108.4 | 66.0 | Karışabilir | 1.74 |
| Dioksan | O(C2H4)2O | 11.8 | 101.3 | Karışabilir | 0.45 |
Tepkiler
Basit eterleri oluşturan C-O bağları güçlüdür. En güçlü bazlar dışında hiçbirine karşı reaktif değildirler. Genel olarak düşük kimyasal reaktiviteye sahip olmalarına rağmen, alkanlardan daha reaktiftirler. ⓘ
Epoksitler, ketaller ve asetaller gibi özelleşmiş eterler, temsil edici olmayan eter sınıflarıdır ve ayrı makalelerde ele alınmaktadır. Önemli reaksiyonlar aşağıda listelenmiştir. ⓘ
Bölünme
Eterler hidrolize direnç göstermelerine rağmen, hidrobromik asit ve hidroiyodik asit tarafından parçalanırlar. Hidrojen klorür eterleri sadece yavaşça parçalar. Metil eterler tipik olarak metil halojenürleri verir:
- ROCH3 + HBr → CH3Br + ROH
Bu reaksiyonlar onyum ara ürünleri, yani [RO(H)CH3]+Br- üzerinden ilerler. ⓘ
Bazı eterler, alkil bromür vermek için bor tribromürle (hatta bazı durumlarda alüminyum klorür kullanılır) hızlı bir şekilde parçalanır. Sübstitüentlere bağlı olarak, bazı eterler çeşitli reaktiflerle, örneğin güçlü bazlarla ayrılabilir. ⓘ
Peroksit oluşumu
Hava veya oksijen varlığında depolandığında eterler dietil eter hidroperoksit gibi patlayıcı peroksitler oluşturma eğilimindedir. Reaksiyon ışık, metal katalizörler ve aldehitler tarafından hızlandırılır. Peroksit oluşturabilecek saklama koşullarından kaçınmanın yanı sıra, bir eter çözücü olarak kullanıldığında, orijinal eterden daha az uçucu olan oluşmuş olabilecek peroksitler sıvının son birkaç damlasında yoğunlaşacağından, kuruluğa kadar damıtılmaması önerilir. Eski eter örneklerinde peroksit varlığı, yeni hazırlanmış demir sülfat çözeltisi ile çalkalanıp ardından KSCN eklenerek tespit edilebilir. Kan kırmızısı rengin ortaya çıkması peroksitlerin varlığını gösterir. Eter peroksitlerinin tehlikeli özellikleri, dietil eter ve tetrahidrofuran (THF) veya etilen glikol dimetil eter (1,2-dimetoksietan) gibi peroksit oluşturan diğer eterlerin endüstriyel işlemlerde kullanılmasından kaçınılmasının nedenidir. ⓘ
Lewis bazları
Eterler Lewis bazları olarak görev yapar. Örneğin, dietil eter bor triflorür ile bir kompleks oluşturur, yani dietil eterat (BF3-OEt2). Eterler ayrıca Grignard reaktiflerindeki Mg merkezine de koordine olur. Tetrahidrofuran asiklik eterlerden daha baziktir. Birçok metal halojenür ile kompleks oluşturur. ⓘ
Alfa-halojenasyon
Bu reaktivite, alfa hidrojen atomlu eterlerin peroksit oluşturma eğilimine benzer. Klor ile reaksiyon alfa-kloroeterler üretir. ⓘ
Sentez
Eterler çok sayıda yolla hazırlanabilir. Genel olarak alkil eterler, aril eterlerden daha kolay oluşur ve sonraki türler genellikle metal katalizörler gerektirir. ⓘ
Dietil eterin etanol ve sülfürik asit arasındaki bir reaksiyonla sentezi 13. yüzyıldan beri bilinmektedir. ⓘ
Alkollerin dehidrasyonu
Alkollerin dehidrasyonu eterleri ortaya çıkarır:
- 2 R-OH → R-O-R + H2O yüksek sıcaklıkta ⓘ
Bu doğrudan nükleofilik yer değiştirme reaksiyonu yüksek sıcaklıklar (yaklaşık 125 °C) gerektirir. Reaksiyon, genellikle sülfürik asit olmak üzere asitler tarafından katalize edilir. Yöntem simetrik eterler üretmek için etkilidir, ancak simetrik olmayan eterler için etkili değildir, çünkü her iki OH protonlanabilir, bu da bir ürün karışımı verir. Dietil eter bu yöntemle etanolden üretilir. Siklik eterler bu yaklaşımla kolayca üretilir. Eliminasyon reaksiyonları alkolün dehidrasyonu ile rekabet eder:
- R-CH2-CH2(OH) → R-CH=CH2 + H2O ⓘ
Dehidrasyon yolu genellikle hassas moleküllerle uyumlu olmayan koşullar gerektirir. Eter üretmek için daha hafif birkaç yöntem mevcuttur. ⓘ
Birincil alkoller, dehidrasyonla eter oluşturur. Dehidrasyon, alken oluşumu için uygulanan dehidrasyondan daha düşük sıcaklıklarda yapılır. Örneğin etanolün dehidrasyonuyla 140 °C'de başlıca ürün dietil eter, 180 °C'de etendir. ⓘ
Williamson eter sentezi
Alkil halojenürlerin alkoksitler tarafından nükleofilik yer değiştirmesi
- R-ONa + R′-X → R-O-R′ + NaX
Bu reaksiyon Williamson eter sentezi olarak adlandırılır. Alkoksit oluşturmak için bir ana alkolün güçlü bir baz ile muamele edilmesini ve ardından uygun bir ayrılma grubu (R-X) taşıyan uygun bir alifatik bileşiğin eklenmesini içerir. Uygun ayrılma grupları (X) iyodür, bromür veya sülfonatları içerir. Bu yöntem genellikle aril halojenürler için iyi çalışmaz (örneğin bromobenzen, aşağıdaki Ullmann kondenzasyonuna bakınız). Aynı şekilde, bu yöntem yalnızca birincil halojenürler için en iyi verimi verir. İkincil ve üçüncül halojenürler, büyük alkil gruplarından kaynaklanan sterik engelleme nedeniyle reaksiyonda kullanılan bazik alkoksit anyonuna maruz kaldıklarında E2 eliminasyonuna uğramaya eğilimlidirler. ⓘ
İlgili bir reaksiyonda, alkil halojenürler fenoksitler tarafından nükleofilik yer değiştirmeye uğrar. R-X alkol ile reaksiyona girmek için kullanılamaz. Ancak fenoller, alkil halojenür korunurken alkolün yerini almak için kullanılabilir. Fenoller asidik olduklarından, fenoksit iyonları oluşturmak için sodyum hidroksit gibi güçlü bir baz ile kolayca reaksiyona girerler. Fenoksit iyonu daha sonra alkil halojenürdeki -X grubunun yerine geçerek SN2 mekanizmasına sahip bir reaksiyonda kendisine bağlı bir aril grubu olan bir eter oluşturacaktır. ⓘ
- C6H5OH + OH- → C6H5-O- + H2O ⓘ
- C6H5-O- + R-X → C6H5VEYA ⓘ
Simetrik olmayan eterlerin eldesindeki en önemli yol Williamson sentezidir. Nükleofilik bir yer değiştirme tepkimesi olan bu sentezde alkolat (alkoksit) kullanılır. ⓘ
R-ONa + R'-X → R-O-R' + NaX ⓘ
Ullmann yoğuşması
Ullmann kondenzasyonu, substratın bir aril halojenür olması dışında Williamson yöntemine benzer. Bu tür reaksiyonlar genellikle bakır gibi bir katalizör gerektirir. ⓘ
Alkollerin alkenlere elektrofilik katılması
Alkoller elektrofilik olarak aktifleştirilmiş alkenlere eklenir.
- R2C=CR2 + R-OH → R2CH-C(-O-R)-R2
Bu reaksiyon için asit katalizi gereklidir. Genellikle, cıva trifloroasetat (Hg(OCOCF3)2), Markovnikov regiokimyası ile bir eter üreten reaksiyon için katalizör olarak kullanılır. Benzer reaksiyonlar kullanılarak, tetrahidropiranil eterler alkoller için koruyucu gruplar olarak kullanılır. ⓘ
Bu tepkime kuvvetli bir asit katalizörlüğünde gerçekleşir. ⓘ
R2C=CR2 + R-OH → R2CH-C(-O-R)-R2 ⓘ
Epoksitlerin hazırlanması
Epoksitler tipik olarak alkenlerin oksidasyonu ile hazırlanır. Endüstriyel ölçekte en önemli epoksit, etilenin oksijen ile oksidasyonu ile üretilen etilen oksittir. Diğer epoksitler iki yoldan biriyle üretilir:
- Alkenlerin m-CPBA gibi bir peroksiasit ile oksidasyonu ile.
- Bir halohidrinin baz intramoleküler nükleofilik sübstitüsyonu ile. ⓘ
Önemli eterler

|
Etilen oksit | Halkalı bir eter. Ayrıca en basit epoksittir. ⓘ |
| Dimetil eter | Aerosol sprey itici olarak kullanılan renksiz bir gaz. Dizel motorlar için 56-57 gibi yüksek bir setan oranına sahip potansiyel bir yenilenebilir alternatif yakıt. | |
| Dietil eter | Tatlı kokulu renksiz bir sıvı. Yaygın bir düşük kaynama noktalı çözücü (b.p. 34.6 °C) ve erken dönem anestezik. Dizel motorlar için çalıştırma sıvısı olarak kullanılır. Parfümeride kullanılmasının yanı sıra soğutucu olarak ve dumansız barut üretiminde de kullanılır. | |
| Dimetoksietan (DME) | Genellikle lityum pillerde bulunan suyla karışabilen bir çözücü (b.p. 85 °C): | |

|
Dioksan | Halkalı bir eter ve yüksek kaynama noktalı bir çözücüdür (b.p. 101,1 °C). |

|
Tetrahidrofuran (THF) | Çözücü olarak kullanılan en polar basit eterlerden biri olan halkalı bir eter. |

|
Anizol (metoksibenzen) | Bir aril eter ve anason tohumunun uçucu yağının ana bileşenidir. |

|
Taç eterleri | Faz transfer katalizörü olarak kullanılan döngüsel polieterler. |

|
Polietilen glikol (PEG) | Örneğin kozmetik ve eczacılıkta kullanılan doğrusal bir polieter. |
| Polipropilen glikol | Örneğin poliüretanlarda kullanılan doğrusal bir polieter. | |
|
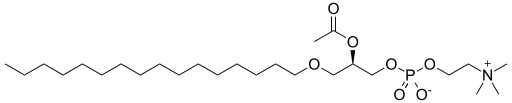
Trombosit aktive edici faktör | Bir eter lipid, sn-1 üzerinde bir eter, sn-2 üzerinde bir ester ve gliseril iskeletinin sn-3 üzerinde bir inorganik eter içeren bir örnek. |
Adlandırma
Dallanmış ve dallanmamış Eterlerde adlandırma
| Eterlerde adlandırma yapılırken dikkat edilecek hususlar. ⓘ |
| 1.) Dimetileter ya da Metoksimetan |
| 2.) 2-Metoksipropan |
| 3.) 1-Etoksi-2-floroetan |
Eterlerde adlandırma yapılırken kurala uygun olarak alkil grupları ya da aril grupları alfabetik sıraya göre yazılır ve sonuna "eter" eki getirilir. Bu kural simetrik eterlerin adlandırılmasında ismin başına di- ekinin getirilmesiyle kolayca çözülürken asimetrik olan eterlerde O-R grubunun alkoksil grubu olarak adlandırılmasında R kısmı da alkan olarak adlandırılır. Örneğin dietil eter, diğer bir deyişle etoksietan, dimetil eter, yani metoksi metan şeklinde adlandırılır. ⓘ
Yan taraftaki tabloya bakıldığında 1. ile gösterilen eter molekülü simetrik bir molekül olduğundan adlandırma zorluk çekilmeden yapılabilir. Burada oksijen atomunun her iki tarafında bulunan moleküller aynı olduğu için istenildiğinde dimetil eter şeklinde adlandırılacağı gibi metoksi metan şeklinde de adlandırılabilir. ⓘ
Tablodaki 2. örneğe bakıldığında molekülün simetrik bir molekül olmadığı görülür. Böyle durumlarda oksijenin bağlı olduğu ve yapısında daha az karbon içeren kısım alkoksi grubu olarak adlandırılır. Bu örnekte maviyle gösterilen kısım alkoksi grubu ve kırmızı olarak gösterilen kısım ise alkan grubu olarak adlandırılır. Bu yüzden oksijenin solunda bir karbon bundan dolayı metoksi, oksijenin sağ tarafında ise üç karbonlu bir molekül olduğu için propan denilir. Son olarak metoksi grubu alkanın ikinci karbonuna bağlı olduğu için 2- öne yazılır ve 2-metoksipropan şeklinde adlandırılmış olur. ⓘ
Tablodaki 3. örneğe bakıldığında oksijenin sağındaki ve solundaki karbon sayıları birbirine eşittir. Yalnız burada karbon ve hidrojen dışında üçüncü bir atom (F) bulunmaktadır ve bu yüzden daha fazla dallanma yapmış olarak kabul edilir. Bundan dolayı sol taraf alkan olarak ve sağ taraf da alkoki grubu olarak kabul edilir ve böyle adlandırılır. ⓘ
Siklo eterlerde adlandırma
| Siklo eterlerde adlandırma ⓘ | |
| 1. oksasikloheksan | 2. 4-floroksasikloheksan |
Siklo eterlerde adlandırma yapılırken dikkat edilecek hususları yandaki tabloda verilen örnekler üzerinden gösterilmekdedir. ⓘ
Yandaki tabloda 1. ile gösterilen örneğe bakıldığında halkasal bir yapı gösterdiğini görülür. Diğer dikkat çekecek husus ise halkasal yapıyı oluşturan altı atomunun hepsinin karbon olmadığı, bunlardan birinin oksijen olduğudur. İşte halka altı atomdan oluştuğu için heksan ve bu altı atomdan birisinin oksijen olmasıyla da oksa ve halkalı olmasından dolayı da siklo eklerini alır. Sonuç olarak oksasikloheksan şeklinde adlandırma yapılır. ⓘ
Tablodaki 2. örneğe bakıldığında bir önceki örneğe göre farkı yapısında flor atomunun bulunmasıdır. Burada dikkat edilecek husus ise oksijen atomunda karbon atomuymuş gibi sayılması ve bununla flor atomunun yerinin belirtilmesidir. Bu işlemi yaptıktan sonra ortaya çıkan 4-flor oksa siklo heksan, IUPAC adlandırma yöntemini gösterir. ⓘ
Kimyasal özellikleri
- Eterdeki oksijen atomu, eterleri bazik yapar. Eterler, proton verici maddelerle tepkimeye girerek oksonyum tuzlarını oluşturur.
- Dialkil eterler kuvvetli asitlerle ısıtıldıklarında oksijen-karbon bağının kırıldığı tepkimeler gerçekleşir. ⓘ
C2H5OC2H5 + 2HBr → 2C2H5Br + H2O ⓘ
- Çok kolay tutuşurlar. ⓘ
Fiziksel özelikleri
- Renksizdirler ve kendilerine özgü hoş kokuları vardır.
- Polar bileşiklerdir.
- Suda çözünürler, karbon sayısı arttıkça çözünürlük azalır. Dimetil eterin 100 mL sudaki çözünürlüğü 71 g iken, dietil eterin çözünürlüğü 8 gramdır.
- Alkollerle fonksiyonel grup izomeridir. Alkollerde hidrojen bağı olduğu için alkollerin kaynama noktası çok daha yüksektir.
- Vernik, reçine, katı ve sıvı yağlar eterde iyi çözünür. Bu sebeple özütleme (ektraksiyon) işlemlerinde sık kullanılırlar.
- Küçük eterler tatsızdır. ⓘ











