Etanol

| |||
|
| |||
|
| |||
| İsimler | |||
|---|---|---|---|
| Telaffuz | /ˈɛθənɒl/ | ||
| Tercih edilen IUPAC adı
Etanol | |||
| Diğer isimler
mutlak alkol
alkol kolonya ruhu alkol içmek eti̇li̇k alkol EtOH eti̇l alkol etil hidrat etil hidroksit etilol tahıl alkolü hidroksietan metilkarbinol | |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| 3DMet | |||
Beilstein Referans
|
1718733 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
Gmelin Referans
|
787 | ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
| BM numarası | UN 1170 | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
C2H6O | ||
| Molar kütle | 46.069 g-mol-1 | ||
| Görünüş | Renksiz sıvı | ||
| Koku | Metanol benzeri | ||
| Yoğunluk | 0,78945 g/cm3 (20 °C'de) | ||
| Erime noktası | -114,14 ± 0,03 °C (-173,45 ± 0,05 °F; 159,01 ± 0,03 K) | ||
| Kaynama noktası | 78.23 ± 0.09 °C (172.81 ± 0.16 °F; 351.38 ± 0.09 K) | ||
Suda çözünürlük
|
Karışabilir | ||
| log P | −0.18 | ||
| Buhar basıncı | 5,95 kPa (20 °C'de) | ||
| Asitlik (pKa) | 15,9 (H2O), 29,8 (DMSO) | ||
Manyetik duyarlılık (χ)
|
-33,60-10-6 cm3/mol | ||
Kırılma indisi (nD)
|
1.3611 | ||
| Viskozite | 1,2 mPa-s (20 °C'de), 1,074 mPa-s (25 °C'de) | ||
Dipol moment
|
1.69 D | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|
 
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H225, H319 | ||
İhtiyati ifadeler
|
P210, P280, P305+P351+P338 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | 14 °C (Mutlak) | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
7340 mg/kg (oral, sıçan) 7300 mg/kg (fare) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 1000 ppm (1900 mg/m3) | ||
REL (Önerilen)
|
TWA 1000 ppm (1900 mg/m3) | ||
IDLH (Acil tehlike)
|
N.D. | ||
| Güvenlik veri sayfası (SDS) | |||
| İlgili bileşikler | |||
İlgili bileşikler
|
Etan Metanol | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Etanol (etil alkol, tahıl alkolü, içme alkolü veya sadece alkol olarak da adlandırılır) organik bir kimyasal bileşiktir. C2H6O kimyasal formülüne sahip basit bir alkoldür. Formülü CH olarak da yazılabilir
3-CH
2-OH veya C
2H
5OH (bir hidroksil grubuna bağlı bir etil grubu) ve genellikle EtOH olarak kısaltılır. Etanol, karakteristik şarap benzeri kokusu ve keskin tadı olan uçucu, yanıcı, renksiz bir sıvıdır. Psikoaktif bir ilaç, eğlence amaçlı bir uyuşturucu ve alkollü içeceklerin aktif bileşenidir. ⓘ
Etanol, şekerlerin mayalar tarafından fermantasyonu veya etilen hidrasyonu gibi petrokimyasal süreçler yoluyla doğal olarak üretilir. Antiseptik ve dezenfektan olarak tıbbi uygulamaları vardır. Kimyasal bir çözücü olarak ve organik bileşiklerin sentezinde ve bir yakıt kaynağı olarak kullanılır. Etanol ayrıca önemli bir kimyasal hammadde olan etilen yapmak için dehidre edilebilir. ⓘ
| Etanol ⓘ | |
|---|---|
 
| |
| Genel | |
| Kimyasal Adı | Etanol |
| Diğer adları | Etil alkol, bitkisel alkol, hidroksietan, EtOH |
| Kimyasal formül | C2H5OH |
| SMILES | CCO |
| Molekül ağırlığı | 46.06844(232) g/mol |
| Görünüşü | Renksiz Sıvı |
| CAS numarası | 64-17-5 |
| Özellikler | |
| Yoğunluk ve faz | 0.789 g/cm³, sıvı |
| Suda Çözünürlük | Tamamıyla |
| Erime noktası | −114.3 °C (158.8 K) |
| Kaynama noktası | 78.4 °C (351.6 K) |
| Asidite (pKa) | 15.9 (OH grubundan H+) |
| Viskozite | 1.200 cP 20 °C de |
| Dipol momenti | 1.69 D (gaz) |
| Tehlikeleri | |
| MGVS | Dış MGVS |
| EU sınıflandırması | Yanıcı (F) |
| NFPA 704 | |
| R-ifadeleri | R11 |
| S-ifadeleri | S2, S7, S16 |
| Parlama noktası | 13 °C |
| RTECS nosu | KQ6300000 |
| Destekleyici veri sayfası | |
| Yapısı ve özellikleri | n, εr, vb. |
| Termodinamik veri | Faz davranışı Katı, sıvı, gaz |
| Spektral veri | UV, IR, NMR, MS |
| İlgili bileşikler | |
| İlgili alkoller | Metanol, 1-Propanol |
| Diğer heteroatomlar | Etilamin, Etil klorür, Etil bromür, Etantiyol |
| Yerine geçen etanoller | Etilen glikol, Etanolamin, 2-Kloroetanol |
| Diğer bileşikler | Asetaldehit, Asetik asit |
| Aksi belirtilmediği sürece, veriler malzemelerin standart halleri (at 25°C, 100 kPa) için verilmiştir Kaynakça ve sorumluluk reddi | |
Etimoloji
Etanol, Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC) tarafından iki karbon atomlu bir alkil grubundan ("eth-" ön eki), aralarında tek bir bağ bulunan ("-an-" son eki) ve bağlı bir fonksiyonel grup olan -OH grubundan ("-ol" son eki) oluşan bir bileşik için tanımlanan sistematik isimdir. ⓘ
"Etil alkol "deki "eth-" ön eki ve "etil" niteleyicisi aslen 1834 yılında C
2H
5- Justus Liebig tarafından. Bu kelimeyi Almanca Aether olarak bilinen C
2H
5-O-C
2H
5 (İngilizce'de yaygın olarak "eter", daha spesifik olarak "dietil eter" olarak adlandırılır). Oxford İngilizce Sözlüğü'ne göre Ethyl, Eski Yunanca αἰθήρ (aithḗr, "üst hava") ve Yunanca ὕλη (hýlē, "madde") sözcüklerinin kısaltılmış halidir. ⓘ
Etanol adı, Nisan 1892'de İsviçre'nin Cenevre kentinde düzenlenen Uluslararası Kimyasal Adlandırma Konferansı'nda kabul edilen bir kararın sonucu olarak ortaya çıkmıştır. ⓘ
"Alkol" terimi artık kimya terminolojisinde daha geniş bir madde sınıfını ifade etmektedir, ancak yaygın kullanımda etanolün adı olarak kalmaktadır. Antik çağlardan beri kozmetik olarak kullanılan toz haline getirilmiş bir antimon cevheri olan Arapça al-kuḥl'den Ortaçağ'da ödünç alınmış ve Orta Latince'de bu anlamını korumuştur. Etanol (tam olarak "şarap alkolü") için "alkol" kullanımı moderndir ve ilk olarak 1753 yılında kaydedilmiştir. 18. yüzyılın sonlarından önce "alkol" terimi genellikle süblimleşmiş herhangi bir maddeyi ifade etmekteydi. ⓘ
Kullanım Alanları
Tıbbi
Antiseptik
Etanol tıbbi mendillerde ve en yaygın olarak antibakteriyel el dezenfektanı jellerinde bakterisidal ve anti-fungal etkileri nedeniyle antiseptik olarak kullanılır. Etanol, mikroorganizmaları membran lipid çift tabakalarını çözerek ve proteinlerini denatüre ederek öldürür ve çoğu bakteri, mantar ve virüse karşı etkilidir. Bununla birlikte, bakteri sporlarına karşı etkisizdir, ancak bu durum hidrojen peroksit kullanılarak hafifletilebilir. 70'lik bir etanol çözeltisi saf etanolden daha etkilidir çünkü etanol optimum antimikrobiyal aktivite için su moleküllerine dayanır. Mutlak etanol mikropları yok etmeden etkisiz hale getirebilir çünkü alkol mikrobun zarına tam olarak nüfuz edemez. Etanol dezenfektan ve antiseptik olarak da kullanılabilir çünkü hücre zarındaki ozmotik dengeyi bozarak hücre dehidrasyonuna neden olur, böylece su hücreyi terk ederek hücre ölümüne yol açar. ⓘ
Panzehir
Etanol, etilen glikol zehirlenmesi ve metanol zehirlenmesine karşı bir panzehir olarak uygulanabilir. Etanol, alkol dehidrojenaz için metanol ve etilen glikole karşı rekabetçi bir inhibitör olarak hareket ederek bu sürece hizmet eder. Daha fazla yan etkisi olmasına rağmen etanol, metanol ve etilen glikol zehirlenmelerinde de panzehir olarak kullanılan fomepizole göre daha ucuzdur ve daha kolay temin edilebilir. ⓘ
Tıbbi çözücü
Etanol, genellikle yüksek konsantrasyonlarda, suda çözünmeyen birçok ilacı ve ilgili bileşikleri çözmek için kullanılır. Örneğin, ağrı kesici ilaçların, öksürük ve soğuk algınlığı ilaçlarının ve ağız yıkamalarının sıvı preparatları %25'e kadar etanol içerebilir ve alkole bağlı solunum reaksiyonları gibi etanole karşı olumsuz reaksiyonları olan bireylerde kaçınılması gerekebilir. Etanol, asetaminofen, demir takviyeleri, ranitidin, furosemid, mannitol, fenobarbital, trimetoprim/sülfametoksazol ve reçetesiz satılan öksürük ilaçları dahil olmak üzere 700'den fazla sıvı ilaç preparatında esas olarak antimikrobiyal koruyucu olarak bulunur. ⓘ
Farmakoloji
Memelilerde etanol öncelikle karaciğer ve midede alkol dehidrojenaz (ADH) enzimleri tarafından metabolize edilir. Bu enzimler etanolün asetaldehide (etanal) oksidasyonunu katalize eder:
- CH3CH2OH + NAD+ → CH3CHO + NADH + H+ ⓘ
Önemli konsantrasyonlarda bulunduğunda, etanolün bu metabolizmasına ek olarak insanlarda sitokrom P450 enzimi CYP2E1 yardımcı olurken, eser miktarlar da katalaz tarafından metabolize edilir. ⓘ
Ortaya çıkan ara ürün asetaldehit, bilinen bir kanserojendir ve insanlarda etanolün kendisinden önemli ölçüde daha fazla toksisite oluşturur. Tipik olarak alkol zehirlenmesi ile ilişkilendirilen semptomların birçoğunun yanı sıra tipik olarak uzun süreli etanol tüketimi ile ilişkilendirilen sağlık tehlikelerinin birçoğu insanlarda asetaldehit toksisitesine bağlanabilir. ⓘ
Asetaldehitin daha sonra asetata oksidasyonu aldehit dehidrojenaz (ALDH) enzimleri tarafından gerçekleştirilir. Bu enzimin inaktif veya işlevsiz bir formunu kodlayan ALDH2 genindeki bir mutasyon, Doğu Asya popülasyonlarının yaklaşık %50'sini etkilemekte ve cildin geçici olarak kızarmasına ve asetaldehit toksisitesinin bir dizi ilgili ve genellikle hoş olmayan semptomuna neden olabilen karakteristik alkol yıkama reaksiyonuna katkıda bulunmaktadır. Bu mutasyona tipik olarak Doğu Asyalıların yaklaşık %80'inde alkol dehidrojenaz enzimi ADH1B'de etanolün asetaldehide dönüştürülmesinde katalitik etkinliği artıran başka bir mutasyon eşlik eder. ⓘ
Rekreasyonel
Merkezi sinir sistemi depresanı olan etanol, en yaygın tüketilen psikoaktif ilaçlardan biridir. ⓘ
Alkolün psikoaktif ve kanserojen özelliklerine rağmen, çoğu ülkede kolayca bulunabilmekte ve satışı yasaldır. Bununla birlikte, alkollü içeceklerin satışı, ihracatı/ithalatı, vergilendirilmesi, üretimi, tüketimi ve bulundurulmasını düzenleyen yasalar bulunmaktadır. En yaygın düzenleme reşit olmayanlar için yasaklamadır. ⓘ
Yakıt
Motor yakıtı
| Yakıt türü | MJ/L | MJ/kg | Araştırma oktan numara |
|---|---|---|---|
| Kuru ahşap (%20 nem) | ~19.5 | ||
| Metanol | 17.9 | 19.9 | 108.7 |
| Etanol | 21.2 | 26.8 | 108.6 |
| E85 (%85 etanol, %15 benzin) |
25.2 | 33.2 | 105 |
| Sıvılaştırılmış doğal gaz | 25.3 | ~55 | |
| Otogaz (LPG) (%60 propan + %40 bütan) |
26.8 | 50 | |
| Havacılık benzini (yüksek oktanlı benzin, jet yakıtı değil) |
33.5 | 46.8 | 100/130 (yağsız/zengin) |
| Gasohol (%90 benzin + %10 etanol) |
33.7 | 47.1 | 93/94 |
| Normal benzin/petrol | 34.8 | 44.4 | min. 91 |
| Premium benzin/petrol | maks. 104 | ||
| Dizel | 38.6 | 45.4 | 25 |
| Kömür, ekstrüde | 50 | 23 |
Etanolün tek başına en büyük kullanım alanı motor yakıtı ve yakıt katkı maddesidir. Özellikle Brezilya, kısmen dünyanın önde gelen etanol üreticilerinden biri olması nedeniyle etanolün motor yakıtı olarak kullanımına büyük ölçüde güvenmektedir. Brezilya'da satılan benzin en az %25 oranında susuz etanol içerir. Susuz etanol (yaklaşık %95 etanol ve %5 su) ülkede satılan yeni benzinli araçların %90'ından fazlasında yakıt olarak kullanılabilmektedir. Brezilya etanolü, diğer bazı enerji bitkilerine kıyasla nispeten yüksek verime sahip olan (üretmek için kullanılan fosil yakıtlardan %830 daha fazla yakıt) şeker kamışından üretilmektedir. ABD ve diğer birçok ülke öncelikle E10 (%10 etanol, bazen gasohol olarak da bilinir) ve E85 (%85 etanol) etanol/benzin karışımlarını kullanmaktadır. ⓘ

Avustralya yasaları şeker kamışı atıklarından elde edilen saf etanolün otomobillerde kullanımını %10 ile sınırlamaktadır. Daha eski otomobillerin (ve daha yavaş yanan bir yakıt kullanmak üzere tasarlanmış eski otomobillerin) motor valfleri yükseltilmeli veya değiştirilmelidir. ⓘ
Bir endüstri savunma grubuna göre, yakıt olarak etanol, karbon monoksit, partikül madde, nitrojen oksitleri ve diğer ozon oluşturan kirleticilerin zararlı egzoz borusu emisyonlarını azaltmaktadır. Argonne Ulusal Laboratuvarı birçok farklı motor ve yakıt kombinasyonunun sera gazı emisyonlarını analiz etmiş ve saf benzinle karşılaştırıldığında biyodizel/petrodizel karışımının (B20) %8, geleneksel E85 etanol karışımının %17 ve selülozik etanolün %64 oranında azalma gösterdiğini tespit etmiştir. Etanol, benzinden çok daha yüksek bir araştırma oktan sayısına (RON) sahiptir, yani ön ateşlemeye daha az eğilimlidir, daha iyi ateşleme ilerlemesine izin verir, bu da daha düşük karbon emisyonlarına ek olarak daha fazla tork ve verimlilik anlamına gelir. ⓘ
İçten yanmalı bir motorda etanolün yanması, benzin tarafından üretilen eksik yanma ürünlerinin çoğunu ve önemli ölçüde daha fazla miktarda formaldehit ve asetaldehit gibi ilgili türleri ortaya çıkarır. Bu da önemli ölçüde daha büyük bir fotokimyasal reaktiviteye ve daha fazla yer seviyesi ozonuna yol açar. Bu veriler, yakıt emisyonlarının karşılaştırıldığı Temiz Yakıtlar Raporu'nda bir araya getirilmiştir ve etanol egzozunun benzin egzozundan 2,14 kat daha fazla ozon ürettiğini göstermektedir. Bu, Temiz Yakıtlar Raporu'nun özel Yerel Kirlilik Endeksi'ne (LPI) eklendiğinde, etanolün yerel kirliliği (dumana katkıda bulunan kirlilik) 1.7 olarak derecelendirilir, benzin 1.0'dır ve daha yüksek sayılar daha fazla kirlilik anlamına gelir. Kaliforniya Hava Kaynakları Kurulu, 2008 yılında formaldehitler için kontrol standartlarını, geleneksel NOx ve Reaktif Organik Gazlar (ROG'ler) gibi bir emisyon kontrol grubu olarak kabul ederek bu konuyu resmileştirmiştir. ⓘ
Dünya etanol üretimi 2006 yılında 51 gigalitre (1.3×1010 US gal) olup, dünya arzının %69'u Brezilya ve Amerika Birleşik Devletleri'nden gelmektedir. Brezilya'daki otomobillerin %20'sinden fazlası yakıt olarak %100 etanol kullanabilmektedir; bu motorlar arasında sadece etanol kullanan motorlar ve esnek yakıtlı motorlar bulunmaktadır. Brezilya'daki esnek yakıtlı motorlar tamamen etanol, tamamen benzin veya her ikisinin karışımı ile çalışabilmektedir. ABD'de esnek yakıtlı araçlar %0 ila %85 etanol (%15 benzin) ile çalışabilmektedir, zira daha yüksek etanol karışımlarına henüz izin verilmemektedir. Brezilya, etanol yakan bu otomobil filosunu, yurt içinde yetiştirilen şeker kamışından etanol üreten büyük bir ulusal altyapı ile desteklemektedir. Şeker kamışı sadece mısırdan daha fazla sakaroz konsantrasyonuna sahip olmakla kalmaz (yaklaşık %30 oranında), aynı zamanda çıkarılması da çok daha kolaydır. İşlem sonucunda ortaya çıkan küspe israf edilmemekte, elektrik santrallerinde elektrik üretmek için kullanılmaktadır. ⓘ
Amerika Birleşik Devletleri'nde etanol yakıt endüstrisi büyük ölçüde mısıra (mısır olarak da bilinir) dayanmaktadır. Yenilenebilir Yakıtlar Birliği'ne göre, 30 Ekim 2007 itibariyle, ABD'de 131 tahıl etanolü biyo-rafinerisi yılda 7.0 milyar ABD galonu (26,000,000 m3) etanol üretme kapasitesine sahiptir. (ABD'de) devam eden 72 inşaat projesi, önümüzdeki 18 ay içinde 6,4 milyar ABD galonu (24.000.000 m3) yeni kapasite ekleyebilir. Zaman içinde, benzin için yıllık ≈150 milyar ABD galonu (570.000.000 m3) olan pazarın önemli bir kısmının yakıt etanolü ile değiştirilmeye başlanacağına inanılmaktadır. ⓘ
Tatlı sorgum bir başka potansiyel etanol kaynağıdır ve kurak arazi koşullarında yetiştirilmeye uygundur. Uluslararası Yarı Kurak Tropik Bitkiler Araştırma Enstitüsü (ICRISAT), Asya ve Afrika'nın kurak bölgelerinde yakıt, gıda ve hayvan yemi kaynağı olarak sorgum yetiştirme olasılığını araştırmaktadır. Tatlı sorgum aynı zaman diliminde şeker kamışının üçte biri kadar su ihtiyacına sahiptir. Ayrıca mısırdan yaklaşık %22 daha az su gerektirir. Dünyanın ilk tatlı sorgum etanol damıtma tesisi 2007 yılında Andhra Pradesh, Hindistan'da ticari üretime başlamıştır. ⓘ
Etanolün suyla yüksek oranda karışabilir olması, sıvı hidrokarbonlar gibi modern boru hatlarıyla nakledilmesini uygunsuz kılmaktadır. Tamirciler küçük motorlarda (özellikle karbüratörde) hasar vakalarının arttığını görmüş ve bu hasarı etanolün yakıtta daha fazla su tutmasına bağlamışlardır. ⓘ
Roket yakıtı
Etanol, sıvı oksijen gibi bir oksitleyici ile birlikte erken dönem çift yakıtlı roket (sıvı tahrikli) araçlarında yakıt olarak yaygın bir şekilde kullanılmıştır. İkinci Dünya Savaşı'nın Alman A-4 balistik roketi, daha çok propaganda adı olan V-2 ile bilinir ve uzay çağını başlattığı kabul edilir, B-Stoff'un ana bileşeni olarak etanol kullanmıştır. Bu isimlendirme altında, yanma odası sıcaklığını düşürmek için etanol %25 su ile karıştırılıyordu. V-2'nin tasarım ekibi, ilk ABD uydusunu fırlatan etanol yakıtlı Redstone roketi de dahil olmak üzere, İkinci Dünya Savaşı sonrasında ABD roketlerinin geliştirilmesine yardımcı oldu. Daha enerji yoğun roket yakıtları geliştirildikçe alkoller genel olarak kullanım dışı kaldı, ancak etanol şu anda hafif roketle çalışan yarış uçaklarında kullanılmaktadır. ⓘ
Yakıt hücreleri
Ticari yakıt hücreleri yeniden biçimlendirilmiş doğal gaz, hidrojen veya metanol ile çalışır. Etanol, geniş çapta bulunabilirliği, düşük maliyeti, yüksek saflığı ve düşük toksisitesi nedeniyle cazip bir alternatiftir. Doğrudan etanol yakıt hücreleri, oto-termal reforming sistemleri ve termal olarak entegre edilmiş sistemler dahil olmak üzere denemelere girmiş çok çeşitli yakıt hücresi konseptleri bulunmaktadır. Etanol yakıt hücrelerinin ticarileştirilmesinin başlangıcında olan bir dizi kuruluş olmasına rağmen, çalışmaların çoğu araştırma düzeyinde yürütülmektedir. ⓘ
Evsel ısıtma ve pişirme
Etanol şömineler ev ısıtması veya dekorasyon için kullanılabilir. Etanol ayrıca yemek pişirmek için soba yakıtı olarak da kullanılabilir. ⓘ
Hammadde
Etanol önemli bir endüstriyel bileşendir. Etil halojenürler, etil esterler, dietil eter, asetik asit ve etil aminler gibi diğer organik bileşikler için öncü olarak yaygın bir kullanıma sahiptir. ⓘ
Çözücü
Etanol, moleküler yapısı hem polar, hidrofilik hem de polar olmayan, hidrofobik bileşiklerin çözülmesine izin verdiği için evrensel bir çözücü olarak kabul edilir. Etanol ayrıca düşük bir kaynama noktasına sahip olduğundan, diğer bileşikleri çözmek için kullanılan bir çözeltiden çıkarılması kolaydır, bu da onu botanik yağlar için popüler bir ekstraksiyon maddesi haline getirir. Kenevir yağı ekstraksiyon yöntemleri genellikle etanolü bir ekstraksiyon çözücüsü olarak ve ayrıca kışlama olarak bilinen bir işlemde yağları, mumları ve klorofili çözeltiden çıkarmak için işlem sonrası bir çözücü olarak kullanır. ⓘ
Etanol boyalarda, tentürlerde, işaretleyicilerde ve ağız gargaraları, parfümler ve deodorantlar gibi kişisel bakım ürünlerinde bulunur. Bununla birlikte, polisakkaritler alkol varlığında sulu çözeltiden çökelir ve etanol çökeltmesi bu nedenle DNA ve RNA'nın saflaştırılmasında kullanılır. ⓘ
Düşük sıcaklıkta sıvı
Düşük donma noktası -173,20 °F (-114,14 °C) ve düşük toksisitesi nedeniyle, etanol bazen laboratuvarlarda (kuru buz veya diğer soğutucularla birlikte) kapları suyun donma noktasının altındaki sıcaklıklarda tutmak için bir soğutma banyosu olarak kullanılır. Aynı nedenle, alkol termometrelerinde aktif sıvı olarak da kullanılır. ⓘ
Kimya
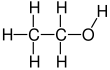
Kimyasal formül
Etanol 2 karbonlu bir alkoldür. Moleküler formülü CH3CH2OH'dir. Alternatif bir gösterim CH3-CH2-OH olup, bir metil grubunun (CH3-) karbonunun, bir hidroksil grubunun (-OH) oksijenine bağlı olan bir metilen grubunun (-CH2-) karbonuna bağlı olduğunu gösterir. Dimetil eterin yapısal bir izomeridir. Etanol bazen, etil grubunu (C2H5-) Et ile temsil eden yaygın organik kimya notasyonu kullanılarak EtOH olarak kısaltılır. ⓘ
Fiziksel özellikler

Etanol hafif bir kokuya sahip, uçucu, renksiz bir sıvıdır. Normal ışıkta her zaman görülemeyen dumansız mavi bir alevle yanar. Etanolün fiziksel özellikleri öncelikle hidroksil grubunun varlığından ve karbon zincirinin kısalığından kaynaklanır. Etanolün hidroksil grubu hidrojen bağına katılabilir, bu da onu propan gibi benzer moleküler ağırlığa sahip daha az polar organik bileşiklerden daha viskoz ve daha az uçucu hale getirir. ⓘ
Etanolün havada yanma için adyabatik alev sıcaklığı 2082 Celsius veya 3779 Fahrenheit'tır. ⓘ
Etanol sudan biraz daha kırıcıdır, kırılma indisi 1.36242'dir (λ=589.3 nm ve 18.35 °C veya 65.03 °F'de). Etanol için üçlü nokta 4,3 × 10-4 Pa basınçta 150 K'dir. ⓘ
Çözücü özellikleri
Etanol çok yönlü bir çözücüdür, suyla ve asetik asit, aseton, benzen, karbon tetraklorür, kloroform, dietil eter, etilen glikol, gliserol, nitrometan, piridin ve toluen gibi birçok organik çözücü ile karışabilir. Çözücü olarak ana kullanımı iyot tentürü, öksürük şurupları vb. yapmaktır. Ayrıca pentan ve hekzan gibi hafif alifatik hidrokarbonlarla ve trikloroetan ve tetrakloroetilen gibi alifatik klorürlerle karışabilir. ⓘ
Etanolün suyla karışabilirliği, karbon sayısı arttıkça suyla karışabilirliği keskin bir şekilde azalan daha uzun zincirli alkollerin (beş veya daha fazla karbon atomu) karışmazlığıyla tezat oluşturur. Etanolün alkanlarla karışabilirliği undekana kadar olan alkanlarla sınırlıdır: dodekan ve daha yüksek alkanlarla karışımlar belirli bir sıcaklığın altında (dodekan için yaklaşık 13 °C) bir karışabilirlik boşluğu gösterir. Karışabilirlik aralığı daha yüksek alkanlarla genişleme eğilimindedir ve tam karışabilirlik için sıcaklık artar. ⓘ
Etanol-su karışımları, verilen fraksiyonlarda kendi bileşenlerinin toplamından daha az hacme sahiptir. Eşit hacimlerde etanol ve su karıştırıldığında sadece 1,92 hacim karışım elde edilir. Etanol ve suyun karıştırılması ekzotermiktir ve 298 K'de 777 J/mol'e kadar açığa çıkar. ⓘ
Etanol ve su karışımları normal basınçta yaklaşık %89 mol-etanol ve %11 mol- su veya kütlece %95,6 etanol (veya hacimce yaklaşık %97 alkol) karışımından oluşan bir azeotrop oluşturur ve 351K'da (78 °C) kaynar. Bu azeotropik bileşim güçlü bir şekilde sıcaklık ve basınca bağlıdır ve 303 K'nin altındaki sıcaklıklarda kaybolur. ⓘ

Hidrojen bağı, saf etanolün havadaki suyu kolayca emdiği ölçüde higroskopik olmasına neden olur. Hidroksil grubunun polar yapısı, etanolün başta sodyum ve potasyum hidroksitler, magnezyum klorür, kalsiyum klorür, amonyum klorür, amonyum bromür ve sodyum bromür olmak üzere birçok iyonik bileşiği çözmesine neden olur. Sodyum ve potasyum klorürler etanolde az çözünür. Etanol molekülü aynı zamanda polar olmayan bir uca sahip olduğundan, çoğu uçucu yağ ve çok sayıda tatlandırıcı, renklendirici ve tıbbi madde dahil olmak üzere polar olmayan maddeleri de çözecektir. ⓘ
Suya yüzde birkaç oranında etanol eklenmesi bile suyun yüzey gerilimini keskin bir şekilde azaltır. Bu özellik "şarabın gözyaşları" fenomenini kısmen açıklamaktadır. Şarap bir kadehte döndürüldüğünde, etanol kadehin duvarındaki ince şarap tabakasından hızla buharlaşır. Şarabın etanol içeriği azaldıkça, yüzey gerilimi artar ve ince film "boncuklanır" ve düz bir tabaka yerine kanallar halinde bardaktan aşağı akar. ⓘ
Yanıcılık
Bir etanol-su çözeltisi, parlama noktası olarak adlandırılan bir sıcaklığın üzerinde ısıtılırsa ve daha sonra üzerine bir ateşleme kaynağı uygulanırsa alev alacaktır. Kütlece %20 alkol (hacimce yaklaşık %25) için bu durum yaklaşık 25 °C'de (77 °F) meydana gelecektir. Saf etanolün parlama noktası 13 °C'dir (55 °F), ancak basınç ve nem gibi atmosferik bileşimden çok az etkilenebilir. Etanol karışımları ortalama oda sıcaklığının altında tutuşabilir. Etanol, kütlece %2,35'in (hacimce %3,0; 6 proof) üzerindeki konsantrasyonlarda yanıcı bir sıvı (Sınıf 3 Tehlikeli Madde) olarak kabul edilir. ⓘ
ⓘEtanol-su karışımlarının parlama noktaları Etanol
kütle fraksiyonu, %Sıcaklık °C °F 1 84,5 184.1 2 64 147 2.35 60 140 3 51,5 124.7 5 43 109 6 39,5 103.1 10 31 88 20 25 77 30 24 75 40 21,9 71.4 50 20 68 60 17,9 64.2 70 16 61 80 15,8 60.4 90 14 57 100 12,5 54.5
Mutfak efektleri için yanan alkol kullanılan yemeklere flambe denir. ⓘ
Doğal oluşum
Etanol, mayanın metabolik sürecinin bir yan ürünüdür. Bu nedenle, etanol herhangi bir maya habitatında mevcut olacaktır. Etanol genellikle olgunlaşmış meyvelerde bulunabilir. Simbiyotik maya tarafından üretilen etanol bertam palmiyesi çiçeklerinde bulunabilir. Beş kuyruklu ağaç faresi gibi bazı hayvan türleri etanol arama davranışları sergilese de, çoğu etanol içeren besin kaynaklarına ilgi göstermez veya bunlardan kaçınır. Etanol ayrıca birçok bitkinin çimlenmesi sırasında doğal anaerobiyozun bir sonucu olarak üretilir. Etanol, yıldızlararası bulutlardaki toz taneciklerinin etrafında buzlu bir kaplama oluşturarak uzayda tespit edilmiştir. Sağlıklı gönüllülerin nefeslerinde çok küçük miktarlarda (ortalama 196 ppb) endojen etanol ve asetaldehit bulunmuştur. Bağırsak fermantasyon sendromu olarak da bilinen oto-bira sendromu, sindirim sistemi içinde endojen fermantasyon yoluyla sarhoş edici miktarlarda etanolün üretildiği nadir bir tıbbi durumdur. ⓘ
Üretim

Etanol hem petrokimyasal olarak etilenin hidrasyonu yoluyla hem de biyolojik süreçlerle şekerlerin maya ile fermente edilmesi yoluyla üretilmektedir. Hangi sürecin daha ekonomik olduğu, petrol ve tahıl besleme stoklarının geçerli fiyatlarına bağlıdır. 1970'lerde Amerika Birleşik Devletleri'nde endüstriyel etanolün çoğu petrokimyasal olarak üretiliyordu, ancak 1980'lerde Amerika Birleşik Devletleri mısır bazlı etanol için sübvansiyonlar getirdi ve bugün neredeyse tamamı bu kaynaktan üretiliyor. Hindistan'da etanol şeker kamışından yapılmaktadır. ⓘ
Etilen hidrasyonu
Endüstriyel hammadde veya çözücü olarak kullanılmak üzere etanol (bazen sentetik etanol olarak da adlandırılır) petrokimyasal hammaddelerden, öncelikle etilenin asit katalizli hidrasyonu ile yapılır:
- C
2H
4 + H
2O → CH
3CH
2OH ⓘ
Katalizör çoğunlukla silika jel veya diyatomlu toprak gibi gözenekli bir destek üzerine adsorbe edilen fosforik asittir. Bu katalizör ilk olarak 1947 yılında Shell Oil Company tarafından büyük ölçekli etanol üretimi için kullanılmıştır. Reaksiyon, 300 °C'de (572 °F) yüksek basınçlı buhar varlığında gerçekleştirilir ve burada 5:3 etilen/buhar oranı korunur. Bu süreç Union Carbide Corporation ve ABD'deki diğerleri tarafından endüstriyel ölçekte kullanılmıştır, ancak şu anda sadece LyondellBasell ticari olarak kullanmaktadır. ⓘ
İlk kez 1930 yılında Union Carbide tarafından endüstriyel ölçekte uygulanan, ancak artık neredeyse tamamen kullanılmayan daha eski bir süreçte etilen, etil sülfat üretmek için konsantre sülfürik asit ile reaksiyona sokularak dolaylı olarak hidratlanır, bu da etanol elde etmek ve sülfürik asidi yeniden üretmek için hidrolize edilir:
- C
2H
4 + H
2SO
4 → CH
3CH
2SO
4H - CH
3CH
2SO
4H + H
2O → CH
3CH
2OH + H
2SO
4 ⓘ
CO2'den
Etanol, biyolojik ve elektrokimyasal reaksiyonlar yoluyla karbondioksitin dönüştürülmesiyle laboratuvarda üretilmiştir. ⓘ
- CO2 + H
2O → CH
3CH
2OH + yan ürünler ⓘ
Fermantasyon
Alkollü içeceklerdeki ve yakıtlardaki etanol fermantasyon yoluyla üretilir. Bazı maya türleri (örneğin Saccharomyces cerevisiae) şekeri metabolize ederek etanol ve karbondioksit üretir. Aşağıdaki kimyasal denklemler dönüşümü özetlemektedir:
- C
6H
12O
6 → 2 CH
3CH
2OH + 2 CO2 - C
12H
22O
11 + H
2O → 4 CH
3CH
2OH + 4 CO2 ⓘ
Fermantasyon, mayanın alkol üretmek için uygun termal koşullar altında kültürlenmesi sürecidir. Bu işlem yaklaşık 35-40 °C'de (95-104 °F) gerçekleştirilir. Etanolün maya için toksisitesi, mayalama yoluyla elde edilebilecek etanol konsantrasyonunu sınırlar; bu nedenle daha yüksek konsantrasyonlar, takviye veya damıtma yoluyla elde edilir. Etanole en toleranslı maya türleri hacimsel olarak yaklaşık %18 etanole kadar hayatta kalabilir. ⓘ
Tahıllar gibi nişastalı maddelerden etanol üretmek için önce nişastanın şekere dönüştürülmesi gerekir. Bira üretiminde bu işlem geleneksel olarak tahılın çimlenmesine ya da amilaz enzimi üreten malt haline gelmesine izin verilerek gerçekleştirilir. Maltlanmış tahıl püre haline getirildiğinde, amilaz kalan nişastaları şekere dönüştürür. ⓘ
Selüloz
Etanol fermantasyonu için şekerler selülozdan elde edilebilir. Bu teknolojinin kullanılması mısır koçanı, saman ve talaş gibi selüloz içeren bir dizi tarımsal yan ürünü yenilenebilir enerji kaynaklarına dönüştürebilir. Şeker kamışı küspesi gibi diğer tarımsal kalıntılar ve şalter otu gibi enerji bitkileri de fermente edilebilir şeker kaynakları olabilir. ⓘ
Test


Bira fabrikaları ve biyoyakıt tesisleri etanol konsantrasyonunu ölçmek için iki yöntem kullanmaktadır. Kızılötesi etanol sensörleri 2900 cm-1'deki C-H bandını kullanarak çözünmüş etanolün titreşim frekansını ölçer. Bu yöntem, etanol içeriğini hesaplamak için C-H bandını bir referans bandıyla karşılaştıran nispeten ucuz bir katı hal sensörü kullanır. Hesaplamada Beer-Lambert yasasından yararlanılır. Alternatif olarak, bir hidrometre kullanarak başlangıç malzemesinin yoğunluğunu ve ürünün yoğunluğunu ölçerek, fermantasyon sırasında özgül ağırlıktaki değişim alkol içeriğini gösterir. Bu ucuz ve dolaylı yöntem bira endüstrisinde uzun bir geçmişe sahiptir. ⓘ
Saflaştırma
Distilasyon
Etilen hidrasyonu veya mayalanması bir etanol-su karışımı üretir. Çoğu endüstriyel ve yakıt kullanımı için etanolün saflaştırılması gerekir. Atmosferik basınçta fraksiyonel damıtma, etanolü ağırlıkça %95,6'ya (%89,5 mol) kadar konsantre edebilir. Bu karışım, kaynama noktası 78,1 °C (172,6 °F) olan bir azeotroptur ve damıtma yoluyla daha fazla saflaştırılamaz. Benzen, siklohekzan veya heptan gibi bir sürükleyici maddenin eklenmesi, etanol, su ve sürükleyici maddeden oluşan yeni bir üçlü azeotropun oluşmasını sağlar. Bu düşük kaynama noktalı üçlü azeotrop tercihli olarak uzaklaştırılarak su içermeyen etanol elde edilir. ⓘ
Moleküler elekler ve kurutucular
Damıtmanın yanı sıra, etanol moleküler elekler, selüloz veya mısır unu gibi bir kurutucu madde eklenerek kurutulabilir. Kurutucular kurutulabilir ve yeniden kullanılabilir. Moleküler elekler %95,6 etanol çözeltisindeki suyu seçici olarak absorbe etmek için kullanılabilir. Bir tür zeolit olan gözenek boyutu 3 Ångstrom olan moleküler elekler, etanol moleküllerini dışarıda bırakırken su moleküllerini etkili bir şekilde tutar. Islak eleklerin ısıtılması suyu dışarı atarak kurutucu özelliklerinin yenilenmesini sağlar. ⓘ
Membranlar ve ters osmoz
Membranlar etanol ve suyu ayırmak için de kullanılabilir. Membran bazlı ayırmalar su-etanol azeotropunun sınırlamalarına tabi değildir çünkü ayırmalar buhar-sıvı dengelerine dayanmaz. Membranlar genellikle hibrit membran distilasyon prosesinde kullanılır. Bu proses ilk ayırma adımı olarak bir ön konsantrasyon distilasyon kolonu kullanır. Daha sonraki ayırma işlemi buhar geçirgenliği ya da pervaporasyon modunda çalışan bir membran ile gerçekleştirilir. Buhar geçirgenliğinde bir buhar membranı beslemesi, buharlaştırmada ise bir sıvı membran beslemesi kullanılır. ⓘ
Diğer teknikler
Aşağıdakiler de dahil olmak üzere çeşitli diğer teknikler tartışılmıştır:
- Çözünmezliğinden faydalanmak için potasyum karbonat kullanarak tuzlama, etanol ve su ile bir faz ayrışmasına neden olacaktır. Bu, alkolde damıtma yoluyla giderilebilecek çok küçük bir potasyum karbonat safsızlığı sunar. Etanol su ile bir azeotrop oluşturduğundan, bu yöntem etanolün damıtma yoluyla saflaştırılmasında çok kullanışlıdır.
- Katalizör olarak bir karbon nanospike film üzerinde bakır nanopartiküller kullanılarak ortam koşulları altında karbondioksitin etanole doğrudan elektrokimyasal indirgenmesi;
- Süperkritik karbondioksit ile tahıl püresinden etanol ekstraksiyonu;
- Pervaporasyon;
- Fraksiyonel dondurma, geleneksel olarak yapılan Applejack (içecek) gibi fermente alkollü çözeltileri konsantre etmek için de kullanılır;
- Basınç salınımlı adsorpsiyon. ⓘ
Etanol sınıfları
Denatüre alkol
Saf etanol ve alkollü içecekler psikoaktif uyuşturucu olarak ağır vergilendirilmektedir, ancak etanolün tüketimini içermeyen birçok kullanımı vardır. Bu kullanımlar üzerindeki vergi yükünü hafifletmek için çoğu ülke, etanole içmeye elverişsiz hale getirecek bir madde eklendiğinde vergiden feragat etmektedir. Bunlar arasında denatonyum benzoat gibi acılaştırıcı maddeler ve metanol, nafta ve piridin gibi toksinler yer almaktadır. Bu tür ürünler denatüre alkol olarak adlandırılır. ⓘ
Mutlak alkol
Mutlak veya susuz alkol, düşük su içeriğine sahip etanol anlamına gelir. Maksimum su içeriği %1 ile milyonda birkaç parça (ppm) arasında değişen çeşitli sınıflar vardır. Suyu uzaklaştırmak için azeotropik distilasyon kullanılırsa, eser miktarda malzeme ayırma maddesi (örn. benzen) içerecektir. Mutlak alkol insan tüketimi için tasarlanmamıştır. Mutlak etanol, suyun diğer kimyasallarla reaksiyona gireceği laboratuvar ve endüstriyel uygulamalar için bir çözücü olarak ve yakıt alkolü olarak kullanılır. Spektroskopik etanol, ultraviyole ve görünür ışıkta düşük absorbansa sahip, ultraviyole-görünür spektroskopide çözücü olarak kullanıma uygun mutlak bir etanoldür. ⓘ
Saf etanol ABD'de 200 proof olarak sınıflandırılır, İngiltere sisteminde 175 derece proof'a eşdeğerdir. ⓘ
Rektifiye alkollü içkiler
Rektifiye ispirto, %96 etanol ve %4 su içeren azeotropik bir bileşim olup çeşitli amaçlar için susuz etanol yerine kullanılmaktadır. Şarap ispirtosu yaklaşık %94 etanol (188 proof) içerir. Safsızlıklar %95 (190 proof) laboratuvar etanolündekilerden farklıdır. ⓘ
Reaksiyonlar
Etanol birincil alkol olarak sınıflandırılır, yani hidroksil grubunun bağlandığı karbonda da en az iki hidrojen atomu bulunur. Birçok etanol reaksiyonu hidroksil grubunda meydana gelir. ⓘ
Ester oluşumu
Asit katalizörlerin varlığında etanol, etil esterler ve su üretmek için karboksilik asitlerle reaksiyona girer:
- RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O
Endüstriyel olarak büyük ölçekte gerçekleştirilen bu reaksiyon, oluşurken suyun reaksiyon karışımından uzaklaştırılmasını gerektirir. Esterler, alkol ve tuzu geri vermek için bir asit veya baz varlığında reaksiyona girer. Bu reaksiyon sabun yapımında kullanıldığı için sabunlaşma olarak bilinir. Etanol ayrıca inorganik asitlerle de ester oluşturabilir. Dietil sülfat ve trietil fosfat, etanolün sırasıyla sülfür trioksit ve fosfor pentoksit ile muamele edilmesiyle hazırlanır. Dietil sülfat organik sentezlerde yararlı bir etilleme maddesidir. Etanolün sodyum nitrit ve sülfürik asit ile reaksiyonundan hazırlanan etil nitrit, eskiden idrar söktürücü olarak kullanılırdı. ⓘ
Dehidrasyon
Asit katalizörlerin varlığında, alkoller etanol gibi alkenlere, etilene dönüştürülebilir. Tipik olarak alümina gibi katı asitler kullanılır.
- CH3CH2OH → H2C=CH2 + H2O ⓘ
Su aynı molekülden uzaklaştırıldığı için reaksiyon intramoleküler dehidrasyon olarak bilinir. Bir alkolün molekül içi dehidrasyonu yüksek sıcaklık ve sülfürik asit gibi bir asit katalizörünün varlığını gerektirir. ⓘ
Şekerden elde edilen etanolden üretilen etilen (özellikle Brezilya'da), nafta ve etan gibi petrokimyasal hammaddelerden üretilen etilen ile rekabet etmektedir. ⓘ
Molekül içi dehidrasyondan daha düşük bir sıcaklıkta, simetrik bir eter üreten moleküller arası alkol dehidrasyonu meydana gelebilir. Bu bir yoğunlaşma reaksiyonudur. Aşağıdaki örnekte etanolden dietil eter üretilmektedir:
- 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O ⓘ
Yanma
Etanolün tamamen yanması karbondioksit ve su oluşturur:
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l); -ΔHc = 1371 kJ/mol = 29,8 kJ/g = 327 kcal/mol = 7,1 kcal/g ⓘ
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g); -ΔHc = 1236 kJ/mol = 26,8 kJ/g = 295,4 kcal/mol = 6,41 kcal/g ⓘ
Özgül ısı = 2,44 kJ/(kg-K) ⓘ
Asit-baz kimyası
Etanol nötr bir moleküldür ve sudaki etanol çözeltisinin pH değeri yaklaşık 7.00'dir. Etanol, sodyum gibi bir alkali metal ile reaksiyona sokularak eşlenik bazı olan etoksit iyonuna (CH3CH2O-) kantitatif olarak dönüştürülebilir:
- 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
veya sodyum hidrür gibi çok güçlü bir baz:
- CH3CH2OH + NaH → CH3CH2ONa + H2
Su ve etanolün asitlikleri, sırasıyla 15,7 ve 16 olan pKa değerlerinin de gösterdiği gibi neredeyse aynıdır. Dolayısıyla, sodyum etoksit ve sodyum hidroksit birbirine yakın bir dengede bulunur:
- CH3CH2OH + NaOH ⇌ CH3CH2ONa + H2O ⓘ
Halojenasyon
Etanol endüstriyel olarak etil halojenürlerin öncüsü olarak kullanılmaz, ancak reaksiyonlar açıklayıcıdır. Etanol, bir SN2 reaksiyonu yoluyla etil klorür ve etil bromür gibi etil halojenürleri üretmek için hidrojen halojenürlerle reaksiyona girer:
- CH3CH2OH + HCl → CH3CH2Cl + H2O
Bu reaksiyonlar çinko klorür gibi bir katalizör gerektirir. HBr, bir sülfürik asit katalizörü ile geri akış gerektirir. Etil halojenürler, prensip olarak, etanolün tiyonil klorür veya fosfor tribromür gibi daha özel halojenleştirici maddelerle muamele edilmesiyle de üretilebilir.
- CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl ⓘ
Baz varlığında halojenlerle muamele edildiğinde, etanol karşılık gelen haloformu verir (CHX3, burada X = Cl, Br, I). Bu dönüşüm haloform reaksiyonu olarak adlandırılır. " Klor ile reaksiyona giren bir ara ürün, su ile reaksiyona girdiğinde kloral hidrat oluşturan kloral adlı aldehittir:
- 4 Cl2 + CH3CH2OH → CCl3CHO + 5 HCl
- CCl3CHO + H2O → CCl3C(OH)2H ⓘ
Oksidasyon
Etanol, reaktiflere ve koşullara bağlı olarak asetaldehide oksitlenebilir ve daha sonra asetik aside oksitlenebilir. Bu oksidasyon endüstriyel olarak önemli değildir, ancak insan vücudunda bu oksidasyon reaksiyonları karaciğer alkol dehidrojenaz enzimi tarafından katalize edilir. Etanolün oksidasyon ürünü olan asetik asit, asetil grubunun enerji olarak harcanabileceği veya biyosentez için kullanılabileceği asetil CoA'nın öncüsü olarak insanlar için bir besindir. ⓘ
Metabolizma
Etanol, kalori sağlaması bakımından proteinler, yağlar ve karbonhidratlar gibi makro besinlere benzer. Tüketildiğinde ve metabolize edildiğinde, etanol metabolizması yoluyla gram başına 7 kaloriye katkıda bulunur. ⓘ
Güvenlik
Saf etanol cildi ve gözleri tahriş eder. Mide bulantısı, kusma ve zehirlenme yutmanın belirtileridir. Yutma yoluyla uzun süreli kullanım ciddi karaciğer hasarına neden olabilir. Binde birin üzerindeki atmosferik konsantrasyonlar Avrupa Birliği mesleki maruziyet limitlerinin üzerindedir. ⓘ
Tarihçe
Şekerin etanole fermantasyonu, insanlar tarafından kullanılan en eski biyoteknolojilerden biridir. Etanol tarihsel olarak çeşitli şekillerde şarap ruhu veya ateşli içkiler ve aqua vitae veya aqua vita olarak tanımlanmıştır. Tüketiminin sarhoş edici etkileri antik çağlardan beri bilinmektedir. Etanol, tarih öncesinden beri insanlar tarafından alkollü içeceklerin sarhoş edici bileşeni olarak kullanılmaktadır. Çin'de bulunan 9.000 yıllık çanak çömlek üzerindeki kurumuş kalıntılar, Neolitik insanların alkollü içecekler tükettiğini göstermektedir. ⓘ
Şarap ekshalasyonlarının yanıcı doğası Aristoteles (MÖ 384-322), Theophrastus (MÖ 371-287) ve Yaşlı Pliny (MS 23/24-79) gibi antik doğa filozofları tarafından zaten biliniyordu. Ancak bu durum, ikinci ve üçüncü yüzyıl Roma Mısır'ında daha gelişmiş damıtma tekniklerinin geliştirilmesine rağmen, etanolün hemen izole edilmesine yol açmamıştır. İlk olarak Cābir ibn Ḥayyān'a (MS dokuzuncu yüzyıl) atfedilen yazılardan birinde bulunan önemli bir tanıma göre, kaynayan şaraba tuz eklenerek şarabın nispi uçuculuğu arttırılır ve ortaya çıkan buharların yanıcılığı arttırılabilir. Şarabın damıtılması Kindî'ye (MS 801-873) ve Fârâbî'ye (MS 872-950) atfedilen Arapça eserlerde ve Zehrâvî'nin (Latince: Abulcasis, 936-1013) Kitâbü't-Tasrîf'inin (daha sonra Liber servatoris olarak Latinceye çevrilmiştir) 28. kitabında yer almaktadır. On ikinci yüzyılda, şarabın tuzla damıtılması yoluyla aqua ardens ("yanan su", yani etanol) üretimine ilişkin tarifler bir dizi Latince eserde yer almaya başladı ve on üçüncü yüzyılın sonunda Batı Avrupalı kimyagerler arasında yaygın olarak bilinen bir madde haline geldi. ⓘ
Taddeo Alderotti'nin (1223-1296) çalışmaları, etanolün konsantre edilmesi için su soğutmalı bir imbikten tekrarlanan fraksiyonel damıtmayı içeren ve %90'lık bir etanol saflığının elde edilebildiği bir yöntemi tanımlamaktadır. Etanolün tıbbi özellikleri Villanova'lı Arnald (MS 1240-1311) ve Rupescissa'lı John (yak. 1310-1366) tarafından incelenmiş, ikincisi onu tüm hastalıkları önleyebilen, yaşamı koruyan bir madde olarak görmüştür (aqua vitae veya "yaşam suyu", John tarafından şarabın özü olarak da adlandırılmıştır). ⓘ
Çin'de arkeolojik kanıtlar alkolün gerçek anlamda damıtılmasının Jin (1115-1234) veya Güney Song (1127-1279) hanedanları döneminde başladığını göstermektedir. Hebei, Qinglong'daki bir arkeolojik alanda 12. yüzyıla tarihlenen bir imbik bulunmuştur. Hindistan'da alkolün gerçek anlamda damıtılması Orta Doğu'dan gelmiş ve 14. yüzyılda Delhi Sultanlığı'nda yaygın olarak kullanılmaya başlanmıştır. ⓘ
1796 yılında Alman-Rus kimyager Johann Tobias Lowitz, kısmen saflaştırılmış etanolü (alkol-su azeotropu) fazla miktarda susuz alkali ile karıştırarak ve ardından karışımı düşük ısıda damıtarak saf etanol elde etmiştir. Fransız kimyager Antoine Lavoisier etanolü karbon, hidrojen ve oksijenden oluşan bir bileşik olarak tanımlamış ve 1807 yılında Nicolas-Théodore de Saussure etanolün kimyasal formülünü belirlemiştir. Elli yıl sonra Archibald Scott Couper etanolün yapısal formülünü yayınladı. Bu, belirlenen ilk yapısal formüllerden biriydi. ⓘ
Etanol ilk olarak 1825 yılında Michael Faraday tarafından sentetik olarak hazırlanmıştır. Sülfürik asidin büyük miktarlarda kömür gazını emebildiğini buldu. Elde ettiği çözeltiyi İngiliz kimyager Henry Hennell'e verdi ve 1826'da bu çözeltinin "sülfovinik asit" (etil hidrojen sülfat) içerdiğini buldu. 1828'de Hennell ve Fransız kimyager Georges-Simon Serullas bağımsız olarak sülfovinik asidin etanole ayrıştırılabileceğini keşfettiler. Böylece, 1825 yılında Faraday farkında olmadan etanolün etilenden (kömür gazının bir bileşeni) asit katalizli hidrasyon yoluyla üretilebileceğini keşfetmişti ki bu da günümüzdeki endüstriyel etanol sentezine benzer bir süreçti. ⓘ
Etanol, Amerika Birleşik Devletleri'nde 1840 gibi erken bir tarihte lamba yakıtı olarak kullanılmış, ancak İç Savaş sırasında endüstriyel alkole uygulanan bir vergi bu kullanımı ekonomik olmaktan çıkarmıştır. Vergi 1906 yılında yürürlükten kaldırılmıştır. Otomotiv yakıtı olarak kullanımı 1908 yılına kadar uzanmaktadır ve Ford Model T benzin veya etanol ile çalışabilmektedir. Bazı ispirto lambalarına yakıt sağlamaktadır. ⓘ
Endüstriyel kullanım amaçlı etanol genellikle etilenden üretilir. Etanol, kokular, tatlandırıcılar, renklendiriciler ve ilaçlar dahil olmak üzere insan teması veya tüketimine yönelik maddelerin çözücüsü olarak yaygın bir kullanıma sahiptir. Kimyada, diğer ürünlerin sentezi için hem bir çözücü hem de bir hammaddedir. Isı ve ışık yakıtı olarak ve son zamanlarda içten yanmalı motorlar için bir yakıt olarak uzun bir geçmişe sahiptir. ⓘ
Özellikler
Etanol iki karbonlu bir monoalkoldür. dimetil eterin izomeridir. Etanol uçucu, renksiz bir sıvıdır. Günışığında fark edilmeyen mavi, dumansız bir alevle yanar. ⓘ