Ester
| Ester ⓘ |
| Karboksilik asit esteri |
| Fosforik asit esteri (mono ester) |
| Sülfürik asit esteri (mono ester) |
| Nitrik asit esteri |
| Borik asit esteri (tri ester) |
Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir. ⓘ
En yaygın esterler karboksilat esterlerdir, bunlarda söz konusu asit bir karboksilik asittir. Örneğin, eğer asit asetik asit ise, esterine asetat denir. Kararsız bileşikler olan karbamik asit veya karbonik asitten, sırasıyla karbamatlar, RO(CO)NHR', ve dialkil karbonatlar, RO(CO)OR, gibi kararlı esterler elde edilebilir. Esterler inorganik asitlerden de oluşabilirler, örneğin dimetil sulfat bir esterdir ve bazen "sülfürik asit dimetil ester" olarak adlandırılır. ⓘ
Esterler tuzlara benzer, benzer şekilde adlandırılırlar; katyon ve anyonları olmasa da, kullanılan terminoloji aynı biçimdedir: daha elektronegatif olan kısmın ardından daha elektropozitif olan kısım söylenir. ⓘ
Esterler bir asit (genelde bir organik asit) ile bir alkolün (veya fenol bileşiğinin) yoğunlaşma tepkimesi ürünü olarak düşünülebilir, ama esterleri elde etmek için başka tepkimeler de vardır. Yoğunlaşma (kondansasyon) iki molekülün birleşerek küçük bir molekülü attıkları bir tip kimyasal tepkimedir; bu durumda iki -OH grubu birleşirken bir su molekülü atılır. Ester oluşumuna yol açan yoğunlaşma tepkimesine esterleşme denir. Esterleşme tepkimeleri H+ iyonları tarafından katalizlenir. Sülfürik asit bu tepkimede sıkça kullanılan bir katalizördür. Ester ismi Almanca Essig-Äther 'den gelir, bu, asetik asit etil esterin (etil asetatın) eski bir ismidir. ⓘ

Esterler tipik olarak hoş bir kokuya sahiptir; düşük molekül ağırlıklı olanlar genellikle koku olarak kullanılır ve uçucu yağlarda ve feromonlarda bulunur. Çok çeşitli plastikler, plastikleştiriciler, reçineler ve cilalar için yüksek dereceli çözücüler olarak işlev görürler ve ticari pazardaki en büyük sentetik yağlayıcı sınıflarından biridir. Poliesterler, monomerleri ester bağları ile bağlanmış önemli plastiklerdir. Fosfoesterler DNA moleküllerinin omurgasını oluşturur. Nitrogliserin gibi nitrat esterleri patlayıcı özellikleriyle bilinirler. ⓘ
İsimlendirme
Etimoloji
Ester kelimesi 1848 yılında Alman kimyager Leopold Gmelin tarafından, muhtemelen Almanca Essigäther, "asetik eter" kelimesinin kısaltması olarak icat edilmiştir. ⓘ
IUPAC isimlendirmesi
Esterlerin isimleri ana alkol ve ana asitten türetilir; ana asit organik veya inorganik olabilir. En basit karboksilik asitlerden türetilen esterler, IUPAC isimlendirmesi olan metanoat, etanoat, propanoat ve bütanoatın aksine, genellikle daha geleneksel ve "önemsiz isimler" olarak adlandırılan format, asetat, propiyonat ve bütirat gibi isimlerle adlandırılır. Öte yandan, daha karmaşık karboksilik asitlerden türetilen esterler daha sık olarak sistematik IUPAC adı kullanılarak adlandırılır; bu adlandırma asit adının ardından gelen -oate son ekine dayanır. Örneğin, heksil kaprilat adı altında da bilinen heksil oktanoat esteri CH3(CH2)6CO2(CH2)5CH3 formülüne sahiptir. ⓘ
Organik esterlerin kimyasal formülleri genellikle RCO2R′ şeklindedir; burada R ve R′ sırasıyla karboksilik asit ve alkolün hidrokarbon kısımlarıdır. Örneğin, bütanol ve asetik asitten (sistematik olarak etanoik asit) türetilen bütil asetat (sistematik olarak bütil etanoat) CH3CO2C4H9 şeklinde yazılır. BuOAc ve CH3COOC4H9 gibi alternatif sunumlar yaygındır. ⓘ
Siklik esterler, organik veya inorganik bir asitten türetilmiş olmalarına bakılmaksızın lakton olarak adlandırılır. Organik laktona bir örnek γ-valerolakton'dur. ⓘ
Ortoesterler
Nadir bir organik ester sınıfı, RC(OR′)3 formülüne sahip olan ortoesterlerdir. Trietilortoformat (HC(OC2H5)3), adı bakımından (ancak sentezi değil) ortoformik asit (HC(OH)3) ve etanolden türetilmiştir. ⓘ
İnorganik esterler

Esterler inorganik asitlerden de türetilebilir.
- Fosforik asit fosfat esterleri oluşturur, örneğin trifenilfosfat
- sülfürik asit sülfat esterleri oluşturur, örneğin dimetilsülfat
- nitrik asit nitrat esterleri oluşturur, örneğin metil nitrat
- borik asit boratlar oluşturur, örneğin trimetilborat.
- karbonik asit karbonat esterleri oluşturur, örneğin etilen karbonat
Tautomer olarak bulunan inorganik asitler çeşitli esterler oluşturur
- fosfor asidi iki çeşit fosfit esteri oluşturur, örneğin trietilfosfit (P(OEt)3) ve dietilfosfit (HP(O)(OEt)2). ⓘ
Kararsız veya zor bulunan inorganik asitler kararlı esterler oluşturur.
- Hiç tespit edilmemiş olan kromik asit, di-tert-butil kromat oluşturur
- nadir bulunan sülfürlü asit, dimetilsülfit oluşturur ⓘ
Prensip olarak, yüzlercesi bilinen tüm metal ve metaloid alkoksitler, varsayımsal asitlerin esterleri olarak sınıflandırılabilir. ⓘ
Yapı ve bağlanma
Esterler, 120° C-C-O ve O-C-O açılarına yol açan bir karbonil merkezi içerir. Amidlerin aksine, esterler yapısal olarak esnek fonksiyonel gruplardır çünkü C-O-C bağları etrafında dönme düşük bir bariyere sahiptir. Esneklikleri ve düşük polariteleri fiziksel özelliklerinde kendini gösterir; karşılık gelen amidlere göre daha az katı (daha düşük erime noktası) ve daha uçucu (daha düşük kaynama noktası) olma eğilimindedirler. Esterler üzerindeki alfa-hidrojenlerin pKa değeri 25 civarındadır. ⓘ
Birçok ester konformasyonel izomerizm potansiyeline sahiptir, ancak hiperkonjugasyon ve dipol minimizasyon etkilerinin bir kombinasyonu nedeniyle s-trans (veya E) alternatifinden ziyade bir s-cis (veya Z) konformasyonu benimseme eğilimindedirler. Z konformasyonu tercihi, varsa sübstitüentlerin ve çözücünün doğasından etkilenir. Küçük halkalı laktonlar, halkalı yapıları nedeniyle s-trans (yani E) konformasyonu ile sınırlıdır. ⓘ
Fiziksel özellikler ve karakterizasyon
Esterler eterlerden daha polardır ancak alkollerden daha az polardır. Hidrojen bağlarına hidrojen bağı alıcıları olarak katılırlar, ancak ana alkollerinin aksine hidrojen bağı vericileri olarak hareket edemezler. Bu hidrojen bağına katılma yeteneği, bir miktar suda çözünürlük sağlar. Hidrojen bağı bağışlama yeteneklerinin olmaması nedeniyle, esterler kendi kendilerine ayrışmazlar. Sonuç olarak, esterler benzer molekül ağırlığına sahip karboksilik asitlerden daha uçucudur. ⓘ
Karakterizasyon ve analiz
Esterler genellikle uçuculuklarından yararlanılarak gaz kromatografisi ile tanımlanır. Esterlerin IR spektrumları 1730-1750 cm-1 aralığında νC=O'ya atanan yoğun bir keskin bant içerir. Bu pik, karbonile bağlı fonksiyonel gruplara bağlı olarak değişir. Örneğin, karbonil ile konjugasyon halindeki bir benzen halkası veya çift bağ, dalga sayısını yaklaşık 30 cm-1 aşağı çekecektir. ⓘ
Uygulamalar ve oluşum
Esterler doğada yaygın olarak bulunur ve endüstride yaygın olarak kullanılır. Doğada yağlar genel olarak gliserol ve yağ asitlerinden türetilen triesterlerdir. Esterler elma, durian, armut, muz, ananas ve çilek gibi birçok meyvenin aromasından sorumludur. Polietilen tereftalat, akrilat esterler ve selüloz asetat önemli ürünler olmak üzere yılda birkaç milyar kilogram polyester endüstriyel olarak üretilmektedir.
 Keten tohumu yağında bulunan temsili trigliserit, linoleik asit, alfa-linolenik asit ve oleik asitten türetilmiş bir triester (trigliserit). ⓘ
Keten tohumu yağında bulunan temsili trigliserit, linoleik asit, alfa-linolenik asit ve oleik asitten türetilmiş bir triester (trigliserit). ⓘ
Hazırlık
Esterleşme, iki reaktantın (tipik olarak bir alkol ve bir asit) reaksiyon ürünü olarak bir ester oluşturduğu kimyasal reaksiyonun genel adıdır. Esterler organik kimyada ve biyolojik materyallerde yaygındır ve genellikle hoş bir karakteristik, meyvemsi kokuya sahiptir. Bu da koku ve aroma endüstrisinde yaygın olarak kullanılmalarına yol açmaktadır. Ester bağları birçok polimerde de bulunur. ⓘ
Karboksilik asitlerin alkollerle esterleştirilmesi
Klasik sentez, bir karboksilik asidin bir dehidrasyon ajanı varlığında bir alkol ile muamele edilmesini içeren Fischer esterifikasyonudur:
- RCO2H + R′OH ⇌ RCO2R′ + H2O
Bu tür reaksiyonlar için denge sabiti, örneğin etil asetat gibi tipik esterler için yaklaşık 5'tir. Reaksiyon katalizör yokluğunda yavaştır. Sülfürik asit bu reaksiyon için tipik bir katalizördür. Polimerik sülfonik asitler gibi diğer birçok asit de kullanılır. Esterleşme yüksek oranda tersinir olduğundan, ester verimi Le Chatelier prensibi kullanılarak iyileştirilebilir:
- Alkolü fazla miktarda kullanmak (yani çözücü olarak).
- Bir dehidrasyon ajanı kullanmak: sülfürik asit sadece reaksiyonu katalize etmekle kalmaz, aynı zamanda suyu (bir reaksiyon ürünü) tutar. Moleküler elekler gibi diğer kurutucu maddeler de etkilidir.
- Dean-Stark aparatı ile birlikte toluen ile düşük kaynama noktalı azeotroplar olarak damıtma gibi fiziksel yollarla suyun uzaklaştırılması. ⓘ
Alkol ve karboksilik asit karışımlarının dehidrasyonunu sağlayan reaktifler bilinmektedir. Bir örnek, hafif koşullar altında esterler oluşturmanın bir yöntemi olan Steglich esterifikasyonudur. Bu yöntem, substratların yüksek ısı gibi sert koşullara karşı hassas olduğu peptit sentezinde popülerdir. DCC (disikloheksilkarbodiimid), karboksilik asidi daha ileri reaksiyona aktive etmek için kullanılır. Asil-transfer katalizörü olarak 4-Dimetilaminopiridin (DMAP) kullanılır.
Alkol ve karboksilik asit karışımlarının dehidrasyonu için bir başka yöntem de Mitsunobu reaksiyonudur:
- RCO2H + R′OH + P(C6H5)3 + R2N2 → RCO2R′ + OP(C6H5)3 + R2N2H2 ⓘ
Karboksilik asitler diazometan kullanılarak esterleştirilebilir:
- RCO2H + CH2N2 → RCO2CH3 + N2
Bu diazometan kullanılarak, karboksilik asit karışımları, örneğin gaz kromatografisi ile analiz için neredeyse kantitatif verimlerde metil esterlerine dönüştürülebilir. Bu yöntem özel organik sentetik işlemlerde kullanışlıdır ancak büyük ölçekli uygulamalar için çok tehlikeli ve pahalı olduğu düşünülmektedir. ⓘ
Karboksilik asitlerin epoksitlerle esterleştirilmesi
Karboksilik asitler epoksitlerle muamele edilerek esterleştirilir ve β-hidroksiesterler elde edilir:
- RCO2H + RCHCH2O → RCO2CH2CH(OH)R
Bu reaksiyon akrilik asitten vinil ester reçinelerinin üretiminde kullanılır. ⓘ
Açil klorürlerin ve asit anhidritlerin alkolizi
Alkoller, esterleri vermek için açil klorürler ve asit anhidritlerle reaksiyona girer:
- RCOCl + R′OH → RCO2R′ + HCl
- (RCO)2O + R′OH → RCO2R′ + RCO2H ⓘ
Reaksiyonlar geri dönüşümsüzdür ve çalışmayı kolaylaştırır. Açil klorürler ve asit anhidritler de su ile reaksiyona girdiğinden, susuz koşullar tercih edilir. Aminlerin amidleri vermek için benzer asilasyonları daha az hassastır çünkü aminler daha güçlü nükleofillerdir ve sudan daha hızlı reaksiyona girerler. Bu yöntem pahalı olduğu için yalnızca laboratuvar ölçekli prosedürler için kullanılmaktadır. ⓘ
Karboksilat tuzlarının alkilasyonu
Esterleştirmeler için yaygın olarak kullanılmasa da, karboksilat anyonlarının tuzları, esterleri vermek için alkil halojenürlerle alkilleyici ajan olabilir. Bir alkil klorür kullanılması durumunda, bir iyodür tuzu reaksiyonu katalize edebilir (Finkelstein reaksiyonu). Karboksilat tuzu genellikle yerinde üretilir. Zor durumlarda, gümüş karboksilat kullanılabilir, çünkü gümüş iyonu halide koordine olarak ayrılmasına yardımcı olur ve reaksiyon hızını artırır. Bu reaksiyon anyon mevcudiyeti sorunlarından muzdarip olabilir ve bu nedenle faz transfer katalizörlerinin veya DMF gibi oldukça polar aprotik çözücülerin eklenmesinden yararlanabilir. ⓘ
Transesterifikasyon
Bir esteri diğerine dönüştürmeyi içeren transesterifikasyon yaygın olarak uygulanmaktadır:
- RCO2R′ + CH3OH → RCO2CH3 + R′OH
Hidrolizasyon gibi, transesterifikasyon da asitler ve bazlar tarafından katalize edilir. Bu reaksiyon trigliseritlerin parçalanmasında, örneğin yağ asidi esterleri ve alkollerin üretiminde yaygın olarak kullanılmaktadır. Poli(etilen tereftalat), dimetil tereftalat ve etilen glikolün transesterifikasyonu ile üretilir:
- (C6H4)(CO2CH3)2 + 2 C2H4(OH)2 → 1⁄n {(C6H4)(CO2)2(C2H4)}n + 2 CH3OH ⓘ
Transesterifikasyonun bir alt kümesi diketenin alkolizidir. Bu reaksiyon 2-ketoesterleri ortaya çıkarır.
- (CH2CO)2 + ROH → CH3C(O)CH2CO2R ⓘ
Karbonilasyon
Alkenler, metal karbonil katalizörlerin varlığında "hidroesterifikasyona" uğrar. Bu yöntemle ticari olarak propanoik asit esterleri üretilmektedir:
- C2H4 + ROH + CO → C2H5CO2R
Metil propiyonatın hazırlanması açıklayıcı bir örnektir.
- C2H4 + CO + MeOH → MeO2CCH2CH3 ⓘ
Metanolün karbonilasyonu, formik asidin ana ticari kaynağı olan metil formatı verir. Reaksiyon sodyum metoksit tarafından katalize edilir:
- CH3OH + CO → CH3O2CH ⓘ
Alken ve alkinlere karboksilik asitlerin eklenmesi
Hidroesterifikasyonda, alkenler ve alkinler karboksilik asitlerin H-O bağına girerler. Vinil asetat, çinko asetat katalizörleri varlığında asetik asidin asetilene eklenmesiyle endüstriyel olarak üretilir: Halen katalizör olarak çinko asetat kullanılmaktadır:
- CH3CO2H + C2H2 → CH3CO2CHCH2 ⓘ
Vinil asetat ayrıca etilen, asetik asit ve oksijenin paladyum katalizli reaksiyonu ile de üretilebilir:
- C2H4 + CH3CO2H + 1⁄2 O2 → C2H3O2CCH3 + H2O ⓘ
Silikotungstik asit, asetik asidin etilen ile alkilasyonu yoluyla etil asetat üretiminde kullanılır:
- C2H4 + CH3CO2H → CH3CO2C2H5 ⓘ
Aldehitlerden
Tishchenko reaksiyonu, bir ester vermek için susuz bir baz varlığında bir aldehitin orantısızlaştırılmasını içerir. Katalizörler alüminyum alkoksitler veya sodyum alkoksitlerdir. Benzaldehit, benzil benzoat üretmek için sodyum benziloksit (sodyum ve benzil alkolden üretilir) ile reaksiyona girer. Bu yöntem asetaldehitten etil asetat üretiminde kullanılır. ⓘ
Diğer yöntemler
- Baz varlığında α-haloketonların Favorskii yeniden düzenlenmesi
- Ketonların peroksitlerle Baeyer-Villiger oksidasyonu
- Nitrillerin bir alkol ile Pinner reaksiyonu
- Bir metal-açil kompleksinin nükleofilik soyutlanması
- Sulu asit içinde ortoesterlerin hidrolizi
- Esterifikasyon yoluyla selüloliz
- Hidroklorik asit ve çeşitli alkollerin varlığında bir çalışma kullanarak alkenlerin ozonolizi.
- Metil ketonların metil esterlere yol açan anodik oksidasyonu.
- İnteresterifikasyon, farklı esterlerin yağ asidi gruplarını değiştirir. ⓘ
Reaksiyonlar
Esterler karbonil karbonundaki nükleofillerle reaksiyona girer. Karbonil zayıf elektrofiliktir ancak güçlü nükleofiller (aminler, alkoksitler, hidrit kaynakları, organolityum bileşikleri, vb) tarafından saldırıya uğrar. Karbonile bitişik C-H bağları zayıf asidiktir ancak güçlü bazlarla deprotonasyona uğrar. Bu süreç genellikle kondenzasyon reaksiyonlarını başlatan süreçtir. Esterlerdeki karbonil oksijeni, amidlerdeki azottan bir elektron çiftinin rezonans bağışı nedeniyle amidlerdeki karbonil oksijeninden daha az olmak üzere zayıf baziktir, ancak eklentiler oluşturur. ⓘ
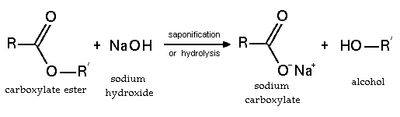
Hidroliz ve sabunlaşma
Esterleşme tersinir bir reaksiyondur. Esterler asidik ve bazik koşullar altında hidrolize uğrar. Asidik koşullar altında, reaksiyon Fischer esterleşmesinin ters reaksiyonudur. Bazik koşullar altında, hidroksit bir nükleofil olarak hareket ederken, bir alkoksit ayrılan gruptur. Bu reaksiyon, sabunlaşma, sabun yapımının temelidir.
Alkoksit grubu ayrıca amonyak veya birincil veya ikincil aminler gibi daha güçlü nükleofillerle yer değiştirerek amidleri verebilir: (ammonoliz reaksiyonu)
- RCO2R′ + NH2R″ → RCONHR″ + R′OH
Bu reaksiyon genellikle tersinir değildir. Aminler yerine hidrazinler ve hidroksilamin kullanılabilir. Esterler, Lossen yeniden düzenlemesinde ara hidroksamik asitler yoluyla izosiyanatlara dönüştürülebilir. ⓘ
Grignard reaktifleri ve organolityum bileşikleri gibi karbon nükleofil kaynakları karbonile kolayca eklenir. ⓘ
İndirgeme
Ketonlar ve aldehitlerle karşılaştırıldığında esterler indirgenmeye karşı nispeten dirençlidir. Katalitik hidrojenasyonun 20. yüzyılın başlarında kullanılmaya başlanması bir dönüm noktası olmuştur; yağ asitlerinin esterleri hidrojenlenerek yağ alkollerine dönüştürülmüştür.
- RCO2R′ + 2 H2 → RCH2OH + R′OH
Tipik bir katalizör bakır kromittir. Katalitik hidrojenasyonun geliştirilmesinden önce, esterler Bouveault-Blanc indirgemesi kullanılarak büyük ölçekte indirgenmiştir. Büyük ölçüde geçerliliğini yitirmiş olan bu yöntem, proton kaynaklarının varlığında sodyum kullanır. ⓘ
Özellikle ince kimyasal sentezlerde, esterleri iki birincil alkole indirgemek için lityum alüminyum hidrür kullanılır. İlgili reaktif sodyum borohidrit bu reaksiyonda yavaştır. DIBAH esterleri aldehitlere indirger. ⓘ
Karşılık gelen eteri vermek için doğrudan indirgeme zordur çünkü ara hemiasetal bir alkol ve bir aldehit (ikinci bir alkol vermek için hızla indirgenir) vermek üzere ayrışma eğilimindedir. Reaksiyon, çeşitli Lewis asitleri ile trietilsilan kullanılarak gerçekleştirilebilir. ⓘ
Claisen kondenzasyonu ve ilgili reaksiyonlar
Aldehitlerde olduğu gibi, esterlerdeki karboksil grubuna komşu ("α'ya") karbon üzerindeki hidrojen atomları deprotonasyona uğramak için yeterince asidiktir ve bu da çeşitli yararlı reaksiyonlara yol açar. Deprotonasyon, alkoksitler gibi nispeten güçlü bazlar gerektirir. Deprotonasyon nükleofilik bir enolat verir ve bu da örneğin Claisen kondenzasyonu ve onun molekül içi eşdeğeri olan Dieckmann kondenzasyonu gibi reaksiyonlara girebilir. Bu dönüşüm, malonik asit diesterinin bir elektrofil (örneğin alkil halojenür) ile reaksiyona girdiği ve daha sonra dekarboksilasyona uğradığı malonik ester sentezinde kullanılır. Bir başka varyasyon da Fráter-Seebach alkilasyonudur. ⓘ
Diğer reaksiyonlar
- Fenil esterler, Fries yeniden düzenlenmesinde hidroksiarilketonlarla reaksiyona girer.
- Belirli esterler, Chan yeniden düzenlemesinde bir α-hidroksil grubu ile işlevselleştirilir.
- β-hidrojen atomlu esterler, ester pirolizinde alkenlere dönüştürülebilir.
- Esterlerin nitrillere doğrudan dönüşümü. ⓘ
Koruyucu gruplar
Bir sınıf olarak esterler, karboksilik asitler için koruyucu gruplar olarak hizmet eder. Bir karboksilik asidin korunması, iki fonksiyonlu amino asitlerin kendiliğinden reaksiyona girmesini önlemek için peptit sentezinde yararlıdır. Metil ve etil esterler birçok amino asit için yaygın olarak mevcuttur; t-butil ester daha pahalı olma eğilimindedir. Bununla birlikte, t-butil esterler özellikle kullanışlıdır, çünkü güçlü asidik koşullar altında, t-butil esterler karboksilik asit ve izobütilen vermek üzere eliminasyona uğrayarak çalışmayı basitleştirir. ⓘ
Ester koku maddelerinin listesi
Birçok esterin kendine özgü meyve benzeri kokuları vardır ve birçoğu bitkilerin uçucu yağlarında doğal olarak bulunur. Bu durum aynı zamanda bu kokuları taklit etmeyi amaçlayan yapay tatlandırıcılarda ve kokularda yaygın olarak kullanılmalarına yol açmıştır. ⓘ
| Ester adı | Yapı | Koku veya oluşum ⓘ |
|---|---|---|
| Alil hekzanoat | ANANAS | |
| Benzil asetat | armut, çilek, yasemin | |
| Bornil asetat | 
|
çam |
| Bütil asetat | elma, bal | |
| Butil bütirat | ANANAS | |
| Bütil propanoat | armut damlaları | |
| Etil asetat | oje çıkarıcı, maket boyası, maket uçak tutkalı, armut | |
| Etil benzoat | tatlı, keklik üzümü, meyveli, şifalı, kiraz, üzüm | |
| Etil bütirat | muz, ananas, çilek | |
| Etil hekzanoat | ananas, balmumu yeşili muz | |
| Etil sinamat | tarçın | |
| Etil format | limon, rom, çilek | |
| Etil heptanoat | kayısı, kiraz, üzüm, ahududu | |
| Etil izovalerat | elma | |
| Etil laktat | 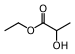
|
tereyağı, krema |
| Etil nonanoat | Üzüm | |
| Etil pentanoat | elma | |
| Geranil asetat | Sardunya | |
| Geranil bütirat | kiraz | |
| Geranil pentanoat | elma | |
| İzobütil asetat | 
|
kiraz, ahududu, çilek |
| İzobütil format | ahududu | |
| İzoamil asetat | armut, muz (Armut damlalarında tatlandırıcı) | |
| İzopropil asetat | meyveli | |
| Linalil asetat | lavanta, adaçayı | |
| Linalil bütirat | ŞEFTALİ | |
| Linalil format | elma, şeftali | |
| Metil asetat | 
|
yapıştırıcı |
| Metil antranilat | 
|
üzüm, yasemin |
| Metil benzoat | 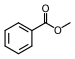
|
meyvemsi, ylang ylang, feijoa |
| Metil bütirat (metil bütanoat) | ananas, elma, çilek | |
| Metil sinnamat | ÇİLEK | |
| Metil pentanoat (metil valerat) | Çiçekli | |
| Metil fenilasetat | bal | |
| Metil salisilat (keklik üzümü yağı) | 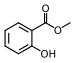
|
Modern kök birası, keklik üzümü, Germolene ve Ralgex merhemleri (Birleşik Krallık) |
| Nonil kaprilat | turuncu | |
| Oktil asetat | meyveli-turuncu | |
| Oktil bütirat | Yaban havucu | |
| Amil asetat (pentil asetat) | elma, muz | |
| Pentil bütirat (amil bütirat) | kayısı, armut, ananas | |
| Pentil hekzanoat (amil kaproat) | elma, ananas | |
| Pentil pentanoat (amil valerat) | elma | |
| Propil asetat | armut | |
| Propil hekzanoat | böğürtlen, ananas, peynir, şarap | |
| Propil izobütirat | rum | |
| Terpenil bütirat | 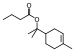
|
kiraz |
Esterler hidrojen bağı oluşumlarında hidrojen bağı alıcısı olarak yer alırlar (kendilerini oluşturan alkollerin aksine). Hidrojen bağlanmasına katılma yeteneği sayesinde aynı uzunluktaki hidrokarbonlardan daha çok suda çözünebilirler. Ancak, oluşturabildikleri hidrojen bağlarının yetersiz kalan özellikleri yüzünden kendilerini oluşturan alkol ve asitlere kıyasla daha hidrofobiktirler. Hidrojen bağı vericisi olmamaları nedeniyle birbirleriyle hidrojen bağı oluşturamazlar, bu yüzden de esterler aynı molekül ağırlıklı karboksilik asitlere kıyasla daha uçucudurlar. Bu özellik onları analitik organik kimyada çok yararlı kılar: uçuculuğu az olan ve bilinmeyen organik asitler çoğu zaman esterleştirilerek uçucu bir estere dönüştürülebilirler, bu da gaz kromatografisi, gaz-sıvı kromatografisi veya kütle spektrometrisi ile analiz edilebilir. ⓘ