Asit
| Asitler ve bazlar ⓘ |
|---|
 |
|
| Asit türleri |
|
| Temel tipler |
|
Bir asit, Brønsted-Lowry asidi olarak bilinen bir proton (yani hidrojen iyonu, H+) bağışlayabilen veya Lewis asidi olarak bilinen bir elektron çifti ile kovalent bağ oluşturabilen bir molekül veya iyon. ⓘ
İlk asit kategorisi proton donörleri veya Brønsted-Lowry asitleridir. Sulu çözeltilerin özel durumunda, proton donörleri hidronyum iyonu H3O+ oluşturur ve Arrhenius asitleri olarak bilinir. Brønsted ve Lowry, Arrhenius teorisini sulu olmayan çözücüleri de içerecek şekilde genelleştirmiştir. Bir Brønsted veya Arrhenius asidi genellikle H+ kaybından sonra hala enerjik olarak elverişli olan bir kimyasal yapıya bağlı bir hidrojen atomu içerir. ⓘ
Sulu Arrhenius asitleri, bir asidin pratik bir tanımını sağlayan karakteristik özelliklere sahiptir. Asitler ekşi bir tada sahip sulu çözeltiler oluşturur, mavi turnusol kırmızısına dönüşebilir ve tuzlar oluşturmak için bazlarla ve bazı metallerle (kalsiyum gibi) reaksiyona girebilir. Asit kelimesi Latince acidus/acēre'den türetilmiştir ve 'ekşi' anlamına gelir. Bir asidin sulu çözeltisinin pH'ı 8'den düşüktür ve halk arasında "asit" olarak da adlandırılır ("asitte çözünmüş" gibi), ancak kesin tanım sadece çözünen maddeyi ifade eder. Daha düşük bir pH, daha yüksek bir asitlik ve dolayısıyla çözeltide daha yüksek bir pozitif hidrojen iyonu konsantrasyonu anlamına gelir. Asit özelliğine sahip kimyasalların veya maddelerin asidik olduğu söylenir. ⓘ
Yaygın sulu asitler arasında hidroklorik asit (midedeki mide asidinde bulunan ve sindirim enzimlerini aktive eden bir hidrojen klorür çözeltisi), asetik asit (sirke bu sıvının seyreltik sulu bir çözeltisidir), sülfürik asit (araba akülerinde kullanılır) ve sitrik asit (turunçgillerde bulunur) bulunur. Bu örneklerin de gösterdiği gibi, asitler (günlük anlamda) çözeltiler veya saf maddeler olabilir ve katı, sıvı veya gaz olan asitlerden (gerçek anlamda) türetilebilir. Güçlü asitler ve bazı konsantre zayıf asitler aşındırıcıdır, ancak karboranlar ve borik asit gibi istisnalar da vardır. ⓘ
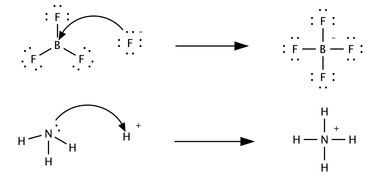
İkinci asit kategorisi, bir elektron çifti ile kovalent bağ oluşturan Lewis asitleridir. Buna bir örnek, bor atomu bir bazdaki bir atomda, örneğin amonyaktaki (NH3) nitrojen atomunda yalnız bir elektron çiftini paylaşarak kovalent bağ oluşturabilen boş bir orbitali olan bor triflorürdür (BF3). Lewis bunu Brønsted tanımının bir genellemesi olarak düşünmüştür, böylece bir asit ya doğrudan ya da çözeltiye protonlar (H+) salarak elektron çiftlerini kabul eden kimyasal bir türdür ve bunlar da elektron çiftlerini kabul eder. Ancak hidrojen klorür, asetik asit ve diğer Brønsted-Lowry asitlerinin çoğu bir elektron çifti ile kovalent bağ oluşturamaz ve bu nedenle Lewis asidi değildir. Tersine, birçok Lewis asidi Arrhenius veya Brønsted-Lowry asidi değildir. Modern terminolojide, bir asit Lewis asidi değil Brønsted asididir, çünkü kimyagerler bir Lewis asidinden neredeyse her zaman açıkça Lewis asidi olarak bahsederler. ⓘ
Tanımlar ve kavramlar
Modern tanımlar, tüm asitler için ortak olan temel kimyasal reaksiyonlarla ilgilidir. ⓘ
Günlük hayatta karşılaşılan asitlerin çoğu sulu çözeltilerdir veya suda çözünebilir, bu nedenle Arrhenius ve Brønsted-Lowry tanımları en uygun olanlardır. ⓘ
Brønsted-Lowry tanımı en yaygın kullanılan tanımdır; aksi belirtilmedikçe, asit-baz reaksiyonlarının bir protonun (H+) bir asitten bir baza transferini içerdiği varsayılır. ⓘ
Hidronyum iyonları her üç tanıma göre de asittir. Alkoller ve aminler Brønsted-Lowry asitleri olabilmelerine rağmen, oksijen ve nitrojen atomlarındaki yalnız elektron çiftleri nedeniyle Lewis bazları olarak da işlev görebilirler. ⓘ
Arrhenius asitleri

1884 yılında Svante Arrhenius asitlik özelliklerini hidrojen iyonlarına (H+) atfetmiş, daha sonra proton veya hidron olarak tanımlamıştır. Bir Arrhenius asidi, suya eklendiğinde sudaki H+ iyonlarının konsantrasyonunu artıran bir maddedir. Kimyagerlerin asit-baz reaksiyonlarını tanımlarken genellikle H+(aq) yazdıklarını ve hidrojen iyonuna atıfta bulunduklarını unutmayın, ancak serbest hidrojen çekirdeği, bir proton, suda tek başına bulunmaz, hidronyum iyonu (H3O+) veya diğer formlar (H5O2+, H9O4+) olarak bulunur. Bu nedenle, bir Arrhenius asidi, suya eklendiğinde hidronyum iyonlarının konsantrasyonunu artıran bir madde olarak da tanımlanabilir. Örnekler arasında hidrojen klorür ve asetik asit gibi moleküler maddeler yer alır. ⓘ
Öte yandan bir Arrhenius bazı, suda çözündüğünde hidroksit (OH-) iyonlarının konsantrasyonunu artıran bir maddedir. Bu, hidronyum konsantrasyonunu azaltır çünkü iyonlar H2O molekülleri oluşturmak üzere reaksiyona girer:
- H3O+
(aq) + OH-
(aq) ⇌ H2O(liq) + H2O(liq) ⓘ
Bu denge nedeniyle, hidronyum konsantrasyonundaki herhangi bir artışa hidroksit konsantrasyonunda bir azalma eşlik eder. Bu nedenle, bir Arrhenius asidinin hidroksit konsantrasyonunu azaltan, bir Arrhenius bazının ise artıran bir asit olduğu söylenebilir. ⓘ
Asidik bir çözeltide, hidronyum iyonlarının konsantrasyonu litre başına 10-7 molden daha fazladır. pH, hidronyum iyonları konsantrasyonunun negatif logaritması olarak tanımlandığından, asidik çözeltilerin pH değeri 7'den düşüktür. ⓘ
- Tatları ekşidir.
- Mavi turnusol kağıdını kırmızıya çevirirler.
- Bazlarla tepkimeye girdiklerinde tuz ve su oluştururlar.(Nötralleşme Tepkimesi)
- Ciltte yanıcı bir his uyandırırlar.
- Fenolftalein damlatıldığında renk değiştirmezler.
- Asitlerin pH derecesi 7'den küçüktür.
- Suda çözündüklerinde elektrik akımını iletirler.
- Metil oranjın rengini kırmızıya çevirirler.
- Metalleri ve mermeri aşındırırlar.
Bundan başka çok çeşitlilik gösteren başka özellikleri de bulunur. Bu spesifik özellikler, anyon muhtevası ve ayrılmamış moleküllerden dolayı olur. Çeşitli asitlerin molekülleri, çözeltiye farklı miktarda serbest hidrojen iyonu bırakma eğilimindedir.
- Mavi turnusol kağıdını kırmızıya çevirirler. ⓘ
Brønsted-Lowry asitleri

Arrhenius konsepti birçok reaksiyonu tanımlamak için kullanışlı olsa da kapsamı oldukça sınırlıdır. 1923 yılında kimyager Johannes Nicolaus Brønsted ve Thomas Martin Lowry bağımsız olarak asit-baz reaksiyonlarının bir proton transferini içerdiğini fark ettiler. Bir Brønsted-Lowry asidi (ya da kısaca Brønsted asidi), bir Brønsted-Lowry bazına proton veren bir türdür. Brønsted-Lowry asit-baz teorisinin Arrhenius teorisine göre çeşitli avantajları vardır. Sirkeye karakteristik tadını veren organik asit olan asetik asidin (CH3COOH) aşağıdaki reaksiyonlarını düşünün:
- CH3COOH + H2O ⇌ CH3COO- + H3O+
- CH3COOH + NH3 ⇌ CH3COO- + NH+4 ⓘ
Her iki teori de ilk reaksiyonu kolayca açıklamaktadır: CH3COOH bir Arrhenius asidi gibi davranır çünkü suda çözündüğünde bir H3O+ kaynağı olarak hareket eder ve suya bir proton bağışlayarak bir Brønsted asidi gibi davranır. İkinci örnekte CH3COOH aynı dönüşüme uğrar, bu durumda amonyağa (NH3) bir proton verir, ancak reaksiyon hidronyum üretmediği için Arrhenius asit tanımıyla ilgili değildir. Bununla birlikte, CH3COOH hem Arrhenius hem de Brønsted-Lowry asididir. ⓘ
Brønsted-Lowry teorisi, sulu olmayan çözeltideki veya gaz fazındaki moleküler bileşiklerin reaksiyonlarını tanımlamak için kullanılabilir. Hidrojen klorür (HCl) ve amonyak birkaç farklı koşul altında birleşerek amonyum klorür, NH4Cl oluşturur. Sulu çözeltide HCl hidroklorik asit gibi davranır ve hidronyum ve klorür iyonları olarak bulunur. Aşağıdaki reaksiyonlar Arrhenius'un tanımının sınırlamalarını göstermektedir:
- H3O+
(aq) + Cl-
(aq) + NH3 → Cl-
(aq) + NH+
4(aq) + H2O - HCl(benzen) + NH3(benzen) → NH4Cl(s)
- HCl(g) + NH3(g) → NH4Cl(s) ⓘ
Asetik asit reaksiyonlarında olduğu gibi, her iki tanım da suyun çözücü olduğu ve HCl çözüneni tarafından hidronyum iyonunun oluşturulduğu ilk örnek için geçerlidir. Sonraki iki reaksiyon iyon oluşumunu içermez ancak yine de proton transferi reaksiyonlarıdır. İkinci reaksiyonda hidrojen klorür ve amonyak (benzen içinde çözünmüş) bir benzen çözücü içinde katı amonyum klorür oluşturmak üzere reaksiyona girer ve üçüncü reaksiyonda gaz halindeki HCl ve NH3 birleşerek katıyı oluşturur. ⓘ
Lewis asitleri
Gilbert N. Lewis tarafından 1923 yılında, proton transferi içermeyen asit-baz özelliklerine sahip reaksiyonları içeren, sadece marjinal olarak ilişkili üçüncü bir kavram önerilmiştir. Bir Lewis asidi, başka bir türden bir çift elektron kabul eden bir türdür; başka bir deyişle, bir elektron çifti alıcısıdır. Brønsted asit-baz reaksiyonları proton transfer reaksiyonları iken Lewis asit-baz reaksiyonları elektron çifti transferleridir. Birçok Lewis asidi Brønsted-Lowry asidi değildir. Aşağıdaki tepkimelerin asit-baz kimyası açısından nasıl tanımlandığını karşılaştırınız:
İlk reaksiyonda bir florür iyonu, F-, tetrafloroborat ürününü oluşturmak için bor triflorüre bir elektron çifti verir. Florür bir çift değerlik elektronunu "kaybeder" çünkü B-F bağında paylaşılan elektronlar iki atom çekirdeği arasındaki boşluk bölgesinde bulunur ve bu nedenle florür çekirdeğinden yalnız florür iyonunda olduğundan daha uzaktadır. BF3 bir Lewis asididir çünkü florürden elektron çiftini kabul eder. Bu reaksiyon Brønsted teorisi açısından tanımlanamaz çünkü proton transferi yoktur. İkinci reaksiyon her iki teori kullanılarak açıklanabilir. Belirtilmemiş bir Brønsted asitten bir Brønsted bazı olan amonyağa bir proton aktarılır; alternatif olarak, amonyak bir Lewis bazı gibi davranır ve bir hidrojen iyonu ile bir bağ oluşturmak için yalnız bir çift elektron aktarır. Elektron çifti kazanan tür Lewis asididir; örneğin, H3O+ 'daki oksijen atomu, H-O bağlarından biri koptuğunda bir çift elektron kazanır ve bağda paylaşılan elektronlar oksijen üzerinde lokalize olur. Bağlama bağlı olarak, bir Lewis asidi aynı zamanda bir oksitleyici veya bir elektrofil olarak da tanımlanabilir. Asetik, sitrik veya oksalik asit gibi organik Brønsted asitleri Lewis asidi değildir. Suda ayrışarak bir Lewis asidi olan H+ üretirler, ancak aynı zamanda eşit miktarda bir Lewis bazı da verirler (bahsedilen asitler için sırasıyla asetat, sitrat veya oksalat). Bu makale Lewis asitlerinden ziyade çoğunlukla Brønsted asitleri ile ilgilidir. ⓘ
Ayrışma ve denge
Asitlerin reaksiyonları genellikle HA ⇌ H+ + A- şeklinde genelleştirilir; burada HA asidi ve A- eşlenik bazı temsil eder. Bu reaksiyon protoliz olarak adlandırılır. Bir asidin protonlanmış formu (HA) bazen serbest asit olarak da adlandırılır. ⓘ
Asit-baz eşlenik çiftleri bir protonla farklılık gösterir ve bir protonun eklenmesi veya çıkarılmasıyla (sırasıyla protonasyon ve deprotonasyon) birbirine dönüştürülebilir. Asidin yüklü tür ve eşlenik bazın nötr olabileceğini unutmayın; bu durumda genelleştirilmiş reaksiyon şeması HA+ ⇌ H+ + A olarak yazılabilir. Çözeltide asit ve eşlenik baz arasında bir denge vardır. Denge sabiti K, çözeltideki moleküllerin veya iyonların denge konsantrasyonlarının bir ifadesidir. Parantezler konsantrasyonu gösterir, öyle ki [H2O] H2O konsantrasyonu anlamına gelir. Asit ayrışma sabiti Ka genellikle asit-baz reaksiyonları bağlamında kullanılır. Ka'nın sayısal değeri, ürünlerin konsantrasyonlarının reaktanların konsantrasyonuna bölünmesiyle elde edilen çarpıma eşittir; burada reaktan asit (HA), ürünler ise eşlenik baz ve H+'dır.
İki asitten daha güçlü olanı, daha zayıf olanından daha yüksek bir Ka değerine sahip olacaktır; hidrojen iyonlarının aside oranı daha güçlü asit için daha yüksek olacaktır, çünkü daha güçlü asit protonunu kaybetme eğilimindedir. Ka için olası değer aralığı birçok büyüklük mertebesini kapsadığından, daha yönetilebilir bir sabit olan pKa daha sık kullanılır, burada pKa = -log10 Ka'dır. Daha güçlü asitler, daha zayıf asitlerden daha küçük bir pKa değerine sahiptir. Sulu çözeltide 25 °C'de deneysel olarak belirlenen pKa değerleri ders kitaplarında ve referans materyallerde sıklıkla alıntılanır. ⓘ
İsimlendirme
Arrhenius asitleri anyonlarına göre adlandırılır. Klasik adlandırma sisteminde, iyonik son ek atılır ve aşağıdaki tabloya göre yeni bir son ek ile değiştirilir. "Hidro-" ön eki, asit sadece hidrojen ve bir başka elementten oluştuğunda kullanılır. Örneğin, HCl'nin anyonu klorürdür, bu nedenle hidro- ön eki kullanılır ve -ide son eki ismin hidroklorik asit şeklini almasını sağlar. ⓘ
Klasik adlandırma sistemi:
| Anyon öneki | Anyon son eki | Asit öneki | Asit son eki | Örnek ⓘ |
|---|---|---|---|---|
| başına | yedi | başına | ik asit | perklorik asit (HClO4) |
| yedi | ik asit | klorik asit (HClO3) | ||
| ite | ous asit | kloröz asit (HClO2) | ||
| hipo | ite | hipo | ous asit | hipokloröz asit (HClO) |
| ide | hidro | ik asit | hidroklorik asit (HCl) |
IUPAC adlandırma sisteminde, "sulu" basitçe iyonik bileşiğin adına eklenir. Dolayısıyla, bir asit çözeltisi olarak hidrojen klorür için IUPAC adı sulu hidrojen klorürdür. ⓘ
Asit gücü
Bir asidin gücü, bir proton kaybetme yeteneğini veya eğilimini ifade eder. Kuvvetli bir asit suda tamamen ayrışan bir asittir; başka bir deyişle, bir mol kuvvetli asit HA suda çözünerek bir mol H+ ve bir mol eşlenik baz, A- verir ve protonlanmış asit HA'dan hiçbir şey vermez. Bunun aksine, zayıf bir asit sadece kısmen ayrışır ve dengede hem asit hem de eşlenik baz çözeltidedir. Güçlü asitlere örnek olarak hidroklorik asit (HCl), hidroiyodik asit (HI), hidrobromik asit (HBr), perklorik asit (HClO4), nitrik asit (HNO3) ve sülfürik asit (H2SO4) verilebilir. Bunların her biri suda esasen %100 iyonize olur. Bir asit ne kadar güçlüyse, bir protonu (H+) o kadar kolay kaybeder. Deprotonasyonun kolaylığına katkıda bulunan iki temel faktör, H-A bağının polaritesi ve H-A bağının gücünü belirleyen A atomunun boyutudur. Asit kuvvetleri genellikle eşlenik bazın kararlılığı açısından da tartışılır. ⓘ
Daha güçlü asitler, daha büyük bir asit ayrışma sabiti olan Ka'ya ve daha zayıf asitlere göre daha negatif bir pKa'ya sahiptir. ⓘ
Organik oksiasitler olan sülfonik asitler, güçlü asitlerin bir sınıfıdır. Yaygın bir örnek toluensülfonik asittir (tosilik asit). Sülfürik asidin aksine, sülfonik asitler katı olabilir. Aslında, polistiren sülfonata işlevselleştirilmiş polistiren, filtrelenebilen katı, güçlü asidik bir plastiktir. ⓘ
Süperasitler %100 sülfürik asitten daha güçlü asitlerdir. Süper asitlere örnek olarak floroantimonik asit, sihirli asit ve perklorik asit verilebilir. Süper asitler iyonik, kristal hidronyum "tuzları" vermek için suyu kalıcı olarak protonlayabilir. Ayrıca karbokatyonları nicel olarak stabilize edebilirler. ⓘ
Ka bir asit bileşiğinin gücünü ölçerken, sulu bir asit çözeltisinin gücü, çözeltideki hidronyum konsantrasyonunun bir göstergesi olan pH ile ölçülür. Bir asit bileşiğinin sudaki basit bir çözeltisinin pH'ı, bileşiğin seyreltilmesi ve bileşiğin Ka'sı ile belirlenir. ⓘ
Sulu olmayan çözeltilerde Lewis asit gücü
Lewis asitleri ECW modelinde sınıflandırılmış ve asit kuvvetlerinin tek bir sırası olmadığı gösterilmiştir. Lewis asitlerinin bir dizi baza karşı göreceli alıcı gücü, diğer Lewis asitlerine karşı C-B grafikleri ile gösterilebilir. Lewis asit gücünün sırasını tanımlamak için en az iki özelliğin dikkate alınması gerektiği gösterilmiştir. Pearson'ın nitel HSAB teorisi için bu iki özellik sertlik ve kuvvet iken Drago'nun nicel ECW modeli için bu iki özellik elektrostatik ve kovalenttir. ⓘ
Kimyasal özellikler
Monoprotik asitler
Monobazik asitler olarak da bilinen monoprotik asitler, aşağıda gösterildiği gibi ayrışma (bazen iyonlaşma olarak da adlandırılır) işlemi sırasında molekül başına bir proton bağışlayabilen asitlerdir (HA ile sembolize edilmiştir):
- HA (aq) + H2O (l) ⇌ H3O+ (aq) + A- (aq) Ka ⓘ
Mineral asitlerdeki monoprotik asitlerin yaygın örnekleri hidroklorik asit (HCl) ve nitrik asittir (HNO3). Öte yandan, organik asitler için terim esas olarak bir karboksilik asit grubunun varlığını gösterir ve bazen bu asitler monokarboksilik asit olarak bilinir. Organik asitlere örnek olarak formik asit (HCOOH), asetik asit (CH3COOH) ve benzoik asit (C6H5COOH) verilebilir. ⓘ
Poliprotik asitler
Polibazik asitler olarak da bilinen poliprotik asitler, molekül başına yalnızca bir proton bağışlayan monoprotik asitlerin aksine, asit molekülü başına birden fazla proton bağışlayabilmektedir. Belirli poliprotik asit türleri, diprotik (veya dibazik) asit (bağışlanacak iki potansiyel proton) ve triprotik (veya tribazik) asit (bağışlanacak üç potansiyel proton) gibi daha spesifik isimlere sahiptir. Proteinler ve nükleik asitler gibi bazı makromoleküller çok fazla sayıda asidik protona sahip olabilir. ⓘ
Diprotik bir asit (burada H2A ile sembolize edilmiştir) pH'a bağlı olarak bir veya iki ayrışmaya uğrayabilir. Her ayrışmanın kendi ayrışma sabiti vardır, Ka1 ve Ka2.
- H2A (aq) + H2O (l) ⇌ H3O+ (aq) + HA- (aq) Ka1
- HA- (aq) + H2O (l) ⇌ H3O+ (aq) + A2- (aq) Ka2 ⓘ
İlk ayrışma sabiti tipik olarak ikincisinden daha büyüktür (yani, Ka1 > Ka2). Örneğin, sülfürik asit (H2SO4) bisülfat anyonu oluşturmak için bir proton bağışlayabilir (HSO-
4), bunun için Ka1 çok büyüktür; daha sonra sülfat anyonu oluşturmak için ikinci bir proton bağışlayabilir (SO2-
4), burada Ka2 orta güçtedir. İlk ayrışma için büyük Ka1, sülfüriği güçlü bir asit yapar. Benzer bir şekilde, zayıf kararsız karbonik asit (H2CO3) bir proton kaybederek bikarbonat anyonu (HCO-
3) ve karbonat anyonu oluşturmak için bir saniye kaybeder (CO2-
3). Her iki Ka değeri de küçüktür, ancak Ka1 > Ka2 . ⓘ
Triprotik bir asit (H3A) bir, iki veya üç ayrışmaya uğrayabilir ve Ka1 > Ka2 > Ka3 olmak üzere üç ayrışma sabitine sahiptir.
- H3A (aq) + H2O (l) ⇌ H3O+ (aq) + H2A- (aq) Ka1
- H2A- (aq) + H2O (l) ⇌ H3O+ (aq) + HA2- (aq) Ka2
- HA2- (aq) + H2O (l) ⇌ H3O+ (aq) + A3- (aq) Ka3 ⓘ
Triprotik asidin inorganik bir örneği ortofosforik asittir (H3PO4), genellikle sadece fosforik asit olarak adlandırılır. Her üç proton da H2PO- vermek üzere art arda kaybedilebilir.
4, sonra HPO2-
4 ve son olarak PO3-
4, ortofosfat iyonu, genellikle sadece fosfat olarak adlandırılır. Orijinal fosforik asit molekülündeki üç protonun konumları eşdeğer olsa da, eşlenik baz daha negatif yüklü ise bir proton kaybetmek enerjik olarak daha az elverişli olduğundan, ardışık Ka değerleri farklılık gösterir. Triprotik asidin organik bir örneği sitrik asittir ve bu asit art arda üç proton kaybederek sonunda sitrat iyonunu oluşturabilir. ⓘ
Her bir hidrojen iyonunun müteakip kaybı daha az elverişli olsa da, tüm eşlenik bazlar çözeltide mevcuttur. Her tür için fraksiyonel konsantrasyon, α (alfa), hesaplanabilir. Örneğin, genel bir diprotik asit çözeltide 3 tür oluşturacaktır: H2A, HA- ve A2-. Kesirli konsantrasyonlar, pH ([H+]'ya dönüştürülebilir) veya asidin tüm eşlenik bazlarıyla konsantrasyonları verildiğinde aşağıdaki gibi hesaplanabilir:
Verilen K1 ve K2 için bu fraksiyonel konsantrasyonların pH'a karşı grafiği Bjerrum grafiği olarak bilinir. Yukarıdaki denklemlerde bir model gözlenir ve i-kez deprotonlanmış genel n-protik aside genişletilebilir:
Burada K0 = 1 ve diğer K-terimleri asit için ayrışma sabitleridir. ⓘ
Nötralizasyon
Nötralizasyon, bir asit ve bir baz arasındaki tepkimedir, bir tuz ve nötralize edilmiş baz üretir; örneğin, hidroklorik asit ve sodyum hidroksit, sodyum klorür ve su oluşturur:
- HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq) ⓘ
Nötralizasyon, bir aside eşdeğer sayıda mol baz eklendiğinde bir pH göstergesinin eşdeğerlik noktasını gösterdiği titrasyonun temelidir. Nötralizasyonun pH 7,0 olan bir çözelti ile sonuçlanması gerektiği genellikle yanlış bir şekilde varsayılır, bu durum yalnızca bir reaksiyon sırasında benzer asit ve baz kuvvetlerinde geçerlidir. ⓘ
Asitten daha zayıf bir baz ile nötralizasyon zayıf asidik bir tuz ile sonuçlanır. Güçlü asit hidrojen klorür ve zayıf baz amonyaktan üretilen zayıf asidik amonyum klorür buna bir örnektir. Tersine, zayıf bir asidin güçlü bir baz ile nötrleştirilmesi zayıf bazik bir tuz verir (örneğin, hidrojen florür ve sodyum hidroksitten sodyum florür). ⓘ
Zayıf asit-zayıf baz dengesi
Protonlanmış bir asidin bir proton kaybetmesi için sistemin pH'ının asidin pKa değerinin üzerine çıkması gerekir. Bu bazik çözeltide azalan H+ konsantrasyonu dengeyi eşlenik baz formuna (asidin deprotonlanmış formu) doğru kaydırır. Düşük pH'lı (daha asidik) çözeltilerde, çözeltide asidin protonlanmış formda kalmasına neden olacak kadar yüksek bir H+ konsantrasyonu vardır. ⓘ
Zayıf asitlerin ve eşlenik bazlarının tuzlarının çözeltileri tampon çözeltiler oluşturur. ⓘ
Titrasyon
Sulu bir çözeltideki bir asidin konsantrasyonunu belirlemek için genellikle asit-baz titrasyonu yapılır. Bilinen bir konsantrasyona sahip güçlü bir baz çözeltisi, genellikle NaOH veya KOH, eklenen baz miktarı ile indikatörün renk değişimine göre asit çözeltisini nötralize etmek için eklenir. Bir baz ile titre edilen bir asidin titrasyon eğrisi, x ekseninde baz hacmi ve y ekseninde çözeltinin pH değeri olmak üzere iki eksene sahiptir. Çözeltiye baz eklendikçe çözeltinin pH değeri daima yükselir. ⓘ
Örnek olarak: Diprotik asit

Her diprotik asit titrasyon eğrisi için soldan sağa doğru iki orta nokta, iki eşdeğerlik noktası ve iki tampon bölge vardır. ⓘ
Eşdeğerlik noktaları
Ardışık ayrışma süreçleri nedeniyle, diprotik bir asidin titrasyon eğrisinde iki eşdeğerlik noktası vardır. İlk eşdeğerlik noktası, ilk iyonizasyondan gelen tüm ilk hidrojen iyonları titre edildiğinde meydana gelir. Başka bir deyişle, eklenen OH- miktarı ilk eşdeğerlik noktasındaki orijinal H2A miktarına eşittir. İkinci eşdeğerlik noktası, tüm hidrojen iyonları titre edildiğinde oluşur. Bu nedenle, eklenen OH- miktarı bu andaki H2A miktarının iki katına eşittir. Güçlü bir baz ile titre edilen zayıf bir diprotik asit için ikinci eşdeğerlik noktası, çözeltide oluşan tuzların hidrolizi nedeniyle pH 7'nin üzerinde gerçekleşmelidir. Her iki eşdeğerlik noktasında da, bir damla baz eklenmesi sistemdeki pH değerinin en dik şekilde yükselmesine neden olacaktır. ⓘ
Tampon bölgeler ve orta noktalar
Diprotik bir asit için titrasyon eğrisi pH=pKa olan iki orta nokta içerir. İki farklı Ka değeri olduğundan, ilk orta nokta pH=pKa1'de ve ikincisi pH=pKa2'de meydana gelir. Merkezinde bir orta nokta içeren eğrinin her bir parçasına tampon bölge denir. Tampon bölgeler asit ve eşlenik bazından oluştuğu için, bir sonraki eşdeğer noktalara kadar baz eklendiğinde pH değişikliklerine direnebilir. ⓘ
Asitlerin uygulamaları
Asitler hayatımızda evrensel olarak mevcuttur. Hem biyolojik işlevleri olan çok sayıda doğal asit bileşiği hem de birçok şekilde kullanılan büyük miktarda sentezlenmiş asitler vardır. ⓘ
Endüstri alanında
Asitler, günümüz endüstrisindeki neredeyse tüm proseslerin arıtılmasında temel reaktiflerdir. Diprotik bir asit olan sülfürik asit, endüstride en yaygın kullanılan asittir ve aynı zamanda dünyada en çok üretilen endüstriyel kimyasaldır. Başlıca gübre, deterjan, pil ve boya üretiminde kullanıldığı gibi, safsızlıkların giderilmesi gibi birçok ürünün işlenmesinde de kullanılmaktadır. İstatistik verilerine göre 2011 yılında dünyada yıllık sülfürik asit üretimi 200 milyon ton civarındaydı. Örneğin, fosfat mineralleri sülfürik asit ile reaksiyona girerek fosfatlı gübre üretimi için fosforik asit üretir ve çinko oksitin sülfürik asit içinde çözülmesi, çözeltinin saflaştırılması ve elektrowinning yoluyla çinko üretilir. ⓘ
Kimya endüstrisinde asitler nötralizasyon reaksiyonlarına girerek tuzlar üretir. Örneğin, nitrik asit amonyakla reaksiyona girerek bir gübre olan amonyum nitrat üretir. Ayrıca, karboksilik asitler alkollerle esterleştirilerek esterler üretilebilir. ⓘ
Asitler genellikle asitleme olarak bilinen bir işlemde metallerden pas ve diğer korozyonu gidermek için kullanılır. Bir araba aküsündeki sülfürik asit gibi ıslak hücreli bir aküde elektrolit olarak kullanılabilirler. ⓘ
Yiyeceklerde

Tartarik asit, olgunlaşmamış mango ve demirhindi gibi yaygın olarak kullanılan bazı gıdaların önemli bir bileşenidir. Doğal meyve ve sebzeler de asit içerir. Sitrik asit portakal, limon ve diğer turunçgillerde bulunur. Oksalik asit domates, ıspanak ve özellikle karambola ve raventte bulunur; ravent yaprakları ve olgunlaşmamış karambolalar yüksek oksalik asit konsantrasyonları nedeniyle toksiktir. Askorbik asit (C Vitamini) insan vücudu için gerekli bir vitamindir ve amla (Hint bektaşi üzümü), limon, turunçgiller ve guava gibi gıdalarda bulunur. ⓘ
Birçok asit, tatlarını değiştirdikleri ve koruyucu olarak hizmet ettikleri için çeşitli gıdalarda katkı maddesi olarak bulunabilir. Örneğin fosforik asit, kolalı içeceklerin bir bileşenidir. Asetik asit günlük hayatta sirke olarak kullanılır. Sitrik asit soslarda ve turşularda koruyucu olarak kullanılır. ⓘ
Karbonik asit, alkolsüz içeceklere yaygın olarak eklenen en yaygın asit katkı maddelerinden biridir. Üretim sürecinde, CO2 genellikle bu içeceklerde çözünerek karbonik asit oluşturması için basınçlandırılır. Karbonik asit çok kararsızdır ve oda sıcaklığı ve basıncında su ve CO2'ye ayrışma eğilimindedir. Bu nedenle, bu tür meşrubatların şişeleri veya kutuları açıldığında, CO2 kabarcıkları çıktıkça meşrubatlar köpürür ve efervesan hale gelir. ⓘ
Bazı asitler ilaç olarak kullanılır. Asetilsalisilik asit (Aspirin) ağrı kesici olarak ve ateş düşürmek için kullanılır. ⓘ
İnsan vücudunda
Asitler insan vücudunda önemli roller oynar. Midede bulunan hidroklorik asit, büyük ve karmaşık gıda moleküllerini parçalayarak sindirime yardımcı olur. Amino asitler, vücut dokularının büyümesi ve onarımı için gerekli olan proteinlerin sentezi için gereklidir. Yağ asitleri de vücut dokularının büyümesi ve onarımı için gereklidir. Nükleik asitler, DNA ve RNA üretimi ve genler aracılığıyla özelliklerin yavrulara aktarılması için önemlidir. Karbonik asit vücuttaki pH dengesinin korunması için önemlidir. ⓘ
İnsan vücudu çeşitli organik ve inorganik bileşikler içerir, bunlar arasında dikarboksilik asitler birçok biyolojik davranışta önemli bir rol oynar. Bu asitlerin çoğu, esas olarak protein sentezi için malzeme görevi gören amino asitlerdir. Diğer zayıf asitler, vücudun pH'ının hücreler için zararlı olabilecek büyük ölçekli değişikliklere uğramasını önlemek için eşlenik bazları ile tampon görevi görür. Dikarboksilik asitlerin geri kalanı da insan vücudunda biyolojik açıdan önemli çeşitli bileşiklerin sentezine katılır. ⓘ
Asit katalizi
Asitler endüstriyel ve organik kimyada katalizör olarak kullanılır; örneğin, sülfürik asit benzin üretmek için alkilasyon işleminde çok büyük miktarlarda kullanılır. Sülfürik, fosforik ve hidroklorik asitler gibi bazı asitler dehidrasyon ve kondensasyon reaksiyonlarını da etkiler. Biyokimyada birçok enzim asit katalizini kullanır. ⓘ
Biyolojik oluşum
Biyolojik açıdan önemli birçok molekül asittir. Asidik fosfat grupları içeren nükleik asitler DNA ve RNA'yı içerir. Nükleik asitler, bir organizmanın birçok özelliğini belirleyen genetik kodu içerir ve ebeveynlerden yavrulara aktarılır. DNA, amino asit alt birimlerinden oluşan proteinlerin sentezi için kimyasal planı içerir. Hücre zarları fosfolipidler gibi yağ asidi esterleri içerir. ⓘ
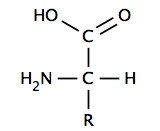
Bir α-amino asit, bir karboksil grubuna (bu nedenle karboksilik asitlerdir), bir amino grubuna, bir hidrojen atomuna ve bir değişken gruba kovalent olarak bağlanmış merkezi bir karbona (α veya alfa karbonu) sahiptir. R grubu veya yan zincir olarak da adlandırılan değişken grup, belirli bir amino asidin kimliğini ve birçok özelliğini belirler. En basit amino asit olan glisinde R grubu bir hidrojen atomudur, ancak diğer tüm amino asitlerde hidrojenlere bağlı bir veya daha fazla karbon atomu içerir ve kükürt, oksijen veya nitrojen gibi başka elementler de içerebilir. Glisin haricinde, doğal olarak oluşan amino asitler kiraldir ve neredeyse her zaman L konfigürasyonunda meydana gelirler. Bazı bakteriyel hücre duvarlarında bulunan peptidoglikan, bazı D-amino asitleri içerir. Fizyolojik pH'da, tipik olarak 7 civarında, serbest amino asitler, asidik karboksil grubunun (-COOH) bir proton kaybettiği (-COO-) ve bazik amin grubunun (-NH2) bir proton kazandığı (-NH+) yüklü bir formda bulunur.
3). Bazik veya asidik yan zincirlere sahip amino asitler haricinde, molekülün tamamı net nötr bir yüke sahiptir ve bir zwitteriondur. Örneğin aspartik asit, fizyolojik pH'da -1 net yük için bir protonlanmış amin ve iki deprotonlanmış karboksil grubuna sahiptir. ⓘ
Yağ asitleri ve yağ asidi türevleri, biyolojide önemli bir rol oynayan bir başka karboksilik asit grubudur. Bunlar uzun hidrokarbon zincirleri ve bir ucunda bir karboksilik asit grubu içerir. Neredeyse tüm organizmaların hücre zarı temel olarak bir fosfolipid çift tabakadan, polar, hidrofilik fosfat "baş" gruplarına sahip hidrofobik yağ asidi esterlerinden oluşan bir miselden oluşur. Membranlar, bazıları asit-baz reaksiyonlarına katılabilen ek bileşenler içerir. ⓘ
İnsanlarda ve diğer birçok hayvanda hidroklorik asit, proteinleri ve polisakkaritleri hidrolize etmeye yardımcı olmak ve inaktif pro-enzim olan pepsinojeni pepsin enzimine dönüştürmek için mide içinde salgılanan mide asidinin bir parçasıdır. Bazı organizmalar savunma için asit üretir; örneğin karıncalar formik asit üretir. ⓘ
Asit-baz dengesi memeli solunumunun düzenlenmesinde kritik bir rol oynar. Oksijen gazı (O2), hayvanların gıdalarda depolanan kimyasal potansiyel enerjiyi serbest bıraktığı ve yan ürün olarak karbondioksit (CO2) ürettiği süreç olan hücresel solunumu yönlendirir. Oksijen ve karbondioksit akciğerlerde değiş tokuş edilir ve vücut değişen enerji taleplerine havalandırma oranını ayarlayarak yanıt verir. Örneğin, efor dönemlerinde vücut depolanmış karbonhidratları ve yağları hızla parçalayarak kan akışına CO2 salar. Kan gibi sulu çözeltilerde CO2, karbonik asit ve bikarbonat iyonu ile dengede bulunur.
- CO2 + H2O ⇌ H2CO3 ⇌ H+ + HCO-3
Beyne daha hızlı ve daha derin nefes alma sinyali veren, fazla CO2'yi dışarı atan ve hücrelere O2 takviyesi yapan pH'daki düşüştür. ⓘ

Hücre membranları, iç kısımlarını oluşturan lipofilik yağ asil zincirleri nedeniyle genellikle yüklü veya büyük, polar moleküllere karşı geçirimsizdir. Bir dizi farmasötik ajan da dahil olmak üzere biyolojik olarak önemli birçok molekül, protonlanmış, yüksüz formlarında membranı geçebilen ancak yüklü formlarında (yani, konjugat baz olarak) geçemeyen organik zayıf asitlerdir. Bu nedenle birçok ilacın aktivitesi antiasit veya asidik gıdaların kullanımıyla arttırılabilir veya engellenebilir. Bununla birlikte, yüklü form genellikle her ikisi de sulu ortamlar olan kan ve sitozolde daha fazla çözünür. Hücre dışı ortam hücre içindeki nötr pH'dan daha asidik olduğunda, bazı asitler nötr formlarında bulunacak ve zarda çözünerek fosfolipid çift tabakayı geçmelerine izin verecektir. Hücre içi pH'da bir proton kaybeden asitler çözünebilir, yüklü formlarında bulunacak ve böylece sitozolden hedeflerine doğru difüze olabileceklerdir. İbuprofen, aspirin ve penisilin zayıf asit olan ilaçlara örnektir. ⓘ
Yaygın asitler
Mineral asitler (inorganik asitler)
- Hidrojen halojenürler ve çözeltileri: hidroflorik asit (HF), hidroklorik asit (HCl), hidrobromik asit (HBr), hidroiyodik asit (HI)
- Halojen oksoasitler: hipokloröz asit (HClO), kloröz asit (HClO2), klorik asit (HClO3), perklorik asit (HClO4) ve brom ve iyot için karşılık gelen analoglar
- Hipofloröz asit (HFO), flor için bilinen tek oksoasittir.
- Sülfürik asit (H2SO4)
- Florosülfürik asit (HSO3F)
- Nitrik asit (HNO3)
- Fosforik asit (H3PO4)
- Floroantimonik asit (HSbF6)
- Floroborik asit (HBF4)
- Heksaflorofosforik asit (HPF6)
- Kromik asit (H2CrO4)
- Borik asit (H3BO3) ⓘ
Sülfonik asitler
Bir sülfonik asit RS(=O)2-OH genel formülüne sahiptir, burada R organik bir radikaldir.
- Metansülfonik asit (veya mesilik asit, CH3SO3H)
- Etanesülfonik asit (veya esilik asit, CH3CH2SO3H)
- Benzensülfonik asit (veya besilik asit, C6H5SO3H)
- p-Toluensülfonik asit (veya tosilik asit, CH3C6H4SO3H)
- Triflorometansülfonik asit (veya triflik asit, CF3SO3H)
- Polistiren sülfonik asit (sülfonlanmış polistiren, [CH2CH(C6H4)SO3H]n) ⓘ
Karboksilik asitler
Bir karboksilik asit R-C(O)OH genel formülüne sahiptir, burada R organik bir radikaldir. Karboksil grubu -C(O)OH, bir karbonil grubu, C=O ve bir hidroksil grubu, O-H içerir.
- Asetik asit (CH3COOH)
- Sitrik asit (C6H8O7)
- Formik asit (HCOOH)
- Glukonik asit HOCH2-(CHOH)4-COOH
- Laktik asit (CH3-CHOH-COOH)
- Oksalik asit (HOOC-COOH)
- Tartarik asit (HOOC-CHOH-CHOH-COOH) ⓘ
Halojenli karboksilik asitler
Alfa pozisyonundaki halojenasyon asit gücünü artırır, böylece aşağıdaki asitlerin hepsi asetik asitten daha güçlüdür.
- Floroasetik asit
- Trifloroasetik asit
- Kloroasetik asit
- Dikloroasetik asit
- Trikloroasetik asit ⓘ
Vinilogöz karboksilik asitler
Normal karboksilik asitler, bir karbonil grubu ile bir hidroksil grubunun doğrudan birleşimidir. Vinilogöz karboksilik asitlerde, bir karbon-karbon çift bağı karbonil ve hidroksil gruplarını ayırır. ⓘ
- Askorbik asit ⓘ
Nükleik asitler
Asit türleri
Asitler başlıca iki grupta toplanabilirler: ⓘ
Organik asitler
Bitkiler, hayvanlar ve insanlar, organik asitler adı verilen çeşitli asidik karbon bileşimleri üretir. Bunların çoğu zararsızdır; meyveler ve diğer yiyeceklere tat verir. ⓘ
Organik asitler yapıları karbon iskeletine dayalı asitlerdir. Formik, asetik, propiyonik, bütirik, fumarik, sorbik, sitrik ve malik asit gibi asitler ve bunların tuzları başlıca organik asitlerdendir. ⓘ
Doğada saf olarak bitkisel ve hayvansal organizmada bulunabilir ve ayrıca doğal yollardan elde edilebilir. Hayvan vücudunda kullanılıp metobolize olduktan sonra karbondioksit ve suya okside olur. ⓘ
Dolayısıyla canlı organizma için herhangi bir sağlık sorunu ya da bir risk oluşturabilecek hiçbir kalıntı bırakmaz. ⓘ
Bu özellikleri nedeniyle kâr büyütme faktörlerinin hayvan beslemede kullanımının yasaklanmasından sonra antibiyotiklerin yerini alabilecek çok sayıda yapay organik asit üretilmiştir. ⓘ

![{\displaystyle K_{a}={\frac {{\ce {[H+] [A^{-}]}}}{{\ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad1f54a70a45ea863263baa691826f3ee6cfb58)
![{\displaystyle {\begin{aligned}\alpha _{{\ce {H2A}}}&={\frac {{\ce {[H+]^2}}}{{\ce {[H+]^2}}+[{\ce {H+}}]K_{1}+K_{1}K_{2}}}={\frac {{\ce {[H2A]}}}{{\ce {{[H2A]}}}+[HA^{-}]+[A^{2-}]}}\\\alpha _{{\ce {HA^-}}}&={\frac {[{\ce {H+}}]K_{1}}{{\ce {[H+]^2}}+[{\ce {H+}}]K_{1}+K_{1}K_{2}}}={\frac {{\ce {[HA^-]}}}{{\ce {[H2A]}}+{[HA^{-}]}+{[A^{2-}]}}}\\\alpha _{{\ce {A^{2-}}}}&={\frac {K_{1}K_{2}}{{\ce {[H+]^2}}+[{\ce {H+}}]K_{1}+K_{1}K_{2}}}={\frac {{\ce {[A^{2-}]}}}{{\ce {{[H2A]}}}+{[HA^{-}]}+{[A^{2-}]}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e09f46996e12e5d2c821158e6bc6f70f54edbe7)
![{\displaystyle \alpha _{{\ce {H}}_{n-i}A^{i-}}={{[{\ce {H+}}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}} \over {\displaystyle \sum _{i=0}^{n}{\Big [}[{\ce {H+}}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}}{\Big ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a82c39009cacb7d891f1f06a46a6558c3c91e76)