Molnupiravir
 | |
| Klinik veriler | |
|---|---|
| Ticari isimler | Lagevrio |
| Diğer isimler | MK-4482, EIDD-2801 |
| AHFS/Drugs.com | Monografi |
| Lisans verileri |
|
| Hamilelik Kategori |
|
| Güzergahları YÖNETİM | Ağızdan |
| ATC kodu |
|
| Yasal statü | |
| Yasal statü |
|
| Tanımlayıcılar | |
IUPAC adı
| |
| CAS Numarası | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| Kimyasal ve fiziksel veriler | |
| Formül | C13H19N3O7 |
| Molar kütle | 329.309 g-mol-1 |
| 3D model (JSmol) | |
GÜLÜMSEMELER
| |
InChI
| |
Molnupiravir, belirli RNA virüslerinin replikasyonunu inhibe eden antiviral bir ilaçtır. SARS-CoV-2 ile enfekte olanlarda COVID-19'u tedavi etmek için kullanılır. ⓘ
Molnupiravir, sentetik nükleozit türevi N4-hidroksisitidinin bir ön ilacıdır ve antiviral etkisini viral RNA replikasyonu sırasında kopyalama hatalarının ortaya çıkması yoluyla gösterir. ⓘ
Molnupiravir ilk olarak Emory Üniversitesi'nde influenza tedavisi için üniversitenin ilaç inovasyon şirketi Drug Innovation Ventures at Emory (DRIVE) tarafından geliştirilmiş, ancak mutajenite endişeleri nedeniyle terk edildiği bildirilmiştir. Daha sonra Miami merkezli Ridgeback Biotherapeutics şirketi tarafından satın alındı ve bu şirket daha sonra ilacı daha da geliştirmek için Merck & Co. ile ortaklık kurdu. ⓘ
Plasebo kontrollü çift kör randomize klinik çalışmalardaki olumlu sonuçlara dayanarak, Molnupiravir Kasım 2021'de Birleşik Krallık'ta tıbbi kullanım için onaylandı. Aralık 2021'de ABD Gıda ve İlaç Dairesi (FDA), diğer tedavilerin uygulanabilir olmadığı belirli popülasyonlarda kullanılmak üzere molnupiravire acil kullanım izni (EUA) vermiştir. Acil kullanım izni, etkinlikle ilgili sorular ve molnupiravirin mutajenik etkilerinin bağışıklıktan kaçan ve COVID-19 pandemisini uzatan yeni varyantlar yaratabileceği endişeleri nedeniyle yalnızca dar bir şekilde onaylanmıştır (13-10). ⓘ
Molnupiravir, Birleşik Krallık'ta Kasım 2021'de tıbbi kullanım için onaylanmıştır. 14 Şubat 2022 Pazartesi itibarı ile Türkiye'de de kullanılmaya başlanmıştır. 65 Yaş üstü ve Bağısıklığı baskılanmış 18 yaş Üstünde Kullanılmaktadır. ⓘ
Tıbbi kullanımlar
Molnupiravir, doğrudan SARS-CoV-2 viral test sonuçları pozitif olan ve şiddetli COVID-19'a ilerleme riski yüksek olan yetişkinlerde hafif-orta şiddette koronavirüs hastalığının (COVID-19) tedavisinde endikedir. ⓘ
Kontrendikasyonlar
Hamilelikte kullanımı tavsiye edilmez. Advers maternal veya fetal sonuç riskini değerlendirmek için gebelik sırasında kullanımla ilgili insan verisi yoktur. Hayvan verilerine dayanarak, ilaç fetal zarara neden olabilir. ⓘ
Sıçanlarda, tekrarlanan dozlamadan sonra kemik ve kıkırdak toksisitesi gözlenmiştir. ⓘ
Advers etkiler
Faz III MOVe-OUT çalışmasında gözlenen advers reaksiyonlar arasında diyare (%2), bulantı (%1) ve baş dönmesi (%1) yer almaktadır ve bunların tümü hafif veya orta şiddette olmuştur. ⓘ
Aşırı Doz
Doz aşımının etkileri bilinmemektedir, tedavi klinik durumun izlenmesi gibi genel destekleyici önlemlerden oluşur. ⓘ
İlaç etkileşimleri
Mevcut sınırlı verilere dayanmakla birlikte, bilinen bir ilaç etkileşimi yoktur. ⓘ
Etki mekanizması
Molnupiravir, RNA'ya yönelik RNA polimeraz tarafından viral RNA'nın replikasyonunda yaygın mutasyonları teşvik ederek viral üremeyi engeller. Sitidine benzeyen bir ribonükleozit analoğuna, β-D-N4-Hidroksisitidin 5′-trifosfata (EIDD-1931 5′-trifosfat veya NHC-TP olarak da adlandırılır) metabolize olur. Virüsün enzimi replikasyon sırasında gerçek sitidin kullanmak yerine NHC-TP'yi yeni yapılan RNA'ya dahil eder. ⓘ
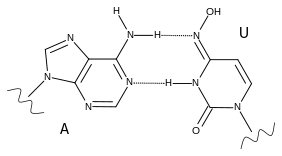
Molnupiravir, biri sitidini (C) diğeri üridini (U) taklit eden iki form (tautomer) arasında geçiş yapabilir. NHC-TP, mutasyona uğramış nükleotidleri düzeltilmiş versiyonlarıyla değiştirebilen virüsün düzeltici ekzonükleaz enzimleri tarafından bir hata olarak tanınmaz. Viral RNA polimeraz molnupiravir içeren RNA'yı kopyalamaya çalıştığında, bunu bazen C bazen de U olarak yorumlar. Bu durum, viral hata felaketi veya ölümcül mutajenez adı verilen bir etki olarak, tüm aşağı akış kopyalarında virüsün hayatta kalabileceğinden daha fazla mutasyona neden olur.

|
|
Kimya
Molnupiravirin ilk sentezi 2018 yılında Emory Üniversitesi tarafından dosyalanan bir patentte açıklanmıştır. ⓘ
İlk adımda aseton, üridinin üç hidroksi grubundan ikisini, üçüncü hidroksi grubunu esterine dönüştüren izobütirik asidin asit anhidriti ile muameleye karşı reaktif olmayan hale getirmek için koruyucu bir grup olarak kullanılır. 1,2,4-triazol ve fosforil klorür ile muamele, triazol kısmının hidroksilamin ile değiştirilebildiği reaktif bir ara ürün üretir. Son olarak, koruyucu grubun formik asit kullanılarak çıkarılması materyali molnupiravire dönüştürür.
Molnupiravir için alternatif patentli yollar gözden geçirilmiştir. ⓘ
Tarihçe
Molnupiravir, Emory Üniversitesi'nde, üniversitenin ilaç inovasyon şirketi Drug Innovation Ventures at Emory (DRIVE) tarafından geliştirilmiştir. DRIVE, 2014 yılında Venezuela at ensefaliti virüsünü (VEEV) hedef alan antiviral bir ilaç bulmak için Savunma Tehdit Azaltma Ajansı tarafından finanse edilen bir tarama projesi başlattı ve bu da EIDD-1931'in keşfine yol açtı. EIDD-2801 (molnupiravir) ön ilacına dönüştürüldüğünde, bileşik ayrıca influenza, Ebola, chikungunya ve çeşitli koronavirüsler dahil olmak üzere diğer RNA virüslerine karşı da aktivite gösterdi. ⓘ
İlacın uluslararası tescilli olmayan ismi Thor'un çekici Mjölnir'den esinlenilmiştir. Buradaki fikir, ilacın gök gürültüsü tanrısının güçlü bir darbesi gibi virüsü yere sereceğidir. ⓘ
2019 yılında Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü (NIAID) molnupiravirin influenza için Faz I klinik deneylerine alınmasını onayladı. ⓘ
Mart 2020'de araştırma ekibi SARS-CoV-2 üzerinde çalışmaya başladı ve ilacı yeni koronavirüs ile enfekte olmuş insan hücrelerini tedavi etmek için başarıyla kullandı. Bir çalışma, molnupiravirin gelinciklerde SARS-CoV-2'ye karşı oral olarak aktif olduğunu buldu. ⓘ
DRIVE daha sonra molnupiravirin insan klinik çalışmaları için lisansını Miami merkezli Ridgeback Biotherapeutics şirketine verdi ve bu şirket daha sonra ilacı daha da geliştirmek için Merck & Co. ile ortaklık kurdu. ⓘ
Molnupiravir için ABD Gıda ve İlaç Dairesi (FDA) acil kullanım iznini destekleyen birincil veriler, şiddetli COVID-19'a ilerleme ve/veya hastaneye yatma riski yüksek olan hafif ila orta şiddette COVID-19'lu hastanede yatmayan katılımcıların tedavisi için molnupiraviri inceleyen randomize, çift kör, plasebo kontrollü bir klinik çalışma olan MOVe-OUT'tan elde edilmiştir. Katılımcılar, önceden belirlenmiş bir kronik tıbbi durumu olan veya başka nedenlerle SARS-CoV-2 enfeksiyonu riski yüksek olan ve COVID-19 aşısı olmamış 18 yaş ve üstü yetişkinlerdir. Çalışmada ölçülen ana sonuç, 29 günlük takip süresince herhangi bir nedenden dolayı hastaneye kaldırılan veya ölen kişilerin yüzdesiydi. Molnupiravir alan 709 kişinin %6,8'i bu süre içinde hastaneye kaldırılmış veya ölmüştür; plasebo alan 699 kişinin %9,7'si ise bu süre içinde ölmüştür. Molnupiravir alan kişilerden biri, plasebo alan dokuz kişiye kıyasla takip süresi boyunca ölmüştür. ⓘ
Toplum ve kültür
Ekonomi
Eylül 2021'de Merck, İlaç Patent Havuzu (MPP) ile MPP'nin molnupiravirin alt lisansını almasına ve COVID-19 oral ilacını 105 düşük ve orta gelirli ülkeye tedarik etmesine olanak tanıyan gönüllü bir lisans anlaşması imzaladı. ABD hükümeti tarafından yapılan ilk satın almanın maliyeti tedavi kürü başına yaklaşık 712 $ iken, gelişmekte olan ülkelerde jenerik ilaçlarla tedavi 20 $ gibi düşük bir maliyete mal olabiliyor. ⓘ
Yasal statü
Merck, 11 Ekim 2021 tarihinde FDA'ya bir EUA başvurusu sundu ve FDA'nın İlaç Değerlendirme ve Araştırma Merkezi'ndeki Antimikrobiyal İlaçlar Danışma Komitesi (AMDAC) 30 Kasım 2021 tarihinde EUA başvurusunu görüşmek üzere toplandı. Komite, hafif ve orta şiddette hastalığı olan ve ciddi COVID-19 gelişme riski yüksek olan yetişkinler için ruhsat verilmesini tavsiye etmek üzere az farkla (13 lehte ve 10 aleyhte) oy kullandı. Son denemede sadece %30 olan ilacın ölümü önlemedeki düşük etkinliğinin yanı sıra, ilacın neden olduğu ve teorik olarak daha tehlikeli varyantların evrimini tetikleyerek küresel pandemiyi kötüleştirebilecek artan mutasyon oranına ilişkin endişeler dile getirildi. Aralık 2021'de ABD Gıda ve İlaç Dairesi (FDA), doğrudan SARS-CoV-2 viral test sonuçları pozitif olan ve hastaneye yatış veya ölüm dahil olmak üzere şiddetli COVID-19'a ilerleme riski yüksek olan ve FDA tarafından yetkilendirilen alternatif COVID-19 tedavi seçeneklerine erişilemeyen veya klinik olarak uygun olmayan yetişkinlerde hafif ila orta şiddette koronavirüs hastalığının (COVID-19) tedavisi için molnupiravir için bir acil kullanım izni (EUA) yayınladı. ⓘ
Ekim 2021'de, Avrupa İlaç Ajansı (EMA) Beşeri Tıbbi Ürünler Komitesi (CHMP) molnupiravir için sürekli bir inceleme başlatmıştır. ⓘ
4 Kasım 2021'de molnupiravir, COVID-19'un yerleşik enfeksiyonlarının tedavisi için İlaç ve Sağlık Ürünleri Düzenleme Kurumu (MHRA) tarafından Birleşik Krallık'ta onaylanmıştır. MHRA, Birleşik Krallık'ta geçerli bir şartlı pazarlama izni ve Kuzey İrlanda için bir acil kullanım izni vermiştir. ⓘ
Kasım 2021'de Bangladeş İlaç İdaresi Genel Müdürlüğü (DGDA) molnupiravirin acil kullanımına izin vermiştir. ⓘ
Molnupiravir, Ocak 2022'de İsrail'de tıbbi kullanım için onaylanmıştır. ⓘ
İsimler
Molnupiravir uluslararası tescilli olmayan isimdir (INN). ⓘ
Jenerik versiyonları Molulife (Mankind) ve Molena (Emcure) markaları altında mevcuttur. ⓘ
Halk sağlığı endişeleri
AMDAC'ın 30 Kasım 2021 tarihli toplantısında birden fazla danışman, molnupiravirin endişe verici varyantların ortaya çıkışını hızlandırabileceği endişesini dile getirmiştir. Benzer endişeler hem toplantı öncesinde hem de sonrasında diğer bilim insanları tarafından da dile getirilmiştir. ⓘ
Araştırma
COVID-19 klinik araştırması
Ekim 2021'de, bir klinik çalışmanın (MOVe-OUT) ön sonuçları, molnupiravir ile tedavinin COVID-19'dan kaynaklanan hastaneye yatış ve ölüm riskini azaltabileceğini göstermektedir. Nihai analiz, hastaneye yatış ve ölümlerde %30'luk bir azalma olduğunu bildirmiştir. ⓘ
Hafif veya orta şiddette COVID-19 ve hastalığın ilerlemesi için en az bir risk faktörü olan aşılanmamış yetişkinlerde hastaneye yatış veya ölüme karşı etkinlik yaklaşık %30'dur (%95 CI, %1-51). ⓘ
2022 itibariyle Panoramic çalışması molnupiravirin etkinliğini test etmektedir. ⓘ

