Aseton
|
| |||
|
| |||

| |||
| İsimler | |||
|---|---|---|---|
| IUPAC adı
Aseton
| |||
| Tercih edilen IUPAC adı
Propan-2-on | |||
Diğer isimler
| |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| 3DMet | |||
Beilstein Referans
|
635680 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
1466 | ||
| KEGG | |||
| MeSH | Aseton | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 1090 | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
C3H6O | ||
| Molar kütle | 58.080 g-mol-1 | ||
| Görünüş | Renksiz sıvı | ||
| Koku | Keskin, tahriş edici, çiçeksi, salatalık benzeri | ||
| Yoğunluk | 0,7845 g/cm3 (25 °C) | ||
| Erime noktası | -94,7 °C (-138,5 °F; 178,5 K) | ||
| Kaynama noktası | 56,05 °C (132,89 °F; 329,20 K) | ||
Suda çözünürlük
|
Karışabilir | ||
| Çözünürlük | Benzen, dietil eter, metanol, kloroform, etanol ile karışabilir | ||
| log P | −0.16 | ||
| Buhar basıncı |
| ||
| Asitlik (pKa) |
| ||
Manyetik duyarlılık (χ)
|
-33,78-10-6 cm3/mol | ||
Kırılma indisi (nD)
|
1,3588 (VD = 54,46) | ||
| Viskozite | 0,295 mPa-s (25 °C) | ||
| Yapı | |||
Koordinasyon geometrisi
|
C2'de trigonal düzlemsel | ||
Moleküler şekil
|
C2'de dihedral | ||
Dipol moment
|
2.91 D | ||
| Termokimya | |||
Isı kapasitesi (C)
|
125,45 J/(mol-K) | ||
Std molar
entropi (S |
200,4 J/(mol-K) | ||
Std entalpi
oluşumu (ΔfH⦵298) |
(-250,03) - (-248,77) kJ/mol | ||
Std entalpi
yanma (ΔcH⦵298) |
-1.772 MJ/mol | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|
 
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H225, H319, H336, H373 | ||
Önlem ifadeleri
|
P210, P235, P260, P305+P351+P338 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | -20 °C (-4 °F; 253 K) | ||
Otomatik ateşleme
sıcaklık |
465 °C (869 °F; 738 K) | ||
| Patlayıcı limitleri | 2.6–12.8% | ||
Eşik sınır değeri (TLV)
|
1185 mg/m3 (TWA), 2375 mg/m3 (STEL) | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
| ||
LC50 (medyan konsantrasyon)
|
20,702 ppm (sıçan, 8 saat) | ||
LCLo (yayınlanan en düşük)
|
45,455 ppm (fare, 1 saat) | ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
1000 ppm (2400 mg/m3) | ||
REL (Önerilen)
|
TWA 250 ppm (590 mg/m3) | ||
IDLH (Acil tehlike)
|
2500 ppm | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
| ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
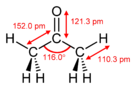
Aseton, propanon veya dimetil keton, (CH3)2CO formülüne sahip organik bir bileşiktir. En basit ve en küçük ketondur. Renksiz, oldukça uçucu ve yanıcı bir sıvı olup karakteristik keskin bir kokuya sahiptir. ⓘ
Aseton su ile karışabilir ve endüstride, evde ve laboratuvarda kendi başına önemli bir organik çözücü olarak hizmet eder. Organik kimyada yaygın bir yapı taşıdır. 2010 yılında dünya çapında yaklaşık 6,7 milyon ton üretilmiştir ve esas olarak çözücü olarak ve metil metakrilat (ve bundan PMMA) ve bisfenol A üretimi için kullanılmıştır. Asetonun evlerde bilinen kullanım alanları oje çıkarıcıda aktif bileşen ve boya incelticidir. Amerika Birleşik Devletleri'nde uçucu organik bileşik (VOC) muafiyet statüsüne sahiptir. ⓘ
Aseton, normal metabolik süreçler yoluyla insan vücudunda üretilir ve atılır. Normalde kan ve idrarda bulunur. Diyabetik ketoasidozu olan kişilerde daha fazla miktarda üretilir. Üreme toksisitesi testleri, üreme sorunlarına neden olma potansiyelinin düşük olduğunu göstermektedir. Kandaki keton cisimlerini (aseton, β-hidroksibütirik asit ve asetoasetik asit) artıran ketojenik diyetler, dirençli epilepsiden muzdarip bebeklerde ve çocuklarda epileptik ataklara karşı kullanılır. ⓘ
Su, etanol ve dietil eterle her oranda birleşir. Odunun kuru kuruya damıtılmasından, kalsiyum asetatın ısıtılmasından, teknikte izopropil alkolün bakır katalizörlerinden 250 °C'de dehidrojenlenmesinden, etanol ve su buharının 250 °C'de gaz fazında Fe2O3 katalizörlüğünde karışımından elde edilir. Aseton ile sodyum nitrozil prussiat bazik ortamda karıştırılırsa kırmızı çökelme olur, aseton saptanır. Önemli bir tepkimesi bazik ortamda iyotla verdiği iyodoform oluşumudur. Yağ, kauçuk ve diğer maddelerin çözücüsü olarak kullanılır. Ayrıca boya, izopren, kloroform, bromoform ve iyodoform gibi ürünlerin elde edilişinde öncü madde olarak kullanılır. ⓘ
Tarihçe
Aseton ilk olarak 1606 yılında Andreas Libavius tarafından Kurşun(II) asetatın damıtılmasıyla üretilmiştir. ⓘ
1832 yılında Fransız kimyager Jean-Baptiste Dumas ve Alman kimyager Justus von Liebig asetonun ampirik formülünü belirlemişlerdir. 1833'te Fransız kimyager Antoine Bussy, asetona karşılık gelen asidin (yani asetik asit) köküne -one son ekini ekleyerek asetonu adlandırdı. 1852'de İngiliz kimyager Alexander William Williamson asetonun metil asetil olduğunu fark etti; ertesi yıl Fransız kimyager Charles Frédéric Gerhardt da aynı fikirdeydi. 1865 yılında Alman kimyager August Kekulé aseton için modern yapısal formülü yayınladı. Johann Josef Loschmidt 1861 yılında asetonun yapısını sunmuştu, ancak özel olarak yayınladığı kitapçığı çok az ilgi gördü. Birinci Dünya Savaşı sırasında Chaim Weizmann asetonun endüstriyel üretimi için bir süreç geliştirdi (Weizmann Süreci). ⓘ
Üretim
2010 yılında dünya çapında aseton üretim kapasitesinin yılda 6,7 milyon ton olduğu tahmin edilmektedir. Yılda 1.56 milyon ton ile Amerika Birleşik Devletleri en yüksek üretim kapasitesine sahipken, onu Tayvan ve Çin anakarası takip etmiştir. En büyük aseton üreticisi, dünya kapasitesinin %17'sine sahip olan INEOS Phenol'dür. 2010 yılında Mitsui, Sunoco ve Shell de önemli kapasiteye (%7-8) sahipti. INEOS Phenol aynı zamanda Beveren'de (Belçika) dünyanın en büyük üretim tesisine (420.000 ton/yıl) sahiptir. Asetonun 2011 yazındaki spot fiyatı Amerika Birleşik Devletleri'nde 1100-1250 USD/ton idi. ⓘ
Mevcut yöntem
Aseton doğrudan veya dolaylı olarak propilenden üretilir. Asetonun yaklaşık %83'ü kümen prosesi yoluyla üretilir; sonuç olarak aseton üretimi fenol üretimine bağlıdır. Kümen prosesinde benzen propilen ile alkillenerek kümen üretilir ve bu da hava ile oksitlenerek fenol ve aseton üretilir:
Diğer prosesler propilenin doğrudan oksidasyonunu (Wacker-Hoechst prosesi) veya propilenin asetona oksitlenen (dehidrojenlenen) 2-propanol vermek üzere hidrasyonunu içerir. ⓘ
Eski yöntemler
Önceleri aseton, ketonik dekarboksilasyonda kalsiyum asetat gibi asetatların kuru damıtılmasıyla üretiliyordu.
- Ca(CH3COO)2 → CaO(s) + CO2(g) + (CH3)2CO (v)
O zamandan sonra, I. Dünya Savaşı sırasında, İngiliz savaş çabalarına yardımcı olmak için Chaim Weizmann (daha sonra İsrail'in ilk başkanı) tarafından geliştirilen Clostridium acetobutylicum bakterileri ile aseton-butanol-etanol fermantasyonu kullanılarak Kordit hazırlanmasında aseton üretildi. Bu aseton-bütanol-etanol fermantasyonu, daha iyi verim sağlayan yeni yöntemler bulununca terk edilmiştir. ⓘ
Kimyasal özellikler
Keto/enol tautomerizmi
Çoğu keton gibi, aseton da keto-enol tautomerizmi sergiler; burada nominal keto yapısı (CH
3)
Asetonun 2C=O'su enol izomeri ile dengededir (CH
3)C(OH)=(CH
2) (prop-1-en-2-ol). Ortam sıcaklığındaki aseton buharında, moleküllerin sadece %2,4×10-7'si enol formundadır. Yine de enol formu bazı kimyasal reaksiyonlarda kimyasal olarak önemlidir. ⓘ
Aldol kondenzasyonu
Uygun katalizörlerin varlığında, iki aseton molekülü de birleşerek diaseton alkol (CH
3)C=O(CH
2)C(OH)(CH
3)
2, dehidrasyonda mesitil oksit (CH
3)C=O(CH)=C(CH3)
2. Bu ürün, başka bir aseton molekülü ile birleşerek, başka bir su molekülü kaybıyla birlikte floron ve diğer bileşikleri verebilir. ⓘ
Polimerizasyon
Asetonun ayrıca iki tip polimer ve (muhtemelen döngüsel) oligomer oluşturması beklenebilir. Bir türde birimler, poliketal benzeri (PKA) bir zincir vermek üzere çift bağın açılmasından türetilen -O- eter köprüleri ile bağlanan aseton molekülleri olabilir [-O-C(CH
3)
2-]n. Diğer tip, her adımda bir molekül su uzaklaştırılarak tekrarlanan aldol kondenzasyonu yoluyla elde edilebilir ve bir poli(metilasetilen) (PMA) zinciri [-CH=C(CH
3)-]n. ⓘ
PKA tipi
Asetonun bir poliketale (PKA) dönüşümü, formolden paraformaldehit ve tiyoasetondan tritiyoaseton oluşumuna benzer olacaktır. 1960 yılında Kargin, Kabanov ve diğerleri bu sürecin termodinamiğinin sıvı aseton için elverişsiz olduğunu, dolayısıyla (tiyoaseton ve formolün aksine) katalizörlerle bile kendiliğinden polimerleşmesinin beklenmediğini gözlemlemişlerdir. Ancak, termodinamiğin erime noktasındaki (-96 °C) kristal katı aseton için uygun hale geldiğini gözlemlemişlerdir. Böyle bir polimeri (asetonda çözünen, oda sıcaklığında birkaç saat stabil kalan beyaz elastik bir katı), aseton buharını katalizör olarak bir miktar magnezyumla birlikte çok soğuk bir yüzey üzerine biriktirerek elde ettiklerini iddia ettiler. ⓘ
1962 yılında Wasaburo Kawai, katalizör olarak n-bütil lityum veya trietilalüminyum kullanarak -70 ila -78 °C'ye soğutulmuş sıvı asetondan benzer bir ürünün sentezini rapor etmiştir. Kızılötesi absorpsiyon spektrumunun -O- bağlarının varlığını gösterdiğini ancak C=O gruplarının olmadığını iddia etmiştir. Ancak daha sonra diğer araştırmacılar tarafından çelişkili sonuçlar elde edilmiştir. ⓘ

PMA tipi
Asetonun PMA tipi polimerleri, bir keto uç grubu dışında propinin polimerizasyon ürününe eşdeğer olacaktır. ⓘ
Biyokimya
Biyosentez
Keton cisimlerinin dekarboksilasyonu ile vücutta az miktarda aseton üretilir. Uzun süreli açlık ve yüksek yağlı düşük karbonhidratlı diyet de dahil olmak üzere belirli beslenme şekilleri, vücut dokusunda asetonun oluştuğu ketozis üretebilir. Alkolizm ve diyabet gibi belirli sağlık koşulları, kanın asitliğinde keskin ve potansiyel olarak ölümcül bir artışa yol açan kontrol edilemeyen ketozis olan ketoasidoz üretebilir. Fermantasyonun bir yan ürünü olduğu için aseton, damıtım endüstrisinin bir yan ürünüdür. ⓘ
Aseton, yutulan izopropanolün oksidasyonundan veya ketotik bireylerde asetoasetatın (bir keton cismi) kendiliğinden/enzimatik olarak parçalanmasından üretilebilir. ⓘ
Metabolizma
Bazı biyokimya ders kitapları ve güncel araştırma yayınları asetonun metabolize edilemeyeceğini belirtse de, bunun aksini gösteren kanıtlar mevcuttur. Daha sonra CYP2E1 tarafından metilglioksal yoluyla D-laktat ve pirüvata ve nihayetinde glikoz/enerjiye ya da propilen glikol yoluyla pirüvat, laktat, asetat (enerji için kullanılabilir) ve propiyonaldehide farklı bir yolla metabolize edilebilir. ⓘ
Kullanım Alanları
Endüstriyel
Aseton kullanımının büyük bir kısmını çözücü olaraktır. Diğer bir kısmı ise endüstride metil metakrilatın üretiminde kullanılan aseton siyanohidrinin üretimidir. ⓘ
Dünyadaki asetonun yaklaşık üçte biri solvent olarak kullanılmakta ve dörtte biri de metil metakrilatın öncüsü olan aseton siyanohidrin olarak tüketilmektedir. ⓘ
Çözücü
Aseton birçok plastik ve bazı sentetik elyaflar için iyi bir çözücüdür. Polyester reçineyi inceltmek, bununla kullanılan aletleri temizlemek ve sertleşmeden önce iki parçalı epoksileri ve süper yapıştırıcıyı çözmek için kullanılır. Bazı boya ve verniklerin uçucu bileşenlerinden biri olarak kullanılır. Ağır hizmet tipi bir yağ giderici olarak, boyama veya lehimleme öncesinde metalin hazırlanmasında ve lehimlemeden sonra reçine akısının giderilmesinde (kir ve elektrik kaçağının yapışmasını ve belki de korozyonu önlemek veya kozmetik nedenlerle) yararlıdır, ancak birçok elektronik bileşene (örneğin polistiren kapasitörler) saldırır, bu nedenle birçok devre kartının temizlenmesi için uygun değildir. ⓘ
Asetilen taşıyıcı
Kendisi yanıcı olmasına rağmen aseton, saf bir bileşik olarak güvenli bir şekilde basınçlandırılamayan asetilenin güvenli bir şekilde taşınması ve depolanması için bir çözücü olarak yaygın bir şekilde kullanılmaktadır. Gözenekli bir malzeme içeren kaplar önce asetonla doldurulur, ardından asetilen aseton içinde çözülür. Bir litre aseton 10 bar (1.0 MPa) basınçta yaklaşık 250 litre asetileni çözebilir. ⓘ
Aseton, kendisi yanıcı olmasına karşın, saf hâlde basınçlı olarak saklanamayan asetilenin taşınmasında çözücü olarak kullanılır. ⓘ
Kimyasal ara madde
Aseton, metil metakrilat sentezlemek için kullanılır. Asetonun aseton siyanohidrine ilk dönüşümü ile başlar:
- (CH3)2CO + HCN → (CH3)2C(OH)CN
Sonraki bir adımda nitril, esterleştirilen doymamış amide hidrolize edilir:
- (CH3)2C(OH)CN + CH3OH → CH2=C(CH3)CO2CH3 + NH3
Asetonun üçüncü büyük kullanımı (yaklaşık %20) bisfenol A sentezidir. Bisfenol A polikarbonatlar, poliüretanlar ve epoksi reçineler gibi birçok polimerin bir bileşenidir. Sentez, asetonun fenol ile yoğunlaştırılmasını içerir:
- (CH3)2CO + 2 C6H5OH → (CH3)2C(C6H4OH)2 + H2O
Metil izobütil alkol ve metil izobütil keton çözücülerinin üretiminde milyonlarca kilogram aseton tüketilmektedir. Bu ürünler, diaseton alkolü vermek için ilk aldol kondenzasyonu yoluyla ortaya çıkar.
- 2 (CH3)2CO → (CH3)2C(OH)CH2C(O)CH3
Asetilen ile yoğunlaştırma, sentetik terpenlerin ve terpenoidlerin öncüsü olan 2-metilbut-3-yn-2-ol'ü verir. ⓘ
Laboratuvar
Kromatografi
Spektroskopi teknikleri, test edilen numune saf veya çok yaygın bir karışım olduğunda kullanışlıdır. Bilinmeyen bir karışım analiz edilirken tek tek parçalarına ayrılması gerekir. Kromatografi teknikleri, karışımları bileşenlerine ayırarak her bir parçanın ayrı ayrı analiz edilmesini sağlamak için kullanılabilir. ⓘ
İnce tabaka kromatografisi (TLC) daha karmaşık kromatografi yöntemlerine hızlı bir alternatiftir. TLC, mürekkep ve boyaları tek tek bileşenlerine ayırarak analiz etmek için kullanılabilir. Her şirketin ürünü biraz farklı olduğundan ve bu farklılıklar TLC ile görülebildiğinden, bu, olay yerinde bırakılan notları veya lifleri araştırmak için kullanılabilir. TLC analizindeki tek sınırlayıcı faktör, bileşenleri analiz plakasına taşımak için kullanılan çözelti içinde bileşenlerin çözünebilir olması gerekliliğidir. Bu çözelti mobil faz olarak adlandırılır. Adli kimyager, her bir bileşenin kat ettiği mesafeye bakarak bilinmeyenleri bilinen standartlarla karşılaştırabilir. Bu mesafe, başlangıç noktasıyla karşılaştırıldığında, ekstrakte edilen her bir bileşen için alıkonma faktörü (Rf) olarak bilinir. Her bir Rf değeri bilinen bir numuneyle eşleşiyorsa, bu bilinmeyenin kimliğinin bir göstergesidir. ⓘ
Yüksek performanslı sıvı kromatografisi, bir çözelti içinde çözünmüş bir karışımdan tek tek bileşenleri çıkarmak için kullanılabilir. HPLC, gaz kromatografisi için uygun olmayan uçucu olmayan karışımlar için kullanılır. Bu, farmasötiğin bir kombinasyon ilacı olduğu ilaç analizinde yararlıdır, çünkü bileşenler farklı zamanlarda ayrılır veya elüe olur ve her bir bileşenin doğrulanmasına olanak tanır. HPLC kolonundan çıkan eluatlar daha sonra kolondan çıkarken konsantrasyonuna göre bir grafik üzerinde bir pik üreten çeşitli dedektörlere beslenir. En yaygın dedektör türü ultraviyole-görünür spektrometredir, çünkü HPLC ile test edilen en yaygın ilgi alanı olan farmasötikler UV absorbansına sahiptir. ⓘ
Gaz kromatografisi (GC) sıvı kromatografisi ile aynı işlevi görür, ancak uçucu karışımlar için kullanılır. Adli kimyada en yaygın GC cihazları dedektör olarak kütle spektrometresi kullanır. GC-MS kundaklama, zehirlenme ve patlama soruşturmalarında tam olarak ne kullanıldığını belirlemek için kullanılabilir. Teorik olarak, GC-MS cihazları konsantrasyonları femtogram (10-15) aralığında olan maddeleri tespit edebilir. Ancak pratikte, sinyal-gürültü oranları ve cihazın münferit parçalarının yaşı gibi diğer sınırlayıcı faktörler nedeniyle, GC-MS için pratik tespit sınırı pikogram (10-12) aralığındadır. GC-MS ayrıca tespit ettiği maddelerin miktarını belirleyebilir; kimyagerler bu bilgiyi maddenin bir birey üzerinde yaratacağı etkiyi belirlemek için kullanabilir. GC-MS cihazları, miktarı belirlemek için, sadece tespit etmek için ihtiyaç duyduklarından yaklaşık 1.000 kat daha fazla maddeye ihtiyaç duyar; miktar belirleme sınırı tipik olarak nanogram (10-9) aralığındadır. ⓘ
Kimyasal araştırma
Laboratuvarda aseton, SN2 reaksiyonları gibi çeşitli organik reaksiyonlarda polar, aprotik bir çözücü olarak kullanılır. Aseton çözücüsünün kullanımı Jones oksidasyonu için kritik öneme sahiptir. Su ile azeotrop oluşturmaz (azeotrop tablolarına bakınız). Düşük maliyeti ve uçuculuğu nedeniyle laboratuvar cam eşyalarının durulanması için yaygın bir çözücüdür. Sözde kurutma maddesi olarak yaygın kullanımına rağmen, toplu yer değiştirme ve seyreltme dışında etkili değildir. Aseton donmadan kuru buz ile -78 °C'ye kadar soğutulabilir; aseton/kuru buz banyoları düşük sıcaklıklarda reaksiyonları yürütmek için yaygın olarak kullanılır. Aseton ultraviyole ışık altında floresandır ve buharı sıvı akışı deneylerinde floresan izleyici olarak kullanılabilir. ⓘ
Aseton proteinleri çökeltmek için kullanılır. Protein çökeltme için alternatifler trikloroasetik asit veya etanoldür. ⓘ
Temizlik
Düşük dereceli aseton, akademik laboratuvar ortamlarında son yıkamadan önce kalıntı ve katı maddeleri gidermek için cam eşya durulama maddesi olarak da yaygın bir şekilde kullanılmaktadır. Aseton kurutulduğunda yüzeyde az miktarda kalıntı bırakır ve bu da yüzey numuneleri için zararlıdır. ⓘ
Düşük sıcaklık banyosu
Aseton ve kuru buz karışımı, bir miktar kuru buz kaldığı sürece -78 °C sıcaklığı koruyan popüler bir soğutma banyosudur. ⓘ
Histoloji
Aseton, patoloji alanında tümör evrelemesi için yağlı dokulardaki lenf düğümlerini bulmak için kullanılır (bağırsakları çevreleyen yağdaki lenf düğümlerini aramak gibi). Bu, yağın çözülmesine yardımcı olur ve düğümleri sertleştirerek onları bulmayı kolaylaştırır. ⓘ
Aseton ayrıca belirli boyaların mikroskop lamlarını boyamak için de kullanılır. ⓘ
Lewis bazı özellikleri
Aseton, I2 gibi yumuşak asitlerle ve fenol gibi sert asitlerle adükt oluşturan zayıf bir Lewis bazıdır. Aseton ayrıca iki değerli metallerle kompleksler oluşturur. ⓘ
Tıbbi
İlaç çözücüsü ve yardımcı madde
Aseton, ilaç endüstrisi tarafından bir çözücü olarak ve denatüre alkolde bir denatürant olarak kullanılır. Aseton ayrıca bazı farmasötik ilaçlarda yardımcı madde olarak da bulunur. ⓘ
Cilt yağsızlaştırma
Dermatologlar akne tedavilerinde kuru cildi kimyasal olarak soymak için alkol ile aseton kullanırlar. Günümüzde kimyasal peeling için kullanılan yaygın ajanlar salisilik asit, glikolik asit, azelaik asit, etanol içinde %30 salisilik asit ve trikloroasetik asittir (TCA). Kemofoliasyon öncesinde cilt temizlenir ve yağ alma adı verilen bir işlemle fazla yağlar alınır. Aseton, Septisol veya bu ajanların bir kombinasyonu bu işlemde yaygın olarak kullanılır. ⓘ
Antikonvülsan
Asetonun, epilepsi hayvan modellerinde, toksisite olmaksızın, milimolar konsantrasyonlarda uygulandığında antikonvülsan etkilere sahip olduğu gösterilmiştir. Çocuklarda ilaca dirençli epilepsiyi kontrol etmek için klinik olarak kullanılan yüksek yağlı düşük karbonhidratlı ketojenik diyetin beyindeki asetonu yükselterek çalıştığı varsayılmıştır. Daha yüksek enerji gereksinimleri nedeniyle, çocuklar çoğu yetişkinden daha yüksek aseton üretimine sahiptir - ve çocuk ne kadar küçükse, beklenen üretim de o kadar yüksektir. Bu da çocukların asetona maruz kalmaya karşı benzersiz bir şekilde duyarlı olmadıklarını göstermektedir. Dış maruziyetler, ketojenik diyetle ilişkili maruziyetlere kıyasla küçüktür. ⓘ
Evsel ve diğer niş kullanımlar
Aseton genellikle oje ve süper yapıştırıcı sökücüler gibi temizlik maddelerinin birincil bileşenidir. Ancak bazı plastiklere saldırır. ⓘ
Makyaj sanatçıları, peruk ve bıyıkların ağındaki deri yapışkanını çıkarmak için aseton kullanır; bu amaçla ürünü aseton banyosuna daldırır, ardından sert bir fırçayla yumuşatılmış tutkal kalıntısını çıkarır. ⓘ
Aseton genellikle ABS plastik ile basılmış 3D baskılı modellerdeki baskı eserlerinin buharla parlatılması için kullanılır. Aseton buharı banyosunda pürüzsüzleştirme adı verilen teknik, basılı parçanın az miktarda aseton içeren kapalı bir odaya yerleştirilmesini ve 10 dakika boyunca yaklaşık 80 santigrat dereceye kadar ısıtılmasını içerir. Bu, kabın içinde bir aseton buharı yaratır. Aseton parçanın her yerinde eşit olarak yoğunlaşarak yüzeyin yumuşamasına ve sıvılaşmasına neden olur. Yüzey gerilimi daha sonra yarı sıvı plastiği pürüzsüzleştirir. Parça hazneden çıkarıldığında, aseton bileşeni buharlaşır ve geriye işlenmemiş 3D baskılı parçalardaki ortak özellikler olan çizgi, desen ve görünür katman kenarlarından arınmış camsı pürüzsüz bir parça kalır. ⓘ
Aseton, cam ve metallerdeki keçeli kalem izlerini etkili bir şekilde giderir. ⓘ
Güvenlik
Yanıcılık
Asetonun en tehlikeli özelliği aşırı yanıcı olmasıdır. Aseton küçük miktarlarda donuk mavi bir alevle yanar, daha büyük miktarlarda yakıtın buharlaşması eksik yanmaya ve parlak sarı bir aleve neden olur. Asetonun parlama noktası olan -20 °C'den (-4 °F) daha yüksek sıcaklıklarda, hacimce %2,5 ila %12,8 aseton içeren hava karışımları patlayabilir veya ani bir yangına neden olabilir. Buharlar yüzeyler boyunca uzaktaki ateşleme kaynaklarına akabilir ve geri parlayabilir. Statik boşalma da aseton buharlarını tutuşturabilir, ancak asetonun çok yüksek bir tutuşma başlatma enerji noktası vardır ve bu nedenle kazara tutuşma nadirdir. Kırmızı yanan kömürün üzerine aseton dökmek veya püskürtmek bile yüksek buhar konsantrasyonu ve sıvının buharlaşmasının soğutma etkisi nedeniyle kömürü tutuşturmayacaktır. Kendiliğinden 465 °C'de (869 °F) tutuşur. Otomatik tutuşma sıcaklığı maruz kalma süresine de bağlıdır, bu nedenle bazı testlerde 525 °C olarak belirtilmiştir. Ayrıca, endüstriyel asetonun tutuşmayı engelleyen az miktarda su içermesi de muhtemeldir. ⓘ
Aseton peroksit
Aseton oksitlendiğinde, yan ürün olarak aseton peroksit oluşturur ve bu da oldukça kararsız, birincil yüksek patlayıcı bir bileşiktir. Kazara oluşabilir, örneğin atık hidrojen peroksit aseton içeren atık çözücüye döküldüğünde. Kararsızlığı nedeniyle, basit kimyasal sentezine rağmen nadiren kullanılır. ⓘ
Zehirlilik
Aseton üzerinde kapsamlı çalışmalar yapılmıştır ve normal kullanımda sadece hafif toksisite gösterdiğine inanılmaktadır. Temel önlemlere uyulduğu takdirde kronik sağlık etkileri olduğuna dair güçlü bir kanıt yoktur. Genel olarak yutulduğunda ve/veya solunduğunda düşük akut ve kronik toksisiteye sahip olduğu kabul edilmektedir. Aseton şu anda bir kanserojen, mutajenik bir kimyasal veya kronik nörotoksisite etkileri için bir endişe kaynağı olarak görülmemektedir. ⓘ
Aseton, kozmetikten işlenmiş ve işlenmemiş gıdalara kadar çeşitli tüketici ürünlerinde bir bileşen olarak bulunabilir. Aseton, içeceklerde, pişmiş gıdalarda, tatlılarda ve konservelerde 5 ila 8 mg/L arasında değişen konsantrasyonlarda bulunduğunda genel olarak güvenli kabul edilen (GRAS) bir madde olarak derecelendirilmiştir. ⓘ
Ancak aseton tahriş edicidir, hafif cilt tahrişine ve orta ila şiddetli göz tahrişine neden olur. Yüksek buhar konsantrasyonlarında, diğer birçok solvent gibi merkezi sinir sistemini baskılayabilir. Fareler için sindirim yoluyla akut toksisite (LD50) 3 g/kg ve solunum yoluyla (LC50) 4 saat boyunca 44 g/m3'tür. ⓘ
EPA Sınıflandırması
1995 yılında Amerika Birleşik Devletleri Çevre Koruma Ajansı (EPA) asetonu Acil Durum Planlaması ve Toplumun Bilme Hakkı Yasası (EPCRA) Bölüm 313 kapsamında tutulan "zehirli kimyasallar" listesinden çıkarmıştır. Bu kararı verirken EPA, asetonla ilgili mevcut toksisite verilerinin kapsamlı bir incelemesini yapmış ve asetonun "yalnızca salınımları ve sonuçta ortaya çıkan maruziyetleri büyük ölçüde aşan seviyelerde akut toksisite sergilediğini" ve ayrıca asetonun "kronik çalışmalarda düşük toksisite sergilediğini" tespit etmiştir.
- Genotoksisite. Aseton iki düzineden fazla in vitro ve in vivo deneyde test edilmiştir. Bu çalışmalar asetonun genotoksik olmadığını göstermektedir.
- Kanserojenlik. EPA 1995 yılında şu sonuca varmıştır: "Şu anda kanserojenlik endişesi olduğunu gösteren bir kanıt yoktur". (EPCRA İncelemesi, Bölüm 3.3'te açıklanmıştır). NTP bilim adamları asetonun kronik toksisite/kanserojenite testlerine karşı tavsiyede bulunmuşlardır çünkü "prekronik çalışmalar kemirgenlerde çok yüksek dozlarda sadece çok hafif bir toksik tepki göstermiştir".
- Nörotoksisite ve Gelişimsel Nörotoksisite. Hem asetonun hem de asetonun metabolik öncüsü olan izopropanolün nörotoksik potansiyeli kapsamlı bir şekilde incelenmiştir. Bu çalışmalar, yüksek dozda asetona maruz kalmanın geçici merkezi sinir sistemi etkilerine neden olabilmesine rağmen, asetonun nörotoksik bir madde olmadığını göstermektedir. İzopropanol ile kılavuz niteliğinde bir gelişimsel nörotoksisite çalışması yürütülmüş ve test edilen en yüksek dozda bile hiçbir gelişimsel nörotoksik etki tespit edilmemiştir. (SIAR, s. 1, 25, 31).
- Çevresel. EPA 1995 yılında asetonu uçucu organik bileşik (VOC) olarak düzenlemeden muaf tuttuğunda, EPA bu muafiyetin "birkaç önemli çevresel hedefe ulaşılmasına katkıda bulunacağını ve EPA'nın kirliliği önleme çabalarını destekleyeceğini" belirtmiştir. 60 Fed. Reg. 31,634 (16 Haziran 1995). 60 Fed. Reg. 31,634 (16 Haziran 1995). EPA, asetonun Temiz Hava Yasası'nın 112. bölümü kapsamında tehlikeli hava kirleticileri (HAP) olarak listelenen çeşitli bileşiklerin yerine kullanılabileceğini belirtmiştir. ⓘ
Çevresel etkiler
Aseton çevrede doğal olarak bitkilerde, ağaçlarda, volkanik gazlarda, orman yangınlarında ve vücut yağının parçalanmasının bir ürünü olarak bulunmasına rağmen, çevreye salınan asetonun büyük bir kısmı endüstriyel kaynaklıdır. Aseton sudan ve topraktan bile hızla buharlaşır. Atmosfere girdikten sonra 22 günlük bir yarılanma ömrüne sahiptir ve UV ışığı ile fotoliz yoluyla bozunur (öncelikle metan ve etana dönüşür.) Mikroorganizmalar tarafından tüketilmesi asetonun toprakta, hayvanlarda veya su yollarında dağılmasına katkıda bulunur. ⓘ
Asetonun balıklar için LD50 değeri 96 saat boyunca 8,3 g/L su (veya yaklaşık %1) olup, sudaki çevresel yarı ömrü yaklaşık 1 ila 10 gündür. Aseton, mikrobiyal tüketim nedeniyle sucul sistemlerde önemli bir oksijen azalması riski oluşturabilir. ⓘ
Dünya dışı oluşumu
30 Temmuz 2015'te bilim insanları Philae iniş aracının 67P kuyruklu yıldızının yüzeyine ilk inişinin ardından COSAC ve Ptolemy araçları tarafından yapılan ölçümlerin, dördü bir kuyruklu yıldızda ilk kez görülen asetamid, aseton, metil izosiyanat ve propiyonaldehit olmak üzere on altı organik bileşiği ortaya çıkardığını bildirdi. ⓘ