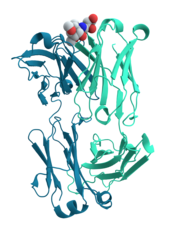
Protein

Proteinler, bir veya daha fazla uzun amino asit artık zincirini içeren büyük biyomoleküller ve makromolekül'lerdir. Proteinler organizmalar içinde, hücrelere yapı ve organizmalar sağlayarak ve molekülleri bir konumdan diğerine taşıyarak metabolik reaksiyonları katalizleme, DNA kopyalama, uyaranlara yanıt verme dahil olmak üzere çok çeşitli işlevler gerçekleştirir. Proteinler, genlerinin nükleotit dizisi tarafından dikte edilen ve genellikle faaliyetini belirleyen özel 3D yapıya protein katlanmasıyla sonuçlanan amino asit dizilimlerinde birbirlerinden farklıdır. ⓘ
Proteinler, açlık anında en son tüketilirler. Kimyasal sindirimleri midede başlar. Proteinler hayvansal proteinler ve bitkisel proteinler olarak ikiye ayrılır. Vejeteryanlar et yemezler ama sağlık için hayvansal ürünler yumurta, süt, yoğurt, peynir gibi benzer ürünleri tüketirler. ⓘ
Hayvansal protein Yoğurt, süt, yumurta, çökelek, lor peyniri, az yağlı peynir, tavuk eti, balık eti, diğer hayvan etleri gibi yiyeceklerde hayvansal protein oranı yüksektir. ⓘ
Bitkisel protein Mercimek, fasulye, bezelye, kenevir, chia, karabuğday, ıspanak gibi yiyeceklerde bitkisel protein oranı yüksektir. ⓘ
Proteinler, amino asitlerin polimerleşmesi sonucu oluşan polimerlerdir. Her proteinin kendisine has özelliklerinin olmasını sağlayan özel amino asit dizilimleri vardır. Proteinlerin işlevlerinin çoğu, kendisini oluşturan amino asitlerin özelliklerinin tayin edilmesiyle anlaşılabilir. İnsandan virüse proteinlerin oluşumunda en çok kullanılan 20 çeşit amino asit vardır. ⓘ
Bu zincirde bir amino asitin karboksil grubunun bir diğerinin amino grubuna bağlanmasıyla oluşan bağ peptit bağı olarak adlandırılır. Her proteindeki amino asit dizisinin sırası bir gen tarafından tanımlanır ve genetik kod ile kodlanmıştır. Genetik kod 22 "standart" amino asit tanımlasa da proteinlerdeki amino asitler çevrim sonrası değişimle kimyasal olarak değişikliğe uğrar. Bu değişimler ya proteinin işlev görmeye başlamasından önce gerçekleşir ya da kontrol mekanizmalarının parçası olarak, proteinin işlevini değiştirmek için olur. Proteinler belli işlevleri yerine getirmek için beraberce de çalışabilirler ve bazıları bir araya gelip kararlı kompleksler oluşturabilir. ⓘ
Polisakkaritler, nükleik asitler ve yağlar gibi biyolojik makromoleküllere benzer şekilde, proteinler de canlı organizmaların temel bileşenlerindendir ve hücrelerin içindeki her süreçte yer alırlar. Çoğu protein, biyokimyasal tepkimelerde katalizör işlevi olan enzimlerdir ve metabolizma için yaşamsal bir role sahiptir. Başka proteinlerin ise yapısal veya mekanik işlevleri vardır: örneğin hücre iskeletindeki proteinler, hücrenin şeklini koruması için bir iskele görevi yaparlar. Proteinler hücre haberleşmesi, bağışıklık yanıtı, hücre tutunması ve hücre bölünme döngüsünde yer alır. ⓘ
Protein, beslenmemizin önemli bir parçasıdır. Hayvanlar her amino asiti sentezleyemediklerinden, temel (esansiyel) aminoasitleri gıda yoluyla almak zorundadırlar. Sindirimde hayvanlar yedikleri proteini serbest amino asitlere parçalayıp bunlarla yeni proteinler sentezler. ⓘ
"Protein" sözcüğünün kaynağı, Yunanca'nın "birincil öneme sahip" anlamını taşıyan πρώτα (prota) sözcüğüdür. Bu isim, proteinleri 1838'de ilk tanımlayan Jöns Jakob Berzelius tarafından verilmiştir. 1926'da James B. Sumner'in üreaz enziminin bir protein olduğunu göstermesine kadar, proteinlerin canlılar için ne derece önemli olduğu tam anlaşılmamıştır. Yapısı çözülen ilk proteinler arasında insülin ve miyoglobin bulunur ki, insülin için Sir Frederick Sanger 1958'de, miyoglobin için de Max Perutz ve Sir John Cowdery Kendrew 1962'de Nobel Kimya Ödülü kazanmıştır. Her iki protein de kırınım analizi ile üç boyutlu yapıları çözümlenen ilk proteinlerdendir. ⓘ

Proteinler bir kez oluştuktan sonra sadece belirli bir süre var olurlar ve daha sonra protein döngüsü süreci boyunca hücre mekanizması tarafından parçalanır ve geri dönüştürülürler. Bir proteinin ömrü yarı ömrü ile ölçülür ve geniş bir aralığı kapsar. Memeli hücrelerinde ortalama 1-2 günlük ömürleri ile dakikalarca veya yıllarca var olabilirler. Anormal veya yanlış katlanmış proteinler ya yıkım için hedef alındıklarından ya da kararsız olduklarından dolayı daha hızlı bozunurlar. ⓘ
Proteinler, ultrasantrifüjleme, çökeltme, elektroforez ve kromatografi gibi çeşitli teknikler kullanılarak diğer hücresel bileşenlerden saflaştırılabilir; genetik mühendisliğinin ortaya çıkışı, saflaştırmayı kolaylaştırmak için bir dizi yöntemi mümkün kılmıştır. Protein yapısı ve işlevini incelemek için yaygın olarak kullanılan yöntemler arasında immünohistokimya, bölgeye yönelik mutajenez, X-ışını kristalografisi, nükleer manyetik rezonans ve kütle spektrometrisi bulunmaktadır. ⓘ
Tarihçe ve etimoloji
Proteinler, on sekizinci yüzyılda Antoine Fourcroy ve diğerleri tarafından biyolojik moleküllerin farklı bir sınıfı olarak kabul edilmiş ve moleküllerin ısı veya asitle muamele altında pıhtılaşma veya topaklanma kabiliyetleri ile ayırt edilmiştir. O dönemde dikkat çeken örnekler arasında yumurta akından elde edilen albümin, kan serumu albümini, fibrin ve buğday glüteni yer alıyordu. ⓘ
Proteinler ilk olarak Hollandalı kimyager Gerardus Johannes Mulder tarafından tanımlanmış ve 1838 yılında İsveçli kimyager Jöns Jacob Berzelius tarafından adlandırılmıştır. Mulder yaygın proteinlerin element analizini yapmış ve neredeyse tüm proteinlerin aynı ampirik formüle, C400H620N100O120P1S1, sahip olduğunu bulmuştur. Tek bir tür (çok büyük) molekülden oluşabilecekleri gibi hatalı bir sonuca varmıştır. Bu molekülleri tanımlamak için "protein" terimi Mulder'in iş arkadaşı Berzelius tarafından önerildi; protein Yunanca πρώτειος (proteios) kelimesinden türetilmiştir, "birincil", "önde" veya "önde duran" anlamına gelir, + -in. Mulder, 131 Da'lık (neredeyse doğru) bir molekül ağırlığı bulduğu lösin amino asidi gibi protein bozunma ürünlerini tanımlamaya devam etti. "Protein "den önce, "albüminler" veya "albüminli maddeler" (Almanca'da Eiweisskörper) gibi başka isimler de kullanılmıştır. ⓘ
Alman Carl von Voit gibi ilk beslenme bilimcileri, proteinin vücudun yapısını korumak için en önemli besin maddesi olduğuna inanıyordu, çünkü genellikle "etin et yaptığına" inanılıyordu. Karl Heinrich Ritthausen, glutamik asidin tanımlanmasıyla bilinen protein formlarını genişletmiştir. Connecticut Tarımsal Deney İstasyonu'nda Thomas Burr Osborne tarafından bitkisel proteinlerin ayrıntılı bir incelemesi derlendi. Lafayette Mendel ile birlikte çalışarak ve Liebig'in minimum yasasını laboratuvar farelerinin beslenmesinde uygulayarak, besinsel olarak gerekli amino asitler belirlendi. Çalışma William Cumming Rose tarafından devam ettirildi ve iletildi. Proteinlerin polipeptit olarak anlaşılması 1902 yılında Franz Hofmeister ve Hermann Emil Fischer'in çalışmalarıyla gerçekleşmiştir. Canlı organizmalarda enzim olarak proteinlerin merkezi rolü, James B. Sumner'ın üreaz enziminin aslında bir protein olduğunu gösterdiği 1926 yılına kadar tam olarak takdir edilmemiştir. ⓘ
Proteinleri büyük miktarlarda saflaştırmanın zorluğu, ilk protein biyokimyacıları için onları çalışmayı çok zorlaştırdı. Bu nedenle, ilk çalışmalar büyük miktarlarda saflaştırılabilen proteinlere, örneğin kan, yumurta akı, çeşitli toksinler ve mezbahalardan elde edilen sindirim/metabolik enzimlere odaklanmıştır. 1950'lerde Armour Hot Dog Co. 1 kg saf sığır pankreatik ribonükleaz A'yı saflaştırdı ve bilim insanlarına ücretsiz olarak sundu; bu jest ribonükleaz A'nın sonraki on yıllar boyunca biyokimyasal çalışmalar için önemli bir hedef haline gelmesine yardımcı oldu. ⓘ
Linus Pauling, ilk kez 1933 yılında William Astbury tarafından ortaya atılan bir fikir olan hidrojen bağına dayalı düzenli protein ikincil yapılarının başarılı bir şekilde tahmin edilmesiyle tanınır. Walter Kauzmann'ın kısmen Kaj Linderstrøm-Lang'ın önceki çalışmalarına dayanan denatürasyon üzerine daha sonraki çalışmaları, hidrofobik etkileşimlerin aracılık ettiği protein katlanması ve yapısının anlaşılmasına katkıda bulunmuştur. ⓘ
Dizilenen ilk protein, 1949 yılında Frederick Sanger tarafından insülin olmuştur. Sanger, insülinin amino asit dizisini doğru bir şekilde belirlemiş ve böylece proteinlerin dallanmış zincirler, kolloidler veya sikloller yerine amino asitlerin doğrusal polimerlerinden oluştuğunu kesin olarak göstermiştir. Bu başarısı için 1958 yılında Nobel Ödülü'nü kazandı. ⓘ

X-ışını kristalografisinin gelişmesiyle birlikte protein yapılarını dizilemek mümkün hale gelmiştir. Çözülen ilk protein yapıları 1958 yılında Max Perutz tarafından hemoglobin ve Sir John Cowdery Kendrew tarafından miyoglobindir. Bilgisayarların kullanımı ve artan hesaplama gücü de karmaşık proteinlerin dizilenmesini destekledi. Roger Kornberg 1999 yılında senkrotronlardan gelen yüksek yoğunluklu X-ışınlarını kullanarak RNA polimerazın oldukça karmaşık yapısını dizilemeyi başarmıştır. ⓘ
O zamandan beri, büyük makromoleküler düzeneklerin kriyo-elektron mikroskopisi geliştirilmiştir. Kriyo-EM, kristaller yerine dondurulmuş protein örneklerini ve x-ışınları yerine elektron demetlerini kullanır. Numuneye daha az zarar vererek bilim insanlarının daha fazla bilgi edinmesini ve daha büyük yapıları analiz etmesini sağlar. Küçük protein alanlarının hesaplamalı protein yapısı tahmini de araştırmacıların protein yapılarının atomik düzeydeki çözünürlüğüne yaklaşmalarına yardımcı olmuştur. Protein Veri Bankası'nda 2017 itibariyle 126.060'dan fazla atomik çözünürlükte protein yapısı bulunmaktadır. ⓘ
Genomlarda kodlanan protein sayısı
Bir genomda kodlanan proteinlerin sayısı kabaca genlerin sayısına karşılık gelir (ribozomal RNA'lar gibi protein RNA'larını kodlayan önemli sayıda gen olsa da). Virüsler tipik olarak birkaç ila birkaç yüz protein, arkea ve bakteriler birkaç yüz ila birkaç bin protein kodlarken, ökaryotlar tipik olarak birkaç bin ila on binlerce protein kodlar (örneklerin bir listesi için genom boyutuna bakın). ⓘ
Biyokimya

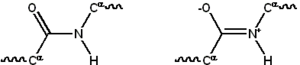
Çoğu protein, 20'ye kadar farklı L-α- amino asit serisinden oluşan doğrusal polimerlerden oluşur. Tüm proteinojenik amino asitler, bir amino grubunun, bir karboksil grubunun ve değişken bir yan zincirin bağlı olduğu bir α-karbonu içeren ortak yapısal özelliklere sahiptir. Sadece prolin, CO-NH amid kısmını sabit bir konformasyona zorlayan N-uç amin grubuna alışılmadık bir halka içerdiğinden bu temel yapıdan farklıdır. Standart amino asitler listesinde ayrıntıları verilen standart amino asitlerin yan zincirleri çok çeşitli kimyasal yapılara ve özelliklere sahiptir; bir proteinin üç boyutlu yapısını ve kimyasal reaktivitesini nihai olarak belirleyen, o proteindeki tüm amino asit yan zincirlerinin birleşik etkisidir. Bir polipeptit zincirindeki amino asitler peptit bağları ile birbirine bağlanır. Protein zincirine bağlandıktan sonra, tek bir amino asit kalıntı olarak adlandırılır ve bağlı karbon, nitrojen ve oksijen atomları serisi ana zincir veya protein omurgası olarak bilinir. ⓘ
Peptit bağı, bir miktar çift bağ karakterine katkıda bulunan ve ekseni etrafında dönmeyi engelleyen iki rezonans formuna sahiptir, böylece alfa karbonları kabaca eş düzlemlidir. Peptit bağındaki diğer iki dihedral açı, protein omurgası tarafından üstlenilen yerel şekli belirler. Serbest bir amino grubuna sahip uç N-terminali veya amino terminali olarak bilinirken, serbest bir karboksil grubuna sahip proteinin ucu C-terminali veya karboksi terminali olarak bilinir (protein dizisi N-terminalinden C-terminaline, soldan sağa doğru yazılır). ⓘ
Protein, polipeptit ve peptit kelimeleri biraz belirsizdir ve anlam olarak örtüşebilir. Protein genellikle kararlı bir konformasyondaki tam biyolojik molekülü ifade etmek için kullanılırken, peptit genellikle kararlı bir 3D yapıdan yoksun kısa amino asit oligomerleri için ayrılmıştır. Ancak ikisi arasındaki sınır iyi tanımlanmamıştır ve genellikle 20-30 kalıntıya yakındır. Polipeptit, genellikle uzunluğuna bakılmaksızın herhangi bir tek doğrusal amino asit zincirini ifade edebilir, ancak genellikle tanımlanmış bir konformasyonun yokluğunu ima eder. ⓘ

Etkileşimler
Proteinler, diğer proteinler, lipidler, karbonhidratlar ve DNA dahil olmak üzere birçok molekül türüyle etkileşime girebilir. ⓘ
Hücrelerdeki bolluk
Ortalama büyüklükteki bakterilerin hücre başına yaklaşık 2 milyon protein içerdiği tahmin edilmektedir (örneğin E. coli ve Staphylococcus aureus). Mikoplazma veya spiroket gibi daha küçük bakteriler 50.000 ila 1 milyon arasında daha az molekül içerir. Buna karşın, ökaryotik hücreler daha büyüktür ve dolayısıyla çok daha fazla protein içerir. Örneğin, maya hücrelerinin yaklaşık 50 milyon, insan hücrelerinin ise 1 ila 3 milyar protein içerdiği tahmin edilmektedir. Bireysel protein kopyalarının konsantrasyonu hücre başına birkaç molekülden 20 milyona kadar değişir. Proteinleri kodlayan tüm genler çoğu hücrede ifade edilmez ve bunların sayısı örneğin hücre tipine ve dış uyaranlara bağlıdır. Örneğin, insan genomu tarafından kodlanan 20.000 kadar proteinin sadece 6.000'i lenfoblastoid hücrelerde tespit edilmiştir. ⓘ
Sentez
Biyosentez

Proteinler, genlerde kodlanan bilgiler kullanılarak amino asitlerden bir araya getirilir. Her proteinin, bu proteini kodlayan genin nükleotid dizisi tarafından belirlenen kendine özgü bir amino asit dizisi vardır. Genetik kod, kodon adı verilen üç nükleotitlik bir settir ve her üç nükleotit kombinasyonu bir amino asidi belirtir, örneğin AUG (adenin-urasil-guanin) metiyonin için koddur. DNA dört nükleotid içerdiğinden, olası kodonların toplam sayısı 64'tür; dolayısıyla, genetik kodda bazı amino asitlerin birden fazla kodon tarafından belirtildiği bir miktar fazlalık vardır. DNA'da kodlanan genler ilk olarak RNA polimeraz gibi proteinler tarafından ön-messenger RNA'ya (mRNA) dönüştürülür. Çoğu organizma daha sonra olgun mRNA'yı oluşturmak için çeşitli Post-transkripsiyonel modifikasyon formlarını kullanarak pre-mRNA'yı (birincil transkript olarak da bilinir) işler ve bu daha sonra ribozom tarafından protein sentezi için bir şablon olarak kullanılır. Prokaryotlarda mRNA üretildiği anda kullanılabilir ya da nükleoidden uzaklaştıktan sonra bir ribozom tarafından bağlanabilir. Buna karşılık, ökaryotlar mRNA'yı hücre çekirdeğinde üretir ve daha sonra nükleer membran boyunca protein sentezinin gerçekleştiği sitoplazmaya aktarır. Protein sentez hızı prokaryotlarda ökaryotlardan daha yüksektir ve saniyede 20 amino asite kadar ulaşabilir. ⓘ
Bir mRNA şablonundan bir protein sentezleme işlemi çeviri olarak bilinir. mRNA ribozoma yüklenir ve her bir kodon, tanıdığı kodona karşılık gelen amino asidi taşıyan bir transfer RNA molekülü üzerinde bulunan baz eşleştirme antikodonuyla eşleştirilerek bir seferde üç nükleotid okunur. Aminoasil tRNA sentetaz enzimi tRNA moleküllerini doğru amino asitlerle "yükler". Büyüyen polipeptit genellikle yeni oluşan zincir olarak adlandırılır. Proteinler her zaman N-terminalinden C-terminaline doğru biyosentezlenir. ⓘ
Sentezlenen bir proteinin boyutu, içerdiği amino asitlerin sayısı ve normalde dalton birimleri (atomik kütle birimleri ile eşanlamlı) veya türev birimi kilodalton (kDa) cinsinden rapor edilen toplam moleküler kütlesi ile ölçülebilir. Bir proteinin ortalama büyüklüğü, yüksek organizmalarda proteinleri oluşturan daha fazla sayıda protein alanı nedeniyle Arke'den Bakteri'ye ve Ökaryot'a doğru artar (sırasıyla 283, 311, 438 kalıntı ve 31, 34, 49 kDa). Örneğin, maya proteinleri ortalama 466 amino asit uzunluğunda ve 53 kDa kütlesindedir. Bilinen en büyük proteinler, neredeyse 3.000 kDa moleküler kütleye ve neredeyse 27.000 amino asit toplam uzunluğa sahip kas sarkomerinin bir bileşeni olan titinlerdir. ⓘ
Kimyasal sentez
Kısa proteinler laboratuvarda kimyasal yolla da sentezlenebilir. Peptit sentezi olarak adlandırılan yöntemler, kimyasal bağlama (ligation) gibi organik sentez tekniklerine dayandırılmıştır. Kimyasal sentez yoluyla polipeptit zincirlerine doğal olmayan aminoasitlerin de dahil edilmesi mümkündür, örneğin amino asit yan zincirlerine floresan işaretler takılabilir. Bu yöntemler laboratuvar biyokimyası ve hücre biyolojisi araştırmalarında faydalıdır ama genelde ticari uygulamalarda kullanılmazlar. 300 amino asitten uzun polipeptitler için kimyasal sentez verimsizdir ve sentezlenmiş protein kendiliğinden doğadaki üç boyutlu şeklini kazanmayabilir. Çoğu kimyasal sentez yöntemi, biyolojik reaksiyonun tersi yönde, yani C-uçtan N-uca doğru ilerler. ⓘ
Yapı

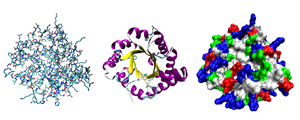
Çoğu protein benzersiz 3D yapılara katlanır. Bir proteinin doğal olarak katlandığı şekil, doğal konformasyonu olarak bilinir. Birçok protein, sadece amino asitlerinin kimyasal özellikleri sayesinde yardım almadan katlanabilse de, diğerleri doğal hallerine katlanmak için moleküler şaperonların yardımına ihtiyaç duyar. Biyokimyacılar genellikle bir proteinin yapısının dört farklı yönüne atıfta bulunurlar:
- Birincil yapı: amino asit dizisi. Bir protein bir poliamiddir.
- İkincil yapı: hidrojen bağları ile stabilize edilen düzenli olarak tekrar eden yerel yapılar. En yaygın örnekler α-sarmal, β-sheet ve dönüşlerdir. İkincil yapılar yerel olduğundan, aynı protein molekülünde farklı ikincil yapıya sahip birçok bölge bulunabilir.
- Tersiyer yapı: tek bir protein molekülünün genel şekli; ikincil yapıların birbirleriyle uzamsal ilişkisi. Üçüncül yapı genellikle yerel olmayan etkileşimlerle, en yaygın olarak hidrofobik bir çekirdek oluşumuyla, aynı zamanda tuz köprüleri, hidrojen bağları, disülfit bağları ve hatta posttranslasyonel modifikasyonlarla stabilize edilir. "Üçüncül yapı" terimi genellikle katlanma terimi ile eş anlamlı olarak kullanılır. Üçüncül yapı, proteinin temel işlevini kontrol eden şeydir.
- Kuaterner yapı: tek bir protein kompleksi olarak işlev gören ve bu bağlamda genellikle protein alt birimleri olarak adlandırılan birkaç protein molekülünün (polipeptit zincirleri) oluşturduğu yapı.
- Dörtlü yapı: kalabalık hücresel iç mekanı organize eden protein yüzeyinin imzaları. Dörtlü yapı, canlı hücrelerin içinde meydana gelen geçici ancak temel makromoleküler etkileşimlere bağlıdır. ⓘ
Proteinler tamamen katı moleküller değildir. Bu yapı seviyelerine ek olarak, proteinler işlevlerini yerine getirirken birbirleriyle ilişkili çeşitli yapılar arasında geçiş yapabilirler. Bu işlevsel yeniden düzenlemeler bağlamında, bu üçüncül veya dördüncül yapılar genellikle "konformasyonlar" olarak adlandırılır ve bunlar arasındaki geçişler konformasyonel değişiklikler olarak adlandırılır. Bu tür değişiklikler genellikle bir substrat molekülünün bir enzimin aktif bölgesine veya proteinin kimyasal katalize katılan fiziksel bölgesine bağlanmasıyla tetiklenir. Çözeltideki proteinler de termal titreşim ve diğer moleküllerle çarpışma yoluyla yapıda değişikliğe uğrar. ⓘ

Proteinler gayri resmi olarak tipik üçüncül yapılarla ilişkili üç ana sınıfa ayrılabilir: globüler proteinler, lifli proteinler ve membran proteinleri. Neredeyse tüm globüler proteinler çözünürdür ve birçoğu enzimdir. Lifli proteinler genellikle yapısaldır, örneğin bağ dokusunun ana bileşeni olan kolajen veya saç ve tırnakların protein bileşeni olan keratin gibi. Membran proteinleri genellikle reseptör görevi görür veya polar veya yüklü moleküllerin hücre zarından geçmesi için kanallar sağlar. ⓘ
Proteinler içindeki molekül içi hidrojen bağlarının, su saldırısından zayıf bir şekilde korunan ve dolayısıyla kendi dehidrasyonlarını teşvik eden özel bir durumuna dehidronlar denir. ⓘ
Protein alanları
Birçok protein birkaç protein alanından, yani bir proteinin farklı yapısal birimlere katlanan bölümlerinden oluşur. Domainler genellikle enzimatik aktiviteler (örn. kinaz) gibi belirli işlevlere sahiptir veya bağlanma modülleri olarak hizmet ederler (örn. SH3 domaini diğer proteinlerdeki prolin bakımından zengin dizilere bağlanır). ⓘ
Dizi motifi
Proteinler içindeki kısa amino asit dizileri genellikle diğer proteinler için tanıma bölgeleri olarak işlev görür. Örneğin, SH3 alanları tipik olarak kısa PxxP motiflerine bağlanır (yani, iki belirtilmemiş amino asit [x] ile ayrılmış 2 prolin [P], ancak çevreleyen amino asitler tam bağlanma özgüllüğünü belirleyebilir). Bu tür birçok motif Ökaryotik Lineer Motif (ELM) veritabanında toplanmıştır. ⓘ
Hücresel fonksiyonlar
Proteinler hücre içindeki baş aktörlerdir ve genlerde kodlanan bilgiler tarafından belirlenen görevleri yerine getirdikleri söylenir. Bazı RNA türleri haricinde, diğer biyolojik moleküllerin çoğu proteinlerin üzerinde hareket ettiği nispeten hareketsiz unsurlardır. Proteinler bir Escherichia coli hücresinin kuru ağırlığının yarısını oluştururken, DNA ve RNA gibi diğer makromoleküller sırasıyla sadece %3 ve %20'sini oluşturur. Belirli bir hücre veya hücre tipinde ifade edilen proteinler kümesi proteom olarak bilinir. ⓘ

Proteinlerin çok çeşitli işlevlere sahip olmalarını sağlayan başlıca özelliği, diğer molekülleri spesifik ve sıkı bir şekilde bağlayabilmeleridir. Proteinin başka bir molekülü bağlamaktan sorumlu bölgesi bağlanma bölgesi olarak bilinir ve genellikle moleküler yüzeyde bir çöküntü veya "cep" şeklindedir. Bu bağlanma yeteneğine, bağlanma bölgesi cebini tanımlayan proteinin üçüncül yapısı ve çevresindeki amino asitlerin yan zincirlerinin kimyasal özellikleri aracılık eder. Protein bağlanması olağanüstü sıkı ve spesifik olabilir; örneğin, ribonükleaz inhibitör proteini insan anjiyogeninine alt-femtomolar ayrışma sabiti (<10-15 M) ile bağlanır, ancak amfibi homologu onkonaza (>1 M) hiç bağlanmaz. Bir bağlanma partnerine tek bir metil grubunun eklenmesi gibi son derece küçük kimyasal değişiklikler bazen bağlanmayı neredeyse ortadan kaldırmak için yeterli olabilir; örneğin, valin amino asidine özgü aminoasil tRNA sentetaz, izolösin amino asidinin çok benzer yan zincirine karşı ayrımcılık yapar. ⓘ
Proteinler, küçük moleküllü substratların yanı sıra diğer proteinlere de bağlanabilir. Proteinler aynı molekülün diğer kopyalarına özel olarak bağlandıklarında, fibriller oluşturmak üzere oligomerleşebilirler; bu süreç genellikle sert lifler oluşturmak üzere kendi kendine birleşen küresel monomerlerden oluşan yapısal proteinlerde meydana gelir. Protein-protein etkileşimleri ayrıca enzimatik aktiviteyi düzenler, hücre döngüsü boyunca ilerlemeyi kontrol eder ve ortak bir biyolojik işlevle yakından ilişkili birçok reaksiyonu gerçekleştiren büyük protein komplekslerinin bir araya gelmesine izin verir. Proteinler ayrıca hücre membranlarına bağlanabilir ve hatta entegre olabilir. Bağlanma ortaklarının proteinlerde konformasyonel değişikliklere neden olma yeteneği, son derece karmaşık sinyal ağlarının oluşturulmasına olanak tanır. Proteinler arasındaki etkileşimler tersine çevrilebilir olduğundan ve büyük ölçüde farklı işlev kümelerini yerine getirebilen agregatlar oluşturmak için farklı ortak protein gruplarının mevcudiyetine bağlı olduğundan, belirli proteinler arasındaki etkileşimlerin incelenmesi, hücresel işlevin önemli yönlerini ve nihayetinde belirli hücre tiplerini ayırt eden özellikleri anlamak için bir anahtardır. ⓘ
Enzimler
Proteinlerin hücre içindeki en iyi bilinen rolü, kimyasal reaksiyonları katalize eden enzimlerdir. Enzimler genellikle oldukça spesifiktir ve yalnızca bir ya da birkaç kimyasal reaksiyonu hızlandırırlar. Enzimler metabolizmada yer alan reaksiyonların çoğunu gerçekleştirmenin yanı sıra DNA replikasyonu, DNA onarımı ve transkripsiyon gibi süreçlerde DNA'yı manipüle eder. Bazı enzimler, posttranslasyonel modifikasyon olarak bilinen bir süreçte kimyasal gruplar eklemek veya çıkarmak için diğer proteinler üzerinde hareket eder. Yaklaşık 4.000 reaksiyonun enzimler tarafından katalize edildiği bilinmektedir. Enzimatik katalizin sağladığı hız artışı genellikle muazzamdır - orotat dekarboksilaz örneğinde katalizlenmemiş reaksiyona göre 1017 kat hız artışı (enzim olmadan 78 milyon yıl, enzimle 18 milisaniye). ⓘ
Enzimler tarafından bağlanan ve etki edilen moleküllere substrat denir. Enzimler yüzlerce amino asitten oluşabilse de, genellikle substratla temas eden kalıntıların sadece küçük bir kısmı ve daha da küçük bir kısmı - ortalama üç ila dört kalıntı - doğrudan katalize dahil olur. Enzimin substratı bağlayan ve katalitik kalıntıları içeren bölgesi aktif bölge olarak bilinir. ⓘ
Dirigent proteinler, diğer enzimler tarafından sentezlenen bir bileşiğin stereokimyasını belirleyen bir protein sınıfının üyeleridir. ⓘ
Hücre sinyalizasyonu ve ligand bağlanması
Birçok protein hücre sinyalizasyonu ve sinyal iletimi sürecinde yer alır. İnsülin gibi bazı proteinler, sentezlendikleri hücreden uzak dokulardaki diğer hücrelere bir sinyal ileten hücre dışı proteinlerdir. Diğerleri, ana işlevi bir sinyal molekülünü bağlamak ve hücrede biyokimyasal bir yanıtı tetiklemek olan reseptörler olarak hareket eden membran proteinleridir. Birçok reseptörün hücre yüzeyinde açıkta kalan bir bağlanma bölgesi ve hücre içinde enzimatik aktiviteye sahip olabilen veya hücre içindeki diğer proteinler tarafından tespit edilen bir konformasyonel değişikliğe uğrayabilen bir efektör alanı vardır. ⓘ
Antikorlar, ana işlevi antijenleri veya vücuttaki yabancı maddeleri bağlamak ve onları yok etmek için hedef almak olan adaptif bir bağışıklık sisteminin protein bileşenleridir. Antikorlar hücre dışı ortama salgılanabilir veya plazma hücreleri olarak bilinen özelleşmiş B hücrelerinin membranlarına sabitlenebilir. Enzimlerin substratlarına bağlanma afiniteleri, reaksiyonlarını yürütme gerekliliği ile sınırlıyken, antikorların böyle bir kısıtlaması yoktur. Bir antikorun hedefine bağlanma afinitesi olağanüstü yüksektir. ⓘ
Birçok ligand taşıma proteini belirli küçük biyomolekülleri bağlar ve bunları çok hücreli bir organizmanın vücudundaki başka yerlere taşır. Bu proteinler, ligandları yüksek konsantrasyonlarda mevcut olduğunda yüksek bir bağlanma afinitesine sahip olmalı, ancak aynı zamanda hedef dokularda düşük konsantrasyonlarda mevcut olduğunda ligandı serbest bırakmalıdır. Ligand bağlayıcı bir proteinin kanonik örneği, tüm omurgalılarda akciğerlerden diğer organlara ve dokulara oksijen taşıyan ve her biyolojik alemde yakın homologları bulunan hemoglobindir. Lektinler şeker bağlayıcı proteinlerdir ve şeker parçaları için oldukça spesifiktirler. Lektinler tipik olarak hücreleri ve proteinleri içeren biyolojik tanıma olaylarında rol oynarlar. Reseptörler ve hormonlar son derece spesifik bağlayıcı proteinlerdir. ⓘ
Transmembran proteinleri, hücre zarının küçük moleküllere ve iyonlara karşı geçirgenliğini değiştiren ligand taşıma proteinleri olarak da hizmet edebilir. Membran tek başına polar veya yüklü moleküllerin difüze olamadığı hidrofobik bir çekirdeğe sahiptir. Membran proteinleri, bu tür moleküllerin hücreye girmesine ve çıkmasına izin veren iç kanallar içerir. Birçok iyon kanalı proteini yalnızca belirli bir iyonu seçecek şekilde özelleşmiştir; örneğin potasyum ve sodyum kanalları genellikle iki iyondan yalnızca biri için ayrım yapar. ⓘ
Yapısal proteinler
Yapısal proteinler, aksi takdirde akışkan olan biyolojik bileşenlere sertlik ve katılık kazandırır. Yapısal proteinlerin çoğu lifli proteinlerdir; örneğin, kolajen ve elastin kıkırdak gibi bağ dokusunun kritik bileşenleridir ve keratin saç, tırnak, tüy, toynak ve bazı hayvan kabukları gibi sert veya ipliksi yapılarda bulunur. Bazı küresel proteinler yapısal işlevler de görebilir, örneğin aktin ve tubulin küreseldir ve monomer olarak çözünür, ancak hücrenin şeklini ve boyutunu korumasını sağlayan hücre iskeletini oluşturan uzun, sert lifler oluşturmak için polimerize olur. ⓘ
Yapısal işlevlere hizmet eden diğer proteinler, mekanik kuvvetler üretebilen miyozin, kinesin ve dynein gibi motor proteinlerdir. Bu proteinler, tek hücreli organizmaların hücresel hareketliliği ve cinsel yolla üreyen birçok çok hücreli organizmanın spermi için çok önemlidir. Ayrıca kasılma kasları tarafından uygulanan kuvvetleri üretirler ve hücre içi taşımada önemli roller oynarlar. ⓘ
Protein evrimi
Moleküler biyolojideki kilit sorulardan biri proteinlerin nasıl evrimleştiğidir, yani mutasyonlar (ya da amino asit dizilimindeki değişiklikler) nasıl yeni yapı ve işlevlere yol açabilir? Bir proteindeki amino asitlerin çoğu, türler arasında çok sayıda homolog proteinden görülebileceği gibi (protein aileleri için özel veri tabanlarında toplandığı gibi, örneğin PFAM), aktivite veya işlevi bozmadan değiştirilebilir. Mutasyonların dramatik sonuçlarını önlemek için, bir gen serbestçe mutasyona uğramadan önce çoğaltılabilir. Ancak bu da gen işlevinin tamamen kaybolmasına ve dolayısıyla sahte genlere yol açabilir. Daha yaygın olarak, tek amino asit değişiklikleri sınırlı sonuçlara sahiptir, ancak bazıları özellikle enzimlerde protein işlevini önemli ölçüde değiştirebilir. Örneğin, birçok enzim substrat özgüllüğünü bir veya birkaç mutasyonla değiştirebilir. Substrat özgüllüğündeki değişiklikler, substrat karışıklığı, yani birçok enzimin birden fazla substratı bağlama ve işleme yeteneği ile kolaylaştırılır. Mutasyonlar meydana geldiğinde, bir enzimin özgüllüğü ve dolayısıyla enzimatik aktivitesi artabilir (veya azalabilir). Böylece bakteriler (veya diğer organizmalar) plastik gibi doğal olmayan substratlar da dahil olmak üzere farklı gıda kaynaklarına uyum sağlayabilir. ⓘ
Çalışma yöntemleri
Biyolojik moleküller arasında en fazla çalışılmış olanlardan olan proteinlerin etkinlikleri ve yapıları hem in vitro hem de in vivo olarak çalışılır. Saflaştırılmış proteinlerin kontrollü ortamlarda incelendiği in vitro çalışmalar bir proteinin nasıl işlev gördüğünü öğrenmeye yarar. Örneğin enzim kinetiği çalışmaları bir enzimin katalitik etkinliğinin kimyasal mekanizmasını ve olası substrat moleküllerine olan afinitesinin araştırılmasına yarar. Buna karşın, proteinlerin hücre içinde hatta bütün bür organizmadaki etkinlikleriyle ilgili in vivo deneyler bir proteinin nerede işlev gördüğü ve nasıl düzenlendiği hakkında tamamlayıcı bilgiler verir. ⓘ
Protein saflaştırma
İn vitro analiz yapmak için bir proteinin diğer hücresel bileşenlerden arındırılması gerekir. Bu süreç genellikle bir hücrenin zarının parçalandığı ve iç içeriğinin ham lizat olarak bilinen bir çözeltiye salındığı hücre parçalanması ile başlar. Elde edilen karışım, çeşitli hücresel bileşenleri çözünür proteinler; membran lipidleri ve proteinleri; hücresel organeller ve nükleik asitler içeren fraksiyonlara ayıran ultrasantrifüj kullanılarak saflaştırılabilir. Tuzlama olarak bilinen bir yöntemle çökeltme, proteinleri bu lizattan konsantre edebilir. Daha sonra moleküler ağırlık, net yük ve bağlanma afinitesi gibi özelliklere dayalı olarak ilgilenilen protein veya proteinleri izole etmek için çeşitli kromatografi türleri kullanılır. Saflaştırma seviyesi, istenen proteinin moleküler ağırlığı ve izoelektrik noktası biliniyorsa çeşitli jel elektroforezi türleri kullanılarak, protein ayırt edilebilir spektroskopik özelliklere sahipse spektroskopi ile veya protein enzimatik aktiviteye sahipse enzim deneyleri ile izlenebilir. Ek olarak, proteinler elektrofokuslama kullanılarak yüklerine göre izole edilebilir. ⓘ
Doğal proteinlerde, laboratuvar uygulamaları için yeterince saf protein elde etmek için bir dizi saflaştırma adımı gerekli olabilir. Bu süreci basitleştirmek için, genetik mühendisliği genellikle proteinlere yapılarını veya aktivitelerini etkilemeden saflaştırılmalarını kolaylaştıran kimyasal özellikler eklemek için kullanılır. Burada, belirli bir amino asit dizisinden oluşan bir "etiket", genellikle bir dizi histidin kalıntısı ("His etiketi"), proteinin bir ucuna eklenir. Sonuç olarak, lizat nikel içeren bir kromatografi kolonu üzerinden geçirildiğinde, histidin kalıntıları nikele bağlanır ve lizatın etiketlenmemiş bileşenleri engellenmeden geçerken kolona bağlanır. Araştırmacıların karmaşık karışımlardan belirli proteinleri saflaştırmasına yardımcı olmak için bir dizi farklı etiket geliştirilmiştir. ⓘ
Hücresel lokalizasyon
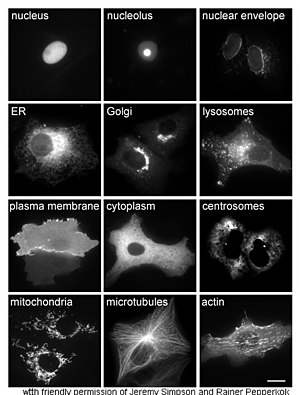
Proteinlerin in vivo olarak incelenmesi genellikle proteinin hücre içindeki sentezi ve lokalizasyonu ile ilgilidir. Birçok hücre içi protein sitoplazmada ve membrana bağlı veya salgılanan proteinler endoplazmik retikulumda sentezlenmesine rağmen, proteinlerin belirli organellere veya hücresel yapılara nasıl hedeflendiğinin özellikleri genellikle belirsizdir. Hücresel lokalizasyonu değerlendirmek için yararlı bir teknik, bir hücrede yeşil floresan protein (GFP) gibi bir "raportör" ile bağlantılı doğal proteinden oluşan bir füzyon proteini veya kimerayı ifade etmek için genetik mühendisliğini kullanır. Kaynaşmış proteinin hücre içindeki konumu, yandaki şekilde gösterildiği gibi mikroskopi kullanılarak temiz ve verimli bir şekilde görselleştirilebilir. ⓘ
Proteinlerin hücresel konumunu aydınlatmaya yönelik diğer yöntemler ER, Golgi, lizozomlar veya vakuoller, mitokondri, kloroplastlar, plazma zarı gibi bölgeler için bilinen bölme işaretleyicilerinin kullanılmasını gerektirir. Bu işaretleyicilerin floresan etiketli versiyonlarının veya bilinen işaretleyicilere karşı antikorların kullanılmasıyla, ilgilenilen bir proteinin lokalizasyonunu belirlemek çok daha basit hale gelir. Örneğin, dolaylı immünofloresan, floresan kolokalizasyonuna ve konumun gösterilmesine izin verecektir. Floresan boyalar benzer bir amaçla hücresel bölmeleri etiketlemek için kullanılır. ⓘ
Başka olasılıklar da mevcuttur. Örneğin, immünohistokimya genellikle ilgilenilen bir veya daha fazla proteine karşı enzimlere konjuge edilmiş bir antikor kullanır ve bu da örnekler arasında karşılaştırılabilen lüminesan veya kromojenik sinyaller vererek lokalizasyon bilgisine olanak sağlar. Uygulanabilir bir diğer teknik de izopiknik santrifüjleme kullanılarak sükroz (veya başka bir materyal) gradyanlarında kofraksiyonasyondur. Bu teknik, yoğunluğu bilinen bir bölmenin ve ilgilenilen proteinin kolokalizasyonunu kanıtlamasa da, olasılığı artırır ve büyük ölçekli çalışmalara daha uygundur. ⓘ
Son olarak, hücresel lokalizasyonun altın standart yöntemi immünoelektron mikroskopisidir. Bu teknikte de klasik elektron mikroskopi teknikleriyle birlikte ilgilenilen proteine karşı bir antikor kullanılır. Numune normal elektron mikroskobik inceleme için hazırlanır ve daha sonra, genellikle altın olmak üzere son derece elektro-yoğun bir malzemeye konjuge edilmiş olan ilgili proteine karşı bir antikor ile muamele edilir. Bu, hem ultrastrüktürel detayların hem de ilgili proteinin lokalizasyonuna olanak tanır. ⓘ
Araştırmacılar, bölgeye yönelik mutajenez olarak bilinen bir başka genetik mühendisliği uygulaması aracılığıyla protein dizisini ve dolayısıyla yapısını, hücresel lokalizasyonunu ve düzenlemeye yatkınlığını değiştirebilirler. Bu teknik, değiştirilmiş tRNA'lar kullanılarak doğal olmayan amino asitlerin proteinlere dahil edilmesine bile izin verir ve yeni özelliklere sahip yeni proteinlerin rasyonel tasarımına izin verebilir. ⓘ
Proteomiks
Bir hücre veya hücre tipinde bir anda mevcut olan proteinlerin toplamı proteom olarak bilinir ve bu tür büyük ölçekli veri setlerinin incelenmesi, ilgili genomik alanına benzetilerek adlandırılan proteomik alanını tanımlar. Proteomikteki temel deneysel teknikler arasında birçok proteinin ayrılmasını sağlayan 2D elektroforez, proteinlerin hızlı bir şekilde yüksek verimle tanımlanmasını ve peptitlerin sıralanmasını sağlayan kütle spektrometrisi (çoğunlukla jel içi sindirimden sonra), bir hücrede bulunan çeşitli proteinlerin göreceli seviyelerinin tespit edilmesini sağlayan protein mikro dizileri ve protein-protein etkileşimlerinin sistematik olarak araştırılmasını sağlayan iki hibrit tarama yer almaktadır. Biyolojik olarak mümkün olan bu tür etkileşimlerin toplamı interaktom olarak bilinir. Mümkün olan her kıvrımı temsil eden proteinlerin yapılarını belirlemeye yönelik sistematik bir girişim yapısal genomik olarak bilinir. ⓘ
Yapı belirleme
Bir proteinin üçüncül yapısının veya komplekslerinin dördüncül yapısının keşfedilmesi, proteinin işlevini nasıl yerine getirdiği ve nasıl etkilenebileceği hakkında, yani ilaç tasarımında önemli ipuçları sağlayabilir. Proteinler ışık mikroskobu altında görülemeyecek kadar küçük olduklarından, yapılarını belirlemek için başka yöntemlerin kullanılması gerekir. Yaygın deneysel yöntemler arasında, her ikisi de atomik çözünürlükte yapısal bilgi üretebilen X-ışını kristalografisi ve NMR spektroskopisi bulunmaktadır. Bununla birlikte, NMR deneyleri, atom çiftleri arasındaki mesafelerin bir alt kümesinin tahmin edilebileceği bilgileri sağlayabilir ve bir protein için nihai olası konformasyonlar, bir mesafe geometrisi probleminin çözülmesiyle belirlenir. Çift polarizasyon interferometrisi, genel protein konformasyonunu ve etkileşimler veya diğer uyaranlardan kaynaklanan konformasyonel değişiklikleri ölçmek için nicel bir analitik yöntemdir. Dairesel dikroizm, proteinlerin iç β-sheet / α-helikal bileşimini belirlemek için kullanılan bir başka laboratuvar tekniğidir. Kriyoelektron mikroskopisi, birleştirilmiş virüsler de dahil olmak üzere çok büyük protein kompleksleri hakkında daha düşük çözünürlüklü yapısal bilgi üretmek için kullanılır; elektron kristalografisi olarak bilinen bir varyant, bazı durumlarda, özellikle membran proteinlerinin iki boyutlu kristalleri için yüksek çözünürlüklü bilgi de üretebilir. Çözülen yapılar genellikle, binlerce protein hakkında yapısal verilerin proteindeki her bir atom için Kartezyen koordinatlar şeklinde elde edilebildiği, ücretsiz olarak erişilebilen bir kaynak olan Protein Veri Bankası'na (PDB) kaydedilir. ⓘ
Protein yapılarından çok daha fazla gen dizisi bilinmektedir. Ayrıca, çözülen yapılar kümesi, başlıca yapı belirleme yöntemlerinden biri olan X-ışını kristalografisinde gerekli koşullara kolayca tabi tutulabilen proteinlere doğru eğilimlidir. Özellikle, globüler proteinlerin X-ışını kristalografisine hazırlanırken kristalize edilmesi nispeten daha kolaydır. Membran proteinleri ve büyük protein komplekslerinin ise kristalize edilmesi zordur ve PDB'de yeterince temsil edilmezler. Yapısal genomik girişimleri, ana kıvrım sınıflarının temsili yapılarını sistematik olarak çözerek bu eksiklikleri gidermeye çalışmıştır. Protein yapısı tahmin yöntemleri, yapıları deneysel olarak belirlenmemiş proteinler için makul bir yapı oluşturma aracı sağlamaya çalışır. ⓘ
Yapı tahmini

Yapısal genomik alanının tamamlayıcısı olan protein yapı tahmini, yapıları laboratuvar gözlemiyle tespit etmek yerine, moleküler oluşumları teoride hesaplamalı olarak tahmin etmek için proteinlerin verimli matematiksel modellerini geliştirir. Homoloji modellemesi olarak bilinen en başarılı yapı tahmini türü, modellenen proteinle sekans benzerliği olan bir "şablon" yapının varlığına dayanır; yapısal genomiğin amacı, geriye kalanların çoğunu modellemek için çözülmüş yapılarda yeterli temsil sağlamaktır. Sadece uzaktan ilişkili şablon yapılar mevcut olduğunda doğru modeller üretmek bir zorluk olmaya devam etse de, "mükemmel" bir dizi hizalaması biliniyorsa oldukça doğru modeller üretilebileceğinden, dizi hizalamasının bu süreçte darboğaz olduğu öne sürülmüştür. Birçok yapı tahmin yöntemi, yeni protein kıvrımlarının tasarlandığı gelişmekte olan protein mühendisliği alanını bilgilendirmeye hizmet etmiştir. Ayrıca proteinler (ökaryotlarda ~% 33) büyük yapılandırılmamış ancak biyolojik olarak işlevsel segmentler içerir ve içsel olarak düzensiz proteinler olarak sınıflandırılabilir. Bu nedenle protein düzensizliğini tahmin etmek ve analiz etmek, protein yapısı karakterizasyonunun önemli bir parçasıdır. ⓘ
Biyoinformatik
Proteinlerin yapısını, işlevini ve evrimini analiz etmek için çok çeşitli hesaplama yöntemleri geliştirilmiştir. Bu tür araçların geliştirilmesi, insan genomu da dahil olmak üzere çeşitli organizmalar için mevcut olan büyük miktarda genomik ve proteomik veri tarafından yönlendirilmiştir. Tüm proteinleri deneysel olarak incelemek imkansızdır, bu nedenle sadece birkaçı laboratuvar deneylerine tabi tutulurken, benzer proteinlere ekstrapolasyon yapmak için hesaplama araçları kullanılır. Bu tür homolog proteinler, uzak akraba organizmalarda dizi hizalamasıyla verimli bir şekilde tanımlanabilir. Genom ve gen dizileri, belirli özellikler için çeşitli araçlar tarafından aranabilir. Dizi profilleme araçları, kısıtlama enzim bölgelerini, nükleotid dizilerindeki açık okuma çerçevelerini bulabilir ve ikincil yapıları tahmin edebilir. ClustalW gibi özel yazılımlar kullanılarak modern organizmaların ve ifade ettikleri genlerin atalarına ilişkin filogenetik ağaçlar oluşturulabilir ve evrimsel hipotezler geliştirilebilir. Biyoinformatik alanı artık genlerin ve proteinlerin analizi için vazgeçilmezdir. ⓘ
Dinamik süreçlerin in silico simülasyonu
Daha karmaşık bir hesaplama problemi, moleküler yerleştirme, protein katlama, protein-protein etkileşimi ve kimyasal reaktivite gibi moleküller arası etkileşimlerin tahminidir. Bu dinamik süreçleri simüle etmek için matematiksel modeller moleküler mekaniği, özellikle de moleküler dinamiği içerir. Bu bağlamda, in silico simülasyonlar, villin başlığı, HIV aksesuar proteini gibi küçük α-helikal protein alanlarının katlanmasını keşfetmiş ve standart moleküler dinamikleri kuantum mekanik matematiği ile birleştiren hibrit yöntemler rodopsinlerin elektronik durumlarını araştırmıştır. ⓘ
Klasik moleküler dinamiğin ötesinde, kuantum dinamiği yöntemleri, kuantum mekanik etkilerinin doğru bir tanımıyla proteinlerin atomistik detayda simülasyonuna izin verir. Örnekler arasında, sırasıyla bitki kriptokromlarına ve bakteri ışık hasat komplekslerine uygulanan çok katmanlı çok konfigürasyonlu zamana bağlı Hartree (MCTDH) yöntemi ve hiyerarşik hareket denklemleri (HEOM) yaklaşımı yer almaktadır. Biyolojik ölçekli sistemlerin hem kuantum hem de klasik mekanik simülasyonları hesaplama açısından son derece zahmetlidir, bu nedenle dağıtık hesaplama girişimleri (örneğin, Folding@home projesi) GPU paralel işleme ve Monte Carlo tekniklerindeki gelişmelerden yararlanarak moleküler modellemeyi kolaylaştırmaktadır. ⓘ
Kimyasal analiz
Organik maddenin toplam azot içeriği esas olarak proteinlerdeki amino gruplarından oluşur. Toplam Kjeldahl Azotu (TKN), genel olarak (atık) su, toprak, gıda, yem ve organik madde analizlerinde yaygın olarak kullanılan bir azot ölçüsüdür. Adından da anlaşılacağı gibi, Kjeldahl yöntemi uygulanır. Daha hassas yöntemler de mevcuttur. ⓘ
Beslenme
Çoğu mikroorganizma ve bitki standart amino asitlerin 20'sini de sentezleyebilmesine karşın hayvanlar bazı amino asitleri diyetlerinden elde etmek zorundadırlar. Bazı amino asitlerin sentezlendiği biyosentetik yollarda yer alan anahtar enzimler, örneğin aspartattan başlayarak lizin, metionin ve treonin sentezinin ilk adımını katalizleyen aspartokinaz, hayvanlarda yoktur. Bir organizmanın sentezleyemediği amino asitler esansiyel amino asitler olarak bilinir (bu terim sıkça insanlar için gerekli olanları kastetmek için kullanılır). Eğer bir amino asit ortamda mevcutsa çoğu canlı enerji tasarufu için biyosentetik yolu durdurarak amino asiti ortamdan içine alır. Laboratuvarda bakteriler çoğu zaman belli amino asitleri sentezlemek için gereken genlerden yoksun bırakılarak seçilebilir bir işaret (selectable marker) yaratılır. Bu yolla hücre içine yabancı DNA sokmanın (transfeksiyon) başarısı belirlenebilir. ⓘ
Hayvanlarda amino asitler protein içeren besinlerin tüketilmesi yoluyla elde edilir. Yenen proteinler sindirim yoluyla parçalanırlar, bu süreç zarfında protein önce mide asitlerinin etkisiyle doğal yapısı bozulur (denatüre olur) ve ardından proteaz olarak adlandırılan enzimler tarafından yıkıma uğrar. Esansiyel amino asitlerin vücuda alınması canlının sağlığı için çok önemlidir çünkü bu amino asitleri içeren proteinlerin sentezi onların düşük konsantrasyonda olmaları halinde ketlenir (inhibe olur). Amino asitler önemli bir azot kaynağıdır. Vücuda alınan bazı amino asitler, özellikle esansiyel olmayanlar, protein sentezi için doğrudan kullanılmazlar. Onun yerine glukoneogenez yoluyla karbonhidratlara dönüşürler. Glukoneogenez açlık durumunda vücudun kendi proteinlerinden, özelikle kas proteinlerinden, glikoz elde edilmesinde de kullanılır. Protein için gerekli amino asitler; peynir, süt, et gibi hayvansal gıdalardan alınabileceği gibi mercimek, baklagiller, buğday gluteni, tam tahıl, tohumlar (ör: susam/tahin) ve tofu gibi bitkisel besinlerden yeterli miktarda alınabilir. ⓘ
Köpek ve kedi gibi hayvanlarda protein, kıl folikülü büyümesini ve keratinizasyonu teşvik ederek ve böylece kötü koku üreten cilt problemleri olasılığını azaltarak cildin sağlığını ve kalitesini korur. Düşük kaliteli proteinler aynı zamanda gastrointestinal sağlık açısından da rol oynar ve köpeklerde gaz ve kokulu bileşiklerin oluşma potansiyelini artırır, çünkü proteinler sindirilmemiş halde kolona ulaştığında fermente olarak hidrojen sülfür gazı, indol ve skatol üretir. Köpekler ve kediler hayvansal proteinleri bitkilerden elde edilenlerden daha iyi sindirir, ancak deri, tüy ve bağ dokusu da dahil olmak üzere düşük kaliteli hayvansal kaynaklı ürünler zayıf bir şekilde sindirilir. ⓘ