Oksit

Oksit (/ˈɒksaɪd/), kimyasal formülünde en az bir oksijen atomu ve bir başka element içeren kimyasal bir bileşiktir. "Oksit "in kendisi oksijenin bir dianyonu, bir O2- (moleküler) iyonudur. Bu nedenle metal oksitler tipik olarak -2 oksidasyon durumunda bir oksijen anyonu içerir. Yerkabuğunun çoğu, elementlerin havadaki veya sudaki oksijen tarafından oksitlenmesinin sonucu olan katı oksitlerden oluşur. Saf elementler olarak kabul edilen malzemeler bile genellikle bir oksit kaplama geliştirir. Örneğin, alüminyum folyo, folyoyu daha fazla korozyondan koruyan ince bir Al2O3 (pasivasyon tabakası olarak adlandırılır) kabuğu geliştirir. Bazı elementler, oksijenle birleşen element miktarlarına göre farklılık gösteren çoklu oksitler oluşturabilir. Örnek olarak karbon, demir, azot (bkz. azot oksit), silikon, titanyum, lityum ve alüminyum verilebilir. Bu gibi durumlarda oksitler, karbon monoksit ve karbon dioksitte olduğu gibi ilgili atom sayıları belirtilerek veya demir (II) oksit ve demir (III) oksitte olduğu gibi elementin oksidasyon numarası belirtilerek ayırt edilir. ⓘ
Lavoisier'in geliştirdiği kimyasal adlandırma kurallarına göre oksijenle birleşen elementin adından sonra oksit ifadesi eklenir. ⓘ
Oluşum
Elektronegatifliği nedeniyle oksijen, ilgili oksitleri vermek için neredeyse tüm elementlerle kararlı kimyasal bağlar oluşturur. Asil metaller (altın veya platin gibi) oksijenle doğrudan kimyasal birleşime direnç gösterdikleri için değerlidir ve altın (III) oksit gibi maddeler dolaylı yollardan üretilmelidir. ⓘ
Elementlerin korozyonu için iki bağımsız yol hidroliz ve oksijenle oksidasyondur. Su ve oksijen kombinasyonu daha da aşındırıcıdır. Neredeyse tüm elementler oksijen atmosferinde veya oksijen açısından zengin bir ortamda yanar. Su ve oksijenin (ya da sadece havanın) varlığında, sodyum gibi bazı elementler hidroksitleri vermek üzere hızla reaksiyona girer. Kısmen bu nedenle alkali ve toprak alkali metaller doğada metalik, yani doğal halleriyle bulunmazlar. Sezyum oksijenle o kadar reaktiftir ki vakum tüplerinde alıcı olarak kullanılır ve NaK olarak adlandırılan potasyum ve sodyum çözeltileri bazı organik çözücülerin oksijenini gidermek ve dehidrasyonunu sağlamak için kullanılır. Çoğu metalin yüzeyi, hava varlığında oksit ve hidroksitlerden oluşur. İyi bilinen bir örnek, metali pasifleştiren ve daha fazla korozyonu yavaşlatan ince bir alüminyum oksit filmi ile kaplanmış olan alüminyum folyodur. Alüminyum oksit tabakası elektrolitik anotlama işlemi ile daha kalın hale getirilebilir. Katı magnezyum ve alüminyum STP'de oksijenle yavaş reaksiyona girse de, çoğu metal gibi havada yanarak çok yüksek sıcaklıklar oluşturur. Çoğu metalin ince taneli tozları havada tehlikeli bir şekilde patlayıcı olabilir. Sonuç olarak, genellikle katı yakıtlı roketlerde kullanılırlar. ⓘ

Kuru oksijende demir kolayca demir(II) oksit oluşturur, ancak esas olarak pası oluşturan hidratlı ferrik oksitlerin, Fe2O3-x(OH)2x, oluşumu tipik olarak oksijen ve su gerektirir. Yaklaşık 3,5 milyar yıl önce fotosentetik bakteriler tarafından serbest oksijen üretimi, ekonomik açıdan önemli demir cevheri hematitte Fe2O3 olarak demiri okyanuslardaki çözeltiden çökeltmiştir. ⓘ
Yapı
Oksitler, tek tek moleküllerden polimerik ve kristal yapılara kadar bir dizi farklı yapıya sahiptir. Standart koşullarda oksitler katılardan gazlara kadar değişebilir. ⓘ
Metallerin oksitleri
Çoğu metalin oksitleri seramik yapıları benimser. M-O bağları tipik olarak güçlü olduğundan, asitler ve bazlar tarafından saldırıya uğrayabilmelerine rağmen katılar çözücülerde çözünmez olma eğilimindedir. Birçoğu stokiyometrik olmayan bileşikler olan formüller genellikle aldatıcı derecede basittir. ⓘ
Moleküler oksitler
- Bazı önemli gaz oksitler
Karbondioksit fosil yakıtların yanmasının ana ürünüdür.
Azot oksit ("gülme gazı") toprak bakterileri tarafından üretilen güçlü bir sera gazıdır. ⓘ
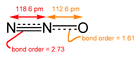
Metal oksitlerin çoğu kristal katılar olmasına rağmen, bazı oksitler moleküldür. Moleküler oksitlere örnek olarak karbon dioksit ve karbon monoksit verilebilir. Tüm basit azot oksitleri molekülerdir, örneğin NO, N2O, NO2 ve N2O4. Fosfor pentoksit aldatıcı bir isme sahip daha karmaşık bir moleküler oksittir, gerçek formülü P4O10'dur. Tetroksitler nadirdir, daha yaygın birkaç örnek rutenyum tetroksit, osmiyum tetroksit ve ksenon tetroksittir. ⓘ
Polifosfatlar ve polioksometalatlar gibi birçok oksiyanyon bilinmektedir. Oksikasyonlar daha nadirdir, bazı örnekler nitrosonyum (NO+), vanadil (VO2+) ve uranildir (UO2+
2). Elbette hem oksitler hem de diğer gruplarla birçok bileşik bilinmektedir. Organik kimyada bunlar ketonları ve ilgili birçok karbonil bileşiğini içerir. Geçiş metalleri için, oksihalidlerin yanı sıra birçok okso kompleksi de bilinmektedir. ⓘ
İndirgeme
Bir metal oksidin metale dönüştürülmesine indirgeme denir. İndirgeme birçok reaktif tarafından indüklenebilir. Birçok metal oksit sadece ısıtılarak metale dönüşür. ⓘ
Karbon ile indirgeme
Metaller oksitlerinden kimyasal indirgeme yoluyla, yani kimyasal bir reaktifin eklenmesiyle "kazanılır". Yaygın ve ucuz bir indirgeyici madde kok kömürü formundaki karbondur. Bunun en belirgin örneği demir cevherinin eritilmesidir. Birçok reaksiyon söz konusudur, ancak basitleştirilmiş denklem genellikle şu şekilde gösterilir:
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2 ⓘ
Metal oksitler organik bileşikler tarafından indirgenebilir. Bu redoks süreci, ilaçların P450 enzimleri tarafından detoksifikasyonu ve antifrize dönüştürülen etilen oksit üretimi gibi kimyadaki birçok önemli dönüşümün temelini oluşturur. Bu tür sistemlerde, metal merkezi organik bileşiğe bir oksit ligandı aktarır ve ardından metal oksidin genellikle havadaki oksijen tarafından rejenerasyonu sağlanır. ⓘ
Isıtma yoluyla indirgeme
Reaktivite serisinde daha düşük olan metaller sadece ısıtılarak indirgenebilir. Örneğin, gümüş oksit 200 °C'de ayrışır:
- 2 Ag2O → 4 Ag + O2 ⓘ
Yer değiştirme ile azaltma
Daha reaktif olan metaller, daha az reaktif olan metallerin oksitlerinin yerini alır. Örneğin, çinko bakırdan daha reaktiftir, bu nedenle çinko oksit oluşturmak için bakır (II) oksit ile yer değiştirir:
- Zn + CuO → ZnO + Cu ⓘ
Hidrojen ile indirgeme
Metallerin yanı sıra hidrojen de metal oksitlerin yerini alarak su (hidrojen oksit) oluşturabilir:
- H2 + CuO → Cu + H2O ⓘ
Elektroliz ile indirgeme
Reaktif olan metaller kararlı oksitler oluşturduğundan, bazı metal oksitlerin indirgenmesi için elektroliz edilmesi gerekir. Buna sodyum oksit, potasyum oksit, kalsiyum oksit, magnezyum oksit ve alüminyum oksit dahildir. Grafit elektrotları içine daldırmadan önce oksitlerin erimiş olması gerekir:
- 2Al2O3 → 4Al + 3O2 ⓘ
Hidroliz ve çözünme
Oksitler tipik olarak asitlerle veya bazlarla, bazen de her ikisiyle birden reaksiyona girer. Sadece asitlerle reaksiyona girenler bazik oksitler olarak etiketlenir. Sadece bazlarla reaksiyona girenlere "asidik oksitler" denir. Her ikisiyle de reaksiyona giren oksitler amfoteriktir. Metaller bazik oksitler oluşturma eğilimindedir, metal olmayanlar asidik oksitler oluşturma eğilimindedir ve amfoterik oksitler metaller ve metal olmayanlar (metaloidler) arasındaki sınıra yakın elementler tarafından oluşturulur. Bu reaktivite, hidrometalurji adı verilen süreçte bazı metallerin cevherlerinden çıkarılması gibi birçok pratik işlemin temelini oluşturur. ⓘ
Daha elektropozitif elementlerin oksitleri bazik olma eğilimindedir. Bunlara bazik anhidritler denir. Suya maruz kaldıklarında bazik hidroksitler oluşturabilirler. Örneğin, sodyum oksit baziktir - hidratlandığında sodyum hidroksit oluşturur. Daha elektronegatif elementlerin oksitleri asidik olma eğilimindedir. Bunlara "asit anhidritler" denir; su eklendiğinde oksoasitler oluştururlar. Örneğin, diklorin heptoksit bir asit anhidrittir; perklorik asit ise tamamen hidratlanmış formudur. Bazı oksitler hem asit hem de baz olarak hareket edebilir. Bunlar amfoteriktir. Buna bir örnek alüminyum oksittir. Bazı oksitler asit ya da baz olarak davranış göstermezler. ⓘ
Oksit iyonu O2- formülüne sahiptir. Hidroksit iyonu OH-'nin eşlenik bazıdır ve kalsiyum oksit gibi iyonik katılarda görülür. O2- sulu çözeltide kararsızdır - H+'ya olan ilgisi o kadar büyüktür ki (pKb ~ -38) çözücü H2O molekülünden bir proton soyutlar:
- O2- + H2O → 2 OH- ⓘ
Söz konusu reaksiyonların denge sabiti pKeq ~ -22'dir. ⓘ
18. yüzyılda oksitler, oksit üretmek için kullanılan kalsinasyon işleminden sonra calxes veya calces olarak adlandırıldı. Calx daha sonra oxyd ile değiştirilmiştir. ⓘ
İndirgeyici çözünme
Bir geçiş metali oksidin indirgeyici çözünmesi, çözünme bir redoks olayına bağlandığında meydana gelir. Örneğin, ferrik oksitler organik bileşikleri içerebilen indirgeyicilerin varlığında çözünür. veya bakteriler İndirgeyici çözünme, demir döngüsü gibi jeokimyasal olayların ayrılmaz bir parçasıdır. ⓘ
İndirgeyici çözünme, indirgeyicinin adsorbe olduğu bölgede gerçekleşmek zorunda değildir. Bunun yerine, eklenen elektron parçacık boyunca ilerleyerek parçacık üzerinde başka bir yerde indirgeyici çözünmeye neden olur. ⓘ
İsimlendirme ve formüller
Bazen oksitleri adlandırmak için metal-oksijen oranları kullanılır. Böylece, NbO niyobyum monoksit ve TiO2 titanyum dioksit olarak adlandırılır. Bu adlandırma Yunan sayısal öneklerini takip eder. Eski literatürde ve endüstride devam eden uygulamada oksitler, elementin adına -a eki eklenerek adlandırılır. Dolayısıyla alümina, magnezya ve krom, sırasıyla Al2O3, MgO ve Cr2O3'tür. ⓘ
Özel oksit türleri peroksit, O2-
2 ve süperoksit, O-
2. Bu türlerde, oksijene oksitten daha yüksek (daha az negatif) oksidasyon durumları atanır. ⓘ
En yüksek oksidasyon durumundaki kimyasal elementlerin oksitlerinin kimyasal formülleri tahmin edilebilir ve o elementin değerlik elektronlarının sayısından türetilir. Tetraoksijen olan O4'ün kimyasal formülü bile bir grup 16 elementi olarak öngörülebilirdir. Bunun bir istisnası, en yüksek oksidasyon durumundaki oksidin bakır(I) oksit değil bakır(II) oksit olduğu bakırdır. Bir başka istisna da, beklenebileceği gibi F2O7 olarak değil, OF2 olarak var olan florürdür. ⓘ
Flor oksijenden daha elektronegatif olduğundan, oksijen diflorür (OF2) bir flor oksitini temsil etmez, bunun yerine bir oksijen florürünü temsil eder. ⓘ
Oksit örnekleri
Aşağıdaki tabloda yaygın olarak karşılaşılan oksitlere örnekler verilmektedir. Uygulamada karşılaşılan çok atomlu iyonların sayısı çok fazla olduğu için sadece birkaç temsilci verilmiştir. ⓘ
| İsim | Formül | Bulundu/Kullanım ⓘ |
|---|---|---|
| Su (hidrojen oksit) | H 2O |
Karbon bazlı yaşam için gerekli olan yaygın çözücü |
| Azot oksit | N 2O |
Gülme gazı, anestezik (nitröz oksit ve oksijen anestezisi yapmak için diyatomik oksijen (O2) ile birlikte kullanılır), nitrojen bağlayıcı bakteriler tarafından üretilen, nitröz, roketçilikte oksitleyici ajan, aerosol itici, eğlence amaçlı ilaç, sera gazı. NO gibi diğer azot oksitler 2 (azot dioksit), NO (azot oksit), N 2O 3 (dinitrojen trioksit) ve N 2O 4 (dinitrojen tetroksit), özellikle önemli hava kirliliği olan bölgelerde mevcuttur. Ayrıca güçlü oksitleyicilerdir, asit yağmurlarına nitrik asit ekleyebilirler ve sağlığa zararlıdırlar. |
| Silisyum dioksit | SiO 2 |
Kum, kuvars |
| Demir (II,III) oksit | Fe 3O 4 |
Demir cevheri, pas, demir(III) oksit (Fe 2O 3) |
| Alüminyum oksit | Al 2O 3 |
Alüminyum cevheri, alümina, korundum, yakut (krom safsızlıkları içeren korundum). |
| Çinko oksit | ZnO | Kauçuk vulkanizasyonu için gerekli, betona katkı maddesi, güneş kremi, cilt bakım losyonları, antibakteriyel ve antifungal özellikler, gıda katkı maddesi, beyaz pigment. |
| Karbondioksit | CO 2 |
Dünya atmosferinin bileşeni, en bol ve önemli sera gazı, bitkiler tarafından fotosentezde şeker yapmak için kullanılır, solunum gibi biyolojik süreçlerin ve yanma ve karbonatların kimyasal ayrışması gibi kimyasal reaksiyonların ürünüdür. CO veya Karbon monoksit eksik yanmanın bir ürünü olarak bulunur ve oldukça zehirli bir gazdır. |
| Kalsiyum oksit | CaO | Sönmemiş kireç (inşaatta harç ve beton yapımında kullanılır), kalsiyum hidroksit üretmek için suyla ekzotermik reaksiyona girmesi nedeniyle kendinden ısıtmalı teneke kutularda kullanılır, Yunan ateşinin olası bileşenidir ve 2.400 °C'nin üzerinde ısıtıldığında kireç ışığı üretir. |
Çeşitleri
Asidik oksit
Ametallerin oksijence zengin bileşikleridir. CO2, SO2, SO3, N2O3, N2O5, P2O5, CI2O7, Cl2O1 ⓘ
Asidik oksitler suda çözündüklerinde asit oluştururlar. Bazlarla tepkimeye girerek ise tuz oluştururlar. ⓘ
Amfoter oksit
Asitlerin karşısında baz, bazların karşısında asit özelliği gösteren maddelerdir. Zn, Cr, AI, Sn, Pb, Be elementlerinin oksitleri amfoterdir. AI2O3, ZnO, AI(OH)3, Zn(OH)2 ⓘ
Amfoter oksitler suda çözünmezler. Hem asit hem bazlarla tepkimeye girerek tuz oluşturabilirler. ⓘ
Nötr oksit
Oksijence fakir ametal oksitlere nötr oksit denir. CO, NO, N2O ⓘ
Nötr oksitler asit, baz veya suyla tepkime vermezler. Ancak yanarak asit oksitlere dönüşebilirler. ⓘ
Peroksit
O−1 iyonunun yer aldığı bileşiklerdir. 1A ve 2A elementleriyle oluşabilir. Peroksitler kararsız bileşiklerdir ve ısıtıldıklarında kararlı hale geçerler. ⓘ
Bileşik oksit
Farklı değerlikteki aynı metallerin bir arada bulunduğu oksitlerdir. Fe3O4 (Fe+2O ve Fe2+3O3), Pb3O4 (2Pb+2O ve Pb+4O2) ⓘ