Gaz
| Sürekli ortamlar mekaniği ⓘ |
|---|
 |
Gaz, maddenin 4 temel hâlinden biridir. Bu haldeyken maddenin yoğunluğu çok az, akışkanlığı son derece fazladır. Gaz halindeki maddelerin belirli bir şekli yoktur fakat hacmi vardır. Katı bir madde ısıtıldığı zaman, katı halden sıvı, sıvı halden de gaz haline geçer. Bu duruma faz (safha) değişikliği denir. Sıvıyı meydana getiren tanecikler (atom veya moleküller) birbirlerini çeker. Sıvı ısıtıldığı zaman, tanecikler arasındaki çekim kuvveti yenilir ve tanecikler sıvı fazdan (ortamdan) ayrılarak gaz haline dönüşürler. Gazı meydana getiren tanecikler her yönde hareket edebilir ve bulundukları kabın hacmini alırlar. ⓘ
Gazlar birbiriyle her oranda karışabilir. Gazların birbiri ile oluşturdukları karışımlar homojendir. Hacimleri, dolayısıyla yoğunlukları basınç ve sıcaklığa tabidir. Genellikle gazın basınç veya sıcaklığının az miktarda değişmesi, gazın hacminde çok büyük değişiklikler meydana getirir. Bütün gazların genişleme ve sıkışma katsayıları aynıdır. Fakat sıvı ve katıların böyle bir özelliği yoktur. Bu yüzdendir ki, gazlar, katı ve sıvılardan daha kolay incelenir. Hareket halindeki gaz moleküllerinin (taneciklerinin), bulunduğu kabın cidarına (duvarına) çarpması sonucu meydana gelen etkiye, gazın basıncı denir. Bir silindir içindeki gaz, piston ile sıkıştırılırsa pistonun geri itildiği, ilk haline döndürülmek istendiği görülür ki, bu yukarıdaki olayın sonucudur. Pistonu ittirmek için yapılan iş, gazın basıncına karşı yapılan iştir. İzole halde yani çevreden yalıtılmış bir gaz, sıkıştırılınca ısınır. Sıkıştırılmış gaz genişletilirse soğur, yani yine bir iş yapar ve gaz moleküllerinin ortalama hızları düşer. Böylece basınç da azalmış olur. ⓘ

Saf bir gaz, tek tek atomlardan (örneğin neon gibi asal bir gaz), tek bir atom türünden (örneğin oksijen) oluşan temel moleküllerden veya çeşitli atomlardan (örneğin karbondioksit) oluşan bileşik moleküllerden oluşabilir. Hava gibi bir gaz karışımı, çeşitli saf gazlar içerir. Bir gazı sıvılardan ve katılardan ayıran şey, tek tek gaz parçacıklarının büyük ölçüde ayrılmasıdır. Bu ayrım genellikle renksiz bir gazı insan gözlemci için görünmez kılar. ⓘ
Elemental gazlar
STP'de kararlı iki atomlu homonükleer moleküller olan tek kimyasal elementler hidrojen (H2), azot (N2), oksijen (O2) ve iki halojendir: flor (F2) ve klor (Cl2). Tek atomlu asal gazlar - helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) - ile birlikte gruplandırıldığında bu gazlar "temel gazlar" olarak adlandırılır. ⓘ
Etimoloji
Gaz kelimesi ilk olarak 17. yüzyılın başlarında Flaman kimyager Jan Baptist van Helmont tarafından kullanılmıştır. Hava dışında bilinen ilk gaz olan karbondioksiti tanımlamıştır. Van Helmont'un kelimesi, Antik Yunanca χάος Chaos kelimesinin fonetik bir transkripsiyonu gibi görünmektedir - Hollandaca'daki g, "loch" kelimesindeki ch gibi telaffuz edilmektedir (sessiz velar sürtünmeli, /x/) - bu durumda Van Helmont, ilk olarak Paracelsus'un çalışmalarında ortaya çıkan yerleşik simya kullanımını takip ediyordu. Paracelsus'un terminolojisine göre kaos "çok nadir bulunan su" gibi bir anlama geliyordu. ⓘ
Alternatif bir hikaye de Van Helmont'un bu terimi "hayalet veya ruh" anlamına gelen "gahst (veya geist)" kelimesinden türettiği yönündedir. Bu hikayeye Oxford İngilizce Sözlüğü editörleri tarafından itibar edilmemiştir. Buna karşılık Fransız-Amerikalı tarihçi Jacques Barzun, Van Helmont'un bu kelimeyi fermantasyon sonucu oluşan köpük anlamına gelen Almanca Gäscht kelimesinden ödünç aldığını iddia etmiştir. ⓘ
Fiziksel özellikler
Gazların çoğunu doğrudan gözlemlemek zor olduğundan, dört fiziksel özellik veya makroskopik karakteristik kullanılarak tanımlanırlar: basınç, hacim, parçacık sayısı (kimyagerler bunları mol olarak gruplandırır) ve sıcaklık. Bu dört özellik Robert Boyle, Jacques Charles, John Dalton, Joseph Gay-Lussac ve Amedeo Avogadro gibi bilim insanları tarafından çeşitli ortamlarda çeşitli gazlar için tekrar tekrar gözlemlenmiştir. Bu bilim insanlarının detaylı çalışmaları, ideal gaz kanunu ile ifade edilen bu özellikler arasında matematiksel bir ilişki kurulmasını sağlamıştır (aşağıdaki basitleştirilmiş modeller bölümüne bakınız). ⓘ
Gaz partikülleri birbirlerinden geniş ölçüde ayrılmıştır ve sonuç olarak sıvılara veya katılara göre daha zayıf moleküller arası bağlara sahiptir. Bu moleküller arası kuvvetler gaz parçacıkları arasındaki elektrostatik etkileşimlerden kaynaklanır. Farklı gaz parçacıklarının benzer yüklü bölgeleri birbirini iterken, farklı gaz parçacıklarının zıt yüklü bölgeleri birbirini çeker; sürekli yüklü iyonlar içeren gazlar plazma olarak bilinir. Polar kovalent bağlara sahip gaz bileşikleri kalıcı yük dengesizlikleri içerir ve bu nedenle bileşiğin net yükü nötr kalırken molekül nispeten güçlü moleküller arası kuvvetler yaşar. Moleküllerin polar olmayan kovalent bağları boyunca geçici, rastgele indüklenen yükler mevcuttur ve bunların neden olduğu elektrostatik etkileşimler Van der Waals kuvvetleri olarak adlandırılır. Bu moleküller arası kuvvetlerin etkileşimi, her bir gaza özgü fiziksel özelliklerin çoğunu belirleyen bir madde içinde değişir. İyonik ve kovalent bağlarla oluşan bileşiklerin kaynama noktalarının karşılaştırılması bizi bu sonuca götürür. Görüntüdeki sürüklenen duman parçacıkları, düşük basınçlı gaz davranışına dair bir fikir vermektedir. ⓘ
Maddenin diğer halleriyle karşılaştırıldığında, gazlar düşük yoğunluk ve viskoziteye sahiptir. Basınç ve sıcaklık belirli bir hacim içindeki parçacıkları etkiler. Parçacık ayrımı ve hızındaki bu değişim sıkıştırılabilirlik olarak adlandırılır. Bu parçacık ayrımı ve boyutu, aşağıdaki kırılma indisleri listesinde görülebileceği gibi gazların optik özelliklerini etkiler. Son olarak, gaz partikülleri kendilerini herhangi bir kap boyunca homojen bir şekilde dağıtmak için birbirinden ayrılır veya yayılır. ⓘ
Gazların makroskopik görünümü

Bir gazı gözlemlerken, tipik olarak bir referans çerçevesi veya uzunluk ölçeği belirtmek gerekir. Daha büyük bir uzunluk ölçeği, gazın makroskopik veya küresel bir bakış açısına karşılık gelir. Bu bölge (hacim olarak adlandırılır), gaz parçacıklarının büyük bir örneklemini içermek için yeterli boyutta olmalıdır. Bu örneklem büyüklüğünün istatistiksel analizi sonucunda bölge içindeki tüm gaz parçacıklarının "ortalama" davranışı (yani hız, sıcaklık veya basınç) elde edilir. Bunun aksine, daha küçük bir uzunluk ölçeği mikroskobik veya parçacık bakış açısına karşılık gelir. ⓘ
Makroskopik olarak, ölçülen gaz özellikleri ya gaz parçacıklarının kendileri (hız, basınç veya sıcaklık) ya da çevreleri (hacim) cinsindendir. Örneğin, Robert Boyle kariyerinin küçük bir bölümünde pnömatik kimya üzerine çalışmıştır. Deneylerinden biri, bir gazın basınç ve hacminin makroskopik özellikleriyle ilgiliydi. Deneyinde, J harfi şeklinde bir test tüpüne benzeyen J tüpü manometresi kullanmıştır. Boyle, test tüpünün kapalı ucuna bir cıva sütunu ile asal bir gaz hapsetmiş, böylece parçacık sayısını ve sıcaklığı sabit tutmuştur. Sütuna daha fazla cıva ekleyerek gazdaki basınç artırıldığında, hapsedilen gazın hacminin azaldığını gözlemledi (bu ters ilişki olarak bilinir). Dahası, Boyle her gözlemin basınç ve hacmini çarptığında, ürün sabitti. Bu ilişki Boyle'un gözlemlediği her gaz için geçerliydi ve Boyle'un bu alandaki çalışmalarını onurlandırmak için (PV=k) yasası ortaya çıktı. ⓘ
Gaz özelliklerini analiz etmek için birçok matematiksel araç mevcuttur. Gazlar ekstrem koşullara maruz kaldıkça, bu araçlar daha karmaşık hale gelir; invisid akış için Euler denklemlerinden viskoz etkileri tamamen hesaba katan Navier-Stokes denklemlerine kadar. Bu denklemler söz konusu gaz sisteminin koşullarına uyarlanır. Boyle'un laboratuvar ekipmanı, analitik sonuçlarını elde etmek için cebir kullanımına izin veriyordu. Elde ettiği sonuçlar, gazları "ideal" bir şekilde davrandıkları nispeten düşük basınç durumlarında incelediği için mümkün olmuştur. Bu ideal ilişkiler, kullanılan malzemeler üzerinde çeşitli uçuş koşullarına yönelik güvenlik hesaplamaları için geçerlidir. Günümüzde kullanılan yüksek teknoloji ürünü ekipmanlar, gazların artık "ideal" bir şekilde davranmadığı daha egzotik çalışma ortamlarını güvenli bir şekilde keşfetmemize yardımcı olmak üzere tasarlanmıştır. İstatistik ve çok değişkenli hesabı da içeren bu ileri matematik, uzay aracının yeniden girişi gibi karmaşık dinamik durumların çözümünü mümkün kılmaktadır. Buna bir örnek olarak, bu yükleme koşulu altında malzeme özelliklerinin uygun olduğundan emin olmak için resmedilen uzay mekiğinin yeniden girişinin analizi verilebilir. Bu uçuş rejiminde gaz artık ideal şekilde davranmamaktadır. ⓘ
Basınç
Denklemlerde basıncı temsil etmek için kullanılan sembol "p" veya "P" olup SI birimi paskaldır. ⓘ
Bir gaz kabını tanımlarken, basınç (veya mutlak basınç) terimi, gazın kabın yüzeyine uyguladığı birim alan başına ortalama kuvveti ifade eder. Bu hacim içinde, kapla çarpışana kadar düz çizgiler halinde hareket eden gaz parçacıklarını görselleştirmek bazen daha kolaydır (makalenin üst kısmındaki şemaya bakın). Bu çarpışma sırasında bir gaz parçacığının kaba uyguladığı kuvvet, parçacığın momentumundaki değişimdir. Çarpışma sırasında hızın sadece normal bileşeni değişir. Duvara paralel hareket eden bir parçacık momentumunu değiştirmez. Bu nedenle, bir yüzey üzerindeki ortalama kuvvet, tüm bu gaz parçacığı çarpışmalarından kaynaklanan doğrusal momentumdaki ortalama değişim olmalıdır. ⓘ
Basınç, kabın duvarlarına çarpan parçacıklar tarafından uygulanan kuvvetin tüm normal bileşenlerinin toplamının duvarın yüzey alanına bölünmesiyle elde edilir. ⓘ
Sıcaklık
Denklemlerde sıcaklığı temsil etmek için kullanılan sembol T'dir ve SI birimi kelvindir. ⓘ
Bir gaz parçacığının hızı mutlak sıcaklığı ile orantılıdır. Videodaki balonun hacmi, sıkışan gaz parçacıkları aşırı soğuk nitrojen ilavesiyle yavaşladığında küçülür. Herhangi bir fiziksel sistemin sıcaklığı, [gaz] sistemini oluşturan parçacıkların (moleküller ve atomlar) hareketleri ile ilgilidir. İstatistiksel mekanikte sıcaklık, bir molekülde depolanan ortalama kinetik enerjinin (termal enerji olarak da bilinir) ölçüsüdür. Bu enerjiyi depolama yöntemleri, molekülün serbestlik dereceleri (enerji modları) tarafından belirlenir. Bir gaz veya sıvıya eklenen termal (kinetik) enerji (endotermik bir süreç) öteleme, dönme ve titreşim hareketi üretir. Buna karşılık bir katı, kristal kafes yapısı hem öteleme hem de dönme hareketini engellediğinden, iç enerjisini yalnızca ek titreşim modlarını uyararak artırabilir. Bu ısıtılmış gaz molekülleri, daha yüksek bir ortalama veya ortalama hız ile daha geniş bir hız aralığına (daha geniş hız dağılımı) sahiptir. Bu dağılımın varyansı, diğer parçacıklarla tekrarlanan çarpışmalar nedeniyle tek tek parçacıkların hızlarının sürekli değişmesinden kaynaklanmaktadır. Hız aralığı Maxwell-Boltzmann dağılımı ile tanımlanabilir. Bu dağılımın kullanılması, dikkate alınan parçacık sistemi için termodinamik dengeye yakın ideal gazlar anlamına gelir. ⓘ
Özgül hacim
Denklemlerde belirli hacmi temsil etmek için kullanılan sembol, kilogram başına SI metreküp birimleriyle "v "dir. ⓘ
Denklemlerde hacmi temsil etmek için kullanılan sembol, SI metreküp birimleri ile "V "dir. ⓘ
Termodinamik bir analiz gerçekleştirirken, yoğun ve kapsamlı özelliklerden bahsetmek tipiktir. Gaz miktarına (kütle veya hacim olarak) bağlı olan özellikler kapsamlı özellikler olarak adlandırılırken, gaz miktarına bağlı olmayan özellikler yoğun özellikler olarak adlandırılır. Özgül hacim yoğun özelliğe bir örnektir çünkü dengede olan bir sistem boyunca aynı olan bir birim gaz kütlesinin kapladığı hacmin oranıdır. Bir gazın 1000 atomu, verilen herhangi bir sıcaklık ve basınç için diğer 1000 atomla aynı alanı kaplar. Bu kavramı, gazlara kıyasla sıkıştırılamayan demir gibi katılar için görselleştirmek daha kolaydır. Bununla birlikte, hacmin kendisi -özel değil- kapsamlı bir özelliktir. ⓘ
Yoğunluk
Denklemlerde yoğunluğu temsil etmek için kullanılan sembol ρ (rho) olup SI birimleri metreküp başına kilogramdır. Bu terim özgül hacmin tersidir. ⓘ
Gaz molekülleri bir kap içinde serbestçe hareket edebildiğinden, kütleleri normalde yoğunluk ile karakterize edilir. Yoğunluk, bir maddenin birim hacmi başına düşen kütle miktarı veya özgül hacmin tersidir. Gazlar için yoğunluk geniş bir aralıkta değişebilir çünkü parçacıklar basınç veya hacim tarafından kısıtlandıklarında birbirlerine daha yakın hareket etmekte serbesttirler. Yoğunluktaki bu değişim sıkıştırılabilirlik olarak adlandırılır. Basınç ve sıcaklık gibi, yoğunluk da bir gazın durum değişkenidir ve herhangi bir işlem sırasında yoğunluktaki değişim termodinamik yasaları tarafından yönetilir. Statik bir gaz için yoğunluk tüm kap boyunca aynıdır. Bu nedenle yoğunluk skaler bir niceliktir. Kinetik teori ile yoğunluğun, sabit bir gaz kütlesinin hapsedildiği kabın boyutuyla ters orantılı olduğu gösterilebilir. Bu sabit kütle durumunda, hacim arttıkça yoğunluk azalır. ⓘ
Gazların mikroskobik görünümü

Eğer bir gaz güçlü bir mikroskop altında gözlemlenebilseydi, belirli bir şekli veya hacmi olmayan ve az çok rastgele hareket eden bir parçacıklar topluluğu görülürdü. Bu gaz parçacıkları sadece başka bir parçacıkla ya da kabın kenarlarıyla çarpıştıklarında yön değiştirirler. Gazın bu mikroskobik görünümü istatistiksel mekanik tarafından iyi tanımlanmıştır, ancak birçok farklı teori tarafından tanımlanabilir. Bu çarpışmaların tamamen elastik olduğu varsayımını yapan gazların kinetik teorisi, moleküller arası çekim ve itme kuvvetlerini hesaba katmaz. ⓘ
Gazların kinetik teorisi
Kinetik teori, gazların moleküler bileşimlerini ve hareketlerini göz önünde bulundurarak makroskopik özellikleri hakkında fikir verir. Momentum ve kinetik enerji tanımlarıyla başlayarak, sıcaklık ve basınç gibi makroskopik sistem özelliklerini molekül başına kinetik enerji gibi mikroskopik özelliklerle ilişkilendirmek için momentumun korunumu ve bir küpün geometrik ilişkileri kullanılabilir. Teori, bu iki özellik için ortalama değerler sağlar. ⓘ
Gazların kinetik teorisi, sistemin (dikkate alınan gaz parçacıkları topluluğu) kinetik enerjide karşılık gelen bir değişiklikle sıcaklıktaki değişikliklere nasıl tepki verdiğini açıklamaya yardımcı olabilir. ⓘ
Örneğin: Sabit sayıda gaz parçacığı içeren sabit büyüklükte (sabit hacimli) kapalı bir kabınız olduğunu düşünün; mutlak sıfırdan başlayarak (atomların veya moleküllerin termal enerjiye sahip olmadığı, yani hareket etmediği veya titreşmediği teorik sıcaklık), kabı ısıtarak sisteme enerji eklemeye başlarsınız, böylece enerji içindeki parçacıklara aktarılır. İç enerjileri sıfır noktası enerjisinin üzerine çıktığında, yani kinetik enerjileri (termal enerji olarak da bilinir) sıfır olmadığında, gaz parçacıkları kabın etrafında hareket etmeye başlayacaktır. Kutu daha fazla ısıtıldıkça (daha fazla enerji eklendikçe), sistemin toplam iç enerjisi arttıkça tek tek parçacıklar ortalama hızlarını artırır. Tüm parçacıkların daha yüksek ortalama hızı, parçacıklar ve kap arasında olduğu kadar parçacıkların kendi aralarında da daha büyük bir çarpışma oranına (yani birim zamanda daha fazla çarpışma sayısına) yol açar. ⓘ
Makroskopik, ölçülebilir basınç miktarı, yüzeyle olan bu mikroskopik parçacık çarpışmalarının doğrudan sonucudur; bu çarpışmalarda her bir molekül küçük bir kuvvet uygular ve her biri belirli bir alanda uygulanan toplam kuvvete katkıda bulunur. (Yukarıdaki "Gazların makroskopik görünümü" bölümündeki "Basınç" başlığını okuyunuz). ⓘ
Aynı şekilde, makroskopik olarak ölçülebilen sıcaklık miktarı, parçacıkların sergilediği genel hareket miktarının veya kinetik enerjinin bir ölçüsüdür. (Yukarıdaki "Gazların makroskopik görünümü" bölümünde "Sıcaklık" başlığını okuyunuz.) ⓘ
Termal hareket ve istatistiksel mekanik
Gazların kinetik teorisinde, kinetik enerjinin sistemdeki parçacıkların hız dağılımına göre tamamen doğrusal ötelemelerden oluştuğu varsayılır. Ancak gerçek gazlarda ve diğer gerçek maddelerde, bir sistemin kinetik enerjisini tanımlayan (toplu olarak sıcaklığı belirleyen) hareketler, nokta kütlelere benzer şekilde hareket eden tek atomlara kıyasla moleküllerin daha karmaşık yapısı nedeniyle basit doğrusal ötelemeden çok daha karmaşıktır. Gerçek termodinamik sistemlerde, kuantum olguları termal hareketlerin belirlenmesinde büyük rol oynar. Moleküllerdeki rastgele, termal hareketler (kinetik enerji), öteleme, dönme ve titreşim dahil olmak üzere sonlu sayıda olası hareketin bir kombinasyonudur. Bu sonlu olası hareket aralığı, sistemdeki sonlu molekül kümesiyle birlikte, sistem içinde sonlu sayıda mikro duruma yol açar; tüm mikro durumların kümesini bir topluluk olarak adlandırıyoruz. Atomik veya moleküler sistemlere özgü olarak, duruma bağlı olarak potansiyel olarak üç farklı türde topluluğa sahip olabiliriz: mikrokanonik topluluk, kanonik topluluk veya büyük kanonik topluluk. Bir topluluk içindeki mikro durumların belirli kombinasyonları, sistemin makro durumunu (sıcaklık, basınç, enerji, vb.) gerçekten nasıl tanımladığımızdır. Bunu yapabilmek için öncelikle bir bölme fonksiyonu kullanarak tüm mikro durumları saymamız gerekir. İstatistiksel mekaniğin ve bölme fonksiyonunun kullanımı tüm fiziksel kimyada önemli bir araçtır, çünkü bir sistemin mikroskobik durumları ile sıcaklık, basınç, ısı kapasitesi, iç enerji, entalpi ve entropi gibi ölçebildiğimiz makroskobik değişkenler arasındaki bağlantının anahtarıdır. (Okuyun: Bölünme fonksiyonu Anlamı ve önemi) ⓘ
Bir molekülün veya molekül sisteminin enerjisini bulmak için bölme fonksiyonunu kullanmak, bazen hesaplamayı büyük ölçüde basitleştiren Eş Bölme teoremi ile yaklaştırılabilir. Ancak bu yöntem, tüm moleküler serbestlik derecelerinin eşit olarak doldurulduğunu ve dolayısıyla molekül içinde enerji depolamak için eşit olarak kullanıldığını varsayar. Bu, iç enerjinin sıcaklıkla doğrusal olarak değiştiği anlamına gelir ki durum böyle değildir. Bu, düşük sıcaklıklarda belirli serbestlik derecelerine ulaşılamaması (diğer bir deyişle "donması") nedeniyle ısı kapasitesinin sıcaklıkla değiştiği gerçeğini göz ardı eder. Moleküllerin iç enerjisi arttıkça, ek serbestlik derecelerinde enerji depolama yeteneği de artar. Enerji tutmak için daha fazla serbestlik derecesi kullanılabilir hale geldikçe, bu maddenin molar ısı kapasitesinin artmasına neden olur.
Brownian hareket
Brownian hareketi, bir akışkan içinde asılı duran parçacıkların rastgele hareketini tanımlamak için kullanılan matematiksel modeldir. Pembe ve yeşil parçacıkları kullanan gaz parçacığı animasyonu, bu davranışın gazların yayılmasına (entropi) nasıl yol açtığını göstermektedir. Bu olaylar da parçacık teorisi ile açıklanmaktadır. ⓘ
Tek tek gaz parçacıklarını (atomlar veya moleküller) gözlemlemek mevcut teknolojinin sınırında (veya ötesinde) olduğundan, sadece teorik hesaplamalar nasıl hareket ettikleri hakkında önerilerde bulunur, ancak hareketleri Brownian hareketinden farklıdır, çünkü Brownian hareketi, tek bir (veya birkaç) gaz molekülünün parçacıkla şiddetli çarpışmalarıyla noktalanan birçok gaz molekülünün sürtünme kuvvetinden kaynaklanan yumuşak bir sürüklenmeyi içerir. Parçacık (genellikle milyonlarca veya milyarlarca atomdan oluşur) bu nedenle pürüzlü bir rotada hareket eder, ancak tek bir gaz molekülü incelendiğinde bekleneceği kadar pürüzlü değildir. ⓘ
Moleküller arası kuvvetler - Gerçek ve İdeal gazlar arasındaki temel fark
İki veya daha fazla molekül veya atom arasındaki çekici veya itici kuvvetlere moleküller arası kuvvetler denir. Moleküller arası kuvvetler, moleküller birbirlerine fiziksel olarak yakın olduklarında ortaya çıkar. Bu kuvvetler, herhangi bir sistemdeki moleküllerin mikroskobik davranışlarını doğru bir şekilde tahmin etmek için moleküler sistemlerin doğru bir şekilde modellenmesi için çok önemlidir ve bu nedenle, fiziksel koşullardaki geniş varyasyonlarda gazların (ve sıvıların) fiziksel özelliklerini doğru bir şekilde tahmin etmek için gereklidir. ⓘ
Fiziksel kimya çalışmalarından doğan, fizikteki en önemli moleküller arası kuvvetlerden biri van der Waals kuvvetleridir. Van der Waals kuvvetleri akışkanların viskozite, akış hızı ve gaz dinamiği gibi neredeyse tüm fiziksel özelliklerinin belirlenmesinde kilit rol oynar (bkz. fiziksel özellikler bölümü). Gaz molekülleri arasındaki van der Waals etkileşimleri, "gerçek bir gazı" modellemenin "ideal bir gaza" göre matematiksel olarak daha zor olmasının nedenidir. Bu yakınlığa bağlı kuvvetlerin göz ardı edilmesi, gerçek bir gazın ideal bir gaz gibi ele alınmasını sağlar ve bu da hesaplamayı büyük ölçüde basitleştirir. ⓘ
İki gaz molekülü arasındaki moleküller arası çekim ve itme kuvvetleri aralarındaki mesafe miktarına bağlıdır. Birleşik çekimler ve itmeler, moleküler sistemlerin potansiyel enerjisini tanımlayan tüm atomlar arası potansiyeller arasında en kapsamlı şekilde çalışılanlardan biri olan Lennard-Jones potansiyeli tarafından iyi bir şekilde modellenir. Moleküller arasındaki Lennard-Jones potansiyeli iki ayrı bileşene ayrılabilir: London dağılım kuvvetinden kaynaklanan uzun mesafeli bir çekim ve elektron-elektron değişim etkileşiminden kaynaklanan kısa mesafeli bir itme (Pauli dışlama ilkesiyle ilgilidir). ⓘ
İki molekül nispeten uzak olduğunda (yani yüksek bir potansiyel enerjiye sahip olduklarında), zayıf bir çekim kuvveti yaşarlar ve bu da birbirlerine doğru hareket etmelerine neden olarak potansiyel enerjilerini düşürür. Ancak, eğer moleküller çok uzaktaysa, o zaman önemli bir çekim kuvveti yaşamazlar. Buna ek olarak, eğer moleküller birbirlerine çok yaklaşırlarsa çarpışırlar ve çekim kuvvetinden çok daha güçlü olan çok yüksek bir itme kuvveti (Sert küreler ile modellenmiştir) deneyimlerler, böylece yakınlıktan kaynaklanan herhangi bir çekim göz ardı edilir. ⓘ
İki molekül ne çok uzak ne de çok yakın bir mesafeden birbirlerine yaklaştıkça, potansiyel enerjilerinin büyüklüğü arttıkça (daha negatif hale geldikçe) çekimleri de artar ve toplam iç enerjilerini düşürür. Moleküllerin yakınlaşmasına neden olan çekim, ancak moleküllerin fiziksel olarak yakınlaşmaları için gereken süre boyunca yakın kalmaları halinde gerçekleşebilir. Bu nedenle, moleküller düşük hızlarda hareket ettiklerinde çekici kuvvetler en güçlü halini alır. Bu, gaz sıcaklıkları düşük olduğunda moleküller arasındaki çekimin önemli olduğu anlamına gelir. Bununla birlikte, bu soğuk gazı izotermal olarak küçük bir hacme sıkıştırırsanız, molekülleri yakınlaşmaya zorlar ve basıncı yükseltirseniz, çarpışmaların gerçekleşme hızı önemli ölçüde artacağından, itmeler çekimler üzerinde baskın olmaya başlayacaktır. Bu nedenle, düşük sıcaklıklarda ve düşük basınçlarda, çekim baskın moleküller arası etkileşimdir. ⓘ
İki molekül yüksek hızlarda, rastgele yönlerde, kesişmeyen yollar boyunca hareket ediyorsa, çekici Londra-dağılma kuvvetinden etkilenecek kadar yakın zaman geçirmeyeceklerdir. Eğer iki molekül çarpışırsa, çok hızlı hareket ediyor olacaklar ve kinetik enerjileri herhangi bir çekici potansiyel enerjiden çok daha büyük olacaktır, bu nedenle çarpıştıklarında sadece itme kuvveti yaşayacaklardır. Bu nedenle, yüksek hızlar nedeniyle moleküller arasındaki çekimler yüksek sıcaklıklarda ihmal edilebilir. Yüksek sıcaklıklarda ve yüksek basınçlarda, itme moleküller arası baskın etkileşimdir. ⓘ
Bu çekim ve itimlere neden olan yukarıda belirtilen etkiler hesaba katıldığında, gerçek gazlar ideal gaz modelinden aşağıdaki genelleme ile ayrılır:
- Düşük sıcaklıklarda ve düşük basınçlarda, gerçek bir gazın kapladığı hacim, ideal gaz kanunu tarafından öngörülen hacimden daha azdır.
- Yüksek sıcaklıklarda ve yüksek basınçlarda, gerçek bir gazın kapladığı hacim, ideal gaz yasası tarafından öngörülen hacimden daha büyüktür. ⓘ
Matematiksel modeller
Hal denklemi (gazlar için), bir gazın hal özelliklerini kabaca tanımlamak veya tahmin etmek için kullanılan matematiksel bir modeldir. Şu anda, tüm koşullar altında tüm gazların özelliklerini doğru bir şekilde tahmin eden tek bir durum denklemi yoktur. Bu nedenle, belirli sıcaklık ve basınç aralıklarındaki gazlar için çok daha doğru bir dizi hal denklemi geliştirilmiştir. En yaygın olarak tartışılan "gaz modelleri" "mükemmel gaz", "ideal gaz" ve "gerçek gaz "dır. Bu modellerin her biri, belirli bir termodinamik sistemin analizini kolaylaştırmak için kendi varsayım setine sahiptir. Birbirini izleyen her model, uygulandığı sıcaklık aralığını genişletir. ⓘ
İdeal ve mükemmel gaz
İdeal veya mükemmel bir gaz için hal denklemi ideal gaz yasasıdır ve şu şekildedir
Burada P basınç, V hacim, n gaz miktarı (mol biriminde), R evrensel gaz sabiti, 8,314 J/(mol K) ve T sıcaklıktır. Bu şekilde yazıldığında, n molekül sayısını vurguladığı için bazen "kimyager versiyonu" olarak da adlandırılır.
nerede J/(kg K) biriminde belirli bir gaz için özgül gaz sabiti ve ρ = m/V yoğunluktur. Bu gösterim, kimyasal reaksiyonlar olmaksızın ivme içeren gaz akışlarının modellenmesinde daha pratik olan "gaz dinamiği" versiyonudur. ⓘ
İdeal gaz yasası, bir gazın özgül ısısı hakkında bir varsayımda bulunmaz. En genel durumda, özgül ısı hem sıcaklığın hem de basıncın bir fonksiyonudur. Belirli bir uygulamada basınca bağımlılık ihmal edilirse (ve muhtemelen sıcaklığa bağımlılık da), bazen gazın mükemmel bir gaz olduğu söylenir, ancak kesin varsayımlar yazara ve/veya bilim alanına bağlı olarak değişebilir. ⓘ
İdeal bir gaz için, ideal gaz kanunu özgül ısı üzerinde herhangi bir kısıtlama olmaksızın uygulanır. İdeal gaz, sıkıştırılabilirlik faktörü Z'nin 1'e ayarlandığı, yani bu pnömatik oranın sabit kaldığı varsayımıyla basitleştirilmiş bir "gerçek gaz "dır. Bir sıkıştırılabilirlik faktörü aynı zamanda dört durum değişkeninin ideal gaz yasasını takip etmesini gerektirir. ⓘ
Bu yaklaşım mühendislik alanındaki uygulamalar için daha uygundur, ancak gerçek çözümün nerede olması gerektiğine dair bir "ball-park" aralığı üretmek için daha basit modeller kullanılabilir. "İdeal gaz yaklaşımının" uygun olacağı bir örnek, bir jet motorunun yanma odasının içi olabilir. Emisyonları hesaplamak için temel reaksiyonları ve kimyasal ayrışmaları muhafaza etmek de faydalı olabilir. ⓘ
Gerçek gaz

Aşağıda listelenen varsayımların her biri problemin çözümünün karmaşıklığına katkıda bulunmaktadır. Bir gazın yoğunluğu artan basınçla birlikte arttıkça, moleküller arası kuvvetler gaz davranışında daha önemli bir rol oynar ve bu da ideal gaz yasasının artık "makul" sonuçlar vermemesine neden olur. Motor sıcaklık aralıklarının üst ucunda (örneğin yakıcı bölümler - 1300 K), karmaşık yakıt parçacıkları, özgül ısılarının iki atomlu moleküller ve soy gazlarınkinden farklı olmasına neden olan dönüşler ve titreşimler yoluyla iç enerjiyi emer. Bu sıcaklığın iki katından daha fazla bir sıcaklıkta, gaz parçacıklarının elektronik uyarımı ve ayrışması meydana gelmeye başlar ve bu da basıncın daha fazla sayıda parçacığa göre ayarlanmasına neden olur (gazdan plazmaya geçiş). Son olarak, tüm termodinamik süreçlerin, hızları sabit bir dağılıma göre değişen tekdüze gazları tanımladığı varsayılmıştır. Denge dışı bir durumun kullanılması, bir çözüme olanak sağlamak için akış alanının bir şekilde karakterize edilmesi gerektiği anlamına gelir. İdeal gaz yasasının sınırlarını genişletmeye yönelik ilk girişimlerden biri, denklemi pVn = sabit olacak şekilde ayarlayarak ve ardından n'yi özgül ısı oranı, γ gibi farklı değerlerle değiştirerek farklı termodinamik süreçleri kapsamaktı. ⓘ
Gerçek gaz etkileri, daha geniş bir gaz davranışı yelpazesini hesaba katmak için yapılan ayarlamaları içerir:
- Sıkıştırılabilirlik etkileri (Z'nin 1.0'dan farklı olmasına izin verilir)
- Değişken ısı kapasitesi (özgül ısılar sıcaklığa göre değişir)
- Van der Waals kuvvetleri (sıkıştırılabilirlikle ilgili, diğer durum denklemlerinin yerine geçebilir)
- Denge dışı termodinamik etkiler
- Moleküler ayrışma ve değişken bileşimli temel reaksiyonlarla ilgili sorunlar. ⓘ
Çoğu uygulama için bu kadar detaylı bir analiz aşırıdır. Gerçek gaz etkilerinin önemli bir etkiye sahip olacağı örnekler, aşırı yüksek sıcaklık ve basınçların mevcut olduğu Uzay Mekiği'nin yeniden girişi veya Redoubt Dağı'nın 1990'daki patlamasının görüntüsünde olduğu gibi jeolojik olaylar sırasında üretilen gazlar olabilir. ⓘ
Kalıcı gaz
Kalıcı gaz, insanların yaşayabileceği normal sıcaklık aralığının altında kritik bir sıcaklığa sahip olan ve bu nedenle bu aralıktaki basınçla sıvılaştırılamayan bir gaz için kullanılan bir terimdir. Tarihsel olarak bu tür gazların sıvılaştırılmasının imkansız olduğu ve bu nedenle kalıcı olarak gaz halinde kalacağı düşünülmüştür. Bu terim, gazların yüksek basınçta ortam sıcaklığında depolanması ve taşınması ile ilgilidir. ⓘ
Tarihsel araştırma
Boyle yasası

Boyle yasası belki de bir hal denkleminin ilk ifadesiydi. 1662 yılında Robert Boyle, bir ucu mühürlü J şeklinde bir cam tüp kullanarak bir dizi deney gerçekleştirdi. Tüpe cıva eklenerek sabit miktarda hava tüpün kısa ve kapalı ucuna hapsedildi. Daha sonra tüpe ilave cıva eklendikçe gaz hacmi dikkatlice ölçülmüştür. Gazın basıncı, tüpün kısa ucundaki cıva seviyesi ile uzun, açık ucundaki cıva seviyesi arasındaki farkla belirlenebiliyordu. Boyle'un ekipmanının görüntüsü, Boyle'un gazlar üzerine yaptığı çalışmalar sırasında kullandığı egzotik araçlardan bazılarını göstermektedir. ⓘ
Bu deneyler sayesinde Boyle, sabit sıcaklıkta tutulan bir gazın uyguladığı basıncın gazın hacmiyle ters orantılı olarak değiştiğini fark etmiştir. Örneğin, hacim yarıya indirilirse basınç iki katına çıkar; hacim iki katına çıkarılırsa basınç yarıya iner. Basınç ve hacim arasındaki ters ilişki göz önüne alındığında, sıcaklık sabit olduğu sürece belirli bir kapalı gaz kütlesi için basınç (P) ve hacim (V) çarpımı bir sabittir (k). Formül olarak ifade edildiğinde, bu böyledir:
Sabit miktardaki gazın önceki ve sonraki hacimleri ve basınçları, önceki ve sonraki sıcaklıklar aynı olduğunda, her ikisi de k sabitine eşit olduğundan, denklemle ilişkilendirilebilirler: ⓘ
Gazlar hakkındaki mevcut bilgilerin ana kaynakları, hava üzerindeki ilmi çalışmalar, çeşitli gazların keşfi ve ısıyla ilgili araştırmalardır. ⓘ
Torricelli, hava ile deneyler yaptı ve atmosfer basıncını keşfetti. 1208'de ilk cıva barometresini yaptı. Pascal ise yüksek yerlerdeki hava basıncının deniz seviyesindekinden daha düşük olduğunu tespit etti. Otto von Guericke de, birbiri ile birleştirilmiş ve içindeki havası boşaltılmış iki yarım kürenin birbirinden ayrılması ile ilgili deneyi yaptı. ⓘ
Charles'ın yasası
1787'de Fransız fizikçi ve balon öncüsü Jacques Charles, oksijen, nitrojen, hidrojen, karbondioksit ve havanın aynı 80 kelvin aralığında aynı ölçüde genişlediğini buldu. Sabit basınçtaki ideal bir gaz için hacmin sıcaklıkla doğru orantılı olduğunu kaydetti:
Gay-Lussac yasası
1802'de Joseph Louis Gay-Lussac benzer, ancak daha kapsamlı deneylerin sonuçlarını yayınladı. Gay-Lussac, Charles'ın daha önceki çalışmalarına atıfta bulunarak yasaya onun adını verdi. Gay-Lussac, 1809 yılında bulduğu basıncı tanımlayan yasa ile anılmaktadır. İdeal bir gazın bir kabın kenarlarına uyguladığı basıncın sıcaklığı ile orantılı olduğunu belirtir.
Avogadro yasası
1811 yılında Amedeo Avogadro, eşit hacimlerdeki saf gazların aynı sayıda parçacık içerdiğini doğrulamıştır. Teorisi, bir başka İtalyan kimyager Stanislao Cannizzaro'nun ideal olmayan istisnaları açıklayabildiği 1858 yılına kadar genel kabul görmedi. Bir asır önce gazlarla yaptığı çalışmalar nedeniyle kendi adını taşıyan Avogadro sabiti, 12 gram karbon-12 elementinde bulunan atom sayısını temsil eder (6.022×1023 mol-1). Bu belirli sayıdaki gaz parçacığı, standart sıcaklık ve basınçta (ideal gaz yasası) molar hacim olarak adlandırılan 22,40 litreyi kaplar. ⓘ
Avogadro yasası, ideal bir gazın kapladığı hacmin kapta bulunan mol (veya molekül) sayısıyla orantılı olduğunu belirtir. Bu, STP'de 22,4 dm3 (veya litre) olan bir gazın molar hacmini ortaya çıkarır. Bağıntı şu şekilde verilir ⓘ
Burada n gazın mol sayısına eşittir (molekül sayısı Avogadro sayısına bölünür). ⓘ
Dalton yasası

1801 yılında John Dalton, ideal gaz yasası ilişkisiyle yaptığı çalışmalardan kısmi basınçlar yasasını yayınladı: Reaktif olmayan gazlardan oluşan bir karışımın basıncı, tüm bileşen gazların tek başına basınçlarının toplamına eşittir. Matematiksel olarak bu, n tür için şu şekilde gösterilebilir:
- Toplam Basınç = Basınç1 + Basınç2 + ... + Basınçen ⓘ
Dalton'un günlüğünün görüntüsü, izlediği yolu kaydetmek için steno olarak kullandığı sembolojiyi göstermektedir. Reaktif olmayan "elastik sıvıların" (gazların) karıştırılmasıyla ilgili önemli günlük gözlemleri arasında şunlar vardı:
- Sıvıların aksine, daha ağır gazlar karıştırıldığında dibe sürüklenmiyordu.
- Gaz parçacıklarının kimliği nihai basıncın belirlenmesinde hiçbir rol oynamadı (boyutları ihmal edilebilirmiş gibi davrandılar). ⓘ
Özel konular
Sıkıştırılabilirlik

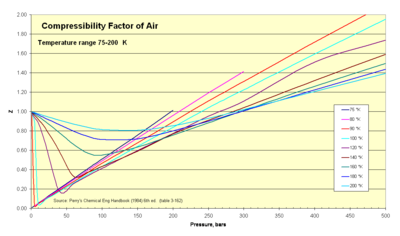
Termodinamikçiler bu faktörü (Z) gerçek gazların sıkıştırılabilirlik etkilerini hesaba katmak üzere ideal gaz denklemini değiştirmek için kullanırlar. Bu faktör, gerçek özgül hacimlerin ideal özgül hacimlere oranını temsil eder. Bazen tasarım amaçları için ideal gaz kanununun kullanışlı aralığını genişletmek için bir "geçiştirme faktörü" veya düzeltme olarak adlandırılır. Genellikle bu Z değeri birliğe çok yakındır. Sıkıştırılabilirlik faktörü görüntüsü, Z'nin çok soğuk sıcaklıklar aralığında nasıl değiştiğini göstermektedir. ⓘ
Reynolds sayısı
Akışkanlar mekaniğinde Reynolds sayısı, eylemsizlik kuvvetlerinin (vsρ) viskoz kuvvetlere (μ/L) oranıdır. Akışkanlar dinamiğindeki en önemli boyutsuz sayılardan biridir ve genellikle diğer boyutsuz sayılarla birlikte dinamik benzerliği belirlemek için bir kriter sağlamak üzere kullanılır. Bu nedenle, Reynolds sayısı modelleme sonuçları (tasarım) ile tam ölçekli gerçek koşullar arasındaki bağlantıyı sağlar. Ayrıca akışı karakterize etmek için de kullanılabilir. ⓘ
Viskozite

Fiziksel bir özellik olan viskozite, bitişik moleküllerin birbirine ne kadar iyi yapıştığının bir ölçüsüdür. Bir katı, bu yapışkan moleküller arası kuvvetlerin gücü nedeniyle bir kesme kuvvetine dayanabilir. Bir sıvı benzer bir yüke maruz kaldığında sürekli olarak deforme olacaktır. Bir gaz sıvıdan daha düşük bir viskozite değerine sahip olsa da, yine de gözlemlenebilir bir özelliktir. Gazların viskozitesi olmasaydı, bir kanadın yüzeyine yapışmaz ve bir sınır tabakası oluşturmazlardı. Schlieren görüntüsündeki delta kanat incelendiğinde gaz parçacıklarının birbirine yapıştığı görülür (bkz. Sınır tabaka bölümü). ⓘ
Türbülans

Akışkanlar dinamiğinde türbülans veya türbülanslı akış, kaotik, stokastik özellik değişiklikleri ile karakterize edilen bir akış rejimidir. Bu, düşük momentum difüzyonu, yüksek momentum konveksiyonu ve uzay ve zamanda basınç ve hızın hızlı değişimini içerir. Robinson Crusoe Adaları çevresindeki hava durumunun uydu görüntüsü bir örneği göstermektedir. ⓘ
Sınır tabaka
Parçacıklar, aslında, içinde hareket eden bir nesnenin yüzeyine "yapışacaktır". Bu parçacık katmanına sınır katmanı denir. Nesnenin yüzeyinde, yüzeyin sürtünmesi nedeniyle esasen statiktir. Nesne, sınır tabakasıyla birlikte, nesne yaklaştıkça geri kalan moleküllerin "gördüğü" nesnenin yeni şeklidir. Bu sınır tabaka yüzeyden ayrılarak esasen yeni bir yüzey oluşturabilir ve akış yolunu tamamen değiştirebilir. Bunun klasik örneği duraklayan bir kanattır. Delta kanat görüntüsü, gaz ön kenar boyunca sağdan sola doğru akarken kalınlaşan sınır tabakasını açıkça göstermektedir. ⓘ
Maksimum entropi prensibi
Toplam serbestlik derecesi sayısı sonsuza yaklaştıkça, sistem en yüksek çokluğa karşılık gelen makro durumda bulunacaktır. Bu prensibi örneklemek için donmuş bir metal çubuğun deri sıcaklığını gözlemleyin. Deri sıcaklığının termal görüntüsünü kullanarak, yüzeydeki sıcaklık dağılımını not edin. Bu ilk sıcaklık gözlemi bir "mikro durumu" temsil eder. İleriki bir zamanda, deri sıcaklığının ikinci bir gözlemi ikinci bir mikro durum üretir. Bu gözlem sürecini devam ettirerek, çubuk yüzeyinin termal geçmişini gösteren bir dizi mikro durum üretmek mümkündür. Bu tarihsel mikro haller serisinin karakterizasyonu, hepsini tek bir grupta başarılı bir şekilde sınıflandıran makro halin seçilmesiyle mümkündür. ⓘ
Termodinamik denge
Bir sistemden enerji transferi durduğunda, bu durum termodinamik denge olarak adlandırılır. Genellikle bu durum, sistem ve çevresinin aynı sıcaklıkta olduğu ve böylece aralarında ısı transferinin gerçekleşmediği anlamına gelir. Aynı zamanda dış kuvvetlerin dengelendiği (hacim değişmez) ve sistem içindeki tüm kimyasal reaksiyonların tamamlandığı anlamına gelir. Bu olaylar için zaman çizelgesi söz konusu sisteme bağlı olarak değişir. Oda sıcaklığında erimeye bırakılan bir kap buz saatler alırken, yarı iletkenlerde cihazın açık durumdan kapalı duruma geçişinde meydana gelen ısı transferi birkaç nanosaniye mertebesinde olabilir. ⓘ
için Kimden
|
Katı | Sıvı | Gaz | Plazma |
|---|---|---|---|---|
| Katı | Erime | Süblimasyon | ||
| Sıvı | Dondurma | Buharlaşma | ||
| Gaz | İfade Alma | Yoğuşma | İyonizasyon | |
| Plazma | Rekombinasyon |
Özellikleri
- Gaz partikülleri noktadaki kütleli, sabit, rastgele ve doğrusal hareket yapar.
- Gaz partikülleri birbirinden çok uzak mesafededirler.
- Tüm çarpışmalar hızlı ve elastiktir.
- Toplam enerji sabit kalır.
- Sıkıştırılabilir.
- Gazları oluşturan atomlar çok hızlı hareket eder. ⓘ








