Fotosentez


Fotosentez, bitkiler ve diğer organizmalar tarafından ışık enerjisini kimyasal enerjiye dönüştürmek için kullanılan ve hücresel solunum yoluyla daha sonra organizmanın faaliyetlerini beslemek için serbest bırakılabilen bir süreçtir. Bu kimyasal enerjinin bir kısmı karbondioksit ve sudan sentezlenen şeker ve nişasta gibi karbonhidrat moleküllerinde depolanır - dolayısıyla fotosentez adı Yunanca phōs (φῶς), "ışık" ve sentez (σύνθεσις), "bir araya getirme" kelimelerinden gelmektedir. Çoğu bitki, alg ve siyanobakteri fotosentez yapar; bu tür organizmalara fotoototroflar denir. Fotosentez, Dünya atmosferinin oksijen içeriğinin üretilmesinden ve korunmasından büyük ölçüde sorumludur ve Dünya'daki yaşam için gerekli enerjinin çoğunu sağlar. ⓘ
Fotosentez farklı türler tarafından farklı şekilde gerçekleştirilse de, süreç her zaman ışıktan gelen enerjinin yeşil klorofil (ve diğer renkli) pigmentler/kromoforlar içeren reaksiyon merkezleri adı verilen proteinler tarafından emilmesiyle başlar. Bitkilerde bu proteinler, yaprak hücrelerinde en bol bulunan kloroplast adı verilen organellerin içinde tutulurken, bakterilerde plazma zarına gömülüdür. Işığa bağlı bu reaksiyonlarda, bir miktar enerji su gibi uygun maddelerden elektron koparmak için kullanılır ve oksijen gazı üretilir. Suyun bölünmesiyle serbest kalan hidrojen, kısa süreli enerji depoları olarak hizmet veren iki bileşiğin daha oluşturulmasında kullanılır ve diğer reaksiyonları yürütmek için transferini sağlar: bu bileşikler, hücrelerin "enerji para birimi" olan indirgenmiş nikotinamid adenin dinükleotid fosfat (NADPH) ve adenosin trifosfattır (ATP). ⓘ
Bitkilerde, alglerde ve siyanobakterilerde şekerler, Calvin döngüsü adı verilen ışıktan bağımsız bir dizi reaksiyonla sentezlenir. Calvin döngüsünde atmosferik karbondioksit, ribuloz bisfosfat (RuBP) gibi halihazırda mevcut olan organik karbon bileşiklerine dahil edilir. Işığa bağlı reaksiyonlar tarafından üretilen ATP ve NADPH kullanılarak, ortaya çıkan bileşikler daha sonra indirgenir ve glikoz gibi başka karbonhidratlar oluşturmak üzere uzaklaştırılır. Diğer bakterilerde, aynı sonuca ulaşmak için ters Krebs döngüsü gibi farklı mekanizmalar kullanılır. ⓘ
İlk fotosentetik organizmalar muhtemelen yaşamın evrimsel tarihinin erken dönemlerinde evrimleşmiştir ve büyük olasılıkla elektron kaynağı olarak su yerine hidrojen veya hidrojen sülfür gibi indirgeyici maddeler kullanmışlardır. Siyanobakteriler daha sonra ortaya çıkmıştır; ürettikleri fazla oksijen, Dünya'nın oksijenlenmesine doğrudan katkıda bulunarak karmaşık yaşamın evrimini mümkün kılmıştır. Bugün, fotosentez yoluyla küresel olarak yakalanan ortalama enerji oranı yaklaşık 130 terawatt'tır; bu da insan uygarlığının mevcut güç tüketiminin yaklaşık sekiz katıdır. Fotosentetik organizmalar ayrıca yılda yaklaşık 100-115 milyar ton (91-104 Pg petagram veya milyar metrik ton) karbonu biyokütleye dönüştürmektedir. Bitkilerin hava, toprak ve suya ek olarak ışıktan da bir miktar enerji aldığı ilk kez 1779 yılında Jan Ingenhousz tarafından keşfedilmiştir. ⓘ
Fotosentez, havadaki karbondioksiti yakaladığı ve daha sonra karbonu bitkilerde, toprakta ve hasat edilen ürünlerde bağladığı için iklim süreçleri için hayati önem taşımaktadır. Sadece tahılların her yıl 3.825 Tg (teragram) veya 3.825 Pg (petagram), yani 3.825 milyar metrik ton karbondioksit bağladığı tahmin edilmektedir. ⓘ

Genel bakış

Fotosentetik organizmaların çoğu fotoototroftur, yani ışıktan gelen enerjiyi kullanarak doğrudan karbondioksit ve sudan gıda sentezleyebilirler. Bununla birlikte, tüm organizmalar fotosentez yapmak için karbon atomu kaynağı olarak karbondioksit kullanmaz; fotoheterotroflar karbon kaynağı olarak karbondioksit yerine organik bileşikler kullanır. Bitkilerde, alglerde ve siyanobakterilerde fotosentez oksijen açığa çıkarır. Bu oksijenik fotosentez, canlı organizmalar tarafından kullanılan en yaygın fotosentez türüdür. Bitkiler, algler ve siyanobakterilerdeki oksijenik fotosentez arasında bazı farklılıklar olmasına rağmen, genel süreç bu organizmalarda oldukça benzerdir. Çoğunlukla bakteriler tarafından kullanılan, karbondioksit tüketen ancak oksijen salmayan birçok anoksijenik fotosentez çeşidi de vardır. ⓘ
Karbondioksit, karbon fiksasyonu adı verilen bir süreçte şekerlere dönüştürülür; fotosentez, karbondioksiti karbonhidratlara dönüştürmek için güneş ışığından enerji alır. Karbon fiksasyonu endotermik bir redoks reaksiyonudur. Genel hatlarıyla, fotosentez hücresel solunumun tersidir: fotosentez karbondioksitin karbonhidratlara indirgenmesi süreciyken, hücresel solunum karbonhidratların veya diğer besin maddelerinin karbondioksite oksidasyonudur. Hücresel solunumda kullanılan besinler arasında karbonhidratlar, amino asitler ve yağ asitleri bulunur. Bu besinler karbondioksit ve su üretmek ve organizmanın metabolizmasını çalıştırmak için kimyasal enerji açığa çıkarmak üzere oksitlenir. Fotosentez ve hücresel solunum, farklı kimyasal reaksiyon dizileri yoluyla ve farklı hücresel bölümlerde gerçekleştikleri için farklı süreçlerdir. ⓘ
Fotosentez için ilk olarak Cornelis van Niel tarafından önerilen genel denklem şöyledir:
- + + → + + ⓘ
Oksijenik fotosentezde elektron donörü olarak su kullanıldığından, bu süreç için denklem şöyledir:
- + + → + + ⓘ
Bu denklem, suyun hem ışığa bağlı reaksiyonda bir reaktan hem de ışıktan bağımsız reaksiyonun bir ürünü olduğunu vurgular, ancak her iki taraftan n su molekülünü iptal etmek net denklemi verir:
- + + → + ⓘ
Diğer süreçler elektron kaynağı rolünde suyun yerine diğer bileşikleri (arsenit gibi) koyar; örneğin bazı mikroplar arseniti arsenata oksitlemek için güneş ışığını kullanır: Bu reaksiyon için denklem şöyledir:
- + + → + (sonraki reaksiyonlarda diğer bileşikleri oluşturmak için kullanılır) ⓘ
Fotosentez iki aşamada gerçekleşir. İlk aşamada, ışığa bağlı reaksiyonlar veya ışık reaksiyonları ışık enerjisini yakalar ve bunu hidrojen taşıyıcı NADPH ve enerji depolama molekülü ATP yapmak için kullanır. İkinci aşamada, ışıktan bağımsız reaksiyonlar bu ürünleri karbondioksiti yakalamak ve azaltmak için kullanır. ⓘ
Oksijenik fotosentezi kullanan organizmaların çoğu ışığa bağlı reaksiyonlar için görünür ışık kullanır, ancak en az üçü kısa dalga kızılötesi veya daha spesifik olarak uzak kırmızı radyasyon kullanır. ⓘ
Bazı organizmalar fotosentezin daha da radikal varyantlarını kullanır. Bazı arkeler, hayvanlarda görme için kullanılanlara benzer bir pigment kullanan daha basit bir yöntem kullanır. Bakteriorhodopsin, bir proton pompası gibi hareket ederek güneş ışığına yanıt olarak konfigürasyonunu değiştirir. Bu, daha doğrudan bir proton gradyanı üretir ve daha sonra kimyasal enerjiye dönüştürülür. Bu süreç karbondioksit fiksasyonunu içermez ve oksijen açığa çıkarmaz ve daha yaygın fotosentez türlerinden ayrı olarak evrimleşmiş gibi görünmektedir. ⓘ
Fotosentez, ışık enerjisini kimyasal bağ enerjisine dönüştürerek ilk basamaktaki organik madde üretimini sağlayan mekanizmadır. Bitkiler besin zincirinin ilk halkasını oluşturduğundan, diğer tüm canlıların var olabilmesi ve yaşamlarını sürdürebilmeleri için gerekli enerji fotosentez olayı sırasında elde edilir. ⓘ
Fotosentezle havanın CO2 ve O2 dengesi korunmaktadır. ⓘ
Fotosenteze ilişkin bulgular, her yeşil bitkinin organik madde üreten bir fabrika olduğu, bu süreçte güneş enerjisini kullanan aygıtların kloroplastlar olduğunu göstermiştir. Yeryüzüne ulaşan güneş ışınlarının yalnızca yarısı fotosentezde kullanılmaktadır. Bu konuda yapılan araştırmaların dünya nüfusunun gıda ihtiyaçları yönünden önemli olduğu bilinmektedir. ⓘ
Fotosentetik membranlar ve organeller

- dış membran
- zarlar arası boşluk
- iç zar (1+2+3: zarf)
- stroma (aköz sıvı)
- tilakoid lümen (tilakoidin içi)
- tilakoid membran
- granum (thylakoid yığını)
- thylakoid (lamel)
- nişasta
- ribozom
- plastidial DNA
- plastoglobül (lipid damlası) ⓘ
Fotosentetik bakterilerde, fotosentez için ışığı toplayan proteinler hücre zarlarına gömülüdür. En basit şekliyle bu, hücrenin kendisini çevreleyen zarı içerir. Ancak zar, tilakoid adı verilen silindirik tabakalar halinde sıkıca katlanabilir veya intrasitoplazmik zar adı verilen yuvarlak kesecikler halinde toplanabilir. Bu yapılar bir hücrenin iç kısmının çoğunu doldurarak zara çok geniş bir yüzey alanı kazandırabilir ve dolayısıyla bakterinin emebileceği ışık miktarını artırabilir. ⓘ
Bitkilerde ve alglerde fotosentez, kloroplast adı verilen organellerde gerçekleşir. Tipik bir bitki hücresi yaklaşık 10 ila 100 kloroplast içerir. Kloroplast bir zar ile çevrilidir. Bu zar bir fosfolipid iç zar, bir fosfolipid dış zar ve bir zarlar arası boşluktan oluşur. Membran tarafından çevrelenen, stroma adı verilen sulu bir sıvıdır. Stroma içinde fotosentezin gerçekleştiği yer olan tilakoid (grana) yığınları bulunur. Tilakoidler düzleştirilmiş diskler olarak görünür. Tilakoidin kendisi tilakoid membran tarafından çevrelenmiştir ve kapalı hacim içinde bir lümen veya tilakoid boşluk bulunur. Tilakoid membrana gömülü olarak fotosentetik sistemin integral ve periferik membran protein kompleksleri bulunur. ⓘ
Bitkiler ışığı öncelikle klorofil pigmentini kullanarak emer. Işık spektrumunun yeşil kısmı emilmez ancak yansıtılır, bu da çoğu bitkinin yeşil bir renge sahip olmasının nedenidir. Bitkiler klorofilin yanı sıra karotenler ve ksantofiller gibi pigmentler de kullanırlar. Algler de klorofil kullanır, ancak yeşil alglerde fikosiyanin, karotenler ve ksantofiller, kırmızı alglerde (rodofitler) fikoeritrin ve kahverengi alglerde ve diyatomlarda fukoksantin gibi çok çeşitli renklere neden olan çeşitli başka pigmentler de mevcuttur. ⓘ
Bu pigmentler bitkilerde ve alglerde anten proteinleri adı verilen kompleksler içine gömülüdür. Bu tür proteinlerde pigmentler birlikte çalışacak şekilde düzenlenmiştir. Böyle bir protein kombinasyonuna ışık toplama kompleksi de denir. ⓘ
Bir bitkinin yeşil kısımlarındaki tüm hücreler kloroplastlara sahip olsa da, bunların çoğu yaprak adı verilen özel olarak uyarlanmış yapılarda bulunur. Birçok sütleğen ve kaktüs türü gibi güçlü güneş ışığı ve kuraklık koşullarına adapte olmuş bazı türlerin ana fotosentetik organları gövdelerindedir. Bir yaprağın mezofil adı verilen iç dokularındaki hücreler, yaprağın her milimetre karesi için 450.000 ila 800.000 kloroplast içerebilir. Yaprağın yüzeyi, yaprağı aşırı su buharlaşmasından koruyan ve ısınmayı en aza indirmek için ultraviyole veya mavi ışığın emilimini azaltan suya dayanıklı mumsu bir kütikül ile kaplıdır. Şeffaf epidermis tabakası, ışığın fotosentezin çoğunun gerçekleştiği palisade mezofil hücrelerine geçmesine izin verir. ⓘ

Fotosentezde en önemli olgu güneş enerjisini yakalayıp onu kimyasal bağ enerjisine dönüştürebilme yeteneğidir. Bu işlevi bitkilerin kloroplastlarında veya kromatoforlarında bulunan pigmentler yapmaktadır. Bunların başlıcaları şöyledir:
- Klorofiller
- Karotenoidler
- Fikobilinler ⓘ
Işığa bağlı reaksiyonlar

Işığa bağlı reaksiyonlarda, klorofil pigmentinin bir molekülü bir foton emer ve bir elektron kaybeder. Bu elektron, feofitin adı verilen modifiye edilmiş bir klorofil formu tarafından alınır ve elektronu bir kinon molekülüne aktararak, NADP'nin NADPH'ye nihai indirgenmesine yol açan bir elektron taşıma zincirinde elektron akışını başlatır. Ayrıca bu, ATP sentaz tarafından ATP sentezinde kullanılan kloroplast membranı boyunca bir proton gradyanı (enerji gradyanı) oluşturur. Klorofil molekülü, fotoliz adı verilen ve oksijeni serbest bırakan bir süreçte bir su molekülü bölündüğünde kaybettiği elektronu nihayetinde geri kazanır. ⓘ
Yeşil bitkilerdeki döngüsel olmayan elektron akışı koşulları altında ışığa bağlı reaksiyonlar için genel denklem şöyledir:
Işığın tüm dalga boyları fotosentezi destekleyemez. Fotosentetik etki spektrumu, mevcut aksesuar pigmentlerin türüne bağlıdır. Örneğin, yeşil bitkilerde eylem spektrumu, mor-mavi ve kırmızı ışıkta emilim zirveleri olan klorofiller ve karotenoidler için emilim spektrumuna benzer. Kırmızı alglerde etki spektrumu mavi-yeşil ışıktır, bu da bu alglerin toprak üstü yeşil bitkiler tarafından kullanılan daha uzun dalga boylarını (kırmızı ışık) filtreleyen daha derin sularda büyümek için spektrumun mavi ucunu kullanmasına olanak tanır. Işık spektrumunun emilmeyen kısmı, fotosentetik organizmalara renklerini veren şeydir (örneğin, yeşil bitkiler, kırmızı algler, mor bakteriler) ve ilgili organizmalarda fotosentez için en az etkili olanıdır. ⓘ
Z şeması
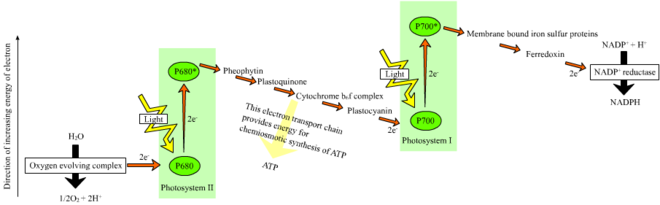
Bitkilerde ışığa bağlı reaksiyonlar, ATP ve NADPH sentezini yönlendirdikleri kloroplastların tilakoid membranlarında meydana gelir. Işığa bağlı reaksiyonlar iki şekildedir: döngüsel ve döngüsel olmayan. ⓘ
Döngüsel olmayan reaksiyonda, fotonlar fotosistem II'nin ışık hasat eden anten komplekslerinde klorofil ve diğer aksesuar pigmentler tarafından yakalanır (sağdaki şemaya bakınız). Bir fotonun anten kompleksi tarafından emilmesi, fotoindüklenmiş yük ayrımı adı verilen bir işlemle bir elektronu gevşetir. Anten sistemi, fotosistem II reaksiyon merkezinin klorofil molekülünün çekirdeğinde yer alır. Bu gevşemiş elektron, birincil elektron alıcı molekül olan feofitin tarafından alınır. Elektronlar bir elektron taşıma zinciri (şemada gösterilen Z-şeması) aracılığıyla taşınırken, proton katyonları (H+) zar boyunca ve tilakoid boşluğa pompalanarak bir kemiyozmotik potansiyel oluşturulur. Bir ATP sentaz enzimi fotofosforilasyon sırasında ATP yapmak için bu kemiyosmotik potansiyeli kullanır, NADPH ise Z-şemasındaki terminal redoks reaksiyonunun bir ürünüdür. Elektron Fotosistem I'deki bir klorofil molekülüne girer ve orada fotosistem tarafından emilen ışık tarafından daha da uyarılır. Elektron daha sonra enerjisinin bir kısmını aktardığı bir elektron alıcıları zinciri boyunca iletilir. Elektron alıcılarına iletilen enerji, hidrojen iyonlarını tilakoid membran boyunca lümene taşımak için kullanılır. Elektron sonunda ko-enzim NADP'yi bir H+ ile NADPH'ye (ışıktan bağımsız reaksiyonda işlevleri olan) indirgemek için kullanılır; bu noktada elektronun yolu sona erer. ⓘ
Döngüsel reaksiyon döngüsel olmayan reaksiyona benzer ancak sadece ATP üretmesi ve indirgenmiş NADP (NADPH) yaratmaması bakımından farklılık gösterir. Döngüsel reaksiyon sadece fotosistem I'de gerçekleşir. Elektron fotosistemden çıktıktan sonra, elektron alıcı moleküllerden aşağıya geçer ve yayıldığı fotosistem I'e geri döner, dolayısıyla döngüsel reaksiyon adını alır. ⓘ
Su fotolizi
Bir fotosistem boyunca doğrusal elektron taşınımı, fotosistemin reaksiyon merkezini oksitlenmiş halde bırakacaktır. Başka bir elektronun yükseltilmesi için önce reaksiyon merkezinin yeniden indirgenmesi gerekir. Fotosistem I'in reaksiyon merkezinden (P700) kaybedilen uyarılmış elektronlar, elektronları fotosistem II yoluyla elektron taşınımından gelen plastosiyaninden transfer ile değiştirilir. Fotosistem II, Z-şemasının ilk adımı olarak, oksitlenmiş klorofil a reaksiyon merkezini indirgemek için harici bir elektron kaynağına ihtiyaç duyar. Yeşil bitkiler ve siyanobakterilerde fotosentez için elektron kaynağı sudur. İki su molekülü, fotosistem II'nin birbirini izleyen dört yük ayırma reaksiyonunun enerjisiyle oksitlenerek bir diyatomik oksijen molekülü ve dört hidrojen iyonu verir. Elde edilen elektronlar, P680+ enerjisi ile oksitlenen redoks aktif bir tirozin kalıntısına aktarılır. Bu, P680'in başka bir fotonu absorbe etme ve başka bir foto-ayrışmış elektronu serbest bırakma yeteneğini sıfırlar. Suyun oksidasyonu fotosistem II'de dört manganez iyonu ve bir kalsiyum iyonu içeren redoks aktif bir yapı tarafından katalize edilir; bu oksijen geliştirici kompleks iki su molekülünü bağlar ve su oksitleme reaksiyonunu yürütmek için kullanılan dört oksitleyici eşdeğeri içerir (Kok'un S-hali diyagramları). Hidrojen iyonları tilakoid lümeninde serbest bırakılır ve bu nedenle ATP sentezine yol açan transmembran kemiyozmotik potansiyele katkıda bulunur. Oksijen ışığa bağlı reaksiyonların atık ürünüdür, ancak fotosentetik organizmalar da dahil olmak üzere Dünya üzerindeki organizmaların çoğu oksijeni ve enerjisini hücresel solunum için kullanır. ⓘ
Işıktan bağımsız reaksiyonlar
Kalvin döngüsü
Işıktan bağımsız (veya "karanlık") reaksiyonlarda, RuBisCO enzimi atmosferden CO2 yakalar ve Calvin döngüsü adı verilen bir süreçte yeni oluşan NADPH'yi kullanır ve daha sonra sükroz ve nişasta oluşturmak üzere birleştirilen üç karbonlu şekerleri serbest bırakır. Yeşil bitkilerdeki ışıktan bağımsız reaksiyonlar için genel denklem şöyledir ⓘ

Karbon fiksasyonu üç karbonlu şeker ara ürününü üretir ve bu ara ürün daha sonra nihai karbonhidrat ürünlerine dönüştürülür. Fotosentezle üretilen basit karbonlu şekerler daha sonra yapı malzemesi selüloz, lipid ve amino asit biyosentezinin öncüleri gibi diğer organik bileşikleri oluşturmak için veya hücresel solunumda yakıt olarak kullanılır. Sonuncusu sadece bitkilerde değil, bitkilerden gelen karbon ve enerji bir besin zincirinden geçtiğinde hayvanlarda da meydana gelir. ⓘ
Karbondioksitin fiksasyonu veya indirgenmesi, karbondioksitin beş karbonlu bir şeker olan ribuloz 1,5-bisfosfat ile birleşerek iki molekül üç karbonlu bir bileşik olan gliserat 3-fosfat (3-fosfogliserat olarak da bilinir) verdiği bir süreçtir. Gliserat 3-fosfat, ışığa bağımlı aşamalar sırasında üretilen ATP ve NADPH varlığında gliseraldehit 3-fosfata indirgenir. Bu ürün aynı zamanda 3-fosfogliseraldehit (PGAL) veya daha genel olarak trioz fosfat olarak da adlandırılır. Üretilen gliseraldehit 3-fosfatın çoğu (6 molekülden 5'i) ribuloz 1,5-bisfosfatı yeniden oluşturmak için kullanılır, böylece süreç devam edebilir. Bu şekilde "geri dönüştürülmeyen" trioz fosfatlar genellikle yoğunlaşarak heksoz fosfatları oluşturur ve sonuçta sükroz, nişasta ve selüloz elde edilir. Karbon metabolizması sırasında üretilen şekerler, amino asit ve lipid üretimi gibi diğer metabolik reaksiyonlar için kullanılabilecek karbon iskeletleri verir. ⓘ
Karbon yoğunlaştırma mekanizmaları
Karada

Sıcak ve kuru koşullarda bitkiler su kaybını önlemek için stomalarını kapatırlar. Bu koşullar altında, CO2 azalacak ve fotosentezin ışık reaksiyonları tarafından üretilen oksijen gazı artacak, ribuloz-1,5-bisfosfat karboksilaz/oksijenazın oksijenaz aktivitesi ile fotorespirasyonun artmasına ve karbon fiksasyonunun azalmasına neden olacaktır. Bazı bitkiler bu koşullar altında yapraklardaki CO2 konsantrasyonunu artıracak mekanizmalar geliştirmiştir. ⓘ
C4 karbon sabitleme sürecini kullanan bitkiler, mezofil hücrelerindeki karbondioksiti, PEP karboksilaz adı verilen bir enzim tarafından katalize edilen bir reaksiyonla üç karbonlu molekül fosfoenolpirüvata (PEP) ekleyerek kimyasal olarak sabitler ve dört karbonlu organik asit oksaloasetik asit oluşturur. Bu işlemle sentezlenen oksaloasetik asit veya malat daha sonra RuBisCO enziminin ve diğer Calvin döngüsü enzimlerinin bulunduğu ve dört karbonlu asitlerin dekarboksilasyonuyla açığa çıkan CO2'nin RuBisCO aktivitesi tarafından üç karbonlu 3-fosfogliserik asitlere sabitlendiği özelleşmiş demet kılıfı hücrelerine taşınır. RuBisCO'nun oksijen üreten ışık reaksiyonlarından fiziksel olarak ayrılması fotorespirasyonu azaltır ve CO2 fiksasyonunu ve dolayısıyla yaprağın fotosentetik kapasitesini artırır. C4 bitkileri yüksek ışık ve sıcaklık koşullarında C3 bitkilerinden daha fazla şeker üretebilir. Mısır, sorgum, şeker kamışı ve darı dahil olmak üzere birçok önemli mahsul bitkisi C4 bitkisidir. Karbon fiksasyonunda PEP-karboksilaz kullanmayan bitkiler C3 bitkileri olarak adlandırılır çünkü RuBisCO tarafından katalize edilen birincil karboksilasyon reaksiyonu, Calvin-Benson döngüsünde doğrudan üç karbonlu 3-fosfogliserik asitleri üretir. Bitkilerin %90'ından fazlası C3 karbon fiksasyonu kullanırken, %3'ü C4 karbon fiksasyonu kullanır; ancak C4'ün 60'tan fazla bitki soyunda evrimleşmesi, onu yakınsak evrimin çarpıcı bir örneği haline getirir. Fotorespiratuar glisinin seçici olarak parçalanması yoluyla karbon konsantrasyonunu içeren C2 fotosentezi, hem C4'ün evrimsel bir öncüsü hem de kendi başına yararlı bir CCM'dir. ⓘ
Kaktüsler ve çoğu sulu meyveler gibi kserofitler de Crassulacean asit metabolizması (CAM) adı verilen bir süreçte karbondioksiti yakalamak için PEP karboksilaz kullanır. PEP'e CO2 fiksasyonunu Calvin döngüsünden mekansal olarak ayıran C4 metabolizmasının aksine, CAM bu iki süreci zamansal olarak ayırır. CAM bitkileri C3 bitkilerinden farklı bir yaprak anatomisine sahiptir ve CO2'yi stomaları açıkken geceleri sabitler. CAM bitkileri CO2'yi çoğunlukla fosfoenolpiruvatın oksaloasetata karboksilasyonu yoluyla malik asit formunda depolar, bu da daha sonra malata indirgenir. Gün boyunca malatın dekarboksilasyonu yaprakların içindeki CO2'yi serbest bırakır, böylece RuBisCO tarafından 3-fosfogliserata karbon fiksasyonuna izin verir. CAM 16.000 bitki türü tarafından kullanılmaktadır. ⓘ
Amaranthus hybridus ve Colobanthus quitensis gibi kalsiyum oksalat biriktiren bitkiler, stomalar kısmen veya tamamen kapalı olduğunda fotosentetik hücrelere karbondioksit (CO2) sağlayarak kalsiyum oksalat kristallerinin dinamik karbon havuzları olarak işlev gördüğü bir fotosentez çeşidi gösterir. Bu süreç Alarm fotosentezi olarak adlandırılmıştır. Stres koşulları altında (örneğin su eksikliği) kalsiyum oksalat kristallerinden salınan oksalat, bir oksalat oksidaz enzimi tarafından CO2'ye dönüştürülür ve üretilen CO2, Calvin döngüsü reaksiyonlarını destekleyebilir. Oksalat oksidaz reaksiyonunun yan ürünü olan reaktif hidrojen peroksit (H2O2) katalaz ile nötralize edilebilir. Alarm fotosentezi, iyi bilinen C4 ve CAM yollarına eklenecek bir fotosentetik varyantı temsil eder. Bununla birlikte, alarm fotosentezi, bu yolların aksine, karbonu atmosferden değil organın içinden (veya topraktan) toplayan bir biyokimyasal pompa olarak çalışır. ⓘ
Su içinde
Siyanobakteriler, fotosentez hızını artırmak için RuBisCO etrafındaki CO2 konsantrasyonunu artıran karboksizomlara sahiptir. Karboksizom içinde bulunan bir enzim, karbonik anhidraz, CO2'yi çözünmüş hidrokarbonat iyonlarından (HCO-
3). CO2 dışarı yayılmadan önce, karboksizomlar içinde yoğunlaşmış olan RuBisCO tarafından hızla süngerleştirilir. HCO-
3 iyonları başka bir karbonik anhidraz tarafından hücre dışındaki CO2'den yapılır ve bir membran proteini tarafından aktif olarak hücre içine pompalanır. Yüklü oldukları için zarı geçemezler ve sitozol içinde karbonik anhidrazın yardımı olmadan çok yavaş bir şekilde CO2'ye geri dönerler. Bu da HCO-
3 iyonlarının karboksizomlara difüze oldukları yerden hücre içinde birikmesini sağlar. Algler ve boynuzotlarındaki pirenoidler de CO2'yi RuBisCO etrafında yoğunlaştırmak için hareket eder. ⓘ
Düzen ve kinetik
Fotosentezin genel süreci dört aşamada gerçekleşir:
| Aşama | Açıklama | Zaman ölçeği ⓘ |
|---|---|---|
| 1 | Anten klorofilinde enerji transferi (tilakoid membranlar) | Femtosaniyeden pikosaniyeye |
| 2 | Fotokimyasal reaksiyonlarda elektron transferi (tilakoid membranlar) | Pikosaniyeden nanosaniyeye |
| 3 | Elektron taşıma zinciri ve ATP sentezi (tilakoid membranlar) | Mikrosaniyeden milisaniyeye |
| 4 | Karbon fiksasyonu ve stabil ürünlerin ihracatı | Milisaniyeden saniyeye |
Verimlilik
Bitkiler genellikle ışığı %3-6'lık bir fotosentetik verimlilikle kimyasal enerjiye dönüştürür. Dönüştürülmeden emilen ışık öncelikle ısı olarak dağılır ve küçük bir kısmı (%1-2) daha uzun (daha kırmızı) dalga boylarında klorofil floresanı olarak yeniden yayılır. Bu gerçek, klorofil florometreleri kullanılarak fotosentezin ışık reaksiyonunun ölçülmesini sağlar. ⓘ
Gerçek bitkilerin fotosentetik verimliliği dönüştürülen ışığın frekansına, ışık yoğunluğuna, sıcaklığa ve atmosferdeki karbondioksit oranına göre değişir ve %0,1 ila %8 arasında değişebilir. Buna karşılık güneş panelleri, seri üretim paneller için yaklaşık %6-20, laboratuvar cihazlarında ise %40'ın üzerinde bir verimlilikle ışığı elektrik enerjisine dönüştürmektedir. Bilim insanları, verimi artırılmış bitkiler geliştirme umuduyla fotosentez üzerinde çalışmaktadır. ⓘ
Hem aydınlık hem de karanlık reaksiyonların verimliliği ölçülebilir ancak ikisi arasındaki ilişki karmaşık olabilir. Örneğin, ışık reaksiyonu tarafından oluşturulan ATP ve NADPH enerji molekülleri karbon fiksasyonu veya C3 bitkilerinde fotorespirasyon için kullanılabilir. Elektronlar diğer elektron alıcılarına da akabilir. Bu nedenle, yazarların fotorespirasyon olmayan koşullar altında ve fotorespirasyon koşulları altında yapılan işler arasında ayrım yapmaları nadir değildir. ⓘ
Fotosistem II'nin klorofil floresanı ışık reaksiyonunu ölçebilir ve kızılötesi gaz analizörleri karanlık reaksiyonu ölçebilir. Entegre bir klorofil florometresi ve gaz değişim sistemi kullanarak veya iki ayrı sistemi birlikte kullanarak her ikisini aynı anda araştırmak da mümkündür. Kızılötesi gaz analizörleri ve bazı nem sensörleri, güvenilir yöntemler kullanarak CO2 ve ΔH2O'nun fotosentetik asimilasyonunu ölçmek için yeterince hassastır CO2 genellikle μmol/(m2/s), milyonda parça veya milyonda hacim cinsinden ve H2O genellikle mmol/(m2/s) veya mbar cinsinden ölçülür. CO2 asimilasyonu, ΔH2O, yaprak sıcaklığı, barometrik basınç, yaprak alanı ve fotosentetik olarak aktif radyasyon veya PAR ölçülerek, "A" veya karbon asimilasyonu, "E" veya transpirasyon, "gs" veya stoma iletkenliği ve Ci veya hücre içi CO2 tahmin etmek mümkün hale gelir. Bununla birlikte, en yaygın olarak kullanılan FV/FM ve Y(II) veya F/FM' parametreleri birkaç saniye içinde ölçülebildiğinden ve daha büyük bitki popülasyonlarının incelenmesine olanak sağladığından, uygun olduğunda bitki stresi ölçümü için klorofil floresanının kullanılması daha yaygındır. ⓘ
Ortamın üstünde ve altında CO2 seviyelerinin kontrolünü sağlayan gaz değişim sistemleri, bir bitkinin fotosentetik tepkisini karakterize etmek için farklı CO2 seviyelerinde A/Ci eğrilerinin ölçümünün yaygın olarak uygulanmasına izin verir. ⓘ
Entegre klorofil florometre - gaz değişim sistemleri, fotosentetik tepki ve mekanizmaların daha hassas bir şekilde ölçülmesini sağlar. Standart gaz değişim fotosentez sistemleri Ci veya substomatal CO2 seviyelerini ölçebilirken, entegre klorofil floresan ölçümlerinin eklenmesi, Ci'nin yerine CC'nin daha hassas bir şekilde ölçülmesini sağlar. Kloroplasttaki karboksilasyon bölgesinde veya CC'de CO2 tahmini, entegre bir sistem kullanılarak mezofil iletkenliği veya gm ölçümü ile mümkün hale gelir. ⓘ
Fotosentez ölçüm sistemleri, yaprak tarafından emilen ışık miktarını doğrudan ölçmek için tasarlanmamıştır. Ancak klorofil-floresans, P700- ve P515-absorbans ve gaz değişimi ölçümlerinin analizi, örneğin fotosistemler, kuantum verimliliği ve CO2 asimilasyon oranları hakkında ayrıntılı bilgiler ortaya koyar. Bazı cihazlarla fotosentetik verimliliğin dalga boyuna bağımlılığı bile analiz edilebilir. ⓘ
Kuantum yürüyüşü olarak bilinen bir olgu, ışığın enerji taşıma verimliliğini önemli ölçüde artırır. Bir alg, bakteri veya bitkinin fotosentetik hücresinde, fotokompleks adı verilen anten şeklindeki bir yapıda düzenlenmiş kromofor adı verilen ışığa duyarlı moleküller vardır. Bir foton bir kromofor tarafından emildiğinde, eksiton olarak adlandırılan ve enerjisini hücrenin metabolizması için erişilebilir bir kimyasal formda hapseden bir molekül koleksiyonu olan fotokompleksin reaksiyon merkezine doğru kromofordan kromofora atlayan bir kuasipartiküle dönüştürülür. Eksitonun dalga özellikleri, daha geniş bir alanı kaplamasını ve aynı anda birkaç olası yolu denemesini sağlayarak, hedefine mümkün olan en kısa sürede varma olasılığının en yüksek olduğu en verimli rotayı anında "seçmesine" olanak tanır. ⓘ
Bu kuantum yürüyüşü, kuantum olaylarının genellikle meydana geldiğinden çok daha yüksek sıcaklıklarda gerçekleştiğinden, yalnızca çok kısa mesafelerde mümkündür. Yıkıcı girişim şeklindeki engeller parçacığın dalga özelliklerini bir anlığına kaybetmesine neden olur, ardından klasik bir "zıplama" yoluyla kilitli konumundan kurtulduktan sonra tekrar kazanır. Elektronun fotoğraf merkezine doğru hareketi bu nedenle bir dizi geleneksel sıçrama ve kuantum yürüyüşü ile gerçekleşir. ⓘ
Evrim
Yaşam zaman çizelgesi ⓘ | ||||||||||||||||||||||||||||||||||||||||||||||
−4500 — – — – −4000 — – — – −3500 — – — – −3000 — – — – −2500 — – — – −2000 — – — – −1500 — – — – −1000 — – — – −500 — – — – 0 — | Su Tek hücreli yaşam Fotosentez Çok hücreli yaşam P l a n t s Eklembacaklılar Yumuşakçalar Çiçekler H a d e a n A r c h e a n P r o t e r o z o i c P h a n e r o z o i c |
| ||||||||||||||||||||||||||||||||||||||||||||
(milyon yıl önce) *Buz Çağları | ||||||||||||||||||||||||||||||||||||||||||||||
Yeşil ve mor sülfürlü ve yeşil ve mor sülfürsüz bakterilerdeki gibi erken fotosentetik sistemlerin anoksijenik olduğu ve elektron vericisi olarak sudan başka çeşitli moleküller kullandığı düşünülmektedir. Yeşil ve mor sülfür bakterilerinin elektron vericisi olarak hidrojen ve sülfür kullandığı düşünülmektedir. Yeşil kükürtsüz bakteriler elektron vericisi olarak çeşitli amino ve diğer organik asitleri kullanmıştır. Mor kükürtsüz bakteriler çeşitli spesifik olmayan organik moleküller kullanmıştır. Bu moleküllerin kullanımı, Dünya'nın erken atmosferinin o dönemde oldukça indirgeyici olduğuna dair jeolojik kanıtlarla tutarlıdır. ⓘ
İpliksi fotosentetik organizmalar olduğu düşünülen fosiller 3,4 milyar yıl öncesine tarihlendirilmiştir. Daha yeni çalışmalar da fotosentezin yaklaşık 3,4 milyar yıl önce başlamış olabileceğini göstermektedir. ⓘ
Dünya atmosferindeki oksijenin ana kaynağı oksijenik fotosentezden kaynaklanmaktadır ve bunun ortaya çıkışı bazen oksijen felaketi olarak adlandırılmaktadır. Jeolojik kanıtlar, siyanobakterilerde olduğu gibi oksijenik fotosentezin yaklaşık 2 milyar yıl önce Paleoproterozoik dönemde önemli hale geldiğini göstermektedir. Bitkilerdeki ve çoğu fotosentetik prokaryottaki modern fotosentez oksijeniktir ve fotosentetik reaksiyon merkezinde moleküler oksijene oksitlenen bir elektron donörü olarak suyu kullanır. ⓘ
Simbiyoz ve kloroplastların kökeni

Çeşitli hayvan grupları fotosentetik alglerle simbiyotik ilişkiler kurmuştur. Bunlar en yaygın olarak mercanlar, süngerler ve deniz anemonlarında görülür. Bunun, bu hayvanların özellikle basit vücut planlarından ve hacimlerine kıyasla geniş yüzey alanlarından kaynaklandığı tahmin edilmektedir. Buna ek olarak, birkaç deniz yumuşakçası Elysia viridis ve Elysia chlorotica da diyetlerindeki alglerden yakaladıkları ve daha sonra vücutlarında depoladıkları kloroplastlarla simbiyotik bir ilişki sürdürmektedir (bkz. Kleptoplasti). Bu, yumuşakçaların bir seferde birkaç ay boyunca yalnızca fotosentez yaparak hayatta kalmalarını sağlar. Hatta bitki hücresi çekirdeğindeki bazı genler sümüklü böceklere aktarılmıştır, böylece kloroplastlar hayatta kalmak için ihtiyaç duydukları proteinlerle beslenebilmektedir. ⓘ
Daha da yakın bir simbiyoz şekli kloroplastların kökenini açıklayabilir. Kloroplastlar fotosentetik bakterilerle dairesel kromozom, prokaryotik tip ribozom ve fotosentetik reaksiyon merkezindeki benzer proteinler de dahil olmak üzere birçok benzerliğe sahiptir. Endosimbiyotik teori, fotosentetik bakterilerin ilk bitki hücrelerini oluşturmak için erken ökaryotik hücreler tarafından (endositoz yoluyla) alındığını öne sürer. Bu nedenle, kloroplastlar bitki hücreleri içindeki yaşama adapte olmuş fotosentetik bakteriler olabilir. Mitokondri gibi, kloroplastlar da bitki konak hücrelerinin nükleer DNA'sından ayrı olarak kendi DNA'larına sahiptir ve bu kloroplast DNA'sındaki genler siyanobakterilerde bulunanlara benzer. Kloroplastlardaki DNA, fotosentetik reaksiyon merkezlerinde bulunanlar gibi redoks proteinlerini kodlar. CoRR Hipotezi, genlerin gen ürünleriyle birlikte bu şekilde konumlandırılmasının gen ifadesinin redoks düzenlemesi için gerekli olduğunu ve DNA'nın biyoenerjetik organellerde kalıcılığını açıkladığını öne sürmektedir. ⓘ
Fotosentetik ökaryotik soylar
Simbiyotik ve kleptoplastik organizmalar hariçtir:
- Glaucophytes ve kırmızı ve yeşil alg kladları Archaeplastida (tek ve çok hücreli)
- Cryptophytes sınıfı Cryptista (tek hücreliler)
- Haptophytes-clade Haptista (tek hücreli)
- Myzozoa süper filumundaki dinoflagellatlar ve kromeridler - Alveolata sınıfı (tek hücreliler)
- Okrofit sınıfı Heterokonta (tek ve çok hücreli)
- Cercozoa filumu Rhizaria (tek hücreliler) sınıfındaki klorarachniophytes ve 3 Paulinella türü
- Euglenids-clade Excavata (tek hücreliler) ⓘ
Excavata içinde bulunan öglenidler hariç, bunların hepsi Diaphoretickes'e aittir. Archaeplastida ve fotosentetik Paulinella, iki zarla çevrili plastidlerini iki ayrı olayda bir siyanobakteriyi yutarak birincil endosimbiyoz yoluyla almıştır. Diğer tüm gruplardaki plastidler ya kırmızı ya da yeşil alg kökenlidir ve "kırmızı soylar" ve "yeşil soylar" olarak adlandırılır. Dinoflagellatlar ve öglenidlerde plastidler üç zarla, diğer soylarda ise dört zarla çevrilidir. Plastidin iç ve dış zarları arasında yer alan orijinal alg çekirdeğinin kalıntıları olan bir nükleomorf, kriptofitlerde (kırmızı algden) ve klorarakniyofitlerde (yeşil algden) mevcuttur. Fotosentetik yeteneklerini kaybeden bazı dinoflaggelatlar daha sonra farklı alglerle yeni endosimbiyotik olaylar yoluyla bu yeteneklerini tekrar kazanmıştır. Fotosentez yapabilmelerine rağmen, bu ökaryotik grupların çoğu miksotroftur ve çeşitli derecelerde heterotrofi uygularlar. ⓘ
Siyanobakteriler ve fotosentezin evrimi
Fotosentezde elektron kaynağı olarak suyu kullanma biyokimyasal kapasitesi, oksijenik fotosentez yapan tek prokaryot olan siyanobakterilerin (eski adıyla mavi-yeşil algler) ortak atasında bir kez evrimleşmiştir. Jeolojik kayıtlar, bu dönüşüm olayının Dünya tarihinin erken dönemlerinde, en az 2450-2320 milyon yıl önce (Ma) ve tahminlere göre çok daha önce gerçekleştiğini göstermektedir. Fotosentezin tahmini gelişimi sırasında Dünya atmosferi neredeyse hiç oksijen içermediğinden, ilk fotosentetik siyanobakterilerin oksijen üretmediğine inanılmaktadır. Archean (>2500 Ma) tortul kayaçlarının jeobiyolojik çalışmalarından elde edilen mevcut kanıtlar, yaşamın 3500 Ma'da var olduğunu göstermektedir, ancak oksijenik fotosentezin ne zaman geliştiği sorusu hala cevaplanmamıştır. Siyanobakteriyel evrime ilişkin net bir paleontolojik pencere yaklaşık 2000 Ma'da açılmış ve çok çeşitli bir siyanobakteri biyotası ortaya çıkmıştır. Siyanobakteriler, kısmen okyanusların redoks yapısının azot fiksasyonu yapabilen fotoototrofları desteklemesi nedeniyle Proterozoik Eon (2500-543 Ma) boyunca oksijenin başlıca birincil üreticileri olarak kaldı. Yeşil algler, Proterozoik'in sonlarına doğru kıta sahanlıklarında oksijenin başlıca birincil üreticileri olarak siyanobakterilere katıldı, ancak yalnızca dinoflagellatlar, kokolitoforidler ve diyatomların Mezozoik (251-66 Ma) yayılımları ile deniz sahanlığı sularında birincil oksijen üretimi modern şeklini aldı. Siyanobakteriler, okyanus girdaplarında birincil oksijen üreticileri, biyolojik azot fiksasyonunun ajanları ve değiştirilmiş formda deniz alglerinin plastidleri olarak deniz ekosistemleri için kritik olmaya devam etmektedir. ⓘ
Deneysel tarihçe
Keşif
Fotosentezdeki bazı adımlar hala tam olarak anlaşılamamış olsa da, genel fotosentetik denklem 19. yüzyıldan beri bilinmektedir. ⓘ

Jan van Helmont, 17. yüzyılın ortalarında bir bitkinin kullandığı toprağın kütlesini ve büyüdükçe bitkinin kütlesini dikkatlice ölçtüğünde süreci araştırmaya başladı. Toprak kütlesinin çok az değiştiğini fark ettikten sonra, büyüyen bitkinin kütlesinin, saksıdaki bitkiye eklediği tek madde olan sudan gelmesi gerektiğini varsaydı. Hipotezi kısmen doğruydu - kazanılan kütlenin çoğu suyun yanı sıra karbondioksitten de geliyordu. Ancak bu, bir bitkinin biyokütlesinin büyük kısmının toprağın kendisinden değil fotosentez girdilerinden geldiği fikrine işaret eden bir noktaydı. ⓘ
Bir kimyager ve papaz olan Joseph Priestley, ters çevrilmiş bir kavanozun altında bir miktar havayı izole edip içinde bir mum yaktığında (ki bu mum CO2 yayar), mumun balmumu bitmeden çok önce çok hızlı bir şekilde yandığını keşfetti. Ayrıca bir farenin de benzer şekilde havayı "yaralayabildiğini" keşfetti. Daha sonra mum ve fare tarafından "yaralanan" havanın bir bitki tarafından eski haline getirilebileceğini gösterdi. ⓘ
1779'da Jan Ingenhousz, Priestley'in deneylerini tekrarladı. Bir farenin birkaç saat içinde canlanmasına neden olan şeyin güneş ışığının bitki üzerindeki etkisi olduğunu keşfetti. ⓘ
1796 yılında İsviçreli bir papaz, botanikçi ve doğa bilimci olan Jean Senebier, yeşil bitkilerin ışığın etkisi altında karbondioksit tükettiğini ve oksijen saldığını gösterdi. Kısa bir süre sonra Nicolas-Théodore de Saussure, bitki büyüdükçe kütlesindeki artışın sadece CO2 alımından değil, aynı zamanda su katılımından da kaynaklanabileceğini gösterdi. Böylece, fotosentezin gıda (glikoz gibi) üretmek için kullanıldığı temel reaksiyon ana hatlarıyla belirlenmiş oldu. ⓘ
İyileştirmeler
Cornelis Van Niel fotosentezin kimyasını açıklayan önemli keşifler yapmıştır. Mor sülfür bakterileri ve yeşil bakteriler üzerinde çalışarak fotosentezin, hidrojenin karbondioksiti indirgediği (atomlarını elektron ve proton olarak bağışladığı) ışığa bağlı bir redoks reaksiyonu olduğunu gösteren ilk kişi oldu. ⓘ
Robert Emerson, farklı dalga boylarında ışık kullanarak bitki verimliliğini test ederek iki ışık reaksiyonu keşfetmiştir. Yalnızca kırmızı ile ışık reaksiyonları bastırıldı. Mavi ve kırmızı birleştirildiğinde, çıktı çok daha önemli oldu. Böylece, biri 600 nm dalga boyuna kadar, diğeri 700 nm'ye kadar absorbe eden iki fotosistem vardı. İlki PSII olarak bilinir, ikincisi ise PSI'dır. PSI sadece klorofil "a" içerir, PSII ise diğer pigmentlerin yanı sıra mevcut klorofil "b" nin çoğuyla birlikte esas olarak klorofil "a" içerir. Bunlar arasında sırasıyla kırmızı ve mavi alglerin kırmızı ve mavi pigmentleri olan fikobilinler ve kahverengi algler ve diyatomlar için fukoksantol bulunur. Süreç, kuantum emilimi hem PSII hem de PSI'da eşit olduğunda en verimli hale gelir ve anten kompleksinden gelen giriş enerjisinin PSI ve PSII sistemleri arasında bölünmesini sağlar, bu da fotokimyaya güç verir. ⓘ
Robert Hill, bir reaksiyon kompleksinin sitokrom b6'ya (şimdi bir plastokinon) giden bir ara maddeden oluştuğunu ve bir diğerinin de sitokrom f'den karbonhidrat üreten mekanizmalardaki bir adıma gittiğini düşünmüştür. Bunlar, sitokrom f'yi indirgemek için enerji gerektiren plastokinon ile bağlantılıdır. Yeşil bitkilerin fotosentezi sırasında gelişen oksijenin sudan geldiğini kanıtlamak için 1937 ve 1939'da Hill tarafından daha ileri deneyler yapıldı. İzole edilmiş kloroplastların ışığa maruz kaldıktan sonra demir oksalat, ferrisiyanid veya benzokinon gibi doğal olmayan indirgeyici maddelerin varlığında oksijen verdiğini göstermiştir. Hill reaksiyonunda:
- 2 H2O + 2 A + (ışık, kloroplastlar) → 2 AH2 + O2 ⓘ
A elektron alıcısıdır. Bu nedenle ışıkta elektron alıcısı indirgenir ve oksijen açığa çıkar. Samuel Ruben ve Martin Kamen, fotosentezde serbest kalan oksijenin sudan geldiğini belirlemek için radyoaktif izotoplar kullandı. ⓘ

Melvin Calvin ve Andrew Benson, James Bassham ile birlikte bitkilerdeki karbon asimilasyon yolunu (fotosentetik karbon indirgeme döngüsü) aydınlattı. Karbon azaltma döngüsü Calvin döngüsü olarak bilinir, ancak birçok bilim insanı bunu Calvin-Benson, Benson-Calvin veya hatta Calvin-Benson-Bassham (veya CBB) Döngüsü olarak adlandırır. ⓘ
Nobel Ödüllü bilim insanı Rudolph A. Marcus daha sonra elektron taşıma zincirinin işlevini ve önemini keşfetmeyi başardı. ⓘ
Otto Heinrich Warburg ve Dean Burk, solunum tarafından aktive edilen CO2'yi ayrıştıran I-kuantum fotosentez reaksiyonunu keşfetti. ⓘ
1950 yılında, in vivo fotofosforilasyonun varlığına dair ilk deneysel kanıt, Otto Kandler tarafından bozulmamış Chlorella hücreleri kullanılarak ve bulguları ışığa bağlı ATP oluşumu olarak yorumlanarak sunuldu. 1954 yılında Daniel I. Arnon ve arkadaşları, P32 yardımıyla izole kloroplastlarda in vitro fotofosforilasyonu keşfetti. ⓘ
Louis N.M. Duysens ve Jan Amesz, klorofil "a "nın bir ışığı absorbe edip sitokrom f'yi oksitlediğini, klorofil "a "nın (ve diğer pigmentlerin) başka bir ışığı absorbe edip aynı oksitlenmiş sitokromu indirgediğini keşfederek iki ışık reaksiyonunun seri olduğunu belirtmiştir. ⓘ
Kavramın gelişimi
1893 yılında Charles Reid Barnes, ışığın etkisi altında klorofil varlığında karbonik asitten karmaşık karbon bileşiklerinin sentezlendiği biyolojik süreç için fotosentaks ve fotosentez olmak üzere iki terim önermiştir. Zaman içinde fotosentez terimi yaygın olarak kullanılmaya başlandı. Daha sonra anoksijenik fotosentetik bakterilerin ve fotofosforilasyonun keşfi, terimin yeniden tanımlanmasını gerektirmiştir. ⓘ
C3 : C4 fotosentez araştırması
1940'ların sonunda Berkeley'deki Kaliforniya Üniversitesi'nde, fotosentetik karbon metabolizmasının ayrıntıları kimyagerler Melvin Calvin, Andrew Benson, James Bassham ve bir grup öğrenci ve araştırmacı tarafından karbon-14 izotopu ve kağıt kromatografisi teknikleri kullanılarak çözüldü. Chlorella yosunu tarafından ışıkta saniyenin çok küçük bir bölümünde CO2 fiksasyonu yolu, fosfogliserik asit (PGA) adı verilen 3 karbonlu bir molekülle sonuçlandı. Bu orijinal ve çığır açan çalışma için 1961 yılında Melvin Calvin'e Nobel Kimya Ödülü verildi. Buna paralel olarak, bitki fizyologları yeni kızılötesi gaz analizi yöntemini ve net fotosentetik oranların 10 ila 13 μmol CO2-m-2-s-1 arasında değiştiği bir yaprak odasını kullanarak yaprak gaz değişimlerini incelediler ve tüm karasal bitkilerin aynı fotosentetik kapasiteye sahip olduğu ve güneş ışığının %50'sinden daha azında ışığa doyduğu sonucuna vardılar. ⓘ
Daha sonra 1958-1963 yıllarında Cornell Üniversitesi'nde, tarlada yetiştirilen mısırın 40 μmol CO2-m-2-s-1 gibi çok daha yüksek yaprak fotosentez oranlarına sahip olduğu ve neredeyse tam güneş ışığında doygunluğa ulaşmadığı rapor edilmiştir. Mısırdaki bu yüksek oran, buğday ve soya fasulyesi gibi diğer türlerde gözlenenin neredeyse iki katıydı ve bu da yüksek bitkiler arasında fotosentezde büyük farklılıklar olduğunu gösteriyordu. Arizona Üniversitesi'nde, 15'ten fazla tek çenekli ve çift çenekli tür üzerinde yapılan ayrıntılı gaz değişimi araştırması, yaprak anatomisindeki farklılıkların türler arasındaki fotosentetik kapasiteleri farklılaştırmada çok önemli faktörler olduğunu ilk kez ortaya çıkardı. Mısır, sorgum, şeker kamışı, Bermuda otu ve iki çenekli amaranthus dahil olmak üzere tropik otlarda yaprak fotosentetik oranları 38-40 μmol CO2-m-2-s-1 civarındaydı ve yapraklar iki tip yeşil hücreye sahipti, yani sıkıca paketlenmiş bir kolorofilli vasküler demet kılıf hücrelerini çevreleyen mezofil hücrelerinin dış tabakası. Bu tip anatomi, 19. yüzyılda botanikçi Gottlieb Haberlandt tarafından şeker kamışının yaprak anatomisini incelerken Kranz anatomisi olarak adlandırılmıştır. En yüksek fotosentetik oranlara ve Kranz anatomisine sahip bitki türleri, belirgin bir fotorespirasyon, çok düşük CO2 dengeleme noktası, yüksek optimum sıcaklık, yüksek stoma dirençleri ve gaz difüzyonu için daha düşük mezofil dirençleri ve tam güneş ışığında asla doygun olmayan oranlar göstermiştir. Arizona'daki araştırma 1986 yılında bir Citation Classic olarak belirlenmiştir. Bu türler daha sonra C4 bitkileri olarak adlandırılmıştır çünkü ışıkta CO2 fiksasyonunun ilk kararlı bileşiği malat ve aspartat olarak 4 karbona sahiptir. Kranz anatomisine sahip olmayan pamuk ve ayçiçeği gibi diğer türler, ilk kararlı karbon bileşiği 3 karbonlu PGA olduğu için C3 tipi olarak adlandırılmıştır. Ölçüm havasındaki 1000 ppm CO2'de, hem C3 hem de C4 bitkileri 60 μmol CO2-m-2-s-1 civarında benzer yaprak fotosentetik oranlarına sahipti ve bu da C3 bitkilerinde fotorespirasyonun baskılandığını gösteriyordu. ⓘ
Faktörler
Fotosentezi etkileyen üç ana faktör ve bunlara bağlı birkaç faktör vardır. Bu üç ana faktör şunlardır:
- Işık şiddeti ve dalga boyu
- Karbondioksit konsantrasyonu
- Sıcaklık. ⓘ
Toplam fotosentez bir dizi çevresel faktör tarafından sınırlandırılır. Bunlar arasında mevcut ışık miktarı, bir bitkinin ışığı yakalamak için sahip olduğu yaprak alanı miktarı (diğer bitkiler tarafından gölgelenme fotosentezin önemli bir sınırlamasıdır), fotosentezi desteklemek için kloroplastlara karbondioksit sağlama hızı, suyun mevcudiyeti ve fotosentezin gerçekleştirilmesi için uygun sıcaklıkların mevcudiyeti yer alır. ⓘ
Işık yoğunluğu (ışınım), dalga boyu ve sıcaklık

Fotosentez süreci biyosfere serbest enerjinin ana girdisini sağlar ve radyasyonun bitki yaşamı için önemli olduğu dört ana yoldan biridir. ⓘ
Bitki toplulukları içindeki radyasyon iklimi hem zaman hem de mekan açısından son derece değişkendir. ⓘ
20. yüzyılın başlarında Frederick Blackman ve Gabrielle Matthaei, ışık yoğunluğu (ışınım) ve sıcaklığın karbon asimilasyon oranı üzerindeki etkilerini araştırmıştır.
- Sabit sıcaklıkta, karbon asimilasyon oranı ışınımla değişir, ışınım arttıkça artar, ancak daha yüksek ışınımda bir platoya ulaşır.
- Düşük ışınımda, sıcaklığın artırılmasının karbon asimilasyon oranı üzerinde çok az etkisi vardır. Sabit yüksek ışınımda, sıcaklık arttıkça karbon asimilasyon oranı da artar. ⓘ
Bu iki deney birkaç önemli noktayı göstermektedir: İlk olarak, genel olarak fotokimyasal reaksiyonların sıcaklıktan etkilenmediği bilinmektedir. Ancak, bu deneyler sıcaklığın karbon asimilasyon oranını etkilediğini açıkça göstermektedir, bu nedenle karbon asimilasyon sürecinin tamamında iki reaksiyon seti olmalıdır. Bunlar ışığa bağlı 'fotokimyasal' sıcaklıktan bağımsız aşama ve ışıktan bağımsız, sıcaklığa bağlı aşamadır. İkinci olarak, Blackman'ın deneyleri sınırlayıcı faktörler kavramını göstermektedir. Bir başka sınırlayıcı faktör de ışığın dalga boyudur. Suyun birkaç metre altında yaşayan siyanobakteriler, geleneksel fotosentetik pigmentlerde fotoindüklenmiş yük ayrımına neden olmak için gereken doğru dalga boylarını alamazlar. Bu sorunla mücadele etmek için, farklı pigmentlere sahip bir dizi protein reaksiyon merkezini çevreler. Bu birime fikobilizom adı verilir. ⓘ
Karbondioksit seviyeleri ve fotorespirasyon

Karbondioksit konsantrasyonları arttıkça, şekerlerin ışıktan bağımsız reaksiyonlar tarafından üretilme hızı, diğer faktörler tarafından sınırlanana kadar artar. Işıktan bağımsız reaksiyonlarda karbondioksiti yakalayan enzim olan RuBisCO, hem karbondioksit hem de oksijen için bir bağlanma afinitesine sahiptir. Karbondioksit konsantrasyonu yüksek olduğunda, RuBisCO karbondioksiti sabitleyecektir. Ancak, karbondioksit konsantrasyonu düşükse, RuBisCO karbondioksit yerine oksijeni bağlayacaktır. Fotorespirasyon adı verilen bu süreç enerji kullanır, ancak şeker üretmez. ⓘ
RuBisCO oksijenaz aktivitesi çeşitli nedenlerden dolayı bitkiler için dezavantajlıdır:
- Oksijenaz aktivitesinin bir ürünü 3-fosfogliserat (3 karbon) yerine fosfoglikolattır (2 karbon). Fosfoglikolat, Calvin-Benson döngüsü tarafından metabolize edilemez ve döngüden kaybedilen karbonu temsil eder. Bu nedenle yüksek bir oksijenaz aktivitesi, ribuloz 5-bisfosfatın geri dönüşümü ve Calvin-Benson döngüsünün devamı için gerekli olan şekerleri tüketir.
- Fosfoglikolat hızlı bir şekilde yüksek konsantrasyonda bitki için toksik olan glikolata metabolize olur; fotosentezi engeller.
- Glikolatın kurtarılması, glikolat yolunu kullanan enerjik olarak pahalı bir süreçtir ve karbonun yalnızca %75'i Calvin-Benson döngüsüne 3-fosfogliserat olarak geri döner. Reaksiyonlar ayrıca bitkiden dışarı difüze olabilen amonyak (NH3) üreterek azot kaybına yol açar. ⓘ
- Oldukça basitleştirilmiş bir özet şöyledir:
- 2 glikolat + ATP → 3-fosfogliserat + karbondioksit + ADP + NH3 ⓘ
- Oldukça basitleştirilmiş bir özet şöyledir:
RuBisCO oksijenaz aktivitesinin ürünleri için kurtarma yolu, ışığa bağlı oksijen tüketimi ve karbondioksit salınımı ile karakterize edildiğinden, daha yaygın olarak fotorespirasyon olarak bilinir. ⓘ
Tepkimeler
Işığa bağlı tepkimeler
Işığa bağlı tepkimeler, canlının ışıklı ortamda ışığa bağımsız tepkimeler için gereken ATP ve NADPH'yi ürettiği bir dizi tepkime zinciridir. Bu tepkimeler tilakoit zar üzerinde gerçekleşir. Işığı soğuran klorofil molekülünden serbest kalan elektronlar elektron taşıma sistemi (ETS) elemanlarından geçer. Bu sırada ATP ve NADPH çıkışı olur. ⓘ
Klorofile sahip canlıların ADP ve inorganik fosfat (Pi) kullanarak ATP üretmesine fotofosforilasyon denir. Bu olay devirli fotofosforilasyon ve devirsiz fotofosforilasyon olmak üzere iki yolla gerçekleşir. Devirsiz fotofosforilasyonda, devirliden farklı olarak su, fotolize uğrar. Tepkime şu şekildedir. ⓘ
- 2 H2O + 2 NADP+ + 3 ADP + 3 Pi + ışık → 2 NADPH + 2 H+ + 3 ATP + O2 ⓘ
Bu tepkimeler sonucu oluşan O2'nin bir kısmı mitokondrilere gönderilir, artanı ise atmosfere verilir. Oluşan ATP ve NADPH molekülleri stroma sıvısına girer, artık canlı ışıktan bağımsız tepkimeleri gerçekleştirmeye hazırdır. ⓘ
Işıktan bağımsız tepkimeler
Bu tepkimeler stroma bölgesinde gerçekleşir. Stromalar protein yapılıdır. Bu tepkimeler aydınlıkta da karanlıkta da olabilir. CO2’nin devreye girmesiyle başlar. Hidrojen ile CO2 birleşerek karbonhidratları meydana getirir. ⓘ
Calvin döngüsü
Calvin-Benson döngüsü, fotosentez sırasında kloroplast'ta gerçekleşen kimyasal reaksiyonlar kümesidir. Bu döngü karanlık evre reaksiyonları içindedir çünkü Güneş ışığından enerji sağlandıktan sonraki bölgede yer alır. Calvin döngüsü ismini, bunu bulduğu için 1961 Nobel Kimya Ödülü'nü kazanan Melvin Calvin'den alır. Calvin ve meslektaşları Kaliforniya Üniversitesi, Berkeley'de çalışmışlardır. ⓘ
Fotosentez hızını etkileyen etkenler
Çevresel etkenler
- CO2 miktarı: Karbondioksit arttığında fotosentez hızı belli bir yere kadar artar, sonra sabit kalır.
- Işık şiddeti: Arttığında fotosentez hızı belli bir değere kadar artar, sonra sabit kalır.
- Işık rengi: Fotosentez en çok mor ve kırmızı ışıkta gerçekleşir, en düşük hız ise yeşildedir.
- Sıcaklık: Enzimlerin çalıştığı optimum sıcaklık olan 25-35 derece arası fotosentez hızı maksimumdur. Eğer sıcaklık artmaya devam ederse enzimler bozulur. Sıcaklık çok düşerse enzimler durur.
- Su miktarı: Su miktarı %15'in altına indiğinde enzimler inaktif olacağından fotosentez durur. Su miktarının belli bir değerden sonra artması fotosentez hızını etkilemez. ⓘ
Genetik etkenler
- Kloroplast sayısı
- Yaprak sayısı ve yapısı
- Stoma sayısı
- Kütikula kalınlığı
- Klorofil sentezleme geni ⓘ
Ayrıca bakınız
- Yapay fotosentez
- D vitamini
- Calvin döngüsü
- Hücresel solunum
- Kemosentez
- C3 karbon tutulumu mekanizması
- C4 karbon tutulumu mekanizması
- Karbon sabitlenmesi
- Günlük ışık entegrali
- Hill tepkimesi
- Tümleşik florometre
- Işığa bağımlı reaksiyon
- Organik tepkime
- Fotobiyoloji
- Foto inhibisyon
- Fotosentetik reaksiyon merkezi
- Fotosentetik aktif radyasyon
- Fotosistemler
- Kuantum biyolojisi
- Radyosentez
- Kırmızı kenar ⓘ
Konuyla ilgili yayınlar
Kitaplar
- Kingsley R. Stern; Shelley Jansky; James E. Bidlack (2003). Introductory Plant Biology (İngilizce). New York: McGraw-Hill. ISBN 978-0-07-290941-8.
- Robert E. Blankenship (2014). Molecular Mechanisms of Photosynthesis (İngilizce) (2. bas.). John Wiley & Sons. ISBN 978-1-4051-8975-0.
- Govindjee; J.T. Beatty; H. Gest; J.F. Allen (2006). Discoveries in Photosynthesis. Advances in Photosynthesis and Respiration (İngilizce). 20. Berlin: Springer. ISBN 978-1-4020-3323-0.
- Jane B. Reece; Lisa A. Urry; Michael L. Cain; Steven A. Wasserman; Robert B. Jackson; Peter V. Minorsky (2013). Campbell Biology (İngilizce). Benjamin Cummings. ISBN 978-0-321-77565-8. ⓘ
Makaleler
- Gupta RS, Mukhtar T, Singh B (Jun 1999). "Evolutionary relationships among photosynthetic prokaryotes (Heliobacterium chlorum, Chloroflexus aurantiacus, cyanobacteria, Chlorobium tepidum and proteobacteria): implications regarding the origin of photosynthesis". Molecular Microbiology. 32 (5). ss. 893-906. doi:10.1046/j.1365-2958.1999.01417.x. PMID 10361294.
- Rutherford AW, Faller P (Jan 2003). "Photosystem II: evolutionary perspectives". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1429). ss. 245-253. doi:10.1098/rstb.2002.1186. PMC 1693113 $2. PMID 12594932. ⓘ
