Epigenetik

Biyolojide epigenetik, DNA dizisindeki değişiklikleri içermeyen kalıtsal fenotip değişikliklerinin incelenmesidir. Epigenetikteki Yunanca epi- (ἐπι- "üzerinde, dışında, etrafında") öneki, kalıtım için geleneksel genetik temelin "üstünde" veya "ek olarak" olan özellikleri ifade eder. Epigenetik çoğunlukla gen aktivitesini ve ifadesini etkileyen değişiklikleri içerir, ancak bu terim herhangi bir kalıtsal fenotipik değişikliği tanımlamak için de kullanılabilir. Hücresel ve fizyolojik fenotipik özellikler üzerindeki bu tür etkiler dış veya çevresel faktörlerden kaynaklanabilir veya normal gelişimin bir parçası olabilir. ⓘ
Bu terim aynı zamanda değişikliklerin kendisini de ifade eder: genomda nükleotid dizisinde bir değişiklik içermeyen işlevsel olarak ilgili değişiklikler. Bu tür değişiklikleri üreten mekanizmaların örnekleri, her biri altta yatan DNA dizisini değiştirmeden genlerin nasıl ifade edildiğini değiştiren DNA metilasyonu ve histon modifikasyonudur. Gen ifadesi, DNA'nın susturucu bölgelerine bağlanan baskılayıcı proteinlerin etkisiyle kontrol edilebilir. Bu epigenetik değişiklikler, hücrenin yaşamı boyunca hücre bölünmeleri boyunca sürebilir ve organizmanın temel DNA dizisindeki değişiklikleri içermemelerine rağmen birden fazla nesil boyunca da sürebilir; bunun yerine, genetik olmayan faktörler organizmanın genlerinin farklı davranmasına (veya "kendilerini ifade etmesine") neden olur. ⓘ
Ökaryotik biyolojide epigenetik değişimin bir örneği hücresel farklılaşma sürecidir. Morfogenez sırasında, totipotent kök hücreler embriyonun çeşitli pluripotent hücre hatlarına dönüşür ve bunlar da tamamen farklılaşmış hücreler haline gelir. Başka bir deyişle, tek bir döllenmiş yumurta hücresi - zigot - bölünmeye devam ettikçe, ortaya çıkan yavru hücreler, bazı genleri aktive ederken diğerlerinin ifadesini inhibe ederek nöronlar, kas hücreleri, epitel, kan damarlarının endoteli vb. dahil olmak üzere bir organizmadaki tüm farklı hücre tiplerine dönüşür. ⓘ

Tanımlar
Günümüzdeki kullanımıyla epigenetik terimi 1990'larda ortaya çıkmıştır, ancak birkaç yıldır biraz değişken anlamlarda kullanılmaktadır. Epigenetik özellik kavramının "DNA dizisinde değişiklik olmaksızın bir kromozomdaki değişikliklerden kaynaklanan kararlı bir şekilde kalıtılabilir fenotip" olarak bir tanımı 2008 yılında Cold Spring Harbor toplantısında formüle edilmiştir, ancak kalıtılabilir olmayan özellikleri içeren alternatif tanımlar hala yaygın olarak kullanılmaktadır. ⓘ
Epigenez terimi, 17. yüzyıldan beri İngilizce'de kullanılan "ekstra büyüme" gibi genel bir anlama sahiptir. ⓘ
Waddington'ın kanalizasyonu, 1940'lar
Kromozomların ifadesini etkileyen epigenetik değişiklikler hipotezi Rus biyolog Nikolai Koltsov tarafından ortaya atılmıştır. İngiliz embriyolog C. H. Waddington, 1942 yılında, Valentin Haecker'in 'fenogenetik' (Phänogenetik) terimine paralel olarak, epigenetik terimini genel anlamından ve ilişkili epigenetik sıfatından yola çıkarak epigenezle ilgili olarak icat etmiştir. O dönemin biyolojisi bağlamında epigenez, embriyonik gelişim sırasında hücrelerin başlangıçtaki totipotent durumlarından farklılaşmasını ifade ediyordu. ⓘ
Waddington bu terimi ortaya attığında, genlerin fiziksel doğası ve kalıtımdaki rolleri bilinmiyordu. Bunun yerine, genetik bileşenlerin bir fenotip üretmek için çevreleriyle nasıl etkileşime girebileceğine dair kavramsal bir model olarak kullandı; biyolojik gelişim için bir metafor olarak "epigenetik manzara" ifadesini kullandı. Waddington, hücre kaderlerinin gelişim sırasında, bir mermerin en düşük yerel yükseklik noktasına doğru yuvarlanması gibi, kanalizasyon adını verdiği bir süreçte belirlendiğini savunmuştur. Waddington, hücre tipi farklılaşmasının artan geri döndürülemezliğini, mermerlerin (hücrelere benzer şekilde) hareket ettiği vadiler arasında yükselen sırtlar olarak görselleştirmeyi önerdi. ⓘ
Son zamanlarda, Waddington'un epigenetik manzara kavramı, hücre kaderi çalışmasına sistem dinamiği durumu yaklaşımı bağlamında titizlikle resmileştirilmiştir. Hücre kaderinin belirlenmesinin, çekici-yakınsama (çekici bir denge noktası, limit döngüsü veya garip çekici olabilir) veya salınım gibi belirli dinamikler sergileyeceği öngörülmektedir. ⓘ
Çağdaş
Robin Holliday 1990 yılında epigenetiği "karmaşık organizmaların gelişimi sırasında gen aktivitesinin zamansal ve mekânsal kontrol mekanizmalarının incelenmesi" olarak tanımlamıştır. Dolayısıyla, en geniş anlamıyla epigenetik, bir organizmanın gelişimini etkileyen DNA dizisi dışındaki her şeyi tanımlamak için kullanılabilir. ⓘ
Kelimenin biyolojideki daha yeni kullanımı daha katı tanımları takip etmektedir. Arthur Riggs ve meslektaşları tarafından tanımlandığı gibi, "DNA dizisindeki değişikliklerle açıklanamayan gen işlevindeki mitotik ve/veya mayotik kalıtsal değişikliklerin incelenmesidir." ⓘ
Ancak bu terim, bazı histon modifikasyon biçimleri gibi kalıtsal olduğu kanıtlanmamış süreçleri tanımlamak için de kullanılmıştır. Sonuç olarak, "epigenetiği" kalıtımsal olma zorunluluğunun getirdiği kısıtlamalardan kaçınacak daha geniş terimlerle yeniden tanımlama girişimleri olmuştur. Örneğin, Adrian Bird epigenetiği "kromozomal bölgelerin yapısal adaptasyonu, böylece değişen aktivite durumlarını kaydetmek, işaret etmek veya sürdürmek" olarak tanımlamıştır. Bu tanım, DNA onarımı veya hücre döngüsü aşamalarıyla ilişkili geçici değişikliklerin yanı sıra birden fazla hücre nesli boyunca sürdürülen kararlı değişiklikleri de içerecek, ancak kromozom işlevini etkilemedikleri sürece membran mimarisinin şablonlanması ve prionlar gibi diğerlerini hariç tutacaktır. Ancak bu tür yeniden tanımlamalar evrensel olarak kabul görmemekte ve halen tartışmalara konu olmaktadır. NIH'in 2016 itibariyle devam etmekte olan "Epigenomik Yol Haritası Projesi" aşağıdaki tanımı kullanmaktadır: "Bu programın amaçları doğrultusunda epigenetik, hem gen aktivitesi ve ifadesindeki kalıtsal değişiklikleri (hücrelerin veya bireylerin neslinde) hem de bir hücrenin transkripsiyon potansiyelinde kalıtsal olması gerekmeyen istikrarlı, uzun vadeli değişiklikleri ifade eder." 2008 yılında, Cold Spring Harbor toplantısında epigenetik özelliğin "DNA dizisinde değişiklik olmaksızın kromozomda meydana gelen değişikliklerden kaynaklanan kararlı kalıtımsal fenotip" şeklinde ortak bir tanımı yapılmıştır. ⓘ
Kelimenin "genetik" ile olan benzerliği birçok paralel kullanıma yol açmıştır. "Epigenom", bir hücrenin genel epigenetik durumuna atıfta bulunan "genom" kelimesine paraleldir ve epigenomik, tüm genom boyunca epigenetik değişikliklerin küresel analizlerini ifade eder. "Genetik kod" ifadesi de uyarlanmıştır - "epigenetik kod", aynı altta yatan DNA dizisinden farklı hücrelerde farklı fenotipler yaratan epigenetik özellikler kümesini tanımlamak için kullanılmıştır. En uç noktaya götürüldüğünde, "epigenetik kod" hücrenin toplam durumunu temsil edebilir, her molekülün konumu bir epigenomik haritada, belirli bir genomik bölgenin gen ifadesinin, DNA metilasyonunun ve histon modifikasyon durumunun şematik bir temsilinde hesaba katılır. Daha tipik olarak bu terim, histon kodu veya DNA metilasyon kalıpları gibi spesifik, ilgili epigenetik bilgi biçimlerini ölçmeye yönelik sistematik çabalara atıfta bulunmak için kullanılır. ⓘ
Gelişimsel psikoloji
"Epigenetik" terimi, herhangi bir biyolojik disiplindeki kullanımıyla ilgisi olmayan bir anlamda, gelişim psikolojisinde, psikolojik gelişimi kalıtım ve çevre arasında süregelen, çift yönlü bir değişimin sonucu olarak tanımlamak için de kullanılmıştır. Etkileşimli gelişim fikirleri 19. ve 20. yüzyıllar boyunca çeşitli şekillerde ve çeşitli isimler altında tartışılmıştır. Erken bir versiyon, embriyolojinin kurucu ifadeleri arasında Karl Ernst von Baer tarafından önerilmiş ve Ernst Haeckel tarafından popülerleştirilmiştir. Fizyolojik epigenez olarak bilinen radikal bir epigenetik görüş Paul Wintrebert tarafından geliştirilmiştir. Bir başka varyasyon olan olasılıksal epigenez ise 2003 yılında Gilbert Gottlieb tarafından sunulmuştur. Bu görüş, bir organizma üzerindeki tüm olası gelişim faktörlerini ve bunların sadece organizmayı ve birbirlerini değil, aynı zamanda organizmanın kendi gelişimini de nasıl etkilediğini kapsar. Gottlieb, tipik anne bakımı görmeyen bebeklerin serotoninden yoksun olduğu ve bunun da onları büyüdükçe daha agresif hale getirdiği Rhesus maymunlarını örnek vermiştir. Başka bir not olarak, uzun süredir var olan "birlikte ateşleyen hücreler, birlikte teller" kavramı, büyük epigenetik önceliğe sahip gelişimsel bir süreç olan sinaptogenezin, bir sinir ağı içindeki ilgili sinapsların aktivitesine bağlı olduğunu ileri süren Hebbian teorisinden türemiştir. Deneyimin nöronların uyarılabilirliğini değiştirdiği durumlarda, artan nöral aktivite artan demetilasyon ile ilişkilendirilmiştir. ⓘ
Gelişim psikoloğu Erik Erikson 1968 tarihli Kimlik adlı kitabında epigenetik bir ilkeden bahsetmiştir: Gençlik ve Kriz adlı kitabında, kişiliğimizin önceden belirlenmiş aşamalarda ortaya çıkmasıyla geliştiğimiz ve çevremizin ve çevremizdeki kültürün bu aşamalarda nasıl ilerlediğimizi etkilediği fikrini kapsayan epigenetik bir ilkeden bahsetmiştir. Sosyo-kültürel ortamlarımızla ilişkili olarak bu biyolojik açılım, "her aşamadaki ilerlemenin kısmen önceki tüm aşamalardaki başarımız veya başarısızlığımız tarafından belirlendiği" psikososyal gelişim aşamalarında gerçekleşir. ⓘ
Ampirik çalışmalar tutarsız sonuçlar vermiş olsa da, epigenetik değişikliklerin transgenerasyonel travma için biyolojik bir mekanizma olduğu düşünülmektedir. ⓘ
Moleküler temel
Epigenetik değişiklikler belirli genlerin aktivasyonunu değiştirir, ancak DNA'nın genetik kod dizisini değiştirmez. DNA'nın kendisinin veya ilişkili kromatin proteinlerinin mikro yapısı (kodu değil) değiştirilerek aktivasyona veya susturmaya neden olabilir. Bu mekanizma, çok hücreli bir organizmada farklılaşmış hücrelerin yalnızca kendi faaliyetleri için gerekli olan genleri ifade etmelerini sağlar. Epigenetik değişiklikler hücreler bölündüğünde korunur. Epigenetik değişikliklerin çoğu yalnızca bir organizmanın yaşam süresi boyunca meydana gelir; ancak bu epigenetik değişiklikler, transgenerasyonel epigenetik kalıtım adı verilen bir süreçle organizmanın yavrularına aktarılabilir. Ayrıca, döllenme ile sonuçlanan bir sperm veya yumurta hücresinde gen inaktivasyonu meydana gelirse, bu epigenetik modifikasyon da bir sonraki nesle aktarılabilir. ⓘ
Spesifik epigenetik süreçler arasında paramutasyon, yer imi, imprinting, gen susturma, X kromozomu inaktivasyonu, pozisyon etkisi, DNA metilasyonunun yeniden programlanması, transveksiyon, maternal etkiler, karsinogenezin ilerlemesi, teratojenlerin birçok etkisi, histon modifikasyonlarının ve heterokromatinin düzenlenmesi ve partenogenez ve klonlamayı etkileyen teknik sınırlamalar yer almaktadır. ⓘ
DNA hasarı
DNA hasarı epigenetik değişikliklere de neden olabilir. DNA hasarı çok sık görülür, insan vücudunda hücre başına günde ortalama 60.000 kez meydana gelir (bkz. DNA hasarı (doğal olarak meydana gelen)). Bu hasarlar büyük ölçüde onarılır, ancak epigenetik değişiklikler yine de DNA onarım bölgesinde kalabilir. Özellikle, DNA'daki bir çift sarmal kırılması, hem DNA metilasyonuna neden olarak hem de histon modifikasyonlarının susturma türlerini teşvik ederek (kromatin yeniden şekillenmesi - bir sonraki bölüme bakınız) programlanmamış epigenetik gen susturmasını başlatabilir. Ayrıca, Parp1 (poli(ADP)-riboz polimeraz) enzimi ve onun ürünü olan poli(ADP)-riboz (PAR) onarım sürecinin bir parçası olarak DNA hasarı bölgelerinde birikir. Bu birikim de nükleozomun yeniden şekillenmesine neden olabilen kromatin yeniden şekillenme proteini ALC1'in işe alımını ve aktivasyonunu yönlendirir. Nükleozom yeniden şekillenmesinin, örneğin DNA onarım geni MLH1'in epigenetik susturulmasına neden olduğu bulunmuştur. Benzen, hidrokinon, stiren, karbon tetraklorür ve trikloroetilen gibi DNA'ya zarar veren kimyasallar, bazıları oksidatif stres yollarının aktivasyonu yoluyla olmak üzere, DNA'da önemli ölçüde hipometilasyona neden olur. ⓘ
Gıdaların, farklı diyetler uygulayan sıçanların epigenetiğini değiştirdiği bilinmektedir. Bazı gıda bileşenleri MGMT ve MLH1 ve p53 gibi DNA onarım enzimlerinin seviyelerini epigenetik olarak artırmaktadır. Soya izoflavonları gibi diğer gıda bileşenleri DNA hasarını azaltabilir. Bir çalışmada, DNA hasarından kaynaklanabilen modifiye nükleotidler gibi oksidatif stres belirteçleri, soya ile desteklenmiş 3 haftalık bir diyetle azaltılmıştır. Antosiyanin bakımından zengin yabanmersini (Vaccinium myrtillius L.) pomace ekstresi tüketiminden 2 saat sonra oksidatif DNA hasarında da bir azalma gözlenmiştir. ⓘ
Epigenetiği incelemek için kullanılan teknikler
Epigenetik araştırmalar, epigenetik olayların daha iyi anlaşılması için çok çeşitli moleküler biyolojik teknikler kullanmaktadır. Bu teknikler arasında kromatin immünopresipitasyonu (büyük ölçekli varyantları ChIP-on-chip ve ChIP-Seq ile birlikte), floresan in situ hibridizasyon, metilasyona duyarlı restriksiyon enzimleri, DNA adenin metiltransferaz tanımlama (DamID) ve bisülfit dizileme yer almaktadır. Ayrıca, biyoinformatik yöntemlerin kullanımı hesaplamalı epigenetikte bir role sahiptir. ⓘ
Kromatin İmmünopresipitasyonu
Kromatin İmmünopresipitasyonu (ChIP), DNA ve epigenetik etkileşimler arasındaki boşluğu doldurmaya yardımcı olmuştur. ChIP kullanımı ile araştırmacılar gen düzenlemesi, transkripsiyon mekanizmaları ve kromatin yapısı ile ilgili bulgular elde edebilmektedir. ⓘ
Floresan in situ hibridizasyon
Floresan in situ hibridizasyon (FISH) epigenetik mekanizmaları anlamak için çok önemlidir. FISH, kromozomlar üzerindeki genlerin yerini bulmanın yanı sıra kodlamayan RNA'ları bulmak için de kullanılabilir. FISH ağırlıklı olarak insanlarda kromozomal anormallikleri tespit etmek için kullanılır. ⓘ
Metilasyona duyarlı restriksiyon enzimleri
PCR ile eşleştirilmiş metilasyona duyarlı restriksiyon enzimleri, DNA'daki metilasyonu - özellikle CpG bölgelerini - değerlendirmenin bir yoludur. DNA metillenmişse, restriksiyon enzimleri ipliği parçalamayacaktır. Aksine, DNA metillenmemişse, enzimler ipliği parçalayacak ve PCR ile çoğaltılacaktır. ⓘ
Bisülfit dizileme
Bisülfit dizileme DNA metilasyonunu değerlendirmenin başka bir yoludur. Sitozin, sodyum bisülfit ile muamele edildiğinde urasile dönüşürken, metillenmiş sitozinler etkilenmeyecektir. ⓘ
Mekanizmalar
Epigenetik mekanizmalar çevresel etkilere karşı duyarlıdır ve yetişkin fenotipinin şekillenmesinde kilit rol oynarlar. Çeşitli epigenetik kalıtım sistemleri, hücre hafızası olarak bilinen şeyde rol oynayabilir, ancak bunların hepsinin evrensel olarak epigenetik örnekleri olarak kabul edilmediğini unutmayın. ⓘ
Kovalent modifikasyonlar
DNA'nın (örneğin sitozin metilasyonu ve hidroksimetilasyonu) veya histon proteinlerinin (örneğin lizin asetilasyonu, lizin ve arginin metilasyonu, serin ve treonin fosforilasyonu ve lizin ubikitinasyonu ve sumoyilasyonu) kovalent modifikasyonu, birçok epigenetik kalıtım türünde merkezi rol oynar. Bu nedenle, "epigenetik" kelimesi bazen bu süreçlerle eşanlamlı olarak kullanılır. Ancak bu yanıltıcı olabilir. Kromatin yeniden şekillenmesi her zaman kalıtsal değildir ve tüm epigenetik kalıtım kromatin yeniden şekillenmesini içermez. 2019 yılında, bilimsel literatürde epigenetik modifikasyonu hücre metabolizmasına bağlayan başka bir lizin modifikasyonu ortaya çıktı, yani Laktilasyon ⓘ

Bir hücrenin veya bireyin fenotipi hangi genlerin transkripsiyonundan etkilendiğinden, kalıtsal transkripsiyon durumları epigenetik etkilere yol açabilir. Gen ifadesinin düzenlenmesinin birkaç katmanı vardır. Genlerin düzenlenmesinin bir yolu kromatinin yeniden şekillendirilmesidir. Kromatin, DNA ve ilişkili olduğu histon proteinlerinden oluşan bir komplekstir. DNA'nın histonların etrafına sarılma şekli değişirse, gen ifadesi de değişebilir. Kromatinin yeniden modellenmesi iki ana mekanizma ile gerçekleştirilir:
- İlk yol, histon proteinlerini oluşturan amino asitlerin translasyon sonrası modifikasyonudur. Histon proteinleri uzun amino asit zincirlerinden oluşur. Zincirdeki amino asitler değiştirilirse, histon şekli de değişebilir. DNA replikasyon sırasında tamamen çözülmez. O halde, değiştirilmiş histonların DNA'nın her yeni kopyasına taşınması mümkündür. Bu histonlar oraya vardıklarında şablon görevi görerek çevrelerindeki yeni histonların yeni bir şekilde şekillenmesini sağlayabilir. Etraflarındaki histonların şeklini değiştirerek, bu değiştirilmiş histonlar hücre bölünmesinden sonra soya özgü bir transkripsiyon programının sürdürülmesini sağlayacaktır.
- İkinci yol, sitozini 5-metilsitozine dönüştürmek için çoğunlukla CpG bölgelerinde olmak üzere DNA'ya metil gruplarının eklenmesidir. 5-Metilsitozin, çift sarmallı DNA'da bir guanin ile eşleşerek normal bir sitozin gibi davranır. Bununla birlikte, genlerin promotör ve enhancer bölgelerindeki CpG bölgelerinde metillenmiş sitozinler bulunduğunda, genler genellikle baskılanır. Gen gövdesindeki CpG bölgelerinde metillenmiş sitozinler bulunduğunda (transkripsiyon başlangıç bölgesi hariç kodlama bölgesinde) genin ifadesi genellikle artar. Bir genin transkripsiyonu genellikle o genin promotör bölgesindeki bir (10 baz veya daha az) tanıma dizisine bağlanan bir transkripsiyon faktörüne bağlıdır. Tanıma dizisi metillenmiş bir sitozine sahip olduğunda transkripsiyon faktörlerinin yaklaşık %22'sinin bağlanması engellenir. Buna ek olarak, bir promotör bölgede metillenmiş sitozinlerin varlığı metil-CpG-bağlayıcı domain (MBD) proteinlerini çekebilir. Tüm MBD'ler nükleozom yeniden şekillenmesi ve histon deasetilaz kompleksleri ile etkileşime girerek gen susturulmasına yol açar. Buna ek olarak, metillenmiş sitozini içeren bir başka kovalent modifikasyon da TET enzimleri tarafından demetilasyonudur. Bu tür yüzlerce demetilasyon, örneğin nöronlarda öğrenme ve hafıza oluşturma olayları sırasında meydana gelir. ⓘ
Histon durumunun kalıtsallığının mekanizmaları iyi anlaşılmamıştır; ancak hücre bölünmesi ve farklılaşması sırasında DNA metilasyon durumunun kalıtsallığının mekanizması hakkında çok şey bilinmektedir. Metilasyon durumunun kalıtılabilirliği, 5-metilsitozin için sitozinden daha yüksek bir afiniteye sahip olan belirli enzimlere (DNMT1 gibi) bağlıdır. Bu enzim DNA'nın "hemimetillenmiş" bir kısmına ulaşırsa (5-metilsitozin iki DNA ipliğinden yalnızca birinde bulunursa) enzim diğer yarısını metillendirecektir. ⓘ
Histon modifikasyonları tüm dizi boyunca meydana gelse de, histonların yapılandırılmamış N-termini (histon kuyrukları olarak adlandırılır) özellikle yüksek oranda modifiye edilir. Bu modifikasyonlar asetilasyon, metilasyon, ubikitilasyon, fosforilasyon, sumoyilasyon, ribozilasyon ve sitrülinasyonu içerir. Asetilasyon bu modifikasyonlar arasında en çok çalışılanıdır. Örneğin, histon asetiltransferaz enzimleri (HAT'lar) tarafından histon H3 kuyruğunun K14 ve K9 lizinlerinin asetilasyonu genellikle transkripsiyonel yeterlilikle ilişkilidir. ⓘ
Bir düşünce tarzı, asetilasyonun "aktif" transkripsiyonla ilişkili olma eğiliminin doğası gereği biyofiziksel olduğudur. Normalde ucunda pozitif yüklü bir nitrojen bulunduğundan, lizin DNA omurgasının negatif yüklü fosfatlarını bağlayabilir. Asetilasyon olayı, yan zincir üzerindeki pozitif yüklü amin grubunu nötr bir amid bağlantısına dönüştürür. Bu, pozitif yükü ortadan kaldırır ve böylece DNA'yı histondan gevşetir. Bu gerçekleştiğinde, SWI/SNF ve diğer transkripsiyon faktörleri gibi kompleksler DNA'ya bağlanabilir ve transkripsiyonun gerçekleşmesine izin verebilir. Bu, epigenetik işlevin "cis" modelidir. Başka bir deyişle, histon kuyruklarındaki değişiklikler DNA'nın kendisi üzerinde doğrudan bir etkiye sahiptir. ⓘ
Epigenetik işlevin bir başka modeli de "trans" modelidir. Bu modelde, histon kuyruklarındaki değişiklikler DNA üzerinde dolaylı olarak etki eder. Örneğin, lizin asetilasyonu kromatin modifiye edici enzimler (veya transkripsiyon makineleri) için bir bağlanma bölgesi oluşturabilir. Bu kromatin yeniden şekillendirici daha sonra kromatinin durumunda değişikliklere neden olabilir. Gerçekten de, bir bromodomain - özellikle asetil-lizini bağlayan bir protein alanı - SWI/SNF kompleksi de dahil olmak üzere transkripsiyonu aktive etmeye yardımcı olan birçok enzimde bulunur. Asetilasyon, transkripsiyonel aktivasyona yardımcı olmak için bu ve önceki şekilde hareket ediyor olabilir. ⓘ
Modifikasyonların ilgili faktörler için yerleştirme modülleri olarak hareket ettiği fikri, histon metilasyonu ile de ortaya çıkmaktadır. Histon H3'ün lizin 9'unun metilasyonu uzun zamandır transkripsiyonel olarak sessiz kromatin (konstitütif heterokromatin) ile ilişkilendirilmektedir. Transkripsiyonel olarak baskılayıcı protein HP1'deki bir kromodomainin (özellikle metil-lizini bağlayan bir alan) HP1'i K9 metillenmiş bölgelere aldığı belirlenmiştir. Metilasyon için bu biyofiziksel modeli çürüten bir örnek, lizin 4'teki histon H3'ün tri-metilasyonunun transkripsiyonel aktivasyonla güçlü bir şekilde ilişkili olması (ve tam) için gerekli olmasıdır. Bu durumda tri-metilasyon, kuyruğa sabit bir pozitif yük getirecektir. ⓘ
Histon lizin metiltransferazın (KMT), H3 & H4 histonları modelindeki bu metilasyon aktivitesinden sorumlu olduğu gösterilmiştir. Bu enzim, SET alanı (Suppressor of variegation, Enhancer of zeste, Trithorax) adı verilen katalitik olarak aktif bir bölgeyi kullanır. SET alanı, gen aktivitelerinin modüle edilmesinde rol oynayan 130 amino asitlik bir dizidir. Bu alanın histon kuyruğuna bağlandığı ve hortumun metilasyonuna neden olduğu gösterilmiştir. ⓘ
Farklı histon modifikasyonlarının farklı şekillerde işlev görmesi muhtemeldir; bir pozisyondaki asetilasyonun başka bir pozisyondaki asetilasyondan farklı işlev görmesi muhtemeldir. Ayrıca, aynı anda birden fazla modifikasyon meydana gelebilir ve bu modifikasyonlar nükleozomun davranışını değiştirmek için birlikte çalışabilir. Çoklu dinamik modifikasyonların gen transkripsiyonunu sistematik ve tekrarlanabilir bir şekilde düzenlediği fikrine histon kodu adı verilir, ancak histon durumunun dijital bir bilgi taşıyıcısı olarak doğrusal bir şekilde okunabileceği fikri büyük ölçüde çürütülmüştür. Kromatin bazlı susturmayı düzenleyen en iyi anlaşılmış sistemlerden biri, maya gizli çiftleşme tipi lokusları HML ve HMR'nin SIR proteini bazlı susturulmasıdır. ⓘ
DNA metilasyonu sıklıkla tekrarlanan dizilerde meydana gelir ve 'transposable elementlerin' ifadesini ve hareketliliğini bastırmaya yardımcı olur: 5-metilsitozin kendiliğinden timidine deamine olabildiğinden (nitrojenin oksijenle yer değiştirmesi), CpG bölgeleri sıklıkla mutasyona uğrar ve metillenmeden kaldıkları CpG adaları dışında genomda nadir hale gelir. Dolayısıyla bu tip epigenetik değişiklikler, kalıcı genetik mutasyon sıklığını artırma potansiyeline sahiptir. DNA metilasyon modellerinin, farelerde herhangi birinin kaybı ölümcül olan en az üç bağımsız DNA metiltransferaz, DNMT1, DNMT3A ve DNMT3B'nin karmaşık bir etkileşimi ile çevresel faktörlere yanıt olarak oluşturulduğu ve değiştirildiği bilinmektedir. DNMT1 somatik hücrelerde en bol bulunan metiltransferazdır, replikasyon odaklarına lokalize olur, hemimetillenmiş DNA için 10-40 kat tercihi vardır ve çoğalan hücre nükleer antijeni (PCNA) ile etkileşime girer. ⓘ
DNMT1, tercihen hemimetillenmiş DNA'yı modifiye ederek, DNA replikasyonundan sonra metilasyon modellerini yeni sentezlenen bir ipliğe aktarır ve bu nedenle genellikle 'bakım' metiltransferazı olarak adlandırılır. DNMT1 uygun embriyonik gelişim, imprinting ve X-inaktivasyonu için gereklidir. Bu moleküler kalıtım mekanizmasının, genetik bilginin aktarımının kanonik Watson-Crick baz eşleştirme mekanizmasından farkını vurgulamak için 'Epigenetik şablonlama' terimi ortaya atılmıştır. Ayrıca, metillenmiş DNA durumlarının korunması ve aktarılmasına ek olarak, aynı prensip histon modifikasyonlarının ve hatta sitoplazmik (yapısal) kalıtsal durumların korunması ve aktarılmasında da işe yarayabilir. ⓘ
Histon H3 ve H4, histon lizin demetilaz (KDM) kullanılarak demetilasyon yoluyla da manipüle edilebilir. Yakın zamanda tanımlanan bu enzim, Jumonji alanı (JmjC) adı verilen katalitik olarak aktif bir bölgeye sahiptir. Demetilasyon, JmjC metil grubunu hidroksile etmek için çoklu kofaktörler kullandığında ve böylece onu çıkardığında gerçekleşir. JmjC mono-, di- ve tri-metillenmiş substratları demetilize edebilir. ⓘ
Kromozomal bölgeler kararlı ve kalıtsal alternatif durumları benimseyebilir, bu da DNA dizisinde değişiklik olmaksızın iki değişkenli gen ifadesine neden olur. Epigenetik kontrol genellikle histonların alternatif kovalent modifikasyonları ile ilişkilidir. Daha büyük kromozomal bölgelerin durumlarının kararlılığının ve kalıtsallığının, değiştirilmiş nükleozomların yakındaki nükleozomları benzer şekilde değiştiren enzimleri işe aldığı pozitif geri bildirimi içerdiği öne sürülmektedir. Bu tür epigenetik için basitleştirilmiş bir stokastik model burada bulunmaktadır. ⓘ
Kromatin tabanlı transkripsiyonel düzenlemeye küçük RNA'ların etkisinin aracılık edebileceği öne sürülmüştür. Küçük interfering RNA'lar, hedeflenen promotörlerin epigenetik modülasyonu yoluyla transkripsiyonel gen ifadesini modüle edebilir. ⓘ
Bu mekanizmalar da ikiye ayrılır:
- DNA düzeyindeki modifikasyonlar
- Kromatin düzeyindeki modifikasyonlar ⓘ
- Bu modifikasyonlar hem kovalent hem de nonkovalent olabilirler.
- Genlerin sessizleşmesine neden olurlar. Bu da geni inaktive edici bir mütasyon veya delesyon gibi genetik bir mekanizmayla eşdeğerdir. ⓘ
RNA transkriptleri
Bazen bir gen açıldıktan sonra (doğrudan veya dolaylı olarak) o genin aktivitesini koruyan bir ürün transkripsiyonu yapar. Örneğin, Hnf4 ve MyoD, kodladıkları proteinlerin transkripsiyon faktörü aktivitesi yoluyla, kendileri de dahil olmak üzere, sırasıyla birçok karaciğere özgü ve kasa özgü genin transkripsiyonunu artırır. RNA sinyali, farklılaşma ve gelişim sırasında RNA'lar tarafından belirli lokuslara genel kromatin modifiye edici komplekslerin ve DNA metiltransferazların hiyerarşisinin diferansiyel olarak işe alınmasını içerir. Diğer epigenetik değişikliklere RNA'nın farklı ek formlarının üretimi veya çift sarmallı RNA (RNAi) oluşumu aracılık eder. Genin açıldığı hücrenin torunları, gen aktivasyonu için orijinal uyarıcı artık mevcut olmasa bile bu aktiviteyi miras alacaktır. Bu genler genellikle sinyal iletimi ile açılır veya kapatılır, ancak sinsitya veya boşluk kavşaklarının önemli olduğu bazı sistemlerde RNA difüzyon yoluyla doğrudan diğer hücrelere veya çekirdeklere yayılabilir. Büyük miktarda RNA ve protein, oogenez sırasında anne tarafından veya hemşire hücreler aracılığıyla zigota katkıda bulunur ve bu da maternal etki fenotiplerine neden olur. Babadan daha az miktarda sperm RNA'sı aktarılır, ancak bu epigenetik bilginin birkaç nesil yavruda gözle görülür değişikliklere yol açabileceğine dair yeni kanıtlar vardır. ⓘ
Dolaylı yoldan gen ifadesine etkiyen mekanizmalar post-transkripsyonel (transkripsiyon sonrası, yani ana DNA molekülünden RNA molekülü elde edildikten sonra) mekanizmaları özellikle de nonkoding RNA’nın (RNAi vb.) kodlayıcı RNA (mRNA) üzerine etkiyerek protein sentezini engellemesini içerir. ⓘ
MikroRNA'lar
MikroRNA'lar (miRNA'lar), boyutları 17 ila 25 nükleotid arasında değişen kodlamayan RNA'ların üyeleridir. miRNA'lar bitki ve hayvanlarda çok çeşitli biyolojik işlevleri düzenler. Şimdiye kadar, 2013 yılında, insanlarda yaklaşık 2000 miRNA keşfedilmiştir ve bunlar bir miRNA veri tabanında çevrimiçi olarak bulunabilir. Bir hücrede ifade edilen her miRNA, aşağı regüle ettiği yaklaşık 100 ila 200 mesajcı RNA'yı (mRNA) hedefleyebilir. mRNA'ların aşağı regülasyonunun çoğu, hedeflenen mRNA'nın bozunmasına neden olarak gerçekleşirken, bazı aşağı regülasyon proteine çeviri düzeyinde gerçekleşir. ⓘ
İnsan protein kodlayan genlerinin yaklaşık %60'ının miRNA'lar tarafından düzenlendiği görülmektedir. Birçok miRNA epigenetik olarak düzenlenir. MiRNA genlerinin yaklaşık %50'si epigenetik metilasyon ile baskılanabilen CpG adaları ile ilişkilidir. Metillenmiş CpG adalarından gelen transkripsiyon güçlü ve kalıtsal olarak baskılanır. Diğer miRNA'lar epigenetik olarak ya histon modifikasyonları ya da kombine DNA metilasyonu ve histon modifikasyonu ile düzenlenir. ⓘ
mRNA
2011 yılında, mRNA'nın metilasyonunun insan enerji homeostazında kritik bir rol oynadığı gösterilmiştir. Obezite ile ilişkili FTO geninin RNA'daki N6-metiladenozini demetile edebildiği gösterilmiştir. ⓘ
sRNA'lar
sRNA'lar bakterilerde bulunan küçük (50-250 nükleotid), yüksek yapılı, kodlamayan RNA parçalarıdır. Patojenlerdeki virülans genleri de dahil olmak üzere gen ifadesini kontrol ederler ve ilaca dirençli bakterilerle mücadelede yeni hedefler olarak görülürler. Prokaryotlarda mRNA ve protein hedeflerine bağlanarak birçok biyolojik süreçte önemli bir rol oynarlar. Filogenetik analizleri, örneğin sRNA-mRNA hedef etkileşimleri veya protein bağlanma özellikleri aracılığıyla, kapsamlı veri tabanları oluşturmak için kullanılır. mikrobiyal genomlardaki hedeflerine dayalı sRNA-gen haritaları da oluşturulmaktadır. ⓘ
Prionlar
Prionlar, proteinlerin bulaşıcı formlarıdır. Genel olarak, proteinler farklı hücresel işlevleri yerine getiren ayrı birimler halinde katlanır, ancak bazı proteinler prion olarak bilinen bulaşıcı bir konformasyonel durum da oluşturabilir. Genellikle bulaşıcı hastalık bağlamında görülse de prionlar, aynı proteinin diğer doğal hal versiyonlarını katalitik olarak bulaşıcı bir konformasyonel duruma dönüştürme yetenekleriyle daha gevşek bir şekilde tanımlanır. Bu ikinci anlamda, genomda bir değişiklik olmaksızın fenotipik bir değişikliğe neden olabilen epigenetik ajanlar olarak görülebilirler. ⓘ
Fungal prionlar, bazıları tarafından epigenetik olarak kabul edilir çünkü prionun neden olduğu bulaşıcı fenotip, genomda değişiklik yapılmadan kalıtılabilir. Mayada 1965 ve 1971 yıllarında keşfedilen PSI+ ve URE3, bu tür prionlar arasında en iyi çalışılan iki tanesidir. Prionlar, proteinin agregalar halinde tutulması yoluyla fenotipik bir etkiye sahip olabilir ve böylece bu proteinin aktivitesini azaltabilir. PSI+ hücrelerinde, Sup35 proteininin kaybı (translasyonun sonlandırılmasında rol oynar) ribozomların dur kodonlarını daha yüksek oranda okumasına neden olur, bu da diğer genlerde saçma mutasyonların baskılanmasıyla sonuçlanan bir etkidir. Sup35'in prion oluşturma yeteneği korunmuş bir özellik olabilir. Hücrelere PSI+ durumuna geçme ve normalde stop kodon mutasyonlarıyla sonlandırılan hareketsiz genetik özellikleri ifade etme yeteneği kazandırarak adaptif bir avantaj sağlayabilir. ⓘ
Prion temelli epigenetik Saccharomyces cerevisiae'de de gözlemlenmiştir. ⓘ
Yapısal kalıtım
Tetrahymena ve Paramecium gibi siliyatlarda, genetik olarak özdeş hücreler, hücre yüzeylerindeki siliyer sıra desenlerinde kalıtsal farklılıklar gösterir. Deneysel olarak değiştirilen desenler yavru hücrelere aktarılabilir. Görünüşe göre mevcut yapılar yeni yapılar için şablon görevi görmektedir. Bu tür kalıtım mekanizmaları belirsizdir, ancak çok hücreli organizmaların da yenilerini bir araya getirmek için mevcut hücre yapılarını kullandığını varsaymak için nedenler vardır. ⓘ
Nükleozom konumlandırması
Ökaryotik genomlar çok sayıda nükleozoma sahiptir. Nükleozom pozisyonu rastgele değildir ve DNA'nın düzenleyici proteinlere erişilebilirliğini belirler. Farklı dokularda aktif olan promotörlerin farklı nükleozom konumlandırma özelliklerine sahip olduğu gösterilmiştir. Bu durum gen ifadesi ve hücre farklılaşmasındaki farklılıkları belirler. Sperm hücrelerinde en azından bazı nükleozomların korunduğu gösterilmiştir (tüm histonların değil ama çoğunun protaminlerle yer değiştirdiği). Dolayısıyla nükleozom konumlandırması bir dereceye kadar kalıtsaldır. Son çalışmalar nükleozom konumlandırması ile DNA metilasyonu ve hidroksimetilasyonu gibi diğer epigenetik faktörler arasındaki bağlantıları ortaya çıkarmıştır. ⓘ
Histon varyantları
Farklı histon varyantları genomun belirli bölgelerine rastgele olmayan bir şekilde dahil edilir. Bunların farklı biyokimyasal özellikleri, gen düzenlemesindeki rolleri ve kromozom yapılarının korunması yoluyla genom işlevlerini etkileyebilir. ⓘ
Genomik mimari
Genomun üç boyutlu konfigürasyonu (3D genom) karmaşık, dinamik ve genomik fonksiyonun ve DNA replikasyonu, transkripsiyon ve DNA hasarı onarımı gibi nükleer süreçlerin düzenlenmesi için çok önemlidir. ⓘ
İşlevler ve sonuçlar
Geliştirme
Gelişimsel epigenetik, önceden belirlenmiş ve olasılıksal epigenez olarak ikiye ayrılabilir. Önceden belirlenmiş epigenez, DNA'daki yapısal gelişimden proteinin işlevsel olgunlaşmasına doğru tek yönlü bir harekettir. Burada "önceden belirlenmiş", gelişimin senaryolaştırılmış ve öngörülebilir olduğu anlamına gelir. Öte yandan olasılıksal epigenez, deneyimler ve dış kalıplama gelişimi ile çift yönlü bir yapı-fonksiyon gelişimidir. ⓘ
Somatik epigenetik kalıtım, özellikle DNA ve histon kovalent modifikasyonları ve nükleozomun yeniden konumlandırılması yoluyla, çok hücreli ökaryotik organizmaların gelişiminde çok önemlidir. Genom dizisi statiktir (bazı önemli istisnalar dışında), ancak hücreler farklı işlevleri yerine getiren birçok farklı türe farklılaşır ve çevreye ve hücreler arası sinyalleşmeye farklı yanıtlar verir. Bu nedenle, bireyler geliştikçe, morfojenler epigenetik olarak kalıtsal bir şekilde genleri aktive eder veya susturur ve hücrelere bir hafıza kazandırır. Memelilerde çoğu hücre nihai olarak farklılaşır, sadece kök hücreler çeşitli hücre tiplerine ("totipotensi" ve "multipotensi") farklılaşma yeteneğini korur. Memelilerde bazı kök hücreler nörogenezde olduğu gibi yaşam boyunca yeni farklılaşmış hücreler üretmeye devam eder, ancak memeliler bazı dokuların kaybına yanıt veremez, örneğin diğer bazı hayvanların yapabildiği uzuvların yenilenememesi gibi. Epigenetik modifikasyonlar nöral kök hücrelerden glial progenitör hücrelere geçişi düzenler (örneğin, oligodendrositlere farklılaşma histonların deasetilasyonu ve metilasyonu ile düzenlenir. Hayvanların aksine, bitki hücreleri nihai olarak farklılaşmaz, yeni bir bireysel bitkiye yol açma yeteneği ile totipotent kalır. Bitkiler, kromatin yeniden şekillenmesi gibi hayvanlarla aynı epigenetik mekanizmaların çoğunu kullanırken, bazı bitki hücrelerinin "hücresel hafızaları" kullanmadıkları veya gerektirmedikleri, kaderlerini belirlemek için çevreden ve çevredeki hücrelerden gelen konumsal bilgileri kullanarak gen ekspresyon modellerini sıfırladıkları varsayılmıştır. ⓘ
Epigenetik değişiklikler çevresel maruziyete yanıt olarak ortaya çıkabilir - örneğin, genistein (250 mg/kg) ile maternal diyet takviyesi, agouti geninin ifadesini etkileyen epigenetik değişikliklere sahiptir, bu da kürk rengini, ağırlığını ve kanser geliştirme eğilimini etkiler. Devam eden araştırmalar, diyabetik embriyopati gibi bilinen diğer teratojenlerin metilasyon imzaları üzerindeki etkisini keşfetmeye odaklanmıştır. ⓘ
Bir çalışmanın tartışmalı sonuçları, travmatik deneyimlerin gelecek nesillere aktarılabilecek epigenetik bir sinyal üretebileceğini öne sürdü. Fareler, ayak şokları kullanılarak kiraz çiçeği kokusundan korkmaları için eğitilmiştir. Araştırmacılar, fare yavrularının bu özel kokuya karşı artan bir isteksizliğe sahip olduğunu bildirdi. Araştırmacılar, burunda özellikle bu kiraz çiçeği kokusuna tepki veren bir koku reseptörünün işleyişini yöneten M71 adlı bir gende, DNA'nın kendisinden ziyade gen ifadesini artıran epigenetik değişiklikler olduğunu öne sürdüler. Eğitilen farelerin ve torunlarının beyinlerinde olfaktör (koku) fonksiyonu ile ilişkili fiziksel değişiklikler olmuştur. Çalışmanın düşük istatistiksel gücünün, sonuçların raporlanmasında önyargı gibi bazı düzensizliklerin kanıtı olduğu da dahil olmak üzere çeşitli eleştiriler rapor edilmiştir. Örneklem büyüklüğünün sınırları nedeniyle, bir etkinin var olsa bile istatistiksel anlamlılık dahilinde gösterilememe olasılığı vardır. Eleştiriler, iddia edilen etkilerin var olduğu varsayımıyla, aynı protokolün izlenmesi halinde rapor edilen tüm deneylerin olumlu sonuç verme olasılığının yalnızca %0,4 olduğunu öne sürmektedir. Yazarlar ayrıca hangi farelerin kardeş olduğunu belirtmemiş ve tüm farelere istatistiksel olarak bağımsız muamelesi yapmıştır. Orijinal araştırmacılar, makalenin ekinde, eleştirilerin hesaplamalarında atladığı olumsuz sonuçlara dikkat çekmiş ve gelecekte hangi farelerin kardeş olduğunu takip etmeyi taahhüt etmişlerdir. ⓘ
Kuşaklararası
Epigenetik mekanizmalar, hücre farklılaşmasının evrimsel kökeninin gerekli bir parçasıydı. Çok hücreli organizmalarda epigenetiğin genellikle farklılaşmayla ilgili bir mekanizma olduğu düşünülse de, organizmalar çoğaldığında epigenetik kalıplar "sıfırlanır", bazı kuşak ötesi epigenetik kalıtım gözlemleri olmuştur (örneğin, mısırda gözlemlenen paramutasyon olgusu). Bu çok kuşaklı epigenetik özelliklerin çoğu birkaç kuşak boyunca kademeli olarak kaybolsa da, çok kuşaklı epigenetiğin evrim ve adaptasyonun başka bir yönü olabileceği ihtimali devam etmektedir. Yukarıda belirtildiği gibi, bazıları epigenetiği kalıtsal olarak tanımlamaktadır. ⓘ
Tecrit edilmiş bir germ hattı veya Weismann bariyeri hayvanlara özgüdür ve epigenetik kalıtım bitkiler ve mikroplarda daha yaygındır. Eva Jablonka, Marion J. Lamb ve Étienne Danchin, bu etkilerin modern sentezin standart kavramsal çerçevesinin geliştirilmesini gerektirebileceğini savunmuş ve genişletilmiş bir evrimsel sentez çağrısında bulunmuştur. John Maynard Smith gibi diğer evrimsel biyologlar epigenetik kalıtımı popülasyon genetiği modellerine dahil etmiş ya da genişletilmiş evrimsel senteze açıkça şüpheyle yaklaşmışlardır (Michael Lynch). Thomas Dickins ve Qazi Rahman, DNA metilasyonu ve histon modifikasyonu gibi epigenetik mekanizmaların doğal seçilimin kontrolü altında genetik olarak kalıtıldığını ve bu nedenle daha önceki "modern senteze" uyduğunu belirtmektedir. ⓘ
Epigenetik kalıtımın geleneksel genetik kalıtımdan farklı olabileceği ve evrim için önemli sonuçları olan iki önemli yol şunlardır:
- epimutasyon oranları mutasyon oranlarından çok daha hızlı olabilir
- epimutasyonlar daha kolay tersine çevrilebilir ⓘ
Bitkilerde, kalıtsal DNA metilasyon mutasyonlarının meydana gelme olasılığı DNA mutasyonlarına kıyasla 100.000 kat daha fazladır. PSI+ sistemi gibi epigenetik olarak kalıtılan bir unsur, mutasyon ve/veya rekombinasyonun adaptif fenotipik değişikliği genetik olarak asimile etmesi için soyun yeterince uzun süre hayatta kalmasını sağlayan kısa vadeli adaptasyon için yeterince iyi bir "stop-gap" görevi görebilir. Bu olasılığın varlığı bir türün evrimleşebilirliğini artırır. ⓘ
Prokaryotlar, bitkiler ve hayvanlar da dahil olmak üzere çok çeşitli organizmalarda 100'den fazla transgenerasyonel epigenetik kalıtım olgusu bildirilmiştir. Örneğin, yas tutan pelerin kelebekleri, değişen sıcaklık deneylerine yanıt olarak hormon değişiklikleri yoluyla renk değiştirecektir. ⓘ
İpliksi mantar Neurospora crassa, sitozin metilasyonunun kontrolünü ve işlevini anlamak için önde gelen bir model sistemdir. Bu organizmada DNA metilasyonu, RIP (tekrarla indüklenen nokta mutasyonu) adı verilen bir genom savunma sisteminin kalıntılarıyla ilişkilidir ve transkripsiyon uzamasını inhibe ederek gen ekspresyonunu susturur. ⓘ
Maya prionu PSI, daha sonra yavru hücreler tarafından miras alınan bir çeviri sonlandırma faktörünün konformasyonel bir değişikliği ile üretilir. Bu, tek hücreli organizmaların çevresel strese hızla yanıt vermesini sağlayan epigenetik düzenlemeyi örnekleyerek olumsuz koşullar altında hayatta kalma avantajı sağlayabilir. Prionlar, genomda değişiklik yapmadan fenotipik bir değişikliğe neden olabilen epigenetik ajanlar olarak görülebilir. ⓘ
Mikroorganizmalardaki epigenetik işaretlerin doğrudan tespiti, polimeraz hassasiyetinin bir DNA molekülü dizilenirken metilasyon ve diğer modifikasyonların ölçülmesine izin verdiği tek moleküllü gerçek zamanlı dizileme ile mümkündür. Birkaç proje, bakterilerde genom çapında epigenetik veri toplama yeteneğini göstermiştir. ⓘ
Bakterilerde Epigenetik
Epigenetik, ökaryotlarda, özellikle de metazoanlarda temel öneme sahipken, bakterilerde farklı bir rol oynar. En önemlisi, ökaryotlar epigenetik mekanizmaları öncelikle bakterilerin nadiren yaptığı gen ifadesini düzenlemek için kullanır. Bununla birlikte, bakteriler DNA-protein etkileşimlerinin epigenetik kontrolü için postreplikatif DNA metilasyonunu yaygın olarak kullanırlar. Bakteriler ayrıca DNA adenin metilasyonunu (DNA sitozin metilasyonu yerine) epigenetik bir sinyal olarak kullanırlar. DNA adenin metilasyonu Escherichia coli, Salmonella, Vibrio, Yersinia, Haemophilus ve Brucella gibi organizmalarda bakteri virülansında önemlidir. Alphaproteobacteria'da adenin metilasyonu hücre döngüsünü düzenler ve gen transkripsiyonunu DNA replikasyonuna bağlar. Gammaproteobacteria'da adenin metilasyonu DNA replikasyonu, kromozom ayrımı, uyumsuzluk onarımı, bakteriyofajın paketlenmesi, transpozaz aktivitesi ve gen ifadesinin düzenlenmesi için sinyaller sağlar. Streptococcus pneumoniae'yi (pnömokok) kontrol eden ve bakterinin özelliklerini rastgele altı alternatif duruma dönüştürmesini sağlayan genetik bir anahtar vardır ve bu durum gelişmiş aşıların yolunu açabilir. Her bir form, faz değişkenli bir metilasyon sistemi tarafından rastgele oluşturulmaktadır. Pnömokokun ölümcül enfeksiyonlara neden olma yeteneği bu altı durumun her birinde farklıdır. Benzer sistemler diğer bakteri cinslerinde de mevcuttur. Clostridioides difficile gibi Bacillota'da adenin metilasyonu sporülasyonu, biyofilm oluşumunu ve konakçı adaptasyonunu düzenler. ⓘ
Tıp
Epigenetiğin çok sayıda ve çeşitli potansiyel tıbbi uygulamaları vardır. 2008 yılında Ulusal Sağlık Enstitüleri önümüzdeki beş yıl içinde epigenetik araştırmaları için 190 milyon dolar ayrıldığını duyurdu. Hükümet yetkilileri bu fonu duyururken epigenetiğin yaşlanma mekanizmalarını, insan gelişimini ve kanser, kalp hastalıkları, akıl hastalıkları ve diğer bazı durumların kökenlerini açıklama potansiyeline sahip olduğunu belirtmişlerdir. Duke Üniversitesi Tıp Merkezi'nden Randy Jirtle gibi bazı araştırmacılar, epigenetiğin sonuçta hastalıklarda genetikten daha büyük bir role sahip olabileceğini düşünüyor. ⓘ
İkizler
Tek yumurta ikizlerinin doğrudan karşılaştırılması, çevresel epigenetiğin sorgulanması için en uygun modeli oluşturmaktadır. Farklı çevresel maruziyetlere sahip insanlar söz konusu olduğunda, monozigotik (tek yumurta) ikizleri ilk yıllarında epigenetik olarak ayırt edilemezken, daha yaşlı ikizlerin 5-metilsitozin DNA ve histon asetilasyonunun genel içeriği ve genomik dağılımında dikkate değer farklılıklar vardı. Yaşamlarının daha azını birlikte geçiren ve/veya tıbbi geçmişlerinde daha büyük farklılıklar olan ikiz çiftleri, 5-metilsitozin DNA seviyelerinde ve H3 ve H4 histonlarının asetilasyonunda en büyük farklılıkları gösterenlerdi. ⓘ
Dizigotik (çift yumurta) ve monozigotik (tek yumurta) ikizler insanlarda epigenetik etkinin kanıtlarını göstermektedir. Tek yumurta ikizlerine dayalı bir çalışmada bol miktarda bulunacak olan DNA dizisi farklılıkları analize müdahale etmez. Çevresel farklılıklar uzun vadeli epigenetik etkiler yaratabilir ve farklı gelişimsel monozigotik ikiz alt tipleri, epigenetik açıdan uyumsuz olmaya yatkınlıkları açısından farklı olabilir. ⓘ
Kapsamlı genetik belirteçlere bakan teknolojiyi ifade eden yüksek verimli bir çalışma, 40 monozigotik ikiz çiftinden oluşan bir örnekte DNA metilasyonu ve histon modifikasyonlarındaki küresel ve lokusa özgü değişiklikleri karşılaştırmak için monozigotik ikizler arasındaki epigenetik farklılıklara odaklanmıştır. Bu durumda, yalnızca sağlıklı ikiz çiftleri incelenmiş, ancak 3 ila 74 yaş arasında geniş bir yaş aralığı temsil edilmiştir. Bu çalışmadan elde edilen en önemli sonuçlardan biri, ikiz çiftlerin iki kardeşi arasında yaşa bağlı epigenetik farklılık birikimi olduğudur. Bu birikim, epigenetik "sürüklenmenin" varlığına işaret etmektedir. Epigenetik sürüklenme, yaşla birlikte doğrudan bir işlev olarak ortaya çıkan epigenetik değişikliklere verilen addır. Yaş birçok hastalık için bilinen bir risk faktörü olsa da, yaşa bağlı metilasyon genom boyunca belirli bölgelerde farklı şekilde meydana geldiği bulunmuştur. Zaman içinde bu durum biyolojik ve kronolojik yaş arasında ölçülebilir farklılıklara yol açabilir. Epigenetik değişikliklerin yaşam tarzını yansıttığı ve klinik eşiğe ulaşılmadan önce hastalığın işlevsel biyobelirteçleri olarak işlev görebileceği bulunmuştur. ⓘ
Yaklaşık 6000 benzersiz genomik bölgenin DNA metilasyon durumu için 114 monozigotik ikiz ve 80 dizigotik ikizin analiz edildiği daha yeni bir çalışmada, blastosist bölünmesi sırasındaki epigenetik benzerliğin monozigotik eş ikizlerde fenotipik benzerliklere de katkıda bulunabileceği sonucuna varılmıştır. Bu, embriyonik gelişimin erken aşamalarındaki mikro çevrenin epigenetik işaretlerin oluşumu için oldukça önemli olabileceği fikrini desteklemektedir. Konjenital genetik hastalıklar iyi anlaşılmıştır ve epigenetiğin, örneğin Angelman sendromu ve Prader-Willi sendromunda bir rol oynayabileceği açıktır. Bunlar gen delesyonları veya genlerin inaktivasyonundan kaynaklanan normal genetik hastalıklardır, ancak alışılmadık derecede yaygındır çünkü bireyler genomik baskı nedeniyle esasen hemizigottur ve bu nedenle çoğu vakada her iki kopyanın da devre dışı bırakılması gerekirken tek bir genin devre dışı bırakılması hastalığa neden olmak için yeterlidir. ⓘ
Genomik baskı
Bazı insan hastalıkları, memelilerde baba ve annenin üreme hücrelerindeki belirli genomik lokuslar için farklı epigenetik modellere katkıda bulunduğu bir fenomen olan genomik imprinting ile ilişkilidir. İnsan hastalıklarında en iyi bilinen imprinting vakası Angelman sendromu ve Prader-Willi sendromudur - her ikisi de aynı genetik mutasyon, kromozom 15q kısmi delesyonu tarafından üretilebilir ve gelişecek olan belirli sendrom, mutasyonun çocuğun annesinden mi yoksa babasından mı miras kaldığına bağlıdır. Bunun nedeni bölgede genomik baskının varlığıdır. Beckwith-Wiedemann sendromu da genomik baskı ile ilişkilidir ve genellikle kromozom 11 üzerindeki bir bölgenin maternal genomik baskısındaki anormalliklerden kaynaklanır. ⓘ
Metil CpG-bağlayıcı protein 2 (MeCP2), BDNF promotöründen salınmadan önce fosforile edilmesi gereken ve transkripsiyona izin veren transkripsiyonel bir düzenleyicidir. Mikroarray analizlerinde MeCP2'nin ifadesinde büyük ölçekli değişiklikler bulunmamasına rağmen, Rett sendromunun altında MeCP2 genindeki mutasyonlar yatmaktadır. BDNF, MECP2 mutantında aşağı doğru düzenlenir ve Rett sendromunun yanı sıra erken nöral yaşlanmanın artması ve hasarlı DNA birikimi ile sonuçlanır. ⓘ
Överkalix çalışmasında, 19. yüzyılda ergenlik öncesi dönemde kıtlığa maruz kalan İsveçli erkeklerin baba tarafından (ancak anne tarafından değil) torunlarının kardiyovasküler hastalıktan ölme olasılığı daha düşüktü. Yiyecek bolsa, torunlarda diyabet mortalitesi artmış, bu da bunun kuşaklararası epigenetik bir kalıtım olduğunu düşündürmüştür. Kadınlarda ise tam tersi bir etki gözlenmiştir - anne karnındayken (ve dolayısıyla yumurtaları oluşurken) kıtlık yaşayan kadınların baba tarafından (ama anne tarafından değil) torunları ortalama olarak daha kısa yaşamışlardır. ⓘ
Kanser
Farklı kanser türlerinde çeşitli epigenetik mekanizmalar bozulabilir. DNA onarım genlerinin veya hücre döngüsü kontrol genlerinin epigenetik değişiklikleri sporadik (germ hattı olmayan) kanserlerde çok sık görülür ve bu sporadik kanserlerde germ hattı (ailesel) mutasyonlarından önemli ölçüde daha yaygındır. Epigenetik değişiklikler kansere hücresel dönüşümde önemlidir ve bunların manipülasyonu kanserin önlenmesi, tespiti ve tedavisi için büyük umut vaat etmektedir. Bu hastalıkların birçoğunda epigenetik etkisi olan çeşitli ilaçlar kullanılmaktadır. Epigenetiğin bu yönleri kanser epigenetiğinde ele alınmaktadır. ⓘ
Diyabetik yara iyileşmesi
Epigenetik modifikasyonlar, farklı hastalık durumlarının patofizyolojisinin anlaşılmasına ışık tutmuştur. Kanserle güçlü bir şekilde ilişkili olmalarına rağmen, diğer patolojik durumlardaki rolleri de aynı derecede önemlidir. Hiperglisemik ortamın genomik düzeyde bu tür değişikliklere yol açabileceği, makrofajların pro-enflamatuar bir duruma doğru hazırlandığı ve pro-iyileşme tipine doğru herhangi bir fenotipik değişiklik gösteremediği görülmektedir. Bu değişmiş Makrofaj Polarizasyonu olgusu, klinik ortamda çoğunlukla tüm diyabetik komplikasyonlarla ilişkilendirilmektedir. 2018 itibariyle, çeşitli raporlar farklı epigenetik modifikasyonların diyabetik komplikasyonlarla ilgisini ortaya koymaktadır. Er ya da geç, biyomedikal araçlardaki ilerlemelerle birlikte, hastalarda prognostik ve tanısal araçlar olarak bu tür biyobelirteçlerin tespiti muhtemelen alternatif yaklaşımlar olarak ortaya çıkabilir. Burada, epigenetik modifikasyonların terapötik hedefler olarak kullanılmasının, kullanımdan önce kapsamlı klinik öncesi ve klinik değerlendirme gerektirdiğinden bahsetmek kayda değerdir. ⓘ
Epigenetik olaylardan gen ifadesini değiştiren ilaç örnekleri
Beta-laktam antibiyotiklerin kullanımı glutamat reseptör aktivitesini ve siklosporinin çoklu transkripsiyon faktörleri üzerindeki etkisini değiştirebilir. Ayrıca, lityum anormal proteinlerin otofajisini etkileyebilir ve kronik kullanım yoluyla opioid ilaçlar bağımlılık fenotipleriyle ilişkili genlerin ifadesini artırabilir. ⓘ
Çığır açan 2003 tarihli bir raporda Caspi ve meslektaşları, okul öncesinden yetişkinliğe kadar birçok kez değerlendirilen binden fazla denekten oluşan sağlam bir kohortta, serotonin taşıyıcı promoter polimorfizminin kısa alelinin bir veya iki kopyasını taşıyan deneklerin, eşit ELS maruziyetine sahip uzun alel homozigotlarına kıyasla çocuklukta kötü muameleye maruz kaldıklarında daha yüksek yetişkin depresyonu ve intihar eğilimi oranları sergilediklerini göstermiştir. ⓘ
Ebeveyn beslenmesi, strese veya endokrin bozucu kimyasallara utero maruziyet, farklı eş kalitesinin çekiciliği gibi erkek kaynaklı maternal etkiler ve annenin yanı sıra baba yaşı ve yavru cinsiyeti, muhtemelen bir germ hattı epimutasyonunun nihayetinde yavrularda ifade edilip edilmediğini ve nesiller arası kalıtımın gelecek nesiller boyunca sabit kalma derecesini etkileyebilir. Bununla birlikte, epigenetik etkilerin nesiller arasında aktarılıp aktarılamayacağı ve ne ölçüde aktarılabileceği, özellikle insanlarda belirsizliğini korumaktadır. ⓘ
Bağımlılık
Bağımlılık, beynin ödül sisteminde transkripsiyonel ve nöroepigenetik mekanizmalar yoluyla ortaya çıkan ve zaman içinde bağımlılık yapıcı bir uyarana (örneğin morfin, kokain, cinsel ilişki, kumar vb.) kronik olarak yüksek düzeyde maruz kalma sonucu oluşan bir bozukluktur. Klinik öncesi çalışmalarda bağımlılık fenotiplerinin transgenerasyonel epigenetik kalıtımının gerçekleştiği kaydedilmiştir. Bununla birlikte, epigenetik etkilerin birden fazla nesil boyunca devam ettiğini destekleyen sağlam kanıtlar henüz insanlarda ortaya konmamıştır; örneğin, doğum öncesi sigaraya maruz kalmanın epigenetik etkisi, maruz kalmamış torunlarda gözlenmiştir. ⓘ
Depresyon
Depresyonla ilişkili fenotiplerin epigenetik kalıtımı da preklinik bir çalışmada rapor edilmiştir. Paternal stres kaynaklı özelliklerin nesiller boyunca kalıtımı, paternal germ hattı yoluyla iletilen küçük kodlamayan RNA sinyallerini içermektedir. ⓘ
Araştırma
Kalıtsal bilginin iki biçimi, yani genetik ve epigenetik, topluca ikili kalıtım olarak adlandırılır. APOBEC/AID sitozin deaminaz ailesinin üyeleri, benzer moleküler mekanizmalar kullanarak genetik ve epigenetik kalıtımı eş zamanlı olarak etkileyebilir ve kavramsal olarak bölümlere ayrılmış bu süreçler arasında bir çapraz konuşma noktası olabilir. ⓘ
Florokinolon antibiyotikler, demir şelasyonu yoluyla memeli hücrelerinde epigenetik değişikliklere neden olur. Bu, bir ko-faktör olarak demir gerektiren α-ketoglutarat bağımlı dioksijenazların inhibisyonu yoluyla epigenetik etkilere yol açar. ⓘ
İndüklenmiş pluripotent kök hücrelerin (iPSC) üretimi veya epigenetik yaklaşımla embriyonik kök hücre (ESC) fenotipinin korunması için çeşitli farmakolojik ajanlar uygulanmaktadır. Kemik iliği kök hücreleri gibi yetişkin kök hücreleri de G9a histon metiltransferaz inhibitörü BIX01294 ile tedavi edildiğinde kardiyak yetkin hücrelere farklılaşma potansiyeli göstermiştir. ⓘ
Sözde Bilim
Epigenetik bir bilim olarak gelişiminin ilk aşamalarında olduğundan ve kamu medyasında sansasyonel haberlerle kuşatıldığından, David Gorski ve genetikçi Adam Rutherford, bir kişinin genlerinin ve sağlığının zihin kontrolü ile manipüle edilebileceğine dair asılsız önerilerde bulunan yeni çağ yazarlarının yanlış ve sözde bilimsel sonuçlarının çoğalmasına karşı dikkatli olunmasını tavsiye etmişlerdir. Bilimsel terimin şarlatan yazarlar tarafından yanlış kullanımı halk arasında yanlış bilgi üretmiştir. ⓘ
Etimoloji ve anlamları
Eski Yunanca; επί- (epi-) öneki; "üstü(nde)", "üzeri(nde)", "ötesi(nde)", "öncesi(nde)" anlamlarını taşır. Γένεσις (Genesis) ise; "doğuş", "köken", "yaratılış" veya "oluşum" demektir.
Aristoteles, epigenesis "oluşum öncesi" sözcüğünü; biyolojide, o zaman en kabul gören teori olan preformasyona "önceden oluşum"a karşıt bir teori olarak kullanmıştır. Aristoteles'in epigenez teorisine göre, canlının şekli ve yapısı döllenme sırasında mevcut değildir. Bu yapı, doğuma kadar, başkalaşımlar yoluyla yavaş yavaş gelişmektedir. ⓘ
Epigenetik sözcüğü (επιγενετικός - epigenetikόs) işte ilk defa Aristoteles tarafından, epigenez'e (epigenesis'e) ait, ona dair anlamında bir sıfat olarak kullanılmıştır. Hayvanların "epigenetik oluşumlarından" ya da "epigenetik gelişimlerinden" bahsederken, onların - o günkü kanıya ters olarak - rahimde ya da yumurtada yavaş yavaş, aşama aşama gelişimlerini kastetmektedir. Böylelikle epigenetik, ilk anlamıyla, embriyolojik bir süreci anlatan bir sıfat olarak 1940'lara kadar kullanılmıştır. ⓘ
Epigenetik sözcüğü 1942'de, ilk kez bir bilim dalı anlamıyla, Conrad Waddington tarafından kullanılmıştır. Onu bir isim olarak Epigenetic Genetics (Epigenez Genetiği) sözcüklerinden, "Epigenetics" (Epigenetik) kelimesini türetmiştir. Waddington'a göre epigenetik; gelişim esnasında genotipin fenotipi nasıl oluşturduğunu inceleyen bilim dalıdır. ⓘ
Waddington'un daha çok, embriyolojik bir anlam ile oluşturduğu "epigenetik" terimi, moleküler tekniklerin gelişmesiyle, daha moleküler seviyeye indirilmiş ve de kalıtımsal anlam eklenmiştir. Bu anlamda, bugün en çok kullanılan ve de kabul gören tanımı şöyledir: Epigenetik; DNA dizisindeki değişikliklerle açıklanamayan, mitoz veya mayoz yoluyla kalıtılan gen ekspresyonu (ifadesi) değişikliklerini inceleyen bilim dalıdır. ⓘ
Gerçekte, gen ifadeleri, fenotipi belirlediğinden, Waddington'un tanımı da yanlış kabul edilmemektedir. Ancak ırsilik faktörü bulundurmadığından eksik görülmektedir. ⓘ
Böylelikle; "Epigenetik" teriminin Türkçede beş anlamı vardır diyebiliriz. Bunlar; ⓘ
- Epigenez teorisine dair anlamında sıfat, (Aristoteles)
- Irsi kavram içermeyen Epigenetik bilimi (Waddington)
- Bu bilime dair anlamında sıfat
- Irsi kavram içeren Epigenetik bilimi (çağdaş)
- Bu bilime dair anlamında sıfat
Her ne kadar, geçmişten bugüne bu beş anlama sahip olmuş olsa da, son ikisi, çağdaş bilim tarafından kabul edilen ve bundan sonra bu makalede yer verilecek olan anlamlardır. ⓘ
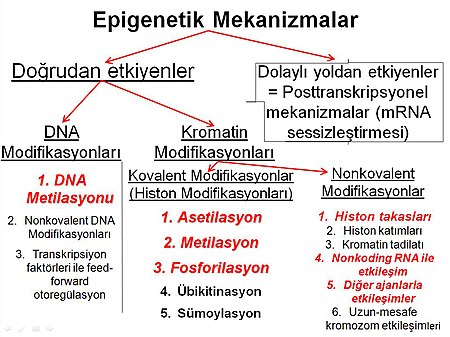
Epigenetik mekanizmalar
Epigenetik mekanizmalar ikiye ayrılır:
- Doğrudan gen ifadesini kontrol eden veya etkileyen mekanizmalar
- Dolaylı yoldan gen ifadesini kontrol eden veya etkileyen mekanizmalar ⓘ
DNA düzeyindeki modifikasyonlar
DNA düzeyindeki modifikasyonları üçe ayırabiliriz:
- DNA metilasyonu (Kovalent DNA modifikasyonları)
- Nonkovalent DNA modifikasyonlar
- Transkripsiyon faktörleri tarafından feed-forward otoregülasyon (Kovalent ve nonkovalent) ⓘ
Bu modifikasyonların arasından DNA metilasyonu en bilinen ve en işlevsel olanıdır. ⓘ
Kromatin düzeyindeki modifikasyonlar

Kromatin düzeyindeki modifikasyonları da kovalent ve nonkovalent olmak üzere ikiye ayırabiliriz:
- Kovalent modifikasyonlar histon modifikasyonlarıdır. Bunlar:
- Asetilasyon,
- Metilasyon,
- Fosforilasyon,
- Übikitinasyon ve de
- Sümoylasyondur.
- Nonkovalent modifikasyonları ise şunlardır:
- Histon takasları
- Histon katımları
- Kromatin tadilatı
- Nonkoding RNA ile etkileşim
- Diğer ajanlarla etkileşim (virüsler, farklı protein grupları)
- Uzun-mesafe kromozom etkileşimleri (hem kromozom-içi hem kromozomlar-arası) ⓘ
Epigenetik olgular
Çok çeşitli ve birbirleriyle alakasız görünen onlarca biyolojik olgu (hadise), aslında epigenetik mekanizmalarca meydana gelmektedir. Epigenetik temelli bu olguları ortaya çıkarmak aslında hiç kolay değildir, çünkü hem birçok biyolojik olgunun moleküler temeli bilinmemektedir, hem de halen keşfedilmemiş muhtelif epigenetik mekanizma mevcuttur. ⓘ
Bu olguların başlıcaları şunlardır:
- X kromozomu inaktivasyonu,
- Genomik imprinting,
- Paramütasyon,
- Floral simetri,
- Farelerde agouti lokusunun aktarılması,
- Polycomb sessizleştirmesi,
- Konum-etki çeşitliliği,
- Drosophila’da Hox genlerinin modellenmesi,
- Hücre farklılaşması,
- Nöronal gelişim ⓘ
Epigenetik mekanizmaların kalıtımı
Hücreye kimliğini kazandıran, yani fenotipini ortaya çıkartan epigenetik mekanizmaların, mitoz sırasında bir sonraki hücre soyuna nasıl aktarıldığı, maalesef halen bir merak konusudur. Aynı şekilde, bu bilginin, organizmalarda, sonraki nesillere nasıl aktarıldığı da pek anlaşılamamıştır. ⓘ
Ancak, bu epigenetik işaretlerin ya da bu epigenetik regülasyonun dölden döle aktarıldığına dair sayısız kanıt mevcuttur:
- Erişkin sirke sineklerinin (Drosophila melanogaster L.) oluşumundan sorumlu embriyonik hücreler, ortamlarından çıkarıldıklarında, bölünmeye devam ederler. Gelişmekte olan embriyoya geri konduklarında da, bacak veya kanat gibi, ilişkili oldukları yapıyı oluşturmaktadırlar. Hücreler sadece kendi kimliklerini hatırlamakla yetinmemekte, aynı zamanda bu bilgiyi hücre bölünmesinde diğer hücrelere de aktarmaktadırlar.
- Geniş çaplı bir araştırma, annenin davranışlarının, bebeğin DNA’sını etkileyebildiğini göstermektedir. Bu etkinin potansiyel mekanizması; anne sütü ile beslenen farelerin, glükokortikoid reseptör kodlayan geninin DNA metilasyonundaki değişimi ile açıklanmaktadır. Embriyonik farelerin, antiandrojenik bir bileşik olan vinklozin’e maruz kalmaları; spermatogenesisin azalmasına neden olmuştur. Ve de, bu fizyolojik etki, sonraki birçok nesilde de gözlenmiştir. ⓘ
Bitkilerle yapılan bir çalışma aşağıdaki sonuçları ortaya koymuştur:
- Strese maruz kalan bitkiler, gen ifadelerini değiştirerek, değişen ortama adaptasyon sağlamışlardır. Bunun için gerekirse genomlarını destabilize bile etmişlerdir. Böylelikle yeni bir fenotip ortaya çıkarmışlardır.
- Yeni fenotipe sahip bitkiler, stres ortamından uzaklaştırılmalarına rağmen, dört nesil boyunca bu adaptasyonu korumuşlardır. Yani stresten ortaya çıkan adaptif fenotipik değişiklikler 4 sonraki nesile kadar aktarılmıştır.
- Strese maruz kalmanın hafızası mevcuttur ve de bu hafıza dölden döle aktarılabilmektedir. ⓘ
Döllenmeden hemen sonra, erken embriyonun genomu büyük çapta ve muazzam bir demetilasyon sürecine girer. Bu ‘silinme’den kurtulan spesifik bölgeler dışında, implantasyon öncesi embriyonun genomu tamamen hipometiledir (az metillenmiş). Bu da embriyonun pluripotensisiyle mantıken bağdaşır. İmplantasyon sonrası, DNA yeniden metillenmeye başlar. ⓘ
Mitoz sırasında da benzeri bir durum yaşanır ve genom demetile olur. ⓘ
Genomun demetilasyona uğramasının ardından, nasıl tekrar aynı bölgelerin metilasyona uğradıkları, yani epigenetik bilginin nasıl korunup aktarıldığını açıklamaya çalışan muhtelif modeller mevcuttur. ⓘ
Epigenetik mekanizmaların bilgisinin, genellikle, mitoz veya mayoz sırasında, ‘silinmeyen’ kromatin modifikasyonları ve de bazı siRNA’larla aktarıldığı düşünülmektedir. ⓘ
Epigenetik etkileşimler
Bilinen bütün epigenetik mekanizmalar, kendi aralarında mükemmel bir şekilde etkileşim içindedirler. ⓘ
Hemen hemen bütün mekanizmalar birbirlerini iki-yönlü olarak etkilemektedirler ve de kontrol etmektedir. ⓘ
Ana mekanizmalar kromatin seviyesinde gerçekleşen mekanizmalardır. (Çok kısa süre öncesine kadar ana mekanizmanın DNA metilasyonu olduğu düşünülüyordu.) ⓘ
Epigenetik çalışmalar

Epigenetik bilimi bugün; ontoloji, embriyoloji, sağlık bilimi, metabolizma, kompleks hastalıklar, biyopsikoloji, antropoloji, osteoarkeoloji vb. ile ilgilenen bilim insanları tarafından, bu konularla iç içe çalışılmaktadır. ⓘ
En büyük çalışmalar;
- Agouti fareleriyle,
- İnsanda tek yumurta ikizleriyle,
- Sirke sineğiyle (Drosophila melanogaster L.),
- İnsanda lösemi hastalarıyla deneysel olarak,
- Nöronal gelişim incelemeleriyle,
- Embriyolojik gelişimlerle ve
- Bitkilerle yapılmaktadır. ⓘ
Löseminin bir türü olarak bilinen ve ölümcül bir ilik kanseri olan MDS (MiyeloDisplastik Sendrom) hastalarıyla 2006 ve 2007’de yapılan deneysel epigenetik tedavi çalışmalarında hastaların %50’si tamamen iyileşmiş, hiçbir yan etki görülmemiştir. 2008 yılının başlarında FDA tarafından kabul edilen desitabin adlı epigenetik etkili kimyasal, Amerika'da ve Avrupa'da "dacogen" ticari ismiyle piyasaya sürülmüştür. Türkiye'de ise halen Sağlık Bakanlığı'nın iznini beklemektedir. ⓘ