Mutasyon
| Üzerine bir serinin parçası ⓘ |
| Genetik |
|---|
 |
|
| Üzerine bir serinin parçası ⓘ |
| Evrimsel biyoloji |
|---|
 |
|
|

Biyolojide mutasyon, bir organizmanın, virüsün veya ekstrakromozomal DNA'nın genomunun nükleik asit dizisindeki bir değişikliktir. Viral genomlar DNA ya da RNA içerir. Mutasyonlar, DNA veya viral replikasyon, mitoz veya mayoz bölünme sırasındaki hatalardan veya DNA'daki diğer hasar türlerinden (ultraviyole radyasyona maruz kalmanın neden olduğu pirimidin dimerleri gibi) kaynaklanır; bunlar daha sonra hataya eğilimli onarımdan (özellikle mikrohomoloji aracılı uç birleştirme) geçebilir, diğer onarım biçimleri sırasında bir hataya neden olabilir veya replikasyon (translesiyon sentezi) sırasında bir hataya neden olabilir. Mutasyonlar ayrıca hareketli genetik unsurlar nedeniyle DNA segmentlerinin eklenmesi veya silinmesinden de kaynaklanabilir. ⓘ
Mutasyonlar, bir organizmanın gözlemlenebilir özelliklerinde (fenotip) tespit edilebilir değişiklikler üretebilir veya üretmeyebilir. Mutasyonlar evrim, kanser ve bağışıklık sisteminin gelişimi de dahil olmak üzere hem normal hem de anormal biyolojik süreçlerde rol oynar. Mutasyon, tüm genetik varyasyonun nihai kaynağıdır ve doğal seçilim gibi evrimsel güçlerin üzerinde hareket edebileceği hammaddeyi sağlar. ⓘ
Mutasyon, dizilerde birçok farklı türde değişikliğe yol açabilir. Genlerdeki mutasyonların hiçbir etkisi olmayabilir, bir genin ürününü değiştirebilir veya genin düzgün ya da tamamen çalışmasını engelleyebilir. Mutasyonlar genik olmayan bölgelerde de meydana gelebilir. Drosophila'nın farklı türleri arasındaki genetik varyasyonlar üzerine 2007 yılında yapılan bir çalışma, bir mutasyonun bir gen tarafından üretilen bir proteini değiştirmesi halinde sonucun muhtemelen zararlı olacağını, amino asit polimorfizmlerinin tahmini %70'inin zararlı etkilere sahip olduğunu, geri kalanının ise nötr veya marjinal olarak faydalı olduğunu ortaya koymuştur. Mutasyonların genler üzerindeki zararlı etkileri nedeniyle, organizmalar mutasyona uğramış diziyi orijinal durumuna geri döndürerek mutasyonları önlemek veya düzeltmek için DNA onarımı gibi mekanizmalara sahiptir. ⓘ
Mutasyon ya da değişinim, bir canlının genomu içindeki DNA ya da RNA diziliminde meydana gelen kalıcı değişmelerdir. Mutasyona sahip bir organizma ise mutant olarak adlandırılır. ⓘ
Mutasyonlar, genel olarak germ hattı mutasyonları ve somatik mutasyonlar olmak üzere ikiye ayrılır. Doku hücreleri içinde gerçekleşen bir mutasyon, kalıtsal olamayacağı için kuşaktan kuşağa aktarılmaz. Bedensel (somatik) mutasyonlar bu anlamda kalıtsal değildir. Eşey (üreme) hücresi mutasyonları, diğer ismiyle germ hattı mutasyonları ise kalıtsaldır ve bir sonraki nesillere aktarılır. ⓘ
Bireyin kalıtsal özelliklerinin ortaya çıkmasını sağlayan genetik şifre, herhangi bir nedenden dolayı (DNA onarımı, mayoz bölünme veya DNA replikasyonu sırasında meydana gelen hatalar, transpozonlar, virüsler, X ışını, radyasyon, ultraviyole, bazı ilaç ve mutajen kimyasallar, ani sıcaklık değişimleri vb. etkenlerle) bozulabilir. Bunun yanında hipermutasyon gibi hücresel süreçlerde organizmanın kendisi tarafından da tetiklenebilir. Bu durumda DNA’nın sentezlediği protein veya enzim bozulur. Böylece canlının, proteinden dolayı yapısı, enzimlerinden dolayı metabolizması değişebilir. Mutasyon ters evrimin temelini oluşturur. ⓘ
Mutasyonlar, kalıtsal materyalin normal kombinasyonunu değiştirmeyen, kalıtsal yapıda meydana gelen bütün değişikliklerdir. Mutasyon terimi genel olarak,
- Kromozom yapısının değişmesini,
- Kromozom sayısının değişmesini,
- Genlerdeki değişiklikleri kapsar. ⓘ
Bu anlamda mutasyonlar, sitogenetikte, değişimlerin kapsamlarına göre, Genom mutasyonu, Kromozom mutasyonu ve Gen mutasyonu olarak adlandırılıp üçe ayrılırlar. Genom mutasyonları kromozom sayısındaki değişmeler olup kromozom mutasyonları ise ışık mikroskobu altında incelenebilen ve kromozomun iç yapısında oluşan değişimlerdir. Gen mutasyonları ise ışık mikroskobu altında görünmeyen ve tek bir geni kapsayan mutasyonlardır. ⓘ
Genetik materyal olarak RNA kullanan virüsler, sürekli ve hızlı bir şekilde çoğalıp geliştikleri için onlara avantaj sağlayan hızlı mutasyon oranlarına sahiptir, ve bu şekilde insan bağışıklık sistemi gibi savunma mekanizmalarını atlatabilir ve reaksiyonlardan kaçabilirler. ⓘ
Genel Bakış
Mutasyonlar, genellikle genetik rekombinasyon yoluyla DNA'nın büyük bölümlerinin çoğaltılmasını içerebilir. Bu çoğalmalar, her milyon yılda bir hayvan genomlarında çoğaltılan onlarca ila yüzlerce gen ile yeni genlerin evrimleşmesi için önemli bir hammadde kaynağıdır. Genlerin çoğu, dizi homolojileri ile tespit edilebilen, ortak soydan gelen daha büyük gen ailelerine aittir. Yeni genler, genellikle atasal bir genin çoğaltılması ve mutasyonu yoluyla veya yeni işlevlere sahip yeni kombinasyonlar oluşturmak için farklı genlerin parçalarının rekombinasyonu yoluyla çeşitli yöntemlerle üretilir. ⓘ
Burada, protein alanları, her biri belirli ve bağımsız bir işleve sahip olan ve yeni özelliklere sahip yeni proteinleri kodlayan genler üretmek için bir araya getirilebilen modüller olarak hareket eder. Örneğin, insan gözü ışığı algılayan yapılar oluşturmak için dört gen kullanır: üçü koni hücresi veya renkli görüş için ve biri çubuk hücresi veya gece görüşü için; dördü de tek bir atasal genden ortaya çıkmıştır. Bir genin (hatta bütün bir genomun) kopyalanmasının bir diğer avantajı da mühendislik fazlalığını arttırmasıdır; bu sayede çiftteki bir gen yeni bir işlev kazanırken diğer kopya orijinal işlevini yerine getirir. Diğer mutasyon türleri zaman zaman daha önce kodlanmayan DNA'dan yeni genler yaratır. ⓘ
Kromozom sayısındaki değişiklikler, kromozomlar içindeki DNA segmentlerinin kırıldığı ve daha sonra yeniden düzenlendiği daha büyük mutasyonları içerebilir. Örneğin, Homininae'de iki kromozom birleşerek insan kromozomu 2'yi oluşturmuştur; bu birleşme diğer maymunların soyunda meydana gelmemiştir ve bu maymunlar bu ayrı kromozomları muhafaza etmektedir. Evrimde, bu tür kromozomal yeniden düzenlemelerin en önemli rolü, popülasyonların birbirleriyle melezleşme olasılığını azaltarak ve böylece bu popülasyonlar arasındaki genetik farklılıkları koruyarak bir popülasyonun yeni türlere farklılaşmasını hızlandırmak olabilir. ⓘ
Transpozonlar gibi genom üzerinde hareket edebilen DNA dizileri, bitki ve hayvanların genetik materyalinin büyük bir kısmını oluşturur ve genomların evriminde önemli olmuş olabilir. Örneğin, insan genomunda Alu dizisinin bir milyondan fazla kopyası bulunmaktadır ve bu diziler artık gen ifadesini düzenlemek gibi işlevleri yerine getirmek için işe alınmıştır. Bu hareketli DNA dizilerinin bir başka etkisi de, bir genom içinde hareket ettiklerinde, mevcut genleri mutasyona uğratabilmeleri veya silebilmeleri ve böylece genetik çeşitlilik üretebilmeleridir. ⓘ
Ölümcül olmayan mutasyonlar gen havuzunda birikir ve genetik çeşitlilik miktarını artırır. Gen havuzundaki bazı genetik değişikliklerin bolluğu doğal seçilimle azaltılabilirken, diğer "daha elverişli" mutasyonlar birikerek adaptif değişikliklere yol açabilir. ⓘ

Örneğin, bir kelebek yeni mutasyonlara sahip yavrular üretebilir. Bu mutasyonların çoğunun bir etkisi olmayacaktır; ancak bir tanesi kelebeğin yavrularından birinin rengini değiştirerek avcıların onu görmesini zorlaştırabilir (ya da kolaylaştırabilir). Bu renk değişikliği avantajlıysa, bu kelebeğin hayatta kalma ve kendi yavrularını üretme şansı biraz daha yüksektir ve zamanla bu mutasyona sahip kelebeklerin sayısı popülasyonun daha büyük bir yüzdesini oluşturabilir. ⓘ
Nötr mutasyonlar, etkileri bir bireyin uygunluğunu etkilemeyen mutasyonlar olarak tanımlanır. Bunlar genetik sürüklenme nedeniyle zaman içinde sıklıklarını artırabilir. Mutasyonların ezici çoğunluğunun bir organizmanın uygunluğu üzerinde önemli bir etkisi olmadığına inanılmaktadır. Ayrıca, DNA onarım mekanizmaları çoğu değişikliği kalıcı mutasyonlara dönüşmeden önce onarabilir ve birçok organizma aksi takdirde kalıcı olarak mutasyona uğramış somatik hücreleri ortadan kaldıracak mekanizmalara sahiptir. ⓘ
Faydalı mutasyonlar üreme başarısını artırabilir. ⓘ
Nedenler
Dört mutasyon sınıfı şunlardır: (1) spontane mutasyonlar (moleküler çürüme), (2) doğal olarak oluşan DNA hasarının hataya eğilimli replikasyon bypass'ından kaynaklanan mutasyonlar (hataya eğilimli translesiyon sentezi olarak da adlandırılır), (3) DNA onarımı sırasında ortaya çıkan hatalar ve (4) mutajenlerin neden olduğu indüklenmiş mutasyonlar. Bilim insanları ayrıca bilimsel deneyler uğruna DNA manipülasyonu yoluyla kasıtlı olarak mutant diziler de oluşturabilir. ⓘ
2017 yılında yapılan bir çalışma, kansere neden olan mutasyonların %66'sının rastgele, %29'unun çevreye bağlı (incelenen nüfus 69 ülkeyi kapsamaktadır) ve %5'inin kalıtsal olduğunu iddia etmiştir. ⓘ
İnsanlar çocuklarına ortalama 60 yeni mutasyon aktarır, ancak babalar yaşlarına bağlı olarak daha fazla mutasyon aktarır ve her yıl bir çocuğa iki yeni mutasyon ekler. ⓘ
Spontane mutasyon
Spontane mutasyonlar, sağlıklı, kontamine olmamış bir hücrede bile sıfır olmayan bir olasılıkla meydana gelir. Doğal olarak meydana gelen oksidatif DNA hasarının insanlarda günde hücre başına 10.000 kez, sıçanlarda ise günde hücre başına 100.000 kez meydana geldiği tahmin edilmektedir. Spontane mutasyonlar spesifik değişim ile karakterize edilebilir:
- Tautomerizm - Bir baz, bir hidrojen atomunun yeniden konumlandırılmasıyla değiştirilir, bu bazın hidrojen bağlanma modelini değiştirir ve replikasyon sırasında yanlış baz eşleşmesine neden olur. Teorik sonuçlar, proton tünellemesinin GC tautomerlerinin kendiliğinden oluşmasında önemli bir faktör olduğunu göstermektedir.
- Depurinasyon - Bir apurinik bölge (AP bölgesi) oluşturmak için bir pürin bazının (A veya G) kaybı.
- Deaminasyon - Hidroliz normal bir bazı orijinal amin grubu yerine keto grubu içeren atipik bir baza dönüştürür. Örnekler arasında DNA onarım mekanizmaları tarafından düzeltilebilen C → U ve A → HX (hipoksantin); ve timin normal bir DNA bazı olduğu için mutasyon olarak tespit edilme olasılığı daha düşük olan 5MeC (5-metilsitozin) → T bulunur.
- Kaymış iplikçik yanlış eşleşmesi - Replikasyon sırasında şablondan gelen yeni iplikçiğin denatürasyonu ve ardından farklı bir noktada yeniden denatürasyonu ("kayma"). Bu durum ekleme veya çıkarmalara yol açabilir. ⓘ
Hataya eğilimli replikasyon baypası
Kendiliğinden ortaya çıkan mutasyonların çoğunun, şablon iplikteki DNA hasarını geçen hataya eğilimli replikasyondan (translesiyon sentezi) kaynaklandığına dair kanıtlar artmaktadır. Farelerde mutasyonların çoğunluğu translesiyon sentezinden kaynaklanmaktadır. Benzer şekilde, mayada Kunz ve arkadaşları, spontane tek baz çifti değişimlerinin ve delesyonların %60'ından fazlasının translesiyon sentezinden kaynaklandığını bulmuştur. ⓘ
DNA onarımı sırasında ortaya çıkan hatalar
Doğal olarak meydana gelen çift iplikçik kırılmaları DNA'da nispeten düşük bir sıklıkta meydana gelse de, bunların onarımı genellikle mutasyona neden olur. Homolog olmayan uç birleştirme (NHEJ), çift iplikçik kırılmalarının onarımı için önemli bir yoldur. NHEJ, yeniden birleştirme için iki ucun biraz yanlış hizalanmasına izin vermek için birkaç nükleotidin çıkarılmasını ve ardından boşlukları doldurmak için nükleotidlerin eklenmesini içerir. Sonuç olarak, NHEJ sıklıkla mutasyonlara yol açar. ⓘ

İndüklenmiş mutasyon
İndüklenmiş mutasyonlar, mutajenlerle ve çevresel nedenlerle temas ettikten sonra gende meydana gelen değişikliklerdir. ⓘ
Moleküler düzeyde indüklenmiş mutasyonlara şunlar neden olabilir:
- Kimyasallar
- Hidroksilamin
- Baz analogları (örneğin, Bromodeoksiüridin (BrdU))
- Alkilleyici ajanlar (örneğin, N-etil-N-nitrosoüre (ENU). Bu ajanlar hem çoğalan hem de çoğalmayan DNA'yı mutasyona uğratabilir. Buna karşılık, bir baz analoğu DNA'yı yalnızca analog DNA'nın replikasyonuna dahil olduğunda mutasyona uğratabilir. Bu kimyasal mutajen sınıflarının her birinin daha sonra geçişlere, transversiyonlara veya delesyonlara yol açan belirli etkileri vardır.
- DNA eklentileri oluşturan ajanlar (örn. okratoksin A)
- DNA interkalasyon ajanları (örn. etidyum bromür)
- DNA çapraz bağlayıcıları
- Oksidatif hasar
- Nitröz asit, A ve C üzerindeki amin gruplarını diazo gruplarına dönüştürerek hidrojen bağlanma modellerini değiştirir ve bu da replikasyon sırasında yanlış baz eşleşmesine yol açar.
- Radyasyon
- Ultraviyole ışık (UV) (iyonlaştırıcı olmayan radyasyon dahil). DNA'daki iki nükleotid bazı -sitozin ve timin- özelliklerini değiştirebilecek radyasyona karşı en savunmasız olanlardır. UV ışığı, bir DNA ipliğindeki bitişik pirimidin bazlarının bir pirimidin dimeri olarak kovalent olarak birleşmesine neden olabilir. UV radyasyonu, özellikle de uzun dalga UVA, DNA'da oksidatif hasara da neden olabilir.
- İyonlaştırıcı radyasyon. Gama radyasyonu gibi iyonlaştırıcı radyasyona maruz kalmak mutasyona yol açarak muhtemelen kanser veya ölümle sonuçlanabilir. ⓘ
Eskiden mutasyonların tesadüfen oluştuğu ya da mutajenler tarafından tetiklendiği varsayılırken, bakterilerde ve yaşam ağacında mutasyonun moleküler mekanizmaları keşfedilmiştir. S. Rosenberg'in belirttiği gibi, "Bu mekanizmalar, stres tepkileri tarafından zamansal olarak düzenlenen ve hücreler/organizmalar çevrelerine uyumsuz olduklarında - stres altında kaldıklarında - potansiyel olarak adaptasyonu hızlandıran, yüksek düzeyde düzenlenmiş bir mutajenez tablosu ortaya koymaktadır." Organizmaların adaptasyon oranını artıran kendi kendine indüklenen mutajenik mekanizmalar oldukları için, bazı zamanlar adaptif mutajenez mekanizmaları olarak adlandırılmışlardır ve bakterilerdeki SOS yanıtını, ektopik intrakromozomal rekombinasyonu ve duplikasyonlar gibi diğer kromozomal olayları içerirler. ⓘ
Türlerin sınıflandırılması
Yapı üzerindeki etkiye göre


Bir genin dizilimi çeşitli şekillerde değiştirilebilir. Gen mutasyonları, nerede meydana geldiklerine ve temel proteinlerin işlevini değiştirip değiştirmediklerine bağlı olarak sağlık üzerinde farklı etkilere sahiptir. Genlerin yapısındaki mutasyonlar çeşitli türlerde sınıflandırılabilir. ⓘ
Büyük ölçekli mutasyonlar
Kromozomal yapıdaki büyük ölçekli mutasyonlar şunları içerir:
- Amplifikasyonlar (veya gen duplikasyonları) veya bir kromozomal segmentin tekrarı veya bir kromozomun fazladan bir parçasının varlığı Bir kromozomun kırık parçası homolog veya homolog olmayan bir kromozoma bağlanabilir, böylece bazı genler ikiden fazla dozda bulunur ve bu da tüm kromozomal bölgelerin birden fazla kopyasına yol açarak içlerinde bulunan genlerin dozajını artırır.
- Poliploidi, tüm kromozom setlerinin çoğalması, potansiyel olarak ayrı bir üreme popülasyonu ve türleşme ile sonuçlanır.
- Büyük kromozomal bölgelerin delesyonu, bu bölgelerdeki genlerin kaybına yol açar.
- Daha önce ayrı olan DNA parçalarını yan yana getiren mutasyonlar, potansiyel olarak ayrı genleri bir araya getirerek işlevsel olarak farklı füzyon genleri oluşturur (örn. bcr-abl).
- Kromozomal yeniden düzenleme olarak adlandırılan kromozomların yapısındaki büyük ölçekli değişiklikler, uygunluğun azalmasına ve aynı zamanda izole edilmiş, melez popülasyonlarda türleşmeye yol açabilir. Bunlar şunları içerir:
- Kromozomal translokasyonlar: homolog olmayan kromozomlardan genetik parçaların değişimi.
- Kromozomal inversiyonlar: bir kromozomal segmentin yönünün tersine çevrilmesi.
- Homolog olmayan kromozomal çaprazlama.
- İnterstisyel delesyonlar: tek bir kromozomdan bir DNA segmentini çıkaran ve böylece daha önce uzak olan genleri birleştiren kromozom içi bir delesyon. Örneğin, bir tür beyin tümörü olan insan astrositomundan izole edilen hücrelerin, Glioblastomada Kaynaşmış (FIG) geni ile reseptör tirozin kinaz (ROS) arasındaki dizileri kaldırarak bir füzyon proteini (FIG-ROS) üreten bir kromozomal delesyona sahip olduğu bulunmuştur. Anormal FIG-ROS füzyon proteini, onkojenik dönüşüme (normal hücrelerden kanser hücrelerine dönüşüm) neden olan yapısal olarak aktif kinaz aktivitesine sahiptir.
- Heterozigotluk kaybı: Daha önce iki farklı alele sahip olan bir organizmada, bir delesyon veya genetik rekombinasyon olayı ile bir alelin kaybı. ⓘ
Mayoz bölünmenin ilk evrelerinde crossing-over ile kromozomlardan kopan parçalar yer değiştirip tekrar kromozomlara bağlanabilirler. Crossing-over, homolog kromatitler arasındaki alışılagelmiş parça değişimidir; ancak genlerin rekombinasyonlarına neden olur; fakat kromozomlarda yapı değişikliklerine neden olmaz. Bazen kromatitler, crossing-over olmadan parça değişimine, yitirilmesine ya da kazanılmasına neden olur. ⓘ
Küçük ölçekli mutasyonlar
Küçük ölçekli mutasyonlar bir geni bir veya birkaç nükleotidde etkiler. (Sadece tek bir nükleotid etkileniyorsa, bunlara nokta mutasyonları denir.) Küçük ölçekli mutasyonlar şunları içerir:
- Eklemeler DNA'ya bir veya daha fazla ekstra nükleotid ekler. Genellikle transposable elementlerden veya tekrarlayan elementlerin replikasyonu sırasındaki hatalardan kaynaklanırlar. Bir genin kodlama bölgesindeki eklemeler mRNA'nın eklenmesini değiştirebilir (ekleme bölgesi mutasyonu) veya okuma çerçevesinde bir kaymaya neden olabilir (çerçeve kayması), bunların her ikisi de gen ürününü önemli ölçüde değiştirebilir. Eklemeler, transpoze edilebilir elementin eksizyonu ile tersine çevrilebilir.
- Delesyonlar DNA'dan bir veya daha fazla nükleotidi çıkarır. Eklemeler gibi, bu mutasyonlar da genin okuma çerçevesini değiştirebilir. Genel olarak geri döndürülemezler: Teorik olarak bir ekleme ile tam olarak aynı dizilim geri getirilebilse de, herhangi bir konumdaki çok kısa bir silmeyi (örneğin 1-2 baz) geri döndürebilen aktarılabilir elementlerin ya var olma olasılığı çok düşüktür ya da hiç yoktur.
- Genellikle kimyasalların ya da DNA replikasyonunun hatalı çalışmasının neden olduğu yer değiştirme mutasyonları, tek bir nükleotidi diğeriyle değiştirir. Bu değişiklikler geçişler veya transversiyonlar olarak sınıflandırılır. En yaygın olanı, bir pürinin bir pürinle (A ↔ G) veya bir pirimidinin bir pirimidinle (C ↔ T) yer değiştirdiği geçişlerdir. Bir geçişe nitröz asit, baz yanlış eşleşmesi veya BrdU gibi mutajenik baz analogları neden olabilir. Daha az yaygın olanı ise bir pürinin bir pirimidinle veya bir pirimidinin bir pürinle (C/T ↔ A/G) yer değiştirdiği transversiyonlardır. Transversiyona örnek olarak adeninin (A) sitozine (C) dönüşmesi verilebilir. Nokta mutasyonları, DNA'nın tek baz çiftlerinin veya bir gen içindeki diğer küçük baz çiftlerinin modifikasyonlarıdır. Bir nokta mutasyonu, nükleotidin orijinal haline geri döndüğü başka bir nokta mutasyonu (gerçek geri dönüşüm) veya ikinci bölge geri dönüşümü (gen işlevselliğinin yeniden kazanılmasıyla sonuçlanan başka bir yerde tamamlayıcı bir mutasyon) ile tersine çevrilebilir. Aşağıda tartışıldığı gibi, bir genin protein kodlama bölgesinde meydana gelen nokta mutasyonları eşanlamlı veya eşanlamlı olmayan ikameler olarak sınıflandırılabilir, ikincisi de yanlış veya saçma mutasyonlara ayrılabilir. ⓘ
Protein dizisi üzerindeki etkiye göre

Bir mutasyonun protein dizisi üzerindeki etkisi, kısmen genomun neresinde meydana geldiğine, özellikle de kodlayıcı veya kodlayıcı olmayan bir bölgede olup olmadığına bağlıdır. Promotörler, arttırıcılar ve susturucular gibi bir genin kodlamayan düzenleyici dizilerindeki mutasyonlar, gen ifadesi seviyelerini değiştirebilir, ancak protein dizisini değiştirme olasılığı daha düşüktür. İntronlar içindeki ve bilinen biyolojik işlevi olmayan bölgelerdeki (örn. psödogenler, retrotranspozonlar) mutasyonlar genellikle nötrdür, fenotip üzerinde etkisi yoktur - ancak intron mutasyonları mRNA splicing'i etkilerse protein ürününü değiştirebilir. ⓘ
Genomun kodlama bölgelerinde meydana gelen mutasyonların protein ürününü değiştirme olasılığı daha yüksektir ve amino asit dizisi üzerindeki etkilerine göre kategorize edilebilirler:
- Bir çerçeve kayması mutasyonu, bir DNA dizisinden üçe eşit olarak bölünemeyen bir dizi nükleotidin eklenmesi veya silinmesinden kaynaklanır. Kodonlar tarafından gen ifadesinin üçlü doğası nedeniyle, ekleme veya silme okuma çerçevesini veya kodonların gruplandırılmasını bozabilir ve orijinalinden tamamen farklı bir çeviri ile sonuçlanabilir. Silme veya ekleme dizide ne kadar erken gerçekleşirse, üretilen protein de o kadar değişmiş olur. (Örneğin, CCU GAC UAC CUA kodu prolin, aspartik asit, tirozin ve lösin amino asitlerini kodlar. CCU'daki U silinirse, ortaya çıkan dizi CCG ACU ACC UAx olur ve bunun yerine prolin, treonin, treonin ve başka bir amino asidin bir kısmını veya belki de bir dur kodonunu kodlar (burada x sonraki nükleotidi temsil eder). Buna karşılık, üçe eşit olarak bölünebilen herhangi bir ekleme veya silme işlemi çerçeve içi mutasyon olarak adlandırılır.
- Bir nokta ikame mutasyonu tek bir nükleotidde değişiklikle sonuçlanır ve eşanlamlı ya da eşanlamlı olmayan olabilir.
- Eşanlamlı bir ikame, bir kodonu aynı amino asidi kodlayan başka bir kodonla değiştirir, böylece üretilen amino asit dizisi değişmez. Eşanlamlı mutasyonlar genetik kodun dejenere doğası nedeniyle meydana gelir. Bu mutasyon herhangi bir fenotipik etkiye yol açmazsa, sessiz olarak adlandırılır, ancak tüm eşanlamlı ikameler sessiz değildir. (İntronlar gibi kodlama bölgelerinin dışındaki nükleotidlerde de sessiz mutasyonlar olabilir, çünkü tam nükleotid dizisi kodlama bölgelerinde olduğu kadar önemli değildir, ancak bunlar eşanlamlı ikame olarak kabul edilmez).
- Eşanlamlı olmayan bir ikame, bir kodonu farklı bir amino asidi kodlayan başka bir kodonla değiştirir, böylece üretilen amino asit dizisi değiştirilir. Eşanlamlı olmayan ikameler, anlamsız veya yanlış anlamlı mutasyonlar olarak sınıflandırılabilir:
- Anlamsız mutasyon bir nükleotidi değiştirerek farklı bir amino asidin ikame edilmesine neden olur. Bu da ortaya çıkan proteini işlevsiz hale getirebilir. Bu tür mutasyonlar Epidermolysis bullosa, orak hücre hastalığı ve SOD1 aracılı ALS gibi hastalıklardan sorumludur. Öte yandan, bir amino asit kodonunda farklı, ancak kimyasal olarak benzer bir amino asit kullanımıyla sonuçlanan bir yanlış anlam mutasyonu meydana gelirse, bazen proteinde çok az değişiklik olur veya hiç değişiklik olmaz. Örneğin, AAA'dan AGA'ya bir değişiklik, amaçlanan lizine kimyasal olarak benzer bir molekül olan arginin kodlayacaktır. Bu ikinci durumda mutasyonun fenotip üzerinde çok az etkisi olacak veya hiç etkisi olmayacaktır ve bu nedenle nötr olacaktır.
- Anlamsız mutasyon, bir DNA dizisinde erken bir stop kodonuna veya transkripsiyonlu mRNA'da anlamsız bir kodona ve muhtemelen kesilmiş ve genellikle işlevsiz bir protein ürününe neden olan bir nokta mutasyonudur. Bu tür mutasyonlar konjenital adrenal hiperplazi gibi farklı hastalıklarla ilişkilendirilmiştir. (Bkz. Dur kodonu.) ⓘ
İşlev üzerindeki etkiye göre
- İnaktive edici mutasyonlar olarak da adlandırılan işlev kaybı mutasyonları, gen ürününün daha az işleve sahip olmasına veya hiç işleve sahip olmamasına (kısmen veya tamamen inaktive olmasına) neden olur. Alelde tam bir işlev kaybı (null alel) olduğunda, Muller'in morf şemasında genellikle amorf veya amorfik mutasyon olarak adlandırılır. Bu tür mutasyonlarla ilişkili fenotipler çoğunlukla resesiftir. İstisnalar, organizmanın haploid olduğu veya normal bir gen ürününün azaltılmış dozajının normal bir fenotip için yeterli olmadığı durumlardır (buna haploinsufficiency denir).
- Aktive edici mutasyonlar olarak da adlandırılan işlev kazanımı mutasyonları, gen ürününü, etkisi güçlenecek (gelişmiş aktivasyon) veya hatta farklı ve anormal bir işlevin yerini alacak şekilde değiştirir. Yeni alel oluşturulduğunda, orijinal alelin yanı sıra yeni oluşturulan aleli de içeren bir heterozigot yeni aleli ifade edecektir; genetik olarak bu mutasyonları baskın fenotipler olarak tanımlar. Muller'in morflarından birkaçı, hipermorf (artan gen ifadesi) ve neomorf (yeni işlev) dahil olmak üzere işlev kazanımına karşılık gelir. Aralık 2017'de ABD hükümeti, 2014 yılında uygulanan ve "Kuş gribi, SARS ve Orta Doğu Solunum Sendromu veya MERS virüsleri gibi" patojenleri geliştiren herhangi bir yeni "işlev kazanımı" deneyi için federal finansmanı yasaklayan geçici bir yasağı kaldırdı.
- Baskın negatif mutasyonlar (antimorfik mutasyonlar olarak da adlandırılır), vahşi tip alele karşı antagonist olarak hareket eden değiştirilmiş bir gen ürününe sahiptir. Bu mutasyonlar genellikle değişmiş bir moleküler fonksiyonla (genellikle inaktif) sonuçlanır ve baskın veya yarı baskın bir fenotip ile karakterize edilir. İnsanlarda, baskın negatif mutasyonlar kanserle ilişkilendirilmiştir (örneğin, p53, ATM, CEBPA ve PPARgamma genlerindeki mutasyonlar). Marfan sendromu, kromozom 15 üzerinde bulunan ve hücre dışı matrisin bir glikoprotein bileşeni olan fibrillin-1'i kodlayan FBN1 genindeki mutasyonlardan kaynaklanır. Marfan sendromu aynı zamanda dominant negatif mutasyon ve haploinsufficiency örneğidir.
- Mullerian sınıflandırmasından sonra hipomorflar, vahşi tip alele kıyasla azalmış gen ekspresyonu ile hareket eden değiştirilmiş gen ürünleri ile karakterize edilir. Genellikle, hipomorfik mutasyonlar resesiftir, ancak haploinsufficiency bazı alellerin dominant olmasına neden olur.
- Neomorflar, yeni protein ürünü sentezinin kontrolü ile karakterize edilir.
- Öldürücü mutasyonlar, mutasyonları taşıyan organizmaların ölümüne yol açan mutasyonlardır.
- Geri mutasyon ya da reversiyon, orijinal diziyi ve dolayısıyla orijinal fenotipi geri getiren bir nokta mutasyonudur. ⓘ
Uygunluk üzerindeki etkisine göre (zararlı, faydalı, nötr mutasyonlar)
Genetikte, mutasyonları zararlı veya faydalı (veya nötr) olarak sınıflandırmak bazen yararlıdır:
- Zararlı veya zararlı bir mutasyon organizmanın uygunluğunu azaltır. Temel genlerdeki mutasyonların hepsi olmasa da çoğu zararlıdır (bir mutasyon temel bir proteindeki amino asit dizilimini değiştirmiyorsa, çoğu durumda zararsızdır).
- Faydalı ya da avantajlı bir mutasyon organizmanın uygunluğunu artırır. Örnek olarak bakterilerde antibiyotik direncine yol açan mutasyonlar verilebilir (bakteriler için faydalıdır ancak genellikle insanlar için değildir).
- Nötr bir mutasyonun organizma üzerinde zararlı ya da faydalı bir etkisi yoktur. Bu tür mutasyonlar sabit bir oranda meydana gelir ve moleküler saatin temelini oluşturur. Nötr moleküler evrim teorisinde, nötr mutasyonlar moleküler düzeyde çoğu varyasyonun temeli olarak genetik sürüklenmeyi sağlar. Hayvanlarda veya bitkilerde, genomlarının büyük çoğunluğunun kodlama yapmadığı veya belirgin bir işlevi olmayan tekrarlayan dizilerden ("önemsiz DNA") oluştuğu göz önüne alındığında, mutasyonların çoğu nötrdür.
Binlerce, milyonlarca mutasyonun test edildiği büyük ölçekli kantitatif mutajenez taramaları, her zaman mutasyonların daha büyük bir kısmının zararlı etkilere sahip olduğunu, ancak her zaman bir dizi faydalı mutasyonun da geri döndüğünü tespit eder. Örneğin, E. coli'deki tüm gen delesyonlarının taranmasında, mutasyonların %80'i negatif, ancak %20'si pozitifti, ancak birçoğunun büyüme üzerinde çok küçük bir etkisi vardı (koşula bağlı olarak). Gen silinmelerinin tüm genlerin çıkarılmasını içerdiğini, bu nedenle nokta mutasyonlarının neredeyse her zaman çok daha küçük bir etkiye sahip olduğunu unutmayın. Streptococcus pneumoniae'deki benzer bir taramada, ancak bu kez transpozon eklemeleriyle, ekleme mutantlarının %76'sı nötr olarak sınıflandırılmış, %16'sının uygunluğu önemli ölçüde azalmış, ancak %6'sı avantajlı olmuştur. ⓘ
Bu sınıflandırma açıkça göreceli ve biraz da yapaydır: koşullar değiştiğinde zararlı bir mutasyon hızla faydalı bir mutasyona dönüşebilir. Ayrıca, birçok mutasyonun küçük ve çoğunlukla ihmal edilebilir etkileri olabileceği, ancak belirli koşullar altında önemli hale geleceği için zararlı/faydalıdan nötre doğru bir eğim vardır. Ayrıca, birçok özellik yüzlerce gen (veya lokus) tarafından belirlenir, böylece her bir lokusun sadece küçük bir etkisi vardır. Örneğin, insan boyu yüzlerce genetik varyant ("mutasyon") tarafından belirlenir, ancak beslenmenin etkisi dışında her birinin boy üzerinde çok küçük bir etkisi vardır. Hayvan ya da bitki gruplarındaki çok çeşitli boyutların gösterdiği gibi, boy (ya da boyut) kendisi az ya da çok faydalı olabilir. ⓘ
Uygunluk etkilerinin dağılımı (DFE)
Mutajenez deneyleri ve moleküler sekans verilerine uygulanan teorik modeller kullanılarak uygunluk etkilerinin (DFE) dağılımını çıkarmak için girişimlerde bulunulmuştur. Farklı mutasyon türlerinin (yani, güçlü zararlı, neredeyse nötr veya avantajlı) göreceli bolluğunu belirlemek için kullanılan DFE, genetik varyasyonun sürdürülmesi, genomik bozulma oranı, akraba evliliğinin aksine eşeyli üremenin sürdürülmesi ve cinsiyet ve genetik rekombinasyonun evrimi gibi birçok evrimsel soruyla ilgilidir. DFE, hafif veya hiç etkisi olmayan mutasyonların dağılımına kıyasla, varsayılan olarak şiddetli etkileri olan mutasyonların dağılımının çarpıklığını izleyerek de takip edilebilir. Özetle, DFE evrimsel dinamiklerin öngörülmesinde önemli bir rol oynamaktadır. DFE'yi incelemek için teorik, deneysel ve analitik yöntemler de dahil olmak üzere çeşitli yaklaşımlar kullanılmıştır.
- Mutajenez deneyi: DFE'yi araştırmak için doğrudan yöntem, mutasyonları tetiklemek ve daha sonra virüslerde, bakterilerde, mayada ve Drosophila'da zaten yapılmış olan mutasyonel uygunluk etkilerini ölçmektir. Örneğin, virüslerde DFE üzerine yapılan çalışmaların çoğu, nokta mutasyonları oluşturmak ve her mutantın göreceli uygunluğunu ölçmek için bölgeye yönelik mutajenezi kullanmıştır. Escherichia coli'de bir çalışma, Tn10'un bir türevinin rastgele yerleştirilmesinin uygunluğunu doğrudan ölçmek için transpozon mutajenezini kullanmıştır. Mayada, yüksek kaliteli sistematik mutant kütüphaneleri oluşturmak ve yüksek verimle uygunluğu ölçmek için kombine bir mutajenez ve derin dizileme yaklaşımı geliştirilmiştir. Bununla birlikte, birçok mutasyonun tespit edilemeyecek kadar küçük etkileri olduğu ve mutajenez deneylerinin yalnızca orta derecede büyük etkiye sahip mutasyonları tespit edebildiği göz önüne alındığında; DNA dizi analizi bu mutasyonlar hakkında değerli bilgiler sağlayabilir. ⓘ
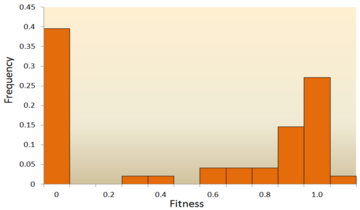
- Moleküler dizi analizi: DNA dizileme teknolojisinin hızla gelişmesiyle birlikte, muazzam miktarda DNA dizileme verisi mevcuttur ve gelecekte daha da fazlası elde edilecektir. DNA dizisi verilerinden DFE'yi çıkarmak için çeşitli yöntemler geliştirilmiştir. Türler içindeki ve arasındaki DNA dizisi farklılıklarını inceleyerek, nötr, zararlı ve avantajlı mutasyonlar için DFE'nin çeşitli özelliklerini çıkarabiliyoruz. Spesifik olmak gerekirse, DNA dizisi analizi yaklaşımı, mutajenez deneyleri yoluyla neredeyse hiç tespit edilemeyen çok küçük etkilere sahip mutasyonların etkilerini tahmin etmemizi sağlar. ⓘ
Uygunluk etkilerinin dağılımına ilişkin en eski teorik çalışmalardan biri, etkili bir teorik popülasyon genetikçisi olan Motoo Kimura tarafından yapılmıştır. Onun nötr moleküler evrim teorisi, yeni mutasyonların çoğunun son derece zararlı olacağını, küçük bir kısmının ise nötr olacağını öne sürmektedir. Hiroshi Akashi'nin daha sonraki bir önerisi, DFE için modları yüksek derecede zararlı ve nötr mutasyonlar etrafında toplanan iki modlu bir model önermiştir. Her iki teori de yeni mutasyonların büyük çoğunluğunun nötr veya zararlı olduğu ve avantajlı mutasyonların nadir olduğu konusunda hemfikirdir ve bu durum deneysel sonuçlarla desteklenmiştir. Buna bir örnek, veziküler stomatit virüsündeki rastgele mutasyonların DFE'si üzerine yapılan bir çalışmadır. Tüm mutasyonların %39,6'sı ölümcül, %31,2'si ölümcül olmayan zararlı ve %27,1'i nötrdür. Bir başka örnek de maya ile yapılan yüksek verimli bir mutajenez deneyinden gelmektedir. Bu deneyde, genel DFE'nin nötr mutasyonlardan oluşan bir küme ve zararlı mutasyonların geniş bir dağılımı ile iki modlu olduğu gösterilmiştir. ⓘ
Nispeten az sayıda mutasyon avantajlı olsa da, avantajlı olanlar evrimsel değişimlerde önemli bir rol oynamaktadır. Nötr mutasyonlar gibi, zayıf seçilmiş avantajlı mutasyonlar da rastgele genetik sürüklenme nedeniyle kaybolabilir, ancak güçlü seçilmiş avantajlı mutasyonların sabitlenme olasılığı daha yüksektir. Avantajlı mutasyonların DFE'sinin bilinmesi, evrimsel dinamikleri tahmin etme becerisinin artmasını sağlayabilir. Avantajlı mutasyonlar için DFE üzerine teorik çalışmalar John H. Gillespie ve H. Allen Orr tarafından yapılmıştır. Avantajlı mutasyonlar için dağılımın çok çeşitli koşullar altında üstel olması gerektiğini öne sürmüşlerdir ve bu genel olarak, en azından güçlü bir şekilde seçilmiş avantajlı mutasyonlar için deneysel çalışmalarla desteklenmiştir. ⓘ
Genel olarak, mutasyonların çoğunun nötr veya zararlı olduğu ve avantajlı mutasyonların nadir olduğu kabul edilmektedir; ancak, mutasyon türlerinin oranı türler arasında değişiklik göstermektedir. Bu durum iki önemli noktaya işaret etmektedir: birincisi, etkili nötr mutasyonların oranının, etkili popülasyon büyüklüğüne bağlı olarak türler arasında değişiklik göstermesi muhtemeldir; ikincisi, zararlı mutasyonların ortalama etkisi türler arasında önemli ölçüde değişiklik göstermektedir. Buna ek olarak, DFE kodlama bölgeleri ve kodlama yapmayan bölgeler arasında da farklılık gösterir; kodlama yapmayan DNA'nın DFE'si daha zayıf seçilmiş mutasyonlar içerir. ⓘ
Kalıtım yoluyla

Özel üreme hücrelerine sahip çok hücreli organizmalarda mutasyonlar, üreme hücreleri aracılığıyla torunlara aktarılabilen germ hattı mutasyonları ve özel üreme grubu dışındaki hücreleri içeren ve genellikle torunlara aktarılmayan somatik mutasyonlar (edinilmiş mutasyonlar olarak da adlandırılır) olarak alt bölümlere ayrılabilir. ⓘ
Diploid organizmalar (örneğin insanlar) her bir genin iki kopyasını içerir; bir baba ve bir anne aleli. Her bir kromozomda mutasyon oluşumuna bağlı olarak mutasyonları üç tipte sınıflandırabiliriz. Vahşi tip ya da homozigot mutasyonsuz organizma, hiçbir alelin mutasyona uğramadığı organizmadır.
- Heterozigot mutasyon, yalnızca bir alelin mutasyona uğramasıdır.
- Homozigot mutasyon, hem baba hem de anne alellerinin özdeş mutasyonudur.
- Bileşik heterozigot mutasyonlar veya genetik bir bileşik, baba ve anne alellerinde iki farklı mutasyondan oluşur. ⓘ
Germ hattı mutasyonu
Bir bireyin üreme hücrelerindeki bir germ hattı mutasyonu, yavruda yapısal bir mutasyona, yani her hücrede mevcut olan bir mutasyona yol açar. Konstitüsyonel bir mutasyon döllenmeden çok kısa bir süre sonra da ortaya çıkabilir veya bir ebeveyndeki önceki konstitüsyonel mutasyondan devam edebilir. Bir germ hattı mutasyonu, organizmaların sonraki nesillerine aktarılabilir. ⓘ
Üreme hücreleri üretmek için özel bir germ hattına sahip hayvanlarda germ hattı ve somatik mutasyonlar arasındaki ayrım önemlidir. Ancak, özel bir germ hattı bulunmayan bitkilerdeki mutasyonların etkilerini anlamada çok az değeri vardır. Tomurcuklanma gibi mekanizmalarla eşeysiz olarak üreyen hayvanlarda da ayrım bulanıktır, çünkü yavru organizmaları meydana getiren hücreler aynı zamanda o organizmanın germ hattını da meydana getirir. ⓘ
Ebeveynlerden herhangi birinden miras alınmayan yeni bir germ hattı mutasyonuna de novo mutasyon denir. ⓘ
Somatik mutasyon
Genetik yapıda bir ebeveynden miras alınmayan ve yavrulara da geçmeyen bir değişikliğe somatik mutasyon denir. Somatik mutasyonlar, germ hattını etkilemedikleri için bir organizmanın yavruları tarafından miras alınmazlar. Ancak, mitoz bölünme sırasında aynı organizma içinde mutasyona uğramış bir hücrenin tüm döllerine aktarılırlar. Bu nedenle bir organizmanın büyük bir bölümü aynı mutasyonu taşıyabilir. Bu tür mutasyonlar genellikle ultraviyole radyasyon veya bazı zararlı kimyasallara maruz kalma gibi çevresel nedenlerden kaynaklanır ve kanser gibi hastalıklara neden olabilir. ⓘ
Bitkilerde, bazı somatik mutasyonlar tohum üretimine gerek kalmadan, örneğin aşılama ve kök kesimi yoluyla çoğaltılabilir. Bu tür mutasyonlar "Delicious" elması ve "Washington" göbek portakalı gibi yeni meyve türlerinin ortaya çıkmasını sağlamıştır. ⓘ
İnsan ve fare somatik hücreleri, her iki tür için de germ hattı mutasyon oranından on kat daha yüksek bir mutasyon oranına sahiptir; fareler, hücre bölünmesi başına insanlardan daha yüksek bir hem somatik hem de germ hattı mutasyon oranına sahiptir. Germ hattı ve somatik dokular arasındaki mutasyon oranındaki eşitsizlik, muhtemelen genom bakımının germ hattında somaya göre daha büyük önemini yansıtmaktadır. ⓘ
Özel sınıflar
- Koşullu mutasyon, belirli "izin verici" çevresel koşullar altında vahşi tip (veya daha az şiddetli) fenotipe ve belirli "kısıtlayıcı" koşullar altında mutant fenotipe sahip bir mutasyondur. Örneğin, sıcaklığa duyarlı bir mutasyon yüksek sıcaklıkta (kısıtlayıcı koşul) hücre ölümüne neden olabilir, ancak daha düşük bir sıcaklıkta (izin verici koşul) zararlı sonuçları olmayabilir. Bu mutasyonlar, otonom olarak ortaya çıkan diğer mutasyonların aksine, tezahürleri belirli koşulların varlığına bağlı olduğu için otonom değildir. İzin verici koşullar sıcaklık, belirli kimyasallar, ışık veya genomun diğer bölümlerindeki mutasyonlar olabilir. Transkripsiyonel anahtarlar gibi in vivo mekanizmalar koşullu mutasyonlar yaratabilir. Örneğin, Steroid Bağlama Alanının birleşmesi, bir steroid ligandının varlığına bağlı olarak bir genin ifadesini değiştirebilen transkripsiyonel bir anahtar oluşturabilir. Koşullu mutasyonlar, gen ifadesi üzerinde kontrol sağladıkları için araştırma uygulamalarına sahiptir. Bu, özellikle belirli bir büyüme döneminden sonra ifadeye izin vererek yetişkinlerdeki hastalıkları incelemek için kullanışlıdır, böylece model organizmalarda gelişim aşamalarında görülen gen ifadesinin zararlı etkisini ortadan kaldırır. Belirli koşullar altında aktive olan promotörlerle birlikte kullanılan Cre-Lox rekombinasyonu gibi DNA Rekombinaz sistemleri koşullu mutasyonlar oluşturabilir. İkili Rekombinaz teknolojisi, birden fazla gende eşzamanlı mutasyonların bir sonucu olarak ortaya çıkan hastalıkları incelemek için çoklu koşullu mutasyonları indüklemek için kullanılabilir. Yalnızca belirli izin verilen sıcaklıklarda birleşerek uygunsuz protein sentezine ve dolayısıyla diğer sıcaklıklarda işlev kaybı mutasyonlarına yol açan belirli inteinler tanımlanmıştır. Koşullu mutasyonlar, organizmanın yaşam süresinde belirli bir zaman diliminden sonra ifade değiştirilebildiğinden, yaşlanma ile ilişkili genetik çalışmalarda da kullanılabilir.
- Replikasyon zamanlaması kantitatif özellik lokusları DNA replikasyonunu etkiler. ⓘ
İsimlendirme
Bir mutasyonun bu şekilde sınıflandırılabilmesi için "normal" dizinin "normal" veya "sağlıklı" bir organizmanın DNA'sından elde edilmesi ("mutant" veya "hasta" olanın aksine), tanımlanması ve raporlanması gerekir; ideal olarak, basit bir nükleotid-nükleotid karşılaştırması için kamuya açık hale getirilmeli ve bilimsel topluluk veya standart veya sözde "fikir birliği" dizisini oluşturma sorumluluğuna sahip bir grup uzman genetikçi ve biyolog tarafından üzerinde anlaşmaya varılmalıdır. Bu adım muazzam bir bilimsel çaba gerektirir. Konsensüs dizisi bilindiğinde, bir genomdaki mutasyonlar tespit edilebilir, tanımlanabilir ve sınıflandırılabilir. İnsan Genomu Varyasyon Derneği (HGVS) komitesi, araştırmacılar ve DNA tanı merkezleri tarafından kesin mutasyon tanımları oluşturmak için kullanılması gereken standart insan dizisi varyant isimlendirmesini geliştirmiştir. Prensip olarak, bu isimlendirme diğer organizmalardaki mutasyonları tanımlamak için de kullanılabilir. İsimlendirme, mutasyon türünü ve baz veya amino asit değişikliklerini belirtir.
- Nükleotid ikamesi (örneğin 76A>T) - Sayı, nükleotidin 5' ucundan itibaren konumudur; ilk harf vahşi tip nükleotidi ve ikinci harf vahşi tipin yerini alan nükleotidi temsil eder. Verilen örnekte, 76. pozisyondaki adenin bir timin ile değiştirilmiştir.
- Genomik DNA, mitokondriyal DNA ve RNA'daki mutasyonlar arasında ayrım yapmak gerekirse, basit bir kural kullanılır. Örneğin, bir nükleotid dizisinin 100. bazı G'den C'ye mutasyona uğramışsa, mutasyon genomik DNA'da meydana gelmişse g.100G>C, mutasyon mitokondriyal DNA'da meydana gelmişse m.100G>C veya mutasyon RNA'da meydana gelmişse r.100g>c olarak yazılır. RNA'daki mutasyonlar için nükleotid kodunun küçük harflerle yazıldığını unutmayın.
- Amino asit ikamesi (örneğin, D111E) - İlk harf vahşi tip amino asidin tek harfli kodudur, sayı amino asidin N-terminalinden pozisyonudur ve ikinci harf mutasyonda bulunan amino asidin tek harfli kodudur. Anlamsız mutasyonlar ikinci amino asit için bir X ile gösterilir (örn. D111X).
- Amino asit delesyonu (örn. ΔF508) - Yunan harfi Δ (delta) bir delesyonu gösterir. Harf, vahşi tipte mevcut olan amino asidi ifade eder ve sayı, vahşi tipte olduğu gibi mevcut olması durumunda amino asidin N terminalinden pozisyonudur. ⓘ
Mutasyon oranları
Mutasyon oranları türler arasında önemli ölçüde değişiklik gösterir ve mutasyonu genel olarak belirleyen evrimsel güçler devam eden araştırmaların konusudur. ⓘ
İnsanlarda mutasyon oranı nesil başına genom başına yaklaşık 50-90 de novo mutasyondur, yani her insan ebeveynlerinde bulunmayan yaklaşık 50-90 yeni mutasyon biriktirir. Bu sayı, binlerce insan üçlüsünün, yani iki ebeveyn ve en az bir çocuğun dizilenmesiyle tespit edilmiştir. ⓘ
RNA virüslerinin genomları DNA'dan ziyade RNA'ya dayanmaktadır. RNA viral genomu çift sarmallı (DNA'da olduğu gibi) veya tek sarmallı olabilir. Bu virüslerin bazılarında (tek sarmallı insan immün yetmezlik virüsü gibi) replikasyon hızlı bir şekilde gerçekleşir ve genomun doğruluğunu kontrol edecek mekanizmalar yoktur. Bu hataya eğilimli süreç genellikle mutasyonlarla sonuçlanır. ⓘ
Mutasyonların rastlantısallığı
Mutasyonların sonuçları bakımından (olasılık açısından) (tamamen) "rastgele" olduğuna dair yaygın bir varsayım vardır. Bunun yanlış olduğu, mutasyon sıklığının genom bölgeleri arasında değişebildiği ve bu tür DNA onarım ve mutasyon biyazlarının çeşitli faktörlerle ilişkili olduğu gösterilmiştir. Örneğin, biyolojik olarak önemli bölgelerin mutasyonlardan korunduğu ve incelenen bitki için faydalı mutasyonların daha olası olduğu bulunmuştur - yani mutasyon "bitkiye fayda sağlayacak şekilde rastgele değildir". ⓘ
Hastalık Nedenselliği
DNA'nın bir kodlama bölgesindeki mutasyonun neden olduğu DNA değişiklikleri, kısmen veya tamamen işlevsiz proteinlerle sonuçlanabilecek protein diziliminde hatalara neden olabilir. Her hücre, doğru şekilde çalışabilmek için binlerce proteinin doğru zamanlarda doğru yerlerde işlev görmesine bağlıdır. Bir mutasyon vücutta kritik bir rol oynayan bir proteini değiştirdiğinde, tıbbi bir durum ortaya çıkabilir. Farklı Drosophila türleri arasındaki genlerin karşılaştırılması üzerine yapılan bir çalışma, bir mutasyonun bir proteini değiştirmesi durumunda, mutasyonun büyük olasılıkla zararlı olacağını, amino asit polimorfizmlerinin tahmini yüzde 70'inin zararlı etkilere sahip olduğunu ve geri kalanının ya nötr ya da zayıf faydalı olduğunu göstermektedir. Bazı mutasyonlar bir genin DNA baz dizilimini değiştirir ancak gen tarafından yapılan proteini değiştirmez. Çalışmalar, mayanın kodlamayan DNA'sındaki nokta mutasyonlarının sadece %7'sinin zararlı olduğunu ve kodlayan DNA'daki %12'sinin zararlı olduğunu göstermiştir. Mutasyonların geri kalanı ya nötrdür ya da hafif faydalıdır. ⓘ
Kalıtsal bozukluklar
Bir üreme hücresinde bir mutasyon varsa, bu mutasyonu tüm hücrelerinde taşıyan yavrular ortaya çıkabilir. Kalıtsal hastalıklarda durum böyledir. Özellikle, bir germ hücresindeki DNA onarım geninde bir mutasyon varsa, bu tür germ hattı mutasyonlarını taşıyan insanlarda kanser riski artabilir. Bu tür 34 germ hattı mutasyonunun bir listesi DNA onarım eksikliği bozukluğu makalesinde verilmiştir. OCA1 veya OCA2 geninde meydana gelen bir mutasyon olan albinizm buna bir örnektir. Bu bozukluğa sahip bireyler birçok kanser türüne, diğer rahatsızlıklara ve görme bozukluğuna daha yatkındır. ⓘ
DNA hasarı, DNA çoğaltılırken bir hataya neden olabilir ve bu çoğaltma hatası, genetik bir bozukluğa neden olabilecek bir gen mutasyonuna neden olabilir. DNA hasarları hücrenin DNA onarım sistemi tarafından onarılır. Her hücrede, enzimlerin DNA'daki hasarları tanıdığı ve onardığı bir dizi yol vardır. DNA birçok şekilde hasar görebileceğinden, DNA onarım süreci vücudun kendini hastalıklardan korumasının önemli bir yoludur. DNA hasarı bir mutasyona yol açtığında, mutasyon onarılamaz. ⓘ
Karsinogenezdeki rolü
Öte yandan, bir mutasyon bir organizmanın somatik bir hücresinde meydana gelebilir. Bu tür mutasyonlar aynı organizma içinde bu hücrenin tüm torunlarında mevcut olacaktır. Somatik hücrelerde nesiller boyunca belirli mutasyonların birikmesi, normal hücreden kanser hücresine malign dönüşümün nedeninin bir parçasıdır. ⓘ
Heterozigot işlev kaybı mutasyonlarına sahip hücreler (genin bir iyi kopyası ve bir mutasyona uğramış kopyası), iyi kopya kendiliğinden somatik olarak mutasyona uğrayana kadar mutasyona uğramamış kopya ile normal şekilde işlev görebilir. Bu tür mutasyonlar canlı organizmalarda sıklıkla meydana gelir, ancak oranını ölçmek zordur. Bu oranı ölçmek, insanların hangi oranda kansere yakalanabileceğini tahmin etmek açısından önemlidir. ⓘ
Nokta mutasyonları, DNA replikasyonu sırasında meydana gelen spontane mutasyonlardan kaynaklanabilir. Mutasyon oranı mutajenler tarafından artırılabilir. Mutajenler UV ışınları, X-ışınları veya aşırı sıcaktan kaynaklanan radyasyon gibi fiziksel veya kimyasal (baz çiftlerinin yerini değiştiren veya DNA'nın sarmal şeklini bozan moleküller) olabilir. Kanserlerle ilişkili mutajenler genellikle kanser ve önlenmesi hakkında bilgi edinmek için incelenir. ⓘ
Prion mutasyonları
Prionlar proteindir ve genetik materyal içermezler. Bununla birlikte, prion replikasyonunun diğer replikasyon biçimleri gibi mutasyona ve doğal seçilime tabi olduğu gösterilmiştir. İnsan geni PRNP, ana prion proteini olan PrP'yi kodlar ve hastalığa neden olan prionlara yol açabilecek mutasyonlara tabidir. ⓘ
Faydalı mutasyonlar
Protein dizilerinde değişikliklere neden olan mutasyonlar bir organizma için zararlı olabilse de, bazen belirli bir ortamda etkisi olumlu olabilir. Bu durumda mutasyon, mutant organizmanın belirli çevresel streslere vahşi tip organizmalardan daha iyi dayanmasını veya daha hızlı üremesini sağlayabilir. Bu durumlarda mutasyon, doğal seçilim yoluyla bir popülasyonda daha yaygın hale gelme eğiliminde olacaktır. Örnekler aşağıdakileri içerir: HIV direnci: İnsan CCR5'indeki (CCR5-Δ32) belirli bir 32 baz çifti delesyonu homozigotlara HIV direnci kazandırır ve heterozigotlarda AIDS'in başlamasını geciktirir. Avrupa nüfusundaki nispeten yüksek CCR5-Δ32 sıklığının etiyolojisinin olası bir açıklaması, 14. yüzyılın ortalarında Avrupa'da hıyarcıklı vebaya karşı direnç kazandırmasıdır. Bu mutasyona sahip kişilerin enfeksiyondan kurtulma olasılığı daha yüksekti; böylece popülasyondaki sıklığı arttı. Bu teori, bu mutasyonun hıyarcıklı vebadan etkilenmemiş olan Güney Afrika'da neden bulunmadığını açıklayabilir. Daha yeni bir teori ise CCR5 Delta 32 mutasyonu üzerindeki seçici baskının hıyarcıklı veba yerine çiçek hastalığından kaynaklandığını öne sürmektedir. ⓘ
Sıtma direnci: Zararlı bir mutasyon örneği, vücudun kırmızı kan hücrelerinde oksijen taşıyan hemoglobin maddesinin anormal bir türünü ürettiği bir kan bozukluğu olan orak hücre hastalığıdır. Sahra Altı Afrika'nın tüm yerli sakinlerinin üçte biri bu aleli taşımaktadır, çünkü sıtmanın yaygın olduğu bölgelerde sadece tek bir orak hücre aleli (orak hücre özelliği) taşımanın hayatta kalma değeri vardır. Orak hücre hastalığının iki alelinden sadece birine sahip olanlar sıtmaya karşı daha dirençlidir, çünkü sıtma Plasmodium'unun istilası, istila ettiği hücrelerin oraklaşması ile durdurulur. ⓘ
Antibiyotik direnci: Neredeyse tüm bakteriler antibiyotiklere maruz kaldıklarında antibiyotik direnci geliştirirler. Aslında, bakteri popülasyonları zaten antibiyotik seçilimi altında seçilen bu tür mutasyonlara sahiptir. Açıkçası, bu tür mutasyonlar sadece bakteriler için faydalıdır, enfekte olanlar için değil. ⓘ
Laktaz kalıcılığı. Bir mutasyon, insanların doğal olarak anne sütünden kesildikten sonra laktaz enzimini ifade etmelerini sağlayarak yetişkinlerin laktozu sindirmesine olanak tanımıştır ki bu muhtemelen son insan evrimindeki en faydalı mutasyonlardan biridir. ⓘ
Tarih

Mutasyonizm, Charles Darwin'in 1859 tarihli Türlerin Kökeni Üzerine adlı kitabının yayınlanmasından önce ve sonra Darwinci evrime karşı var olan çeşitli alternatiflerden biridir. Teoride, mutasyon yeniliğin kaynağıydı ve potansiyel olarak ani bir sıçramayla yeni formlar ve yeni türler yaratıyordu. Bunun, mutasyon arzı ile sınırlı olan evrimi yönlendirdiği öngörülüyordu. ⓘ
Darwin'den önce, biyologlar genellikle ani türleşme de dahil olmak üzere büyük evrimsel sıçramaların olasılığı olan saltasyonizme inanıyorlardı. Örneğin, 1822'de Étienne Geoffroy Saint-Hilaire, türlerin ani dönüşümlerle ya da daha sonra makromutasyon olarak adlandırılacak şeylerle oluşabileceğini savundu. Darwin tuzlanmaya karşı çıkmış, jeolojide olduğu gibi evrimde de tedricilikte ısrar etmiştir. 1864 yılında Albert von Kölliker, Geoffroy'un teorisini yeniden canlandırdı. 1901 yılında genetikçi Hugo de Vries, çuha çiçeği Oenothera lamarckiana üzerinde yaptığı deneylerde aniden ortaya çıkan görünüşte yeni formlara "mutasyon" adını verdi ve 20. yüzyılın ilk on yılında mutasyonizm ya da de Vries'in adlandırdığı şekliyle mutasyon teorisi, William Bateson, Thomas Hunt Morgan ve Reginald Punnett gibi genetikçiler tarafından bir süre desteklenen Darwinizm'e rakip oldu. ⓘ
Mutasyonculuğun anlaşılması, 20. yüzyılın ortalarında modern sentezin destekçileri tarafından ilk mutasyoncuların Darwinci evrimin karşıtları ve seçilimin sürekli varyasyon üzerinde işlediğini savunan biyometri okulunun rakipleri olarak tasvir edilmesiyle gölgelenmiştir. Bu tasvirde mutasyonculuk, daha sonra, 1918 civarında matematikçi Ronald Fisher'in çalışmalarıyla başladığı varsayılan genetik ve doğal seçilim sentezi tarafından yenilgiye uğratılmıştır. Ancak, Mendel genetiği ve doğal seçilimin uyumlaştırılması 1902 gibi erken bir tarihte Udny Yule'un bir makalesi ile başlamış ve Avrupa ve Amerika'da teorik ve deneysel çalışmalarla geliştirilmiştir. Tartışmalara rağmen, ilk mutasyoncular 1918'e kadar doğal seçilimi kabul etmiş ve sürekli varyasyonu, boy gibi aynı özellik üzerinde etkili olan birden fazla genin sonucu olarak açıklamışlardır. ⓘ
Lamarckizm ve ortogenez gibi Darwinizm'in diğer alternatifleri ile birlikte mutasyonizm, Mendel genetiği ve doğal seçilimin birlikte kolayca çalışabileceğini görmeye başladıklarında çoğu biyolog tarafından bir kenara bırakıldı; mutasyon, doğal seçilimin üzerinde çalışması için gerekli olan genetik varyasyonun kaynağı olarak yerini aldı. Ancak mutasyonculuk tamamen ortadan kalkmadı. Richard Goldschmidt 1940 yılında makromutasyon yoluyla tek adımda türleşmeyi tekrar savunmuş ve bu şekilde üretilen organizmaları "umutlu canavarlar" olarak tanımlayarak yaygın bir alay konusu olmuştur. 1987'de Masatoshi Nei tartışmalı bir şekilde evrimin genellikle mutasyonla sınırlı olduğunu savundu. Douglas J. Futuyma gibi modern biyologlar, büyük mutasyonların yol açtığı tüm evrim iddialarının esasen Darwinci evrimle açıklanabileceği sonucuna varmıştır. ⓘ
Tarihçe
Tarihsel olarak "mutasyon" terimi ilk kez 1901 yılında Hugo de Vries tarafından akşamsefası bitkisiyle yaptığı çaprazlamalarda gözlemlediği varyasyonu tanımlamak için kullanılmıştır. Varyasyonların çoğu çoklu translokasyonlar nedeniyle oluşmuştur. Daha sonra iki vakanın, DNA'nın kimyasal kompozisyonunda gerçek değişiklikler olan gen mutasyonları sonucunda olduğu gösterilmiştir. Mutasyon çalışmaları ilerledikçe, meydana gelen değişikliklerin nötr, yararlı ya da zararlı olduğu, evrim süreciyle test edilerek anlaşılır. ⓘ
Mutasyon çeşitleri
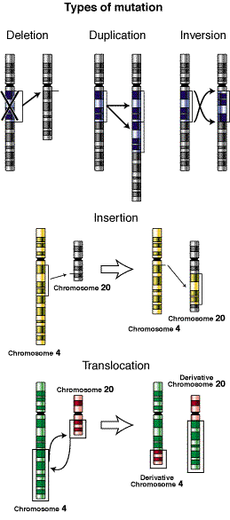
Mutasyonlar genetik çalışmaların temelini oluştururlar. Mutasyonun en önemli sonuçlarından biri, bir sonraki kuşağa farklı genetik özellikler aktarılmasına neden olmasıdır. Bu ise, farklı fiziksel özelliklere sahip bireylerin meydana gelmesidir. ⓘ
Bu değişimler sonucu ortaya çıkarılan fenotipik çeşitlilik, genetikçilerin değişikliğe uğramış olan özelliği kontrol eden genleri çalışmalarına olanak sağlar. Genetik araştırmalarda mutasyonlar, nesilden nesile geçişlerde takip edilebilen, "marker"lar olarak kullanılırlar. Tarihte mutasyonların sunduğu fenotipik çeşitlilik olmasaydı, örneğin Mendel'in araştırmalarını yaptığı bezelye bitkisinin fenotipi tek olsaydı, bu deneyler hiçbir zaman sonuç bulamayacaktı. ⓘ
Bazı canlıların kısa olan hayatlarından yararlanılarak, kolayca tanınabilecek ve çalışılabilecek mutasyonlar bu canlılarda elde edilirler. Mutasyon ve mutagenez çalışmalarında özellikle virüsler, bakteriler, mantarlar, meyve sinekleri, bazı bitkiler ve fareler kullanılmaktadır. Bu canlılar, genetik hakkında bilgilerin elde edilmesinde çok yararlı olmuşlardır. ⓘ
Kromozom sayısının değişmesi
Kromozomlar mitoz ve mayoz bölünme sırasında bazen düzenli olarak ayrılmazlar. Sonuçta kromozom sayısı bakımından farklı hücreler meydana gelir ve kalıtsal açıdan bazı sorunlar oluşturur. Birçok bitki doğadaki diploit kökenli diğer bitkilerden türemiştir. Aynı gen lokusunda meydana gelecek öldürücü bir mutasyon, bu şekilde, diğer normal genleri taşıyan poliploit kromozomlar tarafından korunabilir. Başlangıçta öldürücü ya da engelleyici görünen bu genler bir zaman sonra canlının ayakta kalmasını sağlamak bakımından önemli bir duruma geçebilir. Bu tip bitkiler belli bir süre sonra kısır olarak kalırlar ve çelikleme ya da yumru ile çoğaltılırlar. Hayvanlar, vücutlarının belli bir parçasından üretilemedikleri için, triploidi ve tetraploidi bunlarda bir önem arz etmez. İnsanlardaki kromozom sayısı değişimleri;
- Down sendromu,
- Edward sendromu,
- Patau sendromu,
- Cri du Chat sendromu,
- Kronik miyelojenik lösemi gibi hastalıklara neden olur ve bu insanlarda değiştirilemeyen sorunlara neden olarak kalırlar. ⓘ
Mutasyonların türlerine göre ayrımı
Nedenlerine göre ayrım
- Kendiliğinden mutasyonlar
- dış etkenler olmadan meydana gelen mutasyonlardır. Bu anlamda bir nükleotitin kimyasal bozulumu (örneğin sitozinin oksidatif deaminasyonu sonucu kendiliğinden urasil meydana gelmesi) veya tünel etkisi (DNA'daki proton tünelleri) gibi nedenler kendiliğinden meydana gelen mutasyonlara yol açabilirler.
- Uyarılmış mutasyonlar
- mutajenler (mutasyona neden olan maddeler ya da radyasyon) tarafından oluşturulan mutasyonlardır. ⓘ
Mekanizmalarına göre ayrım
- DNA replikasyonundaki hatalar
- DNA polimerazları farklı hata oranlarına sahiptir. ⓘ
- Yetersiz bilgi okuma ve düzeltme etkinliği
- Bazı DNA polimerazları hatalı yapıları bağımsız olarak tanıma ve düzeltme olanaklarına sahiptir. Ancak, ökaryotlardaki A ailesi DNA polimerazları okuma ve düzeltme etkinliğine sahip değildirler. ⓘ
- Pre- ve postreplikatif onarım hataları
- Mesela urasil gibi olağan dışı bir nükleotit DNA'ya gelip yerleştiğinde çıkartılarak uzaklaştırılır. Onarımdan sorumlu enzimler, iki tipik DNA nükleotiti arasında oluşan olası bir hatalı eşleşmede ise yüzde 50 oranında bir hata olasılığıyla ikisi arasında bir karar vermek zorunda kalırlar. ⓘ
- Dengesiz Krosover
- Bir DNA dizisi üzerinde birbirlerinin yakınlarında yer alan satelit DNA veya transpozonlar gibi benzer veya özdeş sekansların mayoz bölünme sırasında hatalı çiftleşmesi sonucu oluşan bir mutasyon türüdür. ⓘ
- Hücre bölünmesi sırasında eş kromozomların bölünmemesi
- kromozomların yanlış dağılımına ve aynı zamanda böylece trizomi ve monozomi oluşumuna yol açar. ⓘ
