Metan

| |||
|
| |||
| İsimler | |||
|---|---|---|---|
| Tercih edilen IUPAC adı
Metan | |||
| Sistematik IUPAC adı
Karbane (asla tavsiye edilmez) | |||
Diğer isimler
| |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| 3DMet | |||
Beilstein Referans
|
1718732 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
59 | ||
| KEGG | |||
| MeSH | Metan | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 1971 | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
CH4 | ||
| Molar kütle | 16.043 g-mol-1 | ||
| Görünüş | Renksiz gaz | ||
| Koku | Kokusuz | ||
| Yoğunluk |
| ||
| Erime noktası | -182.456 °C (-296.421 °F; 90.694 K) | ||
| Kaynama noktası | -161,5 °C (-258,7 °F; 111,6 K) | ||
| Kritik nokta (T, P) | 190,56 K (-82,59 °C; -116,66 °F), 4,5992 megapaskal (45,391 atm) | ||
Suda çözünürlük
|
22,7 mg-L-1 | ||
| Çözünürlük | Etanol, dietil eter, benzen, toluen, metanol, asetonda çözünür ve suda çözünmez | ||
| log P | 1.09 | ||
Henry'nin yasası
sabit (kH) |
14 nmol-Pa-1-kg-1 | ||
| Konjugat asit | Metanyum | ||
| Konjugat baz | Metil anyonu | ||
Manyetik duyarlılık (χ)
|
-17,4×10-6 cm3-mol-1 | ||
| Yapı | |||
Nokta grubu
|
Td | ||
Moleküler şekil
|
Tetrahedron | ||
Dipol moment
|
0 D | ||
| Termokimya | |||
Isı kapasitesi (C)
|
35,7 J-(K-mol)-1 | ||
Std molar
entropi (S |
186,3 J-(K-mol)-1 | ||
Std entalpi
oluşumu (ΔfH⦵298) |
-74,6 kJ-mol-1 | ||
Gibbs serbest enerjisi (ΔfG˚)
|
-50,5 kJ-mol-1 | ||
Std entalpi
yanma (ΔcH⦵298) |
-891 kJ-mol-1 | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|

| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H220 | ||
Önlem ifadeleri
|
P210 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | -188 °C (-306,4 °F; 85,1 K) | ||
Otomatik ateşleme
sıcaklık |
537 °C (999 °F; 810 K) | ||
| Patlayıcı limitleri | 4.4–17% | ||
| İlgili bileşikler | |||
İlgili alkanlar
|
| ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Metan (ABD: /ˈmɛθeɪn/ MEH-thayn, Birleşik Krallık: /ˈmiːθeɪn/ MEE-thayn), CH4 (dört hidrojen atomuna bağlı bir karbon atomu) kimyasal formülüne sahip kimyasal bir bileşiktir. Bir grup-14 hidrür, en basit alkan ve doğal gazın ana bileşenidir. Metanın Dünya'daki göreceli bolluğu onu ekonomik açıdan cazip bir yakıt haline getirse de, normal sıcaklık ve basınç koşulları altında gaz halinde olması nedeniyle yakalanması ve depolanması teknik zorluklar yaratmaktadır. ⓘ
Doğal olarak oluşan metan hem yer altında hem de deniz tabanında bulunur ve hem jeolojik hem de biyolojik süreçlerle oluşur. En büyük metan rezervuarı, metan klatratları şeklinde deniz tabanının altındadır. Metan yüzeye ve atmosfere ulaştığında atmosferik metan olarak bilinir. Dünya'nın atmosferik metan konsantrasyonu 1750'den bu yana yaklaşık %150 oranında artmıştır ve uzun ömürlü ve küresel olarak karışık sera gazlarının tümünden kaynaklanan toplam ışınımsal zorlamanın %20'sini oluşturmaktadır. Mars da dahil olmak üzere diğer gezegenlerde de tespit edilmiştir ve astrobiyoloji araştırmaları için etkileri vardır. ⓘ
Endüstriyel devrimden önce (1750 yılında) atmosferdeki metan 720 ppb seviyesindeydi. 2000'li yılların başında metan seviyesi stabil bir seviyeye ulaşmış, ancak 2007'den beri atmosferdeki metan oranı hızlı bir artış göstermektedir. 2017 yılında, atmosferik metan 1850 ppb seviyesine ulaşmıştır. ⓘ
Metan, sera gazlarının içerisinde, Küresel ısınmada oynadığı rol açısından, Karbondioksit'ten sonra ikinci sırada gelmektedir. Ayrıca çöplerdeki metandan yakıt elde edilebilir. Doğal metan gazları atmosfere zarar vermez. ⓘ
Metanojen arkeler metan üretimi yapar. Bu canlı türü zorunlu anaerob bir arkedir. ⓘ
Özellikleri ve bağları
Metan, dört eşdeğer C-H bağına sahip dört yüzlü bir moleküldür. Elektronik yapısı, C ve H üzerindeki değerlik orbitallerinin örtüşmesinden kaynaklanan dört bağ moleküler orbitali (MO) ile tanımlanır. En düşük enerjili MO, karbon üzerindeki 2s orbitalinin dört hidrojen atomu üzerindeki 1s orbitallerinin faz içi kombinasyonu ile örtüşmesinin sonucudur. Bu enerji seviyesinin üzerinde, karbon üzerindeki 2p orbitallerinin hidrojen üzerindeki 1s orbitallerinin çeşitli doğrusal kombinasyonlarıyla örtüşmesini içeren üçlü dejenere bir MO kümesi bulunur. Ortaya çıkan "üç üzeri bir" bağlanma şeması fotoelektron spektroskopik ölçümlerle tutarlıdır. ⓘ
Metan kokusuz bir gazdır ve renksiz gibi görünür. Aşırı ton bantları nedeniyle özellikle spektrumun kırmızı ucunda görünür ışığı emer, ancak etki yalnızca ışık yolu çok uzunsa fark edilir. Uranüs ve Neptün'e mavi ya da mavimsi-yeşil renklerini veren de budur, çünkü ışık metan içeren atmosferlerinden geçer ve sonra tekrar dışarı saçılır. ⓘ
Evlerde kullanılan doğal gazın tanıdık kokusu, güvenlik önlemi olarak genellikle tert-butiltiyol içeren karışımlara bir koku verici madde eklenmesiyle elde edilir. Metan, bir atmosfer basınçta -161,5 °C kaynama noktasına sahiptir. Bir gaz olarak, standart basınçta havadaki konsantrasyon aralığında (%5,4-17) yanıcıdır. ⓘ
Katı metan çeşitli modifikasyonlarda mevcuttur. Şu anda dokuz tanesi bilinmektedir. Metanın normal basınçta soğutulması metan I oluşumuyla sonuçlanır. Bu madde kübik sistemde kristalleşir (uzay grubu Fm3m). Hidrojen atomlarının pozisyonları metan I'de sabit değildir, yani metan molekülleri serbestçe dönebilir. Bu nedenle plastik bir kristaldir. ⓘ
Kimyasal reaksiyonlar
Metanın birincil kimyasal reaksiyonları yanma, buharla sentez gazına dönüştürme ve halojenasyondur. Genel olarak metan reaksiyonlarını kontrol etmek zordur. ⓘ
Seçici oksidasyon
Metanın daha kullanışlı, sıvı bir yakıt olan metanole kısmi oksidasyonu zordur çünkü reaksiyon yetersiz oksijen kaynağıyla bile tipik olarak karbondioksit ve suya kadar ilerler. Metan monooksijenaz enzimi metandan metanol üretir, ancak endüstriyel ölçekli reaksiyonlar için kullanılamaz. Bazı homojen katalizörlü sistemler ve heterojen sistemler geliştirilmiştir, ancak hepsinin önemli dezavantajları vardır. Bunlar genellikle aşırı oksidasyondan korunmuş ürünler üreterek çalışır. Örnekler arasında Catalytica sistemi, bakır zeolitler ve alfa-oksijen aktif bölgesini stabilize eden demir zeolitler bulunmaktadır. ⓘ
Bir grup bakteri, oksijen yokluğunda oksidan olarak nitrit ile metan oksidasyonunu katalize ederek metanın anaerobik oksidasyonuna yol açar. ⓘ
Asit-baz reaksiyonları
Diğer hidrokarbonlar gibi metan da son derece zayıf bir asittir. DMSO içindeki pKa değerinin 56 olduğu tahmin edilmektedir. Çözeltide deprotonlanamaz, ancak eşlenik baz metilityum gibi formlarda bilinmektedir. ⓘ
Metandan türetilen çeşitli pozitif iyonlar, çoğunlukla düşük basınçlı gaz karışımlarında kararsız türler olarak gözlemlenmiştir. Bunlar arasında metenyum veya metil katyonu CH+
3, metan katyonu CH+
4 ve metanyum veya protonlanmış metan CH+
5. Bunlardan bazıları uzayda tespit edilmiştir. Metanyum, metandan süperasitlerle seyreltilmiş çözeltiler olarak da üretilebilir. CH2+ gibi daha yüksek yüke sahip katyonlar
6 ve CH3+
7, teorik olarak çalışılmış ve kararlı oldukları varsayılmıştır. ⓘ
C-H bağlarının gücüne rağmen, metanda (ve diğer düşük numaralı alkanlarda) C-H bağı aktivasyonunu kolaylaştıran katalizörlere yoğun bir ilgi vardır. ⓘ
Yanma

Metanın yanma ısısı 55,5 MJ/kg'dır. Metanın yanması aşağıdaki gibi özetlenen çok adımlı bir reaksiyondur:
- CH4 + 2 O2 → CO2 + 2 H2O (ΔH = -891 k J/mol, standart koşullarda)
Peters dört aşamalı kimyası, metanın yanmasını açıklayan sistematik olarak indirgenmiş dört aşamalı bir kimyadır. ⓘ
Metan radikal reaksiyonları
Uygun koşullar sağlandığında, metan halojen radikalleri ile aşağıdaki gibi reaksiyona girer:
- X- + CH4 → HX + CH3-
- CH3- + X2 → CH3X + X- ⓘ
Burada X bir halojendir: florin (F), klorin (Cl), bromin (Br) veya iyot (I). Bu süreç için bu mekanizmaya serbest radikal halojenasyonu denir. UV ışığı veya başka bir radikal başlatıcı (peroksitler gibi) bir halojen atomu ürettiğinde başlatılır. Halojen atomunun bir metan molekülünden bir hidrojen atomunu soyutladığı ve bir hidrojen halojenür molekülü ile bir metil radikalinin (CH3-) oluşmasıyla sonuçlanan iki aşamalı bir zincirleme reaksiyon meydana gelir. Metil radikali daha sonra bir halojen molekülü ile reaksiyona girerek bir halometan molekülü oluşturur ve yan ürün olarak yeni bir halojen atomu ortaya çıkar. Halojenlenmiş ürün üzerinde benzer reaksiyonlar meydana gelebilir ve reaksiyon koşullarına ve halojen-metan oranına bağlı olarak ilave hidrojen atomlarının dihalometan, trihalometan ve nihayetinde tetrahalometan yapıları ile halojen atomları tarafından değiştirilmesine yol açabilir. ⓘ
Kullanım Alanları
Metan endüstriyel kimyasal süreçlerde kullanılır ve soğutulmuş bir sıvı (sıvılaştırılmış doğal gaz veya LNG) olarak taşınabilir. Soğutulmuş bir sıvı konteynerinden sızan gaz, soğuk gazın artan yoğunluğu nedeniyle başlangıçta havadan daha ağır olsa da, ortam sıcaklığındaki gaz havadan daha hafiftir. Gaz boru hatları, ana bileşeni metan olan büyük miktarlarda doğal gaz dağıtımı yapmaktadır. ⓘ
Yakıt
Metan fırınlar, evler, su ısıtıcıları, fırınlar, otomobiller, türbinler vb. için yakıt olarak kullanılır. Aktif karbon metanı depolamak için kullanılır. Rafine sıvı metan, BE-4 ve Raptor motorlarında olduğu gibi sıvı oksijen ile birleştirildiğinde roket yakıtı olarak kullanılır. ⓘ
Doğal gazın ana bileşeni olan metan, bir gaz türbininde veya buhar jeneratöründe yakıt olarak yakılarak elektrik üretimi için önemlidir. Diğer hidrokarbon yakıtlarla karşılaştırıldığında metan, açığa çıkan her ısı birimi için daha az karbondioksit üretir. Yaklaşık 891 kJ/mol ile metanın yanma ısısı diğer hidrokarbonlardan daha düşüktür, ancak yanma ısısının (891 kJ/mol) moleküler kütleye (16,0 g/mol, bunun 12,0 g/mol'ü karbondur) oranı, en basit hidrokarbon olan metanın kütle birimi başına (55,7 kJ/g) diğer karmaşık hidrokarbonlardan daha fazla ısı ürettiğini göstermektedir. Birçok şehirde metan, evsel ısınma ve yemek pişirme amacıyla evlere borularla taşınmaktadır. Bu bağlamda genellikle doğal gaz olarak bilinir ve metre küp başına 39 megajul veya standart ayak küpü başına 1.000 BTU enerji içeriğine sahip olduğu kabul edilir. Sıvılaştırılmış doğal gaz (LNG) ağırlıklı olarak metanın (CH4) depolama veya taşıma kolaylığı için sıvı forma dönüştürülmüş halidir. ⓘ
Sıvı bir roket yakıtı olarak metan, gazyağına kıyasla küçük egzoz molekülleri üretme avantajı sunar. Bu da roket motorlarının iç kısımlarında daha az kurum biriktirerek güçlendiricinin yeniden kullanım zorluğunu azaltır. Egzozun daha düşük moleküler ağırlığı aynı zamanda ısı enerjisinin itiş için kullanılabilir kinetik enerji formundaki kısmını artırarak roketin özgül itkisini artırır. Sıvı metan ayrıca sıvı oksijen (54-90 K) ile neredeyse uyumlu bir sıcaklık aralığına (91-112 K) sahiptir. ⓘ
Kimyasal hammadde
Çoğunlukla metandan oluşan doğal gaz, endüstriyel ölçekte hidrojen gazı üretmek için kullanılır. Buhar metan reformu (SMR) veya kısaca buhar reformu olarak bilinen yöntem, ticari dökme hidrojen gazı üretiminin standart endüstriyel yöntemidir. Esas olarak doğal gazın SMR'sinden dünya çapında yılda 50 milyon metrik tondan fazla hidrojen üretilmektedir (2013). Bu hidrojenin büyük bir kısmı petrol rafinerilerinde, kimyasal madde üretiminde ve gıda işlemede kullanılmaktadır. Amonyağın endüstriyel sentezinde çok büyük miktarlarda hidrojen kullanılmaktadır. ⓘ
Yüksek sıcaklıklarda (700-1100 °C) ve metal bazlı bir katalizörün (nikel) varlığında, buhar metan ile reaksiyona girerek "su gazı" veya "sentez gazı" olarak bilinen CO ve H2 karışımını verir:
Bu reaksiyon güçlü bir şekilde endotermiktir (ısı tüketir, ΔHr = 206 kJ/mol). İlave hidrojen, su-gaz kayması reaksiyonu yoluyla CO'in su ile reaksiyona girmesiyle elde edilir:
Bu reaksiyon hafif ekzotermiktir (ısı üretir, ΔHr = -41 kJ/mol). ⓘ
Metan ayrıca klorometan üretiminde serbest radikal klorlamaya tabi tutulur, ancak metanol daha tipik bir öncüdür. ⓘ
Hidrojen, metan pirolizi olarak da bilinen metanın doğrudan ayrıştırılması yoluyla da üretilebilir. Metan ayrışması, buharlı metan reformunun aksine doğrudan karbon emisyonu üretilmediği için düşük emisyonlu hidrojen üretimi için umut verici bir yoldur. Hidrojen gazı ve katı karbon üretmek üzere metanın bağlarını kırmak için 1200 °C'yi aşan sıcaklıklar gereklidir. Bununla birlikte, uygun bir katalizörün kullanılmasıyla reaksiyon sıcaklığı, seçilen katalizöre bağlı olarak 600 °C - 1000 °C arasına düşürülebilir. Reaksiyon, aşağıdaki reaksiyon denkleminde gösterildiği gibi orta derecede endotermiktir. ⓘ
- CH
4(g) → C(s) + 2 H
2(g) ΔH° = 74,8 kJ/mol ⓘ
Nesil
Jeolojik rotalar
Jeolojik metan üretimi için iki ana yol (i) organik (termal olarak üretilen veya termojenik) ve (ii) inorganik (abiyotik). Termojenik metan, derin tortul tabakalardaki yüksek sıcaklık ve basınçlarda organik maddenin parçalanması nedeniyle oluşur. Sedimanter havzalardaki metanın çoğu termojeniktir; bu nedenle termojenik metan en önemli doğal gaz kaynağıdır. Termojenik metan bileşenlerinin tipik olarak kalıntı (daha eski bir zamandan kalma) olduğu düşünülmektedir. Genel olarak, termojenik metan oluşumu (derinde) organik madde parçalanması veya organik sentez yoluyla gerçekleşebilir. Her iki yol da mikroorganizmaları (metanojenez) içerebilir, ancak inorganik olarak da meydana gelebilir. İlgili süreçler, mikroorganizmalarla veya mikroorganizmalar olmadan da metan tüketebilir. ⓘ
Derinlikteki (kristal ana kaya) daha önemli metan kaynağı abiyotiktir. Abiyotik, metanın inorganik bileşiklerden, biyolojik aktivite olmaksızın, ya magmatik süreçler yoluyla ya da serpantinleşme gibi düşük sıcaklık ve basınçlarda meydana gelen su-kayaç reaksiyonları yoluyla oluştuğu anlamına gelir. ⓘ
Biyolojik yollar
Dünya'daki metanın çoğu biyojeniktir ve sadece Archaea alanının bazı üyeleri tarafından gerçekleştirildiği bilinen bir anaerobik solunum şekli olan metanojenez ile üretilir. Metanojenler çöplükleri ve diğer toprakları, geviş getiren hayvanları (örneğin sığırları), termitlerin bağırsaklarını ve deniz tabanının altındaki anoksik tortuları ve göllerin dibini işgal eder. Pirinç tarlaları da bitki büyümesi sırasında büyük miktarlarda metan üretir. Bu çok aşamalı süreç, bu mikroorganizmalar tarafından enerji için kullanılır. Metanojenezin net reaksiyonu şöyledir:
- CO2 + 4 H2→ CH4 + 2 H2O ⓘ
Sürecin son adımı metil koenzim M redüktaz (MCR) enzimi tarafından katalize edilir.


Geviş Getiren Hayvanlar
Sığır gibi geviş getiren hayvanlar metan geğirerek ABD'nin yıllık metan emisyonlarının yaklaşık %22'sini atmosfere salmaktadır. Bir çalışma, genel olarak hayvancılık sektörünün (öncelikle sığır, tavuk ve domuz) insan kaynaklı tüm metanın %37'sini ürettiğini bildirmiştir. 2013 yılında yapılan bir çalışmada, hayvancılığın insan kaynaklı metanın %44'ünden ve insan kaynaklı sera gazı emisyonlarının yaklaşık %15'inden sorumlu olduğu tahmin edilmiştir. Tıbbi tedaviler ve diyet ayarlamaları gibi hayvancılık metan üretimini azaltmak ve yanma enerjisini kullanmak için gazı hapsetmek için birçok çaba devam etmektedir. ⓘ
Deniz tabanı çökeltileri
Alt deniz tabanının çoğu anoksiktir çünkü oksijen, tortunun ilk birkaç santimetresi içinde aerobik mikroorganizmalar tarafından uzaklaştırılır. Oksijenin bol olduğu deniz tabanının altında metanojenler metan üretir ve bu metan ya diğer organizmalar tarafından kullanılır ya da gaz hidratlar içinde hapsolur. Metanı enerji için kullanan bu diğer organizmalar metanotrof ('metan yiyen') olarak bilinir ve derinlerde üretilen metanın çok azının deniz yüzeyine ulaşmasının ana nedenidir. Arkea ve Bakteri konsorsiyumlarının metanı anaerobik metan oksidasyonu (AOM) yoluyla oksitlediği bulunmuştur; bundan sorumlu organizmalar anaerobik metanotrofik Arkea (ANME) ve sülfat indirgeyen bakterilerdir (SRB). ⓘ
Endüstriyel yollar
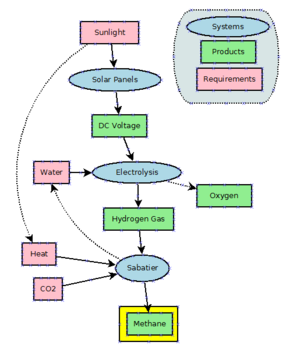
Doğal gazdaki ucuz bolluğu göz önüne alındığında, metanı endüstriyel olarak üretmek için çok az teşvik vardır. Metan, Sabatier süreci ile karbondioksitin hidrojenlenmesi yoluyla üretilebilir. Metan ayrıca, metandan daha uzun zincirli moleküller üretmek için büyük ölçekte uygulanan Fischer-Tropsch işleminde karbon monoksitin hidrojenlenmesinin bir yan ürünüdür. ⓘ
Büyük ölçekli kömürden metana gazlaştırma işleminin bir örneği, 1984 yılında Kuzey Dakota'nın Beulah kentinde, ağırlığı, kül içeriği, düşük kalorifik değeri ve depolama ve taşıma sırasında kendiliğinden yanma eğilimi nedeniyle taşınması zor bir kaynak olan düşük dereceli linyitin bol yerel kaynaklarını geliştirmenin bir yolu olarak başlatılan Great Plains Synfuels tesisidir. Dünya çapında bir dizi benzer tesis mevcuttur, ancak çoğunlukla bu tesisler benzin, dizel veya diğer süreçlere hammadde olarak kullanılmak üzere uzun zincirli alkanların üretimini hedeflemektedir. ⓘ
Power to methane, elektroliz yoluyla sudan hidrojen üretmek için elektrik gücünü kullanan ve metan üretmek üzere hidrojeni karbondioksit ile birleştirmek için Sabatier reaksiyonunu kullanan bir teknolojidir. 2021 itibariyle, bu çoğunlukla geliştirme aşamasındadır ve büyük ölçekli kullanımda değildir. Teorik olarak bu süreç, yüksek dalgalanma gösteren rüzgar türbinleri ve güneş enerjisi dizileri tarafından üretilen fazla ve yoğun olmayan güç için bir tampon olarak kullanılabilir. Ancak şu anda elektrik enerjisi üretmek için enerji santrallerinde (örneğin CCGT) çok büyük miktarlarda doğal gaz kullanıldığından, verimlilikteki kayıplar kabul edilebilir değildir. ⓘ
Laboratuvar sentezi
Metan, metil lityum veya metilmagnezyum klorür gibi bir metil Grignard reaktifinin protonlanmasıyla üretilebilir. Ayrıca susuz sodyum asetat ve kuru sodyum hidroksitin karıştırılıp 300 °C'nin üzerinde ısıtılmasıyla da üretilebilir (yan ürün olarak sodyum karbonat ile). Pratikte, saf metan gereksinimi standart gaz tedarikçilerinden alınan çelik gaz şişesiyle kolayca karşılanabilir. ⓘ
Oluşum
Metan, 1776 ve 1778 yılları arasında Maggiore Gölü'ndeki bataklık gazını incelerken Alessandro Volta tarafından keşfedilmiş ve izole edilmiştir. Doğal gazın hacim olarak yaklaşık %87'sini oluşturan ana bileşenidir. Metanın ana kaynağı, doğal gaz alanları olarak bilinen jeolojik yataklardan çıkarılmasıdır ve kömür damarlarından gaz çıkarılması da önemli bir kaynak haline gelmiştir (bkz. kömür yatağı metan çıkarımı, bir kömür yatağından metan çıkarmak için kullanılan bir yöntemdir; geliştirilmiş kömür yatağı metan geri kazanımı ise çıkarılamayan kömür damarlarından metan geri kazanımı için kullanılan bir yöntemdir). Diğer hidrokarbon yakıtlarla ilişkilidir ve bazen helyum ve nitrojen ile birlikte bulunur. Metan, organik maddenin anaerobik çürümesi ve Dünya yüzeyinin derinliklerinden gelen metanın yeniden işlenmesi ile sığ seviyelerde (düşük basınç) üretilir. Genel olarak, doğal gaz üreten tortular petrol içeren tortulardan daha derine ve daha yüksek sıcaklıklara gömülüdür. ⓘ
Metan genellikle doğal gaz formunda boru hattı ile veya sıvılaştırılmış formda LNG taşıyıcıları ile dökme olarak taşınır; çok az ülke kamyonla taşır. ⓘ
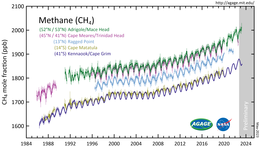
Atmosferik metan
2010 yılında Kuzey Kutbu'ndaki metan seviyeleri 1850 nmol/mol olarak ölçülmüştür. Bu seviye, son 400.000 yıldaki herhangi bir zamandan iki kat daha yüksektir. Dünya atmosferindeki tarihi metan konsantrasyonları, buzul çağları olarak bilinen buzul dönemlerinde 300 ila 400 nmol/mol arasında, sıcak buzul arası dönemlerde ise 600 ila 700 nmol/mol arasında değişmiştir. Dünya okyanusları Arktik metanın potansiyel önemli bir kaynağıdır. ⓘ
Metan, 100 yıllık bir dönemde CO2'ye (1 potansiyel) kıyasla 34, 20 yıllık bir dönemde ise 72 küresel ısınma potansiyeline sahip önemli bir sera gazıdır. ⓘ
Dünya'nın atmosferik metan konsantrasyonu 1750'den bu yana yaklaşık %150 oranında artmıştır ve uzun ömürlü ve küresel olarak karışık sera gazlarının tümünden kaynaklanan toplam ışınımsal zorlamanın %20'sini oluşturmaktadır. IPCC'nin AR6 raporunda şöyle denmektedir: "İyi karışmış sera gazı (GHG) konsantrasyonlarında yaklaşık 1750'den bu yana gözlemlenen artışlar kesin olarak insan faaliyetlerinden kaynaklanmaktadır. 2011 yılından bu yana (AR5'te rapor edilen ölçümler), atmosferdeki konsantrasyonlar artmaya devam etmiş ve 2019 yılında karbondioksit (CO2) için 410 ppm, metan (CH4) için 1866 ppb ve azot oksit (N2O) için 332 ppb yıllık ortalamalara ulaşmıştır. (...) 2019'da atmosferik CO2 konsantrasyonları en az 2 milyon yıldır hiç olmadığı kadar yüksekti (yüksek güven) ve CH4 ve N2O konsantrasyonları en az 800.000 yıldır hiç olmadığı kadar yüksekti (çok yüksek güven). 1750'den bu yana, CO2 (%47) ve CH4 (%156) konsantrasyonlarındaki artışlar, en azından son 800.000 yıldaki buzul ve buzul arası dönemler arasındaki çok yıllık doğal değişimlerin çok üzerinde ve N2O'daki (%23) artışlara benzerdir (çok yüksek güven)." ⓘ
2015'ten 2019'a kadar atmosferik metan seviyelerinde keskin artışlar kaydedilmiştir. Şubat 2020'de, fosil yakıt endüstrisinden kaynaklanan kaçak emisyonların ve gaz tahliyesinin önemli ölçüde hafife alınmış olabileceği bildirildi. ⓘ
İklim değişikliği, doğal ekosistemlerde metan üretimini artırarak atmosferik metan seviyelerini artırabilir ve bir İklim değişikliği geri bildirimi oluşturabilir. Metan emisyonlarındaki artışın bir başka açıklaması da metanı atmosferden uzaklaştıran kimyasal reaksiyonun yavaşlaması olabilir. ⓘ
Klatratlar
Metan klatratlar (metan hidratlar olarak da bilinir), tek metan moleküllerini hapseden su moleküllerinden oluşan katı kafeslerdir. Arktik permafrostta ve okyanus tabanının altındaki kıta kenarları boyunca, yüksek basınçlarda (1 ila 100 MPa; alt uç daha düşük sıcaklık gerektirir) ve düşük sıcaklıklarda (< 15 ° C; üst uç daha yüksek basınç gerektirir) bulunan gaz klatrat stabilite bölgesi içinde önemli metan klatrat rezervuarları bulunmuştur. Metan klatratları biyojenik metan, termojenik metan veya ikisinin karışımından oluşabilir. Bu tortular hem potansiyel bir metan yakıtı kaynağı hem de küresel ısınmaya potansiyel bir katkıda bulunmaktadır. Gaz klatratlarda depolanan küresel karbon kütlesi hala belirsizdir ve 12.500 Gt karbon kadar yüksek ve 500 Gt karbon kadar düşük olarak tahmin edilmiştir. Bu tahmin zaman içinde azalmış ve en son tahmin ~1800 Gt karbon olmuştur. Bu belirsizliğin büyük bir kısmı, metan kaynakları ve yutakları ile metan klatratlarının küresel ölçekteki dağılımı konusundaki bilgi eksikliğimizden kaynaklanmaktadır. Örneğin, Kuzey Kutbu'ndaki aşırı yavaş yayılan bir sırtta nispeten yakın zamanda bir metan kaynağı keşfedilmiştir. Bazı iklim modelleri, günümüzde okyanus tabanından metan emisyon rejiminin potansiyel olarak yaklaşık 55,5 milyon yıl önceki Paleosen-Eosen Termal Maksimum (PETM) dönemindekine benzer olduğunu öne sürmektedir, ancak şu anda klatrat ayrışmasından kaynaklanan metanın atmosfere ulaştığını gösteren hiçbir veri yoktur. Permafrost ve deniz tabanı metan klatratlarından Arktik metan salınımı, küresel ısınmanın potansiyel bir sonucu ve başka bir nedenidir; bu klatrat silahı hipotezi olarak bilinir. 2016'dan elde edilen veriler, Kuzey Kutbu permafrostunun tahmin edilenden daha hızlı çözüldüğünü göstermektedir. ⓘ
Dünya dışı metan
Yıldızlararası ortam
Metan Güneş Sistemi'nin birçok yerinde bol miktarda bulunur ve potansiyel olarak başka bir güneş sistemi cisminin yüzeyinde (özellikle Mars veya Titan'da bulunan yerel malzemelerden metan üretimi kullanılarak) hasat edilebilir ve dönüş yolculuğu için yakıt sağlayabilir. ⓘ
Mars
Metan, Güneş Sistemi'ndeki tüm gezegenlerde ve büyük uyduların çoğunda tespit edilmiştir. Mars hariç olmak üzere, metanın abiyotik süreçlerden kaynaklandığı düşünülmektedir. ⓘ

Curiosity keşif aracı Mars'taki atmosferik metan seviyelerinin mevsimsel dalgalanmalarını belgeledi. Bu dalgalanmalar Mars yazının sonunda milyarda 0,6 parçacıkla zirveye ulaştı. ⓘ
Metan, kısmen yerinde kaynak kullanımı yoluyla gezegende sentezlenmesi olasılığı nedeniyle gelecekteki Mars görevlerinde olası bir roket itici olarak önerilmiştir. Sabatier metanasyon reaksiyonunun bir uyarlaması, Mars'ta bulunan hammaddelerden metan üretmek için karışık bir katalizör yatağı ve tek bir reaktörde ters su-gaz kayması ile kullanılabilir ve Mars toprak altındaki su ve Mars atmosferindeki karbondioksit kullanılabilir. ⓘ
Metan, su, karbondioksit ve Mars'ta yaygın olduğu bilinen olivin mineralini içeren serpentinizasyon adı verilen biyolojik olmayan bir süreçle üretilebilir. ⓘ
Tarihçe

Kasım 1776'da metan ilk kez İtalyan fizikçi Alessandro Volta tarafından İtalya ve İsviçre'yi birbirine bağlayan Maggiore Gölü bataklıklarında bilimsel olarak tanımlandı. Volta, Benjamin Franklin'in "yanıcı hava" hakkında yazdığı bir makaleyi okuduktan sonra bu maddeyi aramak için ilham aldı. Volta bataklıktan yükselen gazı topladı ve 1778'de saf metanı izole etti. Ayrıca gazın bir elektrik kıvılcımıyla tutuşturulabileceğini de gösterdi. ⓘ
Sir Humphry Davy, 1812'de 92 kişinin öldüğü Felling maden faciasının ardından, korkulan ateş gazının aslında büyük ölçüde metan olduğunu tespit etti. ⓘ
"Metan" ismi 1866 yılında Alman kimyager August Wilhelm von Hofmann tarafından bulunmuştur. Bu isim metanolden türetilmiştir. ⓘ
Etimoloji
Etimolojik olarak "metan" kelimesi, alkan ailesine ait maddeleri ifade eden "-ane" kimyasal son ekinden türetilmiştir; "metil" kelimesi ise Almanca "methyl" (1840) veya doğrudan Fransızca "méthyle" kelimesinden türetilmiştir. Bu kelimenin kökü 1834 yılında Jean-Baptiste Dumas ve Eugène Péligot tarafından Yunanca "methy" (şarap) (İngilizce "mead" ile ilgili) ve "hyle" ("odun" anlamına gelir) kelimelerinden türetilen Fransızca "méthylène" (İngilizce "methylene" kelimesine karşılık gelir) kelimesinden gelmektedir. Radikal, ilk olarak odunun damıtılmasıyla izole edilen bir alkol olan metanolde tespit edildiği için bu adı almıştır. Kimyasal son ek "-ane", soyutları temsil etmek için uygulanan Latince dişil son ek "-ina "dan gelen koordinasyon kimyasal son eki "-ine "den gelmektedir. "-ane", "-ene", "-one" vb. koordinasyonu 1866 yılında Alman kimyager August Wilhelm von Hofmann (1818-1892) tarafından önerilmiştir. ⓘ
Kısaltmalar
CH4-C kısaltması, bir metan kütlesinde bulunan karbon kütlesi anlamına gelebilir ve metan kütlesi her zaman CH4-C kütlesinin 1,33 katıdır. CH4-C aynı zamanda kütlece 1,33 olan metan-karbon oranı anlamına da gelebilir. Atmosfer ölçeğinde metan genellikle aynı anlama gelen teragram (Tg CH4) veya milyonlarca metrik ton (MMT CH4) cinsinden ölçülür. Nanomol (nmol, molün milyarda biri), mol (mol), kilogram ve gram gibi diğer standart birimler de kullanılır. ⓘ
Güvenlik
Metan toksik değildir, ancak son derece yanıcıdır ve hava ile patlayıcı karışımlar oluşturabilir. Metan aynı zamanda oksijen konsantrasyonunun yer değiştirme yoluyla yaklaşık %16'nın altına düşürülmesi halinde boğucu bir maddedir, zira çoğu insan %21'den %16'ya düşüşü kötü etki olmaksızın tolere edebilir. Boğulma riskinin önemli hale geldiği metan konsantrasyonu, yanıcı veya patlayıcı bir karışımdaki %5-15'lik konsantrasyondan çok daha yüksektir. Metan gazı, düzenli depolama sahalarının yakınındaki binaların iç kısımlarına nüfuz edebilir ve bina sakinlerini önemli seviyelerde metana maruz bırakabilir. Bazı binaların bodrum katlarının altında bu gazı aktif olarak yakalamak ve binadan uzaklaştırmak için özel olarak tasarlanmış geri kazanım sistemleri bulunmaktadır. ⓘ
Metan gazı patlamaları birçok ölümcül maden felaketinden sorumludur. Metan gazı patlaması 5 Nisan 2010 tarihinde Batı Virginia'daki Upper Big Branch kömür madeni faciasına neden olmuş ve 29 kişinin ölümüne yol açmıştır. Doğal gazın kazara salınması, jet yangını felaketlerinin oluşumuyla sonuçlanan geçmiş kazara salınmalar nedeniyle güvenlik mühendisliği alanında da önemli bir odak noktası olmuştur. ⓘ
Ayrıca bakınız
- 2007 Zasyadko maden faciası
- Abiyojenik petrol kökenli
- Aerobik metan üretimi
- Anaerobik çürütme
- Anaerobik solunum
- Arktik metan emisyonları
- Biyogaz
- Coal Oil Point sızıntı alanı
- Enerji yoğunluğu
- Kaçak gaz emisyonları
- Küresel Metan Girişimi
- Thomas Gold
- Halometan, halojenli metan türevleri.
- Hidrojen Döngüsü
- Endüstriyel gaz
- Kivu Gölü (daha genel: limnik püskürme)
- Düz zincirli alkanların listesi
- Metanasyon
- Metan emisyonları
- Mars'ta metan:
- atmosfer
- iklim
- Metanojen, metan üreten arkea.
- Metanojenez, metan üreten mikroplar.
- Metanotrof, metan ile büyüyen bakteriler.
- Metil grubu, metan ile ilgili bir fonksiyonel grup. ⓘ
Atıf yapılan kaynaklar
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97. baskı). CRC Press. ISBN 9781498754293. ⓘ