Helyum
 | ||||||||||||||||
| Helyum | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | /ˈhiːliəm/ (HEE-lee-əm) | |||||||||||||||
| Görünüş | renksiz gaz, bir elektrik alanına yerleştirildiğinde gri, bulutumsu bir parıltı (veya özellikle yüksek voltaj kullanılırsa kırmızımsı-turuncu) sergiler | |||||||||||||||
| Standart atom ağırlığı Ar°(He) |
| |||||||||||||||
| Periyodik tabloda helyum | ||||||||||||||||
| ||||||||||||||||
| Atom numarası (Z) | 2 | |||||||||||||||
| Grup | grup 18 (asal gazlar) | |||||||||||||||
| Dönem | dönem 1 | |||||||||||||||
| Blok | s-blok | |||||||||||||||
| Elektron konfigürasyonu | 1s2 | |||||||||||||||
| Kabuk başına elektron | 2 | |||||||||||||||
| Fiziksel özellikler | ||||||||||||||||
| STP'de Faz | gaz | |||||||||||||||
| Erime noktası | 0,95 K (-272,20 °C, -457,96 °F) (2,5 MPa'da) | |||||||||||||||
| Kaynama noktası | 4.222 K (-268.928 °C, -452.070 °F) | |||||||||||||||
| Yoğunluk (STP'de) | 0,1786 g/L | |||||||||||||||
| sıvı olduğunda (m.p.'de) | 0,145 g/cm3 | |||||||||||||||
| sıvı olduğunda (b.p.'de) | 0,125 g/cm3 | |||||||||||||||
| Üçlü nokta | 2.177 K, 5.043 kPa | |||||||||||||||
| Kritik nokta | 5.1953 K, 0.22746 MPa | |||||||||||||||
| Füzyon ısısı | 0,0138 kJ/mol | |||||||||||||||
| Buharlaşma ısısı | 0,0829 kJ/mol | |||||||||||||||
| Molar ısı kapasitesi | 20,78 J/(mol-K) | |||||||||||||||
Buhar basıncı (ITS-90 tarafından tanımlanmıştır)
| ||||||||||||||||
| Atomik özellikler | ||||||||||||||||
| Oksidasyon durumları | 0 | |||||||||||||||
| Elektronegatiflik | Pauling ölçeği: veri yok | |||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||
| Kovalent yarıçap | 28 pm | |||||||||||||||
| Van der Waals yarıçapı | 140 pm | |||||||||||||||
| Helyumun spektral çizgileri | ||||||||||||||||
| Diğer özellikler | ||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||
| Kristal yapı | altıgen yakın paketlenmiş (hcp) | |||||||||||||||
| Ses hızı | 972 m/s | |||||||||||||||
| Termal iletkenlik | 0,1513 W/(m⋅K) | |||||||||||||||
| Manyetik sıralama | diamanyetik | |||||||||||||||
| Molar manyetik duyarlılık | -1,88×10-6 cm3/mol (298 K) | |||||||||||||||
| CAS Numarası | 7440-59-7 | |||||||||||||||
| Tarih | ||||||||||||||||
| İsimlendirme | Yunan Güneş Tanrısı Helios'tan sonra | |||||||||||||||
| Keşif | Pierre Janssen, Norman Lockyer (1868) | |||||||||||||||
| İlk izolasyon | William Ramsay, Per Teodor Cleve, Abraham Langlet (1895) | |||||||||||||||
| Helyumun ana izotopları | ||||||||||||||||
| ||||||||||||||||
Helyum (Yunanca: ἥλιος, romanize: helios, lit. 'güneş') sembolü He ve atom numarası 2 olan kimyasal bir elementtir. Renksiz, kokusuz, tatsız, toksik olmayan, inert, monatomik bir gazdır ve periyodik tablodaki soy gaz grubunun ilkidir. Kaynama ve erime noktası tüm elementler arasında en düşük olanıdır. Gözlemlenebilir evrendeki en hafif ve en bol ikinci elementtir (hidrojen en hafif ve en bol olanıdır). Toplam element kütlesinin yaklaşık %24'ünde bulunur, bu da tüm ağır elementlerin toplam kütlesinin 12 katından fazladır. Helyum-4'ün helyumdan sonraki üç elemente göre çok yüksek nükleer bağlanma enerjisi (nükleon başına) nedeniyle hem Güneş'te hem de Jüpiter'de bolluğu buna benzerdir. Bu helyum-4 bağlanma enerjisi aynı zamanda neden hem nükleer füzyonun hem de radyoaktif bozunmanın bir ürünü olduğunu da açıklamaktadır. Evrendeki helyumun çoğu helyum-4'tür ve büyük çoğunluğu Büyük Patlama sırasında oluşmuştur. Yıldızlardaki hidrojenin nükleer füzyonu ile büyük miktarlarda yeni helyum yaratılır. ⓘ
Helyum ilk olarak 1868 yılında Georges Rayet, Yüzbaşı C. T. Haig, Norman R. Pogson ve Teğmen John Herschel tarafından bir güneş tutulması sırasında güneş ışığında bilinmeyen sarı bir spektral çizgi olarak tespit edilmiş ve daha sonra Fransız astronom Jules Janssen tarafından doğrulanmıştır. Janssen genellikle Norman Lockyer ile birlikte bu elementi tespit eden kişi olarak anılır. Janssen helyum spektral çizgisini 1868 güneş tutulması sırasında kaydetmiş, Lockyer ise İngiltere'den gözlemlemiştir. Lockyer, çizginin adını verdiği yeni bir elementten kaynaklandığını öne süren ilk kişi oldu. Elementin resmi keşfi 1895 yılında kimyagerler Sir William Ramsay, Per Teodor Cleve ve Nils Abraham Langlet tarafından yapılmış, kimyagerler günümüzde ayrı bir mineral türü olarak değil, uraninitin bir çeşidi olarak kabul edilen uranyum cevheri cleveite'den yayılan helyumu bulmuşlardır. 1903 yılında, bugün gazın en büyük tedarikçisi olan Amerika Birleşik Devletleri'nin bazı bölgelerindeki doğal gaz sahalarında büyük helyum rezervleri bulundu. ⓘ
Sıvı helyum kriyojenikte (üretimin yaklaşık dörtte birini emen en büyük tek kullanımı) ve MRI tarayıcılarındaki ana ticari uygulamasıyla süper iletken mıknatısların soğutulmasında kullanılır. Helyumun basınçlandırma ve boşaltma gazı olarak, ark kaynağı için koruyucu bir atmosfer olarak ve silikon gofret yapmak için kristal büyütme gibi işlemlerde diğer endüstriyel kullanımları, üretilen gazın yarısını oluşturmaktadır. İyi bilinen ancak küçük bir kullanım alanı da balonlarda ve hava gemilerinde kaldırma gazı olarak kullanılmasıdır. Yoğunluğu havadan farklı olan her gazda olduğu gibi, az miktarda helyum solumak insan sesinin tınısını ve kalitesini geçici olarak değiştirir. Bilimsel araştırmalarda, helyumun iki akışkan fazının (helyum I ve helyum II) davranışı, kuantum mekaniği (özellikle süperakışkanlık özelliği) ve mutlak sıfıra yakın maddede üretilen süperiletkenlik gibi fenomenleri inceleyen araştırmacılar için önemlidir. ⓘ
Dünya'da, atmosferde hacimce 5,2 ppm gibi nispeten nadir bulunur. Günümüzde mevcut olan karasal helyumun çoğu, ağır radyoaktif elementlerin (toryum ve uranyum, başka örnekler de vardır) doğal radyoaktif bozunumu ile oluşur, çünkü bu tür bozunumlar tarafından yayılan alfa parçacıkları helyum-4 çekirdeklerinden oluşur. Bu radyojenik helyum, hacimce %7'ye varan konsantrasyonlarda doğal gazla birlikte bulunur ve fraksiyonel damıtma adı verilen düşük sıcaklıklı bir ayırma işlemiyle ticari olarak çıkarılır. Karasal helyum yenilenemez bir kaynaktır çünkü atmosfere salındıktan sonra derhal uzaya kaçar. Arzının hızla azaldığı düşünülmektedir. Ancak bazı çalışmalar, radyoaktif bozunma yoluyla dünyanın derinliklerinde üretilen helyumun, bazı durumlarda volkanik faaliyetler sonucu açığa çıkan doğal gaz rezervlerinde beklenenden daha büyük miktarlarda toplanabileceğini göstermektedir. ⓘ
Helyum (Yunanca "güneş" anlamına gelen ἥλιος heliostan), sembolü He' ve atom numarası 2 olan kimyasal element. Periyodik cetvelin birinci periyot 8A grubunda yer alan bir gazdır. ⓘ
Tarih
Bilimsel keşifler
Helyumun ilk kanıtı 18 Ağustos 1868'de Güneş'in kromosferinin spektrumunda 587,49 nanometre dalga boyunda parlak sarı bir çizgi olarak gözlemlendi. Bu çizgi Fransız astronom Jules Janssen tarafından Hindistan'ın Guntur kentinde tam güneş tutulması sırasında tespit edilmiştir. Bu çizginin başlangıçta sodyum olduğu varsayıldı. Aynı yılın 20 Ekim'inde İngiliz astronom Norman Lockyer, Güneş spektrumunda sarı bir çizgi gözlemledi ve sodyumun bilinen D1 ve D2 Fraunhofer çizgilerine yakın olduğu için bu çizgiye D3 adını verdi. Bunun Güneş'te bulunan ve Dünya'da bilinmeyen bir elementten kaynaklandığı sonucuna vardı. Lockyer ve İngiliz kimyager Edward Frankland bu elemente Güneş'in Yunanca karşılığı olan ἥλιος (helios) adını verdiler. ⓘ

1881 yılında İtalyan fizikçi Luigi Palmieri, Vezüv Yanardağı'nın yakın zamanda patlaması sırasında süblimleşen bir materyali analiz ettiğinde, D3 spektral çizgisi aracılığıyla Dünya'daki helyumu ilk kez tespit etti. ⓘ


26 Mart 1895'te İskoç kimyager Sir William Ramsay, kleveit mineralini (en az %10 nadir toprak elementleri içeren bir uraninit çeşidi) mineral asitlerle işleyerek Dünya'da helyumu izole etti. Ramsay argon arıyordu, ancak sülfürik asitle serbest kalan gazdan nitrojen ve oksijeni ayırdıktan sonra, Güneş'in spektrumunda gözlemlenen D3 çizgisiyle eşleşen parlak sarı bir çizgi fark etti. Bu örnekler Lockyer ve İngiliz fizikçi William Crookes tarafından helyum olarak tanımlandı. Aynı yıl İsveç'in Uppsala kentinde kimyagerler Per Teodor Cleve ve Abraham Langlet tarafından kleveitten bağımsız olarak izole edildi ve atom ağırlığını doğru bir şekilde belirlemek için yeterli miktarda gaz toplandı. Helyum ayrıca Ramsay'in keşfinden önce Amerikalı jeokimyacı William Francis Hillebrand tarafından uraninit mineralinin bir örneğini test ederken olağandışı spektral çizgiler fark ettiğinde izole edilmiştir. Ancak Hillebrand bu çizgileri nitrojene bağlamıştır. Ramsay'e gönderdiği tebrik mektubu, bilimde ilginç bir keşif ve keşfe yakın bir durum sunmaktadır. ⓘ
1907'de Ernest Rutherford ve Thomas Royds, alfa parçacıklarının helyum çekirdeği olduğunu, parçacıkların boşaltılmış bir tüpün ince cam duvarından geçmesine izin vererek ve ardından tüpte bir deşarj yaratarak, içerideki yeni gazın spektrumunu inceleyerek gösterdiler. 1908 yılında helyum ilk olarak Hollandalı fizikçi Heike Kamerlingh Onnes tarafından gazı 5 K (-268,15 °C; -450,67 °F) altına kadar soğutarak sıvılaştırıldı. Sıcaklığı daha da düşürerek katılaştırmayı denedi, ancak başarısız oldu, çünkü helyum atmosferik basınçta katılaşmaz. Onnes'in öğrencisi Willem Hendrik Keesom 1926'da ek dış basınç uygulayarak 1 cm3 helyumu katılaştırmayı başardı. ⓘ
1913 yılında Niels Bohr, atom modelini destekleyen temel kanıt olarak Pickering-Fowler serisinin yeniden değerlendirilmesini içeren atom yapısı üzerine "üçlemesini" yayınladı. Bu seri adını, 1896 yılında ζ Puppis yıldızının spektrumunda daha önce bilinmeyen çizgilerin gözlemlerini yayınlayan Edward Charles Pickering'den almıştır (bu çizgilerin Wolf-Rayet ve diğer sıcak yıldızlarda da görüldüğü artık bilinmektedir). Pickering gözlemi (4551, 5411 ve 10123 Å'daki çizgiler) yarı tamsayı geçiş seviyelerine sahip yeni bir hidrojen formuna bağladı. 1912'de Alfred Fowler bir hidrojen-helyum karışımından benzer çizgiler üretmeyi başardı ve Pickering'in bu çizgilerin kökenine ilişkin sonucunu destekledi. Bohr'un modeli yarı tamsayı geçişlere izin vermez (kuantum mekaniği de vermez) ve Bohr, Pickering ve Fowler'ın yanıldığı sonucuna vardı ve bunun yerine bu spektral çizgileri iyonize helyuma, He+'ya atadı. Fowler başlangıçta şüpheciydi ama sonunda Bohr'un haklı olduğuna ikna oldu ve 1915'e gelindiğinde "spektroskopistler [Pickering-Fowler serisini] kesin olarak [hidrojenden] helyuma aktarmışlardı." Bohr'un Pickering serisi üzerindeki teorik çalışması, "klasik teoriler içinde zaten çözülmüş gibi görünen sorunların yeniden incelenmesi" ihtiyacını ortaya koymuş ve atom teorisi için önemli bir doğrulama sağlamıştı. ⓘ
1938 yılında Rus fizikçi Pyotr Leonidovich Kapitsa, helyum-4'ün mutlak sıfıra yakın sıcaklıklarda neredeyse hiç viskoziteye sahip olmadığını keşfetti; bu olgu günümüzde süperakışkanlık olarak adlandırılmaktadır. Bu olgu Bose-Einstein yoğunlaşması ile ilgilidir. 1972 yılında Amerikalı fizikçiler Douglas D. Osheroff, David M. Lee ve Robert C. Richardson tarafından aynı olgu helyum-3'te, ancak mutlak sıfıra çok daha yakın sıcaklıklarda gözlemlenmiştir. Helyum-3'teki fenomenin, süper iletkenlik üreten elektronların Cooper çiftlerine benzer şekilde, bozonlar yapmak için helyum-3 fermiyonlarının eşleşmesiyle ilgili olduğu düşünülmektedir. ⓘ
Helyum ilk olarak 1868'de İngiltere'de astronom Norman Lockyer tarafından tayf çizgileri olarak gözlenmiştir. William Ramsay 1895 yılında uranyum içeren kleveyit minerali ve bir asitle yaptığı bir deneyde, helyum oluştuğunu görmüştür. 1868 yılında Pierre Janssen ve Norman Lockyer, birbirinden bağımsız olarak helyumu keşfetmişlerdir. 1908 yılında Heike Kamerlingh Onnes 0,9 °K'de ilk sıvı helyumu elde etmiştir. ⓘ
| Madde Adı | Yoğunluğu (g/l) | Durumu ⓘ |
|---|---|---|
| Helyum | 0,1786 | 0 °C ve deniz seviyesinde |
| Hava | 1,2929 | 0 °C ve deniz seviyesinde |
| SF6 | 6,164 | 0 °C ve deniz seviyesinde |
Çıkarma ve kullanım

Kansas, Dexter'da 1903 yılında yapılan bir petrol sondajı sırasında yanmayan bir gaz gayzeri ortaya çıkınca, Kansas eyaleti jeoloğu Erasmus Haworth çıkan gazdan örnekler toplayarak Lawrence'daki Kansas Üniversitesi'ne götürmüş ve burada kimyager Hamilton Cady ve David McFarland'ın yardımıyla gazın hacimsel olarak %72 nitrojen, %15 metan (sadece yeterli oksijenle yanabilen bir gaz), %1 hidrojen ve %12 tanımlanamayan bir gazdan oluştuğunu keşfetmiştir. Cady ve McFarland daha ileri analizlerle gaz örneğinin %1,84'ünün helyum olduğunu keşfetti. Bu, Dünya'da nadir bulunmasına rağmen, helyumun Amerikan Büyük Ovaları'nın altında büyük miktarlarda yoğunlaştığını ve doğal gazın bir yan ürünü olarak çıkarılmaya müsait olduğunu gösterdi. ⓘ
Bu da Amerika Birleşik Devletleri'nin dünyanın önde gelen helyum tedarikçisi olmasını sağladı. Sir Richard Threlfall'un önerisi üzerine Birleşik Devletler Donanması I. Dünya Savaşı sırasında üç küçük deneysel helyum tesisine sponsor oldu. Amaç baraj balonlarına yanıcı olmayan, havadan hafif gaz sağlamaktı. Daha önce bir metreküpten daha az gaz elde edilmiş olmasına rağmen programda toplam 5.700 m3 (200.000 cu ft) %92 helyum üretildi. Bu gazın bir kısmı dünyanın ilk helyum dolu hava gemisi olan ABD Donanması'nın C sınıfı zeplini C-7'de kullanıldı. 1 Aralık 1921'de Hampton Roads, Virginia'dan Washington, D.C.'deki Bolling Field'a ilk seferini gerçekleştiren zeplin, Donanma'nın ilk katı helyum dolu hava gemisi olan Donanma Uçak Fabrikası yapımı USS Shenandoah'ın Eylül 1923'te uçmasından yaklaşık iki yıl önce uçtu. ⓘ
Düşük sıcaklıkta gaz sıvılaştırma yöntemini kullanan çıkarma işlemi I. Dünya Savaşı sırasında önemli olacak kadar zamanında geliştirilememiş olsa da üretim devam etti. Helyum öncelikle havadan hafif araçlarda kaldırma gazı olarak kullanıldı. İkinci Dünya Savaşı sırasında, kaldırma gazı ve korumalı ark kaynağı için helyuma olan talep arttı. Helyum kütle spektrometresi de atom bombası Manhattan Projesi'nde hayati önem taşıyordu. ⓘ
Birleşik Devletler hükümeti, savaş zamanında askeri hava gemilerine, barış zamanında ise ticari hava gemilerine tedarik sağlamak amacıyla 1925 yılında Amarillo, Teksas'ta Ulusal Helyum Rezervi'ni kurdu. ABD'nin o dönemde üretim tekeline sahip olduğu kıt helyumun ihracatını yasaklayan 1925 tarihli Helyum Yasası ve gazın engelleyici maliyeti nedeniyle, tüm Alman Zeplinleri gibi Hindenburg da kaldırma gazı olarak hidrojen kullanmak zorunda kaldı. İkinci Dünya Savaşı'ndan sonra helyum pazarı daraldı ancak Uzay Yarışı ve Soğuk Savaş sırasında oksijen/hidrojen roket yakıtı oluşturmak için (diğer kullanımların yanı sıra) soğutucu olarak sıvı helyum tedarikini sağlamak üzere 1950'lerde rezerv genişletildi. Amerika Birleşik Devletleri'nde 1965 yılında helyum kullanımı savaş zamanı tüketiminin sekiz katından fazlaydı. ⓘ
"1960 Helyum Yasası Değişiklikleri "nden (86-777 sayılı Kamu Yasası) sonra ABD Maden Bürosu doğal gazdan helyum geri kazanımı için beş özel tesis kurdu. Bu helyum koruma programı için Büro, bu tesisleri hükümetin Amarillo, Texas yakınlarındaki kısmen tükenmiş Cliffside gaz sahasına bağlamak üzere Bushton, Kansas'tan 425 mil (684 km) uzunluğunda bir boru hattı inşa etti. Bu helyum-azot karışımı, ihtiyaç duyulana kadar Cliffside gaz sahasına enjekte edilip depolandı ve bu sırada daha da saflaştırıldı. ⓘ
1995 yılına gelindiğinde bir milyar metreküp gaz toplanmıştı ve rezervin 1,4 milyar ABD doları borcu vardı. 1996 yılında ABD Kongresi rezervin aşamalı olarak tasfiye edilmesine karar verdi. Bunun sonucunda ortaya çıkan 1996 tarihli Helyum Özelleştirme Yasası (104-273 sayılı Kamu Yasası), Amerika Birleşik Devletleri İçişleri Bakanlığı'nı rezervi boşaltmaya yönlendirdi ve satışlar 2005 yılında başladı. ⓘ
1930-1945 yılları arasında üretilen helyum yaklaşık %98.3 saflıktaydı (%2 azot) ve bu da hava gemileri için yeterliydi. 1945 yılında kaynak kullanımı için az miktarda %99.9 helyum üretildi. 1949 yılına gelindiğinde, ticari miktarlarda A Sınıfı %99,95 helyum mevcuttu. ⓘ
Uzun yıllar boyunca Amerika Birleşik Devletleri dünyada ticari olarak kullanılabilir helyumun %90'ından fazlasını üretirken, Kanada, Polonya, Rusya ve diğer ülkelerdeki çıkarma tesisleri geri kalanını üretti. 1990'ların ortalarında Cezayir'in Arzew kentinde 17 milyon metreküp (600 milyon fit küp) üretim yapan yeni bir tesis faaliyete geçti ve Avrupa'nın tüm talebini karşılayacak kadar üretim yaptı. Bu arada, 2000 yılına gelindiğinde ABD'deki helyum tüketimi yılda 15 milyon kg'ın üzerine çıkmıştı. 2004-2006 yıllarında Ras Laffan, Katar ve Skikda, Cezayir'de ek tesisler inşa edildi. Cezayir hızla ikinci önde gelen helyum üreticisi haline geldi. Bu süre zarfında hem helyum tüketimi hem de helyum üretim maliyetleri arttı. 2002'den 2007'ye kadar helyum fiyatları iki katına çıktı. ⓘ
2012 yılı itibariyle ABD Ulusal Helyum Rezervi dünyadaki helyumun yüzde 30'unu oluşturuyordu. Rezervdeki helyumun 2018 yılında tükenmesi bekleniyordu. Buna rağmen, Birleşik Devletler Senatosu'nda önerilen bir yasa tasarısı rezervin gaz satmaya devam etmesine izin verecekti. Diğer büyük rezervler Amerika Birleşik Devletleri'nin Kansas eyaletindeki Hugoton'da ve Kansas ile Teksas ve Oklahoma'nın yakınlarındaki gaz sahalarında bulunuyordu. Katar, Rusya ve ABD'nin Wyoming eyaletinde 2012 yılında yeni helyum tesislerinin açılması planlanıyordu, ancak bunların kıtlığı hafifletmesi beklenmiyordu. ⓘ
Katar 2013 yılında dünyanın en büyük helyum ünitesini faaliyete geçirdi, ancak 2017 Katar diplomatik krizi buradaki helyum üretimini ciddi şekilde etkiledi. 2014 yılı, yıllarca süren ünlü kıtlıkların ardından helyum sektöründe aşırı arzın yaşandığı bir yıl olarak kabul edildi. Nasdaq (2015), endüstriyel kullanım için gaz satan uluslararası bir şirket olan Air Products için helyum hacimlerinin hammadde tedarik kısıtlamaları nedeniyle ekonomik baskı altında kaldığını bildirdi. ⓘ
Özellikleri
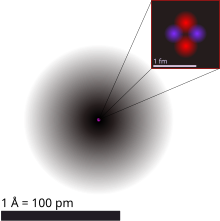
Helyum atomu
Kuantum mekaniğinde helyum
Kuantum mekaniği perspektifinden bakıldığında helyum, hidrojen atomundan sonra modellenmesi en basit ikinci atomdur. Helyum, iki proton ve (genellikle) iki nötron içeren bir çekirdeği çevreleyen atomik orbitallerdeki iki elektrondan oluşur. Newton mekaniğinde olduğu gibi, ikiden fazla parçacıktan oluşan hiçbir sistem tam bir analitik matematiksel yaklaşımla çözülemez (bkz. 3 cisim problemi) ve helyum da bir istisna değildir. Bu nedenle, bir çekirdek ve iki elektrondan oluşan sistemi çözmek için bile sayısal matematiksel yöntemler gereklidir. Bu tür hesaplamalı kimya yöntemleri, birkaç hesaplama adımında doğru değerin <%2'sine kadar doğru olan helyum elektron bağlanmasının kuantum mekaniksel bir resmini oluşturmak için kullanılmıştır. Bu tür modeller, helyumdaki her bir elektronun çekirdeği diğerinden kısmen perdelediğini, böylece her bir elektronun gördüğü etkin nükleer yük Z'nin klasik bir "çıplak" helyum çekirdeğinin 2 yükü değil, yaklaşık 1,69 birim olduğunu göstermektedir. ⓘ
Helyum-4 çekirdeğinin ve elektron kabuğunun ilgili kararlılığı
Helyum-4 atomunun çekirdeği bir alfa parçacığı ile özdeştir. Yüksek enerjili elektron saçılma deneyleri, helyumun kendi elektron bulutunun yük yoğunluğu gibi, yükünün de merkezi bir noktadaki maksimumdan üstel olarak azaldığını göstermektedir. Bu simetri altta yatan benzer fiziği yansıtır: helyumun çekirdeğindeki nötron çifti ve proton çifti, helyumun elektron çifti ile aynı kuantum mekanik kurallarına uyar (nükleer parçacıklar farklı bir nükleer bağlanma potansiyeline tabi olsa da), böylece tüm bu fermiyonlar çiftler halinde 1s orbitallerini tamamen işgal eder, hiçbiri yörüngesel açısal momentuma sahip değildir ve her biri diğerinin içsel spinini iptal eder. Bu parçacıklardan herhangi birinin daha eklenmesi açısal momentum gerektirecek ve önemli ölçüde daha az enerji açığa çıkaracaktır (aslında beş nükleonlu hiçbir çekirdek kararlı değildir). Dolayısıyla bu düzenleme tüm bu parçacıklar için enerjik olarak son derece kararlıdır ve bu kararlılık doğada helyumla ilgili birçok önemli olguyu açıklar. ⓘ
Örneğin, helyumdaki elektron bulutu durumunun kararlılığı ve düşük enerjisi, elementin kimyasal inertliğini ve ayrıca helyum atomlarının birbirleriyle etkileşime girmemesini açıklar ve tüm elementler arasında en düşük erime ve kaynama noktalarını üretir. ⓘ
Benzer bir şekilde, helyum-4 çekirdeğinin benzer etkilerle üretilen özel enerjik kararlılığı, ağır parçacık emisyonu veya füzyon içeren atomik reaksiyonlarda helyum-4 üretiminin kolaylığını açıklar. Hidrojenden füzyon reaksiyonlarında bir miktar kararlı helyum-3 (2 proton ve 1 nötron) üretilir, ancak bu son derece elverişli helyum-4'e kıyasla çok küçük bir kısımdır. ⓘ

Helyum-4 çekirdeğinin olağandışı kararlılığı kozmolojik açıdan da önemlidir: Büyük Patlama'dan sonraki ilk birkaç dakika içinde, başlangıçta yaklaşık 6:1 oranında yaratılmış olan serbest proton ve nötron "çorbası" nükleer bağlanmanın mümkün olduğu noktaya kadar soğudukça, oluşacak ilk bileşik atom çekirdeklerinin neredeyse tamamının helyum-4 çekirdeği olduğu gerçeğini açıklar. Helyum-4 bağlanması o kadar sıkıydı ki, helyum-4 üretimi serbest nötronların neredeyse tamamını beta bozunmasına uğramadan birkaç dakika içinde tüketti ve lityum, berilyum ya da bor gibi daha ağır atomları oluşturacak çok az nötron bıraktı. Helyum-4'ün nükleon başına nükleer bağlanması bu elementlerin herhangi birinden daha güçlüdür (bkz. nükleogenez ve bağlanma enerjisi) ve bu nedenle helyum oluştuktan sonra 3, 4 ve 5. elementleri oluşturmak için hiçbir enerjik itici güç mevcut değildi. Helyumun, nükleon başına daha düşük enerjiye sahip bir sonraki element olan karbona kaynaşması ancak enerjik olarak elverişliydi. Ancak, ara elementlerin eksikliği nedeniyle, bu süreç üç helyum çekirdeğinin neredeyse aynı anda birbirine çarpmasını gerektirir (bkz. üçlü alfa süreci). Dolayısıyla Büyük Patlama'dan sonraki birkaç dakika içinde, erken genişleyen evren helyumun karbona füzyonunun artık mümkün olmadığı sıcaklık ve basınç noktasına soğumadan önce kayda değer bir karbon oluşması için zaman yoktu. Bu durum erken evrende bugün gözlenene çok benzer bir hidrojen/helyum oranı (kütlece 3 kısım hidrojene 1 kısım helyum-4) bırakmış ve evrendeki nötronların neredeyse tamamı helyum-4 içinde hapsolmuştur. ⓘ
Dolayısıyla Büyük Patlama'dan bu yana tüm ağır elementler (Dünya gibi kayalık gezegenler ve karbon bazlı ya da diğer yaşamlar için gerekli olanlar da dahil olmak üzere) helyumun kendisini kaynaştıracak kadar sıcak olan yıldızlarda yaratılmıştır. Bugün hidrojen ve helyum dışındaki tüm elementler evrendeki atomik madde kütlesinin yalnızca %2'sini oluşturmaktadır. Buna karşın Helyum-4, evrendeki sıradan maddenin yaklaşık %23'ünü oluşturur - hidrojen olmayan sıradan maddenin neredeyse tamamını. ⓘ
Gaz ve plazma fazları

Helyum, neondan sonra en az reaktif ikinci soy gazdır ve dolayısıyla tüm elementler arasında en az reaktif ikinci gazdır. Tüm standart koşullarda kimyasal olarak inert ve monatomiktir. Helyumun nispeten düşük molar (atomik) kütlesi nedeniyle, gaz fazındaki termal iletkenliği, özgül ısısı ve ses hızı hidrojen hariç diğer tüm gazlardan daha yüksektir. Bu nedenlerden ve helyum monatomik moleküllerinin küçük boyutundan dolayı, helyum katılar içinde havanın üç katı ve hidrojenin yaklaşık %65'i oranında yayılır. ⓘ
Helyum suda en az çözünen tek atomlu gazdır ve herhangi bir gaz arasında suda en az çözünenlerden biridir (CF4, SF6 ve C4F8 daha düşük mol kesri çözünürlüklerine sahiptir: Helyumun 0,70797 x2/10-5 değerine karşılık sırasıyla 0,3802, 0,4394 ve 0,2372 x2/10-5) ve helyumun kırılma indeksi diğer gazlarınkine kıyasla birliğe daha yakındır. Helyum normal ortam sıcaklıklarında negatif bir Joule-Thomson katsayısına sahiptir, yani serbestçe genişlemesine izin verildiğinde ısınır. Sadece Joule-Thomson inversiyon sıcaklığının altında (1 atmosferde yaklaşık 32 ila 50 K) serbestçe genişlediğinde soğur. Bu sıcaklığın altında ön soğutma yapıldığında, helyum genleşme soğutması yoluyla sıvılaştırılabilir. ⓘ
Dünya dışı helyumun çoğu, atomik helyumdan oldukça farklı özelliklere sahip bir plazma halinde bulunur. Bir plazmada, helyumun elektronları çekirdeğine bağlı değildir, bu da gaz sadece kısmen iyonize olduğunda bile çok yüksek elektrik iletkenliği ile sonuçlanır. Yüklü parçacıklar manyetik ve elektrik alanlardan oldukça etkilenir. Örneğin, iyonize hidrojenle birlikte güneş rüzgarında, parçacıklar Dünya'nın manyetosferiyle etkileşime girerek Birkeland akımlarına ve aurora'ya yol açar. ⓘ
Sıvı helyum

Diğer elementlerin aksine, helyum normal basınçlarda mutlak sıfıra kadar sıvı halde kalacaktır. Bu kuantum mekaniğinin doğrudan bir etkisidir: özellikle sistemin sıfır noktası enerjisi donmaya izin vermeyecek kadar yüksektir. Katı helyum, yaklaşık 25 bar (2,5 MPa) basınçta 1-1,5 K (yaklaşık -272 °C veya -457 °F) sıcaklık gerektirir. İki fazın kırılma indisi neredeyse aynı olduğu için katı helyumu sıvı helyumdan ayırt etmek genellikle zordur. Katı, keskin bir erime noktasına ve kristal bir yapıya sahiptir, ancak yüksek oranda sıkıştırılabilir; bir laboratuvarda basınç uygulamak hacmini %30'dan fazla azaltabilir. Yaklaşık 27 MPa'lık bir yığın modülü ile sudan ~100 kat daha fazla sıkıştırılabilir. Katı helyum 1,15 K ve 66 atm'de 0,214±0,006 g/cm3 yoğunluğa sahiptir; 0 K ve 25 bar'da (2,5 MPa) öngörülen yoğunluk 0,187±0,009 g/cm3'tür. Daha yüksek sıcaklıklarda helyum yeterli basınçla katılaşacaktır. Oda sıcaklığında bunun için yaklaşık 114.000 atm gerekir. ⓘ
Helyum I
Helyum-4 izotopu, 4,22 K (-268,93 °C; -452,07 °F) olan kaynama noktasının altında ve 2,1768 K (-270,9732 °C; -455,7518 °F) olan lambda noktasının üzerinde, helyum I adı verilen normal renksiz sıvı halde bulunur. Ancak lambda noktasının altında helyum kaynamaz ve sıcaklık daha da düşürüldüğünde genleşir. ⓘ
Helyum I'in 1,026'lık gaz benzeri bir kırılma indisi vardır, bu da yüzeyini görmeyi o kadar zorlaştırır ki, yüzeyin nerede olduğunu göstermek için genellikle strafor şamandıralar kullanılır. Bu renksiz sıvının çok düşük bir viskozitesi ve 0,145-0,125 g/mL (yaklaşık 0 ile 4 K arasında) yoğunluğu vardır ki bu değer klasik fizikten beklenen değerin yalnızca dörtte biridir. Bu özelliği açıklamak için kuantum mekaniği gereklidir ve bu nedenle sıvı helyumun her iki hali de (helyum I ve helyum II) kuantum sıvıları olarak adlandırılır, yani makroskopik ölçekte atomik özellikler gösterirler. Bu, kaynama noktasının mutlak sıfıra çok yakın olmasının, rastgele moleküler hareketin (termal enerji) atomik özellikleri maskelemesini engellemesinin bir etkisi olabilir. ⓘ
Helyum II
Lambda noktasının altındaki sıvı helyum (helyum II olarak adlandırılır) çok sıra dışı özellikler sergiler. Yüksek termal iletkenliği nedeniyle kaynadığında kabarcık oluşturmaz, doğrudan yüzeyinden buharlaşır. Helyum-3 de süper akışkan bir faza sahiptir, ancak sadece çok daha düşük sıcaklıklarda; sonuç olarak, izotopun özellikleri hakkında daha az şey bilinmektedir. ⓘ

Helyum II bir süperakışkandır, maddenin garip özelliklere sahip kuantum mekaniksel bir halidir (bkz: makroskopik kuantum fenomenleri). Örneğin, 10-7 ila 10-8 m kadar ince kılcal damarlardan aktığında ölçülebilir bir viskozitesi yoktur. Ancak, iki hareketli disk arasında ölçümler yapıldığında, gaz halindeki helyumunkiyle karşılaştırılabilir bir viskozite gözlemlenmiştir. Mevcut teori bunu helyum II için iki akışkan modelini kullanarak açıklamaktadır. Bu modelde, lambda noktasının altındaki sıvı helyum, süper akışkan olan ve tam olarak sıfır viskozite ile akan bir temel durumdaki helyum atomlarının bir kısmını ve daha çok sıradan bir sıvı gibi davranan uyarılmış bir durumdaki helyum atomlarının bir kısmını içeriyor olarak görülür. ⓘ
Fıskiye etkisinde, süper akışkan helyumun kolayca sızdığı ancak süper akışkan olmayan helyumun geçemediği sinterlenmiş bir disk ile bir helyum II rezervuarına bağlı bir hazne inşa edilir. Kabın içi ısıtılırsa, süperakışkan helyum süperakışkan olmayan helyuma dönüşür. Süperakışkan helyumun denge oranını korumak için, süperakışkan helyum sızar ve basıncı artırarak sıvının kaptan dışarı akmasına neden olur. ⓘ
Helyum II'nin ısıl iletkenliği bilinen diğer tüm maddelerden daha fazladır; helyum I'in bir milyon katı ve bakırın birkaç yüz katıdır. Bunun nedeni ısı iletiminin istisnai bir kuantum mekanizması ile gerçekleşmesidir. Isıyı iyi ileten çoğu malzeme, ısıyı transfer etmeye yarayan serbest elektronlardan oluşan bir valans bandına sahiptir. Helyum II'de böyle bir valans bandı yoktur ama yine de ısıyı iyi iletir. Isı akışı, havadaki ses yayılımını karakterize etmek için kullanılan dalga denklemine benzer denklemler tarafından yönetilir. Isı verildiğinde, ikinci ses olarak bilinen bir fenomende dalgalar halinde helyum II boyunca 1,8 K'de saniyede 20 metre hızla hareket eder. ⓘ
Helyum II ayrıca bir sürünme etkisi de sergiler. Bir yüzey helyum II seviyesinin ötesine uzandığında, helyum II yerçekimi kuvvetine karşı yüzey boyunca hareket eder. Helyum II, buharlaşacağı daha sıcak bir bölgeye ulaşana kadar kenarlar boyunca sürünerek sızdırmaz olmayan bir kaptan kaçacaktır. Yüzey malzemesinden bağımsız olarak 30 nm kalınlığında bir film halinde hareket eder. Bu film Rollin filmi olarak adlandırılır ve adını bu özelliği ilk kez karakterize eden Bernard V. Rollin'den alır. Bu sürünme davranışının ve helyum II'nin küçük açıklıklardan hızla sızma yeteneğinin bir sonucu olarak, hapsedilmesi çok zordur. Kap dikkatli bir şekilde inşa edilmediği sürece, helyum II buharlaşacağı daha sıcak bir yere ulaşana kadar yüzeyler boyunca ve valflerden geçerek sürünecektir. Bir Rollin filmi boyunca yayılan dalgalar sığ sudaki yerçekimi dalgalarıyla aynı denklem tarafından yönetilir, ancak yerçekimi yerine, geri yükleme kuvveti van der Waals kuvvetidir. Bu dalgalar üçüncü ses olarak bilinir. ⓘ
İzotoplar
Bilinen dokuz helyum izotopu vardır, ancak sadece helyum-3 ve helyum-4 kararlıdır. Dünya atmosferinde bir atom 3
Her bir milyon için 4
He. Çoğu elementin aksine, helyumun izotopik bolluğu, farklı oluşum süreçleri nedeniyle kökene göre büyük farklılıklar gösterir. En yaygın izotop olan helyum-4, Dünya'da daha ağır radyoaktif elementlerin alfa bozunmasıyla üretilir; ortaya çıkan alfa parçacıkları tamamen iyonize olmuş helyum-4 çekirdekleridir. Helyum-4 alışılmadık derecede kararlı bir çekirdektir çünkü nükleonları tam kabuklar halinde düzenlenmiştir. Ayrıca Büyük Patlama nükleosentezi sırasında muazzam miktarlarda oluşmuştur. ⓘ
Helyum-3 Dünya'da sadece eser miktarda bulunur. Bir kısmı kozmik toz içinde sıkışmış olarak Dünya'ya düşse de, çoğu Dünya'nın oluşumundan beri mevcuttur. Trityumun beta bozunumu ile de eser miktarda üretilir. Yerkabuğundan elde edilen kayaçların izotop oranları on kata kadar değişmektedir ve bu oranlar kayaçların kökenini ve Dünya'nın mantosunun bileşimini araştırmak için kullanılabilir. 3
Nükleer füzyonun bir ürünü olarak yıldızlarda çok daha bol miktarda bulunur. Bu nedenle yıldızlararası ortamda, 3
4'e kadar
Dünya'dakinden yaklaşık 100 kat daha yüksektir. Ay ve asteroit regoliti gibi gezegen dışı materyaller, güneş rüzgarları tarafından bombardıman edildikleri için eser miktarda helyum-3 içerirler. Ay'ın yüzeyi, Dünya atmosferinde bulunan yaklaşık 5 ppt'den çok daha yüksek, 10 ppb mertebesinde konsantrasyonlarda helyum-3 içerir. 1986'da Gerald Kulcinski ile başlayan bir dizi insan Ay'ı keşfetmeyi, Ay regolitini çıkarmayı ve helyum-3'ü füzyon için kullanmayı önermiştir. ⓘ
Sıvı helyum-4, 1 K'lik bir kapta buharlaştırmalı soğutma kullanılarak yaklaşık 1 K'ye (-272,15 °C; -457,87 °F) kadar soğutulabilir. Daha düşük bir kaynama noktasına sahip olan helyum-3'ün benzer şekilde soğutulması, bir helyum-3 buzdolabında yaklaşık 0,2 kelvin elde edebilir. Sıvı 3'ün eşit karışımları
O ve 4
0,8 K'nin altındaki sıcaklıklar, benzemezliklerinden dolayı iki karışmaz faza ayrılır (farklı kuantum istatistiklerini takip ederler: helyum-4 atomları bozon iken helyum-3 atomları fermiyonlardır). Seyreltme buzdolapları birkaç milikelvinlik sıcaklıklara ulaşmak için bu karışmazlığı kullanır. ⓘ
Hızla bozunarak başka maddelere dönüşen egzotik helyum izotopları üretmek mümkündür. En kısa ömürlü ağır helyum izotopu 7,6×10-22 s yarı ömre sahip helyum-5'tir. Helyum-6 bir beta parçacığı yayarak bozunur ve 0,8 saniye yarı ömre sahiptir. Helyum-7 de bir beta parçacığının yanı sıra bir gama ışını yayar. Helyum-7 ve helyum-8 belirli nükleer reaksiyonlarda oluşur. Helyum-6 ve helyum-8'in bir nükleer halo sergilediği bilinmektedir. ⓘ
Bileşikler


Helyum sıfır değerliğe sahiptir ve tüm normal koşullar altında kimyasal olarak reaktif değildir. İyonize olmadığı sürece bir elektrik yalıtkanıdır. Diğer soy gazlarda olduğu gibi, helyum da iyonlaşma potansiyelinin altında bir gerilime sahip bir elektrik deşarjında iyonize kalmasına izin veren metastabil enerji seviyelerine sahiptir. Helyum, bir kızdırma deşarjına, elektron bombardımanına maruz kaldığında veya başka yollarla plazmaya indirgendiğinde tungsten, iyot, flor, kükürt ve fosfor ile eksimerler olarak bilinen kararsız bileşikler oluşturabilir. Moleküler bileşikler HeNe, HgHe10 ve WHe2 ve moleküler iyonlar He+
2, He2+
2, HeH+
ve HeD+
bu şekilde yaratılmıştır. HeH+ da temel durumunda kararlıdır, ancak son derece reaktiftir - bilinen en güçlü Brønsted asididir ve bu nedenle temas ettiği herhangi bir molekülü veya karşı iyonu protonlayacağı için yalnızca izole olarak var olabilir. Bu teknik aynı zamanda çok sayıda bant sistemine sahip nötr molekül He2'yi ve görünüşe göre sadece polarizasyon kuvvetleriyle bir arada tutulan HgHe'yi de üretmiştir. ⓘ
Van der Waals helyum bileşikleri, kriyojenik helyum gazı ve LiHe ve He2 gibi başka bir maddenin atomlarıyla da oluşturulabilir. ⓘ
Teorik olarak, 2000 yılında keşfedilen HArF'ye benzeyen helyum florohidrit (HHeF) gibi başka gerçek bileşikler de mümkün olabilir. Hesaplamalar, helyum-oksijen bağı içeren iki yeni bileşiğin kararlı olabileceğini göstermektedir. Teori kullanılarak tahmin edilen iki yeni moleküler tür, CsFHeO ve N(CH3)4FHeO, ilk olarak 2005 yılında Tayvan'dan bir grup tarafından teorize edilen metastabil bir FHeO- anyonunun türevleridir. Eğer deneyle doğrulanırsa, bilinen kararlı bileşiği olmayan tek element neon olacaktır. ⓘ
Helyum atomları, yüksek basınç altında ısıtılarak içi boş karbon kafes moleküllerine (fullerenler) yerleştirilmiştir. Oluşan endohedral fulleren molekülleri yüksek sıcaklıklarda kararlıdır. Bu fullerenlerin kimyasal türevleri oluşturulduğunda helyum içeride kalır. Helyum-3 kullanılırsa, helyum nükleer manyetik rezonans spektroskopisi ile kolayca gözlemlenebilir. Helyum-3 içeren birçok fulleren rapor edilmiştir. Helyum atomları kovalent veya iyonik bağlarla bağlanmamış olsa da, bu maddeler tüm stokiyometrik kimyasal bileşikler gibi farklı özelliklere ve belirli bir bileşime sahiptir. ⓘ
Yüksek basınç altında helyum çeşitli diğer elementlerle bileşikler oluşturabilir. Helyum-azot klatrat (He(N2)11) kristalleri oda sıcaklığında, elmas örs hücresinde yaklaşık 10 GPa basınçta büyütülmüştür. Yalıtkan elektrid Na2He'nin 113 GPa'nın üzerindeki basınçlarda termodinamik olarak kararlı olduğu gösterilmiştir. Florit bir yapıya sahiptir. ⓘ
Oluşumu ve üretimi
Doğal bolluk
Dünya'da nadir bulunmasına rağmen, helyum bilinen Evren'de en bol bulunan ikinci elementtir ve baryonik kütlesinin %23'ünü oluşturur. Sadece hidrojen daha bol miktarda bulunur. Helyumun büyük çoğunluğu Büyük Patlama'dan bir ila üç dakika sonra Büyük Patlama nükleosentezi ile oluşmuştur. Bu nedenle, bolluk ölçümleri kozmolojik modellere katkıda bulunur. Yıldızlarda, proton-proton zincir reaksiyonlarında hidrojenin nükleer füzyonu ve yıldız nükleosentezinin bir parçası olan CNO döngüsü ile oluşur. ⓘ
Dünya atmosferinde helyum konsantrasyonu hacim olarak milyonda sadece 5,2 parçadır. Sürekli yeni helyum üretimine rağmen konsantrasyon düşüktür ve oldukça sabittir çünkü Dünya atmosferindeki helyumun çoğu çeşitli süreçlerle uzaya kaçar. Üst atmosferin bir parçası olan Dünya'nın heterosferinde helyum ve diğer hafif gazlar en bol bulunan elementlerdir. ⓘ
Dünya'daki helyumun çoğu radyoaktif bozunmanın bir sonucudur. Helyum, uraninit ve çeşitleri cleveite ve pitchblende, karnotit ve monazit (bir grup adı; "monazit" genellikle monazit-(Ce) anlamına gelir) dahil olmak üzere uranyum ve toryum minerallerinde büyük miktarlarda bulunur, çünkü parçacık kaya tarafından durdurulur durdurulmaz elektronların hemen birleştiği alfa parçacıkları (helyum çekirdekleri, He2+) yayarlar. Bu şekilde litosfer boyunca yılda tahmini 3000 metrik ton helyum üretilmektedir. Yerkabuğundaki helyum konsantrasyonu milyarda 8 parçadır. Deniz suyundaki konsantrasyon ise trilyonda sadece 4 parçadır. Mineral kaynaklarında, volkanik gazda ve meteorik demirde de az miktarda bulunur. Helyum, doğal gazı da hapseden koşullar altında yeraltında hapsolduğundan, gezegendeki en büyük doğal helyum konsantrasyonları, çoğu ticari helyumun çıkarıldığı doğal gazda bulunur. Bu konsantrasyon, New Mexico, San Juan County'deki küçük bir gaz sahasında birkaç ppm'den %7'nin üzerine kadar geniş bir aralıkta değişmektedir. ⓘ
2021 yılı itibariyle dünyadaki helyum rezervlerinin 31 milyar metreküp olduğu ve bunun üçte birinin Katar'da bulunduğu tahmin edilmektedir. 2015 ve 2016 yıllarında Kuzey Amerika'daki Rocky Dağları'nın altında ve Doğu Afrika Rift'inde ilave muhtemel rezervler olduğu açıklanmıştır. ⓘ
Modern çıkarma ve dağıtım
Büyük ölçekli kullanım için helyum, %7'ye kadar helyum içerebilen doğal gazdan fraksiyonel damıtma yoluyla elde edilir. Helyum diğer elementlerden daha düşük bir kaynama noktasına sahip olduğundan, neredeyse tüm diğer gazları (çoğunlukla nitrojen ve metan) sıvılaştırmak için düşük sıcaklık ve yüksek basınç kullanılır. Elde edilen ham helyum gazı, kalan azot ve diğer gazların neredeyse tamamının gaz karışımından çökeltildiği düşük sıcaklıklara ardışık olarak maruz bırakılarak saflaştırılır. Son saflaştırma adımı olarak aktif kömür kullanılır ve genellikle %99,995 oranında saf Grade-A helyum elde edilir. A sınıfı helyumdaki başlıca safsızlık neondur. Son üretim adımında, üretilen helyumun çoğu kriyojenik bir işlemle sıvılaştırılır. Bu, sıvı helyum gerektiren uygulamalar için gereklidir ve ayrıca en büyük sıvı helyum konteynerleri en büyük gaz helyum tüp römorklarının beş katından daha fazla kapasiteye sahip olduğundan helyum tedarikçilerinin uzun mesafeli nakliye maliyetini azaltmasına olanak tanır. ⓘ
2008 yılında yaklaşık 169 milyon standart metreküp (SCM) helyum doğal gazdan çıkarılmış veya helyum rezervlerinden çekilmiştir; bunun yaklaşık %78'i Amerika Birleşik Devletleri'nden, %10'u Cezayir'den ve geri kalanının çoğu Rusya, Polonya ve Katar'dan elde edilmiştir. 2013 yılına gelindiğinde Katar'da (Air Liquide tarafından yönetilen RasGas şirketi altında) helyum üretimindeki artış, Katar'ın dünya helyum üretimindeki payını %25'e çıkarmış ve ABD'den sonra en büyük ikinci ihracatçı konumuna getirmiştir. 2016'da Tanzanya'da tahmini 54 milyar feet küp (1,5×109 m3) helyum yatağı bulundu. Çin'in Ningxia kentinde 2020 yılında büyük ölçekli bir helyum tesisi açılmıştır. ⓘ
Amerika Birleşik Devletleri'nde helyumun çoğu Hugoton ve Kansas, Oklahoma'daki yakın gaz sahalarından ve Teksas'taki Panhandle Sahası'ndan çıkarılmaktadır. Bu gazın büyük bir kısmı bir zamanlar boru hattıyla Ulusal Helyum Rezervine gönderiliyordu, ancak 2005 yılından bu yana bu rezerv tükenmekte ve satılmaktadır ve Ekim 2013 Sorumlu Helyum İdaresi ve Yönetim Yasası (H.R. 527) kapsamında 2021 yılına kadar büyük ölçüde tükenmesi beklenmektedir. ⓘ
Ham doğal gazın özel yarı geçirgen membranlardan ve diğer bariyerlerden difüzyonu, helyumun geri kazanılması ve saflaştırılması için bir başka yöntemdir. 1996 yılında ABD'nin bu tür gaz kuyusu komplekslerinde yaklaşık 147 milyar standart fit küp (4.2 milyar SCM) kanıtlanmış helyum rezervi vardı. O zamanki kullanım oranlarına göre (ABD'de yılda 72 milyon SCM; aşağıdaki pasta grafiğe bakınız) bu, ABD'nin yaklaşık 58 yıllık kullanımı için yeterli helyum olurdu ve tasarruf ve işleme faktörleri etkili rezerv rakamlarını etkilese de, dünya kullanım oranlarında bundan daha az (belki de zamanın% 80'i) olurdu. ⓘ
Helyum doğal gazdan elde edilmelidir çünkü havada neonunkinin sadece bir kısmı kadar bulunur, ancak ona olan talep çok daha yüksektir. Tüm neon üretiminin helyum tasarrufu sağlayacak şekilde yeniden düzenlenmesi halinde, dünyadaki helyum talebinin %0,1'inin karşılanacağı tahmin edilmektedir. Benzer şekilde, tüm hava damıtma tesislerinin yeniden düzenlenmesi ile dünyadaki helyum talebinin sadece %1'i karşılanabilir. Helyum, lityum veya borun yüksek hızlı protonlarla bombardıman edilmesi veya lityumun döteronlarla bombardıman edilmesi yoluyla sentezlenebilir, ancak bu işlemler tamamen ekonomik olmayan bir üretim yöntemidir. ⓘ
Helyum ticari olarak sıvı ya da gaz formunda mevcuttur. Sıvı olarak, 1.000 litreye kadar helyum alabilen dewar adı verilen küçük yalıtımlı kaplarda veya 42 m3 (yaklaşık 11.000 ABD galonu) kadar nominal kapasiteye sahip büyük ISO kaplarında tedarik edilebilir. Gaz halinde, küçük miktarlarda helyum 8 m3 (yaklaşık 282 standart fit küp) kapasiteli yüksek basınçlı silindirlerde tedarik edilirken, büyük miktarlarda yüksek basınçlı gaz 4.860 m3 (yaklaşık 172.000 standart fit küp) kapasiteye sahip tüp römorklarda tedarik edilmektedir. ⓘ
Koruma savunucuları
Nobel ödüllü fizikçi Robert Coleman Richardson gibi helyum korumacılarına göre, 2010 yılında helyumun serbest piyasa fiyatı "savurgan" kullanıma (örneğin helyum balonları için) katkıda bulunmuştur. 2000'li yıllardaki fiyatlar, ABD Kongresi'nin ülkenin büyük helyum stokunu 2015 yılına kadar satma kararıyla düşürülmüştü. Richardson'a göre, aşırı helyum israfını ortadan kaldırmak için fiyatın 20 ile çarpılması gerekiyordu. Nuttall, Clarke & Glowacki (2012), Doğal Kaynak Olarak Helyumun Geleceği (Routledge, 2012) adlı kitaplarında, bu değerli emtia için sürdürülebilir bir pazar oluşturmak amacıyla bir Uluslararası Helyum Ajansı (IHA) kurulmasını da önermişlerdir. ⓘ
Uygulamalar

Kategorilere göre tahmini 2014 ABD fraksiyonel helyum kullanımı. Toplam kullanım 34 milyon metreküptür.
Balonlar belki de helyumun en iyi bilinen kullanımı olsa da, tüm helyum kullanımının küçük bir parçasıdır. Helyum, düşük kaynama noktası, düşük yoğunluk, düşük çözünürlük, yüksek termal iletkenlik veya inertlik gibi benzersiz özelliklerinden bazılarını gerektiren birçok amaç için kullanılır. Yılda yaklaşık 32 milyon kg (180 milyon standart metreküp) olan 2014 dünya helyum üretiminin en büyük kullanımı (2014'teki toplamın yaklaşık %32'si), çoğu tıbbi MRI tarayıcıları ve NMR spektrometrelerindeki süper iletken mıknatısların soğutulmasını içeren kriyojenik uygulamalardır. Diğer önemli kullanım alanları basınçlandırma ve temizleme sistemleri, kaynak, kontrollü atmosferlerin bakımı ve sızıntı tespitidir. Kategoriye göre diğer kullanımlar nispeten küçük kesirlerdi. ⓘ
Kontrollü atmosferler
Helyum, inert olduğu için silikon ve germanyum kristallerinin büyütülmesinde, titanyum ve zirkonyum üretiminde ve gaz kromatografisinde koruyucu gaz olarak kullanılır. Eylemsizliği, termal ve kalorik olarak mükemmel doğası, yüksek ses hızı ve ısı kapasitesi oranının yüksek değeri nedeniyle, süpersonik rüzgar tünellerinde ve impuls tesislerinde de yararlıdır. ⓘ
Gaz tungsten ark kaynağı
Helyum, kaynak sıcaklıklarında hava veya nitrojen tarafından kirletilen ve zayıflatılan malzemeler üzerinde ark kaynağı işlemlerinde koruyucu gaz olarak kullanılır. Gaz tungsten ark kaynağında bir dizi inert koruyucu gaz kullanılır, ancak özellikle alüminyum veya bakır gibi daha yüksek ısı iletkenliğine sahip malzemelerin kaynağında daha ucuz olan argon yerine helyum kullanılır. ⓘ
Minör kullanımlar
Endüstriyel sızıntı tespiti

Helyum için bir endüstriyel uygulama da sızıntı tespitidir. Helyum katı maddelerde havadan üç kat daha hızlı yayıldığından, yüksek vakumlu ekipmanlarda (kriyojenik tanklar gibi) ve yüksek basınçlı kaplarda sızıntıları tespit etmek için izleyici gaz olarak kullanılır. Test edilen nesne, daha sonra boşaltılan ve helyumla doldurulan bir odaya yerleştirilir. Sızıntılardan kaçan helyum, 10-9 mbar-L/s (10-10 Pa-m3/s) kadar küçük sızıntı oranlarında bile hassas bir cihaz (helyum kütle spektrometresi) tarafından tespit edilir. Ölçüm prosedürü normalde otomatiktir ve helyum integral testi olarak adlandırılır. Daha basit bir prosedür, test edilen nesneyi helyumla doldurmak ve elle tutulan bir cihazla sızıntıları manuel olarak aramaktır. ⓘ
Çatlaklardan helyum sızıntıları, dökme bir malzemeden gaz geçirgenliği ile karıştırılmamalıdır. Helyumun camlar, seramikler ve sentetik malzemeler boyunca belgelenmiş geçirgenlik sabitleri (dolayısıyla hesaplanabilir bir geçirgenlik oranı) olsa da, helyum gibi inert gazlar çoğu dökme metale nüfuz etmeyecektir. ⓘ
Uçuş

Havadan daha hafif olduğu için hava gemileri ve balonlar kaldırma kuvveti için helyumla şişirilir. Hidrojen gazı daha kaldırma kuvvetine sahipken ve bir zardan daha düşük bir oranda sızarken, helyum yanıcı olmama ve hatta yangın geciktirici olma avantajına sahiptir. Bir diğer küçük kullanım alanı ise, helyumun depolama tanklarındaki yakıt ve oksitleyicilerin yerini almak ve roket yakıtı yapmak üzere hidrojen ve oksijeni yoğunlaştırmak için bir dolgu maddesi olarak kullanıldığı roketçiliktir. Ayrıca fırlatmadan önce yer destek ekipmanından yakıt ve oksitleyiciyi temizlemek ve uzay araçlarında sıvı hidrojeni önceden soğutmak için de kullanılır. Örneğin, Apollo programında kullanılan Saturn V roketinin fırlatılması için yaklaşık 370.000 m3 (13 milyon fit küp) helyuma ihtiyaç duyulmuştur. ⓘ
Küçük ticari ve rekreasyonel kullanımlar
Solunum gazı olarak helyumun narkotik özelliği yoktur, bu nedenle trimix, heliox ve heliair gibi helyum karışımları, derinlik arttıkça kötüleşen narkozun etkilerini azaltmak için derin dalışlarda kullanılır. Derinlikle birlikte basınç arttıkça, solunum gazının yoğunluğu da artar ve helyumun düşük moleküler ağırlığının, karışımın yoğunluğunu düşürerek solunum çabasını önemli ölçüde azalttığı bulunmuştur. Bu da akıĢın Reynolds sayısını azaltarak türbülanslı akıĢın azalmasına ve daha az nefes alma iĢi gerektiren laminer akıĢın artmasına neden olur. Helyum-oksijen karışımı soluyan dalgıçlar 150 metrenin (490 ft) altındaki derinliklerde yüksek basınçlı sinir sendromunun belirtileri olan titreme ve psikomotor fonksiyonlarda azalma yaşamaya başlarlar. Bu etki, helyum-oksijen karışımına bir miktar hidrojen veya nitrojen gibi narkotik gaz eklenerek bir dereceye kadar önlenebilir. ⓘ
Kırmızı bir ışın üreten düşük güçlü bir gaz lazer türü olan helyum-neon lazerler, neredeyse evrensel olarak daha ucuz diyot lazerlerle değiştirilmeden önce barkod okuyucuları ve lazer işaretleyicileri içeren çeşitli pratik uygulamalara sahipti. ⓘ
Eylemsizliği ve yüksek termal iletkenliği, nötron şeffaflığı ve reaktör koşulları altında radyoaktif izotoplar oluşturmaması nedeniyle helyum, bazı gaz soğutmalı nükleer reaktörlerde ısı aktarım ortamı olarak kullanılır. ⓘ
Ksenon gibi daha ağır bir gazla karıştırılan helyum, ortaya çıkan yüksek ısı kapasitesi oranı ve düşük Prandtl sayısı nedeniyle termoakustik soğutma için kullanışlıdır. Helyumun durağanlığı, ozon tabakasının incelmesine veya küresel ısınmaya katkıda bulunan geleneksel soğutma sistemlerine göre çevresel avantajlara sahiptir. ⓘ
Helyum bazı sabit disk sürücülerinde de kullanılmaktadır. ⓘ
Bilimsel kullanımlar
Helyum kullanımı, son derece düşük kırılma indeksi nedeniyle bazı teleskoplarda mercekler arasındaki boşluktaki sıcaklık değişimlerinin bozucu etkilerini azaltır. Bu yöntem özellikle vakum geçirmez bir teleskop tüpünün çok ağır olacağı güneş teleskoplarında kullanılır. ⓘ
Helyum, gaz kromatografisi için yaygın olarak kullanılan bir taşıyıcı gazdır. ⓘ
Uranyum ve toryum içeren kayaçların ve minerallerin yaşı, helyum tarihlemesi olarak bilinen bir işlemle helyum seviyesi ölçülerek tahmin edilebilir. ⓘ
Düşük sıcaklıklardaki helyum kriyojenikte ve bazı kriyojenik uygulamalarda kullanılır. Uygulamalara örnek olarak, sıvı helyum, manyetik rezonans görüntüleme için süper iletken mıknatıslarda olduğu gibi, bazı metalleri süper iletkenlik için gereken aşırı düşük sıcaklıklara soğutmak için kullanılır. CERN'deki Büyük Hadron Çarpıştırıcısı, sıcaklığı 1,9 K'de (-271,25 °C; -456,25 °F) tutmak için 96 metrik ton sıvı helyum kullanmaktadır. ⓘ
Tıbbi kullanımlar
Helyum, Nisan 2020'de Amerika Birleşik Devletleri'nde insanlar ve hayvanlar için tıbbi kullanım için onaylanmıştır. ⓘ
Bir kirletici olarak
Kimyasal olarak inert olsa da helyum kontaminasyonu mikroelektromekanik sistemlerin (MEMS) çalışmasını bozar, öyle ki iPhone'lar arızalanabilir. ⓘ
Soluma ve güvenlik
Etkileri
Standart koşullarda nötr helyum toksik değildir, biyolojik bir rol oynamaz ve insan kanında eser miktarda bulunur. ⓘ
Helyumdaki ses hızı havadaki ses hızının neredeyse üç katıdır. Gaz dolu bir boşluğun doğal rezonans frekansı gazdaki ses hızıyla orantılı olduğundan, helyum solunduğunda, vokal sesin yükselticisi olan ses yolunun rezonans frekanslarında buna karşılık gelen bir artış meydana gelir. Amplifikatörün (ses yolunun) rezonans frekansındaki bu artış, ses kutusunun hava ile dolu olduğu duruma kıyasla, ses kıvrımlarının doğrudan titreşimiyle üretilen ses dalgasının yüksek frekanslı bileşenlerine daha fazla amplifikasyon sağlar. Bir kişi helyum gazı soluduktan sonra konuştuğunda, ses kutusunu kontrol eden kaslar hala ses kutusu hava ile doluyken olduğu gibi hareket eder, bu nedenle ses kıvrımlarının doğrudan titreşimi ile üretilen temel frekans (bazen perde olarak da adlandırılır) değişmez. Bununla birlikte, yüksek frekans tercihli amplifikasyon, güçlendirilmiş sesin tınısında bir değişikliğe neden olur ve bu da sazlık, ördek benzeri bir vokal kalitesiyle sonuçlanır. Bunun tersi bir etki olan rezonans frekanslarının düşürülmesi, sülfür heksaflorid veya ksenon gibi yoğun bir gazın solunmasıyla elde edilebilir. ⓘ
Benzer şekilde yine, inert ve zehirsiz olan SF6 gazını solumanız durumunda ise, bu kez bu gazın havadan yaklaşık altı kat daha yoğun olması ve bu nedenle sesin SF6 içinde havadakinden çok daha yavaş ilerlemesinden dolayı, bu kez insan sesi kalın çıkmaktadır. ⓘ
Tehlikeler
Helyum solumak aşırıya kaçıldığında tehlikeli olabilir çünkü helyum basit bir boğucu maddedir ve normal solunum için gereken oksijenin yerini alır. Aralarında 2003 yılında Vancouver'da boğulan bir genç ve 2006 yılında Güney Florida'da boğulan iki yetişkinin de bulunduğu ölümler kaydedilmiştir. 1998 yılında Victoria'da yaşayan Avustralyalı bir kız, bir parti balonunun tüm içeriğini soluduktan sonra bilincini yitirmiş ve geçici olarak maviye dönmüştür. Helyumun doğrudan basınçlı tüplerden ve hatta balon doldurma valflerinden solunması son derece tehlikelidir, çünkü yüksek akış hızı ve basınç barotravmaya neden olarak akciğer dokusunu ölümcül şekilde parçalayabilir. ⓘ
Helyumdan kaynaklanan ölüm nadirdir. Medyaya yansıyan ilk vaka, 1998 yılında bir arkadaşının partisinde helyum solumaktan ölen Teksaslı 15 yaşındaki bir kız çocuğudur; helyumdan ölümün tam türü tespit edilememiştir. ⓘ
Amerika Birleşik Devletleri'nde 2000 ve 2004 yılları arasında sadece iki ölüm vakası rapor edilmiştir; bunlardan biri 2002 yılında Kuzey Carolina'da barotravma nedeniyle ölen bir adamdır. Vancouver'da 2003 yılında bir genç boğulmuştur ve Avustralya'da 27 yaşında bir erkek 2000 yılında bir tüpten nefes aldıktan sonra emboli geçirmiştir. O zamandan bu yana 2006 yılında Güney Florida'da iki yetişkin boğulmuştur. 2009 ve 2010 yıllarında da biri Kaliforniyalı bir genç kafasında helyum tankına bağlı bir torba ile bulunmuş, diğeri de Kuzey İrlanda'da bir başka genç boğulma sonucu ölmüştür. Eagle Point, Oregon'da bir genç kız 2012 yılında bir partide barotravma nedeniyle ölmüştür. Michigan'dan bir kız da aynı yıl içinde hipoksiden ölmüştür. ⓘ
4 Şubat 2015'te, Japon kız şarkı grubu 3B Junior'ın 12 yaşındaki bir üyesinin (ismi saklı tutulmuştur) 28 Ocak'taki ana TV şovlarının kaydı sırasında, bir oyunun parçası olarak büyük miktarlarda helyum soluduktan sonra hava kabarcıklarının beyne kan akışını engellemesi sonucu hava embolisi geçirdiği, bilincini kaybettiği ve komaya girdiği ortaya çıkmıştır. Olay bir hafta sonrasına kadar kamuoyuna açıklanmadı. TV Asahi çalışanları acil bir basın toplantısı düzenleyerek üyenin hastaneye kaldırıldığını ve göz ve uzuvlarını hareket ettirme gibi rehabilitasyon belirtileri gösterdiğini ancak bilincinin henüz yeterince yerine gelmediğini duyurdu. Polis, güvenlik önlemlerinin ihmal edilmesi nedeniyle soruşturma başlattı. ⓘ
Kriyojenik helyumun güvenlik sorunları sıvı nitrojeninkine benzer; aşırı düşük sıcaklıkları soğuk yanıklarına neden olabilir ve sıvı-gaz genleşme oranı, basınç düşürme cihazları takılmadığı takdirde patlamalara neden olabilir. 5-10 K'deki helyum gazı kapları, 10 K'den düşük helyum gazı oda sıcaklığına ısıtıldığında meydana gelen hızlı ve önemli termal genleşme nedeniyle sıvı helyum içeriyormuş gibi kullanılmalıdır. ⓘ
Yüksek basınçlarda (yaklaşık 20 atm veya iki MPa'dan fazla), helyum ve oksijen karışımı (heliox), bir tür ters anestezik etki olan yüksek basınç sinir sendromuna yol açabilir; karışıma az miktarda nitrojen eklemek sorunu hafifletebilir. ⓘ
Hakkında
Hidrojenden sonra en hafif gazdır. Renksiz, kokusuz olmakla beraber soy gaz olduğu için tepkimeye girmez ve bu yüzden eylemsizdir. Uçan balonların bazıları yanabildiği için helyumun yanıcı olduğu sanılır ancak bunun sebebi, maliyeti azaltmak için balonun içine hidrojen de eklenmesinden dolayıdır. Soy gazların son yörüngelerindeki elektron sayısı o yörüngenin maksimum elektron bulundurma kapasitesi kadardır, yani o yörünge ne kadar elektron alabiliyorsa o kadar olur. Helyum'un atom numarası ikidir (2), her elementte de olduğu gibi, helyumda da ilk elektron yörüngesinin maksimum alabildiği elektron ikidir. Bu doğrultuda helyum, soy gazlar kuralına uyan bir gazdır. Bağıl atom kütlesi ise 4,0026'tır. Oda sıcaklığında gazdır ve gaz dışında başka hallerde görmek doğal koşullarda imkânsızdır; çünkü erime noktası -272,05 °C ve kaynama noktası -268,785 °C'dir. Ancak laboratuvar koşullarında sağlanabilen sıcaklıklarda katı ve sıvı halinde görebilir. Bu sıcaklıklar mutlak sıfır'a çok yakın olduklarından dolayı laboratuvar koşullarında sağlamak bile çok zordur. Yoğunluğu ise 0,1785 g/l'dir, yani havadan daha hafiftir, bu yüzden de sıcak hava balonlarında ve zeplinlerde kullanılmaktadır. Hidrojen daha hafiftir, ancak hidrojen yanıcı bir madde olduğu için artık pek kullanılmamakta ve yerini Helyum'a bırakmaktadır. Atom çapı 49 pm'dir. Elektronegatifliği yoktur ve elektron dizilimi 1s (kare)'dir. Yükseltgenme basamağı sayısı sıfırdır. (Her 20.000 küçük helyum balonu bir insanın ağırlığını 6 kg azaltır.) Kararlı bir element olduğundan diğer elementlerle bileşik yapmaz ve oksijen ile tepkimeye giremez. Bu yüzden yanma tepkimesinde hiçbir zaman Helyum yer alamaz. ⓘ
Kullanım alanları
Helyum atmosferde çok az miktarda bulunmaktadır. Helyum, sıvı havanın fraksiyonlu destilasyonundan elde edilir. ⓘ
Havadan hafif olması uçan balonlarda kullanılabilmesini sağlar. Hidrojen gibi yanıcı-patlayıcı özelliği olmadığı için de oldukça güvenlidir ama bu güvenlik pahalı olduğu için bu madde pek kullanılmamaktadır. Pahalı olmasının nedeni evrende hidrojenden sonra en çok bulunan element olmasına ve dünya atmosferinde 1/200.000 oranında bulunmasına rağmen, sıvı havanın ayrımsal damıtılmasıyla elde edilemez. Bunun sebebi, Helyumun atmosferdeki diğer birçok gazın aksine Joul-Thompson katsayısının pozitif olmayışıdır. Bu da onun sıkıştırılmak suretiyle sıvılaştırılmasını engeller ve havadan elde edilmesini imkânsız hale getirir. ⓘ
Helyum inert gaz olması özelliğinden dolayı bazı metallerin inert atmosfer oluşturulmasına kullanılır. Ayrıca dalgıç tüpleri %80 He ve %20 O2'den oluşur. Sıvı hava yerine helyumla karıştırılmış oksijen kullanılmasının sebebi vurgun diye tabir edilen olayı önlemektir. Helyumun buradaki fonksiyonu, yukarıda bahsi geçen Joule-Thompson katsayısının negatif olması nedeniyle yüksek basınçta sıvılaşmayıp, dalgıçlar yukarı doğru çıkarırken yüksek basınçtan düşük basınca hızlı geçişte oluşan çözünürlük farkından dolayı kanda baloncuklar oluşturup felce neden olmamasıdır. Helyum ayrıca sıvı roket yakıtlarının basınç altında tutulmasında kullanılır. Sıvı helyum soğutma amaçlı da kullanılmaktadır (NMR cihazlarında). ⓘ
