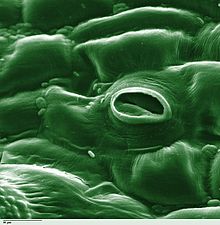
Stoma


Botanikte stoma (Yunanca στόμα, "ağız", çoğulu "stomata"), aynı zamanda stomat (çoğulu "stomates") olarak da adlandırılır, yaprakların, gövdelerin ve diğer organların epidermisinde bulunan ve gaz değişim oranını kontrol eden bir gözenektir. Gözenek, stoma açıklığının boyutunu düzenlemekten sorumlu olan ve koruyucu hücreler olarak bilinen bir çift özelleşmiş parankima hücresi ile sınırlandırılmıştır. ⓘ
Bu terim genellikle eşleştirilmiş bekçi hücreleri ve stoma açıklığı olarak adlandırılan gözeneğin kendisinden oluşan tüm stoma kompleksini ifade etmek için toplu olarak kullanılır. Solunumda kullanılan oksijen ve fotosentezde kullanılan karbondioksit içeren hava, gaz difüzyonu yoluyla stomalardan geçer. Su buharı, transpirasyon adı verilen bir süreçle stomalardan atmosfere yayılır. ⓘ
Stomalar, ciğerotları hariç tüm kara bitkisi gruplarının sporofit neslinde bulunur. Damarlı bitkilerde stomaların sayısı, boyutu ve dağılımı büyük farklılıklar gösterir. Dikotiledonlarda genellikle yaprakların alt yüzeyinde üst yüzeyden daha fazla stoma bulunur. Soğan, yulaf ve mısır gibi tek çenekli bitkiler her iki yaprak yüzeyinde de yaklaşık aynı sayıda stomaya sahip olabilir. Yüzen yapraklı bitkilerde stomalar sadece üst epidermiste bulunabilir ve batık yapraklarda stoma tamamen olmayabilir. Çoğu ağaç türünün sadece alt yaprak yüzeyinde stoma bulunur. Hem üst hem de alt yaprak yüzeyinde stoma bulunan yapraklara amfistomatöz yapraklar; sadece alt yüzeyinde stoma bulunan yapraklara hipostomatöz yapraklar ve sadece üst yüzeyinde stoma bulunan yapraklara epistomatöz veya hiperstomatöz yapraklar denir. Boyutlar türlere göre değişir; uçtan uca uzunlukları 10 ila 80 µm ve genişlikleri birkaç ila 50 µm arasında değişir. ⓘ
Stoma, açılıp kapanma özellikleri ile bitkideki terlemeyi ve gaz değişimini kontrol eden canlı yapılardır. Terimin tekili stoma, epidermislerinde karşılıklı olarak bulunur. ⓘ
Stomalar, epidermisin farklılaşması ile oluşur. Anatomik olarak iç yüzeyindeki zar kalın, dış yüzeyindeki zar ise incedir. Bu incelik kalınlık, stomalara açılıp kapanma özelliği kazandırmıştır ⓘ
İşlev

CO2 kazanımı ve su kaybı
Fotosentezde önemli bir reaktan olan karbondioksit atmosferde yaklaşık 400 ppm konsantrasyonda bulunur. Çoğu bitki stomalarının gündüzleri açık olmasını gerektirir. Yapraktaki hava boşlukları su buharı ile doyurulur ve bu su buharı transpirasyon olarak bilinen bir süreçle stomalar aracılığıyla yapraktan dışarı çıkar. Bu nedenle, bitkiler aynı anda su buharı kaybetmeden karbondioksit kazanamazlar. ⓘ
Alternatif yaklaşımlar
Normalde karbondioksit, yaprağın içindeki hava boşluklarına doğrudan maruz kalan mezofil hücrelerinde RuBisCO enzimi tarafından ribuloz 1,5-bisfosfata (RuBP) sabitlenir. Bu, iki nedenden dolayı terleme sorununu daha da kötüleştirir: birincisi, RuBisCo'nun karbondioksit için nispeten düşük bir afinitesi vardır ve ikincisi, oksijeni RuBP'ye sabitleyerek fotorespirasyon adı verilen bir süreçte enerji ve karbonu boşa harcar. Bu iki nedenden ötürü, RuBisCo yüksek karbondioksit konsantrasyonlarına ihtiyaç duyar, bu da geniş stoma açıklıkları ve sonuç olarak yüksek su kaybı anlamına gelir. ⓘ
Daha dar stoma açıklıkları, yüksek karbondioksit afinitesine sahip bir ara molekül olan fosfoenolpiruvat karboksilaz (PEPcase) ile birlikte kullanılabilir. Ancak karbon sabitleme ürünlerinin PEPCase'den geri alınması enerji yoğun bir süreçtir. Sonuç olarak, PEPCase alternatifi yalnızca suyun sınırlayıcı olduğu ancak ışığın bol olduğu yerlerde veya yüksek sıcaklıkların oksijenin çözünürlüğünü karbondioksite göre artırarak RuBisCo'nun oksijenasyon sorununu büyüttüğü yerlerde tercih edilebilir. ⓘ
CAM bitkileri

"CAM" bitkileri (Crassulacean asit metabolizması, CAM sürecinin ilk keşfedildiği türleri içeren Crassulaceae familyasından sonra) olarak adlandırılan çoğunlukla çöl bitkilerinden oluşan bir grup, stomalarını geceleri açar (belirli bir stoma açıklığı derecesi için su yapraklardan daha yavaş buharlaştığında), karbondioksiti sabitlemek için PEPkarboksilaz kullanır ve ürünleri büyük vakuollerde depolar. Ertesi gün, stomalarını kapatırlar ve önceki gece sabitlenen karbondioksiti RuBisCO varlığında serbest bırakırlar. Bu, RuBisCO'yu karbondioksit ile doyurarak minimum fotorespirasyona izin verir. Ancak bu yaklaşım, sabit karbonu vakuollerde depolama kapasitesi ile ciddi şekilde sınırlıdır, bu nedenle yalnızca suyun ciddi şekilde sınırlı olduğu durumlarda tercih edilir. ⓘ
Açılma ve kapanma

Bununla birlikte, çoğu bitkide CAM yoktur ve bu nedenle ışık yoğunluğu, nem ve karbondioksit konsantrasyonu gibi değişen koşullara yanıt olarak stomalarını gündüz açıp kapatmaları gerekir. Koşullar stoma açılmasına elverişli olduğunda (örneğin, yüksek ışık yoğunluğu ve yüksek nem), bir proton pompası koruma hücrelerinden protonları (H+) yönlendirir. Bu, hücrelerin elektrik potansiyelinin giderek negatif hale geldiği anlamına gelir. Negatif potansiyel potasyum voltaj kapılı kanalları açar ve böylece potasyum iyonlarının (K+) alımı gerçekleşir. Potasyum iyonlarının girişinin durmaması için bu iç negatif voltajı korumak amacıyla negatif iyonlar potasyum akışını dengeler. Bazı durumlarda klorür iyonları girerken, diğer bitkilerde bekçi hücrelerinde organik iyon malat üretilir. Çözünen madde konsantrasyonundaki bu artış hücre içindeki su potansiyelini düşürür, bu da suyun ozmoz yoluyla hücre içine difüzyonuna neden olur. Bu da hücrenin hacmini ve turgor basıncını artırır. Daha sonra, bekçi hücrelerinin genişliğinin şişmesini önleyen ve böylece sadece ekstra turgor basıncının, uçları çevreleyen epidermal hücreler tarafından sıkıca yerinde tutulan bekçi hücrelerini uzatmasına izin veren selüloz mikrofibril halkaları nedeniyle, iki bekçi hücresi birbirinden ayrılarak uzar ve gazın difüze olabileceği açık bir gözenek oluşturur. ⓘ
Kökler toprakta su sıkıntısı hissetmeye başladığında absisik asit (ABA) salgılanır. ABA, bekçi hücrelerinin plazma membranı ve sitozolündeki reseptör proteinlerine bağlanır, bu da önce hücrelerin sitozolünün pH'ını yükseltir ve hücre dışından gelen akış ve endoplazmik retikulum ve vakuoller gibi iç depolardan Ca2+ salınımı nedeniyle sitozolde serbest Ca2+ konsantrasyonunun artmasına neden olur. Bu da klorür (Cl-) ve organik iyonların hücre dışına çıkmasına neden olur. İkinci olarak, bu durum hücrelere daha fazla K+ alınmasını ve ardından K+ kaybını durdurur. Bu çözünen maddelerin kaybı su potansiyelinde bir artışa neden olur ve bu da suyun ozmoz yoluyla hücre dışına geri difüzyonuyla sonuçlanır. Bu da hücrenin plazmolize olmasına ve stoma gözeneklerinin kapanmasına neden olur. ⓘ
Bekçi hücreleri, kendilerinden bekçi hücrelerinin türediği diğer epidermal hücrelerden daha fazla kloroplasta sahiptir. İşlevleri tartışmalıdır. ⓘ
Stoma davranışının gaz değişiminden çıkarılması
Stoma direncinin derecesi, bir yaprağın yaprak gaz değişimi ölçülerek belirlenebilir. Terleme oranı, stoma gözenekleri tarafından sağlanan difüzyon direncine ve ayrıca yaprağın iç hava boşlukları ile dış hava arasındaki nem gradyanına bağlıdır. Stoma direnci (veya tersi olan stoma iletkenliği) bu nedenle terleme oranı ve nem gradyanından hesaplanabilir. Bu, bilim insanlarının stomaların ışık yoğunluğu ve su buharı, karbondioksit ve ozon gibi gazların konsantrasyonları gibi çevresel koşullardaki değişikliklere nasıl tepki verdiğini araştırmasına olanak tanır. Buharlaşma (E) şu şekilde hesaplanabilir; ⓘ
Burada ei ve ea sırasıyla yapraktaki ve ortam havasındaki suyun kısmi basınçları, P atmosferik basınç ve r stoma direncidir. r'nin tersi su buharına karşı iletkenliktir (g), bu nedenle denklem şu şekilde yeniden düzenlenebilir; ⓘ
olarak yeniden düzenlenebilir ve g için çözülebilir; ⓘ
Fotosentetik CO2 asimilasyonu (A) şu şekilde hesaplanabilir ⓘ
Burada Ca ve Ci sırasıyla CO2'nin atmosferik ve stoma altı kısmi basınçlarıdır. Bir yapraktan buharlaşma oranı bir fotosentez sistemi kullanılarak belirlenebilir. Bu bilimsel aletler yapraktan çıkan su buharı miktarını ve ortam havasının buhar basıncını ölçer. Fotosentez sistemleri su kullanım verimliliğini (A/E), g, içsel su kullanım verimliliğini (A/g) ve Ci'yi hesaplayabilir. Bu bilimsel araçlar, bitki fizyologları tarafından CO2 alımını ölçmek ve böylece fotosentetik hızı ölçmek için yaygın olarak kullanılır. ⓘ
Evrim
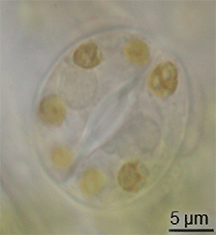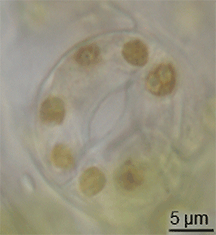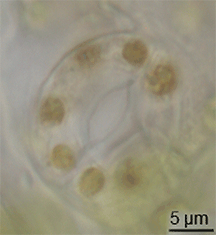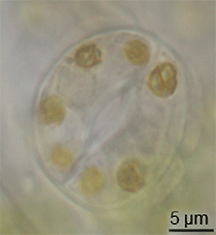
Fosil kayıtlarında stomaların evrimine dair çok az kanıt vardır, ancak Silüryen döneminin ortalarında kara bitkilerinde ortaya çıkmışlardır. Bitkilerin alg benzeri atalarından gelen kavramakaçlarının modifikasyonu ile evrimleşmiş olabilirler. Bununla birlikte, stomaların evrimi mumsu kütikulanın evrimleşmesiyle aynı zamanda gerçekleşmiş olmalıdır - bu iki özellik birlikte erken kara bitkileri için büyük bir avantaj oluşturmuştur. ⓘ
Gelişim
Sürgün apikal meristeminin en dış (L1) doku katmanından türeyen ve protodermal hücreler olarak adlandırılan üç ana epidermal hücre tipi vardır: trikomlar, kaldırım hücreleri ve bekçi hücreleri, bunların hepsi rastgele olmayan bir şekilde düzenlenmiştir. ⓘ
Protodermal hücrelerde asimetrik bir hücre bölünmesi meydana gelir ve bunun sonucunda kaldırım hücresi olmaya aday büyük bir hücre ve sonunda bir stomayı çevreleyen bekçi hücrelerine farklılaşacak meristemoid adı verilen daha küçük bir hücre oluşur. Bu meristemoid daha sonra bir bekçi ana hücresine farklılaşmadan önce bir ila üç kez asimetrik olarak bölünür. Bekçi ana hücresi daha sonra bir çift bekçi hücresi oluşturan bir simetrik bölünme yapar. Bazı hücrelerde hücre bölünmesi engellenir, böylece stomalar arasında her zaman en az bir hücre bulunur. ⓘ
Stomatal desenlenme EPF (Epidermal Desenleme Faktörü), ERL (ERecta Like) ve YODA (varsayılan bir MAP kinaz kinaz) gibi birçok sinyal iletim bileşeninin etkileşimi ile kontrol edilir. Bu faktörleri kodlayan genlerin herhangi birindeki mutasyonlar epidermisteki stomaların gelişimini değiştirebilir. Örneğin, bir gendeki mutasyon daha fazla stomanın bir arada kümelenmesine neden olur ve bu nedenle Çok Fazla Ağız (TMM) olarak adlandırılır. SPCH (SPeecCHless) geninin bozulması ise stoma gelişimini tamamen engeller. Stoma üretiminin aktivasyonu, birlikte YODA'yı aktive eden TMM/ERL'yi aktive eden EPF1'in aktivasyonu ile gerçekleşebilir. YODA, SPCH'yi inhibe ederek SPCH aktivitesinin azalmasına neden olur ve stoma oluşumunu başlatan asimetrik hücre bölünmesine izin verir. Stoma gelişimi aynı zamanda stomagen adı verilen hücresel peptit sinyali ile koordine edilir ve bu sinyal SPCH'nin inhibisyonunu işaret ederek stoma sayısının artmasına neden olur. ⓘ
Çevresel ve hormonal faktörler stoma gelişimini etkileyebilir. Işık, bitkilerde stoma gelişimini artırır; karanlıkta yetişen bitkilerde ise stoma miktarı daha azdır. Oksin, ERL ve TMM reseptörleri gibi reseptör düzeyinde gelişimlerini etkileyerek stoma gelişimini baskılar. Bununla birlikte, düşük bir oksin konsantrasyonu, bir koruyucu ana hücrenin eşit bölünmesine izin verir ve koruyucu hücrelerin üretilme şansını artırır. ⓘ
Çoğu angiosperm ağacının sadece alt yaprak yüzeyinde stoma bulunur. Kavak ve söğütlerin her iki yüzeyinde de stoma bulunur. Yapraklar her iki yaprak yüzeyinde de stoma geliştirdiğinde, alt yüzeydeki stomalar daha büyük ve daha fazla sayıda olma eğilimindedir, ancak türler ve genotipler arasında boyut ve sıklık açısından büyük farklılıklar olabilir. Beyaz dişbudak ve beyaz huş ağacı yaprakları daha az stomaya sahiptir ancak boyutları daha büyüktür. Öte yandan şeker akçaağacı ve gümüş akçaağaçta daha çok sayıda olan küçük stomalar bulunur. ⓘ
Türler
Stoma tiplerinin farklı sınıflandırmaları mevcuttur. Yaygın olarak kullanılan sınıflandırma Julien Joseph Vesque'nin 1889 yılında ortaya koyduğu, Metcalfe ve Chalk tarafından daha da geliştirilen ve daha sonra diğer yazarlar tarafından tamamlanan tiplere dayanmaktadır. İki bekçi hücresini çevreleyen yardımcı hücrelerin boyutu, şekli ve düzenine dayanır. İki çenekliler için ayrım yaparlar:
- Aktinositik (yıldız hücreli anlamına gelir) stomalar, yıldız benzeri bir daire oluşturan en az beş yayılan hücre ile çevrili koruma hücrelerine sahiptir. Bu, örneğin Ebenaceae familyasında bulunabilen nadir bir türdür.
- Anizositik (eşit olmayan hücreli anlamına gelir) stomalar, iki büyük yardımcı hücre ile belirgin bir şekilde daha küçük bir hücre arasında koruma hücrelerine sahiptir. Bu tip stomalar, Brassicaceae, Solanaceae ve Crassulaceae dahil olmak üzere otuzdan fazla dikot familyasında bulunabilir. Bazen turpgiller tipi olarak da adlandırılır.
- Anomositik (düzensiz hücreli anlamına gelir) stomalar, epidermis hücrelerinin geri kalanıyla aynı boyut, şekil ve düzene sahip hücrelerle çevrili koruma hücrelerine sahiptir. Bu tip stomalar Apocynaceae, Boraginaceae, Chenopodiaceae ve Cucurbitaceae gibi yüzden fazla dikot familyasında bulunabilir. Bazen ranunculaceous tipi olarak da adlandırılır.
- Diasitik (çapraz hücreli anlamına gelir) stomalar, her biri açıklığın bir ucunu çevreleyen ve açıklığın ortasının karşısında birbirleriyle temas eden iki yardımcı hücre ile çevrili koruma hücrelerine sahiptir. Bu tip stomalar Caryophyllaceae ve Acanthaceae gibi ondan fazla iki çenekli familyada bulunabilir. Bazen caryophyllaceous tipi olarak da adlandırılır.
- Hemiparasitik stomalar, çevreleyen epidermis hücrelerinden farklı olan ve uzunluğu stoma açıklığına paralel olan tek bir yardımcı hücre ile sınırlandırılmıştır. Bu tip örneğin Molluginaceae ve Aizoaceae'de görülür.
- Parasitik (paralel hücreli anlamına gelir) stomalar, koruyucu hücreler arasındaki açıklığa paralel bir veya daha fazla yardımcı hücreye sahiptir. Bu yardımcı hücreler bekçi hücrelerinin ötesine ulaşabilir ya da ulaşmayabilir. Bu tip stomalar Rubiaceae, Convolvulaceae ve Fabaceae gibi yüzden fazla iki çenekli familyada bulunabilir. Bazen rubiaceous tipi olarak da adlandırılır. ⓘ
Tek çeneklilerde, aşağıdaki gibi birkaç farklı stoma tipi ortaya çıkar:
- gramineous veya graminoid (çim benzeri anlamına gelir) stomalar, iki mercek şeklindeki yardımcı hücre ile çevrili iki koruma hücresine sahiptir. Bekçi hücreleri ortada daha dardır ve her iki uçta da soğancık şeklindedir. Bu orta bölüm güçlü bir şekilde kalınlaşmıştır. Yardımcı hücrelerin ekseni stoma açıklığına paraleldir. Bu tip Poaceae ve Cyperaceae dahil olmak üzere tek çenekli familyalarda bulunabilir.
- Heksasitik (altı hücreli anlamına gelir) stomalarda her iki bekçi hücresinin etrafında, stoma açıklığının her iki ucunda birer tane, her bir bekçi hücresine bitişik birer tane ve son bekçi hücresi ile standart epidermis hücreleri arasında bir tane olmak üzere altı tane yardımcı hücre bulunur. Bu tip bazı monokot ailelerinde bulunabilir.
- Tetrasitik (dört hücreli anlamına gelir) stomalarda, açıklığın her iki ucunda birer tane ve her bir bekçi hücresinin yanında birer tane olmak üzere dört yardımcı hücre bulunur. Bu tip birçok tek çenekli familyada görülür, ancak Tilia ve birkaç Asclepiadaceae gibi bazı iki çeneklilerde de bulunabilir. ⓘ
Eğrelti otlarında dört farklı tip ayırt edilir:
- hipositik stomalar, sadece sıradan epidermis hücreleri ile bir katmanda iki koruma hücresine sahiptir, ancak epidermisin dış yüzeyinde, koruma hücrelerine paralel olarak düzenlenmiş, aralarında stoma açıklığının üzerinde bir gözenek bulunan iki yardımcı hücre bulunur.
- Perisitik stomalar, sürekli bir yardımcı hücre (çörek gibi) tarafından tamamen çevrelenmiş iki bekçi hücresine sahiptir.
- Desmositik stomalar, uçları birleşmemiş bir yardımcı hücre tarafından tamamen çevrelenmiş iki bekçi hücresine sahiptir (sosis gibi).
- polositik stomalar, büyük ölçüde bir yardımcı hücre tarafından çevrelenen, ancak aynı zamanda sıradan epidermis hücreleriyle temas eden (U veya at nalı gibi) iki bekçi hücresine sahiptir. ⓘ
Stoma kriptleri
Stoma kriptleri, yaprak epidermisinin bir veya daha fazla stoma ve bazen trikomlar veya balmumu birikintileri içeren odacık benzeri bir yapı oluşturan çökük alanlarıdır. Stoma kriptleri, stoma kriptleri çok belirgin olduğunda kuraklığa ve kuru iklim koşullarına bir adaptasyon olabilir. Ancak, kuru iklimler bunların bulunabileceği tek yer değildir. Aşağıdaki bitkiler stoma kriptleri veya antekamberi olan türlere örnektir: Nerium oleander, kozalaklı ağaçlar ve bulut ormanlarında bulunan bir bitki türü olan Drimys winteri. ⓘ
Patojenik yollar olarak stomalar
Stomalar, bir süre için varsayıldığı gibi, patojenlerin tartışmasız girebileceği yapraktaki bariz deliklerdir. Ancak yakın zamanda stomaların aslında tüm patojenlerin olmasa da bazılarının varlığını algıladığı gösterilmiştir. Bununla birlikte, deneyde Arabidopsis bitki yapraklarına uygulanan öldürücü bakteriler, stomaları birkaç saat içinde tekrar açılmaya zorlayan kimyasal koronatini serbest bıraktı. ⓘ
Stomalar ve iklim değişikliği
Stomaların çevresel faktörlere tepkisi
Kuraklık stoma açılmasını engeller, ancak orta dereceli kuraklığın soya fasulyesinin stoma kapanması üzerinde önemli bir etkisi olmamıştır. Stoma kapanmasının farklı mekanizmaları vardır. Düşük nem koruma hücrelerini strese sokarak turgor kaybına neden olur ve buna hidropasif kapanma denir. Hidroaktif kapanma, büyük olasılıkla absisik asit tarafından tetiklendiğine inanılan kuraklık stresinden etkilenen tüm yaprak olarak tezat oluşturmaktadır. ⓘ
Fotosentez, bitki su taşınımı (ksilem) ve gaz değişimi, bitkilerin işleyişinde önemli olan stoma fonksiyonu tarafından düzenlenir. ⓘ
Stomalar ışığa karşı duyarlıdır ve mavi ışık stoma tepkisine neden olmada kırmızı ışıktan neredeyse 10 kat daha etkilidir. Araştırmalar bunun sebebinin stomaların mavi ışığa verdiği ışık tepkisinin klorofil gibi diğer yaprak bileşenlerinden bağımsız olması olduğunu öne sürmektedir. Muhafız hücre protoplastları, yeterli potasyum bulunması koşuluyla mavi ışık altında şişer. Birçok çalışma, artan potasyum konsantrasyonlarının sabahları fotosentez süreci başlamadan önce stoma açılmasını artırabileceğini, ancak günün ilerleyen saatlerinde sükrozun stoma açılmasını düzenlemede daha büyük bir rol oynadığını desteklemektedir. ⓘ
Stoma yoğunluğu ve açıklığı (stoma uzunluğu) atmosferik CO2 konsantrasyonu, ışık yoğunluğu, hava sıcaklığı ve fotoperiyot (gündüz süresi) gibi bir dizi çevresel faktör altında değişir. ⓘ
Stoma yoğunluğunun azaltılması, bitkilerin atmosferik CO2 ([CO2]atm) konsantrasyonundaki artışa yanıt vermesinin bir yoludur. CO2]atm tepkisindeki değişiklikler mekanik olarak en az anlaşılan tepki olsa da, bu stoma tepkisi yakında bitkilerdeki transpirasyon ve fotosentez süreçlerini etkilemesi beklenen platoya girmeye başlamıştır. ⓘ
İklim değişikliği sırasında gelecekteki adaptasyonlar
CO2]atm'nin 2100 yılına kadar 500-1000 ppm'e ulaşması beklenmektedir. Geçmiş 400.000 yılın %96'sında 280 ppm CO2 seviyesinin altında yaşanmıştır. Bu rakamdan yola çıkarak, günümüz bitkilerinin genotiplerinin endüstri öncesi akrabalarından farklılaşmış olması kuvvetle muhtemeldir. ⓘ
HIC (yüksek karbondioksit) geni, bitkilerde stomaların gelişimi için negatif bir düzenleyici kodlar. Arabidopsis thaliana kullanılarak HIC geni üzerine yapılan araştırmalar, baskın alelde stoma gelişiminde artış olmadığını, ancak 'vahşi tip' resesif alelde, her ikisi de atmosferdeki artan CO2 seviyelerine yanıt olarak büyük bir artış olduğunu göstermiştir. Bu çalışmalar, bitkilerin değişen CO2 seviyelerine verdiği tepkinin büyük ölçüde genetik tarafından kontrol edildiğini göstermektedir. ⓘ
Tarımsal çıkarımlar
CO2 gübre etkisi, sonuçların atmosferdeki artan CO2 seviyelerinin fotosentezi artırdığını, terlemeyi azalttığını ve su kullanım verimliliğini (WUE) artırdığını gösterdiği Serbest Hava Karbondioksit Zenginleştirme (FACE) deneyleri sırasında büyük ölçüde abartılmıştır. Artan biyokütle, 550 ppm CO2'de mahsul veriminde %5-20 artış öngören deneylerden elde edilen simülasyonlarla ortaya çıkan etkilerden biridir. Yaprak fotosentez oranlarının, iki katına çıkan CO2 seviyeleri altında C3 bitkilerinde %30-50, C4'te ise %10-25 oranında arttığı gösterilmiştir. Bir geri besleme mekanizmasının varlığı, bitki solunumu ve işlevinin evriminde uyarlanabilir bir özellik olabilecek [CO2]atm'ye yanıt olarak fenotipik bir plastisite ile sonuçlanır. ⓘ
Stomaların adaptasyon sırasında nasıl performans gösterdiğini tahmin etmek, hem doğal hem de tarımsal sistemler için bitki sistemlerinin verimliliğini anlamak için yararlıdır. Bitki ıslahçıları ve çiftçiler, gıda güvenliği zorlukları karşısında değişime doğal olarak evrilebilecek ısıya ve kuraklığa dayanıklı mahsul çeşitleri gibi en uygun türleri bulmak için evrimsel ve katılımcı bitki ıslahını kullanarak birlikte çalışmaya başlıyor. ⓘ