Sıcaklık
| Sıcaklık ⓘ | |
|---|---|
 Bir protein alfa sarmal segmentinin termal titreşimi. Genliği sıcaklıkla birlikte artar | |
Ortak semboller | T |
| SI birimi | K |
Diğer birimler | °C, °F, °R, °Rø, °Ré, °N, °D, °L, °W |
| Yoğun mu? | Evet |
Türevleri diğer miktarlar | , |
| Boyut | Θ |
| Termodinamik ⓘ |
|---|
 |
|
Sıcaklık, maddenin ne kadar sıcak olduğunu veya sistemdeki atom veya molekül başına düşen ortalama kinetik enerjinin bir ölçüsü olarak ifade eden fiziksel bir niceliktir. Tüm maddelerde bulunan molar termal enerjinin tespit edilebilir kısmıdır; sıcaklık farkı, enerji daha sıcak bir cisimden daha soğuk bir cisme akarken ısının oluşmasını sağlar. ⓘ
Sıcaklık bir termometre ile ölçülür, tarihsel olarak tanım için çeşitli referans noktaları ve termometrik maddeler kullanan çeşitli sıcaklık ölçeklerinde kalibre edilir. En yaygın ölçekler Celsius ölçeği (eskiden "santigrat" olarak adlandırılırdı, °C olarak gösterilirdi), Fahrenheit ölçeği (°F olarak gösterilirdi) ve Kelvin ölçeğidir (K olarak gösterilirdi), bunlardan sonuncusu Uluslararası Birimler Sistemi (SI) sözleşmeleri tarafından ağırlıklı olarak bilimsel amaçlar için kullanılır. ⓘ
En düşük teorik sıcaklık, bir cisimden daha fazla termal enerjinin elde edilemediği mutlak sıfırdır. Deneysel olarak bu sıcaklığa yalnızca çok yaklaşılabilir (100 pK), ancak termodinamiğin üçüncü yasasında da kabul edildiği üzere bu sıcaklığa ulaşılamaz. ⓘ
Sıcaklık; fizik, kimya, yer bilimi, astronomi, tıp, biyoloji, ekoloji, malzeme bilimi, metalürji, makine mühendisliği ve coğrafya dahil olmak üzere doğa bilimlerinin tüm alanlarında ve günlük yaşamın çoğu alanında önemlidir. ⓘ
Etkileri
Birçok fiziksel süreç sıcaklıkla ilişkilidir, bunlardan bazıları aşağıda verilmiştir:
- faz (katı, sıvı, gaz veya plazma), yoğunluk, çözünürlük, buhar basıncı, elektrik iletkenliği, sertlik, aşınma direnci, termal iletkenlik, korozyon direnci, mukavemet dahil olmak üzere malzemelerin fiziksel özellikleri
- kimyasal reaksiyonların gerçekleşme hızı ve derecesi
- bir nesnenin yüzeyinden yayılan termal radyasyonun miktarı ve özellikleri
- hava sıcaklığı tüm canlı organizmaları etkiler
- mutlak sıcaklığın karekökünün bir fonksiyonu olan ses hızı ⓘ
Terazi

Sıcaklık ölçekleri iki şekilde farklılık gösterir: sıfır derece olarak seçilen nokta ve ölçek üzerindeki artan birimlerin veya derecelerin büyüklükleri. ⓘ
Yaygın olarak kullanılan ölçekler
Celsius ölçeği (°C) dünyanın büyük bölümünde yaygın sıcaklık ölçümleri için kullanılmaktadır. Tarihsel ilerleme ile geliştirilmiş ampirik bir ölçektir ve sıfır noktası 0 °C'nin suyun donma noktası olarak tanımlanmasına ve her ikisi de deniz seviyesindeki atmosferik basınçta 100 °C'nin suyun kaynama noktası olması için ek derecelerin tanımlanmasına yol açmıştır. 100 derecelik aralık nedeniyle santigrat ölçeği olarak adlandırılmıştır. Kelvin'in Uluslararası Birimler Sisteminde standartlaştırılmasından bu yana, daha sonra Kelvin ölçeğindeki eşdeğer sabitleme noktaları açısından yeniden tanımlanmıştır ve böylece bir santigrat derecelik bir sıcaklık artışı, tam olarak 273.15'lik bir ek ofset ile farklılık gösterse de, bir kelvin artışıyla aynıdır. ⓘ
Amerika Birleşik Devletleri'nde yaygın olarak Fahrenheit ölçeği kullanılır; bu ölçekte su deniz seviyesindeki atmosfer basıncında 32 °F'de donar ve 212 °F'de kaynar. ⓘ
Mutlak sıfır
Sıcaklığın mutlak sıfır noktasında, termodinamiğin üçüncü yasasında ifade edilen bir gerçek olarak, maddeden ısı olarak hiçbir enerji çıkarılamaz. Bu sıcaklıkta madde makroskopik termal enerji içermez, ancak belirsizlik ilkesinin öngördüğü gibi kuantum-mekanik sıfır noktası enerjisine sahiptir, ancak bu mutlak sıcaklık tanımına girmez. Deneysel olarak mutlak sıfıra sadece çok yaklaşılabilir; ona asla ulaşılamaz (deneyle ulaşılan en düşük sıcaklık 100 pK'dır). Teorik olarak, mutlak sıfır sıcaklığındaki bir cisimde, parçacıkların tüm klasik hareketleri durmuştur ve bu klasik anlamda tamamen hareketsizdirler. Mutlak sıfır, 0 K olarak tanımlanır ve tam olarak -273,15 °C veya -459,67 °F'ye eşittir. ⓘ
Mutlak ölçekler
Boltzmann sabitine, Maxwell-Boltzmann dağılımına ve entropinin Boltzmann istatistiksel mekanik tanımına atıfta bulunarak, Gibbs tanımından farklı olarak, bağımsız hareket eden mikroskobik parçacıklar için, parçacıklar arası potansiyel enerjiyi göz ardı ederek, uluslararası anlaşma ile bir sıcaklık ölçeği tanımlanmış ve belirli termometrik maddelerin ve termometre mekanizmalarının özelliklerinden bağımsız olduğu için mutlak olduğu söylenmiştir. Mutlak sıfır dışında bir referans sıcaklığı yoktur. Bilim ve teknolojide yaygın olarak kullanılan Kelvin ölçeği olarak bilinir. Kelvin (kelime küçük k harfi ile yazılır) Uluslararası Birimler Sisteminde (SI) sıcaklık birimidir. Kendi termodinamik denge durumundaki bir cismin sıcaklığı, mutlak sıfıra göre her zaman pozitiftir. ⓘ
Uluslararası kabul görmüş Kelvin ölçeğinin yanı sıra, Lord Kelvin tarafından icat edilmiş, sayısal sıfırı mutlak sıcaklık sıfırında olan, ancak makroskopik entropi de dahil olmak üzere tamamen makroskopik termodinamik kavramlarla doğrudan ilişkili, ancak mikroskobik olarak kanonik topluluk için Gibbs istatistiksel mekanik entropi tanımına atıfta bulunan, parçacıklar arası potansiyel enerjiyi ve bağımsız parçacık hareketini hesaba katan ve böylece mutlak sıfıra yakın sıcaklık ölçümlerini hesaba katabilen bir termodinamik sıcaklık ölçeği de vardır. Bu ölçek, suyun üçlü noktasında bir referans sıcaklığına sahiptir ve sayısal değeri yukarıda bahsedilen uluslararası kabul görmüş Kelvin ölçeği kullanılarak yapılan ölçümlerle tanımlanır. ⓘ
Uluslararası Kelvin ölçeği
Birçok bilimsel ölçümde Kelvin sıcaklık ölçeği (birim sembolü: K) kullanılır ve adını ilk tanımlayan fizikçiden alır. Bu mutlak bir ölçektir. Sayısal sıfır noktası olan 0 K, sıcaklığın mutlak sıfır noktasındadır. Mayıs 2019'dan bu yana, dereceleri parçacık kinetik teorisi ve istatistiksel mekanik ile tanımlanmıştır. Uluslararası Birimler Sisteminde (SI) kelvinin büyüklüğü, mikroskobik parçacıkların ortalama kinetik enerjilerinin çeşitli ampirik ölçümleri ile tanımlanır. Sayısal olarak, değeri uluslararası sözleşmelerle sabit olarak tanımlanan Boltzmann sabiti açısından değerlendirilir. ⓘ
İstatistiksel mekanik ve termodinamik sıcaklık ölçekleri
Mayıs 2019'dan bu yana kelvinin büyüklüğü, istatistiksel mekanik açısından karakterize edilen mikroskobik olaylarla ilişkili olarak tanımlanmaktadır. Daha önce, 1954'ten bu yana, Uluslararası Birimler Sistemi, ilk referans noktası mutlak sıfırda 0 K olmak üzere, ikinci bir referans noktası olarak suyun üçlü noktasının güvenilir bir şekilde tekrarlanabilir sıcaklığını kullanarak, termodinamik bir sıcaklık olarak kelvin için bir ölçek ve birim tanımlamıştır. ⓘ
Tarihsel olarak suyun üçlü nokta sıcaklığı, ölçüm artışının tam olarak 273.16 birimi olarak tanımlanmıştır. Günümüzde ise deneysel olarak ölçülen bir niceliktir. Deniz seviyesindeki atmosferik basınçta suyun donma noktası yaklaşık 273,15 K = 0 °C'de gerçekleşir. ⓘ
Ölçeklerin sınıflandırılması
Çeşitli sıcaklık ölçeği türleri vardır. Bunları deneysel ve teorik temelli olarak sınıflandırmak uygun olabilir. Ampirik sıcaklık ölçekleri tarihsel olarak daha eskiyken, teorik temelli ölçekler on dokuzuncu yüzyılın ortalarında ortaya çıkmıştır. ⓘ
Ampirik ölçekler
Ampirik temelli sıcaklık ölçekleri doğrudan malzemelerin basit makroskopik fiziksel özelliklerinin ölçümlerine dayanır. Örneğin, cam duvarlı kılcal bir tüp içine hapsedilmiş bir cıva sütununun uzunluğu büyük ölçüde sıcaklığa bağlıdır ve çok kullanışlı cam içinde cıva termometresinin temelini oluşturur. Bu tür ölçekler yalnızca uygun sıcaklık aralıklarında geçerlidir. Örneğin, cıvanın kaynama noktasının üzerinde, cam içinde cıva termometresi uygulanamaz. Çoğu malzeme sıcaklık artışıyla genleşir, ancak su gibi bazı malzemeler belirli bir aralıkta sıcaklık artışıyla büzülür ve bu durumda termometrik malzeme olarak pek kullanışlı olmazlar. Bir malzeme, örneğin kaynama noktası gibi faz değiĢimi sıcaklıklarından birinin yakınında termometre olarak kullanılamaz. ⓘ
Bu sınırlamalara rağmen, genel olarak kullanılan pratik termometrelerin çoğu ampirik temelli türdendir. Özellikle termodinamiğin keşfine büyük katkı sağlayan kalorimetri için kullanılmıştır. Bununla birlikte, teorik fizik için bir temel olarak değerlendirildiğinde ampirik termometrinin ciddi dezavantajları vardır. Ampirik temelli termometreler, termometrik malzemelerin sıradan fiziksel özelliklerinin basit doğrudan ölçümleri olarak temellerinin ötesinde, teorik fiziksel muhakeme kullanılarak yeniden kalibre edilebilir ve bu onların yeterlilik aralığını genişletebilir. ⓘ
Teorik ölçekler
Teorik temelli sıcaklık ölçekleri doğrudan teorik argümanlara, özellikle de kinetik teori ve termodinamik argümanlarına dayanır. Pratik olarak uygulanabilir fiziksel cihaz ve malzemelerde az çok ideal olarak gerçekleştirilirler. Teorik temelli sıcaklık ölçekleri, pratik deneysel temelli termometrelere kalibrasyon standartları sağlamak için kullanılır. ⓘ
Mikroskobik istatistiksel mekanik ölçek
Fizikte, uluslararası kabul görmüş geleneksel sıcaklık ölçeği Kelvin ölçeği olarak adlandırılır. Sıcaklığı ölçülecek olan cismi oluşturan atomlar, moleküller ve elektronlar gibi mikroskobik parçacıkların hareketlerine atıfta bulunan Boltzmann sabitinin uluslararası kabul görmüş ve öngörülen değeri aracılığıyla kalibre edilir. Kelvin tarafından icat edilen termodinamik sıcaklık ölçeğinin aksine, şu anda geleneksel Kelvin sıcaklığı, standart bir cismin referans durumunun sıcaklığı ile karşılaştırılarak ya da makroskopik termodinamik açısından tanımlanmamaktadır. ⓘ
Sıcaklığın mutlak sıfırının yanı sıra, iç termodinamik denge durumundaki bir cismin Kelvin sıcaklığı, Boltzmann sabiti açısından kesin olarak bilinen teorik açıklamalara sahip fiziksel özelliklerinden uygun şekilde seçilmiş olanların ölçümleriyle tanımlanır. Bu sabit, vücudun yapısındaki mikroskobik parçacıkların seçilmiş hareket türlerini ifade eder. Bu hareket türlerinde, parçacıklar karşılıklı etkileşim olmaksızın bireysel olarak hareket ederler. Bu tür hareketler tipik olarak parçacıklar arası çarpışmalarla kesintiye uğrar, ancak sıcaklık ölçümü için hareketler, çarpışmalar arasında yörüngelerinin etkileşimsiz bölümlerinin doğru ölçüm için erişilebilir olduğu bilinecek şekilde seçilir. Bu amaçla, parçacıklar arası potansiyel enerji göz ardı edilir. ⓘ
İdeal bir gazda ve teorik olarak anlaşılmış diğer cisimlerde Kelvin sıcaklığı, uygun tekniklerle ölçülebilen, etkileşimsiz hareket eden mikroskobik parçacıkların ortalama kinetik enerjisiyle orantılı olarak tanımlanır. Orantı sabiti, Boltzmann sabitinin basit bir katıdır. Eğer moleküller, atomlar veya elektronlar maddeden yayılır ve hızları ölçülürse, hızlarının spektrumu genellikle Maxwell-Boltzmann dağılımı adı verilen teorik bir yasaya neredeyse uyar ve bu da yasanın geçerli olduğu sıcaklıkların iyi temellendirilmiş bir ölçümünü verir. Termometri için doğrudan Fermi-Dirac dağılımını kullanan aynı türden başarılı deneyler henüz yapılmamıştır, ancak belki de gelecekte bu başarılacaktır. ⓘ
Bir gazdaki ses hızı teorik olarak gazın moleküler karakterinden, sıcaklık ve basıncından ve Boltzmann sabitinin değerinden hesaplanabilir. Moleküler karakteri ve basıncı bilinen bir gaz için bu, sıcaklık ve Boltzmann sabiti arasında bir ilişki sağlar. Bu büyüklükler, bir su örneğinin üçlü noktasındaki durumunu tanımlayan termodinamik değişkenlerden daha kesin olarak bilinebilir veya ölçülebilir. Sonuç olarak, Boltzmann sabitinin değeri tam olarak tanımlanmış bir referans olarak alındığında, ses hızının ölçümü gazın sıcaklığının daha kesin bir ölçümünü sağlayabilir. ⓘ
İdeal bir üç boyutlu siyah cisimden gelen elektromanyetik radyasyon spektrumunun ölçümü doğru bir sıcaklık ölçümü sağlayabilir çünkü siyah cisim radyasyonunun maksimum spektral ışıma frekansı siyah cismin sıcaklığı ile doğru orantılıdır; bu Wien'in yer değiştirme yasası olarak bilinir ve Planck yasası ile Bose-Einstein yasasında teorik bir açıklaması vardır. ⓘ
Bir elektrik direnci tarafından üretilen gürültü-güç spektrumunun ölçümü de doğru sıcaklık ölçümü sağlayabilir. Direncin iki terminali vardır ve aslında tek boyutlu bir cisimdir. Bu durum için Bose-Einstein yasası, gürültü gücünün direncin sıcaklığı, direncinin değeri ve gürültü bant genişliği ile doğru orantılı olduğunu gösterir. Belirli bir frekans bandında, gürültü gücü her frekanstan eşit katkıya sahiptir ve Johnson gürültüsü olarak adlandırılır. Direncin değeri biliniyorsa sıcaklık bulunabilir. ⓘ
Makroskopik termodinamik ölçek
Tarihsel olarak, Mayıs 2019'a kadar Kelvin ölçeğinin tanımı, tamamen makroskopik termodinamik açısından, ideal bir Carnot motorundaki süreçlerdeki enerji miktarlarının bir oranına dayanan Kelvin tarafından icat edilen tanımdı. Bu Carnot motoru iki sıcaklık arasında çalışacaktı: sıcaklığı ölçülecek olan cismin sıcaklığı ve bir referans sıcaklık, suyun üçlü noktasının sıcaklığındaki bir cismin sıcaklığı. O zaman referans sıcaklık, yani üçlü noktanın sıcaklığı tam olarak 273,16 K olarak tanımlanmıştı. Mayıs 2019'dan bu yana, bu değer tanım olarak sabitlenmemiştir ancak yukarıda açıklandığı gibi Boltzmann sabitini içeren mikroskobik olaylarla ölçülmektedir. Mikroskobik istatistiksel mekanik tanımın bir referans sıcaklığı yoktur. ⓘ
İdeal gaz
Makroskopik olarak tanımlanmıĢ bir sıcaklık ölçeğinin temel alınabileceği bir malzeme ideal gazdır. Ġdeal bir gazın sabit bir hacmi ve kütlesi tarafından uygulanan basınç, sıcaklığı ile doğru orantılıdır. Bazı doğal gazlar uygun sıcaklık aralığında termometrede kullanılabilecek kadar neredeyse ideal özellikler gösterir; bu termodinamiğin gelişimi sırasında önemliydi ve bugün hala pratik öneme sahiptir. Ancak ideal gaz termometresi termodinamik için teorik olarak mükemmel değildir. Bunun nedeni, ideal bir gazın mutlak sıfır sıcaklığındaki entropisinin pozitif yarı-belirli bir miktar olmamasıdır; bu da gazı termodinamiğin üçüncü yasasını ihlal eder. Gerçek maddelerin aksine, ideal gaz ne kadar soğuk olursa olsun sıvılaşmaz ya da katılaşmaz. Alternatif bir düşünce olan ideal gaz yasası, sonsuz yüksek sıcaklık ve sıfır basınç sınırını ifade eder; bu koşullar, bileşen moleküllerin etkileşimsiz hareketlerini garanti eder. ⓘ
Kinetik teori yaklaşımı
Kelvin'in büyüklüğü artık Boltzmann sabitinin değerinden türetilen kinetik teori açısından tanımlanmaktadır. ⓘ
Kinetik teori, makroskobik sistemlerin çeşitli türlerin molekülleri ve iyonları gibi birçok mikroskobik parçacıktan oluşmasına ve bir türün parçacıklarının hepsinin birbirine benzemesine dayanarak, özellikle gazlar olmak üzere bazı malzeme kütleleri için sıcaklığın mikroskobik bir açıklamasını sağlar. Makroskobik olayları mikroskobik parçacıkların klasik mekaniği aracılığıyla açıklar. Kinetik teorinin eşitlik teoremi, serbestçe hareket eden bir parçacığın her bir klasik serbestlik derecesinin, kB'nin Boltzmann sabitini gösterdiği kBT/2'lik bir ortalama kinetik enerjiye sahip olduğunu ileri sürer. Parçacığın öteleme hareketi üç serbestlik derecesine sahiptir, bu nedenle kuantum etkilerinin baskın olduğu çok düşük sıcaklıklar dışında, T sıcaklığına sahip bir sistemde serbestçe hareket eden bir parçacığın ortalama öteleme kinetik enerjisi 3kBT/2 olacaktır. ⓘ
Oksijen (O2) gibi moleküller, tek küresel atomlardan daha fazla serbestlik derecesine sahiptir: dönme ve titreşim hareketlerinin yanı sıra ötelemelere de maruz kalırlar. Isıtma, moleküllerin ortalama öteleme kinetik enerjisindeki artışa bağlı olarak sıcaklık artışıyla sonuçlanır. Isıtma aynı zamanda eĢit dağılım yoluyla titreĢim ve dönme modlarıyla iliĢkili enerjinin de artmasına neden olacaktır. Dolayısıyla iki atomlu bir gaz, sıcaklığını belirli bir miktarda artırmak için daha fazla enerji girdisine ihtiyaç duyacaktır, yani tek atomlu bir gazdan daha büyük bir ısı kapasitesine sahip olacaktır. ⓘ
Yukarıda belirtildiği gibi, bir gazdaki ses hızı gazın moleküler karakterinden, sıcaklık ve basıncından ve Boltzmann sabitinin değerinden hesaplanabilir. Boltzmann sabitinin değeri, tam olarak tanımlanmış değerin öncelikli olarak tanımlanmış bir referansı olarak alındığında, ses hızının ölçümü, gazın sıcaklığının daha kesin bir ölçümünü sağlayabilir. ⓘ
Sistemi oluĢturan mikroskobik parçacıkların ortalama kinetik enerjisini ölçmek mümkündür, eğer bu parçacıkların sistemin hacminden kaçmasına izin verilirse, parçacıkların bulunduğu duvarda küçük bir delik açılabilir. Hızların spektrumu ölçülmeli ve ortalama bundan hesaplanmalıdır. Kaçan ve ölçülen parçacıkların sistemin yığınında kalan parçacıklarla aynı hız dağılımına sahip olması gerekmez, ancak bazen iyi bir örneklem mümkündür. ⓘ
Termodinamik yaklaşım
Sıcaklık, termodinamik çalışmalarındaki temel büyüklüklerden biridir. Eskiden kelvinin büyüklüğü termodinamik terimlerle tanımlanırdı, ancak günümüzde, yukarıda da belirtildiği gibi, kinetik teori terimleriyle tanımlanmaktadır. ⓘ
Termodinamik sıcaklığın iki nedenden dolayı mutlak olduğu söylenir. Birincisi, biçimsel karakterinin belirli malzemelerin özelliklerinden bağımsız olmasıdır. Diğer neden ise, termodinamiğin üçüncü yasasına göre, sıfır sıcaklık için sıfır sınırlayıcı özgül ısıya sahip olmaları için, maddeyi oluşturan parçacıkların mikroskobik klasik hareketinin olmadığını göstermesi bakımından sıfırın bir anlamda mutlak olmasıdır. Bununla birlikte, termodinamik sıcaklık aslında gelenek tarafından keyfi olarak seçilen ve belirli malzemelerin özelliklerine bağlı olan kesin bir sayısal değere sahiptir; sadece Celsius ve Fahrenheit gibi göreceli "derece" ölçeklerinden daha az keyfidir. Tek bir sabit noktası (sıfır) olan mutlak bir ölçek olduğundan, göreceli ölçeklerde olduğu gibi iki yerine keyfi seçime bırakılan yalnızca bir serbestlik derecesi vardır. Mayıs 2019'dan bu yana Kelvin ölçeği için, uluslararası konvansiyon gereği, moleküler hareketle ilgili mikroskobik kinetik teorilere dayanarak çeşitli termometrik cihazların çalışma modları bilgisini kullanma seçimi yapılmıştır. Sayısal ölçek, makroskobik sıcaklığı moleküller gibi parçacıkların ortalama mikroskobik kinetik enerjisiyle ilişkilendiren Boltzmann sabitinin değerinin geleneksel bir tanımıyla belirlenir. Sayısal değeri keyfidir ve Kelvin'in Celsius ile olduğu gibi Fahrenheit ölçeği ile hizalanması için yapılmış Rankine ölçeği adı verilen alternatif, daha az yaygın olarak kullanılan bir mutlak sıcaklık ölçeği mevcuttur. ⓘ
Sıcaklığın termodinamik tanımı Kelvin'e dayanmaktadır. Carnot motoru olarak adlandırılan idealize edilmiş bir cihazın, çalışan gövdesinin bir durum döngüsünü kat eden ardışık süreçlerin hayali bir sürekli döngüsünde çalıştığı hayal edilir. Motor sıcak bir rezervuardan bir miktar Q1 ısısı alır ve daha az miktarda Q2 < 0 atık ısıyı soğuk bir rezervuara verir. Çalışma gövdesi tarafından emilen net ısı enerjisi, termodinamik iş olarak bir iş rezervuarına aktarılır ve motorun çıktısı olarak kabul edilir. Döngünün o kadar yavaş çalıştığı düşünülür ki, döngünün her noktasında çalışan gövde termodinamik denge durumundadır. Böylece çevrimin birbirini takip eden süreçlerinin entropi üretimi olmaksızın tersinir bir şekilde işlediği düşünülür. Bu durumda, çalışma gövdesi ısıtıldığında sıcak rezervuardan alınan entropi miktarı, çalışma gövdesi soğutulduğunda soğuk rezervuara aktarılan entropi miktarına eşittir. Daha sonra rezervuarların mutlak veya termodinamik sıcaklıkları, T1 ve T2, şu şekilde tanımlanır
-
(1) ⓘ
Termodinamiğin sıfırıncı yasası, bu tanımın, diğer ısı rezervuarının ilgilenilen cisimle aynı sıcaklığa sahip olmasını sağlayarak, ilgilenilen keyfi bir cismin mutlak veya termodinamik sıcaklığını ölçmek için kullanılmasına izin verir. ⓘ
Kelvin'in mutlak sıcaklığı ortaya koyan orijinal çalışması 1848 yılında yayımlanmıştır. Bu çalışma, termodinamiğin birinci yasasının formüle edilmesinden önce Carnot'nun çalışmalarına dayanıyordu. Carnot'nun ısı konusunda sağlam bir anlayışı ve entropi konusunda belirli bir kavramı yoktu. 'Kaloriden' bahsetti ve sıcak rezervuardan geçen tüm kalorinin soğuk rezervuara geçtiğini söyledi. Kelvin 1848 tarihli makalesinde, ölçeğinin "herhangi bir özel madde türünün özelliklerinden bağımsız olarak" tanımlanması anlamında mutlak olduğunu yazmıştır. Az önce belirtilen tanımı ortaya koyan kesin yayını, 1851'de okunan bir makale olarak 1853'te basıldı. ⓘ
Sayısal ayrıntılar eskiden, ısı rezervuarlarından birini, mutlak sıcaklığı 273.16 K olarak tanımlanan suyun üçlü noktasındaki bir hücre haline getirerek çözülürdü. Günümüzde sayısal değer bunun yerine, yukarıdaki gibi mikroskobik istatistiksel mekanik uluslararası tanım aracılığıyla ölçümden elde edilmektedir. ⓘ
Yoğun değişkenlik
Termodinamik açıdan sıcaklık yoğun bir değişkendir çünkü belirli bir cisim için bir kapsamlı değişkenin diğerine göre diferansiyel katsayısına eşittir. Dolayısıyla iki kapsamlı değişkenin oranı boyutlarına sahiptir. Termodinamikte, iki cisim genellikle bazı spesifik geçirgenlik özelliklerine sahip ortak bir duvarla temas yoluyla bağlı olarak düşünülür. Bu tür spesifik geçirgenlik, spesifik bir yoğun değişkene atıfta bulunulabilir. Buna örnek olarak sadece ısıya karşı geçirgen olan diyatermik bir duvar verilebilir; bu durumda yoğun değişken sıcaklıktır. İki cisim çok uzun bir süre boyunca özel geçirgen duvar aracılığıyla birbirine bağlandığında ve kalıcı bir kararlı duruma yerleştiğinde, ilgili yoğun değişkenler iki cisimde eşittir; diatermik bir duvar için bu ifade bazen termodinamiğin sıfırıncı yasası olarak adlandırılır. ⓘ
Özellikle, cisim, kapsamlı bir değişken olan iç enerjisi U, yine kapsamlı bir değişken olan entropisi S'nin ve diğer durum değişkenleri V, N'nin bir fonksiyonu olarak U = U (S, V, N) ile tanımlandığında, sıcaklık iç enerjinin entropiye göre kısmi türevine eşittir:
-
(2) ⓘ
Aynı şekilde, cismin entropisi S, iç enerjisi U'nun ve diğer durum değişkenleri V, N'nin bir fonksiyonu olarak S = S (U, V, N) ile tanımlandığında, sıcaklığın tersi entropinin iç enerjiye göre kısmi türevine eşittir:
-
(3) ⓘ
Mutlak sıcaklığın yukarıdaki tanımı, denklem (1), Kelvin'e aittir. Madde transferine kapalı sistemlere atıfta bulunur ve doğrudan deneysel prosedürlere özel bir vurgu yapar. Gibbs'in termodinamik sunumu daha soyut bir düzeyde başlar ve madde transferine açık sistemlerle ilgilenir; termodinamiğin bu gelişiminde, yukarıdaki (2) ve (3) denklemleri aslında sıcaklığın alternatif tanımlarıdır. ⓘ
Yerel termodinamik denge
Gerçek dünyadaki cisimler genellikle termodinamik dengede değildir ve homojen değildir. Klasik tersinmez termodinamik yöntemleriyle çalışmak için, bir cisim genellikle uzamsal ve zamansal olarak kavramsal olarak küçük boyutlu 'hücrelere' bölünür. Eğer madde için klasik termodinamik denge koşulları böyle bir 'hücre' içinde iyi bir yaklaşımla yerine getiriliyorsa, o zaman homojendir ve onun için bir sıcaklık mevcuttur. Eğer bu durum vücudun her bir 'hücresi' için geçerliyse, o zaman yerel termodinamik dengenin tüm vücutta geçerli olduğu söylenir. ⓘ
Örneğin, U kapsamlı değişkeni ya da S kapsamlı değişkeni için sistemin birim hacmi başına bir yoğunluğa ya da birim kütlesi başına bir miktara sahip olduğunu söylemek mantıklıdır, ancak sistemin birim hacmi başına sıcaklık yoğunluğundan ya da birim kütlesi başına sıcaklık miktarından bahsetmek mantıklı değildir. Öte yandan, bir noktadaki iç enerjiden söz etmenin bir anlamı yoktur, ancak yerel termodinamik denge hüküm sürdüğünde, bir noktadaki sıcaklıktan söz etmek mantıklıdır. Sonuç olarak, küresel termodinamik dengede olmayan ancak yerel termodinamik dengenin olduğu bir ortamda sıcaklık noktadan noktaya değişebilir. ⓘ
Dolayısıyla, bir cisimde yerel termodinamik denge hüküm sürdüğünde, sıcaklık o cisimde uzamsal olarak değişen yerel bir özellik olarak kabul edilebilir ve bunun nedeni sıcaklığın yoğun bir değişken olmasıdır. ⓘ
Temel teori
|
Eşlenik değişkenler termodinamiğin | ||||||||
|
Sıcaklık, bir malzemenin durumunun niteliğinin bir ölçüsüdür. Bu nitelik, onu ölçen belirli bir sıcaklık ölçeğinden daha soyut bir varlık olarak görülebilir ve bazı yazarlar tarafından sıcaklık olarak adlandırılır. Sıcaklığın niteliği, maddenin yalnızca belirli bir yerdeki durumunu ifade eder ve genel olarak, termodinamik dengenin sabit bir durumunda tutulan cisimler dışında, sıcaklık bir yerden bir yere değişir. Belirli bir yerdeki bir malzemenin, iyi tanımlanmış bir sıcaklığa veya sıcaklığa sahip olmasına izin verecek kadar sabit ve neredeyse homojen bir durumda olması gerekmez. Sıcaklık soyut olarak tek boyutlu bir manifold olarak temsil edilebilir. Her geçerli sıcaklık ölçeğinin, sıcaklık manifolduna bire bir haritası vardır. ⓘ
Termal temas halindeki iki sistem aynı sıcaklıkta olduğunda aralarında ısı transferi olmaz. Bir sıcaklık farkı mevcut olduğunda, ısı, termal dengeye gelene kadar daha sıcak sistemden daha soğuk sisteme kendiliğinden akar. Bu tür ısı transferi iletim veya termal radyasyon yoluyla gerçekleşir. ⓘ
Deneysel fizikçiler, örneğin Galileo ve Newton, sonsuz sayıda deneysel sıcaklık ölçeği olduğunu bulmuşlardır. Bununla birlikte, termodinamiğin sıfırıncı yasası hepsinin aynı kaliteyi ölçtüğünü söyler. Bu, kendi iç termodinamik denge durumundaki bir cisim için, cismin sıcaklığını ölçen her türlü doğru kalibre edilmiş termometrenin tek ve aynı sıcaklığı kaydettiği anlamına gelir. Kendi iç termodinamik denge durumunda olmayan bir cisim için, farklı termometreler, sırasıyla termometrelerin çalışma mekanizmalarına bağlı olarak farklı sıcaklıklar kaydedebilir. ⓘ
Termodinamik denge halindeki cisimler
Deneysel fizik açısından sıcaklık, herhangi iki cismi kendi ayrı termodinamik dengelerinde karşılaştırırken, sayısal ölçek okumalarına sahip uygun şekilde verilmiş herhangi iki deneysel termometrenin, verilen iki cisimden hangisinin daha sıcak olduğu veya aynı sıcaklığa sahip oldukları konusunda hemfikir olacağı anlamına gelir. Bu, iki termometrenin sayısal ölçek okumaları arasında doğrusal bir iliĢki olmasını gerektirmez, ancak sayısal okumaları arasındaki iliĢkinin kesinlikle monotonik olmasını gerektirir. Kalorimetreden, termodinamikten ve belirli malzemelerin özelliklerinden bağımsız olarak, Wien'in termal radyasyon yer değiĢtirme yasasından daha fazla sıcaklığa dair kesin bir fikir edinilebilir: bir termal radyasyon banyosunun sıcaklığı, evrensel bir sabitle, frekans spektrumunun maksimum frekansıyla orantılıdır; bu frekans her zaman pozitiftir, ancak sıfıra eğilimli değerlere sahip olabilir. Termal radyasyon başlangıçta termodinamik dengedeki bir boşluk için tanımlanır. Bu fiziksel gerçekler, sıcaklığın sıralı tek boyutlu bir manifold üzerinde var olduğuna dair matematiksel bir ifadeyi haklı çıkarmaktadır. Bu, kendi termodinamik dengesindeki cisimler için sıcaklık ve termometrelerin temel bir karakteridir. ⓘ
Buzun erimesi gibi birinci dereceden bir faz değişimi geçiren bir sistem hariç, kapalı bir sistem ısı aldıkça, hacminde bir değişiklik olmadan ve üzerine etki eden dış kuvvet alanlarında bir değişiklik olmadan sıcaklığı artar. Termodinamik dengeden ayrılmanın ihmal edilebileceği kadar yavaş bir faz değişimi geçiren bir sistem için, sisteme gizli ısı sağlandıkça sıcaklığı sabit kalır. Tersine, kapalı bir sistemden faz değişikliği olmadan, hacim değişikliği olmadan ve üzerine etki eden dış kuvvet alanlarında bir değişiklik olmadan ısı kaybı, sıcaklığını düşürür. ⓘ
Kararlı durumda olan ancak termodinamik dengede olmayan cisimler
Kendi termodinamik denge durumlarındaki cisimler için sıcaklık kavramı, tüm deneysel termometrelerin iki cisimden hangisinin daha sıcak olduğu veya aynı sıcaklıkta oldukları konusunda hemfikir olmasını gerektirirken, termodinamik dengede olmasa da kararlı durumda olan cisimler için bu gereklilik güvenli değildir. Bu durumda farklı deneysel termometreler hangisinin daha sıcak olduğu konusunda hemfikir olmayabilir ve bu durumda cisimlerden en az biri iyi tanımlanmış mutlak termodinamik sıcaklığa sahip değildir. Bununla birlikte, herhangi bir cisim ve herhangi bir uygun ampirik termometre, uygun bir süreç aralığı için ampirik, mutlak olmayan, sıcaklık ve sıcaklık kavramlarını destekleyebilir. Bu, denge dışı termodinamikte çalışılması gereken bir konudur. ⓘ
Kararlı durumda olmayan cisimler
Bir cisim kararlı durumda olmadığında, sıcaklık kavramı termodinamik dengede olmayan kararlı durumdaki bir cisme göre daha da az güvenli hale gelir. Bu aynı zamanda denge dışı termodinamikte incelenmesi gereken bir konudur. ⓘ
Termodinamik denge aksiyomatiği
Termodinamik dengenin aksiyomatik olarak ele alınması için 1930'lardan bu yana termodinamiğin sıfırıncı yasasına atıfta bulunmak geleneksel hale gelmiştir. Böyle bir yasanın geleneksel olarak ifade edilen minimalist versiyonu, yalnızca termal olarak bağlı olduklarında termal dengede olacak tüm cisimlerin tanım gereği aynı sıcaklığa sahip olması gerektiğini varsayar, ancak kendi başına sıcaklığı bir ölçek üzerinde gerçek bir sayı olarak ifade edilen bir miktar olarak belirlemez. Böyle bir yasanın fiziksel olarak daha bilgilendirici bir versiyonu, ampirik sıcaklığı bir sıcaklık manifoldu üzerindeki bir grafik olarak görür. Sıfırıncı yasa birçok farklı ampirik sıcaklık ölçeğinin tanımlanmasına izin verirken, termodinamiğin ikinci yasası, keyfi bir ölçek faktörüne kadar benzersiz olan ve bu nedenle termodinamik sıcaklık olarak adlandırılan, tercih edilen tek bir mutlak sıcaklık tanımını seçer. İç enerji, termodinamik dengede homojen bir sistemin hacminin ve entropisinin bir fonksiyonu olarak düşünülürse, termodinamik mutlak sıcaklık, sabit hacimde entropiye göre iç enerjinin kısmi türevi olarak ortaya çıkar. Doğal, içsel kökeni veya sıfır noktası, herhangi bir sistemin entropisinin minimumda olduğu mutlak sıfırdır. Bu, model tarafından tanımlanan en düşük mutlak sıcaklık olmasına rağmen, termodinamiğin üçüncü yasası mutlak sıfırın herhangi bir fiziksel sistem tarafından elde edilemeyeceğini varsayar. ⓘ
Isı kapasitesi
Bir vücuda veya vücuttan enerji transferi sadece ısı olarak gerçekleştiğinde, vücudun durumu değişir. Çevreye ve onları vücuttan ayıran duvarlara bağlı olarak, vücutta çeşitli değişiklikler mümkündür. Bunlar arasında kimyasal reaksiyonlar, basınç artışı, sıcaklık artışı ve faz değişimi yer alır. Belirli koşullar altında her bir değişim türü için ısı kapasitesi, transfer edilen ısı miktarının değişimin büyüklüğüne oranıdır. ⓘ
Örneğin, eğer değişim sabit hacimde sıcaklık artışı ise, faz değişimi ve kimyasal değişim yoksa, o zaman cismin sıcaklığı artar ve basıncı yükselir. Aktarılan ısı miktarı, ΔQ, gözlemlenen sıcaklık değişimine bölündüğünde, ΔT, cismin sabit hacimdeki ısı kapasitesidir:
Isı kapasitesi iyi tanımlanmış bir madde miktarı için ölçülüyorsa, özgül ısı, bu birim miktarın sıcaklığını bir birim sıcaklık kadar artırmak için gereken ısının ölçüsüdür. Örneğin, suyun sıcaklığını bir kelvin (bir santigrat dereceye eşit) yükseltmek için kilogram başına 4186 jul (J/kg) gerekir. ⓘ
Ölçüm

Modern bilimsel termometreler ve sıcaklık ölçekleri kullanılarak yapılan sıcaklık ölçümleri, Daniel Gabriel Fahrenheit'ın Ole Christensen Rømer tarafından geliştirilen bir termometreyi (cıvaya geçerek) ve bir ölçeği uyarladığı 18. yüzyılın başlarına kadar uzanmaktadır. Fahrenheit'ın ölçeği Amerika Birleşik Devletleri'nde bilimsel olmayan uygulamalar için hala kullanılmaktadır. ⓘ
Sıcaklık, çeşitli sıcaklık ölçeklerine göre kalibre edilebilen termometrelerle ölçülür. Dünyanın büyük bölümünde (Belize, Myanmar, Liberya ve Amerika Birleşik Devletleri hariç), çoğu sıcaklık ölçümü için Celsius ölçeği kullanılır. Çoğu bilim insanı sıcaklığı Celsius ölçeğini kullanarak, termodinamik sıcaklığı ise Celsius ölçeğinin sıfır noktası 0 K = -273,15 °C veya mutlak sıfır olacak şekilde kaydırılmış hali olan Kelvin ölçeğini kullanarak ölçmektedir. Başta yüksek teknoloji ve ABD federal şartnameleri (sivil ve askeri) olmak üzere ABD'deki birçok mühendislik alanı da Kelvin ve Celsius ölçeklerini kullanmaktadır. ABD'deki diğer mühendislik alanları da yanma gibi termodinamikle ilgili disiplinlerde çalışırken Rankine ölçeğine (kaydırılmış Fahrenheit ölçeği) güvenmektedir. ⓘ
Birimler
Uluslararası Birimler Sisteminde (SI) temel sıcaklık birimi Kelvin'dir. K sembolüne sahiptir. ⓘ
Günlük uygulamalar için, 0 °C'nin suyun donma noktasına çok yakın olduğu ve 100 °C'nin deniz seviyesindeki kaynama noktası olduğu Celsius ölçeğini kullanmak genellikle uygundur. Sıvı damlacıkları genellikle sıfırın altındaki sıcaklıklarda bulutlarda bulunduğundan, 0 °C buzun erime noktası olarak daha iyi tanımlanır. Bu ölçekte, 1 santigrat derecelik bir sıcaklık farkı 1kelvinlik bir artışla aynıdır, ancak ölçek buzun eridiği sıcaklıkla (273.15 K) dengelenir. ⓘ
Uluslararası anlaşmayla, Mayıs 2019'a kadar Kelvin ve Celsius ölçekleri iki sabit noktayla tanımlanmıştır: mutlak sıfır ve belirli bir hidrojen ve oksijen izotop karışımıyla özel olarak hazırlanmış su olan Viyana Standart Ortalama Okyanus Suyunun üçlü noktası. Mutlak sıfır tam olarak 0 K ve -273.15 °C olarak tanımlanmıştır. Bu, maddeyi oluşturan parçacıkların tüm klasik öteleme hareketlerinin sona erdiği ve klasik modelde tamamen hareketsiz oldukları sıcaklıktır. Ancak kuantum-mekanik olarak sıfır noktası hareketi devam eder ve sıfır noktası enerjisi olarak adlandırılan ilişkili bir enerjiye sahiptir. Madde temel durumundadır ve termal enerji içermez. 273.16 K ve 0.01 °C sıcaklıkları suyun üçlü noktası olarak tanımlanmıştır. Bu tanım şu amaçlara hizmet etmiştir: kelvinin büyüklüğünü mutlak sıfır ile suyun üçlü noktası arasındaki farkın tam olarak 273,16'da 1'i olarak sabitlemiştir; bir kelvinin Celsius ölçeğinde bir derece ile tam olarak aynı büyüklüğe sahip olduğunu belirlemiştir; ve bu ölçeklerin sıfır noktaları arasındaki farkı 273,15 K olarak belirlemiştir (0 K = -273,15 °C ve 273,16 K = 0,01 °C). 2019'dan bu yana Boltzmann sabitine dayanan yeni bir tanım yapılmıştır, ancak ölçekler neredeyse hiç değişmemiştir. ⓘ
Amerika Birleşik Devletleri'nde en yaygın olarak Fahrenheit ölçeği kullanılmaktadır. Bu ölçekte suyun donma noktası 32 °F'ye ve kaynama noktası 212 °F'ye karşılık gelir. ABD'de kimya mühendisliği alanlarında hala kullanılan Rankine ölçeği, Fahrenheit artışına dayalı mutlak bir ölçektir. ⓘ
Dönüşüm
Aşağıdaki tablo, Celsius ölçeğine ve Celsius ölçeğinden dönüşümler için sıcaklık dönüşüm formüllerini göstermektedir. ⓘ
| Celsius'tan | Celsius'a | |
|---|---|---|
| Fahrenheit | [°F] = [°C] × 9⁄5 + 32 | [°C] = ([°F] - 32) × 5⁄9 |
| Kelvin | [K] = [°C] + 273.15 | [°C] = [K] - 273.15 |
| Rankine | [°R] = ([°C] + 273.15) × 9⁄5 | [°C] = ([°R] - 491,67) × 5⁄9 |
| Delisle | [°De] = (100 - [°C]) × 3⁄2 | [°C] = 100 - [°De] × 2⁄3 |
| Newton | [°N] = [°C] × 33⁄100 | [°C] = [°N] × 100⁄33 |
| Réaumur | [°Ré] = [°C] × 4⁄5 | [°C] = [°Ré] × 5⁄4 |
| Rømer | [°Rø] = [°C] × 21⁄40 + 7,5 | [°C] = ([°Rø] - 7,5) × 40⁄21 |
Günlük hayatta sıcaklık birimi olarak en çok derece Celsius (°C) kullanılmaktadır. Bilimsel işlemlerde ise daha çok Kelvin ölçeği kullanılır. ⓘ
Plazma fiziği
Plazma fiziği alanı, çok yüksek sıcaklıklar içeren elektromanyetik doğa olaylarıyla ilgilenir. Sıcaklığı elektronvolt (eV) veya kiloelektronvolt (keV) birimlerinde enerji olarak ifade etmek gelenekseldir. Sıcaklıktan farklı bir boyuta sahip olan enerji, daha sonra Boltzmann sabiti ve sıcaklığın çarpımı olarak hesaplanır, . O halde, 1 eV 11605 K'ye karşılık gelir. QCD maddesinin incelenmesinde rutin olarak birkaç yüz MeV mertebesinde sıcaklıklarla karşılaşılır, bu da yaklaşık 1012 K'ye denk gelir. ⓘ
Teorik temel
Tarihsel olarak, sıcaklığın açıklanmasına yönelik birkaç bilimsel yaklaşım bulunmaktadır: laboratuvarda ölçülebilen makroskopik ampirik değişkenlere dayanan klasik termodinamik açıklama; makroskopik açıklamayı gaz parçacıklarının hareket enerjisinin olasılık dağılımıyla ilişkilendiren gazların kinetik teorisi; ve istatistiksel fizik ve kuantum mekaniğine dayanan mikroskopik bir açıklama. Buna ek olarak, titiz ve tamamen matematiksel uygulamalar klasik termodinamik ve sıcaklığa aksiyomatik bir yaklaşım sağlamıştır. İstatistiksel fizik, maddenin atomik davranışını tanımlayarak daha derin bir anlayış sağlar ve hem klasik hem de kuantum durumları dahil olmak üzere mikroskobik durumların istatistiksel ortalamalarından makroskobik özellikler türetir. Temel fiziksel tanımda, doğal birimler kullanılarak, sıcaklık doğrudan enerji birimleri cinsinden ölçülebilir. Ancak, modern metrik birimler sistemi gibi bilim, teknoloji ve ticarete yönelik pratik ölçüm sistemlerinde, makroskobik ve mikroskobik tanımlar, sıcaklığı mikroskobik ortalama kinetik enerjiye ölçekleyen bir orantı faktörü olan Boltzmann sabiti ile birbiriyle ilişkilidir. ⓘ
İstatistiksel mekanikteki mikroskobik tanım, bir sistemi temel madde parçacıklarına veya bir dizi klasik veya kuantum-mekanik osilatöre analiz eden ve sistemi mikro durumların istatistiksel bir topluluğu olarak gören bir modele dayanır. Klasik madde parçacıkları topluluğu olarak sıcaklık, ister katı, ister sıvı, ister gaz ya da plazma olsun, parçacıkların öteleme kinetik enerjisi olarak adlandırılan ortalama hareket enerjisinin bir ölçüsüdür. Klasik mekaniğin bir kavramı olan kinetik enerji, bir parçacığın kütlesinin yarısı ile hızının karesinin çarpımıdır. Termal hareketin bu mekanik yorumunda, malzeme parçacıklarının kinetik enerjileri, öteleme veya titreşim hareketlerinin parçacıklarının hızında veya dönme modlarının eylemsizliğinde bulunabilir. Tek atomlu mükemmel gazlarda ve yaklaşık olarak çoğu gazda ve basit metallerde sıcaklık, ortalama parçacık öteleme kinetik enerjisinin bir ölçüsüdür, 3/2 kBT. Aynı zamanda enerjinin olasılık dağılım fonksiyonunu da belirler. Yoğun maddede ve özellikle katılarda, bu tamamen mekanik tanımlama genellikle daha az kullanışlıdır ve osilatör modeli kuantum mekaniksel fenomenleri açıklamak için daha iyi bir tanımlama sağlar. Sıcaklık, topluluğun mikro durumlarının istatistiksel işgalini belirler. Sıcaklığın mikroskobik tanımı yalnızca termodinamik limitte, yani istatistiksel modelin gerekliliklerini yerine getirmek için büyük durum veya parçacık toplulukları için anlamlıdır. ⓘ
Kinetik enerji de termal enerjinin bir bileşeni olarak kabul edilir. Termal enerji, parçacıkların serbestlik derecelerine veya termodinamik bir sistemdeki osilatörlerin modlarına atfedilen bağımsız bileşenlere bölünebilir. Genel olarak, enerjinin eĢit dağılımı için mevcut olan bu serbestlik derecelerinin sayısı sıcaklığa, yani göz önünde bulundurulan etkileĢimlerin enerji bölgesine bağlıdır. Katı maddeler için, termal enerji öncelikle atomlarının veya moleküllerinin denge konumları hakkındaki titreşimleriyle ilişkilidir. İdeal tek atomlu bir gazda, kinetik enerji yalnızca parçacıkların tamamen öteleme hareketlerinde bulunur. Diğer sistemlerde titreşim ve dönme hareketleri de serbestlik derecelerine katkıda bulunur. ⓘ
Gazların kinetik teorisi

Maxwell ve Boltzmann, gazlardaki sıcaklığın temel bir anlayışını sağlayan bir kinetik teori geliştirmiştir. Bu teori aynı zamanda ideal gaz yasasını ve tek atomlu (veya 'soy') gazların gözlemlenen ısı kapasitesini de açıklar. ⓘ
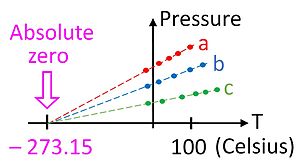
İdeal gaz yasası basınç (p), hacim (V) ve sıcaklık (T) arasındaki gözlemlenen ampirik ilişkilere dayanır ve gazların kinetik teorisi geliştirilmeden çok önce kabul edilmiştir (bkz. Boyle ve Charles yasaları). İdeal gaz yasası şöyle der:
Burada n gazın mol sayısıdır ve R = 8.314462618... J⋅mol-1⋅K-1 gaz sabitidir. ⓘ
Bu ilişki bize sıcaklık ölçeğinde mutlak bir sıfır olduğuna dair ilk ipucunu verir, çünkü yalnızca sıcaklık Kelvin gibi mutlak bir ölçekte ölçüldüğünde geçerlidir. İdeal gaz yasası, gaz termometresi kullanılarak sıcaklığın bu mutlak ölçekte ölçülmesini sağlar. Kelvin cinsinden sıcaklık, bir metreküplük bir kaptaki bir mol gazın paskal cinsinden basıncının gaz sabitine bölünmesi olarak tanımlanabilir. ⓘ
Çok kullanışlı bir cihaz olmamasına rağmen, gaz termometresi tüm termometrelerin kalibre edilebileceği temel bir teorik temel sağlar. Pratik bir mesele olarak, mutlak sıfır sıcaklığını ölçmek için gaz termometresi kullanmak mümkün değildir çünkü gazlar sıcaklık sıfıra ulaşmadan çok önce yoğunlaşarak sıvıya dönüşür. Bununla birlikte, şekilde gösterildiği gibi ideal gaz yasasını kullanarak mutlak sıfıra ekstrapolasyon yapmak mümkündür. ⓘ
Kinetik teori, basıncın tek tek atomların çeperlere çarpmasıyla ilişkili kuvvetten kaynaklandığını ve tüm enerjinin öteleme kinetik enerjisi olduğunu varsayar. Boltzmann, karmaşık bir simetri argümanı kullanarak, ideal bir gazdaki parçacıkların hızı için Maxwell-Boltzmann olasılık dağılım fonksiyonu olarak adlandırılan şeyi çıkardı. Bu olasılık dağılım fonksiyonundan, tek atomlu ideal bir gazın ortalama kinetik enerjisi (parçacık başına) ⓘ
burada Boltzmann sabiti kB ideal gaz sabitinin Avogadro sayısına bölümüdür ve kök-ortalama-kare hızıdır. Sıcaklık ve ortalama moleküler kinetik enerji arasındaki bu doğru orantı, eĢitlik teoreminin özel bir durumudur ve yalnızca mükemmel bir gazın klasik sınırında geçerlidir. Çoğu madde için tam olarak geçerli değildir. ⓘ
Termodinamiğin sıfırıncı yasası
Başka türlü izole edilmiş iki cisim, madde geçirmeyen katı bir fiziksel yolla birbirine bağlandığında, daha sıcak olandan daha soğuk olana ısı olarak kendiliğinden enerji transferi olur. Sonunda, ısı transferinin durduğu ve cisimlerin ilgili durum değişkenlerinin değişmez hale geldiği bir karşılıklı termal denge durumuna ulaşırlar. ⓘ
Termodinamiğin sıfırıncı yasasının bir ifadesi, eğer iki sistemin her biri üçüncü bir sistemle termal dengede ise, o zaman birbirleriyle de termal dengede olduklarıdır. ⓘ
Bu ifade sıcaklığın tanımlanmasına yardımcı olur ancak tek başına tanımı tamamlamaz. Ampirik sıcaklık, termodinamik bir sistemin sıcaklığına ilişkin sayısal bir ölçektir. Böyle bir sıcaklık, sıcak ve soğuk arasında uzanan tek boyutlu bir manifold üzerinde var olarak tanımlanabilir. Bazen sıfırıncı yasanın, ampirik sıcaklığın tam bir tanımını sağlamak için benzersiz bir evrensel sıcaklık manifoldunun ve bunun üzerindeki sayısal ölçeklerin varlığını içerdiği belirtilir. Bir maddenin ampirik termometriye uygun olması için, diğer tüm ilgili koordinatlar sabitken, sıcaklık ile basınç veya hacim gibi kolayca ölçülebilen bazı durum değişkenleri arasında monoton bir ilişki olmalıdır. Son derece uygun bir sistem, mutlak Kelvin ölçeğine uyan bir sıcaklık ölçeği sağlayabilen ideal gazdır. Kelvin ölçeği termodinamiğin ikinci yasası temelinde tanımlanır. ⓘ
Termodinamiğin ikinci yasası
Termodinamiğin sıfırıncı yasasını dikkate almaya veya tanımlamaya alternatif olarak, termodinamikteki tarihsel gelişme, sıcaklığı entropi ile ilgilenen termodinamiğin ikinci yasası açısından tanımlamak olmuştur. İkinci yasa, herhangi bir sürecin evrenin entropisinde ya hiçbir değişikliğe ya da net bir artışa yol açmayacağını belirtir. Bu, olasılık açısından anlaşılabilir. ⓘ
Örneğin, bir dizi yazı tura atışında, mükemmel düzene sahip bir sistem ya her atışta tura gelen ya da her atışta yazı gelen bir sistem olacaktır. Bu, sonucun her zaman %100 aynı olduğu anlamına gelir. Buna karşılık, birçok karışık (düzensiz) sonuç mümkündür ve bunların sayısı her atışta artar. Sonunda, ~%50 tura ve ~%50 yazı kombinasyonları baskın hale gelir ve 50/50'den önemli ölçüde farklı bir sonuç elde etme olasılığı giderek azalır. Böylece sistem doğal olarak maksimum düzensizlik veya entropi durumuna doğru ilerler. ⓘ
Sıcaklık iki sistem arasındaki ısı transferini yönettiğinden ve evren maksimum entropiye doğru ilerleme eğiliminde olduğundan, sıcaklık ve entropi arasında bir ilişki olması beklenir. Bir ısı motoru, termal enerjiyi mekanik enerjiye dönüştürerek iş yapılmasını sağlayan bir cihazdır. Carnot ısı motorunun analizi gerekli ilişkileri sağlar. Enerji korunumuna ve enerjinin tam bir çevrim boyunca değişmeyen bir durum fonksiyonu olmasına göre, bir ısı motorundan tam bir çevrim boyunca elde edilen iş net ısıya, yani sisteme yüksek sıcaklıkta (qH > 0) verilen ısı ile düşük sıcaklıkta (qC < 0) verilen atık ısının toplamına eşittir. ⓘ
Verimlilik, işin ısı girişine bölünmesiyle elde edilir:
-
(4) ⓘ
Burada wcy döngü başına yapılan iştir. Verimlilik yalnızca |qC|/qH değerine bağlıdır. qC ve qH sırasıyla TC ve TH sıcaklıklarındaki ısı transferine karşılık geldiğinden, |qC|/qH bu sıcaklıkların bir fonksiyonu olmalıdır:
-
(5) ⓘ
Carnot teoremi, aynı ısı rezervuarları arasında çalışan tüm tersinir motorların eşit derecede verimli olduğunu belirtir. Dolayısıyla, T1 ve T3 arasında çalışan bir ısı motoru, biri T1 ve T2 arasında, ikincisi T2 ve T3 arasında olmak üzere iki çevrimden oluşan bir ısı motoruyla aynı verime sahip olmalıdır. Bu durum ancak şu koşullarda söz konusu olabilir ⓘ
ki bu da ⓘ
İlk fonksiyon T2'den bağımsız olduğundan, bu sıcaklık sağ tarafta iptal edilmelidir, yani f(T1, T3) g(T1)/g(T3) biçimindedir (yani f(T1, T3) = f(T1, T2)f(T2, T3) = g(T1)/g(T2) - g(T2)/g(T3) = g(T1)/g(T3)), burada g tek bir sıcaklığın fonksiyonudur. Artık şu özelliğe sahip bir sıcaklık ölçeği seçilebilir ⓘ
-
(6) ⓘ
(6)'yı (4)'te tekrar yerine koymak, sıcaklık açısından verimlilik için bir ilişki verir:
-
(7) ⓘ
TC = 0 K için verimlilik %100'dür ve bu verimlilik 0 K'nin altında %100'den büyük olur. %100'den büyük bir verimlilik termodinamiğin birinci yasasını ihlal ettiğinden, bu 0 K'nin mümkün olan minimum sıcaklık olduğu anlamına gelir. Aslında, makroskopik bir sistemde şimdiye kadar elde edilen en düşük sıcaklık, 1995 yılında NIST'de elde edilen 20 nK idi. (5)'in sağ tarafını orta kısımdan çıkarıp yeniden düzenlediğimizde ⓘ
Burada negatif işaret sistemden atılan ısıyı gösterir. Bu ilişki, aşağıdaki şekilde tanımlandığı takdirde tam bir döngü için değişimi karakteristik olarak yok olan bir durum fonksiyonunun, S, varlığına işaret etmektedir ⓘ
-
(8) ⓘ
Burada alt simge tersine çevrilebilir bir süreci gösterir. Bu fonksiyon, daha önce açıklanan sistemin entropisine karşılık gelir. (8)'in yeniden düzenlenmesi, entropi ve ısının kurgusal sonsuz küçük yarı tersinir unsurları açısından sıcaklık için bir formül verir:
-
(9) ⓘ
S(E) entropisinin E enerjisinin bir fonksiyonu olduğu sabit hacimli bir sistem için, dE = dqrev ve (9) şunu verir ⓘ
-
(10) ⓘ
Yani sıcaklığın tersi, sabit hacimde entropinin enerjiye göre artış oranıdır. ⓘ
İstatistiksel mekanikten tanım
İstatistiksel mekanik, sıcaklığı bir sistemin temel serbestlik derecelerine dayalı olarak tanımlar. Eşitlik (10) sıcaklığın tanımlayıcı ilişkisidir, burada entropi verilen makro durumdaki sistemin mikro durumlarının sayısının logaritması ile tanımlanır (bir sabite kadar) (mikrokanonik toplulukta belirtildiği gibi):
burada Boltzmann sabiti ve W ise sistemin E enerjisine sahip mikro durum sayısıdır (dejenerasyon). ⓘ
Farklı sıcaklıklara sahip iki sistem tamamen termal bağlantıya sokulduğunda, ısı daha yüksek sıcaklıktaki sistemden daha düşük sıcaklıktaki sisteme akacaktır; termodinamik olarak bu termodinamiğin ikinci yasası ile anlaşılır: Bir enerji transferini takiben entropideki toplam değişim sistem 1'den sistem 2'ye:
ve dolayısıyla aşağıdaki durumlarda pozitiftir ⓘ
İstatistiksel mekanik açısından bakıldığında, birleşik sistem 1 + sistem 2'deki toplam mikro durum sayısı şöyledir logaritması (çarpı Boltzmann sabiti) entropilerinin toplamıdır; bu nedenle, toplam entropide bir artışa neden olan yüksek sıcaklıktan düşük sıcaklığa doğru bir ısı akışı, diğer senaryolardan daha olasıdır (normalde çok daha olasıdır), çünkü ortaya çıkan makro durumda daha fazla mikro durum vardır. ⓘ
Tek parçacık istatistiklerinden elde edilen genelleştirilmiş sıcaklık
Sıcaklık tanımını bir kuantum noktasındaki gibi az sayıda parçacıktan oluşan sistemlere bile genişletmek mümkündür. Genelleştirilmiş sıcaklık, tek/çift doluluklu bir sistem ile küçük bir fermiyon sistemi (N 10'dan bile az) arasındaki termal ve parçacık değişimi durumunda istatistiksel mekanikte verilen konfigürasyon-uzay toplulukları yerine zaman toplulukları dikkate alınarak elde edilir. Ergodiklik ve ortodiklik hipotezi altında elde edilen sonlu kuantum büyük kanonik topluluk, ortalama işgal süresinin oranından genelleştirilmiş sıcaklığın ifade edilmesine izin verir ve tek/çift doluluklu sistemin:
burada EF Fermi enerjisidir. Bu genelleştirilmiş sıcaklık, N sonsuza gittiğinde normal sıcaklığa yönelir. ⓘ
Negatif sıcaklık
Mutlak sıfıra referanslı olmayan ampirik sıcaklık ölçeklerinde negatif sıcaklık, kullanılan ölçeğin sıfır noktasının bir altındadır. Örneğin, kuru buzun süblimleşme sıcaklığı -109,3 °F'ye eşdeğer olan -78,5 °C'dir. Mutlak Kelvin ölçeğinde bu sıcaklık 194,6 K'dir. Hiçbir cisim uygulanabilir herhangi bir sonlu işlemle tam olarak 0 K'ye (ideal olarak mümkün olan en soğuk cismin sıcaklığı) getirilemez; bu termodinamiğin üçüncü yasasının bir sonucudur. ⓘ
Bir cismin uluslararası kinetik teori sıcaklığı negatif değerler alamaz. Ancak termodinamik sıcaklık ölçeği bu kadar kısıtlı değildir. ⓘ
Bir madde kütlesi için, bazen kavramsal olarak, mikroskobik serbestlik dereceleri, yani parçacık spinleri açısından, tüm kütleninkinden farklı bir sıcaklığa sahip bir alt sistem tanımlanabilir. Cisim kendi iç termodinamik denge durumundayken, tüm cismin ve alt sistemin sıcaklıkları aynı olmalıdır. Bu iki sıcaklık, dıĢarıdan uygulanan kuvvet alanları vasıtasıyla enerji vücudun geri kalanından ayrı olarak alt sisteme aktarılabildiğinde farklı olabilir; bu durumda tüm vücut kendi iç termodinamik denge durumunda değildir. Böyle bir spin alt sisteminin ulaşabileceği bir enerji üst sınırı vardır. ⓘ
Alt sistemin geçici bir sanal termodinamik denge durumunda olduğu düşünüldüğünde, termodinamik ölçekte negatif bir sıcaklık elde etmek mümkündür. Termodinamik sıcaklık, alt sistemin entropisinin iç enerjisine göre türevinin tersidir. Alt sistemin iç enerjisi arttıkça, entropi bir aralık için artar, ancak sonunda maksimum bir değere ulaşır ve ardından en yüksek enerji durumları dolmaya başladıkça azalmaya başlar. Maksimum entropi noktasında, sıcaklık fonksiyonu bir tekillik davranışı gösterir, çünkü enerjinin bir fonksiyonu olarak entropinin eğimi sıfıra düşer ve sonra negatife döner. Alt sistemin entropisi maksimuma ulaştığında, termodinamik sıcaklığı pozitif sonsuza gider ve eğim negatife döndükçe negatif sonsuza geçer. Bu tür negatif sıcaklıklar herhangi bir pozitif sıcaklıktan daha sıcaktır. Zaman içinde, alt sistem pozitif sıcaklığa sahip olan vücudun geri kalanına maruz kaldığında, enerji negatif sıcaklıktaki alt sistemden pozitif sıcaklıktaki sisteme ısı olarak aktarılır. Kinetik teori sıcaklığı bu tür alt sistemler için tanımlanmamıştır. ⓘ
Örnekler
| Sıcaklık | Tepe emittans dalga boyu kara cisim radyasyonunun | ||
|---|---|---|---|
| Kelvin | Celsius | ||
| Mutlak sıfır (tam olarak tanım gereği) |
0 K | -273.15 °C | Tanımlanamaz |
| 'de kara deliğin kara cisim sıcaklığı Galaksimizin merkezi, Sagittarius A* |
15 fK | -273.149999999999985 °C | 2,5×108 km (1,7 AU) |
| En düşük sıcaklık elde edildi |
100 pK | -273.149999999900 °C | 29000 km |
| En soğuk Bose-Einstein yoğuşması |
450 pK | -273.14999999955 °C | 6400 km |
| Bir milikelvin (tam olarak tanım gereği) |
0.001 K | -273.149 °C | 2.89777 m (radyo, FM bandı) |
| Kozmik mikrodalga arka planı (2013 ölçümü) |
2.7260 K | -270.424 °C | 0.00106301 m (milimetre dalga boylu mikrodalga) |
| Su üçlü noktası (tam olarak tanım gereği) |
273.16 K | 0.01 °C | 10608.3 nm (uzun dalga boylu IR) |
| Su kaynama noktası | 373.1339 K | 99.9839 °C | 7766.03 nm (orta dalga boylu IR) |
| Demir erime noktası | 1811 K | 1538 °C | 1600 nm (uzak kızılötesi) |
| Akkor lamba | 2500 K | ≈2200 °C | 1160 nm (yakın kızılötesi) |
| Güneş'in görünür yüzeyi | 5778 K | 5505 °C | 501.5 nm (yeşil-mavi ışık) |
| Yıldırım kanal |
28 kK | 28000 °C | 100 nm (uzak ultraviyole ışık) |
| Güneş'in çekirdeği | 16 MK | 16 milyon °C | 0,18 nm (X-ışınları) |
| Termonükleer silah (en yüksek sıcaklık) |
350 MK | 350 milyon °C | 8,3×10-3 nm (gama ışınları) |
| Sandia Ulusal Laboratuvarları'nın Z makinesi |
2 GK | 2 milyar °C | 1,4×10-3 nm (gama ışınları) |
| Yüksek kütleli bir çekirdeğin son gününde yıldız |
3 GK | 3 milyar °C | 1×10-3 nm (gama ışınları) |
| Birleşen ikili nötron yıldız sistemi |
350 GK | 350 milyar °C | 8×10-6 nm (gama ışınları) |
| Rölativistik Ağır İyon Çarpıştırıcı |
1 TK | 1 trilyon °C | 3×10-6 nm (gama ışınları) |
| CERN'in protonuna karşı çekirdek çarpışmaları |
10 TK | 10 trilyon °C | 3×10-7 nm (gama ışınları) |
| Evren 5.391×10-44 s Büyük Patlama'dan sonra |
1.417×1032 K (Planck sıcaklığı) |
1.417×1032 °C | 1.616×10-27 nm (Planck uzunluğu) |
- A Termodinamik sıcaklığın iki noktalı tanımına göre kalibre edildiğinde bir standart atmosferdeki (101,325 kPa) Viyana Standart Ortalama Okyanus Suyu için.
- B 2500 K değeri yaklaşıktır. K ve °C arasındaki 273,15 K fark, Celsius değerinde yanlış hassasiyeti önlemek için 300 K'ye yuvarlanmıştır.
- C Gerçek bir kara cisim için (ki tungsten filamentler değildir). Tungsten filament emisivitesi daha kısa dalga boylarında daha yüksektir, bu da daha beyaz görünmelerini sağlar.
- D Etkin fotosfer sıcaklığı. K ve °C arasındaki 273,15 K fark, Santigrat değerinde yanlış hassasiyeti önlemek için 273 K'ye yuvarlanmıştır.
- E K ve °C arasındaki 273,15 K fark bu değerlerin hassasiyeti dahilindedir.
- F Gerçek bir kara cisim için (ki plazma öyle değildi). Z makinesinin baskın emisyonu plazma içindeki 40 MK elektronlardan (yumuşak x-ışını emisyonları) kaynaklanmaktadır. ⓘ
Sıcaklık skala karşılaştırması
| Yorum | Kelvin | Celsius | Fahrenheit | Rankine | Delisle | Newton | Réaumur | Rømer ⓘ |
|---|---|---|---|---|---|---|---|---|
| Mutlak sıfır | 0 | -273.15 | -920.34 | 0 | ||||
| Dünya'da kaydedilen en düşük yüzey sıcaklığı (Vostok İstasyonu - 21 Temmuz 1983) |
184 | −89 | −128.2 | 331.47 | 283.5 | −29.37 | −71.2 | −39.225 |
| Celsius / Fahrenheit'ın "cross-over" sıcaklığı | 233.15 | −40 | –40 | 419.67 | . | . | . | . |
| Fahrenheit'ın buz/tuz karışımı | 255.37 | −17.78 | 0 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 |
| Ice melts (sıcaklık ve basınç için standart koşullarda) | 273.15 | 0 | 32 | 491.67 | 150 | 0 | 0 | 7.5 |
| Ortalama yüzey sıcaklığı Dünya'da | 288 | 15 | 59 | 518.67 | 127.5 | 4.95 | 12 | 15.375 |
| İnsan vücudu ortalama sıcaklığı¹ | 309.95 | 36.8 | 98.24 | 557.91 | 94.8 | 12.144 | 29.44 | 26.82 |
| Dünya'da kaydedilen en yüksek yüzey sıcaklığı (El-Aziziye, Libya - 13 Eylül 1922) |
331 | 58 | 136.4 | 596.07 | 63 | 19.14 | 46.4 | 37.95 |
| Suyun kaynaması (sıcaklık ve basınç için standart koşullarda) | 373.1339 | 99.9839 | 211.97102 | 671.64102 | 0 | 33 | 80 | 60 |
| Titanium Erimesi | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Güneş'in yüzeyinde | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |














































