Virüs
| Virüs ⓘ | |
|---|---|
| |
| SARS-CoV-2, Coronavirinae alt ailesinin bir üyesi | |
| Virüs sınıflandırması | |
| (sırasız): | Virüs |
| Diyarlar | |
| |
Virüs, yalnızca bir organizmanın canlı hücreleri içinde çoğalan mikroskobik olmayan bulaşıcı bir ajandır. Virüsler, hayvanlar ve bitkilerden bakteriler ve arkeler dahil mikroorganizmalara kadar tüm yaşam formlarını enfekte eder. Dmitri Ivanovsky'nin 1892'de tütün bitkilerini enfekte eden bakteriyel olmayan bir patojeni tanımladığı makalesinden ve 1898'de Martinus Beijerinck tarafından tütün mozaik virüsünün keşfinden bu yana, çevredeki milyonlarca virüs türünden 9.000'den fazlası ayrıntılı olarak tanımlanmıştır. Virüsler Dünya üzerindeki hemen hemen her ekosistemde bulunur ve en çok sayıdaki biyolojik varlık türüdür. Virüslerin incelenmesi, mikrobiyolojinin bir alt uzmanlık alanı olan viroloji olarak bilinir. ⓘ
Bir konak hücre enfekte olduğunda, genellikle orijinal virüsün binlerce kopyasını hızla üretmek zorunda kalır. Virüsler, enfekte olmuş bir hücrenin içinde değilken veya bir hücreyi enfekte etme sürecindeyken, (i) genetik materyal, yani virüsün etki ettiği proteinlerin yapısını kodlayan uzun DNA veya RNA molekülleri; (ii) genetik materyali çevreleyen ve koruyan bir protein kılıfı, kapsid; ve bazı durumlarda (iii) lipitlerden oluşan bir dış zarf içeren bağımsız parçacıklar veya virionlar şeklinde bulunurlar. Bu virüs partiküllerinin şekilleri basit sarmal ve ikozahedral formlardan daha karmaşık yapılara kadar değişmektedir. Çoğu virüs türünün viryonları optik mikroskopla görülemeyecek kadar küçüktür ve çoğu bakterinin yüzde biri büyüklüğündedir. ⓘ
Yaşamın evrimsel tarihinde virüslerin kökenleri belirsizdir: bazıları plazmidlerden (hücreler arasında hareket edebilen DNA parçaları) evrilmiş olabilirken, diğerleri bakterilerden evrilmiş olabilir. Evrimde virüsler, eşeyli üremeye benzer bir şekilde genetik çeşitliliği artıran önemli bir yatay gen transferi aracıdır. Virüsler bazı biyologlar tarafından bir yaşam formu olarak kabul edilir, çünkü genetik materyal taşırlar, çoğalırlar ve doğal seçilim yoluyla evrimleşirler, ancak hücre yapısı gibi genellikle yaşamı tanımlamak için gerekli kriterler olarak kabul edilen temel özelliklerden yoksundurlar. Bu özelliklerin hepsine olmasa da bazılarına sahip oldukları için virüsler "yaşamın sınırındaki organizmalar" ve çoğaltıcılar olarak tanımlanmıştır. ⓘ
Virüsler birçok yolla yayılır. Bulaşma yollarından biri vektör olarak bilinen hastalık taşıyan organizmalar aracılığıyla gerçekleşir: örneğin, virüsler genellikle yaprak bitleri gibi bitki özsuyuyla beslenen böcekler tarafından bitkiden bitkiye bulaştırılır; ve hayvanlardaki virüsler kan emici böcekler tarafından taşınabilir. İnfluenza virüsleri, SARS-CoV-2, suçiçeği, çiçek ve kızamık dahil olmak üzere birçok virüs öksürme ve hapşırma yoluyla havaya yayılır. Viral gastroenteritin yaygın nedenleri olan norovirüs ve rotavirüs, fekal-oral yolla, elden ağza temasla veya yiyecek ya da su ile bulaşır. İnsanlarda enfeksiyon oluşturmak için gereken bulaşıcı norovirüs dozu 100 partikülden daha azdır. HIV, cinsel temas ve enfekte kana maruz kalma yoluyla bulaşan çeşitli virüslerden biridir. Bir virüsün enfekte edebileceği konak hücrelerin çeşitliliğine "konak aralığı" denir. Bu, bir virüsün birkaç türü enfekte edebildiği anlamına gelen dar veya birçok türü enfekte edebildiği anlamına gelen geniş olabilir. ⓘ
Hayvanlardaki viral enfeksiyonlar, genellikle enfekte eden virüsü ortadan kaldıran bir bağışıklık tepkisine neden olur. Bağışıklık tepkileri, spesifik viral enfeksiyona karşı yapay olarak edinilmiş bir bağışıklık sağlayan aşılar tarafından da üretilebilir. HIV/AIDS, HPV enfeksiyonu ve viral hepatite neden olanlar da dahil olmak üzere bazı virüsler bu bağışıklık yanıtlarından kaçar ve kronik enfeksiyonlara neden olur. Çeşitli antiviral ilaç sınıfları geliştirilmiştir. ⓘ
Etimoloji
Kelime, zehir ve diğer zararlı sıvılara atıfta bulunan Latince nötr vīrus'tan, Sanskritçe viṣa, Avestan vīša ve eski Yunanca ἰός (hepsi 'zehir' anlamına gelir) ile aynı Hint-Avrupa temelinden, ilk olarak 1398'de John Trevisa'nın Bartholomeus Anglicus'un De Proprietatibus Rerum çevirisinde İngilizce olarak onaylanmıştır. Virulent, Latince virulentus ('zehirli') kelimesinden gelmektedir ve yaklaşık 1400 yılına tarihlenmektedir. 'Bulaşıcı hastalığa neden olan ajan' anlamı ilk olarak 1728 yılında, 1892 yılında Dmitri Ivanovsky tarafından virüslerin keşfinden çok önce kaydedilmiştir. İngilizce çoğul viruses (bazen vira) iken, Latince kelime klasik olarak çoğulu bulunmayan bir kitle ismidir (Neo-Latince'de vīra kullanılır). Viral sıfatı 1948 yılına aittir. Virion (çoğul virionlar) terimi de 1959'dan beri, hücreden salınan ve aynı tipteki diğer hücreleri enfekte edebilen tek bir viral partikülü ifade etmek için kullanılmaktadır. ⓘ
Tarihçe

Louis Pasteur kuduz için bir nedensel ajan bulamadı ve bir mikroskop kullanılarak tespit edilemeyecek kadar küçük bir patojenle ilgili spekülasyonlar yaşandı. 1884'te, Fransız mikrobiyolog Charles Chamberland, bakteriden daha küçük gözeneklere sahip olan filtreyi icat etti (günümüzde Chamberland filtresi ya da Chamberland-Pasteur filtresi olarak bilinir). Böylece, bakteri içeren bir çözeltiden bakteriler tamamıyla ayrıştırılabildi. 1892'de, Rus biyolog Dmitriy İvanovskiy şimdiki tütün mozaik virüsü olarak bilinen virüsü incelemek için bu filtreyi kullandı. Deneylerinde enfekte tütün bitkilerinin ezilmiş yapraklarından elde edilen çözeltilerin süzülmesi sonucunda süzülen sıvıda etkenlerin süzülmeden kaldığını gözlemledi. Ivanovsky enfeksiyonun bakteriler tarafından üretilen bir toksin tarafından meydana geldiğini öne sürdü, ancak bu düşüncesini sürdürmedi. O zamanlar tüm enfeksiyöz ajanların filtreler tarafından süzülebildiği ve üretilme ortamlarında üreyebildikleri düşünülmekteydi – Bu düşünce hastalık yapıcı mikrop teorisinin bir parçasıydı. 1898'de, Hollandalı mikrobiyolog Martinus Beijerinck bu deneyleri tekrarladı ve süzülmüş çözeltinin enfeksiyöz ajanların yeni bir formunu içerdiğine ikna oldu. Bu ajanların sadece bölünebilen hücrelerde çoğaldıklarını gözlemledi ancak bu deney sonucunda hastalık oluşturan partikülleri göremedi, ajanlara contagium vivum fluidum (çözünür canlı mikroplar) adını verdi ve sonra virüs olarak yeniden adlandırıldı. Beijerinck virüslerin doğada sıvı olarak bulunduğunu savunmuştur, daha sonra bu teori virüslerin partikül olduğunu düşünen Wendell Stanley tarafından düşürülmüştür. Aynı yıl içinde Friedrich Loeffler ve Paul Frosch ilk hayvan virüsü olan şap hastalığı virüsünü tescillediler. ⓘ
20. yüzyılın başlarında, İngiliz bakteriyolog Frederick Twort, şimdilerde bakteriyofaj (ya da sadece faj) denilen ve bakterileri enfekte eden virüs gruplarını keşfetti. Fransız-Kanadalı mikrobiyolog Félix d'Herelle, besiyerindeki bakterilere süspansiyon şeklinde eklendiğinde onları öldüren virüsları tanımladı. Bu süspansiyonları seyrelterek en yüksek seyreltmeyi keşfetti (en düşük virüs konsantrasyonları), tüm bakterilerin ölmesinden ziyade, ölü organizmaların oluşturduğu alanları gözlemledi. Bu alanları sayma ve seyreltme faktörü ile çarparak orijinal süspansiyondaki virüslerin sayısını hesaplamaya çalıştı. Fajlar tifo ve kolera gibi hastalıkların olası tedavisi gibi takdim edildi, ancak penisilinin geliştirilmesi ile bir kenara bırakıldılar. Faz çalışmaları, genlerin açılıp kapanma mekanizmalarını ve yabancı genlerin bakteri hücrelerine aktarılmaları için kullanışlı bir mekanizmayı anlamayı destekledi. ⓘ
19. yüzyılın sonlarında virüsler, enfeksiyonları, filtrelerden geçebilmeleri ve yaşamaları için konağa gereksinim duymaları bakımından tanımlanmışlardır. Virüsler sadece bitki ve hayvanlarda üretilebilmişlerdi. 1906'da, Ross Granville Harrison lenf dokusu yetiştirmek için bir yöntem icat etti ve 1913'te E. Steinhardt, C. Israeli, ve R. A. Lambert, gine domuzu kornea dokusu parçalarında Vaccinia virüsü üretme amacıyla bu metodu kullandı. 1928'de, H. B. Maitland ve M. C. Maitland, kıyılmış tavuk böbreği süspansiyonunda vaccinia virüsü ürettiler. Bu metotlar 1950'lerde aşı üretimi için büyük ölçekte poliovirüs üretilene kadar geniş ölçüde kabul edilmediler. ⓘ
Diğer bir atılım 1931'de geldi, Amerikan patologlar Ernest William Goodpasture ve Alice Miles Woodruff influenzavirüs ve bazı diğer virüsleri döllenmiş tavuk yumurtasında ürettiler. 1949'da, John Franklin Enders, Thomas Weller ve Frederick Robbins insan embriyo hücre kültüründe poliovirüs ürettiler ve böylece sağlam hayvan dokuları ve embriyonlu yumurta dışında virüs üretilmiş oldu. Bu çalışma etkili polio aşısı üretmek için Jonas Salk tarafından yapıldı. ⓘ
Virüslerin ilk görüntüleri, Alman mühendisler Ernst Ruska ve Max Knoll tarafından 1931'de elektron mikroskobunun icadı üzerine elde edildi. 1935'te, Amerikan biyokimyacı ve virolog Wendell Meredith Stanley tütün mozaik virüsü ile ilgili çalışmalar yaptı ve çoğunlukla protein yapılardan oluştuğunu buldu. Kısa bir süre sonra, virüsler proteinler ve RNA parçalarına ayrıştırıldılar. Tütün mozaik virüsü ilk kez kristalize edildi ve yapısı bu nedenle ayrıntılı olarak tarif edilebildi. Kristalize virüsün ilk X ışını kristalografisi görüntüleri Bernal ve Fankuchen tarafından 1941'de elde edildi. Bu görüntüleri temel alan Rosalind Franklin 1955 yılında virüsün tam yapısını keşfetti. Aynı yıl içinde, Heinz Fraenkel-Conrat ve Robley Williams saflaştırılmış tütün mozaik virüsünün RNA ve protein kapsidinin kendi kendine birleşip fonksiyonel virüs formunu oluşturabildiğini gösterdi, bu basit mekanizmanın muhtemelen virüsler tarafından konak hücre içinde oluşturulduğu düşünüldü. ⓘ
20. yüzyılın ikinci yarsında virüs keşfi altın çağını yaşadı ve bu yıllarda 2000'den fazla hayvan, bitki ve bakteri virüsü türü keşfedildi. 1957'de, atların viral arteritine yol açan equine arterivirüs ve sığır viral diyare virüsü (bir pestivirüstür) keşfedildi. 1963'te, hepatit B virüsü Baruch Blumberg tarafından keşfedildi, ve 1965'te, Howard Temin ilk retrovirüsü tanımladı. Ters transkriptaz enzimi retrovirüsler tarafından kendi RNA'larından DNA kopyalamada kullanılır ve ilk kez birbirinden bağımsız olarak Howard Martin Temin ve David Baltimore tarafından 1970'te tanımlanmıştır. 1983'te Luc Montagnier'in takımı Fransada Pasteur Enstitüsünde, şimdilerde HIV olarak bilinen retrovirüsü ilk kez izole ettiler. ⓘ
Canlılık tartışması
Virüsler ve canlı hücreler, DNA veya RNA, ve proteinler gibi ortak bileşiklere sahiptirler. Lakin biyokimyacı Wendel Stanley'nin tanımına göre virüsler biyolojik moleküllerden "basit" oluşumlardır. Organik moleküllerin kendi kendilerine yapısallaşma özeliklerinin bir sonucudurlar ve dolayısıyla canlı sayılmazlar. François Jacob da virüsler hakkında "bir kültür ortamına yerleştirildiklerinde virüslerin bir metabolik faaliyeti yoktur, enerjiyi ne üretebilirler ne de kullanabilirler, ne büyür ne çoğalabilirler, canlıların bu ortak özelliklerinden hiçbiri yoktur onlarda" der. Virüsler ancak canlı bir hücrenin enzimlerini kullanarak çoğalabilirler. Ayrıca, virüsler DNA veya RNA'dan birine sahip olsalar da, canlı hücrelerde olduğu gibi bunların ikisi birden yoktur. ⓘ
Öte yandan son yıllarda yapılan yeni keşifler virüslerin canlılığı hakkındaki tartışmayı yeniden gündeme getirmiştir. Amipleri enfekte eden Mimivirüsün 1200 geni vardır, ki bu rakam bazı bakterilerin gen sayısından daha fazladır. Bu virüslerin genleri arasında normalde virüslerde bulunmayan, canlı hücrelerde bulunan 30 kadar gen vardır, örneğin protein sentezi ve DNA tamirinden sorumlu enzimleri kodlayan genler. ⓘ
Virüslerin canlı olup olmadığı tartışması sürmektedir. Sorunun cevaplandırılması için "hayat nedir?" sorusunun cevabı gerekmektedir. Zooloji ve botaniğe dayalı kıstaslara göre virüsler canlı değildir. Ancak, bu çıkarım canlı olduğu kabul görmüş varlıkların özelliklerinden genelleme yaparak elde edilmiştir ve yıllar boyunca keşfedilmiş, gittikçe daha küçük canlı türlerini göz önüne alarak sürekli değiştirilmiş tanımlara dayalıdır. Eğer hayat temel ilkelere göre tanımlanırsa, canlılığın en temel kıstası çoğalma yeteneğidir. Virüsler çoğalabildiklerine göre canlı oldukları, veya konak hücreler olmadan çoğalamadıkları için canlı olmadığı iddia edilebilir. Öte yandan pek çok canlı da diğer canlıların ürettiği gıdalar olmadan ne büyüyebilir ne çoğalabilir. Virüslerin canlı olup olmadığı kullanılan hayat tanımına bağlıdır. ⓘ
Hayatı yahut canlılığı tanımlarken Alman bilim adamı Hoimar von Ditfurth şu yorumu yapmıştır: "Amerikalı biyokimyacı ve Nobel Ödülü sahibi Melvin Calvin'in bilimsel bir yazısından aktarılmış 'canlılık:düzenli enerji dönüştürme mekanizmasına ilişkin bilgiyi başka bir özdeş sisteme aktarabilme yeteneği' tanımı, içinden çıkılmazlığıyla aslında sorunun güçlülüğünü ortaya koyuyor. Canlı olmayan ile canlı olanı birbirinden ayırt etmeye kalkışmak, aslında doğaya kendisinde bulunmayan bir duruma ilişkin dıştan bir 'müdahale' ve bu müdahaleye bağlı bir kavram getirme anlamına gelmektedir. Gerçekten de böyle bir girişim doğaya kendisinin tanımadığı sınırları yerleştirmekle eş anlamlıdır. Aslında bu türden sınırların gerçekte karşılığı bulunmayan yapay sınırlar oldukları kesindir. Doğanın o sayısız olayları ve süreçleri karşısında derli toplu bir bakış edinebilmek ve kolaylık sağlayıcı sınıflandırmalar yapabilmek için doğaya dıştan aklın bulunduğu ayırıcı çizgiler yerleştirmek, Dünya'yı gerçekte bulunmayan enlem ve boylam çizgilerine bölmekten hiç farklı değildir. Yön bulmamıza yardımcı olan ve coğrafî alanlar ya da noktalarda nereleri kastettiğimizi kolaylıkla belirtmemizi sağlayan haritalar üzerindeki bu kavramsal çizgileri hiç kimsenin kalkıp da söz konusu bölgelerin doğal bir özelliğini algılayabileceği gibi, bu çizgileri de o bölgelerde aramak kimsenin aklına gelmeyecektir." ⓘ
Kökenleri
Virüsler hayatın olduğu her yerde bulunurlar ve canlı hücrelerin ilk geliştiği andan beri muhtemelen virüsler de vardı. Virüslerin kökenleri bilinmemektedir çünkü fosil formları bulunmamaktadır, virüslerin kökenlerini bulabilmek için DNA ve RNA karşılaştırmasını kullanan moleküler teknikler uygulanmıştır. Ek olarak, viral genetik materyal bazen konak hücredeki gen bölgelerine entegre olabilir, bu yolla virüs genomu nesiller boyu dikey olarak aktarılabilir. Bu bilgiler milyon yıllar önceki antik virüslerin izini sürmeye çalışan paleovirologlar için pahabiçilemezdir. Şu anda, Virüslerin kökenini açıklamaya çalışan üç ana hipotez vardır:
- Gerileme hipotezi
- Virüsler bir zamanlar, şimdiki boyutlarından büyük parazitik küçük hücreler olabilirler. Zamanla, parazitlik için gerekli olmayan genlerini kaybetmiş olabilirler. Rickettsia ve chlamydia bakterileri tıpkı virüsler gibi canlı hücrelerde yaşayabilirler ve sadece konak hücrelerde çoğalabilirler. Parazit yaşamı benimsemiş canlıların yaşamlarını ve bağımlılıklarını kodlayan genler dışındaki gereksinim duymadıkları genleri hücre dışında atıp kaybetmiş olabilme ihtmali bu hipotezi desteklemektedir. Bu aynı zamanda dejenerasyon hipotezi ya da azalma hipotezi olarak da adlandırılır.
- Hücresel kökenli hipotezi
- Bazı virüsler kendilerinden daha yüksek organizma hücrelerinden kaçan DNA ya da RNA parçalarından evrimleşmiş olabilirler. Kaçan DNA'lar plasmidlerden (hücreler arasında hareket edebilen çıplak DNA parçaları) ya da transpozonlardan (hücre içindeki gen bölgelerinde farklı konumlara hareket edebilen ve kopyalanabilen DNA molekülleri) gelmiş olabilirler. Bir zamanlar "atlayan genler" denen transpozonlar hareketli genetik materyallerin örnekleridir ve bazı virüslerin kökeni olabilir. Barbara McClintock tarafından 1950 yılında mısır bitkisinde keşfedildiler. Bu hipotez bazen serserilik hipotezi, ya da kaçış hipotezi olarak da adlandırılır. ⓘ
- Birlikte evrim hipotezi ⓘ
- Ayrıca ilk-virüs hipotezide denmektedir ve virüslerin ilk hücrelerin ortaya çıkmasından bu yana hücresel yaşama bağımlı olarak milyonlarca yıl boyunca karmaşık protein ve nükleik asit komplekslerinden evrimleştiğini önermektedir. RNA'dan oluşan Viroidlerler virüs olarak sınıflandırılmamışlardır çünkü viroidleri saran protein bir kılıf yoktur ancak, birkaç virüse benzeyen karakteristik özelliklerinden dolayı sık sık subviral ajanlar olarak adlandırılırlar. Viroidler bitkiler için önemli hastalık etkenleridir. Protein kodlamamalarına karşın konak hücre ve konak hücre mekanizmalarıyla etkileşime girerek replike olurlar. RNA genomuna sahip insan hepatit delta virüsü viroidlere benzer fakat hepatit B virüslerinde bir protein kılıf elde eder ama kendisi bu kılıfı replike ettiremezler, bu nedenle bu etkene defektif virüsdenmektedir. Bunun yanında hepatit delta virüsü konak hücreye girebilirse, bağımsız olarak replike olabilir. Replike olan hepatit delta virüsleri da defektiftir ve yeni hücreleri enfekte edebilmeleri için hepatit B virüsünün protein kılıfına gereksinim duyar. Aynı davranış, uydu virofajında da mevcuttur, bunlar Acanthamoeba castellanii türü protozoonları enfekte eden mimivirüslere bağımlıdırlar. Bu virofaj, diğer virüs türlerinin konak hücrede aynı anda bulunmasına gereksinim duyar, bunlara uydu denilir ve viroidlerin ve virüslerin evrimsel ara ürünleri temsil edebileceği düşünülmektedir.
Geçmişte, bu hipotezlerin hepsi ile ilgili sorunlar vardı: en küçük hücresel parazitlerin bile virüslere benzememesi nedeniyle gerileme hipotezi açıklanmakta zorlanılmıştır. Kaçış hipotezinde, karmaşık kapsidlerin, virüslerin diğer parçacıklarının ve yapılarının nasıl oluştuğunun açıklaması yapılamamıştır. Birlikte evrim hipotezinde de virüslerin konak hücre gereksinimlerini açıklayamamıştır. Şimdilerde virüslerin antik ve üç üst alemin tarih öncesi bir ayrışımına ait oldukları kabul edilmektedir. Bu keşif modern virologları tekrar düşünmeye ve klasik üç üst alem hipotezini yeniden değerlendirmeye sevketmiştir. ⓘ
RNA dünyası hipotezi, virüslerin bilgisayar analizi ve konak DNA dizileri, farklı virüsler arasındaki evrimsel ilişkileri daha iyi anlamamızı sağlar ve modern virüslerin atalarını belirlemenize yardımcı olabilir. Günümüzde, analizler herhangi bir hipotezi doğrulamamaktadır. Ancak, tüm bilinen virüsler ortak bir atası var zor görünüyor, ve muhtemelen virüsler geçmişte farklı farklı mekanizmalar ile birçok kez ortaya çıkmışlardır. ⓘ
Prionlar DNA ya da RNA barındırmayan infeksiyöz protein molekülleridir. Koyunlardaki scrapie gibi enfeksiyöz hastalıklara neden olurlar, sığırlarda bovin spongiform ensefalopati ("deli dana hastalığı"), ve geyiklerde kronik halsizlik hastalığı; insanlarda, prionik hastalıklar "gülme hastalığı" olarak da bilinen Kuru hastalığı, Creutzfeldt–Jakob hastalığı, ve Gerstmann–Sträussler–Scheinker sendromu. Prionlar temelde viroidlerden ve virüslerden farklı olamasına rağmen keşfedilemeleri, virüslerin kendini kopyalayan moleküllere evrimleşmiş olduğu teorisini destekler. ⓘ
Sınıflandırma
Sınıflandırma, virüsleri benzerliklerine göre isimlendirerek ve gruplandırarak çeşitliliğini tanımlamaya çalışır. 1962 yılında André Lwoff, Robert Horne ve Paul Tournier, Linnaean hiyerarşik sistemine dayanan bir virüs sınıflandırma aracı geliştiren ilk kişiler olmuştur. Bu sistem sınıflandırmayı filum, sınıf, takım, familya, cins ve türe dayandırıyordu. Virüsler, ortak özelliklerine (konakçılarının özelliklerine değil) ve genomlarını oluşturan nükleik asit türüne göre gruplandırılmıştır. 1966 yılında Uluslararası Virüs Taksonomisi Komitesi (ICTV) kurulmuştur. Lwoff, Horne ve Tournier tarafından önerilen sistem başlangıçta ICTV tarafından kabul edilmemiştir çünkü virüslerin küçük genom boyutu ve yüksek mutasyon oranları, sıralamanın ötesinde atalarını belirlemeyi zorlaştırmıştır. Bu nedenle, Baltimore sınıflandırma sistemi daha geleneksel hiyerarşiyi tamamlamak için kullanılmaya başlanmıştır. 2018'den itibaren ICTV, zaman içinde keşfedilen virüsler arasındaki daha derin evrimsel ilişkileri kabul etmeye başladı ve alemden türe kadar uzanan 15 sıralı bir sınıflandırma sistemini benimsedi. Ek olarak, aynı cins içindeki bazı türler bir genogrup içinde gruplandırılmıştır. ⓘ
UAVTK sınıflandırması
Şu andaki sınıflandırmayı Uluslararası Virüs Taksonomisi Komitesi geliştirdi ve aile bütünlüğünü korumak için virüs ailelerinin özelliklerine ağırlık veren bir rehber yayınladı. virüsleri sınıflandırmak için uluslararası birleşik bir taksonomi kuruldu. 9. UAVTK raporunda viral taksonların dallanma hiyerarşisinde en düşük takson grubu olarak virüs türü kavramı tanımlanmıştır. Ancak günümüzde virüsleri ve virüs çeşitliliğinin sadece çok küçük bir bölümü incelenmiştir. ⓘ
Genel taksonomik yapı aşağıdaki gibidir:
- Takım (-virales)
- Aile (-viridae)
- Alt aile (-virinae)
- Cins (-virus)
- Tür (-virus)
- Cins (-virus)
- Alt aile (-virinae)
- Aile (-viridae)
Mevcut (2013) UAVTK taksonomisi, 7 takımdan oluşur, Caudovirales, Herpesvirales, Ligamenvirales, Mononegavirales, Nidovirales, Picornavirales, and Tymovirales. Komite alt tür, suş ve izolatlar arasında resmi bir ayrım yapmamaktadır. Toplamda 7 takım, 103 aile, 22 alt aile, 455 cins, 2,827 civarında tür vardır ve 4,000'den fazla tip henüz sınıflandırılmamıştır. ⓘ
Baltimore sınıflandırması

Nobel ödüllü biyolog David Baltimore, Baltimore sınıflandırma sistemini geliştirmiştir. UAVTK sınıflandırma sistemini, modern sınıflandırma sistemleri ve Baltimore sınıflandırma sistemini bağdaştırarak yapmıştır. ⓘ
Baltimore sınıflandırması viral mRNA sentezini temel alan bir sınıflandırmadır Virüsler genelde genomlarıyla sentez ettirdikleri proteinleri kullanarak kendilerini replike ettirirler. Viral genom çift iplikçikli (çi) veya tek iplikçikli (ti) olabileceği gibi DNA ya da RNA da olabilir, bazı virüslerde ters transkriptaz enzimi varken bazılarında da bu enzim yoktur. Ek olarak tiRNA virüsleri pozitif yönelimli ya da negatif yönelimli olabilirler, pozitif yönelimli virüslerin genomlarına enfektif genom denmektedir. Bu sınıflandırma virüsleri yedi grupta toplamıştır: Bu gruplar aşağıdaki gibidir:
|

|
Yaşam özellikleri
Virüslerin bir yaşam formu mu yoksa canlı organizmalarla etkileşime giren organik yapılar mı olduğu konusunda bilimsel görüşler farklılık göstermektedir. Genlere sahip olmaları, doğal seçilim yoluyla evrimleşmeleri ve kendi kendine bir araya gelme yoluyla kendilerinin birden fazla kopyasını oluşturarak çoğalmaları bakımından organizmalara benzedikleri için "yaşamın sınırındaki organizmalar" olarak tanımlanmışlardır. Genlere sahip olmalarına rağmen, genellikle yaşamın temel birimi olarak görülen hücresel bir yapıya sahip değildirler. Virüslerin kendi metabolizmaları yoktur ve yeni ürünler üretmek için bir konak hücreye ihtiyaç duyarlar. Bu nedenle doğal olarak bir konak hücre dışında üreyemezler - riketsiya ve klamidya gibi bazı bakteriler de aynı sınırlamaya rağmen canlı organizmalar olarak kabul edilirler. Kabul edilen yaşam biçimleri çoğalmak için hücre bölünmesini kullanırken, virüsler hücreler içinde kendiliğinden bir araya gelir. Doğal seçilime tabi olurken genetik mutasyonları miras aldıkları için kristallerin otonom büyümesinden farklıdırlar. Virüslerin konak hücreler içinde kendiliğinden bir araya gelmesi, yaşamın kendi kendine bir araya gelen organik moleküller olarak başlamış olabileceği hipotezine daha fazla güven kazandırdığından, yaşamın kökeni üzerine yapılan çalışmalar açısından önemli sonuçlar doğurmaktadır. ⓘ
Yapıları

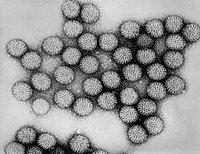
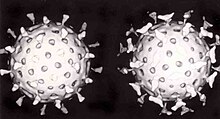
Virüsler morfoloji denilen şekil ve boyutları bakımından farklılıklar gösterirler. Genellikle bakterilerden çok küçüktürler. İncelenen virüslerin çoğunluğu 20 ila 300 nanometre çapa sahiptirler Bazı filovirüslerin çapları yaklaşık 80 nm iken uzunlukları toplamda 1400 nm'ye kadar çıkmaktadır. Çoğu virüs optik mikroskopla görülemez, bu yüzden taramalı ve geçirimli elektron mikroskobu virionları görselleştirmek için kullanılır. Virüs ile arka plan arasındaki kontrastı arttırmak için, elektron - yoğun " boyama" kullanılır. Bu boyalar tungsten gibi ağır metallerden yapılmış tuz solusyonlarıdır, bu boya ile boyanmış yerler elektonla kaplanır. Virionlar boya ile kaplandığında (pozitif boyama), ince ayrıntılar belirsizleşir. Negatif boyamada sadece arka planın boyanması ile bu sorun giderilebilir. ⓘ
Bir virüs türüne özgü yapıların tümünü bir arada bulunduran tek bir virüs partikülüne virion denmektedir. Viral genom tarafından kodlanan ve kapsomer adı verilen alt ünite proteinlerin bir araya gelmesiyle kapsid oluşmuştur ve kapsidin şekli virüsun morfolojik ayrımında kullanılır. Virüsler konak hücre zarından kendilerine "zarf" adı verilen ve kapsidi çevreleyen lipit bir dış zar oluşturabilirler. Virüs tarafından kodlanan protein alt-üniteleri özerk olarak birleşerek, içinde genellikle virüs genomunu barındıran kapsidi oluştururlar. Kapsid yapılarına yardımcı proteinler için virüslerde karmaşık kodlar vardır. nükleik asit ile ilgili proteinler nükleoproteinler şekilde bilinmektedir ve viral nükleik asit ile viral kapsid proteinlerinin birlikte bulunduğu yapı nükleokapsid olarak adlandırılır. Kapsid ve tüm virüs yapısı atomik kuvvet mikroskobu aracılığıyla mekanik (fiziksel) olarak derinlemesine incelenebilir. Genel olarak, dört ana morfolojik virüs türü vardır: ⓘ
Virüs morfolojileri
Virüslerin morfolojilerini çeşitli faktörler etkilemektedir, bunların en önemlisi kapsid ve zarf yapılarıdır.
- Sarmal simetri
- Bu virüsler, merkezinde bir oyuk veya tüp olacak şekilde sarmal simetri meydana getiren ve bir eksen etrafında birleşmiş tek tip kapsomerlerden oluşur. Bu düzen, çubuk veya lif şeklinde virionlarla sonuçlanır: Bu virionlar kısa ve son derece sert ya da uzun ve çok esnek olabilir. Genetik materyal genellikle tek iplikçikli RNA'dır fakat bazılarında tek iplikçikli DNA bulunur. Negatif yüklü nükleik asitler, pozitif yüklü proteinlerin etkileşimi ile protein sarmalın içine girer. Genel olarak virion uzunluğu nükleik asidin çapına ve virion çapı ve dizilimine bağlıdır. İyi çalışılmış tütün mozaik virüsü bir sarmal virüs örneğidir. ⓘ
- Kübik simetri
- Birçok hayvan virüsü kübik ya da küresele yakın kiral ikozahedral simetridedirler. Özdeş alt birimlerden kapalı bir kabuk oluşturmanın en iyi yolu düzenli bir ikozahedron yapısıdır. Bu yapıda her biri beş özdeş alt birimden oluşan asgari 12 adet özdeş kapsomer gereklidir. Rotavirüs gibi birçok virüs, 12'den fazla kapsomer bulundurur ve küresel görünmelerine rağmen kübik simetrilerini korurlar. Kapsomerlerin uçlarını kuşatan ve pentamer adı verilen 5 diğer kapsomerle çevrilidir. Kapsomerlerin üçgen yüzeylerini kuşatan hekzonlar adı verilen. Hexons are in essence flat and pentons, which form the 12 vertices, are curved. The same protein may act as the subunit of both the pentamers and hexamers or they may be composed of different proteins. ⓘ
- Yayvan simetri
- Bu beş katlı eksen boyunca uzatılmış ve bakteriyobaj başlarının genel bir düzenidir. Bu yapı her iki ucunda silindirik bir kapatan oluşur. ⓘ
- Karmaşık simetri
- Bu virüsler ne tamamen sarmal ne tamamen kübik bir kapside sahiptirler ve kuyruk ya da dış duvar gibi ek yapılara sahiptirler. Bazı bakteriyofalar, Enterobacteria faj T4 gibi ikozahedrak bir baş, sarmal bir kuyruk, altıgen taban bir plağı ve çıkıntılı protein kuyruk fibrillerinden oluşan karmaşık bir yapıya sahiptir. Bu kuyruk yapısı moleküler şırınga gibi davranır, virüsun konak bakteriye tutunmasından sonra hücreye virüs genomunu enjekte eder. Yeni araştırmalarda viral genomun fajın baş kısmına basınçla sıkıştırıldığı ve faj konağa tutunduktan sonra basınçla konağın içine fışkırdığı düşünülmektedir bu nedenle enjeksiyon yerine ejeksiyon terimini kullanmaktadır. ⓘ
 Karmaşık simetrili bir bakteriyofaj şeması ⓘ |
Poksvirüsler büyük, karmaşık yapılı, alışılmadık morfolojiye sahip virüslerdir. Viral genom nukleoid olarak bilinen merkezi disk yapısında proteinlerle ilişkilidir; Nükleoid zar ve işlevi bilinmeyen iki adet yanal protein kütlesinden oluşur; Virüs protein yoğun bir tabaka ile çivili dış zara sahiptir; Tam virion oval bir tuğlaya benzeyen pleomorfik yapıya sahiptir. Mimivirüsler, 400 nm'lik kapsid çapları ile en geniş karakterdeki virüslerdendir, yüzeyden çıkan 100 nm boyutlarında iplikçikleri vardır; Kapsid muhtemelen ikozahedral yapıda olduğundan elektron mikroskobu altında altıgen şekilde görünür. 2011'de, araştırmacılar Şilinin Las Cruces kıyılarından toplanan okyanus dibinden alınan su örneklerinde bilinen en uzun virüs örneğini keşfettiler; Bazik optik mikroskopla görülenebilen bu virüsa geçici olarak Megavirüs chilensis adı verildi. 2013'te, Şili ve Avustralyada Megavirüs ve Mimivirüs'tan iki kat daha büyük genoma sahip Pandoravirüs cinsi keşfedildi. ⓘ
Arkeleri enfekte eden bazı virüsler diğer virüs şekillerinden bağımsız, iğ, çengel, çubuk, gözyaşı ve hatta şişe şeklinde çok çeşitli sıra dışı şekillerde kompleks yapıya sahiptirler. Kuyruklu bakteriyofajlara benzer ve çoklu kuyruk yapıları barındırabilen diğer arke virüsler de vardır. ⓘ
Genomlar
| Özellik | Karakteristik özellik ⓘ |
|---|---|
| Nükleik asit |
|
| Biçim |
|
| İplikçik yapısı |
|
| Anlam |
|
Genetik yapıların en muazaam çeşitleri virüs türleri arasında görülebilir; virüsler, bitkilerden, hayvanlarden, arkelerden ya da bakterilerden daha fazla genomik çeşitlilik barındırırlar. Yaklaşık 5.000 tür detaylı bir şekilde tarif edilmiş olmasına rağmen, farklı türde milyonlarca virüs mevcuttur. Eylül 2015 tarihi itibarıyla, NCBI Virüs Genomu Veritabanı 75.000 'den fazla tam genom dizisine sahiptir, kuşkusuz daha keşfedilmeyi bekleyen birçok çeşidi mevcut. ⓘ
Bir virüs DNA ya da RNA'dan sadece birini barındırabilir ve bu sebeple DNA veya RNA virüsu olarak adandırılır. Virüslerin büyük çoğunluğu RNA genomlarına sahiptir. ⓘ
Viral genom polyomavirüslerdaki gibi dairesel ya da adenovirüslerdeki gibi doğrusal olabilir. Nükleik asit türünün genomunun şekliyle alakası yoktur. RNA virüsleri ve bazı DNA virüsleri arasında genomu birkaç parçadan oluşmuş olanlar vardır, bu şekilde genoma sahip virüslera parçalı (segmentli) genoma sahip virüsler denir. RNA virüsleri için, her segment sadece bir protein kodlar ve genelde tüm segmentler aynı kapsidin içinde bulunur. Ancak, brom mozaik virüsü ve diğer çeşitli bitki virüslerinde olduğu gibi virüsun enfektif olması için her segmentin aynı virionda bulunmasına gerek yoktur. ⓘ
Bir viral genom, nükleik asit türü ne olursa olsun tek veya çift sarmallı olabilir. tek şeritli genomları çiftlenmemiş bir nükleik asitten oluşmaktadır, ortadan aşağı bölünmüş bir merdivenin yarısına benzer şekildedir. Çift sarmallı genomlar birbirini tamamlayan nükleik asit çiftlerinden oluşur. Bazı virüs ailelerinin virüs partikülleri, Hepadnaviridae ait olanlar gibi kısmen çift iplikçikli ve kısmen tek iplikçikli olan bir genom içerebilirler. ⓘ
Bazı RNA virüsleri pozitif yönelimli (pozitif polariteli), bazıları ise negatif yönelimli (negatif polariteli) virüsler olarak sınıflandırılır. Pozitif yönelimli viral RNA, viral mesajcı RNA ile aynı yönelimdedir ve böylece konak hücre tarafından kolayca okunabilir. Negatif yönelimli RNA virüslerinin RNA'sı viral mRNA'nın tamamlayıcısıdır ve RNA'ya bağımlı RNA polimeraz enzimine gereksinim duyarlar. ⓘ
Genom boyutu türler arasında büyük ölçüde değişir. En küçük viral genom – the tek iplikçikli DNA'ya sahip circovirüslerdir, Circoviridae ailesi– sadece iki proteini kodlar ve genom boyutu sadece iki kilobazdır; en büyük genom ise pandoravirüslerdedir–genom boyutu 2500e yakın proteini kodlayan iki megabaz civarındadır. ⓘ
Genelde, RNA virüslerı DNA virüslerinden daha küçük genoma sahiptirler çünkü RNa virüs replikasyonunda daha yüksek oranda hata yapılır ve bu hataların azami üst sınırı vardır. Kopyalanan genomdaki bu sınırın ötesinde yapılan hatalar nedeniyle virüs inaktif olur ya da rekabet yeteneğini kaybeder. Bunu telafi etmek için, RNA virüslerı parçalı genoma sahiptirler. Genom daha küçük moleküller halinde bölünür, bu sayede tek bileşenli genomunda oluşacak bir hatanın tüm genomu etkisiz hale getirmesi olasılığı azaltılır. Tersine, DNA virüslerinin replikasyon enzimleri yüksek oranda doğruluğa sahip olduklarından genellikle daha büyük genomlara sahiptirler. Tek sarmallı DNA virüsleri bu kuralın dışındadırlar, mutasyon oranları tek iplikçikli RNA virüslerine yakın b,ir oranda seyredebilir. ⓘ
Kapsid
Virüslerin yönetici molekülünü (genomunu) oluşturan DNA veya RNA'yı ve kor proteinlerini çevreleyerek dış etkilerden korur. Kapsit ayrıca virüse şeklini verir, kapsitteki proteinler virüsün hücreye tutunmasını sağlar ve dolayısıyla konak özgüllüğünü belirler. ⓘ
Viral zarf
- Bazı virüs türleri konak hücrenin zarlarından birisini modifiye ederek kendilerine bir dış zar oluştururlar, bu zar enfekte konak hücreyi çevreleyen zar, çekirdek zarı ya da endoplazmik retikulum gibi iç veya dış zar olabilmektedir. böylece virüs viral zarf denen çift tabakalı lipid zar kazanmış olur. Bu zarda viral genom ve konak hücre genomu tarafından kodlanan proteinler mevcuttur; lipid yapılar ve bazı karbonhidrat yapılarının tamamı zaten ilgili zarda bulunur ve konak hücre genomu tarafından kodlanır. Grip virüsü ve HIV bu stratejiyi kullanırlar. Zarflı virüslerin enfektivitesi zarflarının varlığına bağlıdır ve zarf yapıları zarar gördüğünde inaktif olurlar. ⓘ
Replikasyon döngüsü
|
Virüs nüfusu hücre bölünmesi yoluyla artmamaktadır çünkü virüsler birer hücre değillerdir. Bunun yerine, kendilerinin birden fazla kopyasını üretmek için bir konak hücrenin organellerini, moleküllerini ve metabolizmasını kullanırlar, konağa kendi parçalarını kopyalattırıp bu parçaları yine konakta birleştirirler. ⓘ
Virüslerin hayat döngüleri türlere göre farklılık gösterse de genelde altı temel aşamada gerçekleşir: Tutunma ⓘ
Konak hücre yüzeyindeki reseptörlerle viral kapsid üzerindeki veya viral zarf üzerindeki proteinlerin özgül (spesifik) bağlanması ile gerçekleşir. Bu özgüllük bir virüsün konak aralığını belirleyen faktörlerdendir. Örneğin, HIV'in konak aralığı insan akyuvar hücreleri ile sınırlıdır. Bunun nedeni HIV yüzey molekülü gp120, özgül olarak CD4 molekülü ile etkileşime girer ve CD4 molekülü sıklıkla CD4+ T-Hucrelerinde bulunur. Virüs konak hücreye tutunduktan sonra, konak hücre yüzeyinde çeşitli değişiklikler olur. ⓘ
Hücreye giriş ⓘ
Tutunmayı takip eder: Virion, reseptöre bağımlı endositoz ya da füzyon yolu ile konak hücreye girer. Bu genellikle viral giriş olarak adlandırılır. Bitki ve mantar hücrelerinin enfeksiyonu hayvan hücrelerininkinden farklıdır. Bitkiler selüllozdan ve mantarlar kitinden yapılmış sert bir hücre duvarına sahiptirler, çoğu virüs bitki ve mantarları hücre duvarlarının hasar görmesi sonucu enfekte eder. Ancak, neredeyse tüm bitki virüsleri (tütün mozaik virüsü gibi) tek iplikçikli nükleoprotein komplekslerinin içerisinde, plazmodezmata adlı gözenekler boyunca hücreden hücreye direkt olarak hareket ederler. Bakteriler de bitkiler gibi güçlü hücre duvarına sahiptirler. Ancak, bakteriler bitki hücrelerinden küçük oldukları için hücre duvarları da bitkilerinkine göre çok daha incedir, Bazı virüsler genomlarını bakteriye enjekte edecek mekanizmalar geliştirmişlerdir, bu işlemde viral kapsid hücre dışında kalır. ⓘ
Kapsidin soyulması ⓘ
Viral kapsidin çıkartıldığı bir işlemdir: Bu işlem viral enzimler ya da konak enzimleri tarafından veya kapsidin basit ayrışma ile bozulmasıyla oluşabilir; sonuç olarak viral nükleik asit hücre içinde serbest kalır. ⓘ
Viral replikasyon (kopyalanma) ⓘ
Virüs genomunun birincil çoğalmasını kapsar. Replikasyon, "erken" genlerden viral mRNA'nın sentezi (mRNA) (pozitif yönelimli virüsler için istisnadır), viral protein sentezi, viral proteinlerin olası birleşmeleri, erken veya düzenleyici olarak nitelendirilen proteinlerin aracılığıyla viral genomun replikasyonu aşamalarını kapsar. büyük genomlu kompleks virüslerde mRNA sentezinde bir veya daha fazla aşama olabilir. ⓘ
Birleşme ⓘ
Viral ürünlerin bir araya gelerek birleşmesi ve progeni virüslerinin oluşması aşamasıdır, bu aşamada proteinlerde çeşitli değişiklikler meydana gelebilir. HIV gibi virüslerde, bu değişiklikler (olgunlaşma da denilmektedir) virüs konaktan salınmadan önce meydana gelir. ⓘ
Salınma ⓘ
Virüsler konak hücreden lizis yoluyla salınabilirler, lyzis hücre zarı veya duvarının patlaması ile hücrenin ölmesi olayıdır. Pek çok bakteri virüsü ve bazı hayvan virüsleri bu yolla salınır ve bu tür enfeksiyonlara "litik enfeksiyon" denir. Bazı virüslerin viral genomu genetik rekombinasyon yoluyla konak kromozomunun özgül bir bölgesiyle birleşerek lizojenik döngüye girerler. Bu şekilde birleşmiş virüs genomlarına "provirüs", bakteriyofaj genomlarına ise "profaj" denmektedir. Bu birleşme olayına "lizojeni" ade verilirken, buna maruz kalan konağa da "lizojen" denir. Lizojen konak bölündükçe viral genom da çoğalır. Viral genom konak içinde çoğunlukla sessizdir. Bunun yanında bazı durumlarda provirüs ya da profaj entegre olduğu yerden ayrılabilr ve litik enfeksiyona yol açabilir. Zarflı virüsler (örneğin HIV) tipik olarak tomurcuklanarak konak hücreden salınır. Bu işlem sırasında virüs konağın plazma zarından ya da diğer iç zarlarından modifiye edilmiş bir zarla kendi zarfını elde eder. ⓘ
Virüs partikülleri içindeki genetik malzemeler, ve bu malzemelerin çoğaltılması, farklı virüslerde önemli ölçüde farklılıklar göstermektedir.
- DNA virüsleri
- Birçok DNA virüsünün genom replikasyonu konak hücre çekirdeğinde meydan gelir. Virüsler bazen füzyon ile çoğu zaman da reseptöre bağımlı endositoz yoluyla hücreye girerler. Çoğu DNA virüsü baştan sona konak hücre DNA ve RNA sentez meanizmalarına bağımlıdırlar. Ancak daha büyük genoma sahip virüsler bu mekanizmaları kendileri kodlayabilirler. Ökaryotlarda viral genom bu mekanizmalara ulaşabilmek için hücre çekirdeğine girmesi gerekirken, bakterilerde sadece hücre içine girmesi yeterlidir. ⓘ
- RNA virüsleri
- Replikasyon genellikle konak hücre sitoplazmasında meydana gelir. RNA virüsleri replikasyon modellerine göre dört farklı gruba ayrılabilirler. Tek iplikçikli RNA virüslerinin yönelimi (polarite) büyük ölçüde replikasyon modellerini belirler (kendi proteinlerini üretebilmek için ribozomları direkt kullanıp kullanamadıkları); diğer önemli bir kriter genetik malzemenin tek iplikçikli veya çift iplikçikli olup olmadığıdır. Tüm RNA virüsleri genomlarını kopyalayabilmek için için kendi RNA replikaz (RNA'ya bağımlı RNA polimeraz) enzimleri kullanırlar. ⓘ
- Ters transkripsiyonlu virüsler
- Virionlarında tek iplikçikli RNA bulunduran (Retroviridae, Metaviridae, Pseudoviridae) ya da çift iplikçikli DNA bulunduran (Caulimoviridae ve Hepadnaviridae). Ters transkripsiyon yapan RNA virüsleri replike olmak için bir ara DNA kullanırlar, buna karşılık ters transkripsiyon yapan DNA virüsleri (pararetrovirüses) replike olmak için bir ara RNA kullanırlar. Her iki virüs grubu da nükleik asit dönüşümünü gerçekleştirmek için ters transkriptaz enzimi kullanırlar. Retrovirüslerin provirüs gibi konak hücre DNA'sına entegre olmaları, replikasyon stratejilerinin bir parçasıdır; pararetrovirüslerin bunu yapmamalarına rağmen özellikle bitki pararetrovirüslerinin entegre genom kopyaları enfektif virüslerin ortaya çıkmasına neden olabilir. Ters transkriptaz enzimi zidovudine ve lamivudine gibi antiviral ilaçlara duyarlıdır. Birinci örnek bir retrovirüs olan HIV. İkinci örnek ise Hepatitis B virüsunun içinde bulunduğu Hepadnavirüsler. ⓘ
Virüsler arası ilişkiler
Genetik mutasyon
Virüsler birçok mekanizma ile genetik materyal değişikliğine uğrayabilirler. Antijenik kayma adı verilen işlemleride içeren DNA ya da RNA bazlarının tek tek diğerleri ile mutasyona uğramasıdır. Birçok nokta mutasyon "sessizdir" – sessiz mutasyonlar protein kodlayan genlerde değişime neden olmazlar – fakat örneğin antiviral ilaçlara karşı direnç geliştirebilen diğer mutasyonlardaki gibi, evrimsel avantajlara da neden olabilirler. Antijenik sapma virüs genomunda köklü değişikliklere neden olur; Bu değişiklikler rekombinasyon ve reassortmanın bir sonucudur; İnfluenzavirüslerde meydana gelirken pandemilere neden olur. RNA virüsleri çoğu kez quasispecies (çeyrek tür) ya da aynı türden virüs grupları şeklinde bulunurlar, grup üyelerinin genom nükleotit dizilerinde farklılıklar bulunabilir. Doğal seleksiyon için birincil hedef quasispecieslerdir. ⓘ
Parçalı genom evrimsel avantajlar kazandırır; parçalı genoma sahip virüsün farklı suşları, parçalı genomlarını karıştırabilir ve aynı soydan progeni virüsler ya da benzersiz özelliklere sahip yeni virüsler meydana gelebilir. Bu duruma reassortman ya da viral çiftleşme de denir. ⓘ
Genetik rekombinasyon bir DNA iplikçiğinin kırılıp daha sonra farklı bir DNA molekülünün sonuna birleştirilmesi sürecidir. Virüslerin aynı hücreyi aynı anda enfekte ettiği durumlarda oluşur ve virüs evrimi çalışmaları sırasında çalışılan türler arasında yaygın olarak yapıldığı gözlenmiştir. Rekombinasyon hem DNA hem de RNA virüslerinde meydana gelebilir. ⓘ

Konak ve konak aralığı
Parazitik canlıların faydalandığı diğer canlılara konak denir. Virüsler zorunlu parazitlerdir, replikasyon yoluyla çoğalırlar ve replikasyon yapabilmek için konak hücreye gereksinim duyarlar. ⓘ
Diğerlerini göz önünde bulundurursak virüsler yeryüzünde bugüne kadar en bol biyolojik çeşitliliğe sahip gruptur. Hayvanlar, bitkiler, bakteriler, arkeler ve mantarlar gibi yaşam biçimlerinin her türünü enfekte edebilirler. Bununla birlikte, farklı virüs tipleri bu yaşam biçimlerinin sadece sınırlı bir aralığına bulaşabilir ve virüs enfeksiyonları türe özeldir. Bu özgüllük canlı türü düzeyinde olduğu gibi hücresel düzeyde de olabilir. Örneğin smallpox virüsü sadece insan türünü enfekte edebilir ve dar bir konak aralığı olduğu söylenebilir. Kuduz virüsü gibi bazı virüsler, memelilerin birçok türünü enfekte edebilir ve buvirüslerin geniş bir konak yelpazsesi olduğu söylenebilir. Bitki virüslerinin ve diğer hayvan virüslerinin birçoğu insanları enfekte etmez. Bazı bakteriyofajlar sadece bir bakteri suşunda enfeksiyona neden olurlar ve faj tiplendirilmesi bakteriyel hastalıkların kaynaklarının araştırılmasında kullanılabilen bir yöntemdir. ⓘ
Konak hücredeki etkileri
Virüslerin konak hücrede meydana getirdiği yapısal ve biyokimyasal etkiler geniş kapsamlıdır. Bu etkilere sitopatik etkiler denir. Birçok virüs enfeksiyonu sonrası konak hücre ölür. Ölüm nedenleri, hücre parçalanması (lizis), hücrenin sitoplazmik zarındaki değişiklikler ve apoptozis olabilir. Hücre ölümü vakaları sık sık, virüsün yapısına katılan ve katılmayan partiküller özgül proteinler nedeniyle virüsün hücreyi baskılaması sonucu hücrenin normal faaliyetlerinin durmasından kaynaklanır. ⓘ
Bazı virüsler enfekte hücrede hiçbir belirgin değişikliğe neden olmazlar . Virüsler hücrede sessiz (latent) olarak kalabilirler ve birkaç belirti dışında hücre normal fonksiyonlarına devam eder. Bu kalıcı (persistan) enfeksiyon vakalarına neden olur ve virüs aylarca hatta yıllarca uykuda kalabilir. Bu vakalar genelde herpes virüs enfeksiyonlarında meydana gelir. Baz virüsler, Epstein–Barr virüsü gibi, habis kanserlere neden olmadan hücre çoğalmasına neden olurlar, Papillomavirüsler gibi bazı virüsler ise kanserlere neden olabilirler. ⓘ
Konak savunma mekanizmaları
Vücudun virüslere karşı ilk savunma hattı doğuştan gelen bağışıklık sistemidir. Bu, konağı enfeksiyondan spesifik olmayan bir şekilde koruyan hücreler ve diğer mekanizmalardan oluşur. Bu, doğuştan gelen sistemin hücrelerinin patojenleri genel bir şekilde tanıdığı ve bunlara yanıt verdiği, ancak adaptif bağışıklık sisteminin aksine, konağa uzun süreli veya koruyucu bağışıklık sağlamadığı anlamına gelir. ⓘ
RNA interferansı virüslere karşı doğuştan gelen önemli bir savunmadır. Birçok virüsün çift sarmallı RNA (dsRNA) içeren bir replikasyon stratejisi vardır. Böyle bir virüs bir hücreyi enfekte ettiğinde, RNA molekülünü veya moleküllerini serbest bırakır ve bunlar hemen RNA'yı daha küçük parçalara ayıran dicer adı verilen bir protein kompleksine bağlanır. Viral mRNA'yı parçalayarak hücrenin hayatta kalmasını sağlayan bir biyokimyasal yol (RISC kompleksi) aktive olur. Rotavirüsler bu savunma mekanizmasından kaçınmak için hücre içinde tam olarak kaplamadan çıkmayarak ve yeni üretilen mRNA'yı partikülün iç kapsidindeki porlardan serbest bırakarak evrimleşmiştir. Genomik dsRNA'ları virionun çekirdeği içinde korunmaya devam eder. ⓘ
Bir omurgalının adaptif bağışıklık sistemi bir virüsle karşılaştığında, virüse bağlanan ve genellikle onu bulaşıcı olmayan hale getiren spesifik antikorlar üretir. Buna humoral bağışıklık denir. İki tür antikor önemlidir. IgM adı verilen ilki virüsleri etkisiz hale getirmede oldukça etkilidir ancak bağışıklık sistemi hücreleri tarafından yalnızca birkaç hafta boyunca üretilir. IgG olarak adlandırılan ikincisi ise süresiz olarak üretilir. IgM'nin konakçının kanındaki varlığı akut enfeksiyonu test etmek için kullanılırken, IgG geçmişte bir enfeksiyon olduğunu gösterir. Bağışıklık testleri yapılırken IgG antikoru ölçülür. ⓘ
Antikorlar, virüsler konak hücreye girmeyi başardıktan sonra bile etkili bir savunma mekanizması olmaya devam edebilir. Hücrelerde bulunan ve TRIM21 adı verilen bir protein, virüs partikülünün yüzeyindeki antikorlara bağlanabilir. Bu da virüsün hücrenin proteozom sistemindeki enzimler tarafından yok edilmesini sağlar. ⓘ
Omurgalıların virüslere karşı ikinci bir savunması hücre aracılı bağışıklık olarak adlandırılır ve T hücreleri olarak bilinen bağışıklık hücrelerini içerir. Vücut hücreleri sürekli olarak proteinlerinin kısa parçalarını hücre yüzeyinde sergiler ve bir T hücresi burada şüpheli bir viral parçayı tanırsa, konak hücre 'katil T' hücreleri tarafından yok edilir ve virüse özgü T hücreleri çoğalır. Makrofaj gibi hücreler bu antijen sunumunda uzmandır. İnterferon üretimi önemli bir konakçı savunma mekanizmasıdır. Bu, virüsler mevcut olduğunda vücut tarafından üretilen bir hormondur. Bağışıklıktaki rolü karmaşıktır; sonunda enfekte hücreyi ve yakın komşularını öldürerek virüslerin çoğalmasını durdurur. ⓘ
Tüm virüs enfeksiyonları bu şekilde koruyucu bir bağışıklık tepkisi oluşturmaz. HIV, virionun yüzeyindeki proteinlerin amino asit dizilimini sürekli değiştirerek bağışıklık sisteminden kaçar. Viral epitoplar konakçı bağışıklık tepkisi tarafından tanınmaktan kaçtığı için bu "kaçış mutasyonu" olarak bilinir. Bu inatçı virüsler, sekestrasyon, antijen sunumunun engellenmesi, sitokin direnci, doğal öldürücü hücre faaliyetlerinden kaçınma, apoptozdan kaçma ve antijenik kayma yoluyla bağışıklık kontrolünden kaçar. 'Nörotropik virüsler' olarak adlandırılan diğer virüsler, bağışıklık sisteminin bağışıklık ayrıcalığı nedeniyle kendilerine ulaşamayabileceği nöral yayılım yoluyla yayılır. ⓘ
Epidemiyoloji
Viral epidemiyoloji, insanlarda virüs enfeksiyonlarının bulaşması ve kontrolü ile ilgilenen tıp bilimi dalıdır. Virüslerin bulaşması, anneden çocuğa anlamına gelen dikey veya kişiden kişiye anlamına gelen yatay olabilir. Dikey bulaşma örnekleri arasında hepatit B virüsü ve bebeğin zaten virüsle enfekte olarak doğduğu HIV yer almaktadır. Daha nadir görülen bir başka örnek ise, çocuklarda ve yetişkinlerde nispeten hafif enfeksiyonlara neden olmasına rağmen fetüs ve yeni doğan bebek için ölümcül olabilen varisella zoster virüsüdür. ⓘ
Yatay bulaşma, virüslerin popülasyonlarda en yaygın yayılma mekanizmasıdır. Yatay bulaşma, cinsel aktivite sırasında vücut sıvıları değiş tokuş edildiğinde, tükürük alışverişi yoluyla veya kontamine yiyecek veya su yutulduğunda meydana gelebilir. Virüs içeren aerosoller solunduğunda veya enfekte sivrisineklerin konakçının derisine nüfuz etmesi gibi böcek vektörleri tarafından da meydana gelebilir. Çoğu virüs türü bu mekanizmalardan sadece bir veya ikisiyle sınırlıdır ve "solunum virüsleri" veya "enterik virüsler" vb. olarak adlandırılırlar. Viral enfeksiyonların bulaşma hızı veya oranı, nüfus yoğunluğu, duyarlı bireylerin sayısı (yani bağışıklığı olmayanlar), sağlık hizmetlerinin kalitesi ve hava durumu gibi faktörlere bağlıdır. ⓘ
Epidemiyoloji, viral hastalık salgınları sırasında popülasyonlardaki enfeksiyon zincirini kırmak için kullanılır. Virüsün nasıl bulaştığı bilgisine dayanan kontrol önlemleri kullanılır. Salgının kaynağını veya kaynaklarını bulmak ve virüsü tanımlamak önemlidir. Virüs tanımlandıktan sonra, bulaşma zinciri bazen aşılarla kırılabilir. Aşılar mevcut olmadığında, sanitasyon ve dezenfeksiyon etkili olabilir. Genellikle, enfekte kişiler toplumun geri kalanından izole edilir ve virüse maruz kalanlar karantinaya alınır. İngiltere'de 2001 yılında sığırlarda görülen şap hastalığı salgınını kontrol altına almak için binlerce sığır kesilmiştir. İnsanlarda ve diğer hayvanlarda görülen viral enfeksiyonların çoğunda, enfeksiyonun hiçbir belirti veya semptoma neden olmadığı kuluçka dönemleri vardır. Viral hastalıklar için kuluçka dönemleri birkaç gün ile haftalar arasında değişir, ancak çoğu enfeksiyon için bilinmektedir. Kuluçka dönemiyle biraz örtüşen, ancak esas olarak kuluçka dönemini takiben, enfekte bir birey veya hayvanın bulaşıcı olduğu ve başka bir kişi veya hayvana bulaştırabileceği bir bulaşıcılık dönemi vardır. Bu da birçok viral enfeksiyon için bilinmektedir ve her iki dönemin uzunluğunun bilinmesi salgınların kontrolünde önemlidir. Salgınlar bir popülasyonda, toplulukta veya bölgede alışılmadık derecede yüksek oranda vakaya neden olduğunda salgın olarak adlandırılır. Salgınlar dünya çapında yayılırsa pandemi olarak adlandırılır. ⓘ
Epidemiler ve pandemiler
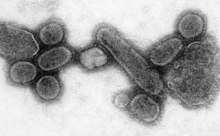
Pandemi, dünya çapında bir salgındır. 1919 yılına kadar süren 1918 grip pandemisi, alışılmadık derecede şiddetli ve ölümcül bir influenza A virüsünün neden olduğu 5. kategori bir influenza pandemisiydi. Kurbanlar, ağırlıklı olarak çocuk, yaşlı veya başka şekilde zayıflamış hastaları etkileyen çoğu grip salgınının aksine, genellikle sağlıklı genç yetişkinlerdi. Eski tahminler 40-50 milyon kişinin öldüğünü söylerken, daha yeni araştırmalar 100 milyon kadar insanın ya da 1918'deki dünya nüfusunun %5'inin ölmüş olabileceğini öne sürüyor. ⓘ
Viral pandemiler nadir görülen olaylar olsa da, maymunlarda ve şempanzelerde bulunan virüslerden evrimleşen HIV en azından 1980'lerden beri pandemiktir. 20. yüzyıl boyunca influenza virüsünün neden olduğu dört pandemi yaşanmış ve 1918, 1957 ve 1968 yıllarında meydana gelenler şiddetli olmuştur. Çoğu araştırmacı HIV'in 20. yüzyılda Sahra altı Afrika'da ortaya çıktığına inanmaktadır; şu anda dünya çapında 37,9 milyon insanın bu hastalıkla yaşadığı tahmin edilmektedir. 2018 yılında AIDS nedeniyle yaklaşık 770.000 ölüm gerçekleşmiştir. Birleşmiş Milletler HIV/AIDS Ortak Programı (UNAIDS) ve Dünya Sağlık Örgütü (WHO), AIDS'in 5 Haziran 1981'de ilk kez fark edilmesinden bu yana 25 milyondan fazla insanın ölümüne yol açtığını tahmin etmekte olup, bu da onu kayıtlı tarihin en yıkıcı salgınlarından biri haline getirmektedir. 2007 yılında 2.7 milyon yeni HIV enfeksiyonu ve 2 milyon HIV bağlantılı ölüm gerçekleşmiştir.
Çok sayıda ölümcül viral patojen Filoviridae üyesidir. Filovirüsler viral hemorajik ateşe neden olan filament benzeri virüslerdir ve ebolavirüsler ile marburgvirüsleri içerirler. İlk olarak 1967 yılında keşfedilen Marburg virüsü, Nisan 2005'te Angola'da ortaya çıkan bir salgınla basının geniş ilgisini çekmiştir. Ebola virüsü hastalığı da ilk tanımlandığı 1976 yılından bu yana aralıklı olarak yüksek ölüm oranlarına sahip salgınlara neden olmuştur. Bunlardan en kötüsü ve en sonuncusu 2013-2016 Batı Afrika salgınıdır. ⓘ
Çiçek hastalığı hariç, pandemilerin çoğuna yeni evrimleşmiş virüsler neden olmaktadır. Bu "yeni ortaya çıkan" virüsler genellikle daha önce insanlarda ya da diğer hayvanlarda dolaşan daha az zararlı virüslerin mutantlarıdır. ⓘ
Şiddetli akut solunum sendromu (SARS) ve Orta Doğu solunum sendromu (MERS) yeni tip koronavirüslerden kaynaklanmaktadır. Diğer koronavirüslerin insanlarda hafif enfeksiyonlara neden olduğu bilinmektedir, bu nedenle Temmuz 2003 itibariyle yaklaşık 8.000 vakaya ve 800 ölüme neden olan SARS enfeksiyonlarının virülansı ve hızlı yayılımı beklenmedikti ve çoğu ülke buna hazırlıklı değildi. ⓘ
Yarasalardan kaynaklandığı düşünülen ilgili bir koronavirüs olan şiddetli akut solunum sendromu koronavirüsü 2 (SARS-Cov-2), Kasım 2019'da Çin'in Wuhan kentinde ortaya çıktı ve hızla dünyaya yayıldı. Virüs ile oluşan enfeksiyonlar 2020 yılında başlayan COVID-19 pandemisine neden oldu. Salgına tepki olarak uluslararası seyahatlere barış zamanında benzeri görülmemiş kısıtlamalar getirildi ve dünya çapında birçok büyük şehirde sokağa çıkma yasağı uygulandı. ⓘ
Amerikan yerlileri kontajiyöz hastalıklar nedeniyle harap olmuş durumda idiler, özellikle de avrupalı sömürgeciler tarafından getirilen çiçek hastalığı nedeniyle. Colomb'un amerikaya ayak basmasından öne kaç tane yerlinin aşina olmadıkları hastalıklardan öldüğü bilinmemektedir, ancak rakamların yerli nüfusunun %70'ine yakın olduğu tahmin edilmiştir. Bu hastalıkların yerlilere verdikleri zararlar önemli ölçede avrupalıların istilalarına yardımcı olmuştur. ⓘ
Korunma ve tedavi
Virüsler çoğalmak için konak hücrelerdeki hayati metabolik yolları kullandıklarından, genel olarak konak hücrelerde toksik etkilere neden olan ilaçlar kullanmadan ortadan kaldırılmaları zordur. Viral hastalıklara yönelik en etkili tıbbi yaklaşımlar, enfeksiyona karşı bağışıklık sağlayan aşılar ve viral replikasyona seçici olarak müdahale eden antiviral ilaçlardır. ⓘ
Aşılama
Aşılama, virüslerin neden olduğu enfeksiyonları önlemenin ucuz ve etkili bir yoludur. Aşılar, gerçek virüslerin keşfinden çok önce viral enfeksiyonları önlemek için kullanılmıştır. Aşıların kullanımı, çocuk felci, kızamık, kabakulak ve kızamıkçık gibi viral enfeksiyonlarla ilişkili morbidite (hastalık) ve mortalitede (ölüm) dramatik bir düşüşle sonuçlanmıştır. Çiçek hastalığı enfeksiyonları ortadan kaldırılmıştır. İnsanların on üçten fazla viral enfeksiyonunu önlemek için aşılar mevcuttur ve hayvanların viral enfeksiyonlarını önlemek için daha fazlası kullanılmaktadır. Aşılar canlı zayıflatılmış veya öldürülmüş virüslerden, viral proteinlerden (antijenler) veya RNA'dan oluşabilir. Canlı aşılar, hastalığa neden olmayan ancak yine de bağışıklık sağlayan virüsün zayıflatılmış formlarını içerir. Bu tür virüsler zayıflatılmış olarak adlandırılır. Canlı aşılar bağışıklığı zayıf olan (bağışıklık sistemi baskılanmış olarak tanımlanan) kişilere verildiğinde tehlikeli olabilir, çünkü bu kişilerde zayıflatılmış virüs orijinal hastalığa neden olabilir. Alt birim aşıları üretmek için biyoteknoloji ve genetik mühendisliği teknikleri kullanılmaktadır. Bu aşılarda virüsün sadece kapsid proteinleri kullanılır. Hepatit B aşısı bu tür aşılara bir örnektir. Alt birim aşılar, hastalığa neden olamadıkları için bağışıklık sistemi baskılanmış hastalar için güvenlidir. 17D adı verilen canlı zayıflatılmış bir tür olan sarıhumma virüsü aşısı muhtemelen şimdiye kadar üretilen en güvenli ve en etkili aşıdır. ⓘ
Antiviral ilaçlar

Antiviral ilaçlar genellikle virüslerin replikasyon sırasında yanlışlıkla genomlarına dahil ettikleri nükleozid analoglarıdır (sahte DNA yapı taşları). Yeni sentezlenen DNA inaktif olduğu için virüsün yaşam döngüsü durdurulur. Bunun nedeni, bu analogların fosfor atomlarıyla birlikte DNA molekülünün güçlü "omurgasını" oluşturmak üzere birbirine bağlanan hidroksil gruplarından yoksun olmasıdır. Buna DNA zincirinin sonlandırılması denir. Nükleozid analoglarına örnek olarak Herpes simpleks virüs enfeksiyonları için asiklovir ve HIV ve hepatit B virüs enfeksiyonları için lamivudin verilebilir. Asiklovir en eski ve en sık reçete edilen antiviral ilaçlardan biridir. Kullanılan diğer antiviral ilaçlar viral yaşam döngüsünün farklı aşamalarını hedef alır. HIV, tamamen bulaşıcı hale gelebilmesi için HIV-1 proteaz adı verilen proteolitik bir enzime bağımlıdır. Proteaz inhibitörleri adı verilen ve bu enzimi etkisiz hale getiren geniş bir ilaç sınıfı vardır. Her biri farklı virüsleri veya viral replikasyon aşamalarını hedef alan yaklaşık on üç antiviral ilaç sınıfı vardır. ⓘ
Hepatit C'ye bir RNA virüsü neden olur. Enfekte olan kişilerin %80'inde hastalık kroniktir ve tedavi edilmezlerse hayatlarının geri kalanında enfekte olurlar. Doğrudan etkili antivirallerin kullanıldığı etkili tedaviler vardır. Hepatit B virüsünün kronik taşıyıcılarının tedavisi de lamivudin ve diğer anti-viral ilaçları içeren benzer stratejiler kullanılarak geliştirilmiştir. ⓘ
Tespit, saflaştırma ve tanı
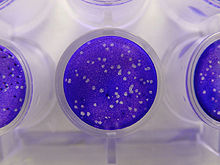
Laboratuvarda virüsleri çoğaltma ve tespit etmek için çeşitli yöntemler vardır. Kültürlenmiş hücreler bir virüsle enfekte edildikten sonra ortama salınan virüslerin saflaştırılması için santrifüjleme yöntemleri, amonyum sülfat veya etilen glikol ile çökeltme, veya hücre bileşenlerinin organik çözücülerle arıtılması gibi teknikler kullanılır. ⓘ
Virüslerin tespiti ve miktarlarının belirlenmesi için kullanılan yöntemler arasında:
- Hemaglütinasyon testi. Bir alyuvar süspansiyonuna virüsler eklenir, alyuvarların kümeleşmesine (aglütinasyonuna) bakılarak virüs sayısı belirlenir. Kümeleşmenin nedeni, virüslerin alyuvarların yüzeyine bağlanarak hücreleri birbirine bağlamalarıdır.
- Elektron mikroskobu ile doğrudan sayım. Derişik bir virüs süspansiyonu, konsantrasyonu bilinen bir mikroskopik bilye süspansiyonu ile karıştırılır ve bu karışım özel bir yüzeyin üzerine damlatılır. Yüksek büyültme altında virüs tanecikleri ve suni bilyeler sayılarak virüslerin konsantrasyonu hesaplanır.
- Plak sayımı. Kültür kaplarında konak hücreler ince bir tabaka halinde büyütülür. Bir virüs süspansiyonu ayrı tüplerde farklı oranlarda seyreltilip bu kaplara eklenir. Her bir virüs tanesi çoğalarak birbirine bitişik çok sayıda hücreyi öldürür, hücre tabakasında bir delik ('plak') oluşmasına neden olur. Plakların sayısından o kaba kaç tane virüs eklenmiş olduğu anlaşılır, buna dayanarak virüs konsantrasyonu hesaplanabilir. ⓘ
Hastalardan yeni bir hastalığın virüsünün tespiti (yakın geçmişten ebola veya HIV örnekleri verilebilir) ve o virüsün saflaştırılması özelleşmiş laboratuvarlar, ayrıca moleküler biyolog ve virolog gibi uzmanlar gerektirir. Bu genelde devlet laboratuvarlarının gayretleriyle gerçekleştirilir ve zor durumlarda Dünya Sağlık Örgütü gibi kuruluşların yardımını gerektirebilir. ⓘ
Diğer türlerdeki viral enfeksiyonlar
Virüsler tüm hücresel yaşam formlarını etkilerler, virüsler evrensel etkenler olmalarına karşın kendilerine özgül konaklarda enfeksiyona neden olurlar. Uydu adı verilen bazı virüsler, replike olabilmek için başka virüslere gereksinim duyarlar. ⓘ
Hayvan virüsleri
Virüsler çiftlik hayvanlarının önemli patojenleridir. Şap hastalığı ve mavi dil gibi hastalıklara virüsler neden olmaktadır. Kediler, köpekler ve atlar gibi evcil hayvanlar aşılanmadıkları takdirde ciddi viral enfeksiyonlara karşı hassastırlar. Köpek parvovirüsüne küçük bir DNA virüsü neden olur ve enfeksiyonlar yavrularda genellikle ölümcüldür. Tüm omurgasızlar gibi bal arısı da birçok viral enfeksiyona karşı hassastır. Virüslerin çoğu konakçılarında zararsız bir şekilde var olur ve hiçbir hastalık belirtisi veya semptomuna neden olmaz. ⓘ
Bitki virüsleri
Birçok bitki virüsü türü vardır, ancak genellikle sadece verim kaybına neden olurlar ve bunları kontrol etmeye çalışmak ekonomik olarak uygun değildir. Bitki virüsleri genellikle vektör olarak bilinen organizmalar tarafından bitkiden bitkiye yayılır. Bunlar genellikle böceklerdir, ancak bazı mantarlar, nematod solucanları, tek hücreli organizmalar ve parazit bitkiler de vektördür. Bitki virüs enfeksiyonlarının kontrolünün ekonomik olduğu düşünüldüğünde, örneğin çok yıllık meyveler için, çabalar vektörlerin öldürülmesi ve yabani otlar gibi alternatif konakçıların ortadan kaldırılması üzerine yoğunlaşır. Bitki virüsleri insanları ve diğer hayvanları enfekte edemez çünkü sadece canlı bitki hücrelerinde üreyebilirler. ⓘ
Aslen Peru kökenli olan patates, dünya çapında temel bir ürün haline gelmiştir. Patates virüsü Y, patateslerde ve domates ve biber de dahil olmak üzere ilgili türlerde hastalığa neden olur. Bu virüs 1980'lerde tohumluk patates ürünlerinde kontrolünün zor olduğu kanıtlanınca ekonomik önem kazanmıştır. Yaprak bitleri tarafından bulaştırılan bu virüs, mahsul verimini yüzde 80'e kadar düşürebilir ve patates veriminde önemli kayıplara neden olabilir. ⓘ
Bitkiler virüslere karşı ayrıntılı ve etkili savunma mekanizmalarına sahiptir. En etkili olanlardan biri de direnç (R) genlerinin varlığıdır. Her bir R geni, enfekte olmuş hücrenin etrafında genellikle çıplak gözle büyük lekeler olarak görülebilen lokalize hücre ölümü alanlarını tetikleyerek belirli bir virüse karşı direnç sağlar. Bu da enfeksiyonun yayılmasını engeller. RNA müdahalesi bitkilerde de etkili bir savunmadır. Bitkiler enfekte olduklarında genellikle salisilik asit, nitrik oksit ve reaktif oksijen molekülleri gibi virüsleri öldüren doğal dezenfektanlar üretirler. ⓘ
Bitki virüsü partikülleri veya virüs benzeri partiküller (VLP'ler) hem biyoteknoloji hem de nanoteknolojide uygulamalara sahiptir. Çoğu bitki virüsünün kapsidleri basit ve sağlam yapılardır ve bitkilerin enfeksiyonu ya da çeşitli heterolog sistemlerde ekspresyon yoluyla büyük miktarlarda üretilebilirler. Bitki virüsü partikülleri, yabancı maddeleri kapsüllemek için genetik ve kimyasal olarak modifiye edilebilir ve biyoteknolojide kullanılmak üzere supramoleküler yapılara dahil edilebilir. ⓘ
Bakteri virüsleri

Bakteriyofajlar yaygın ve çeşitli bir virüs grubudur ve su ortamlarında en bol bulunan biyolojik varlıktır - okyanuslarda bu virüslerin sayısı bakterilerin sayısının on katına kadar çıkmakta ve deniz suyunun mililitresinde 250.000.000 bakteriyofaj seviyesine ulaşmaktadır. Bu virüsler, yüzey reseptör moleküllerine bağlanarak ve ardından hücreye girerek belirli bakterileri enfekte eder. Kısa bir süre içinde, bazı durumlarda sadece dakikalar içinde, bakteriyel polimeraz viral mRNA'yı proteine çevirmeye başlar. Bu proteinler hücre içinde yeni virionlar, yeni virionların bir araya gelmesine yardımcı olan yardımcı proteinler ya da hücre parçalanmasında rol oynayan proteinler haline gelir. Viral enzimler hücre zarının parçalanmasına yardımcı olur ve T4 fajının durumunda, enjeksiyondan sadece yirmi dakika sonra üç yüzden fazla faj salınabilir. ⓘ
Bakterilerin kendilerini bakteriyofajlardan korumalarının başlıca yolu, yabancı DNA'yı yok eden enzimler üretmektir. Restriksiyon endonükleazlar olarak adlandırılan bu enzimler, bakteriyofajların bakteri hücrelerine enjekte ettiği viral DNA'yı keser. Bakteriler ayrıca, bakterilerin geçmişte temas ettiği virüslerin genomlarının parçalarını tutmak için CRISPR dizilerini kullanan bir sistem içerir, bu da bir tür RNA müdahalesi yoluyla virüsün çoğalmasını engellemelerine olanak tanır. Bu genetik sistem bakterilere enfeksiyona karşı edinilmiş bağışıklık sağlamaktadır. ⓘ
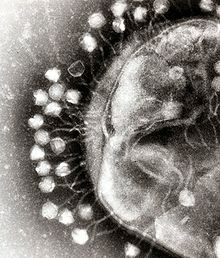
Arkeal virüsler
Bazı virüsler arkeler içinde çoğalır: bunlar alışılmadık ve bazen benzersiz şekillere sahip DNA virüsleridir. Bu virüsler en ayrıntılı olarak termofilik arkelerde, özellikle de Sulfolobales ve Thermoproteales takımlarında incelenmiştir. Bu virüslere karşı savunma, virüslerin genleriyle ilişkili olan arke genomları içindeki tekrarlayan DNA dizilerinden RNA girişimini içerir. Çoğu arke, virüslere karşı adaptif bir savunma olarak CRISPR-Cas sistemlerine sahiptir. Bunlar, arkelerin viral DNA bölümlerini tutmasını sağlar ve daha sonra RNA girişimine benzer bir süreç kullanarak virüs tarafından sonraki enfeksiyonları hedeflemek ve ortadan kaldırmak için kullanılır. ⓘ
İnsan hastalıklarındaki rolleri

Virüslerin neden olduğu yaygın insan hastalıklarına örnek olarak soğuk algınlığı, grip, suçiçeği ve uçuklar verilebilir. Kuduz, Ebola virüsü hastalığı, AIDS (HIV), kuş gribi ve SARS gibi birçok ciddi hastalığa virüsler neden olmaktadır. Virüslerin hastalığa neden olma konusundaki göreceli yetenekleri virülans açısından tanımlanmaktadır. İnsan herpes virüsü 6 (HHV6) ile multipl skleroz ve kronik yorgunluk sendromu gibi nörolojik hastalıklar arasındaki olası bağlantı gibi diğer hastalıklar, etken olarak bir virüse sahip olup olmadıklarını keşfetmek için araştırılmaktadır. Daha önce atlarda nörolojik hastalıklara neden olduğu düşünülen bornavirüsün insanlarda psikiyatrik hastalıklardan sorumlu olup olamayacağı konusunda tartışmalar vardır. ⓘ
Virüslerin bir organizmada hastalık ürettikleri farklı mekanizmalar vardır ve bu mekanizmalar büyük ölçüde viral türe bağlıdır. Hücresel düzeydeki mekanizmalar öncelikle hücre lizisini, hücrenin parçalanarak açılmasını ve ardından ölümünü içerir. Çok hücreli organizmalarda, yeterince hücre ölürse, tüm organizma etkilerden zarar görmeye başlayacaktır. Virüsler sağlıklı homeostazın bozulmasına neden olarak hastalıkla sonuçlansa da, bir organizma içinde nispeten zararsız bir şekilde var olabilirler. Uçuğa neden olan herpes simpleks virüsünün insan vücudunda uyku halinde kalabilmesi buna bir örnektir. Buna latentlik denir ve glandüler ateşe neden olan Epstein-Barr virüsü ile suçiçeği ve zonaya neden olan varisella zoster virüsü de dahil olmak üzere herpes virüslerinin bir özelliğidir. Çoğu insan bu herpes virüsü türlerinden en az biriyle enfekte olmuştur. Bu gizli virüsler bazen faydalı olabilir, çünkü virüsün varlığı Yersinia pestis gibi bakteriyel patojenlere karşı bağışıklığı artırabilir. ⓘ
Bazı virüsler, konakçının savunma mekanizmalarına rağmen virüslerin vücutta çoğalmaya devam ettiği ömür boyu süren veya kronik enfeksiyonlara neden olabilir. Bu durum hepatit B virüsü ve hepatit C virüsü enfeksiyonlarında yaygındır. Kronik olarak enfekte olan kişiler, bulaşıcı virüs rezervuarı olarak hizmet ettikleri için taşıyıcı olarak bilinirler. Yüksek oranda taşıyıcı bulunan toplumlarda hastalığın endemik olduğu söylenir. ⓘ
Kanser
Virüsler, insanlarda ve diğer türlerde kansere yol açan yerleşik bir nedendir. Viral kanserler sadece enfekte olmuş kişilerin (veya hayvanların) azınlığında görülür. Kanser virüsleri hem RNA hem de DNA virüslerini içeren çeşitli virüs ailelerinden gelmektedir ve bu nedenle tek bir "onkovirüs" türü yoktur (başlangıçta akut dönüşüm geçiren retrovirüsler için kullanılan eski bir terim). Kanserin gelişimi, konakçı bağışıklığı ve konakçıdaki mutasyonlar gibi çeşitli faktörler tarafından belirlenir. İnsan kanserlerine neden olduğu kabul edilen virüsler arasında insan papillomavirüsünün bazı genotipleri, hepatit B virüsü, hepatit C virüsü, Epstein-Barr virüsü, Kaposi sarkomu ile ilişkili herpesvirüs ve insan T-lenfotropik virüsü bulunmaktadır. En son keşfedilen insan kanser virüsü, Merkel hücreli karsinom adı verilen nadir bir cilt kanseri türünün çoğu vakasına neden olan bir poliomavirüstür (Merkel hücreli poliomavirüs). Hepatit virüsleri karaciğer kanserine yol açan kronik bir viral enfeksiyona dönüşebilir. İnsan T-lenfotropik virüs enfeksiyonu tropikal spastik paraparezi ve yetişkin T-hücreli lösemiye yol açabilir. İnsan papillomavirüsleri serviks, deri, anüs ve penis kanserlerinin yerleşik bir nedenidir. Herpesviridae içinde, Kaposi sarkomu ile ilişkili herpesvirüs Kaposi sarkomu ve vücut boşluğu lenfomasına neden olurken, Epstein-Barr virüsü Burkitt lenfoması, Hodgkin lenfoması, B lenfoproliferatif bozukluk ve nazofaringeal karsinomaya neden olmaktadır. Merkel hücreli poliomavirüs, 50 yılı aşkın süredir kanser virüsleri için hayvan modeli olarak kullanılan SV40 ve fare poliomavirüsleri ile yakından ilişkilidir. ⓘ
Sucul ekosistemlerdeki rolü
Virüsler su ortamlarında en bol bulunan biyolojik varlıklardır. Bir çay kaşığı deniz suyunda yaklaşık on milyon tane bulunur. Bu virüslerin çoğu heterotrofik bakterileri enfekte eden bakteriyofajlar ve siyanobakterileri enfekte eden siyanofajlardır ve tuzlu su ve tatlı su ekosistemlerinin düzenlenmesi için gereklidirler. Bakteriyofajlar bitkiler ve hayvanlar için zararsızdır ve deniz ve tatlı su ekosistemlerinin düzenlenmesi için gereklidir, sucul ortamlardaki besin zincirinin temeli olan fitoplanktonların önemli ölüm etkenleridir. Sucul mikrobiyal topluluklardaki bakterileri enfekte edip yok ederler ve deniz ortamlarında karbon ve besin döngüsünün geri dönüşümünün en önemli mekanizmalarından biridirler. Ölü bakteri hücrelerinden salınan organik moleküller, viral şant olarak bilinen bir süreçte taze bakteri ve alg büyümesini uyarır. Özellikle, bakterilerin virüsler tarafından parçalanmasının azot döngüsünü artırdığı ve fitoplankton büyümesini teşvik ettiği gösterilmiştir. Viral aktivite, karbonun derin okyanusta tutulduğu süreç olan biyolojik pompayı da etkileyebilir. ⓘ
Mikroorganizmalar denizdeki biyokütlenin %90'ından fazlasını oluşturmaktadır. Virüslerin her gün bu biyokütlenin yaklaşık %20'sini öldürdüğü ve okyanuslarda bakteri ve arkea sayısının 10 ila 15 katı kadar virüs bulunduğu tahmin edilmektedir. Virüsler ayrıca zararlı alg patlamaları da dahil olmak üzere fitoplanktonların yok edilmesinden sorumlu başlıca etkenlerdir, Okyanuslardaki virüslerin sayısı, daha az sayıda konakçı organizmanın bulunduğu açık denizlerde ve suyun derinliklerinde azalmaktadır. ⓘ
Ocak 2018'de bilim insanları, hava sisteminin üzerinde ancak normal havayolu seyahati irtifasının altında dolaşan ve virüsleri gezegene dağıtan küresel bir atmosferik virüs akımının sonucu olarak, Dünya atmosferinden gezegen yüzeyinin her metrekaresine her gün çoğunlukla deniz kökenli 800 milyon virüsün biriktiğini bildirmiştir. ⓘ
Her organizma gibi deniz memelileri de viral enfeksiyonlara karşı hassastır. 1988 ve 2002 yıllarında Avrupa'da binlerce liman foku phocine distemper virüsü nedeniyle ölmüştür. Kalisivirüsler, herpesvirüsler, adenovirüsler ve parvovirüsler de dahil olmak üzere diğer birçok virüs deniz memelisi popülasyonlarında dolaşmaktadır. ⓘ
Evrimdeki rolü
Virüsler farklı türler arasında taşıdığı dna veya rna aracılığıyla gen transferi yapabilen ve genetik çeşitliliği arttıran önemli araçlardır. Yeryüzündeki hayatın son evrimsel atasının olduğu zamanlarda ve bakteri, arke ve ökaryotların çeşitlenmesinden önce virüslerin erken evrimde önemli bir rol oynadığı düşünülmektedir. Virüsler hala yeryüzünde keşfedilmemiş genetik çeşitliliğin en büyük rezervuarlarından biridir. ⓘ
Uygulamalar
Canlı bilimleri ve tıp

Virüsler, hücrelerin işlevlerini manipüle etmek ve araştırmak için kullanılabilecek basit sistemler sağladıkları için moleküler ve hücre biyolojisi çalışmaları için önemlidir. Virüslerin incelenmesi ve kullanılması, hücre biyolojisinin yönleri hakkında değerli bilgiler sağlamıştır. Örneğin, virüsler genetik çalışmalarında faydalı olmuş ve DNA replikasyonu, transkripsiyon, RNA işleme, çeviri, protein taşıma ve immünoloji gibi moleküler genetiğin temel mekanizmalarını anlamamıza yardımcı olmuştur. ⓘ
Genetikçiler, genleri üzerinde çalıştıkları hücrelere sokmak için genellikle virüsleri vektör olarak kullanırlar. Bu, hücrenin yabancı bir madde üretmesini sağlamak veya genoma yeni bir gen eklemenin etkisini incelemek için kullanışlıdır. Benzer şekilde, viroterapi, virüsleri çeşitli hastalıkları tedavi etmek için vektör olarak kullanır, çünkü özellikle hücreleri ve DNA'yı hedefleyebilirler. Kanser tedavisinde ve gen terapisinde umut verici bir kullanım göstermektedir. Doğu Avrupalı bilim insanları bir süredir antibiyotiklere alternatif olarak faj terapisini kullanmaktadır ve bazı patojenik bakterilerde yüksek düzeyde antibiyotik direnci bulunması nedeniyle bu yaklaşıma olan ilgi artmaktadır. Heterolog proteinlerin virüsler tarafından ifade edilmesi, şu anda aşı antijenleri ve antikorlar gibi çeşitli proteinlerin üretimi için kullanılan çeşitli üretim süreçlerinin temelini oluşturmaktadır. Yakın zamanda viral vektörler kullanılarak endüstriyel prosesler geliştirilmiştir ve çeşitli farmasötik proteinler şu anda klinik öncesi ve klinik deneyler aşamasındadır. ⓘ
Viroterapi
Viroterapi, hastalıkları tedavi etmek için genetik olarak değiştirilmiş virüslerin kullanılmasını içerir. Virüsler bilim insanları tarafından kanser hücrelerinde çoğalacak ve onları yok edecek ancak sağlıklı hücreleri enfekte etmeyecek şekilde modifiye edilmiştir. Örneğin Talimogene laherparepvec (T-VEC), virüslerin sağlıklı hücrelerde çoğalması için gerekli olan bir genin silinerek yerine bağışıklığı uyaran bir insan geninin (GM-CSF) yerleştirildiği modifiye edilmiş bir herpes simpleks virüsüdür. Bu virüs kanser hücrelerini enfekte ettiğinde onları yok eder ve bunu yaparken GM-CSF geninin varlığı vücudun çevre dokularından dendritik hücreleri çeker. Dendritik hücreler ölü kanser hücrelerini işler ve bunların bileşenlerini bağışıklık sisteminin diğer hücrelerine sunar. Başarılı klinik deneyleri tamamlayan virüs, 2015'in sonlarında melanom tedavisi için onay aldı. Kanser hücrelerini öldürmek üzere yeniden programlanan virüslere onkolitik virüsler deniyor. ⓘ
Malzeme bilimi ve nanoteknoloji
Nanoteknolojideki mevcut eğilimler, virüslerin çok daha çok yönlü kullanımını vaat etmektedir. Bir malzeme bilimcinin bakış açısından virüsler organik nanopartiküller olarak görülebilir. Yüzeyleri, konak hücrelerinin bariyerlerini aşmalarını sağlayan özel araçlar taşır. Virüslerin boyutu ve şekli ile yüzeylerindeki fonksiyonel grupların sayısı ve doğası kesin olarak tanımlanmıştır. Bu nedenle, virüsler malzeme biliminde kovalent bağlı yüzey modifikasyonları için iskele olarak yaygın şekilde kullanılmaktadır. Virüslerin özel bir niteliği, yönlendirilmiş evrimle uyarlanabilmeleridir. Yaşam bilimleri tarafından geliştirilen güçlü teknikler, nanomalzemelere yönelik mühendislik yaklaşımlarının temelini oluşturmakta ve biyoloji ve tıbbın çok ötesinde geniş bir uygulama yelpazesi açmaktadır. ⓘ
Boyutları, şekilleri ve iyi tanımlanmış kimyasal yapıları nedeniyle virüsler, nano ölçekteki malzemeleri düzenlemek için şablon olarak kullanılmaktadır. Son örnekler arasında Washington, D.C.'deki Donanma Araştırma Laboratuvarı'nda, DNA mikroarray tabanlı sensörlerde sinyalleri yükseltmek için Börülce mozaik virüsü (CPMV) partikülleri kullanılarak yapılan çalışmalar yer almaktadır. Bu uygulamada virüs partikülleri, söndürücü olarak işlev gören floresan olmayan dimerlerin oluşumunu önlemek için sinyalizasyon için kullanılan floresan boyaları ayırmaktadır. Bir başka örnek de CPMV'nin moleküler elektronikler için nano ölçekli bir devre tahtası olarak kullanılmasıdır. ⓘ
Sentetik virüsler
Birçok virüs de novo ("sıfırdan") sentezlenebilir. İlk sentetik virüs 2002 yılında yaratılmıştır. Biraz yanlış bir kanı olsa da, sentezlenen gerçek virüs değil, DNA genomu (DNA virüsü durumunda) veya genomunun bir cDNA kopyasıdır (RNA virüsleri durumunda). Birçok virüs ailesi için çıplak sentetik DNA veya RNA (sentetik cDNA'dan enzimatik olarak geri dönüştürüldükten sonra) bir hücreye sokulduğunda bulaşıcıdır. Yani, yeni virüsler üretmek için gerekli tüm bilgileri içerirler. Bu teknoloji şu anda yeni aşı stratejilerini araştırmak için kullanılmaktadır. Virüs sentezleme becerisinin geniş kapsamlı sonuçları vardır, çünkü genom dizilimi bilgisi bilindiği ve izin veren hücreler mevcut olduğu sürece virüsler artık soyu tükenmiş olarak kabul edilemez. Haziran 2021 itibariyle, çiçek hastalığı da dahil olmak üzere 11.464 farklı virüsün tam uzunluktaki genom dizileri, Ulusal Sağlık Enstitüleri tarafından tutulan çevrimiçi bir veritabanında kamuya açıktır. ⓘ
Silahlar
Virüslerin insan toplumlarında yıkıcı salgınlara yol açabilmesi, virüslerin biyolojik savaş için silah olarak kullanılabileceği endişesine yol açmıştır. Kötü şöhretli 1918 influenza virüsünün bir laboratuarda başarılı bir şekilde yeniden yaratılması bu endişeyi daha da arttırmıştır. Çiçek virüsü, ortadan kaldırılmadan önce tarih boyunca çok sayıda toplumu harap etmiştir. Dünyada DSÖ tarafından çiçek virüsü stoklarını tutma yetkisi verilen sadece iki merkez bulunmaktadır: Rusya'daki Viroloji ve Biyoteknoloji Devlet Araştırma Merkezi VECTOR ve Amerika Birleşik Devletleri'ndeki Hastalık Kontrol ve Önleme Merkezleri. Çiçek aşısı bazen ciddi yan etkilere sahip olduğundan, artık hiçbir ülkede rutin olarak kullanılmamaktadır. Bu nedenle, modern insan nüfusunun çoğunun çiçek hastalığına karşı neredeyse hiç direnci yoktur ve virüse karşı savunmasız olacaktır. ⓘ