Metabolizma
| Üzerine bir serinin parçası ⓘ |
| Biyokimya |
|---|
 |
|
|
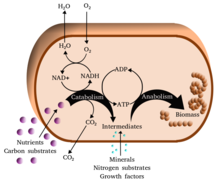

Metabolizma (/məˈtæbəlɪzəm/, Yunanca: μεταβολή metabolē, "değişim") organizmalarda yaşamı sürdüren kimyasal reaksiyonlar bütünüdür. Metabolizmanın üç ana amacı şunlardır: gıdadaki enerjinin hücresel süreçleri çalıştırmak için kullanılabilir enerjiye dönüştürülmesi; gıdanın proteinler, lipitler, nükleik asitler ve bazı karbonhidratlar için yapı taşlarına dönüştürülmesi; ve metabolik atıkların ortadan kaldırılması. Enzim katalizli bu reaksiyonlar organizmaların büyümesini ve çoğalmasını, yapılarını korumasını ve çevrelerine tepki vermesini sağlar. Metabolizma kelimesi, sindirim ve maddelerin farklı hücrelere ve hücreler arasında taşınması da dahil olmak üzere canlı organizmalarda meydana gelen tüm kimyasal reaksiyonların toplamını da ifade edebilir; bu durumda hücreler içinde yukarıda açıklanan reaksiyonlar kümesine ara (veya ara) metabolizma denir. ⓘ
Metabolik reaksiyonlar katabolik - bileşiklerin parçalanması (örneğin, hücresel solunumla glikozun piruvata dönüşmesi); veya anabolik - bileşiklerin oluşturulması (sentez) (proteinler, karbonhidratlar, lipitler ve nükleik asitler gibi) olarak kategorize edilebilir. Genellikle katabolizma enerji açığa çıkarır ve anabolizma enerji tüketir. ⓘ
Metabolizmanın kimyasal reaksiyonları, bir kimyasalın bir dizi adımla başka bir kimyasala dönüştürüldüğü ve her adımın belirli bir enzim tarafından kolaylaştırıldığı metabolik yollar halinde düzenlenir. Enzimler metabolizma için çok önemlidir, çünkü organizmaların enerji gerektiren ve kendiliğinden gerçekleşmeyecek reaksiyonları, enerji açığa çıkaran spontane reaksiyonlara bağlayarak yönlendirmelerini sağlarlar. Enzimler katalizör görevi görürler - bir reaksiyonun daha hızlı ilerlemesini sağlarlar - ve ayrıca, örneğin hücrenin çevresindeki değişikliklere veya diğer hücrelerden gelen sinyallere yanıt olarak bir metabolik reaksiyonun hızının düzenlenmesine izin verirler. ⓘ
Belirli bir organizmanın metabolik sistemi, hangi maddeleri besleyici, hangilerini zehirli bulacağını belirler. Örneğin, bazı prokaryotlar hidrojen sülfürü besin olarak kullanır, ancak bu gaz hayvanlar için zehirlidir. Bir organizmanın bazal metabolizma hızı, tüm bu kimyasal reaksiyonlar tarafından tüketilen enerji miktarının ölçüsüdür. ⓘ
Metabolizmanın çarpıcı bir özelliği, çok farklı türler arasında temel metabolik yolların benzerliğidir. Örneğin, sitrik asit döngüsündeki ara ürünler olarak bilinen karboksilik asitler bilinen tüm organizmalarda mevcuttur ve tek hücreli bakteri Escherichia coli'den filler gibi devasa çok hücreli organizmalara kadar çok çeşitli türlerde bulunur. Metabolik yollardaki bu benzerlikler muhtemelen evrimsel tarihte erken ortaya çıkmalarından kaynaklanmaktadır ve korunmaları muhtemelen etkinliklerinden kaynaklanmaktadır. Tip II diyabet, metabolik sendrom ve kanser gibi çeşitli hastalıklarda normal metabolizma bozulur. Kanser hücrelerinin metabolizması da normal hücrelerin metabolizmasından farklıdır ve bu farklılıklar kanserde terapötik müdahale için hedefler bulmak için kullanılabilir. ⓘ
Metabolizma (yapım-yıkım) veya istiklâp, canlıda yaşamın sürdürülmesi sırasında gerçekleşen tüm kimyasal tepkimelerdir. Canlı organizmada ya da canlı hücrede meydana gelen yapıcı ve yıkıcı nitelikteki kimyasal olayların tümünü içerir. ⓘ
Her organizma; büyüme, gelişme, ısı, hareket, üreme gibi yaşamsal etkinlikleri sürdürebilmek için dış çevreden bazı maddeler ve enerji almak zorundadır. Bu maddeler ve enerji, yaşamsal etkinliklerin sürdürülebilmesi için gereken organik moleküllerin sentezlenmesinde kullanılacaktır. Dış çevreden alınan organik ya da inorganik moleküller, ya önce parçalanarak, yıkıma uğratılarak ya da yıkıma gerek kalmadan gerekli moleküllerin sentezlenmesinde kullanılır. ⓘ
Anahtar biyokimyasallar

Hayvanları, bitkileri ve mikropları oluşturan yapıların çoğu dört temel molekül sınıfından oluşur: amino asitler, karbonhidratlar, nükleik asit ve lipitler (genellikle yağlar olarak adlandırılır). Bu moleküller yaşam için hayati önem taşıdığından, metabolik reaksiyonlar ya hücre ve dokuların inşası sırasında bu moleküllerin yapımına ya da sindirim yoluyla enerji elde etmek için parçalanıp kullanılmasına odaklanır. Bu biyokimyasallar, yaşamın temel makromolekülleri olan DNA ve proteinler gibi polimerleri yapmak için birleştirilebilir. ⓘ
| Molekül türü | Monomer formlarının adı | Polimer formlarının adı | Polimer formlarına örnekler ⓘ |
|---|---|---|---|
| Amino asitler | Amino asitler | Proteinler (polipeptitlerden oluşur) | Lifli proteinler ve globüler proteinler |
| Karbonhidratlar | Monosakkaritler | Polisakkaritler | Nişasta, glikojen ve selüloz |
| Nükleik asitler | Nükleotidler | Polinükleotitler | DNA ve RNA |
Amino asitler ve proteinler
Proteinler, peptit bağları ile birleştirilmiş doğrusal bir zincir halinde düzenlenmiş amino asitlerden oluşur. Birçok protein metabolizmadaki kimyasal reaksiyonları katalize eden enzimlerdir. Diğer proteinler, hücre şeklini koruyan bir iskele sistemi olan hücre iskeletini oluşturanlar gibi yapısal veya mekanik işlevlere sahiptir. Proteinler ayrıca hücre sinyalizasyonunda, bağışıklık tepkilerinde, hücre yapışmasında, zarlar arasında aktif taşımada ve hücre döngüsünde de önemlidir. Amino asitler ayrıca sitrik asit döngüsüne (trikarboksilik asit döngüsü) giriş için bir karbon kaynağı sağlayarak hücresel enerji metabolizmasına katkıda bulunur, özellikle glikoz gibi birincil bir enerji kaynağı az olduğunda veya hücreler metabolik strese maruz kaldığında. ⓘ
Lipidler
Lipidler, biyokimyasalların en çeşitli grubudur. Ana yapısal kullanımları, hücre zarı gibi hem iç hem de dış biyolojik zarların bir parçasıdır. Kimyasal enerjileri de kullanılabilir. Lipidler, oksijen içeren küçük bir polar bölge ile uzun, polar olmayan bir hidrokarbon zinciri içeren yağ asitlerinin polimerleridir. Lipidler genellikle hidrofobik veya amfipatik biyolojik moleküller olarak tanımlanırlar ancak etanol, benzen veya kloroform gibi organik çözücülerde çözünürler. Yağlar, yağ asitleri ve gliserol içeren büyük bir bileşik grubudur; ester bağları ile üç yağ asidine bağlı bir gliserol molekülüne triasilgliserit denir. Sfingomiyelindeki sfingozin gibi omurgalar ve fosfolipitlerde olduğu gibi fosfat gibi hidrofilik gruplar da dahil olmak üzere bu temel yapı üzerinde çeşitli varyasyonlar mevcuttur. Sterol gibi steroidler bir diğer önemli lipid sınıfıdır. ⓘ
Karbonhidratlar

Karbonhidratlar, düz zincirler veya halkalar halinde bulunabilen, birçok hidroksil grubunun bağlı olduğu aldehit veya ketonlardır. Karbonhidratlar en bol bulunan biyolojik moleküllerdir ve enerjinin depolanması ve taşınması (nişasta, glikojen) ve yapısal bileşenler (bitkilerde selüloz, hayvanlarda kitin) gibi çok sayıda rolü yerine getirirler. Temel karbonhidrat birimleri monosakkaritler olarak adlandırılır ve galaktoz, fruktoz ve en önemlisi glikozu içerir. Monosakkaritler neredeyse sınırsız şekilde polisakkaritler oluşturmak üzere birbirine bağlanabilir. ⓘ
Nükleotidler
İki nükleik asit, DNA ve RNA, nükleotidlerin polimerleridir. Her bir nükleotid, azotlu bir baza bağlı bir riboz veya deoksiriboz şeker grubuna bağlı bir fosfattan oluşur. Nükleik asitler, genetik bilginin depolanması ve kullanımı ile transkripsiyon ve protein biyosentezi süreçleri yoluyla yorumlanması için kritik öneme sahiptir. Bu bilgi DNA onarım mekanizmaları tarafından korunur ve DNA replikasyonu yoluyla yayılır. Birçok virüs, viral RNA genomundan bir DNA şablonu oluşturmak için ters transkripsiyon kullanan HIV gibi bir RNA genomuna sahiptir. Spliceosomes ve ribosomes gibi ribozimlerde bulunan RNA, kimyasal reaksiyonları katalize edebildiği için enzimlere benzer. Bireysel nükleozitler, bir riboz şekerine bir nükleobazın bağlanmasıyla yapılır. Bu bazlar, pürinler veya pirimidinler olarak sınıflandırılan azot içeren heterosiklik halkalardır. Nükleotidler ayrıca metabolik grup transferi reaksiyonlarında koenzim görevi görür. ⓘ
Koenzimler

Metabolizma çok çeşitli kimyasal reaksiyonları içerir, ancak çoğu, atomların fonksiyonel gruplarının ve bunların moleküller içindeki bağlarının transferini içeren birkaç temel reaksiyon türüne girer. Bu ortak kimya, hücrelerin farklı reaksiyonlar arasında kimyasal grupları taşımak için küçük bir dizi metabolik ara madde kullanmasına olanak tanır. Bu grup-transfer ara maddelerine koenzim denir. Her grup transfer reaksiyonu sınıfı, onu üreten bir dizi enzim ve onu tüketen bir dizi enzim için substrat olan belirli bir koenzim tarafından gerçekleştirilir. Dolayısıyla bu koenzimler sürekli olarak üretilir, tüketilir ve sonra geri dönüştürülür. ⓘ
Merkezi bir koenzim, hücrelerin evrensel enerji para birimi olan adenozin trifosfattır (ATP). Bu nükleotid, kimyasal enerjiyi farklı kimyasal reaksiyonlar arasında transfer etmek için kullanılır. Hücrelerde sadece az miktarda ATP bulunur, ancak sürekli olarak yenilendiği için insan vücudu günde yaklaşık kendi ağırlığınca ATP kullanabilir. ATP katabolizma ve anabolizma arasında bir köprü görevi görür. Katabolizma molekülleri parçalar ve anabolizma onları bir araya getirir. Katabolik reaksiyonlar ATP üretir ve anabolik reaksiyonlar onu tüketir. Ayrıca fosforilasyon reaksiyonlarında fosfat gruplarının taşıyıcısı olarak da görev yapar. ⓘ
Vitamin, hücrelerde yapılamayan küçük miktarlarda ihtiyaç duyulan organik bir bileşiktir. İnsan beslenmesinde, çoğu vitamin modifikasyondan sonra koenzim olarak işlev görür; örneğin, suda çözünen tüm vitaminler fosforile edilir veya hücrelerde kullanıldıklarında nükleotidlere bağlanır. B3 vitamininin (niasin) bir türevi olan nikotinamid adenin dinükleotid (NAD+), hidrojen alıcısı olarak görev yapan önemli bir koenzimdir. Yüzlerce ayrı dehidrojenaz türü, elektronları substratlarından uzaklaştırır ve NAD+'yi NADH'ye indirger. Koenzimin bu indirgenmiş formu daha sonra hücrede bulunan ve hidrojen atomlarını substratlarına aktarması gereken redüktazlar için bir substrattır. Nikotinamid adenin dinükleotid, hücrede NADH ve NADPH olmak üzere birbiriyle ilişkili iki formda bulunur. NAD+/NADH formu katabolik reaksiyonlarda daha önemliyken, NADP+/NADPH anabolik reaksiyonlarda kullanılır. ⓘ

Mineral ve kofaktörler
İnorganik elementler metabolizmada kritik rol oynar; bazıları bol miktarda bulunurken (örneğin sodyum ve potasyum) diğerleri çok düşük konsantrasyonlarda işlev görür. Bir insanın vücut ağırlığının yaklaşık %99'u karbon, nitrojen, kalsiyum, sodyum, klor, potasyum, hidrojen, fosfor, oksijen ve sülfür elementlerinden oluşur. Organik bileşikler (proteinler, lipitler ve karbonhidratlar) karbon ve nitrojenin çoğunu içerir; oksijen ve hidrojenin çoğu su olarak bulunur. ⓘ
Bol miktarda bulunan inorganik elementler elektrolit görevi görür. En önemli iyonlar sodyum, potasyum, kalsiyum, magnezyum, klorür, fosfat ve organik iyon bikarbonattır. Hücre zarları boyunca hassas iyon gradyanlarının korunması ozmotik basıncı ve pH'ı korur. İyonlar sinir ve kas fonksiyonları için de kritik öneme sahiptir, çünkü bu dokulardaki aksiyon potansiyelleri hücre dışı sıvı ile hücrenin sıvısı olan sitozol arasındaki elektrolit değişimi ile üretilir. Elektrolitler, iyon kanalları adı verilen hücre zarındaki proteinler aracılığıyla hücrelere girer ve çıkar. Örneğin, kas kasılması kalsiyum, sodyum ve potasyumun hücre zarı ve T-tübüllerindeki iyon kanalları aracılığıyla hareketine bağlıdır. ⓘ
Geçiş metalleri organizmalarda genellikle eser elementler olarak bulunur; çinko ve demir bunlardan en bol bulunanlarıdır. Metal kofaktörler proteinlerdeki belirli bölgelere sıkıca bağlanır; enzim kofaktörleri kataliz sırasında modifiye edilebilse de, katalizlenen reaksiyonun sonunda her zaman orijinal durumlarına geri dönerler. Metal mikro besinler belirli taşıyıcılar tarafından organizmalara alınır ve kullanılmadıkları zaman ferritin veya metallothionein gibi depolama proteinlerine bağlanırlar. ⓘ
Katabolizma
Katabolizma, büyük molekülleri parçalayan metabolik süreçler bütünüdür. Bunlar gıda moleküllerinin parçalanmasını ve oksitlenmesini içerir. Katabolik reaksiyonların amacı, molekülleri inşa eden anabolik reaksiyonların ihtiyaç duyduğu enerji ve bileşenleri sağlamaktır. Bu katabolik reaksiyonların kesin doğası organizmadan organizmaya farklılık gösterir ve organizmalar aşağıdaki tabloda gösterildiği gibi enerji, hidrojen ve karbon kaynaklarına (birincil besin grupları) göre sınıflandırılabilir. Organik moleküller organotroflar tarafından hidrojen atomu veya elektron kaynağı olarak kullanılırken, litotroflar inorganik substratları kullanır. Fototroflar güneş ışığını kimyasal enerjiye dönüştürürken, kemotroflar elektronların organik moleküller, hidrojen, hidrojen sülfür veya demir iyonları gibi indirgenmiş donör moleküllerden oksijen, nitrat veya sülfata transferini içeren redoks reaksiyonlarına bağlıdır. Hayvanlarda bu reaksiyonlar, karbondioksit ve su gibi daha basit moleküllere parçalanan karmaşık organik molekülleri içerir. Bitkiler ve siyanobakteriler gibi fotosentetik organizmalar, güneş ışığından emilen enerjiyi depolamak için benzer elektron transferi reaksiyonlarını kullanır. ⓘ
| Enerji kaynağı | güneş ışığı | fotoğraf- | -troph | ||
| Önceden oluşturulmuş moleküller | kemo- | ||||
| Hidrojen veya elektron donörü | organik bileşik | organo- | |||
| inorganik bileşik | lito- | ||||
| Karbon kaynağı | organik bileşik | hetero- | |||
| inorganik bileşik | otomatik- | ||||
Hayvanlardaki en yaygın katabolik reaksiyonlar üç ana aşamaya ayrılabilir. İlk aşamada proteinler, polisakkaritler veya lipitler gibi büyük organik moleküller hücre dışında daha küçük bileşenlerine ayrıştırılır. Daha sonra, bu küçük moleküller hücreler tarafından alınır ve genellikle asetil koenzim A (asetil-CoA) gibi daha küçük moleküllere dönüştürülerek bir miktar enerji açığa çıkarılır. Son olarak, CoA üzerindeki asetil grubu sitrik asit döngüsü ve elektron taşıma zincirinde su ve karbondioksite oksitlenir, koenzim nikotinamid adenin dinükleotidi (NAD+) NADH'ye indirgenirken daha fazla enerji açığa çıkar. ⓘ
Sindirim
Makromoleküller hücreler tarafından doğrudan işlenemez. Makromoleküller hücre metabolizmasında kullanılmadan önce daha küçük birimlere ayrılmalıdır. Bu polimerleri sindirmek için farklı enzim sınıfları kullanılıyordu. Bu sindirim enzimleri arasında proteinleri amino asitlere sindiren proteazların yanı sıra polisakkaritleri monosakkaritler olarak bilinen basit şekerlere sindiren glikozit hidrolazlar da bulunmaktadır. ⓘ
Mikroplar sindirim enzimlerini basitçe çevrelerine salgılarken, hayvanlar bu enzimleri yalnızca mide ve pankreas dahil olmak üzere bağırsaklarındaki özelleşmiş hücrelerden ve tükürük bezlerinden salgılar. Bu hücre dışı enzimler tarafından salınan amino asitler veya şekerler daha sonra aktif taşıma proteinleri tarafından hücrelere pompalanır. ⓘ
Organik bileşiklerden elde edilen enerji
Karbonhidrat katabolizması, karbonhidratların daha küçük birimlere parçalanmasıdır. Karbonhidratlar genellikle monosakkaritlere sindirildikten sonra hücrelere alınır. İçeri girdikten sonra, ana parçalanma yolu, glikoz ve fruktoz gibi şekerlerin pirüvata dönüştürüldüğü ve bir miktar ATP'nin üretildiği glikolizdir. Piruvat çeşitli metabolik yollarda bir ara maddedir, ancak çoğunluğu aerobik (oksijenli) glikoliz yoluyla asetil-CoA'ya dönüştürülür ve sitrik asit döngüsüne beslenir. Sitrik asit döngüsünde bir miktar daha ATP üretilse de, en önemli ürün asetil-CoA oksitlenirken NAD+'dan yapılan NADH'dir. Bu oksidasyon atık ürün olarak karbondioksit açığa çıkarır. Anaerobik koşullarda glikoliz, laktat dehidrojenaz enziminin NADH'yi glikolizde yeniden kullanmak üzere NAD+'ya yeniden oksitlemesi yoluyla laktat üretir. Glikozun parçalanması için alternatif bir yol da NADPH koenzimini indirgeyen ve nükleik asitlerin şeker bileşeni olan riboz gibi pentoz şekerleri üreten pentoz fosfat yoludur. ⓘ
Yağlar hidroliz yoluyla serbest yağ asitlerine ve gliserole katabolize edilir. Gliserol glikolize girer ve yağ asitleri beta oksidasyonu ile parçalanarak asetil-CoA açığa çıkar ve bu da sitrik asit döngüsüne beslenir. Yağ asitleri karbonhidratlara kıyasla oksidasyon sırasında daha fazla enerji açığa çıkarır. Steroidler de bazı bakteriler tarafından beta oksidasyona benzer bir süreçte parçalanır ve bu parçalanma süreci, hücre tarafından enerji için kullanılabilen önemli miktarlarda asetil-CoA, propiyonil-CoA ve piruvatın salınmasını içerir. M. tuberculosis aynı zamanda tek karbon kaynağı olarak lipid kolesterol üzerinde de büyüyebilir ve kolesterol kullanım yollarında yer alan genlerin M. tuberculosis'in enfeksiyon yaşam döngüsünün çeşitli aşamalarında önemli olduğu doğrulanmıştır. ⓘ
Amino asitler ya proteinleri ve diğer biyomolekülleri sentezlemek için kullanılır ya da enerji üretmek için üre ve karbondioksite oksitlenir. Oksidasyon yolu, bir transaminaz tarafından amino grubunun çıkarılmasıyla başlar. Amino grubu, bir keto asit formunda deamine bir karbon iskeleti bırakarak üre döngüsüne beslenir. Bu keto asitlerin birçoğu sitrik asit döngüsünde ara ürünlerdir, örneğin glutamatın deaminasyonu ile oluşan α-ketoglutarat. Glukojenik amino asitler de glukoneogenez yoluyla glukoza dönüştürülebilir (aşağıda tartışılmıştır). ⓘ
Enerji dönüşümleri
Oksidatif fosforilasyon
Oksidatif fosforilasyonda, sitrik asit döngüsü gibi alanlarda organik moleküllerden uzaklaştırılan elektronlar oksijene aktarılır ve açığa çıkan enerji ATP yapmak için kullanılır. Bu işlem ökaryotlarda mitokondri zarlarında bulunan ve elektron taşıma zinciri adı verilen bir dizi protein tarafından gerçekleştirilir. Prokaryotlarda bu proteinler hücrenin iç zarında bulunur. Bu proteinler, protonları bir zar boyunca pompalamak için NADH gibi indirgenmiş moleküllerden gelen enerjiyi kullanır. ⓘ

Protonların mitokondriden dışarı pompalanması membran boyunca bir proton konsantrasyon farkı yaratır ve bir elektrokimyasal gradyan oluşturur. Bu kuvvet protonları ATP sentaz adı verilen bir enzimin tabanı aracılığıyla mitokondriye geri iter. Proton akışı, sap alt biriminin dönmesini sağlayarak sentaz alanının aktif bölgesinin şekil değiştirmesine ve adenozin difosfatı fosforile ederek ATP'ye dönüştürmesine neden olur. ⓘ
İnorganik bileşiklerden gelen enerji
Kemolitotrofi, prokaryotlarda bulunan ve enerjinin inorganik bileşiklerin oksidasyonundan elde edildiği bir metabolizma türüdür. Bu organizmalar indirgeyici güç kaynağı olarak hidrojen, indirgenmiş sülfür bileşikleri (sülfür, hidrojen sülfür ve tiyosülfat gibi), demir (Fe(II)) veya amonyak kullanabilir ve bu bileşiklerin oksidasyonundan enerji elde ederler. Bu mikrobiyal süreçler asetojenez, nitrifikasyon ve denitrifikasyon gibi küresel biyojeokimyasal döngülerde önemlidir ve toprak verimliliği için kritik öneme sahiptir. ⓘ
Işıktan gelen enerji
Güneş ışığındaki enerji bitkiler, siyanobakteriler, mor bakteriler, yeşil sülfür bakterileri ve bazı protistler tarafından yakalanır. Bu süreç genellikle aşağıda ele alınan fotosentezin bir parçası olarak karbondioksitin organik bileşiklere dönüştürülmesiyle bağlantılıdır. Bununla birlikte, enerji yakalama ve karbon sabitleme sistemleri prokaryotlarda ayrı ayrı çalışabilir, çünkü mor bakteriler ve yeşil sülfür bakterileri güneş ışığını bir enerji kaynağı olarak kullanabilirken, karbon sabitleme ve organik bileşiklerin fermantasyonu arasında geçiş yapabilir. ⓘ
Birçok organizmada, güneş enerjisinin yakalanması prensipte oksidatif fosforilasyona benzer, çünkü enerjinin bir proton konsantrasyon gradyanı olarak depolanmasını içerir. Bu proton itici gücü daha sonra ATP sentezini harekete geçirir Bu elektron taşıma zincirini harekete geçirmek için gereken elektronlar fotosentetik reaksiyon merkezleri adı verilen ışık toplayıcı proteinlerden gelir. Reaksiyon merkezleri, mevcut fotosentetik pigmentin doğasına bağlı olarak iki tipte sınıflandırılır; çoğu fotosentetik bakteri yalnızca bir tipe sahipken, bitkiler ve siyanobakteriler iki tipe sahiptir. ⓘ
Bitkilerde, alglerde ve siyanobakterilerde fotosistem II ışık enerjisini kullanarak elektronları sudan uzaklaştırır ve atık ürün olarak oksijen açığa çıkarır. Elektronlar daha sonra sitokrom b6f kompleksine akar, bu da enerjilerini kloroplasttaki tilakoid membran boyunca protonları pompalamak için kullanır. Bu protonlar, daha önce olduğu gibi ATP sentazı çalıştırırken zardan geri hareket eder. Elektronlar daha sonra fotosistem I'den akar ve NADP+ koenzimini indirgemek için kullanılabilir. Bu koenzim aşağıda tartışılan Calvin döngüsüne girebilir veya daha fazla ATP üretimi için geri dönüştürülebilir. ⓘ
Anabolizma
Anabolizma, katabolizma ile açığa çıkan enerjinin karmaşık molekülleri sentezlemek için kullanıldığı yapıcı metabolik süreçler bütünüdür. Genel olarak, hücresel yapıları oluşturan karmaşık moleküller, daha küçük ve daha basit öncüllerden adım adım inşa edilir. Anabolizma üç temel aşamadan oluşur. Birincisi, amino asitler, monosakkaritler, izoprenoidler ve nükleotitler gibi öncüllerin üretimi, ikincisi, ATP'den gelen enerji kullanılarak reaktif formlara aktivasyonu ve üçüncüsü, bu öncüllerin proteinler, polisakkaritler, lipitler ve nükleik asitler gibi karmaşık moleküllere birleştirilmesidir. ⓘ
Organizmalarda anabolizma, hücrelerinde inşa edilen moleküllerin kaynağına göre farklı olabilir. Bitkiler gibi ototroflar, hücrelerindeki polisakkaritler ve proteinler gibi karmaşık organik molekülleri karbondioksit ve su gibi basit moleküllerden oluşturabilir. Heterotroflar ise bu karmaşık molekülleri üretmek için monosakkaritler ve amino asitler gibi daha karmaşık maddelerden oluşan bir kaynağa ihtiyaç duyarlar. Organizmalar enerjilerinin nihai kaynağına göre daha da sınıflandırılabilir: fotoototroflar ve fotoheterotroflar enerjiyi ışıktan elde ederken, kemoototroflar ve kemoheterotroflar enerjiyi oksidasyon reaksiyonlarından elde eder. ⓘ
Karbon fiksasyonu

Fotosentez, güneş ışığı ve karbondioksitten (CO2) karbonhidratların sentezlenmesidir. Bitkilerde, siyanobakterilerde ve alglerde oksijenik fotosentez suyu böler ve atık ürün olarak oksijen üretilir. Bu süreç, yukarıda açıklandığı gibi fotosentetik reaksiyon merkezleri tarafından üretilen ATP ve NADPH'yi CO2'yi gliserat 3-fosfata dönüştürmek için kullanır, bu da daha sonra glikoza dönüştürülebilir. Bu karbon fiksasyon reaksiyonu, Calvin - Benson döngüsünün bir parçası olarak RuBisCO enzimi tarafından gerçekleştirilir. Bitkilerde üç tür fotosentez meydana gelir: C3 karbon fiksasyonu, C4 karbon fiksasyonu ve CAM fotosentezi. Bunlar, karbondioksitin Calvin döngüsünde izlediği yola göre farklılık gösterir; C3 bitkileri CO2'yi doğrudan sabitlerken, C4 ve CAM fotosentezi, yoğun güneş ışığı ve kuru koşullarla başa çıkmak için adaptasyon olarak CO2'yi önce diğer bileşiklere dahil eder. ⓘ
Fotosentetik prokaryotlarda karbon fiksasyon mekanizmaları daha çeşitlidir. Burada karbondioksit, Calvin - Benson döngüsü, tersine çevrilmiş bir sitrik asit döngüsü veya asetil-CoA'nın karboksilasyonu ile sabitlenebilir. Prokaryotik kemoototroflar da CO2'yi Calvin-Benson döngüsü yoluyla sabitler, ancak reaksiyonu yönlendirmek için inorganik bileşiklerden gelen enerjiyi kullanır. ⓘ
Karbonhidratlar ve glikanlar
Karbonhidrat anabolizmasında, basit organik asitler glukoz gibi monosakkaritlere dönüştürülebilir ve daha sonra nişasta gibi polisakkaritleri bir araya getirmek için kullanılabilir. Piruvat, laktat, gliserol, gliserat 3-fosfat ve amino asitler gibi bileşiklerden glukoz üretilmesine glukoneogenez denir. Glukoneogenez, pirüvatı birçoğu glikoliz ile paylaşılan bir dizi ara madde aracılığıyla glukoz-6-fosfata dönüştürür. Bununla birlikte, bu yol basitçe glikolizin tersine işlemesi değildir, çünkü birkaç adım glikolitik olmayan enzimler tarafından katalize edilir. Bu, glikoz oluşumunun ve yıkımının ayrı ayrı düzenlenmesine olanak tanıdığı ve her iki yolun da aynı anda boş bir döngüde çalışmasını önlediği için önemlidir. ⓘ
Yağ enerji depolamanın yaygın bir yolu olmasına rağmen, insanlar gibi omurgalılarda bu depolardaki yağ asitleri glukoneogenez yoluyla glukoza dönüştürülemez çünkü bu organizmalar asetil-CoA'yı piruvata dönüştüremez; bitkiler bunu yapar, ancak hayvanlar gerekli enzimatik mekanizmaya sahip değildir. Sonuç olarak, uzun süreli açlıktan sonra, omurgalıların beyin gibi yağ asitlerini metabolize edemeyen dokularda glikozun yerini almak için yağ asitlerinden keton cisimleri üretmeleri gerekir. Bitkiler ve bakteriler gibi diğer organizmalarda bu metabolik sorun, sitrik asit döngüsündeki dekarboksilasyon adımını atlayan ve asetil-CoA'nın glikoz üretimi için kullanılabileceği oksaloasetata dönüşümünü sağlayan glioksilat döngüsü kullanılarak çözülür. Yağ dışında, glikoz çoğu dokuda, genellikle kandaki glikoz seviyesini korumak için kullanılan glikojenez yoluyla doku içinde mevcut bir enerji kaynağı olarak depolanır. ⓘ
Polisakkaritler ve glikanlar, monosakkaritlerin glikoziltransferaz tarafından üridin difosfat glukoz (UDP-Glc) gibi reaktif bir şeker-fosfat vericisinden büyüyen polisakkarit üzerindeki bir alıcı hidroksil grubuna sırayla eklenmesiyle yapılır. Substratın halkası üzerindeki hidroksil gruplarından herhangi biri alıcı olabileceğinden, üretilen polisakkaritler düz veya dallanmış yapılara sahip olabilir. Üretilen polisakkaritlerin kendileri yapısal veya metabolik işlevlere sahip olabilir veya oligosakkariltransferaz adı verilen enzimler tarafından lipitlere ve proteinlere aktarılabilir. ⓘ
Yağ asitleri, izoprenoidler ve sterol

Yağ asitleri, polimerize olan ve ardından asetil-CoA birimlerini indirgeyen yağ asidi sentazları tarafından yapılır. Yağ asitlerindeki açil zincirleri, açil grubunu ekleyen, bir alkole indirgeyen, bir alken grubuna dehidrate eden ve sonra tekrar bir alkan grubuna indirgeyen bir reaksiyon döngüsü ile uzatılır. Yağ asidi biyosentezi enzimleri iki gruba ayrılır: hayvanlarda ve mantarlarda, tüm bu yağ asidi sentaz reaksiyonları tek bir çok işlevli tip I protein tarafından gerçekleştirilirken, bitki plastidlerinde ve bakterilerde yoldaki her adımı ayrı tip II enzimler gerçekleştirir. ⓘ
Terpenler ve izoprenoidler, karotenoidleri de içeren geniş bir lipit sınıfıdır ve en büyük bitki doğal ürünleri sınıfını oluşturur. Bu bileşikler, reaktif öncüler olan izopentenil pirofosfat ve dimetilalil pirofosfattan bağışlanan izopren birimlerinin birleştirilmesi ve modifikasyonu ile yapılır. Bu öncüler farklı şekillerde yapılabilir. Hayvanlarda ve arkelerde mevalonat yolu bu bileşikleri asetil-CoA'dan üretirken, bitkilerde ve bakterilerde mevalonat olmayan yol substrat olarak piruvat ve gliseraldehit 3-fosfat kullanır. Bu aktif izopren donörlerini kullanan önemli bir reaksiyon sterol biyosentezidir. Burada, izopren birimleri skualen yapmak için birleştirilir ve daha sonra lanosterol yapmak için katlanır ve bir dizi halka haline getirilir. Lanosterol daha sonra kolesterol ve ergosterol gibi diğer sterollere dönüştürülebilir. ⓘ
Proteinler
Organizmalar 20 yaygın amino asidi sentezleme yetenekleri bakımından farklılık gösterir. Çoğu bakteri ve bitki yirmi amino asidin tamamını sentezleyebilir, ancak memeliler yalnızca on bir esansiyel olmayan amino asidi sentezleyebilir, bu nedenle dokuz esansiyel amino asit gıdalardan elde edilmelidir. Mycoplasma pneumoniae bakterisi gibi bazı basit parazitler tüm amino asit sentezinden yoksundur ve amino asitlerini doğrudan konaklarından alırlar. Tüm amino asitler glikoliz, sitrik asit döngüsü veya pentoz fosfat yolundaki ara maddelerden sentezlenir. Azot glutamat ve glutamin tarafından sağlanır. Özsüz amino asit sentezi, daha sonra bir amino asit oluşturmak üzere transaminasyona uğrayan uygun alfa-keto asidin oluşumuna bağlıdır. ⓘ
Amino asitler, bir peptit bağları zincirinde birleştirilerek proteinlere dönüştürülür. Her farklı proteinin kendine özgü bir amino asit kalıntıları dizisi vardır: bu onun birincil yapısıdır. Alfabedeki harflerin neredeyse sonsuz çeşitlilikte sözcükler oluşturmak üzere birleştirilebilmesi gibi, amino asitler de çok çeşitli proteinler oluşturmak üzere farklı dizilimlerde bağlanabilir. Proteinler, bir ester bağı aracılığıyla bir transfer RNA molekülüne bağlanarak aktive edilen amino asitlerden yapılır. Bu aminoasil-tRNA öncüsü, bir aminoasil tRNA sentetaz tarafından gerçekleştirilen ATP'ye bağlı bir reaksiyonda üretilir. Bu aminoasil-tRNA daha sonra ribozom için bir substrattır ve bir mesajcı RNA'daki dizi bilgisini kullanarak amino asidi uzayan protein zincirine birleştirir. ⓘ
Nükleotid sentezi ve kurtarılması
Nükleotidler, büyük miktarlarda metabolik enerji gerektiren yollarda amino asitler, karbondioksit ve formik asitten yapılır. Sonuç olarak, çoğu organizma önceden oluşturulmuş nükleotidleri kurtarmak için etkili sistemlere sahiptir. Pürinler nükleosidler (riboza bağlı bazlar) olarak sentezlenir. Hem adenin hem de guanin, glisin, glutamin ve aspartik asit amino asitlerinden gelen atomların yanı sıra koenzim tetrahidrofolattan aktarılan format kullanılarak sentezlenen öncü nükleozit inozin monofosfattan yapılır. Pirimidinler ise glutamin ve aspartattan oluşan orotat bazından sentezlenir. ⓘ
Ksenobiyotikler ve redoks metabolizması
Tüm organizmalar sürekli olarak gıda olarak kullanamadıkları ve metabolik işlevleri olmadığı için hücrelerde birikmeleri halinde zararlı olabilecek bileşiklere maruz kalırlar. Bu potansiyel olarak zarar verici bileşiklere ksenobiyotik denir. Sentetik ilaçlar, doğal zehirler ve antibiyotikler gibi ksenobiyotikler, bir dizi ksenobiyotik metabolize edici enzim tarafından detoksifiye edilir. İnsanlarda bunlar arasında sitokrom P450 oksidazlar, UDP-glukuronosiltransferazlar ve glutatyon S-transferazlar bulunur. Bu enzim sistemi üç aşamada hareket ederek önce ksenobiyotiği okside eder (faz I) ve ardından suda çözünen grupları molekül üzerine konjuge eder (faz II). Modifiye edilmiş suda çözünür ksenobiyotik daha sonra hücrelerden dışarı pompalanabilir ve çok hücreli organizmalarda atılmadan önce daha fazla metabolize edilebilir (faz III). Ekolojide bu reaksiyonlar özellikle kirleticilerin mikrobiyal biyolojik parçalanmasında ve kirlenmiş arazilerin ve petrol sızıntılarının biyoremediasyonunda önemlidir. Bu mikrobiyal reaksiyonların çoğu çok hücreli organizmalarla paylaşılır, ancak mikrop türlerinin inanılmaz çeşitliliği nedeniyle bu organizmalar çok hücreli organizmalardan çok daha geniş bir ksenobiyotik yelpazesiyle başa çıkabilir ve organoklorür bileşikleri gibi kalıcı organik kirleticileri bile bozabilir. ⓘ
Aerobik organizmalar için ilgili bir sorun da oksidatif strestir. Burada, oksidatif fosforilasyon ve protein katlanması sırasında disülfit bağlarının oluşumu gibi süreçler hidrojen peroksit gibi reaktif oksijen türleri üretir. Bu zararlı oksidanlar, glutatyon gibi antioksidan metabolitler ve katalazlar ve peroksidazlar gibi enzimler tarafından uzaklaştırılır. ⓘ
Canlı organizmaların termodinamiği
Canlı organizmalar, ısı ve iş transferini tanımlayan termodinamik yasalarına uymak zorundadır. Termodinamiğin ikinci yasası, izole edilmiş herhangi bir sistemde entropi (düzensizlik) miktarının azalamayacağını belirtir. Canlı organizmaların şaşırtıcı karmaşıklığı bu yasayla çelişiyor gibi görünse de, tüm organizmalar çevreleriyle madde ve enerji alışverişi yapan açık sistemler olduğu için yaşam mümkündür. Canlı sistemler dengede değildir, bunun yerine çevrelerinin entropisinde daha büyük bir artışa neden olarak yüksek karmaşıklık durumlarını koruyan dağıtıcı sistemlerdir. Bir hücrenin metabolizması bunu, katabolizmanın spontane süreçlerini anabolizmanın spontane olmayan süreçlerine bağlayarak başarır. Termodinamik açıdan, metabolizma düzensizlik yaratarak düzeni korur. ⓘ
Düzenleme ve kontrol
Çoğu organizmanın çevresi sürekli değiştiğinden, metabolizma reaksiyonları, homeostaz adı verilen bir durum olan hücreler içinde sabit bir dizi koşulu korumak için hassas bir şekilde düzenlenmelidir. Metabolik düzenleme ayrıca organizmaların sinyallere yanıt vermesine ve çevreleriyle aktif olarak etkileşime girmesine olanak tanır. Metabolik yolların nasıl kontrol edildiğini anlamak için birbiriyle yakından bağlantılı iki kavram önemlidir. İlk olarak, bir yolaktaki bir enzimin düzenlenmesi, sinyallere yanıt olarak aktivitesinin nasıl artırıldığı ve azaltıldığıdır. İkinci olarak, bu enzim tarafından uygulanan kontrol, aktivitesindeki bu değişikliklerin yolun genel hızı (yol boyunca akı) üzerindeki etkisidir. Örneğin, bir enzim aktivitesinde büyük değişiklikler gösterebilir (yani yüksek oranda düzenlenir), ancak bu değişikliklerin bir metabolik yolun akışı üzerinde çok az etkisi varsa, bu enzim yolun kontrolüne dahil değildir. ⓘ

Metabolik düzenlemenin birden fazla seviyesi vardır. İçsel düzenlemede, metabolik yol, substrat veya ürün seviyelerindeki değişikliklere yanıt vermek için kendi kendini düzenler; örneğin, ürün miktarındaki bir azalma, telafi etmek için yol boyunca akıyı artırabilir. Bu tür bir düzenleme genellikle yolaktaki birden fazla enzimin faaliyetlerinin allosterik düzenlenmesini içerir. Dışsal kontrol, çok hücreli bir organizmada bir hücrenin diğer hücrelerden gelen sinyallere yanıt olarak metabolizmasını değiştirmesini içerir. Bu sinyaller genellikle hormonlar ve büyüme faktörleri gibi suda çözünen haberciler şeklindedir ve hücre yüzeyindeki spesifik reseptörler tarafından algılanır. Bu sinyaller daha sonra genellikle proteinlerin fosforilasyonunu içeren ikinci haberci sistemleri ile hücre içine iletilir. ⓘ
Dışsal kontrolün çok iyi anlaşılmış bir örneği, glikoz metabolizmasının insülin hormonu tarafından düzenlenmesidir. İnsülin, kan glikoz seviyelerindeki artışlara yanıt olarak üretilir. Hormonun hücrelerdeki insülin reseptörlerine bağlanması, hücrelerin glikozu almasına ve yağ asitleri ve glikojen gibi depolama moleküllerine dönüştürmesine neden olan bir dizi protein kinazı aktive eder. Glikojen metabolizması, glikojeni parçalayan enzim olan fosforilaz ve onu yapan enzim olan glikojen sentaz aktivitesi ile kontrol edilir. Bu enzimler karşılıklı bir şekilde düzenlenir; fosforilasyon glikojen sentazı inhibe ederken fosforilazı aktive eder. İnsülin, protein fosfatazları aktive ederek ve bu enzimlerin fosforilasyonunda bir azalma üreterek glikojen sentezine neden olur. ⓘ
Evrim

Glikoliz ve sitrik asit döngüsü gibi yukarıda açıklanan merkezi metabolizma yolları, canlıların her üç alanında da mevcuttur ve son evrensel ortak atada da mevcuttu. Bu evrensel atasal hücre prokaryotikti ve muhtemelen kapsamlı amino asit, nükleotid, karbonhidrat ve lipid metabolizmasına sahip bir metanojendi. Daha sonraki evrim sırasında bu eski yolların korunması, glikoliz ve sitrik asit döngüsü gibi yolların son ürünlerini son derece verimli bir şekilde ve minimum sayıda adımda üretmesiyle, bu reaksiyonların kendi özel metabolik sorunlarına en uygun çözüm olmasının bir sonucu olabilir. Enzim temelli metabolizmanın ilk yolları pürin nükleotid metabolizmasının parçaları olabilirken, önceki metabolik yollar antik RNA dünyasının bir parçasıydı. ⓘ
Yeni metabolik yolların evrimleştiği mekanizmaları tanımlamak için birçok model önerilmiştir. Bunlar arasında yeni enzimlerin kısa bir atasal yola sırayla eklenmesi, tüm yolların çoğaltılması ve ardından farklılaşması ve önceden var olan enzimlerin işe alınması ve bunların yeni bir reaksiyon yoluna birleştirilmesi yer almaktadır. Bu mekanizmaların göreceli önemi belirsizdir, ancak genomik çalışmalar, bir yolaktaki enzimlerin ortak bir ataya sahip olma ihtimalinin yüksek olduğunu göstermiştir; bu da birçok yolağın, yolaktaki önceden var olan adımlardan oluşturulan yeni işlevlerle adım adım evrimleştiğini düşündürmektedir. Alternatif bir model, metabolik ağlardaki protein yapılarının evrimini izleyen çalışmalardan gelmektedir; bu, enzimlerin yaygın bir şekilde işe alındığını, farklı metabolik yollarda benzer işlevleri yerine getirmek için enzimlerin ödünç alındığını öne sürmüştür (MANET veritabanında açıkça görülmektedir) Bu işe alma süreçleri evrimsel bir enzimatik mozaikle sonuçlanır. Üçüncü bir olasılık ise, metabolizmanın bazı bölümlerinin farklı yollarda yeniden kullanılabilen ve farklı moleküller üzerinde benzer işlevleri yerine getiren "modüller" olarak var olabileceğidir. ⓘ
Yeni metabolik yolların evrimleşmesinin yanı sıra, evrim metabolik işlevlerin kaybına da neden olabilir. Örneğin, bazı parazitlerde hayatta kalmak için gerekli olmayan metabolik süreçler kaybolur ve bunun yerine önceden oluşturulmuş amino asitler, nükleotitler ve karbonhidratlar konakçıdan alınabilir. Benzer azalmış metabolik kabiliyetler endosimbiyotik organizmalarda da görülür. ⓘ
Araştırma ve manipülasyon

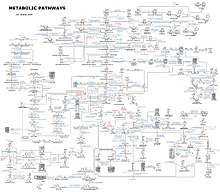
Klasik olarak metabolizma, tek bir metabolik yola odaklanan indirgemeci bir yaklaşımla incelenir. Radyoaktif olarak etiketlenmiş ara ürünleri ve ürünleri tanımlayarak öncüllerden nihai ürünlere giden yolları tanımlayan radyoaktif izleyicilerin tüm organizma, doku ve hücresel seviyelerde kullanılması özellikle değerlidir. Bu kimyasal reaksiyonları katalize eden enzimler daha sonra saflaştırılabilir ve kinetikleri ve inhibitörlere tepkileri araştırılabilir. Paralel bir yaklaşım da bir hücre veya dokudaki küçük molekülleri tanımlamaktır; bu moleküllerin tamamına metabolom adı verilir. Genel olarak, bu çalışmalar basit metabolik yolların yapısı ve işlevi hakkında iyi bir görüş verir, ancak tam bir hücrenin metabolizması gibi daha karmaşık sistemlere uygulandığında yetersiz kalır. ⓘ
Binlerce farklı enzim içeren hücrelerdeki metabolik ağların karmaşıklığı hakkında bir fikir, sağda sadece 43 protein ve 40 metabolit arasındaki etkileşimleri gösteren şekil ile verilmektedir: genom dizileri 26.500'e kadar gen içeren listeler sağlamaktadır. Bununla birlikte, bu genomik verileri biyokimyasal reaksiyonların tam ağlarını yeniden yapılandırmak ve davranışlarını açıklayabilecek ve tahmin edebilecek daha bütünsel matematiksel modeller üretmek için kullanmak artık mümkün. Bu modeller, klasik yöntemlerle elde edilen yolak ve metabolit verilerini proteomik ve DNA mikroarray çalışmalarından elde edilen gen ifadesi verileriyle entegre etmek için kullanıldığında özellikle güçlüdür. Bu teknikler kullanılarak, gelecekteki ilaç keşfi ve biyokimyasal araştırmalara rehberlik edecek bir insan metabolizması modeli üretilmiştir. Bu modeller artık insan hastalıklarını ortak proteinleri veya metabolitleri paylaşan gruplar halinde sınıflandırmak için ağ analizinde kullanılmaktadır. ⓘ
Bakteriyel metabolik ağlar, çok çeşitli besin maddelerini girebilen ve nispeten az sayıda ara ortak para birimi kullanarak çok çeşitli ürünler ve karmaşık makromoleküller üretebilen bir mimari olan papyon organizasyonunun çarpıcı bir örneğidir. ⓘ
Bu bilginin önemli bir teknolojik uygulaması metabolik mühendisliktir. Burada maya, bitki veya bakteri gibi organizmalar, biyoteknolojide daha kullanışlı hale getirmek ve antibiyotik gibi ilaçların veya 1,3-propandiol ve şikimik asit gibi endüstriyel kimyasalların üretimine yardımcı olmak için genetik olarak değiştirilir. Bu genetik modifikasyonlar genellikle ürünü üretmek için kullanılan enerji miktarını azaltmayı, verimi artırmayı ve atık üretimini azaltmayı amaçlamaktadır. ⓘ
Tarih
Metabolizma terimi Fransızca "métabolisme" veya Eski Yunanca μεταβολή - "Metabole" kelimesinden türetilmiş olup "değiştirmek" anlamına gelmektedir. ⓘ
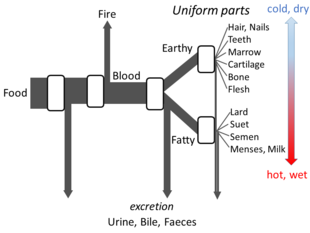
Yunan felsefesi
Aristoteles'in Hayvanların Kısımları adlı eseri, açık bir akış modelinin oluşturulabilmesi için metabolizma hakkındaki görüşlerinin yeterli ayrıntılarını ortaya koymaktadır. Sürecin her aşamasında gıdalardaki maddelerin dönüştüğüne, ısının klasik ateş elementi olarak açığa çıktığına ve artık maddelerin idrar, safra veya dışkı olarak dışarı atıldığına inanmıştır. ⓘ
İslami tıp
İbnü'n-Nefis, MS 1260 yılında yazdığı Al-Risalah al-Kamiliyyah fil Siera al-Nabawiyyah (Kamil'in Peygamberin Biyografisi Üzerine Risalesi) adlı eserinde metabolizmayı şöyle tanımlamıştır: "Hem beden hem de onun parçaları sürekli bir çözülme ve beslenme halindedir, bu nedenle kaçınılmaz olarak sürekli bir değişim geçirirler." ⓘ
Bilimsel yöntemin uygulanması
Metabolizmanın bilimsel olarak incelenmesinin tarihi birkaç yüzyılı kapsar ve ilk çalışmalarda tüm hayvanların incelenmesinden modern biyokimyada tek tek metabolik reaksiyonların incelenmesine kadar uzanır. İnsan metabolizmasına ilişkin ilk kontrollü deneyler 1614 yılında Santorio Santorio tarafından Ars de statica medicina adlı kitabında yayınlanmıştır. Yemekten, uyumadan, çalışmadan, seks yapmadan, aç kalmadan, içmeden ve boşaltım yapmadan önce ve sonra kendini nasıl tarttığını anlatmıştır. Aldığı gıdanın çoğunun "duyarsız terleme" adını verdiği yolla kaybolduğunu tespit etmiştir. ⓘ

Bu ilk çalışmalarda, bu metabolik süreçlerin mekanizmaları tanımlanmamıştı ve canlı dokuyu canlandıran hayati bir güç olduğu düşünülüyordu. 19. yüzyılda, şekerin maya tarafından alkole fermantasyonunu inceleyen Louis Pasteur, fermantasyonun maya hücreleri içindeki "fermentler" olarak adlandırdığı maddeler tarafından katalize edildiği sonucuna varmıştır. "Alkolik fermantasyon, hücrelerin ölümü ya da çürümesi ile değil, maya hücrelerinin yaşamı ve organizasyonu ile ilişkili bir eylemdir" diye yazmıştır. Bu keşif, Friedrich Wöhler'in 1828 yılında ürenin kimyasal sentezi üzerine bir makale yayınlamasıyla birlikte, tamamen inorganik öncüllerden hazırlanan ilk organik bileşik olmasıyla dikkat çekmektedir. Bu, hücrelerde bulunan organik bileşiklerin ve kimyasal reaksiyonların prensipte kimyanın diğer bölümlerinden farklı olmadığını kanıtladı. ⓘ
Metabolizmanın kimyasal reaksiyonlarının incelenmesini hücrelerin biyolojik incelenmesinden ayıran ve biyokimyanın başlangıcına işaret eden, 20. yüzyılın başında Eduard Buchner tarafından enzimlerin keşfedilmesiydi. Biyokimyasal bilgi birikimi 20. yüzyılın başlarında hızla artmıştır. Bu modern biyokimyacıların en üretkenlerinden biri, metabolizma çalışmalarına büyük katkılarda bulunan Hans Krebs'ti. Üre döngüsünü ve daha sonra Hans Kornberg ile birlikte çalışarak sitrik asit döngüsünü ve glioksilat döngüsünü keşfetmiştir. Modern biyokimyasal araştırmalar kromatografi, X-ışını kırınımı, NMR spektroskopisi, radyoizotopik etiketleme, elektron mikroskopisi ve moleküler dinamik simülasyonları gibi yeni tekniklerin geliştirilmesiyle büyük ölçüde desteklenmiştir. Bu teknikler, hücrelerdeki birçok molekülün ve metabolik yolun keşfedilmesine ve ayrıntılı analizine olanak sağlamıştır. ⓘ
