Fenol
|
| |||
|
| |||

| |||
| İsimler | |||
|---|---|---|---|
| Tercih edilen IUPAC adı
Fenol | |||
| Sistematik IUPAC adı
Benzenol | |||
| Diğer isimler
Karbolik asit
Fenilik asit Hidroksibenzen Fenik asit | |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
C6H6O | ||
| Molar kütle | 94.113 g/mol | ||
| Görünüş | Şeffaf kristal katı | ||
| Koku | Tatlı ve katranlı | ||
| Yoğunluk | 1,07 g/cm3 | ||
| Erime noktası | 40,5 °C (104,9 °F; 313,6 K) | ||
| Kaynama noktası | 181,7 °C (359,1 °F; 454,8 K) | ||
Suda çözünürlük
|
8,3 g/100 mL (20 °C) | ||
| log P | 1.48 | ||
| Buhar basıncı | 0,4 mmHg (20 °C) | ||
| Asitlik (pKa) |
| ||
| Konjugat baz | Fenoksit | ||
| UV-vis (λmax) | 270,75 nm | ||
Dipol moment
|
1.224 D | ||
| Farmakoloji | |||
ATC kodu
|
C05BB05 (KIM) D08AE03 (KIM), N01BX03 (KIM), R02AA19 (KIM) | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|
  
| ||
Tehlike bildirimleri
|
H301, H311, H314, H331, H341, H373 | ||
Önlem ifadeleri
|
P261, P280, P301+P310, P305+P351+P338, P310 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | 79 °C (174 °F; 352 K) | ||
| Patlayıcı limitleri | 1.8–8.6% | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
| ||
LDLo (yayınlanan en düşük)
|
| ||
LC50 (medyan konsantrasyon)
|
| ||
| NIOSH (ABD sağlık maruziyet limitleri): | |||
PEL (İzin Verilebilir)
|
TWA 5 ppm (19 mg/m3) [cilt] | ||
REL (Önerilen)
|
| ||
IDLH (Acil tehlike)
|
250 ppm | ||
| Güvenlik bilgi formu (SDS) | [1] | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
Tiyofenol Sodyum fenoksit | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Fenol (karbolik asit olarak da adlandırılır), C6H5OH moleküler formülüne sahip aromatik bir organik bileşiktir. Uçucu olan beyaz kristal bir katıdır. Molekül, bir hidroksi grubuna (-OH) bağlanmış bir fenil grubundan (-C6H5) oluşur. Hafif asidiktir, kimyasal yanıklara neden olabileceğinden dikkatli kullanılması gerekir. ⓘ
Fenol ilk olarak kömür katranından elde edilmiştir, ancak günümüzde petrol türevi hammaddelerden büyük ölçekte (yaklaşık 7 milyar kg/yıl) üretilmektedir. Birçok malzemenin ve faydalı bileşiğin öncüsü olarak önemli bir endüstriyel üründür. Öncelikle plastiklerin ve ilgili malzemelerin sentezlenmesinde kullanılır. Fenol ve kimyasal türevleri polikarbonatlar, epoksiler, bakalit, naylon, deterjanlar, fenoksi herbisitler gibi herbisitlerin ve çok sayıda farmasötik ilacın üretimi için gereklidir. ⓘ

Fenol, benzen halkasına OH- molekülünün bağlanmasıyla oluşan kimyasal bileşiktir. ⓘ
- Ampirik (kimyasal) formülü C6H5OH şeklindedir.
- Zayıf asidik özelliğe sahiptir
- Alkol değildir
- Sulu çözeltisi FeCl3 ile mor renk verir.Bu fenolun tanınma reaksiyonudur.
- Fenol formaldehit ile polimerleşerek plastik oluşturabilir.
Fenoller ve alkoller arasında birçok açıdan benzerlik olmasına rağmen bu benzerlikler yalnızca biçimsel yöndendir. Kimyasal tepkimeleri genellikle büyük ölçüde farklıdır. Fenoller suda asit özelliği gösterirken, alkoller göstermezler. Buna karşılık fenoller ester oluşturmaları açısından alkollerle benzerler. Birçok fenol, özellikle triklorofenol (TKF) antiseptik özellik taşırlar. ⓘ
Özellikler
Fenol, 1000 mL (0,895 M) içinde yaklaşık 84,2 g çözünen, suda kayda değer ölçüde çözünen organik bir bileşiktir. Fenol ve suyun ~2,6 ve daha yüksek fenol-su kütle oranlarında homojen karışımları mümkündür. Fenolün sodyum tuzu olan sodyum fenoksit suda çok daha fazla çözünür. ⓘ
Asitlik
Fenol zayıf bir asittir. Sulu çözeltide pH aralığı ca. 8 - 12 aralığında fenolat anyonu C6H5O- (fenoksit olarak da adlandırılır) ile dengededir:
- C6H5OH ⇌ C6H5O- + H+ ⓘ

Fenol, alifatik alkollerden daha asidiktir. Farklı pKa, fenoksit anyonunun rezonans stabilizasyonuna bağlanmaktadır. Bu şekilde, oksijen üzerindeki negatif yük, pi sistemi aracılığıyla orto ve para karbon atomları üzerinde delokalize edilir. Alternatif bir açıklama sigma çerçevesini içermekte ve baskın etkinin daha elektronegatif sp2 hibridize karbonlardan gelen indüksiyon olduğunu varsaymaktadır; sp2 sistemi tarafından sp3 sistemine kıyasla sağlanan elektron yoğunluğunun nispeten daha güçlü indüktif geri çekilmesi, oksiyanyonun büyük ölçüde stabilizasyonuna izin verir. İkinci açıklamayı destekleyecek şekilde, asetonun enolünün sudaki pKa değeri 10.9'dur ve fenolden (pKa 10.0) sadece biraz daha az asidiktir. Bu nedenle, aseton enolatına kıyasla fenoksit için mevcut olan daha fazla sayıda rezonans yapısı, stabilizasyonuna çok az katkıda bulunuyor gibi görünmektedir. Ancak, solvasyon etkileri hariç tutulduğunda durum değişmektedir. Rezonans stabilizasyonuna izin veren veya vermeyen konformasyonlardaki fenol ve siklohekzanol viniloglarının gaz fazı asitliklerinin yakın zamanda yapılan bir in silico karşılaştırması, fenolün artan asitliğinin yaklaşık 1⁄3'ünün indüktif etkilere atfedilebileceği ve rezonansın kalan farkı oluşturduğu sonucuna yol açmaktadır. ⓘ
Hidrojen bağı
Karbon tetraklorür ve alkan çözücülerinde fenol, piridin, dietil eter ve dietil sülfür gibi çok çeşitli Lewis bazları ile hidrojen bağı kurar. Adduct oluşum entalpileri ve adduct oluşumuna eşlik eden -OH IR frekans kaymaları incelenmiştir. Fenol, EA = 2.27 ve CA = 1.07 ile ECW modelinin C/E oranı ile uyumlu bir sert asit olarak sınıflandırılmıştır. Fenolün bir dizi baza ve diğer Lewis asitlerine karşı göreceli alıcı gücü C-B grafikleri ile gösterilebilir. ⓘ
Fenoksit anyonu
Fenoksit anyonu, karbanyonlar veya tersiyer aminlerle karşılaştırılabilir bir nükleofilikliğe sahip güçlü bir nükleofildir. Hem oksijen hem de karbon bölgelerinde ambident bir nükleofil olarak reaksiyona girebilir (bkz. HSAB teorisi). Genel olarak, fenoksit anyonlarının oksijen saldırısı kinetik olarak tercih edilirken, karbon saldırısı termodinamik olarak tercih edilir (bkz. Termodinamik ve kinetik reaksiyon kontrolü). Karışık oksijen/karbon saldırısı ve bununla birlikte seçicilik kaybı genellikle reaksiyon hızı difüzyon kontrolüne ulaştığında gözlenir. ⓘ
Tautomerizm

Fenol, kararsız keto tautomeri sikloheksadienon ile keto-enol tautomerizmi sergiler, ancak fenolün sadece küçük bir kısmı keto formunda bulunur. Enolisasyon için denge sabiti yaklaşık 10-13'tür, bu da her on trilyon molekülden yalnızca birinin herhangi bir anda keto formunda olduğu anlamına gelir. Bir C=C bağının bir C=O bağı ile değiştirilmesiyle kazanılan az miktardaki stabilizasyon, aromatiklik kaybından kaynaklanan büyük destabilizasyonla fazlasıyla dengelenir. Bu nedenle fenol esasen tamamen enol formunda bulunur. 4, 4' Sübstitüe siklohekzadienon asit koşullarında dienon-fenol yeniden düzenlenmesine uğrayabilir ve kararlı 3,4-disübstitüe fenol oluşturabilir. ⓘ
Fenoksitler aromatiklik ile stabilize edilmiş enolatlardır. Normal şartlar altında, fenoksit oksijen pozisyonunda daha reaktiftir, ancak oksijen pozisyonu "sert" bir nükleofil iken alfa-karbon pozisyonları "yumuşak" olma eğilimindedir. ⓘ
Reaksiyonlar


Fenol elektrofilik aromatik sübstitüsyona karşı oldukça reaktiftir. Nükleofilikliğin artması, O'dan halkaya pi elektron yoğunluğunun bağışlanmasına bağlanır. Halojenasyon, asilasyon, sülfonasyon ve ilgili işlemler yoluyla halkaya birçok grup eklenebilir. Fenol halkası o kadar güçlü bir şekilde aktive olur ki bromlama ve klorlama kolayca polisubstitüsyona yol açar. Fenol oda sıcaklığında seyreltik nitrik asit ile reaksiyona girerek 2-nitrofenol ve 4-nitrofenol karışımı verirken, konsantre nitrik asit ile ilave nitro grupları eklenerek örneğin 2,4,6-trinitrofenol verir. ⓘ
Fenolün sulu çözeltileri zayıf asidiktir ve mavi turnusolü hafifçe kırmızıya çevirir. Fenol, sodyum hidroksit tarafından nötralize edilerek sodyum fenat veya fenolat oluşturur, ancak karbonik asitten daha zayıf olduğu için sodyum bikarbonat veya sodyum karbonat tarafından nötralize edilerek karbondioksit açığa çıkarılamaz.
- C6H5OH + NaOH → C6H5ONa + H2O ⓘ
Bir fenol ve benzoil klorür karışımı seyreltik sodyum hidroksit çözeltisi varlığında çalkalandığında fenil benzoat oluşur. Bu Schotten-Baumann reaksiyonuna bir örnektir:
- C6H5COCl + HOC6H5 → C6H5CO2C6H5 + HCl ⓘ
Fenol, çinko tozu ile damıtıldığında veya buharı 400 °C'de çinko granülleri üzerinden geçirildiğinde benzene indirgenir:
- C6H5OH + Zn → C6H6 + ZnO ⓘ
Fenol, bor triflorür (BF3) varlığında diazometan ile muamele edildiğinde, ana ürün olarak anizol ve yan ürün olarak azot gazı elde edilir.
- C6H5OH + CH2N2 → C6H5OCH3 + N2 ⓘ
Fenol, demir(III) klorür çözeltisi ile reaksiyona girdiğinde yoğun mor-mor bir çözelti oluşur. ⓘ
Üretim
Fenolün ticari önemi nedeniyle, üretimi için birçok yöntem geliştirilmiştir, ancak kümen prosesi baskın teknolojidir. ⓘ
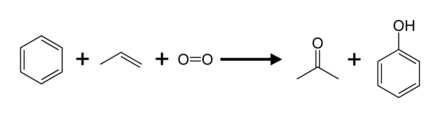
Kümen prosesi
Üretimin %95'ini (2003) Hock prosesi olarak da adlandırılan kümen prosesi oluşturmaktadır. Kümenin (izopropilbenzen) Hock yeniden düzenlemesi yoluyla kısmi oksidasyonunu içerir: Diğer proseslerin çoğuyla karşılaştırıldığında, kümen prosesi nispeten ılımlı koşullar ve nispeten ucuz hammaddeler kullanır. Prosesin ekonomik olabilmesi için hem fenol hem de aseton yan ürününe talep olması gerekir. 2010 yılında dünya çapında aseton talebi yaklaşık 6,7 milyon tondu ve bunun yüzde 83'ü kümen prosesi ile üretilen aseton ile karşılanıyordu. ⓘ
Kümen prosesine benzer bir yol sikloheksilbenzen ile başlar. Kümen hidroperoksit üretimine benzer şekilde bir hidroperoksite oksitlenir. Hock yeniden düzenlemesi yoluyla, sikloheksilbenzen hidroperoksit fenol ve sikloheksanon vermek üzere ayrılır. Siklohekzanon bazı naylonların önemli bir öncüsüdür. ⓘ
Benzen ve toluenin oksidasyonu
Benzenin fenole doğrudan oksidasyonu teorik olarak mümkündür ve büyük ilgi görmektedir, ancak ticarileştirilmemiştir:
- C6H6 + O → C6H5OH
Nitröz oksit, O2'den daha güçlü bir oksidan olan potansiyel olarak "yeşil" bir oksidandır. Bununla birlikte, azot oksit üretimi için kullanılan yollar rekabetçi değildir. ⓘ
Alternatif akım kullanan bir elektrosentez benzenden fenol elde edilmesini sağlar. ⓘ
Dow Chemical tarafından geliştirilen toluenin oksidasyonu, erimiş sodyum benzoatın hava ile bakır katalizli reaksiyonunu içerir:
- C6H5CH3 + 2 O2 → C6H5OH + CO2 + H2O
Reaksiyonun benzoilsalisilat oluşumu yoluyla ilerlemesi önerilmektedir. ⓘ
Eski yöntemler
İlk yöntemler, kömür türevlerinden fenol ekstraksiyonuna veya benzen türevlerinin hidrolizine dayanıyordu. ⓘ
Benzensülfonik asidin hidrolizi
1900'lerin başında Bayer ve Monsanto tarafından geliştirilen ilk ticari yol, güçlü bir bazın benzensülfonik asit ile reaksiyonu ile başlar. Dönüşüm bu idealleştirilmiş denklemle temsil edilir:
- C6H5SO3H + 2 NaOH → C6H5OH + Na2SO3 + H2O ⓘ
Klorobenzenin hidrolizi
Klorobenzen baz (Dow prosesi) veya buhar (Raschig-Hooker prosesi) kullanılarak fenole hidrolize edilebilir:
- C6H5Cl + NaOH → C6H5OH + NaCl
- C6H5Cl + H2O → C6H5OH + HCl
Bu yöntemler, klorobenzenin maliyeti ve klorür yan ürününün bertaraf edilmesi gerekliliğinden muzdariptir. ⓘ
Kömür pirolizi
Fenol de kömür pirolizinin geri kazanılabilir bir yan ürünüdür. Lummus Prosesinde, toluenin benzoik aside oksidasyonu ayrı olarak gerçekleştirilir. ⓘ
Çeşitli yöntemler
Fenildiazonyum tuzları fenole hidrolize olur. Prekürsör pahalı olduğu için yöntem ticari olarak ilgi görmemektedir.
Salisilik asit fenole dekarboksilat oluşturur. ⓘ
Kullanım Alanları
Üretiminin üçte ikisini tüketen fenolün başlıca kullanım alanları, plastikler için öncül maddelere dönüştürülmesini içerir. Aseton ile yoğunlaştırma, polikarbonatların ve epoksit reçinelerinin önemli bir öncüsü olan bisfenol-A'yı verir. Fenol, alkilfenoller veya difenollerin formaldehit ile yoğunlaştırılması, ünlü bir örneği Bakalit olan fenolik reçineleri verir. Fenolün kısmi hidrojenasyonu, naylonun öncüsü olan siklohekzanonu verir. Noniyonik deterjanlar, fenolün alkilasyonu ile alkilfenollerin, örneğin nonilfenolün elde edilmesiyle üretilir ve bunlar daha sonra etoksilasyona tabi tutulur. ⓘ
Fenol aynı zamanda başta aspirin olmak üzere birçok herbisit ve farmasötik ilaç gibi geniş bir ilaç koleksiyonunun çok yönlü bir öncüsüdür. ⓘ
Fenol, moleküler biyolojide dokulardan veya hücre kültürü örneklerinden nükleik asit elde etmek için kullanılan sıvı-sıvı fenol-kloroform ekstraksiyon tekniğinin bir bileşenidir. Çözeltinin pH değerine bağlı olarak DNA ya da RNA ekstrakte edilebilir. ⓘ
Tıbbi
Fenol, antiseptik olarak yaygın bir şekilde kullanılmaktadır. Kullanımına Joseph Lister öncülük etmiştir (Tarihçe bölümüne bakınız). ⓘ
1900'lerin başından 1970'lere kadar karbolik sabun üretiminde kullanılmıştır. Konsantre fenol sıvıları, kimyasal matriksektomi olarak bilinen bir prosedür olan batık ayak ve el tırnaklarının kalıcı tedavisi için yaygın olarak kullanılmaktadır. Bu prosedür ilk olarak 1945 yılında Otto Boll tarafından tanımlanmıştır. O zamandan beri podiatristler tarafından gerçekleştirilen kimyasal matriksektomiler için tercih edilen kimyasal haline gelmiştir. ⓘ
Konsantre sıvı fenol, genel anestezi veya diğer lokal anesteziklere alternatif olarak miringotomi ve timpanotomi tüpü yerleştirme gibi otoloji prosedürleri için lokal anestezik olarak topikal olarak kullanılabilir. Ayrıca bu kullanım için ideal olmasını sağlayan hemostatik ve antiseptik niteliklere sahiptir. ⓘ
Aktif bileşen olarak genellikle %1,4 fenol içeren fenol sprey, boğaz ağrısını tedavi etmek için tıbbi olarak kullanılır. Chloraseptic sprey, TCP ve Carmex gibi bazı oral analjeziklerin aktif bileşenidir. ⓘ
Niş kullanımlar
Fenol o kadar ucuzdur ki birçok küçük ölçekli kullanım alanına sahiptir. Havacılık endüstrisinde epoksi, poliüretan ve diğer kimyasal dirençli kaplamaların sökülmesinde kullanılan endüstriyel boya sökücülerin bir bileşenidir. ⓘ
Fenol türevleri, güneş kremleri, saç boyaları ve cilt rengini açıcı preparatlar dahil olmak üzere kozmetiklerin hazırlanmasında kullanılmıştır. Ancak, güvenlik endişeleri nedeniyle, fenolün Avrupa Birliği ve Kanada'da kozmetik ürünlerde kullanımı yasaklanmıştır. ⓘ
Tarihçe
Fenol 1834 yılında Friedlieb Ferdinand Runge tarafından keşfedilmiş ve kömür katranından (saf olmayan formda) elde edilmiştir. Runge fenole "Karbolsäure" (kömür yağı asidi, karbolik asit) adını verdi. Kömür katranı, petrokimya endüstrisinin gelişimine kadar birincil kaynak olarak kaldı. 1841 yılında Fransız kimyager Auguste Laurent fenolü saf halde elde etti. ⓘ
1836'da Auguste Laurent benzen için "phène" ismini buldu; bu "fenol" ve "fenil" kelimelerinin köküdür. 1843 yılında Fransız kimyager Charles Gerhardt "phénol" ismini icat etmiştir. ⓘ
Fenolün antiseptik özellikleri Sir Joseph Lister (1827-1912) tarafından öncü antiseptik cerrahi tekniğinde kullanılmıştır. Lister, yaraların kendilerinin iyice temizlenmesi gerektiğine karar verdi. Daha sonra yaraları fenol ya da kendi deyimiyle karbolik asitle kaplı bir bez parçası ya da tiftikle kapladı. Sürekli fenole maruz kalmanın neden olduğu cilt tahrişi, sonunda cerrahide aseptik (mikropsuz) tekniklerin kullanılmasına yol açtı. ⓘ
Joseph Lister, University College London'da Robert Liston'ın öğrencisi olmuş ve daha sonra Glasgow Royal Infirmary'de cerrahlığa kadar yükselmiştir. Lister, çağdaşı Louis Pasteur'ün çeşitli biyolojik ortamları sterilize etme konusundaki çalışmalarını ve deneylerini inceledikten sonra karbolik asitle kaplı bezlerle deneyler yaptı. Lister, Pasteur'ün deneylerinin gerektirdiği ısı ile yapılamayan canlı yaraları sterilize etmenin bir yolunu bulmak için ilham aldı. Pasteur'ün araştırmalarını inceleyen Lister, hastaların mikroplar tarafından öldürüldüğüne dair teorisini bir araya getirmeye başladı. Eğer mikroplar öldürülebilir ya da önlenebilirse, enfeksiyon oluşmayacağı teorisini ortaya attı. Lister, enfeksiyona neden olan mikroorganizmaları yok etmek için bir kimyasal kullanılabileceğini düşündü. ⓘ
Bu arada, İngiltere'nin Carlisle kentinde yetkililer, kanalizasyon havuzlarının kokusunu azaltmak için karbolik asit kullanarak bir kanalizasyon arıtma deneyi yapıyordu. Bu gelişmelerden haberdar olan ve daha önce antiseptik amaçlarla başka kimyasallar denemiş ancak başarılı olamamış olan Lister, karbolik asidi bir yara antiseptiği olarak denemeye karar verdi. İlk şansını 12 Ağustos 1865'te, alt bacağının derisini delen tibia kemiği kırığı olan on bir yaşında bir çocuk hastayı kabul ettiğinde yakaladı. Normalde tek çözüm ampütasyon olurdu. Ancak Lister karbolik asidi denemeye karar verdi. Kemiği yerleştirdikten ve bacağı atellerle destekledikten sonra, Lister temiz pamuk havluları seyreltilmemiş karbolik aside batırdı ve bunları yaraya uyguladı, üzerini bir kat kalay folyoyla kapattı ve dört gün boyunca bekletti. Yarayı kontrol ettiğinde, Lister hiçbir enfeksiyon belirtisi bulamayınca çok şaşırdı, sadece yaranın kenarlarında karbolik asidin hafif yanmasından kaynaklanan kızarıklık vardı. Seyreltilmiş karbolik asitle yeni bandajlar uygulayan çocuk, yaklaşık altı haftalık tedavinin ardından evine yürüyebildi. ⓘ
Lister'in çalışmalarının ilk sonuçlarının Lancet'te yayınlandığı 16 Mart 1867 tarihine kadar, yeni antiseptik yöntemini kullanarak toplam on bir hastayı tedavi etmişti. Bunlardan sadece biri ölmüştü ve bu da Lister'in yara pansuman tekniğiyle hiçbir ilgisi olmayan bir komplikasyondan kaynaklanıyordu. Artık ilk kez, bileşik kırıkları olan hastaların hastaneden tüm uzuvları sağlam olarak çıkma ihtimali vardı
- - Richard Hollingham, Kan ve Bağırsaklar: Bir Cerrahi Tarihi, s. 62 ⓘ
Hastanede antiseptik ameliyatlar yapılmaya başlanmadan önce, otuz beş cerrahi vakada on altı ölüm gerçekleşmiştir. Neredeyse her iki hastadan biri ölüyordu. Antiseptik cerrahinin 1865 yazında uygulanmaya başlamasından sonra ise kırk vakada sadece altı ölüm vakası görüldü. Ölüm oranı neredeyse yüzde 50'den yüzde 15 civarına düşmüştü. Bu kayda değer bir başarıydı.
- - Richard Hollingham, Kan ve Bağırsaklar: Bir Cerrahi Tarihi, s. 63 ⓘ
Fenol, 19. yüzyılda Londra'da grip ve diğer hastalıklara karşı koruyucu olarak pazarlanan ve Carlill v Carbolic Smoke Ball Company adlı ünlü davaya konu olan etkisiz bir cihaz olan Karbolik Duman Topu'nun ana bileşeniydi. ⓘ
İkinci Dünya Savaşı
Fenolün aşağıda tartışılan merkezi sinir sistemi üzerindeki toksik etkisi, hem insanlarda hem de hayvanlarda ani çöküşe ve bilinç kaybına neden olur; merkezi sinir sistemi tarafından kontrol edilen motor aktivite nedeniyle bu semptomlardan önce bir kramp durumu ortaya çıkar. Fenol enjeksiyonları İkinci Dünya Savaşı sırasında Nazi Almanyası tarafından bireysel infaz aracı olarak kullanılmıştır. İlk olarak Naziler tarafından 1939 yılında Aktion T4 ötenazi programının bir parçası olarak kullanılmıştır. Almanlar, her bir kurbana fenol enjekte ederek daha küçük grupların imhasının daha ekonomik olduğunu öğrendi. Fenol enjeksiyonları binlerce insana yapıldı. Maximilian Kolbe de Auschwitz'de iki hafta boyunca açlık ve susuzluktan kurtulduktan sonra bir yabancının yerine ölmeye gönüllü olunca fenol iğnesiyle öldürülmüştür. Ölüme neden olmak için yaklaşık bir gram yeterlidir. ⓘ
Olaylar
Fenol normal bir metabolik üründür ve insan idrarında 40 mg/L'ye varan miktarlarda atılır. ⓘ
Erkek fillerin temporal bez salgısı, musth sırasında fenol ve 4-metilfenol varlığını göstermiştir. ⓘ
Aynı zamanda castoreum'da bulunan kimyasal bileşiklerden biridir. Bu bileşik kunduzun yediği bitkilerden alınır. ⓘ
Viskide oluşumu
Fenol, kendine özgü Islay viskisinin aroma ve tadında ölçülebilir bir bileşendir, genellikle ~30 ppm'dir, ancak viski üretmek için kullanılan maltlık arpada 160 ppm'in üzerinde olabilir. Bu miktar distilattaki miktardan farklıdır ve muhtemelen daha yüksektir. ⓘ
Biyodegradasyon
Cryptanaerobacter phenolicus, 4-hidroksibenzoat yoluyla fenolden benzoat üreten bir bakteri türüdür. Rhodococcus phenolicus, fenolü tek karbon kaynağı olarak parçalayabilen bir bakteri türüdür. ⓘ
Toksisite
Fenol ve buharları gözler, cilt ve solunum yolları için aşındırıcıdır. Cilt ve mukoza zarları üzerindeki aşındırıcı etkisi protein dejenere edici etkisinden kaynaklanmaktadır. Fenol ile tekrarlanan veya uzun süreli cilt teması dermatite, hatta ikinci ve üçüncü derece yanıklara neden olabilir. Fenol buharının solunması akciğer ödemine neden olabilir. Bu madde merkezi sinir sistemi ve kalp üzerinde zararlı etkilere neden olarak ritim bozukluğu, nöbetler ve koma ile sonuçlanabilir. Böbrekler de etkilenebilir. Maddenin uzun süreli veya tekrarlanan maruziyeti karaciğer ve böbrekler üzerinde zararlı etkilere neden olabilir. Fenolün insanlarda kansere neden olduğuna dair bir kanıt yoktur. Hidrofobik etkilerinin yanı sıra, fenolün toksisitesi için bir başka mekanizma da fenoksil radikallerinin oluşumu olabilir. ⓘ
Fenol deriden nispeten hızlı bir şekilde emildiğinden, lokal yakıcı yanıklara ek olarak sistemik zehirlenme de meydana gelebilir. Çok miktarda fenolün yol açtığı resorptif zehirlenme, deride küçük bir alanda bile meydana gelebilir ve hızla merkezi sinir sisteminin felç olmasına ve vücut ısısında ciddi bir düşüşe yol açabilir. Oral toksisite için LD50 köpekler, tavşanlar veya fareler için 500 mg/kg'dan azdır; minimum ölümcül insan dozu 140 mg/kg olarak belirtilmiştir. ABD Sağlık ve İnsan Hizmetleri Bakanlığı Toksik Maddeler ve Hastalık Kayıt Ajansı (ATSDR), fenolün yutulması için ölümcül dozun 1 ila 32 g arasında olduğunu belirtmektedir. ⓘ
Deri maruziyetinden kaynaklanan kimyasal yanıklar polietilen glikol, izopropil alkol ve hatta bol miktarda su ile yıkanarak dekontamine edilebilir. Kirlenmiş giysilerin çıkarılması ve büyük sıçramalar için acil hastane tedavisi gereklidir. Bu özellikle fenol kloroform (DNA ve RNA saflaştırma için moleküler biyolojide yaygın olarak kullanılan bir karışım) ile karıştırılmışsa önemlidir. Fenol aynı zamanda düşük yapma riskinin artmasına ve düşük doğum ağırlığına neden olarak rahimde gelişme geriliğine işaret eden bir üreme toksinidir. ⓘ
Fenoller
Fenol kelimesi, doğrudan bir hidroksil grubuna (-OH) bağlanmış altı üyeli aromatik bir halka içeren herhangi bir bileşiği ifade etmek için de kullanılır. Dolayısıyla fenoller, bu makalede ele alınan fenolün en basit üyesi olduğu bir organik bileşikler sınıfıdır. ⓘ