Kataliz


Kataliz (/kəˈtæləsɪs/), katalizör (/ˈkætəlɪst/) olarak bilinen bir madde ekleyerek bir kimyasal reaksiyonun hızını artırma işlemidir. Katalizörler reaksiyonda tüketilmez ve reaksiyondan sonra değişmeden kalır. Reaksiyon hızlıysa ve katalizör hızlı bir şekilde geri dönüştürülüyorsa, çok az miktarda katalizör genellikle yeterlidir; karıştırma, yüzey alanı ve sıcaklık reaksiyon hızında önemli faktörlerdir. Katalizörler genellikle bir veya daha fazla reaktanla reaksiyona girerek ara ürünler oluşturur ve bu ara ürünler daha sonra nihai reaksiyon ürününü verir ve bu süreçte katalizör yeniden üretilir. ⓘ
Kataliz, bileşenleri reaktanla aynı fazda (genellikle gaz veya sıvı) dağılmış olan homojen veya bileşenleri aynı fazda olmayan heterojen olarak sınıflandırılabilir. Enzimler ve diğer biyokatalizörler genellikle üçüncü bir kategori olarak kabul edilir. ⓘ
Kataliz, her türlü kimya endüstrisinde her yerde bulunur. Tahminler, ticari olarak üretilen tüm kimyasal ürünlerin %90'ının üretim süreçlerinin bir aşamasında katalizör içerdiği yönündedir. ⓘ
"Katalizör" terimi Yunanca καταλύειν, kataluein, "gevşetmek" veya "çözmek" anlamına gelmektedir. Kataliz kavramı, kimyager Elizabeth Fulhame tarafından, oksidasyon-redüksiyon deneylerindeki yeni çalışmalarına dayanarak icat edilmiştir. ⓘ
Heterojen katalizör olarak en sık kullanılan katalizörler platin, osminyum, rodyum, rutenyum, paladyum gibi atom numarası büyük geçiş metallerinin kendileri veya kompleksleridir. Heterojen katalizde katalizörler küçük parçacıklar halinde tepkime ortamına konarak yüzey alanları büyütülür ve daha iyi bir tepkime verimi alınır. Organik sentezlerde homojen katalizör olarak sıklıkla asit ve bazlar kullanılır. ⓘ
Canlıların vücudunda bulunan enzimler de çok iyi birer katalizördürler. ⓘ
Genel ilkeler
İllüstrasyon
Örnek olarak hidrojen peroksitin su ve oksijene orantısızlaşması verilebilir:
- 2 H2O2 → 2 H2O + O2
Bu reaksiyon ilerler çünkü reaksiyon ürünleri başlangıç maddesinden daha kararlıdır. Katalizlenmemiş reaksiyon yavaştır. Aslında, hidrojen peroksitin ayrışması o kadar yavaştır ki hidrojen peroksit çözeltileri ticari olarak mevcuttur. Bu reaksiyon, manganez dioksit gibi katalizörlerden veya organizmalardaki peroksidaz enziminden güçlü bir şekilde etkilenir. Az miktarda manganez dioksit eklendiğinde, hidrojen peroksit hızla reaksiyona girer. Bu etki oksijenin efervesansı ile kolayca görülebilir. Manganez dioksit reaksiyonda tüketilmez ve böylece değişmeden geri kazanılabilir ve süresiz olarak yeniden kullanılabilir. Buna göre, manganez dioksit bu reaksiyonu katalize eder. ⓘ
Birimler
Bir katalizörün katalitik aktivitesini ölçmek için SI tarafından türetilen birim, saniyede mol cinsinden ölçülen kataldır. Bir katalizörün üretkenliği devir sayısı (veya TON) ile ve katalitik aktivitesi de zaman birimi başına TON olan devir frekansı (TOF) ile tanımlanabilir. Biyokimyasal eşdeğeri enzim birimidir. Enzimatik katalizin etkinliği hakkında daha fazla bilgi için enzimler hakkındaki makaleye bakınız. ⓘ
Katalitik reaksiyon mekanizmaları
Genel olarak, kimyasal reaksiyonlar bir katalizör varlığında daha hızlı gerçekleşir çünkü katalizör, katalize edilmemiş mekanizmadan daha düşük bir aktivasyon enerjisine sahip alternatif bir reaksiyon yolu - veya mekanizması - sağlar. Katalizörlü mekanizmalarda, katalizör genellikle bir ara ürün oluşturmak üzere reaksiyona girer ve bu ara ürün daha sonra süreçteki orijinal katalizörü yeniden üretir. ⓘ
Gaz fazında basit bir örnek olarak, 2 SO2 + O2 → 2 SO3 reaksiyonu nitrik oksit eklenerek katalize edilebilir. Reaksiyon iki adımda gerçekleşir:
- 2 NO + O2 → 2 NO2 (hız belirleyici)
- NO2 + SO2 → NO + SO3 (hızlı)
NO katalizörü rejenere edilir. Toplam hız, yavaş adımın hızıdır
- v = 2k1[NO]2[O2]. ⓘ
Heterojen katalize bir örnek, su üretmek için titanyum dioksit (TiO2 veya titanya) yüzeyinde oksijen ve hidrojenin reaksiyonudur. Taramalı tünelleme mikroskobu, moleküllerin adsorpsiyon ve ayrışmaya uğradığını göstermiştir. Ayrışmış, yüzeye bağlı O ve H atomları birlikte difüze olur. Ara reaksiyon durumları şunlardır: HO2, H2O2, ardından H3O2 ve reaksiyon ürünü (su molekülü dimerleri), ardından su molekülü katalizör yüzeyinden desorbe olur. ⓘ
Reaksiyon enerjetiği
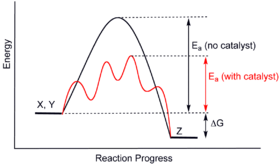
Katalizörler, katalize edilmemiş reaksiyonlardan farklı yolları mümkün kılar. Bu yollar daha düşük aktivasyon enerjisine sahiptir. Sonuç olarak, daha fazla moleküler çarpışma geçiş durumuna ulaşmak için gereken enerjiye sahiptir. Bu nedenle, katalizörler aksi takdirde kinetik bir bariyer tarafından engellenecek veya yavaşlatılacak reaksiyonları mümkün kılabilir. Katalizör reaksiyon hızını veya seçiciliğini artırabilir veya reaksiyonun daha düşük sıcaklıklarda gerçekleşmesini sağlayabilir. Bu etki bir enerji profili diyagramı ile gösterilebilir. ⓘ
Katalize edilmiş temel reaksiyonda, katalizörler reaksiyonun kapsamını değiştirmez: reaksiyonun kimyasal dengesi üzerinde hiçbir etkileri yoktur. İleri ve geri reaksiyon hızlarının oranı etkilenmez (ayrıca bkz. termodinamik). Termodinamiğin ikinci yasası, bir katalizörün bir reaksiyonun kimyasal dengesini neden değiştirmediğini açıklar. Bir dengeyi değiştiren böyle bir katalizör olduğunu varsayalım. Katalizörün sisteme eklenmesi, reaksiyonun yeni dengeye geçmesine ve enerji üretmesine neden olur. Enerji üretimi gerekli bir sonuçtur çünkü reaksiyonlar ancak Gibbs serbest enerjisi üretilirse kendiliğinden gerçekleşir ve enerji bariyeri yoksa katalizöre de gerek yoktur. O halde, katalizörün çıkarılması da enerji üreten bir reaksiyonla sonuçlanacaktır; yani ekleme ve tersi işlem olan çıkarma, her ikisi de enerji üretecektir. Dolayısıyla, dengeyi değiştirebilecek bir katalizör, termodinamik yasalarına aykırı olarak sürekli hareket eden bir makine olacaktır. Dolayısıyla, katalizör denge sabitini değiştirmez. (Ancak bir katalizör, bir sonraki adımda reaksiyona girerek denge konsantrasyonlarını değiştirebilir. Daha sonra reaksiyon ilerledikçe tüketilir ve bu nedenle aynı zamanda bir reaktandır. Örnek olarak esterlerin baz katalizli hidrolizi verilebilir; burada üretilen karboksilik asit hemen baz katalizör ile reaksiyona girer ve böylece reaksiyon dengesi hidrolize doğru kayar). ⓘ
Katalizör, geçiş durumunu başlangıç maddesini stabilize ettiğinden daha fazla stabilize eder. Başlangıç maddesi ile geçiş hali arasındaki enerji farkını azaltarak kinetik bariyeri düşürür. Başlangıç maddeleri ve ürünler arasındaki enerji farkını (termodinamik bariyer) veya mevcut enerjiyi (bu ısı veya ışık olarak çevre tarafından sağlanır) değiştirmez. ⓘ
İlgili kavramlar
Bazı sözde katalizörler aslında ön katalizörlerdir. Ön katalizörler reaksiyon sırasında katalizöre dönüşür. Örneğin, Wilkinson'ın katalizörü RhCl(PPh3)3 gerçek katalitik döngüye girmeden önce bir trifenilfosfin ligandını kaybeder. Ön katalizörlerin depolanması daha kolaydır ancak yerinde kolayca aktive edilirler. Bu ön aktivasyon adımı nedeniyle, birçok katalitik reaksiyon bir indüksiyon periyodu içerir. ⓘ
İşbirlikçi katalizde, katalitik aktiviteyi geliştiren kimyasal türlere kokatalizör veya promotör denir. ⓘ
Tandem katalizde iki veya daha fazla farklı katalizör tek pota reaksiyonda birleştirilir. ⓘ
Otokatalizde katalizör, bu makalede ele alınan diğer tüm kataliz türlerinin aksine, genel reaksiyonun bir ürünüdür. Otokatalizin en basit örneği, bir veya birkaç adımda A + B → 2 B tipi bir reaksiyondur. Genel reaksiyon sadece A → B'dir, dolayısıyla B bir üründür. Ancak B aynı zamanda bir reaktan olduğundan, hız denkleminde bulunabilir ve reaksiyon hızını etkileyebilir. Reaksiyon ilerledikçe, B konsantrasyonu artar ve bir katalizör olarak reaksiyonu hızlandırabilir. Gerçekte, reaksiyon kendi kendini hızlandırır veya otokatalize olur. Aspirin gibi bir esterin bir karboksilik asit ve bir alkole hidrolizi buna bir örnektir. Eklenen asit katalizörlerinin yokluğunda, karboksilik asit ürünü hidrolizi katalize eder. ⓘ
Gerçek bir katalizör, bir kurban katalizör ile birlikte çalışabilir. Gerçek katalizör temel reaksiyonda tüketilir ve devre dışı bırakılmış bir forma dönüşür. Kurban katalizör, başka bir döngü için gerçek katalizörü yeniden üretir. Kurban katalizör reaksiyonda tüketilir ve bu nedenle gerçekte bir katalizör değil, bir reaktiftir. Örneğin, osmiyum tetroksit (OsO4) dihidroksilasyon için iyi bir reaktiftir, ancak oldukça toksik ve pahalıdır. Upjohn dihidroksilasyonunda, kurban katalizör N-metilmorfolin N-oksit (NMMO) OsO4'ü yeniden üretir ve sadece katalitik miktarlarda OsO4 gereklidir. ⓘ
Sınıflandırma
Kataliz homojen ya da heterojen olarak sınıflandırılabilir. Homojen kataliz, bileşenleri reaktan molekülleriyle aynı fazda (genellikle gaz veya sıvı) dağılmış olan katalizdir. Heterojen kataliz ise reaksiyon bileşenlerinin aynı fazda olmadığı katalizdir. Enzimler ve diğer biyokatalizörler genellikle üçüncü bir kategori olarak kabul edilir. Benzer mekanik prensipler heterojen, homojen ve biyokataliz için de geçerlidir. ⓘ
Heterojen kataliz


Heterojen katalizörler, reaktanlardan farklı bir fazda hareket eder. Çoğu heterojen katalizör, sıvı veya gaz halindeki bir reaksiyon karışımındaki substratlar üzerinde etkili olan katı maddelerdir. Önemli heterojen katalizörler arasında zeolitler, alümina, yüksek dereceli oksitler, grafitik karbon, geçiş metal oksitleri, hidrojenasyon için Raney nikel gibi metaller ve temas süreci olarak adlandırılan sülfür dioksitin sülfür trioksite oksidasyonu için vanadyum (V) oksit bulunur. ⓘ
Adsorpsiyonun nasıl gerçekleştiğine bağlı olarak yüzeylerdeki reaksiyonlar için çeşitli mekanizmalar bilinmektedir (Langmuir-Hinshelwood, Eley-Rideal ve Mars-van Krevelen). Katının toplam yüzey alanı reaksiyon hızı üzerinde önemli bir etkiye sahiptir. Katalizör partikül boyutu ne kadar küçükse, belirli bir partikül kütlesi için yüzey alanı o kadar büyük olur. ⓘ
Heterojen bir katalizör, reaksiyonun gerçekte meydana geldiği atomlar veya kristal yüzler olan aktif bölgelere sahiptir. Mekanizmaya bağlı olarak, aktif bölge düzlemsel bir açık metal yüzeyi, kusurlu metal değerliğine sahip bir kristal kenarı veya ikisinin karmaşık bir kombinasyonu olabilir. Bu nedenle, heterojen bir katalizörün sadece hacminin çoğu değil, yüzeyinin çoğu da katalitik olarak inaktif olabilir. Aktif bölgenin doğasını bulmak teknik açıdan zorlu bir araştırma gerektirir. Bu nedenle, kataliz için yeni metal kombinasyonları bulmaya yönelik deneysel araştırmalar devam etmektedir. ⓘ
Örneğin, Haber prosesinde, ince bölünmüş demir, azot ve hidrojenden amonyak sentezi için bir katalizör görevi görür. Tepkimeye giren gazlar demir parçacıkları üzerindeki aktif bölgelere adsorbe olur. Reaktifler fiziksel olarak adsorbe edildikten sonra, adsorbe edilmiş atomik türlere ayrışmayla sonuçlanan kemisorpsiyona uğrar ve ortaya çıkan parçalar arasında kısmen yakınlıklarından dolayı yeni bağlar oluşur. Bu şekilde, azottaki özellikle güçlü üçlü bağ kırılır ki bu da yüksek aktivasyon enerjisi nedeniyle gaz fazında son derece nadir görülür. Böylece, genel reaksiyonun aktivasyon enerjisi düşürülür ve reaksiyon hızı artar. Heterojen katalizörün uygulandığı bir başka yer de sülfürik asit üretimi için vanadyum (V) oksit üzerinde sülfür dioksitin oksidasyonudur. ⓘ
Heterojen katalizörler tipik olarak "desteklenir", bu da katalizörün etkinliğini artıran veya maliyetini en aza indiren ikinci bir malzeme üzerinde dağıldığı anlamına gelir. Destekler, küçük katalizör partiküllerinin topaklanmasını ve sinterlenmesini önler veya en aza indirir, daha fazla yüzey alanı ortaya çıkarır, böylece katalizörler bir destek üzerinde daha yüksek bir spesifik aktiviteye (gram başına) sahiptir. Bazen destek sadece yüzey alanını artırmak için katalizörün yayıldığı bir yüzeydir. Daha sık olarak, destek ve katalizör etkileşime girerek katalitik reaksiyonu etkiler. Destekler, katalizör moleküllerinin kimyasal olarak bağlanması için bölgeler sağlayarak nanopartikül sentezinde de kullanılabilir. Destekler, genellikle alümina, zeolitler veya çeşitli aktif karbon türleri gibi yüksek yüzey alanına sahip gözenekli malzemelerdir. Özel destekler arasında silikon dioksit, titanyum dioksit, kalsiyum karbonat ve baryum sülfat bulunur. ⓘ
Bulamaç reaksiyonlarında, heterojen katalizörler çözünerek kaybolabilir. ⓘ
Birçok heterojen katalizör aslında nanomalzemedir. Enzim taklit eden aktivitelere sahip nanomateryal bazlı katalizörler topluca nanozimler olarak adlandırılır. ⓘ
Elektrokatalizörler
Elektrokimya bağlamında, özellikle yakıt hücresi mühendisliğinde, yakıt hücresini oluşturan yarı reaksiyonların oranlarını artırmak için çeşitli metal içeren katalizörler kullanılır. Yaygın bir yakıt hücresi elektrokatalizörü türü, biraz daha büyük karbon parçacıkları üzerinde desteklenen platin nanoparçacıklarına dayanmaktadır. Bu platin, yakıt hücresindeki elektrotlardan biriyle temas ettiğinde oksijenin suya ya da hidroksit veya hidrojen peroksite indirgenme hızını artırır. ⓘ
Homojen kataliz
Homojen katalizörler reaktanlarla aynı fazda işlev görür. Tipik olarak homojen katalizörler substratlarla birlikte bir çözücü içinde çözülür. Homojen katalizin bir örneği, asetik asit ve metanolden metil asetat oluşumu gibi karboksilik asitlerin esterleştirilmesi üzerinde H+ etkisini içerir. Homojen bir katalizör gerektiren yüksek hacimli işlemler arasında hidroformilasyon, hidrosililasyon, hidrosiyanasyon bulunur. İnorganik kimyacılar için homojen kataliz genellikle organometalik katalizörlerle eş anlamlıdır. Ancak birçok homojen katalizör organometalik değildir; p-ksilenin tereftalik aside oksidasyonunu katalize eden kobalt tuzlarının kullanımı buna örnektir. ⓘ
Organokataliz
Geçiş metalleri bazen kataliz çalışmalarında en çok dikkati çekerken, metal içermeyen küçük organik moleküller de katalitik özellikler sergileyebilir, birçok enzimin geçiş metali içermemesinden de anlaşılacağı gibi. Tipik olarak, organik katalizörler geçiş metali (-iyon) bazlı katalizörlerden daha yüksek bir yükleme (birim reaktan miktarı başına katalizör miktarı, maddenin % mol miktarı olarak ifade edilir) gerektirir, ancak bu katalizörler genellikle ticari olarak toplu halde bulunur ve maliyetleri düşürmeye yardımcı olur. 2000'li yılların başında bu organokatalizörler "yeni nesil" olarak kabul ediliyordu ve geleneksel metal(-iyon)-içeren katalizörlerle rekabet edebiliyorlardı. Organokatalizörlerin, hidrojen bağı gibi kovalent olmayan etkileşimleri kullanarak metalsiz enzimlere benzer şekilde çalışması beklenmektedir. Organokataliz disiplini, sırasıyla tercih edilen katalizör-substrat bağlanması ve etkileşimine atıfta bulunan kovalent (örn. prolin, DMAP) ve kovalent olmayan (örn. tiyoüre organokatalizi) organokatalizörlerin uygulanmasına bölünmüştür. Nobel Kimya Ödülü 2021, "asimetrik organokatalizin geliştirilmesi nedeniyle" Benjamin List ve David W.C. MacMillan'a ortaklaşa verilmiştir. ⓘ
Fotokatalizörler
Fotokataliz, katalizörün redoks reaksiyonlarını etkileyen uyarılmış bir durum oluşturmak için ışık alabildiği olgudur. Singlet oksijen genellikle fotokataliz ile üretilir. Fotokatalizörler, boyaya duyarlı güneş pillerinin bileşenleridir. ⓘ
Enzimler ve biyokatalizörler
Biyolojide enzimler, metabolizma ve katabolizmada protein bazlı katalizörlerdir. Biyokatalizörlerin çoğu enzimlerdir, ancak protein bazlı olmayan diğer biyomolekül sınıfları da ribozimler ve sentetik deoksiribozimler dahil olmak üzere katalitik özellikler sergiler. ⓘ
Biyokatalizörler, homojen ve heterojen katalizörler arasında bir ara madde olarak düşünülebilir, ancak kesin konuşmak gerekirse çözünür enzimler homojen katalizörlerdir ve membrana bağlı enzimler heterojendir. Enzimlerin (ve diğer katalizörlerin) aktivitesini sıcaklık, pH, enzim konsantrasyonu, substrat ve ürünler gibi çeşitli faktörler etkiler. Enzimatik reaksiyonlarda özellikle önemli bir reaktif, birçok bağ oluşturma reaksiyonunun ürünü ve birçok bağ kırma işleminde bir reaktan olan sudur. ⓘ
Biyokatalizde enzimler, yüksek fruktozlu mısır şurubu ve akrilamid de dahil olmak üzere birçok ticari kimyasalın hazırlanmasında kullanılmaktadır. ⓘ
Bağlanma hedefi bir kimyasal reaksiyonun geçiş durumuna benzeyen kararlı bir molekül olan bazı monoklonal antikorlar, aktivasyon enerjisini düşürerek bu kimyasal reaksiyon için zayıf katalizörler olarak işlev görebilir. Bu tür katalitik antikorlar bazen "abzim" olarak adlandırılır. ⓘ
Önem

Ticari olarak üretilen tüm kimyasal ürünlerin %90'ının üretim süreçlerinin bir aşamasında katalizör içerdiği tahmin edilmektedir. 2005 yılında, katalitik süreçler dünya çapında yaklaşık 900 milyar dolarlık ürün üretmiştir. Katalizörlere yönelik küresel talebin 2014 yılında 33,5 milyar ABD doları olduğu tahmin edilmektedir. Kataliz o kadar yaygındır ki alt alanlar kolayca sınıflandırılamaz. Bazı özel yoğunlaşma alanları aşağıda incelenmiştir. ⓘ
Enerji işleme
Petrol rafinasyonu, alkilasyon, katalitik kraking (uzun zincirli hidrokarbonların daha küçük parçalara ayrılması), nafta reformasyonu ve buhar reformasyonu (hidrokarbonların sentez gazına dönüştürülmesi) için katalizden yoğun bir şekilde faydalanmaktadır. Fosil yakıtların yakılmasından çıkan egzoz bile kataliz yoluyla işlenir: Tipik olarak platin ve rodyumdan oluşan katalitik konvertörler, otomobil egzozunun daha zararlı yan ürünlerinden bazılarını parçalamaktadır.
- 2 CO + 2 NO → 2 CO2 + N2 ⓘ
Sentetik yakıtlarla ilgili olarak, eski ancak hala önemli bir süreç, demir tarafından katalize edilen su-gaz kaydırma reaksiyonları yoluyla işlenen sentez gazından hidrokarbonların Fischer-Tropsch sentezidir. Biyodizel ve ilgili biyoyakıtlar hem inorganik hem de biyokatalizörler aracılığıyla işlem gerektirir. ⓘ
Yakıt hücreleri hem anodik hem de katodik reaksiyonlar için katalizörlere dayanır. ⓘ
Katalitik ısıtıcılar yanıcı bir yakıt kaynağından alevsiz ısı üretir. ⓘ
Dökme kimyasallar
En büyük ölçekli kimyasallardan bazıları, genellikle oksijen kullanılarak katalitik oksidasyon yoluyla üretilir. Örnekler arasında nitrik asit (amonyaktan), sülfürik asit (temas işlemiyle sülfür dioksitten sülfür trioksite), p-ksilenden tereftalik asit, propilen veya propandan akrilik asit ve propan ve amonyaktan akrilonitril sayılabilir. ⓘ
Amonyak üretimi en büyük ölçekli ve en enerji yoğun süreçlerden biridir. Haber prosesinde azot, bir demir oksit katalizörü üzerinde hidrojen ile birleştirilir. Metanol, karbon monoksit veya karbon dioksitten bakır-çinko katalizörleri kullanılarak hazırlanır. ⓘ
Etilen ve propilenden türetilen yığın polimerler genellikle Ziegler-Natta katalizi yoluyla hazırlanır. Poliesterler, poliamidler ve izosiyanatlar asit-baz katalizi yoluyla elde edilir. ⓘ
Karbonilasyon proseslerinin çoğu metal katalizörler gerektirir, bunlara örnek olarak Monsanto asetik asit prosesi ve hidroformilasyon verilebilir. ⓘ
İnce kimyasallar
Birçok ince kimyasal kataliz yoluyla hazırlanır; yöntemler arasında ağır sanayide kullanılanların yanı sıra büyük ölçekte çok pahalıya mal olacak daha özel süreçler de yer alır. Örnekler arasında Heck reaksiyonu ve Friedel-Crafts reaksiyonları sayılabilir. Biyoaktif bileşiklerin çoğu kiral olduğundan, birçok farmasötik enantiyoselektif kataliz (katalitik asimetrik sentez) ile üretilir. Antibakteriyel levofloksasinin öncüsü olan (R)-1,2-Propandiol, Noyori asimetrik hidrojenasyonunda BINAP-rutenyum komplekslerine dayalı katalizörler kullanılarak hidroksiasetondan verimli bir şekilde sentezlenebilir:
Gıda işleme
Katalizin en belirgin uygulamalarından biri, margarin üretmek için nikel katalizör kullanılarak yağların hidrojenlenmesidir (hidrojen gazı ile reaksiyon). Diğer birçok gıda maddesi biyokataliz yoluyla hazırlanmaktadır (aşağıya bakınız). ⓘ
Çevre
Kataliz, endüstriyel süreçlerin verimliliğini artırarak çevreyi etkiler, ancak kataliz aynı zamanda çevrede doğrudan bir rol oynar. Kayda değer bir örnek, ozonun parçalanmasında klor serbest radikallerinin katalitik rolüdür. Bu radikaller ultraviyole radyasyonun kloroflorokarbonlar (CFC'ler) üzerindeki etkisiyle oluşur.
- Cl- + O3 → ClO- + O2
- ClO- + O- → Cl- + O2 ⓘ
Tarih
Genel olarak, bir sürecin hızını artıran her şey "katalizör "dür; bu terim Yunanca καταλύειν'den türetilmiştir ve "iptal etmek" veya "çözmek" veya "toplamak" anlamına gelir. Kataliz kavramı kimyager Elizabeth Fulhame tarafından icat edilmiş ve 1794 tarihli bir kitapta oksidasyon-redüksiyon deneylerindeki yeni çalışmalarına dayanarak tanımlanmıştır. Organik kimyada bir katalizörün kullanıldığı ilk kimyasal reaksiyon 1811 yılında Gottlieb Kirchhoff tarafından incelenmiş ve nişastanın asit katalizörlüğünde glikoza dönüşümü keşfedilmiştir. Kataliz terimi daha sonra 1835 yılında Jöns Jakob Berzelius tarafından, reaksiyondan sonra değişmeden kalan maddeler tarafından hızlandırılan reaksiyonları tanımlamak için kullanılmıştır. Berzelius'tan önce yaşamış olan Fulhame, indirgeme deneylerinde metaller yerine su ile çalışmıştır. Kataliz konusunda çalışan diğer 18. yüzyıl kimyagerleri, buna temas süreçleri adını veren Eilhard Mitscherlich ve temas eyleminden bahseden Johann Wolfgang Döbereiner'dir. Döbereiner, hidrojen ve platin süngere dayalı bir çakmak olan ve 1820'lerde ticari bir başarıya dönüşen Döbereiner'in lambasını geliştirmiştir. Humphry Davy platinin katalizde kullanımını keşfetti. 1880'lerde Leipzig Üniversitesi'nde Wilhelm Ostwald, asit ve bazların varlığıyla katalizlenen reaksiyonlar üzerine sistematik bir araştırma başlattı ve kimyasal reaksiyonların sonlu oranlarda gerçekleştiğini ve bu oranların asit ve bazların güçlerini belirlemek için kullanılabileceğini buldu. Ostwald bu çalışmasıyla 1909 Nobel Kimya Ödülü'ne layık görülmüştür. Vladimir Ipatieff, oligomerizasyonun keşfi ve ticarileştirilmesi ve hidrojenasyon için katalizörlerin geliştirilmesi de dahil olmak üzere en eski endüstriyel ölçekli reaksiyonlardan bazılarını gerçekleştirdi. ⓘ
İnhibitörler, zehirler ve destekleyiciler
Hızı düşüren ilave bir madde tersinir ise reaksiyon inhibitörü, tersinmez ise katalizör zehirleri olarak adlandırılır. Destekleyiciler, kendi başlarına katalizör olmasalar da katalitik aktiviteyi artıran maddelerdir. ⓘ
İnhibitörler, reaksiyon hızını düşürdükleri için bazen "negatif katalizörler" olarak da adlandırılırlar. Ancak inhibitör terimi tercih edilir çünkü daha yüksek aktivasyon enerjisine sahip bir reaksiyon yolu sunarak çalışmazlar; reaksiyon katalizlenmemiş yolla gerçekleşmeye devam edeceğinden bu hızı düşürmez. Bunun yerine, ya katalizörleri devre dışı bırakarak ya da serbest radikaller gibi reaksiyon ara maddelerini ortadan kaldırarak etki ederler. Heterojen katalizde koklaşma, polimerik yan ürünlerle kaplanan katalizörü inhibe eder. ⓘ
İnhibitör, hıza ek olarak seçiciliği de değiştirebilir. Örneğin, alkinlerin alkenlere hidrojenlenmesinde, kurşun(II) asetat (Pb(CH3CO2)2) ile kısmen "zehirlenmiş" bir paladyum (Pd) katalizörü kullanılabilir. Katalizörün devre dışı bırakılması olmadan, üretilen alken daha fazla hidrojenlenerek alkan haline gelecektir. ⓘ
İnhibitör bu etkiyi, örneğin sadece belirli tipteki aktif bölgeleri seçici olarak zehirleyerek yaratabilir. Bir başka mekanizma da yüzey geometrisinin değiştirilmesidir. Örneğin, hidrojenasyon işlemlerinde, metal yüzeyinin büyük düzlemleri hidrojenoliz kataliz bölgeleri olarak işlev görürken, doymamış maddelerin hidrojenasyonunu katalizleyen bölgeler daha küçüktür. Bu nedenle, yüzeyi rastgele kaplayan bir zehir, kirlenmemiş büyük düzlemlerin sayısını azaltma eğiliminde olacak, ancak orantılı olarak daha küçük bölgeleri serbest bırakacak, böylece hidrojenasyona karşı hidrojenoliz seçiciliğini değiştirecektir. Başka birçok mekanizma da mümkündür. ⓘ
Destekleyiciler, bir kok matının oluşmasını önlemek için yüzeyi kaplayabilir veya hatta bu tür malzemeleri aktif olarak ortadan kaldırabilir (örneğin, platformlamada platin üzerindeki renyum). Katalitik malzemenin dağılmasına yardımcı olabilir veya reaktiflere bağlanabilir. ⓘ