Mikrotübül
Mikrotübüller, hücre iskeletini oluşturan yapılardan olup, reseptörleri tutarlar veya serbest bırakırlar. Protein yapıda olup, uzun, içi boş silindirik yapılardır. ⓘ
Ökaryot kamçısı (flagella) içerisinde mikrotübüller bulunduğu halde prokaryot kamçısında bulunmaz. Bu ökaryotların prokaryot kamçısı arasındaki farklardan biridir. Bir diğeri ise hareket mekanizmalarından kaynaklanır. Kamçının sitoplazma içerisinde kalan kısmı etrafında enerji gereksinimi fazla olması nedeniyle mitokondri (prokaryot hücrelerde mezozom) bulunur. ⓘ
Mikrotübüllerin belli başlı görevleri ise sentriyollerin, sillerin ve kamçıların yapısal unsurlarını oluşturmaları şeklinde sıralanabilir. Bunlardan başka kan pulcukları (trombosit) ile daha birçok hücrede iskelet sistemini oluştururlar. Sinir hücrelerinde ise madde iletiminde iş görürler.Ayrıca bitki hücrelerinde hücre duvarının yapısındaki selüloz liflerinin düzenlenmesinde rol oynarlar. ⓘ
Mikrofilamentler ise mikrotübüllerin aksine ağsı bir yapı gösterirler ve kalınlıkları da 7 nm kadardır. Yani mikrotübüllerin üçte biri kadar kalınlıktadır. Mikrofilamentler hücrenin hareketi ve hücre kasılmasında rol oynayan fonksiyonel yapılardır. Mikrofilamentler hücre içerisinde sayıca az olmasına karşın kas hücrelerinde oldukça gelişmiş bir yapıya sahiplerdir. Kas hücrelerinde iki proteini içeren iki çeşit mikroflament vardır. ⓘ
Birinci mikrofilament aktin adı verilen bir çeşit protein taşır. İkinci mikrofilament ise miyozin adı verilen diğer bir çeşit proteini içerir. İçerdikleri proteinlerle birbirinden farklılaşmış bu mikrofilamentler, mekanik ve kimyasal etkileşimlerle birbirleri üzerinde kayarak içinde bulundukları kas hücresinin hareketini sağlarlar. ⓘ
Mikrofilamentler aynı zamanda hücre zarının endositoz ve ekzositoz hareketlerini sağlayarak kese oluşturma yöntemiyle hücre içerisine büyük moleküllerin alınmasını sağlarlar. ⓘ
ⓘ| Wikimedia Commons'ta Mikrotübül ile ilgili ortam dosyaları bulunmaktadır. |
| Sitoloji ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |

Mikrotübüller bir dizi hücresel süreçte önemli bir rol oynar. Hücrenin yapısının korunmasında rol oynarlar ve mikrofilamentler ve ara filamentlerle birlikte hücre iskeletini oluştururlar. Ayrıca kirpik ve kamçıların iç yapısını oluştururlar. Hücre içi taşıma için platformlar sağlarlar ve salgı veziküllerinin, organellerin ve hücre içi makromoleküler düzeneklerin hareketi de dahil olmak üzere çeşitli hücresel süreçlerde yer alırlar. Ayrıca hücre bölünmesinde (mitoz ve mayoz bölünme ile) yer alırlar ve ökaryotik kromozomları ayırmak için kullanılan mitotik iğlerin ana bileşenleridir. ⓘ
Mikrotübüller, birçok hayvan hücresinin merkezinde bulunan sentrozom veya sil ve kamçıların bazal gövdeleri veya çoğu mantarda bulunan iğ kutup gövdeleri gibi mikrotübül düzenleyici merkezler tarafından çekirdeklenir ve düzenlenir. ⓘ
Tarihçe
Hücre hareketi gibi tübülin ve mikrotübül aracılı süreçler Leeuwenhoek (1677) gibi ilk mikroskopçular tarafından görülmüştür. Ancak flagella ve diğer yapıların lifli doğası iki yüzyıl sonra, gelişmiş ışık mikroskopları ile keşfedilmiş ve 20. yüzyılda elektron mikroskobu ve biyokimyasal çalışmalar ile doğrulanmıştır. ⓘ
Dynein ve kinesin gibi mikrotübül motor proteinleri için in vitro deneyler, bir mikrotübülün floresan olarak etiketlenmesi ve mikrotübül ya da motor proteinlerin bir mikroskop lamına sabitlenmesi, ardından motor proteinlerin hareketini kaydetmek için lamın video-geliştirilmiş mikroskopi ile görüntülenmesi yoluyla araştırılır. Bu, motor proteinlerin mikrotübül boyunca ya da mikrotübülün motor proteinler boyunca hareket etmesini sağlar. Sonuç olarak, bazı mikrotübül süreçleri kimograf ile belirlenebilir. ⓘ
Yapı

Ökaryotlarda mikrotübüller polimerize α- ve β-tubulin dimerlerinden oluşan uzun, içi boş silindirlerdir. İçi boş mikrotübül silindirlerinin iç alanı lümen olarak adlandırılır. α ve β-tubulin alt birimleri amino asit düzeyinde ~%50 oranında aynıdır ve her ikisi de yaklaşık 50 kDa moleküler ağırlığa sahiptir. ⓘ
Bu α/β-tubulin dimerleri, daha sonra daha fazla α/β-tubulin dimeri eklenerek uzatılabilen tek bir mikrotübül oluşturmak için yanal olarak birleşen doğrusal protofilamentler halinde uç uca polimerize olur. Tipik olarak, mikrotübüller on üç protofilamentin paralel birleşmesiyle oluşur, ancak daha az veya daha fazla protofilamentten oluşan mikrotübüller çeşitli türlerde ve in vitro olarak gözlemlenmiştir. ⓘ
Mikrotübüller, biyolojik işlevleri için kritik olan farklı bir polariteye sahiptir. Tubulin uç uca polimerize olur ve bir tubulin dimerinin β-alt birimleri bir sonraki dimerin α-alt birimleri ile temas eder. Bu nedenle, bir protofilamentte, bir uçta α-alt birimleri açıkta kalırken diğer uçta β-alt birimleri açıkta kalacaktır. Bu uçlar sırasıyla (-) ve (+) uçlar olarak adlandırılır. Protofilamentler aynı polaritede birbirine paralel olarak demetlenir, bu nedenle bir mikrotübülde bir uçta, (+) uçta, sadece β-alt birimleri açıkta iken diğer uçta, (-) uçta, sadece α-alt birimleri açıktadır. Mikrotübül uzaması hem (+) hem de (-) uçlarda gerçekleşebilirken, (+) uçta önemli ölçüde daha hızlıdır. ⓘ
Protofilamentlerin yanal birleşimi, her biri farklı bir protofilamentten gelen 13 tubulin dimeri içeren sarmalın bir dönüşü ile yalancı helikal bir yapı oluşturur. En yaygın "13-3" mimarisinde, 13. tubulin dimeri, dönüşün sarmallığı nedeniyle 3 tubulin monomerinin dikey bir kayması ile bir sonraki tubulin dimeri ile etkileşime girer. Çok daha düşük oranda tespit edilen 11-3, 12-3, 14-3, 15-4 veya 16-4 gibi başka alternatif mimariler de vardır. Mikrotübüller ayrıca foraminifer gibi protist organizmalarda gözlenen sarmal filamentler gibi başka biçimlere de dönüşebilir. Mikrotübül içindeki yanal protofilamentlerin alt birimleri arasında A-tipi ve B-tipi kafesler olarak adlandırılan iki farklı etkileşim türü vardır. A-tipi kafeste, protofilamentlerin yanal ilişkileri bitişik α ve β-tubulin alt birimleri arasında meydana gelir (yani, bir protofilamentten bir α-tubulin alt birimi, bitişik bir protofilamentten bir β-tubulin alt birimi ile etkileşime girer). B-tipi kafeste, bir protofilamandaki α ve β-tubulin alt birimleri, sırasıyla komşu bir protofilamandaki α ve β-tubulin alt birimleriyle etkileşime girer. Deneysel çalışmalar, B-tipi kafesin mikrotübüller içindeki birincil düzenleme olduğunu göstermiştir. Bununla birlikte, çoğu mikrotübülde tubulin alt birimlerinin α-β etkileşime girdiği bir dikiş vardır. ⓘ
Mikrotübül oluşumu sırasında moleküllerin sırası ve tam bileşimi bu nedenle aşağıdaki gibi özetlenebilir: Bir β-tubulin, iki farklı polipeptitten (β-tubulin ve α-tubulin) oluştukları için bağlı formda bir heterodimer olan bir α-tubulin ile var olmayan bir kovalent bağ bağlamında bağlanır. Böylece heterodimerler oluştuktan sonra, mecazi olarak bir yönde (örneğin yukarı doğru) yükselen uzun zincirler oluşturmak üzere birleşirler. Belirli bir yönde bağlanan bu heterodimerler protofilamentleri oluşturur. Bu uzun zincirler (protofilamentler) artık yavaş yavaş yan yana birikir, böylece tüpe benzer bir lümene sahip tüp benzeri bir yapı oluşur. Buna göre, çoğunlukla 13 protofilament mikrotübüllerin dış duvarını oluşturur. Heterodimerlerin bir pozitif ve negatif uçtan oluştuğuna dikkat etmek de önemlidir; negatif ucu alfa-tubulin, pozitif ucu ise beta-tubulin oluşturur. Heterodimerlerin üst üste istiflenmesi nedeniyle, her zaman bir negatif ve pozitif uç vardır. Mikrotübüller artı uca heterodimerlerin eklenmesiyle büyür. ⓘ
Bazı Prosthecobacter türleri de mikrotübüller içerir. Bu bakteriyel mikrotübüllerin yapısı, bakteriyel tubulin A (BtubA) ve bakteriyel tubulin B (BtubB) heterodimerlerinden bir araya gelen içi boş bir protofilament tüpünden oluşan ökaryotik mikrotübüllerinkine benzer. Hem BtubA hem de BtubB, hem α- hem de β-tubulin özelliklerini paylaşır. Ökaryotik mikrotübüllerin aksine, bakteriyel mikrotübüller katlanmak için şaperonlara ihtiyaç duymaz. Ökaryotik mikrotübüllerin 13 protofilamentinin aksine, bakteriyel mikrotübüller sadece beş taneden oluşur. ⓘ
Hücre içi organizasyon
Mikrotübüller hücre iskeletinin bir parçasıdır, hücre sitoplazması içinde yapısal bir ağdır. Mikrotübül hücre iskeletinin rolleri arasında mekanik destek, sitoplazmanın organizasyonu, taşıma, hareketlilik ve kromozom ayrımı yer alır. Gelişmekte olan nöronlarda mikrotübüller nörotübüller olarak bilinir ve hücre iskeletinin başka bir bileşeni olan aktin dinamiklerini modüle edebilirler. Bir mikrotübül kuvvet oluşturmak için büyüyüp küçülebilir ve organellerin ve diğer hücresel bileşenlerin bir mikrotübül boyunca taşınmasını sağlayan motor proteinler vardır. Bu rol kombinasyonu, mikrotübülleri hücre içi bileşenleri organize etmek ve taşımak için önemli kılar. ⓘ
Mikrotübüllerin hücre içindeki organizasyonu hücre tipine özgüdür. Epitelde, mikrotübül polimerinin eksi uçları hücre-hücre teması bölgesinin yakınında sabitlenir ve apikal-bazal eksen boyunca düzenlenir. Çekirdeklenmeden sonra, eksi uçlar serbest bırakılır ve daha sonra ninein ve PLEKHA7 gibi faktörler tarafından periferde yeniden tutturulur. Bu şekilde proteinlerin, veziküllerin ve organellerin hücrenin apikal-bazal ekseni boyunca taşınmasını kolaylaştırabilirler. Fibroblastlarda ve diğer mezenkimal hücre tiplerinde, mikrotübüller sentrozomda sabitlenir ve artı uçlarıyla hücre çevresine doğru yayılır (ilk şekilde gösterildiği gibi). Bu hücrelerde mikrotübüller hücre göçünde önemli rol oynar. Ayrıca, mikrotübüllerin polaritesi, endoplazmik retikulum ve Golgi aygıtı da dahil olmak üzere hücrenin birçok bileşenini organize eden motor proteinler tarafından etkilenir. ⓘ
Mikrotübül polimerizasyonu
Çekirdeklenme
Çekirdeklenme, tubulin dimerinden mikrotübül oluşumunu başlatan olaydır. Mikrotübüller tipik olarak mikrotübül düzenleyici merkezler (MTOC'ler) adı verilen organeller tarafından çekirdeklenir ve düzenlenir. MTOC içinde, mikrotübüllerin α- ve β-alt birimlerinden farklı olan başka bir tubulin türü olan γ-tubulin bulunur. γ-tubulin, "γ-tubulin halka kompleksi" (γ-TuRC) olarak bilinen kilit yıkayıcı benzeri bir yapı oluşturmak için diğer birkaç ilişkili proteinle birleşir. Bu kompleks, α/β-tubulin dimerlerinin polimerizasyona başlaması için bir şablon görevi görür; mikrotübül büyümesi MTOC'den (+) yönde devam ederken (-) ucun bir kapağı olarak işlev görür. ⓘ
Sentrozom çoğu hücre tipinin birincil MTOC'sudur. Bununla birlikte, mikrotübüller başka bölgelerden de çekirdeklenebilir. Örneğin, kirpikler ve kamçıların tabanlarında bazal cisimcikler olarak adlandırılan MTOC'ler bulunur. Buna ek olarak, Vanderbilt'teki Kaverina grubunun ve diğerlerinin çalışmaları, Golgi aparatının mikrotübüllerin çekirdeklenmesi için önemli bir platform olarak hizmet edebileceğini göstermektedir. Sentrozomdan çekirdeklenme doğal olarak simetrik olduğundan, Golgi ile ilişkili mikrotübül çekirdeklenmesi hücrenin mikrotübül ağında asimetri oluşturmasına izin verebilir. Son çalışmalarda, UCSF'deki Vale grubu protein kompleksi augmin'i sentrozoma bağımlı, iğ temelli mikrotübül üretimi için kritik bir faktör olarak tanımladı. Bu proteinin γ-TuRC ile etkileşime girdiği ve mitotik iğ kökeni etrafındaki mikrotübül yoğunluğunu artırdığı gösterilmiştir. ⓘ
Bitki hücreleri gibi bazı hücre tipleri iyi tanımlanmış MTOC'ler içermez. Bu hücrelerde mikrotübüller sitoplazmadaki ayrı bölgelerden çekirdeklenir. Tripanosomatid parazitler gibi diğer hücre tiplerinde bir MTOC bulunur ancak bu MTOC sürekli olarak flagellumun tabanında bulunur. Burada, yapısal roller ve mitotik iğin oluşumu için mikrotübüllerin çekirdeklenmesi kanonik sentriol benzeri bir MTOC'den değildir. ⓘ
Polimerizasyon
İlk çekirdeklenme olayını takiben, tubulin monomerleri büyüyen polimere eklenmelidir. Monomer ekleme veya çıkarma işlemi, mikrotübülün ucunda artık herhangi bir net birleşme veya ayrılmanın olmadığı dimerlerin kararlı durum konsantrasyonu olan kritik konsantrasyonla ilişkili olarak çözeltideki αβ-tubulin dimerlerinin konsantrasyonuna bağlıdır. Dimer konsantrasyonu kritik konsantrasyondan büyükse mikrotübül polimerize olur ve büyür. Konsantrasyon kritik konsantrasyondan az ise mikrotübülün uzunluğu azalacaktır. ⓘ
Mikrotübül dinamikleri
Dinamik kararsızlık
Dinamik kararsızlık, bir mikrotübülün uçlarında birleşme ve ayrılmanın bir arada bulunması anlamına gelir. Mikrotübül bu bölgede dinamik olarak büyüme ve küçülme aşamaları arasında geçiş yapabilir. Tübülin dimerleri iki GTP molekülü bağlayabilir ve bunlardan biri birleşmenin ardından hidrolize olabilir. Polimerizasyon sırasında tubulin dimerleri GTP'ye bağlı durumdadır. α-tubuline bağlı GTP stabildir ve bu bağlı durumda yapısal bir işlev görür. Bununla birlikte, β-tubuline bağlı GTP, birleşmeden kısa bir süre sonra GDP'ye hidrolize olabilir. GDP-tubulinin montaj özellikleri GTP-tubulininkinden farklıdır, çünkü GDP-tubulin depolimerizasyona daha yatkındır. Bir mikrotübülün ucundaki GDP'ye bağlı bir tubulin alt birimi düşme eğiliminde olacaktır, ancak bir mikrotübülün ortasındaki GDP'ye bağlı bir tubulin kendiliğinden polimerden çıkamaz. Tubulin, GTP'ye bağlı durumda mikrotübülün ucuna eklendiğinden, mikrotübülün ucunda onu parçalanmaya karşı koruyan bir GTP'ye bağlı tubulin başlığının var olduğu öne sürülmektedir. Hidroliz mikrotübülün ucuna ulaştığında, hızlı bir depolimerizasyon ve büzülme başlar. Büyümeden küçülmeye bu geçişe felaket denir. GTP bağlı tubulin, mikrotübülün ucuna tekrar eklenmeye başlayabilir, yeni bir başlık sağlar ve mikrotübülü büzülmekten korur. Bu "kurtarma" olarak adlandırılır. ⓘ
"Arama ve yakalama" modeli
1986 yılında Marc Kirschner ve Tim Mitchison, mikrotübüllerin artı uçlarındaki dinamik büyüme ve büzülme özelliklerini hücrenin üç boyutlu alanını araştırmak için kullandıklarını öne sürmüşlerdir. Kinetokorlarla ya da kutup bölgeleriyle karşılaşan artı uçlar yakalanır ve artık büyüme ya da büzülme göstermez. Yarılanma ömrü 5-10 dakika olan normal dinamik mikrotübüllerin aksine, yakalanan mikrotübüller saatlerce dayanabilir. Bu fikir yaygın olarak "arama ve yakalama" modeli olarak bilinir. Gerçekten de, o zamandan beri yapılan çalışmalar bu fikri büyük ölçüde doğrulamıştır. Kinetokorda, çeşitli komplekslerin mikrotübül (+)-uçlarını yakaladığı gösterilmiştir. Ayrıca, interfaz mikrotübülleri için bir (+) uç kapatma aktivitesi de tanımlanmıştır. Bu sonraki aktiviteye, adenomatöz polipozis koli proteini olan forminler ve mikrotübüllerin büyüyen artı uçları boyunca izlenen bir protein olan EB1 aracılık eder. ⓘ
Mikrotübül dinamiğinin düzenlenmesi
Post-translasyonel modifikasyonlar

Çoğu mikrotübülün yarı ömrü 5-10 dakika olmasına rağmen, bazı mikrotübüller saatlerce stabil kalabilir. Bu stabilize mikrotübüller, mikrotübüle bağlı enzimlerin etkisiyle tubulin alt birimlerinde post-translasyonel modifikasyonlar biriktirir. Bununla birlikte, mikrotübül depolimerize olduğunda, bu modifikasyonların çoğu çözünebilir enzimler tarafından hızla tersine çevrilir. Çoğu modifikasyon reaksiyonu yavaşken ters reaksiyonları hızlı olduğundan, modifiye tübülin sadece uzun ömürlü stabil mikrotübüllerde tespit edilir. Bu modifikasyonların çoğu alfa-tubulinin C-terminal bölgesinde meydana gelir. Negatif yüklü glutamat bakımından zengin olan bu bölge, mikrotübülden dışarı çıkan ve motorlarla temas kuran nispeten yapılandırılmamış kuyruklar oluşturur. Bu nedenle, tubulin modifikasyonlarının motorların mikrotübül ile etkileşimini düzenlediğine inanılmaktadır. Bu kararlı modifiye mikrotübüller tipik olarak interfaz hücrelerinde hücre polaritesi bölgesine doğru yönlendirildiğinden, modifiye mikrotübüllerin bu alt kümesi, veziküllerin bu polarize bölgelere iletilmesine yardımcı olan özel bir yol sağlar. Bu modifikasyonlar şunları içerir:
- Detirozinasyon: C-terminal tirozinin alfa-tubulinden çıkarılması. Bu reaksiyon yeni C-terminalinde bir glutamatı açığa çıkarır. Sonuç olarak, bu modifikasyonu biriktiren mikrotübüller genellikle Glu-mikrotübüller olarak adlandırılır. Tubulin karboksipeptidaz henüz tanımlanmamış olsa da, tubulin-tirozin ligaz (TTL) bilinmektedir.
- Delta2: alfa-tubulinin C-terminusundan son iki kalıntının çıkarılması. Detirozinasyonun aksine, bu reaksiyonun geri dönüşümsüz olduğu düşünülmektedir ve sadece nöronlarda belgelenmiştir.
- Asetilasyon: alfa-tubulinin lizin 40'ına bir asetil grubunun eklenmesi. Bu modifikasyon, yalnızca mikrotübülün içinden erişilebilen bir lizin üzerinde gerçekleşir ve enzimlerin lizin kalıntısına nasıl eriştiği belirsizliğini korumaktadır. Tubulin asetiltransferazın doğası tartışmalıdır, ancak memelilerde ana asetiltransferazın ATAT1 olduğu bulunmuştur. bununla birlikte, ters reaksiyonun HDAC6 tarafından katalize edildiği bilinmektedir.
- Poliglutamilasyon: alfa-tubulinin ucuna yakın bulunan beş glutamattan herhangi birinin gama-karboksil grubuna bir glutamat polimerinin (tipik olarak 4-6 kalıntı uzunluğunda) eklenmesi. TTL ile ilişkili enzimler ilk dallanan glutamatı eklerken (TTL4,5 ve 7), aynı aileye ait diğer enzimler poliglutamat zincirini uzatır (TTL6,11 ve 13).
- Poliglisilasyon: beta-tubulinin sonuna yakın bulunan beş glutamattan herhangi birinin gama-karboksil grubuna bir glisin polimerinin (2-10 kalıntı uzunluğunda) eklenmesi. TTL3 ve 8 ilk dallanma glisini eklerken, TTL10 poliglisin zincirini uzatır.
Tubulinin ayrıca fosforile, ubikitine, sumoile ve palmitoile olduğu da bilinmektedir. ⓘ
Tubulin bağlayıcı ilaçlar ve kimyasal etkileri
Çok çeşitli ilaçlar tubuline bağlanabilmekte ve onun birleşme özelliklerini değiştirebilmektedir. Bu ilaçlar, tubulininkinden çok daha düşük hücre içi konsantrasyonlarda etkili olabilir. Mikrotübül dinamiklerine yapılan bu müdahale, bir hücrenin hücre döngüsünü durdurma etkisine sahip olabilir ve programlanmış hücre ölümüne veya apoptoza yol açabilir. Bununla birlikte, mikrotübül dinamiklerine müdahalenin mitoz geçiren hücreleri bloke etmek için yeterli olmadığını gösteren veriler vardır. Bu çalışmalar, dinamiklerin baskılanmasının mitozu engellemek için gerekenden daha düşük konsantrasyonlarda gerçekleştiğini göstermiştir. Mikrotübül dinamiklerinin tübülin mutasyonları veya ilaç tedavisi ile baskılanmasının hücre göçünü engellediği gösterilmiştir. Hem mikrotübül stabilizatörleri hem de destabilizatörleri mikrotübül dinamiklerini baskılayabilir. ⓘ
Mikrotübül dinamiklerini değiştirebilen ilaçlar şunları içerir:
- Kanserle savaşan taksan sınıfı ilaçlar (paklitaksel (taksol) ve dosetaksel) mikrotübüldeki GDP'ye bağlı tubulini stabilize ederek dinamik kararsızlığı engeller. Böylece, GTP hidrolizi mikrotübülün ucuna ulaştığında bile depolimerizasyon olmaz ve mikrotübül geri büzülmez.
Taksanlar (tek başına veya platin türevleri (karboplatin) veya gemsitabin ile birlikte) meme ve jinekolojik malignitelere, skuamöz hücreli karsinomlara (baş-boyun kanserleri, bazı akciğer kanserleri) vb. karşı kullanılır.
- Epotilonlar, örneğin Ixabepilone, taksanlara benzer şekilde çalışır.
- Vinorelbine, Nocodazole, vincristine ve colchicine, tubulinin mikrotübüllere polimerizasyonunu bloke ederek ters etkiye sahiptir.
- Eribulin mikrotübüllerin (+) büyüyen ucuna bağlanır. Eribulin antikanser etkilerini, uzun süreli ve geri dönüşümsüz mitotik blokajın ardından kanser hücrelerinin apoptozunu tetikleyerek gösterir. ⓘ
β3-tubulin ekspresyonunun, mikrotübül dinamiklerinin ilaca bağlı baskılanmasına karşı hücresel tepkileri değiştirdiği bildirilmiştir. Genel olarak dinamikler normalde hücre göçünü de engelleyen düşük, subtoksik konsantrasyonlardaki mikrotübül ilaçları tarafından baskılanır. Bununla birlikte, mikrotübüllere β3-tubulin eklenmesi, dinamikleri bastırmak ve hücre göçünü engellemek için gereken ilaç konsantrasyonunu artırır. Bu nedenle, β3-tubulin eksprese eden tümörler sadece mikrotübül hedefli ilaçların sitotoksik etkilerine değil, aynı zamanda tümör metastazını baskılama yeteneklerine de dirençlidir. Dahası, β3-tubulin ekspresyonu, bu ilaçların normalde etkilerinin bir başka önemli yönü olan anjiyogenezi inhibe etme kabiliyetine de karşı koyar. ⓘ
Mikrotübül polimerleri çeşitli çevresel etkilere karşı son derece hassastır. Çok düşük seviyelerdeki serbest kalsiyum mikrotübüllerin dengesini bozabilir ve bu durum ilk araştırmacıların polimeri in vitro olarak incelemesini engellemiştir. Soğuk sıcaklıklar da mikrotübüllerin hızlı depolimerizasyonuna neden olur. Buna karşılık, ağır su mikrotübül polimer stabilitesini destekler. ⓘ
Mikrotübüller ile etkileşime giren proteinler
Mikrotübülle ilişkili proteinler (MAP'ler)
MAP'lerin in-vivo mikrotübül dinamiklerinin düzenlenmesinde çok önemli bir rol oynadığı gösterilmiştir. Mikrotübül polimerizasyonu, depolimerizasyonu ve katastrof oranları, hangi mikrotübülle ilişkili proteinlerin (MAP'ler) mevcut olduğuna bağlı olarak değişir. Beyin dokusundan orijinal olarak tanımlanan MAP'ler moleküler ağırlıklarına göre iki grupta sınıflandırılabilir. Bu ilk sınıf, moleküler ağırlığı 55-62 kDa'nın altında olan MAP'lerden oluşur ve τ (tau) proteinleri olarak adlandırılır. In-vitro olarak, tau proteinlerinin mikrotübülleri doğrudan bağladığı, çekirdeklenmeyi teşvik ettiği ve parçalanmayı önlediği ve paralel dizilerin oluşumunu indüklediği gösterilmiştir. Ayrıca, tau proteinlerinin aksonlardaki mikrotübülleri stabilize ettiği ve Alzheimer hastalığında rol oynadığı da gösterilmiştir. İkinci sınıf, 200-1000 kDa moleküler ağırlığa sahip MAP'lerden oluşur ve bunların bilinen dört türü vardır: MAP-1, MAP-2, MAP-3 ve MAP-4. MAP-1 proteinleri üç farklı proteinden oluşur: A, B ve C. C proteini veziküllerin retrograd taşınmasında önemli bir rol oynar ve sitoplazmik dynein olarak da bilinir. MAP-2 proteinleri dendritlerde ve nöronların gövdesinde bulunur ve burada diğer hücre iskeleti filamentleriyle bağlanırlar. MAP-4 proteinleri hücrelerin çoğunda bulunur ve mikrotübülleri stabilize eder. Mikrotübül yapısı üzerinde stabilize edici etkisi olan MAP'lara ek olarak, diğer MAP'lar mikrotübülleri parçalayarak ya da depolimerizasyonunu indükleyerek stabilize edici etkiye sahip olabilirler. Katanin, spastin ve fidgetin adı verilen üç proteinin, istikrarsızlaştırıcı faaliyetleri yoluyla mikrotübüllerin sayısını ve uzunluğunu düzenlediği gözlemlenmiştir. Ayrıca, KIAA1211L'nin mikrotübüllere lokalize olduğu tahmin edilmektedir. ⓘ
Artı-uç izleme proteinleri (+TIP'ler)
Artı uç izleme proteinleri, büyüyen mikrotübüllerin uçlarına bağlanan ve mikrotübül dinamiklerinin düzenlenmesinde önemli bir rol oynayan MAP proteinleridir. Örneğin, +TIP'lerin mitoz sırasında mikrotübüllerin kromozomlarla etkileşimlerine katıldığı gözlemlenmiştir. Bir +TIP olarak tanımlanan ilk MAP, mikrotübül depolimerizasyon kurtarma olaylarında rol oynadığı gösterilen CLIP170 (sitoplazmik bağlayıcı protein) idi. Ek +TIP örnekleri arasında EB1, EB2, EB3, p150Glued, Dynamitin, Lis1, CLIP115, CLASP1 ve CLASP2 bulunmaktadır. ⓘ
Motor proteinler
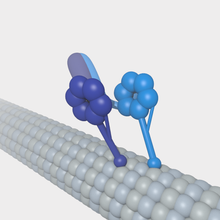

Mikrotübüller, vezikül trafiği ve hücre bölünmesi gibi önemli hücresel işlevlerde yer alan motor proteinler için substrat görevi görebilir. Mikrotübülle ilişkili diğer proteinlerin aksine motor proteinler, proteini substrat boyunca hareket ettiren mekanik iş üretmek için ATP hidrolizinden gelen enerjiyi kullanır. Mikrotübüllerle etkileşime giren başlıca motor proteinler, genellikle mikrotübülün (+) ucuna doğru hareket eden kinesin ve (-) ucuna doğru hareket eden dyneindir. ⓘ
- Dynein, iki büyük küresel baş alanını oluşturan iki özdeş ağır zincirden ve değişken sayıda ara ve hafif zincirden oluşur. Dynein aracılı taşıma, mikrotübülün (+) ucundan (-) ucuna doğru gerçekleşir. ATP hidrolizi, AAA+ (çeşitli hücresel aktivitelerle ilişkili ATPaz) protein ailesi ile benzerlikler gösteren globüler baş alanlarında gerçekleşir. Bu alanlardaki ATP hidrolizi, mikrotübül bağlayıcı alanlar aracılığıyla mikrotübül boyunca harekete bağlanır. Dynein, vezikülleri ve organelleri sitoplazma boyunca taşır. Bunu yapmak için, dynein molekülleri, dynactin de dahil olmak üzere bir dizi element içeren bir protein kompleksi aracılığıyla organel membranlarını bağlar.
- Kinesin, dynein ile benzer bir yapıya sahiptir. Kinesin, veziküller, organeller, protein kompleksleri ve mRNA'lar dahil olmak üzere çeşitli hücre içi kargoların mikrotübülün (+) ucuna doğru taşınmasında rol oynar. ⓘ
Genomlarını çoğaltmak için çekirdeğe erişim gerektiren bazı virüsler (retrovirüsler, herpesvirüsler, parvovirüsler ve adenovirüsler dahil) motor proteinlere bağlanır. ⓘ
Mitoz
Sentrozomlar

Sentrozom, mitoz sırasında hücrenin ana MTOC'sidir (mikrotübül düzenleme merkezi). Her bir sentrozom, sentriyol adı verilen ve birbirlerine dik açılarla yönlendirilmiş iki silindirden oluşur. Sentriyol, her biri kendisine bağlı iki kısmi mikrotübüle sahip 9 ana mikrotübülden oluşur. Her bir sentriyol yaklaşık 400 nm uzunluğunda ve yaklaşık 200 nm çevresindedir. ⓘ
Sentrozom mitoz için kritik öneme sahiptir çünkü sürece dahil olan mikrotübüllerin çoğu sentrozomdan kaynaklanır. Her bir mikrotübülün eksi uçları sentrozomda başlarken, artı uçları her yöne yayılır. Bu nedenle sentrozom mitoz sırasında mikrotübüllerin polaritesinin korunmasında da önemlidir. ⓘ
Çoğu hücrede hücre döngüsünün büyük bir kısmında sadece bir sentrozom bulunur, ancak mitoz bölünmeden hemen önce sentrozom ikiye katlanır ve hücre iki sentrozom içerir. Sentrozomdan yayılan mikrotübüllerin bazıları doğrudan kardeş sentrozomdan uzağa doğru büyür. Bu mikrotübüllere astral mikrotübüller denir. Bu astral mikrotübüllerin yardımıyla sentrozomlar birbirlerinden uzaklaşarak hücrenin karşı taraflarına doğru hareket eder. Bir kez orada, interpolar mikrotübüller ve K-lifleri de dahil olmak üzere mitoz için gerekli diğer mikrotübül türleri oluşmaya başlayabilir. ⓘ
Mitoz sırasında sentrozomlar ve mikrotübüller hakkında son bir önemli not, sentrozom mitoz için gerekli mikrotübüller için MTOC olsa da, araştırmalar mikrotübüllerin kendileri oluştuktan ve doğru yerde olduktan sonra mitozun gerçekleşmesi için sentrozomların kendilerine ihtiyaç olmadığını göstermiştir. ⓘ
Mikrotübül alt sınıfları
Astral mikrotübüller, yalnızca mitoz sırasında ve çevresinde var olan bir mikrotübül alt sınıfıdır. Sentrozomdan kaynaklanırlar, ancak kromozomlarla, kinetokorlarla veya diğer sentrozomdan kaynaklanan mikrotübüllerle etkileşime girmezler. Bunun yerine mikrotübülleri hücre zarına doğru yayılır. Oraya vardıklarında mikrotübülleri ve dolayısıyla tüm sentrozomu hücre zarına doğru çeken kuvveti yaratan belirli motor proteinlerle etkileşime girerler. Yukarıda belirtildiği gibi bu, sentrozomların kendilerini hücre içinde birbirlerinden uzağa yönlendirmelerine yardımcı olur. Ancak bu astral mikrotübüller mitotik iğin kendisi ile etkileşime girmez. Deneyler, bu astral mikrotübüller olmadan mitotik iğin oluşabileceğini, ancak hücre içindeki yöneliminin her zaman doğru olmadığını ve dolayısıyla mitozun etkili bir şekilde gerçekleşmediğini göstermiştir. Astral mikrotübüllerin bir diğer önemli işlevi de sitokinezise yardımcı olmaktır. Astral mikrotübüller, kromozomlar kopyalandıktan sonra iğ ve tüm hücreyi birbirinden ayırmak için hücre zarındaki motor proteinlerle etkileşime girer. ⓘ
İnterpolar/Polar mikrotübüller, mitoz sırasında sentrozomdan yayılan bir mikrotübül sınıfıdır. Bu mikrotübüller, astral mikrotübüllerin aksine mitotik iğe doğru yayılır. İnterpolar mikrotübüller mitoz sırasında mikrotübüllerin hem en bol hem de dinamik alt sınıfıdır. Mitotik iğdeki mikrotübüllerin yaklaşık yüzde 95'i interpolar olarak nitelendirilebilir. Ayrıca, bu mikrotübüllerin yarı ömrü bir dakikadan az olduğu için son derece kısadır. Kinetokorlara bağlanmayan interpolar mikrotübüller, kinetokorlarla yanal etkileşim yoluyla kromozom toplanmasına yardımcı olabilir. ⓘ
K lifleri/Kinetokor mikrotübülleri mitotik mikrotübüllerin üçüncü önemli alt sınıfıdır. Bu mikrotübüller mitotik iğdeki kinetokorlarla doğrudan bağlantılar oluşturur. Her bir K lifi 20-40 paralel mikrotübülden oluşur ve bir ucundan sentrozoma, diğer ucundan da her bir kromozomun merkezinde bulunan kinetokora bağlı güçlü bir tüp oluşturur. Her sentrozomun her bir kromozom çiftine bağlanan bir K lifi olduğundan, kromozomlar mitotik iğin ortasında K lifleri tarafından bağlanır. K lifleri, 4 ila 8 dakika arasında interpolar mikrotübüllerden çok daha uzun bir yarı ömre sahiptir. Mitozların sonunda, her bir K lifini oluşturan mikrotübüller ayrılmaya başlar ve böylece K lifleri kısalır. K lifleri kısaldıkça kromozom çiftleri sitokinezden hemen önce birbirinden ayrılır. Daha önce bazı araştırmacılar K liflerinin diğer mikrotübüller gibi sentrozomdan kaynaklanan eksi uçlarında oluştuğuna inanıyordu, ancak yeni araştırmalar farklı bir mekanizmaya işaret etti. Bu yeni mekanizmada, K lifleri başlangıçta artı uçlarında kinetokorlar tarafından stabilize edilir ve oradan dışarı doğru büyür. Bu K liflerinin eksi ucu sonunda mevcut bir Interpolar mikrotübüle bağlanır ve sonunda bu şekilde sentrozoma bağlanır. ⓘ
Mitotik iğdeki mikrotübül çekirdeği
Mitotik iği oluşturan mikrotübüllerin çoğu sentrozomdan kaynaklanır. Başlangıçta tüm bu mikrotübüllerin, yukarıdaki bir bölümde daha ayrıntılı olarak açıklanan arama ve yakalama adı verilen bir yöntemle sentrozomdan kaynaklandığı düşünülüyordu, ancak yeni araştırmalar mitoz sırasında mikrotübül çekirdeklenmesinin ek yolları olduğunu göstermiştir. Bu ek mikrotübül çekirdeklenme yollarından en önemlilerinden biri RAN-GTP yoludur. RAN-GTP mitoz sırasında kromatin ile birleşerek kromozomların yakınında mikrotübüllerin yerel olarak çekirdeklenmesini sağlayan bir gradyan oluşturur. Ayrıca, augmin/HAUS kompleksi olarak bilinen ikinci bir yol (bazı organizmalar daha çok çalışılan augmin kompleksini kullanırken, insanlar gibi diğerleri HAUS adı verilen benzer bir kompleks kullanır) mitotik iğde mikrotübül çekirdeklenmesi için ek bir araç görevi görür. ⓘ
Fonksiyonlar
Hücre göçü
Mikrotübül artı uçları genellikle belirli yapılara lokalize olur. Polarize interfaz hücrelerinde, mikrotübüller orantısız bir şekilde MTOC'den, göç eden fibroblastların ön kenarı gibi polarite bölgesine doğru yönlendirilir. Bu konfigürasyonun mikrotübüle bağlı veziküllerin Golgi'den polarite bölgesine taşınmasına yardımcı olduğu düşünülmektedir. ⓘ
Mikrotübüllerin dinamik istikrarsızlığı, sürünen çoğu memeli hücresinin göçü için de gereklidir. Dinamik mikrotübüller, hücre kontraktilitesini ve hücre yayılmasını düzenleyen RhoA ve Rac1 gibi anahtar G-proteinlerinin seviyelerini düzenler. Dinamik mikrotübüller ayrıca göç için gerekli olan fokal adezyon sökülmesini tetiklemek için de gereklidir. Mikrotübüllerin, hücre hareketi sırasında arka kenar geri çekilmesi için gerekli olan kasılma kuvvetlerine karşı koyan "destekler" olarak hareket ettiği bulunmuştur. Hücrenin arka kenarındaki mikrotübüller dinamik olduğunda, geri çekilmeye izin vermek için yeniden şekillenebilirler. Dinamikler bastırıldığında, mikrotübüller yeniden şekillenemez ve bu nedenle kasılma kuvvetlerine karşı koyarlar. Mikrotübül dinamikleri baskılanmış hücrelerin morfolojisi, hücrelerin ön kenarı uzatabildiğini (hareket yönünde kutuplaşmış), ancak arka kenarlarını geri çekmekte zorlandıklarını göstermektedir. Öte yandan, yüksek ilaç konsantrasyonları veya mikrotübülleri depolimerize eden mikrotübül mutasyonları, hücre göçünü geri getirebilir, ancak yönlülük kaybı vardır. Mikrotübüllerin hem hücre hareketini kısıtlamak hem de yönlülüğü sağlamak için hareket ettiği sonucuna varılabilir ⓘ
Kirpikler ve kamçı
Mikrotübüller ökaryotik sil ve kamçılarda önemli bir yapısal role sahiptir. Siller ve kamçı her zaman doğrudan bir MTOC'den uzanır, bu durumda bazal gövde olarak adlandırılır. Dynein motor proteinlerinin bir silyum veya flagellum boyunca uzanan çeşitli mikrotübül iplikçikleri üzerindeki etkisi, organelin yüzmek, hücre dışı materyali hareket ettirmek ve diğer roller için bükülmesini ve kuvvet üretmesini sağlar. Prokaryotlar, FtsZ dahil olmak üzere tubulin benzeri proteinlere sahiptir. Bununla birlikte, prokaryotik flagella yapı olarak ökaryotik flagelladan tamamen farklıdır ve mikrotübül bazlı yapılar içermez. ⓘ
Gelişim
Mikrotübüllerin oluşturduğu hücre iskeleti, bir organizmanın gelişiminin morfogenetik süreci için esastır. Örneğin, Drosophila melanogaster'in embriyogenezi sırasında yumurtanın eksenini oluşturmak için oosit içinde polarize mikrotübüllerden oluşan bir ağ gereklidir. Foliküler hücreler ve oosit arasında gönderilen sinyaller (epidermal büyüme faktörüne benzer faktörler gibi) mikrotübüllerin yeniden düzenlenmesine neden olur, böylece (-) uçları oositin alt kısmında bulunur, yapıyı polarize eder ve bir ön-arka eksenin ortaya çıkmasına neden olur. Vücudun mimarisine bu katılım memelilerde de görülür. ⓘ
Mikrotübüllerin önemli olduğu bir başka alan da yüksek omurgalılarda sinir sisteminin gelişimidir; burada tubulin ve ilişkili proteinlerin (mikrotübül ilişkili proteinler gibi) dinamikleri sinir sisteminin gelişimi sırasında hassas bir şekilde kontrol edilir. ⓘ
Gen düzenlemesi
Hücresel hücre iskeleti, birçok farklı seviyede işlev gören dinamik bir sistemdir: Hücreye belirli bir biçim vermenin ve veziküllerin ve organellerin taşınmasını desteklemenin yanı sıra, gen ifadesini de etkileyebilir. Bu iletişimde yer alan sinyal iletim mekanizmaları çok az anlaşılmıştır. Bununla birlikte, mikrotübüllerin ilaç aracılı depolimerizasyonu ile transkripsiyon faktörlerinin spesifik ekspresyonu arasındaki ilişki tanımlanmış ve bu faktörlerin varlığına bağlı olarak genlerin diferansiyel ekspresyonu hakkında bilgi sağlanmıştır. Hücre iskeleti ile hücresel yanıtın düzenlenmesi arasındaki bu iletişim, büyüme faktörlerinin etkisiyle de ilgilidir: örneğin, bu ilişki bağ dokusu büyüme faktörü için mevcuttur. ⓘ

