Asetilen

| |

| |

| |
| İsimler | |
|---|---|
| Tercih edilen IUPAC adı
Asetilen | |
| Sistematik IUPAC adı
Ethyne | |
| Tanımlayıcılar | |
CAS Numarası
|
|
3D model (JSmol)
|
|
Beilstein Referans
|
906677 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Numarası |
|
Gmelin Referans
|
210 |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
| BM numarası | 1001 (çözülmüş) 3138 (etilen ve propilen ile karışım halinde) |
InChI
| |
GÜLÜMSEMELER
| |
| Özellikler | |
Kimyasal formül
|
C2H2 |
| Molar kütle | 26.038 g-mol-1 |
| Görünüş | Renksiz gaz |
| Koku | Kokusuz |
| Yoğunluk | 1,1772 g/L = 1,1772 kg/m3 (0 °C, 101,3 kPa) |
| Erime noktası | -80,8 °C (-113,4 °F; 192,3 K) 1,27 atm'de üçlü nokta |
Süblimasyon
koşullar |
-84 °C; -119 °F; 189 K (1 atm) |
Suda çözünürlük
|
az çözünür |
| Çözünürlük | alkolde az çözünür aseton, benzende çözünür |
| Buhar basıncı | 44,2 atm (20 °C) |
| Asitlik (pKa) | 25 |
| Konjugat asit | Ethynium |
Manyetik duyarlılık (χ)
|
-20,8×10-6 cm3/mol |
| Termal iletkenlik | 21,4 mW-m-1-K-1 (300 K) |
| Yapı | |
Moleküler şekil
|
Doğrusal |
| Termokimya | |
Isı kapasitesi (C)
|
44,036 J-mol-1-K-1 |
Std molar
entropi (S |
200,927 J-mol-1-K-1 |
Std entalpi
oluşumu (ΔfH⦵298) |
227.400 kJ-mol-1 |
Gibbs serbest enerjisi (ΔfG˚)
|
209.879 kJ-mol-1 |
Std entalpi
yanma (ΔcH⦵298) |
1300 kJ-mol-1 |
| Tehlikeler | |
| GHS etiketlemesi: | |
Piktogramlar
|
 
|
Sinyal kelimesi
|
Tehlike |
Tehlike bildirimleri
|
H220, H336 |
Önlem ifadeleri
|
P202, P210, P233, P261, P271, P304, P312, P340, P377, P381, P403, P405, P501 |
| NFPA 704 (yangın elması) | |
Otomatik ateşleme
sıcaklık |
300 °C (572 °F; 573 K) |
| Patlayıcı sınırları | 2.5–100% |
| NIOSH (ABD sağlık maruziyet limitleri): | |
PEL (İzin Verilebilir)
|
Hiçbiri |
REL (Önerilen)
|
C 2500 ppm (2662 mg/m3) |
IDLH (Acil tehlike)
|
N.D. |
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |
Asetilen (sistematik adı: etin), C2H2 formülüne sahip kimyasal bileşiktir. Bir hidrokarbon ve en basit alkindir. Bu renksiz gaz, yakıt ve kimyasal yapı taşı olarak yaygın bir şekilde kullanılmaktadır. Saf haliyle kararsızdır ve bu nedenle genellikle bir çözelti olarak kullanılır. Saf asetilen kokusuzdur, ancak ticari sınıflar genellikle divinil sülfür ve fosfin gibi safsızlıklar nedeniyle belirgin bir kokuya sahiptir. ⓘ
Bir alkin olarak asetilen doymamıştır çünkü iki karbon atomu üçlü bir bağla birbirine bağlanmıştır. Karbon-karbon üçlü bağı, dört atomu da aynı düz çizgiye yerleştirir ve CCH bağ açıları 180°'dir. ⓘ

Asetilen (etin), bir tür hidrokarbondur. Üçlü bağ taşır ve formülü C2H2 şeklindedir. Alkin sınıfının ilk üyesidir. ⓘ
Brethelot tarafından total sentez yöntemiyle elde edildi. Daha sonra metandan ve karpitten de elde edildi. Normal koşullar altında gazdır ve -83,5 °C'da sıvılaşır. Suda ve asetonda çözünür. Sodyum ile olan karışımı kolay patlar ve yüksek ısı çıkışı olur. Narkotik özelliği vardır. Tıpta Narsylen olarak adlandırılır. Asit niteliği gösterdiğinden metallerle bileşik yapar. Yanma enerjisi yüksek olduğundan kaynakçılıkta kullanılır. ⓘ
| Organik kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |
Keşif
Asetilen 1836 yılında Edmund Davy tarafından keşfedilmiş ve "yeni bir hidrojen karbüratı" olarak tanımlanmıştır. Potasyum metalini izole etmeye çalışırken tesadüfi bir keşifti. Potasyum karbonatı karbonla çok yüksek sıcaklıklarda ısıtarak, bugün potasyum karbür (K2C2) olarak bilinen ve suyla tepkimeye girerek yeni gazı açığa çıkaran bir kalıntı üretti. Bu gaz 1860 yılında Fransız kimyager Marcellin Berthelot tarafından yeniden keşfedildi ve acétylène adını aldı. Berthelot'nun asetilen (C4H2) için ampirik formülü ve alternatif adı "quadricarbure d'hydrogène" (hidrojen quadricarbide) yanlıştı çünkü o dönemde birçok kimyager karbon için yanlış atomik kütle (12 yerine 6) kullanıyordu. Berthelot, organik bileşiklerin (metanol, etanol, vb.) buharlarını kırmızı sıcak bir tüpten geçirerek ve atıkları toplayarak bu gazı hazırlamayı başardı. Ayrıca asetilenin, karışık siyanojen ve hidrojen gazlarından elektrik kıvılcımıyla oluştuğunu buldu. Berthelot daha sonra bir karbon arkının kutupları arasından hidrojen geçirerek asetileni doğrudan elde etti. ⓘ
Hazırlık
1950'lerden beri asetilen esas olarak metanın kısmi yanması ile üretilmektedir. Hidrokarbonların parçalanması yoluyla etilen üretiminde geri kazanılan bir yan üründür. Bu yöntemle 1983 yılında yaklaşık 400.000 ton üretilmiştir. Patlayıcı karakteri ve Ziegler-Natta katalizörlerini zehirleme kabiliyeti nedeniyle etilen içinde bulunması genellikle istenmeyen bir durumdur. Genellikle Pd-Ag katalizörleri kullanılarak seçici olarak etilene hidrojenlenir. ⓘ

Petrolün başlıca indirgenmiş karbon kaynağı olarak kömürün yerini aldığı 1950'lere kadar asetilen (ve kömür katranından elde edilen aromatik fraksiyon) kimya endüstrisinde organik kimyasalların ana kaynağıydı. Friedrich Wöhler tarafından 1862 yılında keşfedilen ve öğrencilerin hala aşina olduğu bir reaksiyon olan kalsiyum karbürün hidrolizi ile hazırlanmıştır:
- CaC2 + 2H2O → Ca(OH)2 + C2H2↑ ⓘ
Kalsiyum karbür üretimi, elektrik ark ocağı kullanımını gerektiren ~2000 °C gibi son derece yüksek sıcaklıklar gerektirir. ABD'de bu süreç, Niagara Şelalesi'ndeki devasa hidroelektrik enerji projesi sayesinde 19. yüzyılın sonlarında kimyada yaşanan devrimin önemli bir parçasıydı. ⓘ
Bağlama
Değerlik bağı teorisi açısından, her bir karbon atomunda 2s orbitali bir 2p orbitali ile hibritleşerek bir sp hibriti oluşturur. Diğer iki 2p orbitali hibritleşmeden kalır. İki sp hibrit orbitalinin iki ucu karbonlar arasında güçlü bir σ değerlik bağı oluşturmak için üst üste binerken, diğer iki ucun her birinde hidrojen atomları da σ bağlarıyla bağlanır. Değişmeyen iki 2p orbitali bir çift daha zayıf π bağı oluşturur. ⓘ
Asetilen doğrusal simetrik bir molekül olduğu için D∞h nokta grubuna sahiptir. ⓘ
Fiziksel özellikler
Durum değişiklikleri
Atmosferik basınçta asetilen sıvı olarak bulunamaz ve erime noktası yoktur. Faz diyagramındaki üçlü nokta, sıvı asetilenin var olabileceği minimum basınçtaki (1,27 atm) erime noktasına (-80,8 °C) karşılık gelir. Üçlü noktanın altındaki sıcaklıklarda, katı asetilen süblimleşme yoluyla doğrudan buhara (gaz) dönüşebilir. Atmosferik basınçta süblimleşme noktası -84,0 °C'dir. ⓘ
Diğer
Oda sıcaklığında, asetilenin aseton içindeki çözünürlüğü kg başına 27,9 g'dır. Aynı miktarda dimetilformamid (DMF) için çözünürlük 51 g'dır. 20,26 bar'da çözünürlük aseton ve DMF için sırasıyla 689,0 ve 628,0 g'a yükselir. Bu çözücüler basınçlı gaz tüplerinde kullanılır. ⓘ
Uygulamalar
Kaynak
Asetilenin yaklaşık %20'si, alevin yüksek sıcaklığı nedeniyle oksiasetilen gazı kaynağı ve kesimi için endüstriyel gaz endüstrisi tarafından tedarik edilmektedir. Asetilenin oksijen ile yanması 3.600 K (3.330 °C; 6.020 °F) üzerinde bir alev üretir ve 11,8 kJ/g açığa çıkarır. Oksiasetilen en sıcak yanan yaygın yakıt gazıdır. Asetilen, disiyanoasetilenin 5.260 K (4.990 °C; 9.010 °F) ve siyanojenin 4.798 K (4.525 °C; 8.177 °F) değerinden sonra üçüncü en sıcak doğal kimyasal alevdir. Oksi-asetilen kaynağı önceki yıllarda popüler bir kaynak işlemiydi. Ark tabanlı kaynak işlemlerinin geliştirilmesi ve avantajları, oksi-yakıt kaynağını birçok uygulama için neredeyse yok etmiştir. Kaynak için asetilen kullanımı önemli ölçüde azalmıştır. Öte yandan, oksi-asetilen kaynak ekipmanı oldukça çok yönlüdür - sadece torç bazı demir veya çelik kaynak türlerinde tercih edildiği için değil (bazı sanatsal uygulamalarda olduğu gibi), aynı zamanda lehimleme, sert lehim kaynağı, metal ısıtma (tavlama veya temperleme, bükme veya şekillendirme için), aşınmış somun ve cıvataların gevşetilmesi ve diğer uygulamalara da kolayca uyum sağladığı için. Bell Canada kablo onarım teknisyenleri, menhollerde ve bazı hava konumlarında kurşun manşon ek yerlerini kapatmak için lehimleme aracı olarak hala taşınabilir asetilen yakıtlı torç kitleri kullanmaktadır. Oksiasetilen kaynağı, elektriğin kolayca erişilemediği alanlarda da kullanılabilir. Oksiasetilen kesme birçok metal imalat atölyesinde kullanılmaktadır. Kaynak ve kesme işlemlerinde kullanılmak üzere, çalışma basınçları bir regülatör tarafından kontrol edilmelidir, çünkü 15 psi'nin (100 kPa) üzerinde, bir şok dalgasına maruz kalırsa (örneğin bir geri tepme nedeniyle), asetilen patlayıcı bir şekilde hidrojen ve karbona ayrışır. ⓘ

Taşınabilir aydınlatma
Asetilenin yanması güçlü, parlak bir ışık üretir ve karpit lambaların her yerde bulunması 20. yüzyılın başlarında asetilenin ticarileşmesine yol açmıştır. Yaygın uygulamalar arasında kıyı fenerleri, sokak lambaları, otomobil ve maden farları yer alıyordu. Bu uygulamaların çoğunda, doğrudan yanma bir yangın tehlikesidir ve bu nedenle asetilen, önce akkor aydınlatma ve yıllar sonra düşük güçlü / yüksek lümenli LED'ler ile değiştirilmiştir. Bununla birlikte, asetilen lambalar uzak veya başka türlü erişilemeyen alanlarda ve zayıf veya güvenilmez merkezi elektrik şebekesine sahip ülkelerde sınırlı kullanımda kalmaya devam etmektedir. ⓘ
Plastikler ve akrilik asit türevleri
Asetilen yarı hidrojenle etilene dönüştürülebilir ve çeşitli polietilen plastikler için hammadde sağlar. Asetilenin özellikle Çin'deki bir diğer önemli uygulaması da akrilik asit türevlerine dönüştürülmesidir. Bu türevler akrilik elyaflar, camlar, boyalar, reçineler ve polimerler gibi ürünleri oluşturur. ⓘ
Çin dışında, asetilenin kimyasal hammadde olarak kullanımı, maliyet ve çevresel kaygılar nedeniyle 1965'ten 2007'ye kadar %70 oranında azalmıştır. ⓘ
Niş uygulamalar
1881 yılında Rus kimyager Mikhail Kucherov, cıva(II) bromür gibi katalizörler kullanarak asetilenin asetaldehide hidrasyonunu tanımladı. Wacker prosesinin ortaya çıkmasından önce bu reaksiyon endüstriyel ölçekte gerçekleştirilmiştir. ⓘ
Asetilenin Ziegler-Natta katalizörleri ile polimerizasyonu poliasetilen filmler üretir. Değişken tek ve çift bağlara sahip CH merkezlerinden oluşan bir zincir olan poliasetilen, keşfedilen ilk organik yarı iletkenlerden biridir. İyot ile reaksiyonu, elektriksel olarak oldukça iletken bir malzeme üretir. Bu tür malzemeler kullanışlı olmasa da, bu keşifler 2000 yılında Alan J. Heeger, Alan G MacDiarmid ve Hideki Shirakawa'ya verilen Nobel Kimya Ödülü'nde de belirtildiği gibi organik yarı iletkenlerin geliştirilmesine yol açmıştır. ⓘ
1920'lerde saf asetilen deneysel olarak inhalasyon anestezisi olarak kullanılmıştır. ⓘ
Asetilen bazen, nesne bir fırına sığmayacak kadar büyük olduğunda çeliğin karbürizasyonu (yani sertleştirilmesi) için kullanılır. ⓘ
Asetilen, radyokarbon tarihlemede karbonu uçurmak için kullanılır. Arkeolojik bir numunedeki karbonlu malzeme, lityum karbür (lityum asetilid olarak da bilinir) oluşturmak için küçük bir özel araştırma fırınında lityum metali ile işlenir. Karbür daha sonra, karbon-14'ün karbon-12'ye izotopik oranını ölçmek üzere bir kütle spektrometresine beslenecek asetilen gazı oluşturmak için her zamanki gibi su ile reaksiyona sokulabilir. ⓘ
Doğal oluşumu
C≡C üçlü bağının enerji zenginliği ve asetilenin suda oldukça yüksek çözünürlüğü, yeterli bir kaynağın mevcut olması koşuluyla, onu bakteriler için uygun bir substrat haline getirir. Asetilen üzerinde yaşayan bir dizi bakteri tanımlanmıştır. Asetilen hidrataz enzimi, asetaldehit vermek üzere asetilenin hidrasyonunu katalize eder:
- C2H2 + H2O → CH3CHO ⓘ
Asetilen evrende orta derecede yaygın bir kimyasaldır ve genellikle gaz devlerinin atmosferleriyle ilişkilidir. Satürn'ün bir uydusu olan Enceladus'ta ilginç bir asetilen keşfi yapılmıştır. Doğal asetilenin, uzun zincirli hidrokarbonların 1.700 K (1.430 °C; 2.600 °F) ve üzeri sıcaklıklarda katalitik ayrışmasından oluştuğuna inanılmaktadır. Böylesine küçük ve uzak bir cisimde bu tür sıcaklıkların görülmesi pek olası olmadığından, bu keşif potansiyel olarak o aydaki katalitik reaksiyonları düşündürmekte ve onu prebiyotik kimyayı araştırmak için umut verici bir yer haline getirmektedir. ⓘ
Reaksiyonlar
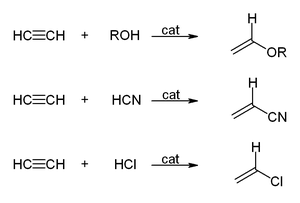
Vinilasyon reaksiyonları
Vinilasyon reaksiyonlarında, H-X bileşikleri üçlü bağ boyunca eklenir. Alkoller ve fenoller vinil eterleri vermek için asetilene eklenir. Tiyoller vinil tiyoeterleri verir. Benzer şekilde, vinilpirolidon ve vinilkarbazol, 2-pirolidon ve karbazolün vinilasyonu ile endüstriyel olarak üretilir.
Asetilenin hidrasyonu bir vinilasyon reaksiyonudur, ancak ortaya çıkan vinil alkol asetaldehide izomerize olur. Reaksiyon cıva tuzları tarafından katalize edilir. Bu reaksiyon bir zamanlar asetaldehit üretimi için baskın teknolojiydi, ancak daha ucuz bir hammadde olan etilenin oksidasyonu ile asetaldehit elde eden Wacker prosesi ile yer değiştirmiştir. Benzer bir durum, etilenin oksiklorlanmasına karşı hidroklorlama yoluyla asetilenin değerli vinil klorüre dönüştürülmesi için de geçerlidir. ⓘ
Etinilasyon
Asetilen, aldehitlere ve ketonlara katılarak α-etinil alkoller oluşturur:
Formaldehit ile reaksiyon endüstriyel olarak butinediol üretiminde kullanılır ve yan ürün olarak propargil alkol oluşturur. Katalizör olarak bakır asetilid kullanılır. ⓘ
Halojenler üçlü bağ boyunca eklendiğinden, ikame edilmiş asetilenler difloroasetilen, dikloroasetilen, dibromoasetilen ve diiyodoasetilen doğrudan asetilenden yapılamaz. Yaygın bir geçici çözüm, vinil dihaloetenolleri dehidre etmektir. ⓘ
Karbonilasyon
Walter Reppe, katalizörlerin varlığında asetilenin endüstriyel açıdan önemli çok çeşitli kimyasallar vermek üzere reaksiyona girdiğini keşfetti.
Karbon monoksit ile asetilen, akrilik cam üretmek için kullanılabilen akrilik asit veya akrilik esterler vermek üzere reaksiyona girer: ⓘ
Organometalik kimya
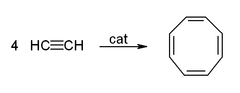
Asetilen ve türevleri (2-butin, difenilasetilen, vb.) geçiş metalleri ile kompleksler oluşturur. Metale bağlanması etilen komplekslerine benzer. Bu kompleksler, benzene alkin trimerizasyonu, siklooktatetraene tetramerizasyon ve hidrokinona karbonilasyon gibi birçok katalitik reaksiyonda ara ürünlerdir:
Belirli geçiş metallerinin varlığında, alkinler alkin metatezine uğrar. ⓘ
Metal asetilitler, LnM-C2R formülündeki türler de yaygındır. Bakır (I) asetilid ve gümüş asetilid, zayıf çözünürlük dengesi nedeniyle sulu çözeltilerde kolaylıkla oluşturulabilir. ⓘ
Asit-baz reaksiyonları
Asetilenin pKa değeri 25'tir, asetilen bir süperbaz tarafından deprotonlanarak bir asetilid oluşturabilir:
- HC≡CH + RM → RH + HC≡CM ⓘ
Çeşitli organometalik ve inorganik reaktifler etkilidir. ⓘ
Güvenlik ve kullanım
Asetilen özellikle zehirli değildir, ancak kalsiyum karbürden üretildiğinde, sarımsak benzeri belirgin bir koku veren fosfin ve arsin izleri gibi zehirli safsızlıklar içerebilir. Ayrıca çoğu hafif hidrokarbon gibi oldukça yanıcıdır, bu nedenle kaynakta kullanılır. En belirgin tehlikesi, özellikle basınçlı olduğunda, içsel istikrarsızlığı ile ilişkilidir: belirli koşullar altında asetilen, muhtemelen karbon ve hidrojene ek olarak tipik olarak benzen ve/veya vinilasetilen gibi bir dizi ürün oluşturmak üzere ekzotermik bir ekleme tipi reaksiyona girebilir. Sonuç olarak, asetilen, yoğun ısı veya şok dalgası ile başlatılırsa, gazın mutlak basıncı yaklaşık 200 kilopaskal (29 psi) değerini aşarsa patlayarak ayrışabilir. Ekipman üzerindeki çoğu regülatör ve basınç göstergesi, gösterge basıncını bildirir ve bu nedenle asetilen için güvenli sınır 101 kPagaj veya 15 psig'dir. Bu nedenle aseton veya dimetilformamid (DMF) içinde çözünmüş olarak tedarik edilir ve depolanır, gözenekli dolgulu (Agamassan) bir gaz tüpünde bulunur, bu da uygun kullanım sağlandığında taşınmasını ve kullanılmasını güvenli hale getirir. Asetilen tüpleri, kullanım sırasında asetonun çekilmesini önlemek için dik konumda kullanılmalıdır. ⓘ
Asetilenin dik silindirlerde güvenli depolanmasına ilişkin bilgiler OSHA, Sıkıştırılmış Gaz Derneği, Birleşik Devletler Maden Güvenliği ve Sağlık İdaresi (MSHA), EIGA ve diğer kurumlar tarafından sağlanmaktadır. ⓘ
Bakır, asetilenin ayrışmasını katalize eder ve sonuç olarak asetilen bakır borularda taşınmamalıdır. ⓘ
Yangın/sızıntı durumunda reaksiyonun şiddetlenmesini önlemek için tüpler oksitleyicilerden ayrı bir alanda depolanmalıdır. Asetilen tüpleri, patlayıcı atmosfere yol açan istenmeyen sızıntıları önlemek için kapalı alanlarda, kapalı araçlarda, garajlarda ve binalarda depolanmamalıdır. ABD'de Ulusal Elektrik Yasası (NEC), kazalar veya sızıntılar sırasında asetilenin açığa çıkabileceği alanlar da dahil olmak üzere tehlikeli alanların dikkate alınmasını gerektirir. Dikkate alınacak hususlar arasında elektrik sınıflandırması ve ABD'de listelenen Grup A elektrikli bileşenlerin kullanımı yer alabilir. Özel dikkat gerektiren alanların belirlenmesine ilişkin daha fazla bilgi NFPA 497'de yer almaktadır. Avrupa'da ATEX, kazalar veya sızıntılar sırasında yanıcı gazların açığa çıkabileceği tehlikeli alanlar için de dikkate alınmasını gerektirir. ⓘ