Gümüş
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gümüş | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Görünüş | parlak beyaz metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Ag) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periyodik tabloda gümüş | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom numarası (Z) | 47 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup | Grup 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dönem | dönem 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | d-blok | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Kripton|Kr]]] 4d10 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| STP'de Faz | katı | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erime noktası | 1234,93 K (961,78 °C, 1763,2 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 2435 K (2162 °C, 3924 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 10,49 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 9.320 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Füzyon ısısı | 11,28 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 254 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 25.350 J/(mol-K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomik özellikler | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidasyon durumları | -2, -1, +1, +2, +3 (amfoterik bir oksit) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.93 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 144 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçap | 145±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 172 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gümüşün spektral çizgileri | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diğer özellikler | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doğal oluşum | ilkel | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal yapı | yüz merkezli kübik (fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ses hızı ince çubuk | 2680 m/s (r.t.'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termal genleşme | 18,9 µm/(m⋅K) (25 °C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termal iletkenlik | 429 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termal difüzivite | 174 mm2/s (300 K'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektriksel direnç | 15,87 nΩ⋅m (20 °C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Manyetik sıralama | diamanyetik | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar manyetik duyarlılık | -19,5×10-6 cm3/mol (296 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young modülü | 83 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kayma modülü | 30 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yığın modülü | 100 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson oranı | 0.37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers sertliği | 251 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell sertliği | 206-250 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Numarası | 7440-22-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tarih | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keşif | MÖ 5000'den önce | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sembol | "Ag": Latince argentum'dan | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gümüşün ana izotopları | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
Gümüş, Ag sembolüne sahip kimyasal bir elementtir (Latince argentum'dan, Proto-Hint-Avrupa h₂erǵ: "parlak" veya "beyaz") ve atom numarası 47 olan kimyasal bir elementtir. Yumuşak, beyaz, parlak bir geçiş metali olup, tüm metaller arasında en yüksek elektrik iletkenliği, termal iletkenlik ve yansıtma özelliğine sahiptir. Metal yerkabuğunda saf, serbest element formunda ("doğal gümüş"), altın ve diğer metallerle alaşım halinde ve argentit ve klorargirit gibi minerallerde bulunur. Gümüşün çoğu bakır, altın, kurşun ve çinko rafinasyonunun bir yan ürünü olarak üretilir. ⓘ
Gümüş uzun zamandır değerli bir metal olarak değerlendirilmektedir. Gümüş metali birçok külçe sikkede, bazen altınla birlikte kullanılır: altından daha bol olmasına rağmen, doğal bir metal olarak çok daha az bulunur. Saflığı genellikle mil bazında ölçülür; %94 saflıkta bir alaşım "0.940 fine" olarak tanımlanır. Antik çağın yedi metalinden biri olan gümüş, çoğu insan kültüründe kalıcı bir role sahip olmuştur. ⓘ
Para birimi ve yatırım aracı (madeni para ve külçe) dışında gümüş, güneş panellerinde, su filtrasyonunda, mücevherlerde, süs eşyalarında, yüksek değerli sofra ve mutfak eşyalarında (dolayısıyla "gümüş eşya" terimi), elektrik kontaklarında ve iletkenlerde, özel aynalarda, pencere kaplamalarında, kimyasal reaksiyonların katalizinde, vitrayda renklendirici olarak ve özel şekerlemelerde kullanılır. Bileşikleri fotoğraf ve X-ışını filmlerinde kullanılır. Gümüş nitrat ve diğer gümüş bileşiklerinin seyreltik çözeltileri dezenfektan ve mikrobiyosit (oligodinamik etki) olarak kullanılır, bandajlara, yara örtülerine, kateterlere ve diğer tıbbi aletlere eklenir. ⓘ
Gümüş, elementlerin periyodik tablosunda simgesi Ag (Ag sembolü Latince argentum kelimesinden gelir) olan, beyaz, parlak, değerli bir metalik element. Atom numarası 47, atom ağırlığı 107,87 gramdır. Erime noktası 961,9 °C, kaynama noktası 1950 °C ve özgül ağırlığı da 10,5 g/cm³'tür. Çoğu bileşiklerinde +1 değerliklidir. ⓘ
Özellikler

Gümüş, fiziksel ve kimyasal özellikleri bakımından periyodik tablonun 11. grubundaki iki dikey komşusuna benzer: bakır ve altın. Gümüşün 47 elektronu bakır ([Ar]3d104s1) ve altına ([Xe]4f145d106s1) benzer şekilde [Kr]4d105s1 konfigürasyonunda düzenlenmiştir; 11. grup d bloğunda tamamen tutarlı elektron konfigürasyonlarına sahip birkaç gruptan biridir. Dolu bir d alt kabuğu üzerinde en yüksek işgalli s alt kabuğunda tek bir elektron içeren bu ayırt edici elektron konfigürasyonu, metalik gümüşün tekil özelliklerinin çoğunu açıklar. ⓘ
Gümüş nispeten yumuşak ve son derece sünek ve dövülebilir bir geçiş metalidir, ancak altından biraz daha az dövülebilirdir. Gümüş, bakır ve altına benzer şekilde sadece tek bir 5s elektronunun delokalize olduğu, yığın koordinasyon numarası 12 olan yüz merkezli kübik bir kafes içinde kristalleşir. Eksik d-kabuğuna sahip metallerin aksine, gümüşteki metalik bağlar kovalent karakterden yoksundur ve nispeten zayıftır. Bu gözlem, gümüşün tek kristallerinin düşük sertliğini ve yüksek sünekliğini açıklar. ⓘ
Gümüşün parlak, beyaz, metalik bir parlaklığı vardır ve bu parlaklık o kadar karakteristiktir ki metalin adı bir renk adı haline gelmiştir. Bakır ve altının aksine, gümüşte bir elektronu dolu d bandından s-p iletim bandına çıkarmak için gereken enerji yeterince büyüktür (yaklaşık 385 kJ/mol) ve artık spektrumun görünür bölgesinde değil, daha ziyade ultraviyolede emilime karşılık gelir; bu nedenle gümüş renkli bir metal değildir. Korumalı gümüş, ~450 nm'den daha uzun tüm dalga boylarında alüminyumdan daha fazla optik yansıtıcılığa sahiptir. Gümüşün yansıtıcılığı 450 nm'den daha kısa dalga boylarında alüminyumunkinden daha düşüktür ve 310 nm civarında sıfıra düşer. ⓘ
Çok yüksek elektriksel ve termal iletkenlik 11. gruptaki elementler için ortaktır, çünkü tek s elektronları serbesttir ve dolu d alt kabuğu ile etkileşime girmez, bu tür etkileşimler (önceki geçiş metallerinde meydana gelir) elektron hareketliliğini azaltır. Karbonun (elmas allotropunda) ve süper akışkan helyum-4'ün termal iletkenliği daha yüksek olmasına rağmen, gümüşün termal iletkenliği tüm malzemeler arasında en yüksek olanıdır. Gümüşün elektrik iletkenliği tüm metaller arasında en yüksektir, bakırdan bile daha yüksektir. Gümüş ayrıca tüm metaller arasında en düşük temas direncine sahiptir. Gümüş, yüksek maliyeti nedeniyle elektrik iletkenliği için nadiren kullanılır, ancak radyo frekansı mühendisliğinde, özellikle gümüş kaplamanın elektrik iletkenliğini artırdığı VHF ve daha yüksek frekanslarda bir istisna vardır, çünkü bu akımlar iletkenlerin iç kısmından ziyade yüzeyinde akma eğilimindedir. İkinci Dünya Savaşı sırasında ABD'de uranyum zenginleştirmek için kullanılan kalutronlardaki elektromıknatıslar için 13540 ton gümüş kullanılmıştır, bunun başlıca nedeni savaş zamanında bakır kıtlığı yaşanmasıdır. ⓘ
Gümüş bakır, altın ve çinko ile kolayca alaşım oluşturur. Düşük çinko konsantrasyonuna sahip çinkogümüş alaşımları, gümüş içindeki çinkonun yüz merkezli kübik katı çözeltileri olarak düşünülebilir, çünkü daha fazla çinko eklendikçe elektron konsantrasyonu artarken gümüşün yapısı büyük ölçüde değişmez. Elektron konsantrasyonunun daha da artırılması, gövde merkezli kübik (elektron konsantrasyonu 1,5), karmaşık kübik (1,615) ve altıgen yakın paketlenmiş fazlara (1,75) yol açar. ⓘ
İzotoplar
Doğal olarak oluşan gümüş, 107Ag ve 109Ag olmak üzere iki kararlı izotoptan oluşur ve 107Ag biraz daha bol miktarda bulunur (%51,839 doğal bolluk). Bu neredeyse eşit bolluk periyodik tabloda nadirdir. Atom ağırlığı 107.8682(2) u'dur; bu değer gümüş bileşiklerinin, özellikle de halojenürlerin gravimetrik analizdeki önemi nedeniyle çok önemlidir. Gümüşün her iki izotopu da yıldızlarda s süreci (yavaş nötron yakalama) ve süpernovalarda r süreci (hızlı nötron yakalama) yoluyla üretilir. ⓘ
Yirmi sekiz radyoizotop karakterize edilmiş olup, en kararlı olanları 41,29 günlük yarı ömre sahip 105Ag, 7,45 günlük yarı ömre sahip 111Ag ve 3,13 saatlik yarı ömre sahip 112Ag'dir. Gümüşün en kararlıları 108mAg (t1/2 = 418 yıl), 110mAg (t1/2 = 249.79 gün) ve 106mAg (t1/2 = 8.28 gün) olmak üzere çok sayıda nükleer izomeri vardır. Geri kalan tüm radyoaktif izotopların yarı ömürleri bir saatten azdır ve bunların çoğunluğunun yarı ömürleri üç dakikadan azdır. ⓘ
Gümüş izotoplarının bağıl atom kütlesi 92.950 u (93Ag) ile 129.950 u (130Ag) arasında değişir; en bol bulunan kararlı izotop olan 107Ag'den önceki birincil bozunma modu elektron yakalama, sonraki birincil mod ise beta bozunmasıdır. 107Ag'den önceki birincil bozunma ürünleri paladyum (element 46) izotopları ve sonraki birincil ürünler kadmiyum (element 48) izotoplarıdır. ⓘ
Paladyum izotopu 107Pd, beta emisyonu ile 6,5 milyon yıllık bir yarı ömürle 107Ag'ye bozunur. Demir meteoritleri, 107Ag bolluğunda ölçülebilir değişimler sağlamak için yeterince yüksek paladyum-gümüş oranına sahip tek nesnelerdir. Radyojenik 107Ag ilk olarak 1978 yılında Santa Clara meteoritinde keşfedilmiştir. Güneş Sistemi'nin oluşumundan bu yana açıkça erimiş olan cisimlerde gözlemlenen 107Pd-107Ag korelasyonları, erken Güneş Sistemi'nde kararsız nüklitlerin varlığını yansıtıyor olmalıdır. ⓘ
Kimya
| Oksidasyon devlet |
Koordinasyon numara |
Stereokimya | Temsilci bileşik |
|---|---|---|---|
| 0 (d10s1) | 3 | Planar | Ag(CO)3 |
| 1 (d10) | 2 | Doğrusal | [Ag(CN)2]- |
| 3 | Trigonal düzlemsel | AgI(PEt2Ar)2 | |
| 4 | Tetrahedral | [Ag(diars)2]+ | |
| 6 | Oktahedral | AgF, AgCl, AgBr | |
| 2 (d9) | 4 | Kare düzlemsel | [Ag(py)4]2+ |
| 3 (d8) | 4 | Kare düzlemsel | [AgF4]- |
| 6 | Oktahedral | [AgF6]3- |
Gümüş oldukça reaktif olmayan bir metaldir. Bunun nedeni, dolu 4d kabuğunun çekirdekten en dıştaki 5s elektronuna olan elektrostatik çekim kuvvetlerini korumada çok etkili olmaması ve dolayısıyla gümüşün elektrokimyasal serinin en altına yakın olmasıdır (E0(Ag+/Ag) = +0,799 V). Grup 11'de gümüş en düşük birinci iyonlaşma enerjisine sahiptir (5s orbitalinin kararsızlığını gösterir), ancak bakır ve altından daha yüksek ikinci ve üçüncü iyonlaşma enerjilerine sahiptir (4d orbitallerinin kararlılığını gösterir), böylece gümüşün kimyası ağırlıklı olarak +1 oksidasyon durumunun kimyasıdır, bu da d-orbitalleri doldukça ve stabilize oldukça geçiş serisi boyunca giderek artan sınırlı oksidasyon durumları aralığını yansıtır. Cu+ ile karşılaştırıldığında Cu2+'nın daha büyük hidrasyon enerjisinin, birincisinin sulu çözelti ve katılarda daha kararlı olmasının nedeni olduğu bakırın aksine, ikincisinin kararlı dolgulu d-alt kabuğundan yoksun olmasına rağmen, gümüşte bu etki daha büyük ikinci iyonlaşma enerjisi tarafından bastırılır. Bu nedenle, Ag+ sulu çözeltide ve katılarda kararlı türdür, Ag2+ ise suyu oksitlediği için çok daha az kararlıdır. ⓘ
Çoğu gümüş bileşiği, gümüşün küçük boyutu ve yüksek birinci iyonlaşma enerjisi (730,8 kJ/mol) nedeniyle önemli ölçüde kovalent karaktere sahiptir. Ayrıca, gümüşün 1,93'lük Pauling elektronegatifliği kurşununkinden (1,87) daha yüksektir ve 125,6 kJ/mol'lük elektron ilgisi hidrojeninkinden (72,8 kJ/mol) çok daha yüksektir ve oksijeninkinden (141,0 kJ/mol) çok daha az değildir. Tam d-alt kabuğu nedeniyle, ana +1 oksidasyon durumundaki gümüş, 4 ila 10. gruplardan uygun geçiş metallerinin nispeten az özelliğini sergiler, oldukça kararsız organometalik bileşikler oluşturur, 2 gibi çok düşük koordinasyon sayıları gösteren doğrusal kompleksler oluşturur ve geçiş sonrası metaller gibi Zintl fazlarının yanı sıra amfoterik bir oksit oluşturur. Önceki geçiş metallerinin aksine, gümüşün +1 oksidasyon durumu π-alıcı ligandların yokluğunda bile kararlıdır. ⓘ
Gümüş, kırmızı ısıda bile hava ile reaksiyona girmez ve bu nedenle simyacılar tarafından altınla birlikte soy metal olarak kabul edilmiştir. Reaktivitesi bakır (havada kırmızı ısıya kadar ısıtıldığında bakır(I) oksit oluşturur) ve altınınki arasındadır. Bakır gibi gümüş de sülfür ve bileşikleriyle tepkimeye girer; bunların varlığında gümüş havada karararak siyah gümüş sülfür oluşturur (bakır bunun yerine yeşil sülfat oluşturur, altın ise tepkimeye girmez). Bakırın aksine gümüş, diflorür oluşturduğu flor gazı haricinde halojenlerle reaksiyona girmez. Gümüş oksitleyici olmayan asitler tarafından saldırıya uğramazken, metal sıcak konsantre sülfürik asitte ve seyreltik veya konsantre nitrik asitte kolayca çözünür. Hava varlığında ve özellikle hidrojen peroksit varlığında, gümüş sulu siyanür çözeltilerinde kolayca çözünür. ⓘ
Tarihi gümüş eserlerdeki üç ana bozulma şekli; kararma, tuzlu suya uzun süre daldırma sonucu gümüş klorür oluşumu ve nitrat iyonları ya da oksijen ile reaksiyona girmedir. Taze gümüş klorür soluk sarı renktedir ve ışığa maruz kaldığında morumsu bir renk alır; eserin veya sikkenin yüzeyinden hafifçe dışarı çıkar. Bakır neredeyse her zaman gümüş alaşımlarının bir bileşeni olduğundan, bakırın eski gümüşte çökelmesi eserleri tarihlendirmek için kullanılabilir. ⓘ
Gümüş metali potasyum permanganat (KMnO) gibi güçlü oksitleyiciler tarafından saldırıya uğrar.
4) ve potasyum dikromat (K
2Cr
2O
7) ve potasyum bromür (KBr) varlığında. Bu bileşikler fotoğrafçılıkta gümüş görüntüleri ağartmak için kullanılır ve onları tiyosülfat ile sabitlenebilen ya da orijinal görüntüyü yoğunlaştırmak için yeniden zarflanabilen gümüş bromüre dönüştürür. Gümüş, fazla miktarda siyanür iyonu varlığında suda çözünebilen siyanür kompleksleri (gümüş siyanür) oluşturur. Gümüş siyanür çözeltileri gümüşün elektrokaplamasında kullanılır. ⓘ
Gümüşün yaygın oksidasyon durumları şunlardır (yaygınlık sırasına göre): +1 (en kararlı hal; örneğin gümüş nitrat, AgNO3); +2 (yüksek oranda oksitleyici; örneğin gümüş(II) florür, AgF2); ve hatta çok nadiren +3 (aşırı oksitleyici; örneğin potasyum tetrafloroargentat(III), KAgF4). 3 durumuna ulaşmak için flor veya peroksodisülfat gibi çok güçlü oksitleyici maddeler gerekir ve bazı gümüş(III) bileşikleri atmosferik nemle reaksiyona girerek cama saldırır. Aslında, gümüş(III) florür genellikle gümüş veya gümüş monoflorürün bilinen en güçlü oksitleyici madde olan kripton diflorür ile reaksiyona sokulmasıyla elde edilir. ⓘ
Bileşikler
Oksitler ve kalkojenler

Gümüş ve altının oksijene olan kimyasal bağlılıkları bakırdan daha düşüktür ve bu nedenle gümüş oksitlerin termal olarak oldukça kararsız olması beklenir. Çözünebilir gümüş(I) tuzları, alkali eklendiğinde koyu kahverengi gümüş(I) oksit, Ag2O, çökelir. (AgOH hidroksit sadece çözeltide bulunur; aksi takdirde kendiliğinden okside ayrışır). Gümüş(I) oksit çok kolay bir şekilde metalik gümüşe indirgenir ve 160 °C'nin üzerinde gümüş ve oksijene ayrışır. Bu ve diğer gümüş(I) bileşikleri güçlü oksitleyici ajan peroksodisülfat tarafından AgIAgIIIO2 formüllü karışık gümüş(I,III) oksit olan siyah AgO'ya oksitlenebilir. Metalik bir iletken olarak davranan Ag3O gibi, Ag2O3 ve Ag3O4 gibi integral olmayan oksidasyon durumlarında gümüş içeren diğer bazı karışık oksitler de bilinmektedir. ⓘ
Gümüş(I) sülfür, Ag2S, kendisini oluşturan elementlerden çok kolay bir şekilde oluşur ve bazı eski gümüş objeler üzerindeki siyah kararmaya neden olur. Hidrojen sülfürün gümüş metali veya sulu Ag+ iyonları ile reaksiyonundan da oluşabilir. Birçok stokiyometrik olmayan selenid ve tellürid bilinmektedir; özellikle AgTe~3 düşük sıcaklıkta bir süper iletkendir. ⓘ
Halidler

Bilinen tek gümüş dihalid, ısı altında elementlerden elde edilebilen diflorid, AgF2'dir. Güçlü ancak termal olarak kararlı ve bu nedenle güvenli bir florlama maddesi olan gümüş (II) florür genellikle hidroflorokarbonları sentezlemek için kullanılır. ⓘ
Bunun tam tersine, dört gümüş(I) halojenürün tümü bilinmektedir. Florür, klorür ve bromür sodyum klorür yapısına sahiptir, ancak iyodürün farklı sıcaklıklarda bilinen üç kararlı formu vardır; oda sıcaklığında olan kübik çinko blende yapısıdır. Bunların hepsi ilgili elementlerin doğrudan reaksiyonu ile elde edilebilir. Halojen grubu azaldıkça, gümüş halojenür giderek daha fazla kovalent karakter kazanır, çözünürlük azalır ve ligand-metal yük transferi (X-Ag+ → XAg) için gereken enerji azaldıkça renk beyaz klorürden sarı iyodüre değişir. Florür anormaldir, çünkü florür iyonu o kadar küçüktür ki önemli bir çözünme enerjisine sahiptir ve bu nedenle suda yüksek oranda çözünür ve di- ve tetrahidratlar oluşturur. Diğer üç gümüş halojenür sulu çözeltilerde yüksek oranda çözünmez ve gravimetrik analitik yöntemlerde çok yaygın olarak kullanılır. Dördü de ışığa duyarlıdır (ancak monoflorür sadece ultraviyole ışığa duyarlıdır), özellikle de bromür ve iyodür gümüş metale fotodecompose olur ve bu nedenle geleneksel fotoğrafçılıkta kullanılır. İlgili reaksiyon şöyledir:
- X- + hν → X + e- (fazladan elektronunu iletim bandına bırakan halojenür iyonunun uyarılması)
- Ag+ + e- → Ag (bir elektron kazanarak gümüş atomuna dönüşen bir gümüş iyonunun serbest kalması) ⓘ
Süreç tersine çevrilebilir değildir çünkü serbest kalan gümüş atomu tipik olarak bir kristal kusurunda veya bir safsızlık bölgesinde bulunur, böylece elektronun enerjisi "hapsolacak" kadar düşer. ⓘ
Diğer inorganik bileşikler

Beyaz gümüş nitrat, AgNO3, başta halojenürler olmak üzere diğer birçok gümüş bileşiğinin çok yönlü bir öncüsüdür ve ışığa karşı çok daha az duyarlıdır. Bir zamanlar ay kostiği olarak adlandırılırdı çünkü gümüşün Ay ile ilişkili olduğuna inanan eski simyacılar tarafından gümüşe luna denirdi. Genellikle gravimetrik analiz için kullanılır ve yaygın bir öncüsü olduğu daha ağır gümüş halojenürlerin çözünmezliğinden faydalanır. Gümüş nitrat organik sentezde birçok şekilde kullanılır, örneğin deproteksiyon ve oksidasyonlar için. Ag+ alkenleri tersinir olarak bağlar ve gümüş nitrat, alken karışımlarını seçici absorpsiyonla ayırmak için kullanılmıştır. Elde edilen eklenti, serbest alkeni serbest bırakmak için amonyak ile ayrıştırılabilir. ⓘ
Sarı gümüş karbonat, Ag2CO3, sulu sodyum karbonat çözeltilerinin bir gümüş nitrat eksikliği ile reaksiyona sokulmasıyla kolayca hazırlanabilir. Başlıca kullanım alanı mikroelektronikte kullanılmak üzere gümüş tozu üretimidir. Formaldehit ile indirgenerek alkali metal içermeyen gümüş üretilir:
- Ag2CO3 + CH2O → 2 Ag + 2 CO2 + H2 ⓘ
Gümüş karbonat, Koenigs-Knorr reaksiyonu gibi organik sentezlerde de reaktif olarak kullanılır. Fétizon oksidasyonunda, selit üzerindeki gümüş karbonat, diollerden laktonlar oluşturmak için bir oksitleyici madde olarak işlev görür. Ayrıca alkil bromürleri alkollere dönüştürmek için de kullanılır. ⓘ
Perküsyon başlıklarında kullanılan güçlü, dokunmaya duyarlı bir patlayıcı olan gümüş fulminat, AgCNO, gümüş metalinin etanol varlığında nitrik asit ile reaksiyona girmesiyle elde edilir. Diğer tehlikeli patlayıcı gümüş bileşikleri, gümüş nitratın sodyum azid ile reaksiyona girmesiyle oluşan gümüş azid, AgN3 ve gümüşün amonyak çözeltisinde asetilen gazıyla reaksiyona girmesiyle oluşan gümüş asetilid, Ag2C2'dir. En karakteristik reaksiyonunda, gümüş azit patlayıcı bir şekilde ayrışarak azot gazı açığa çıkarır: gümüş tuzlarının ışığa duyarlılığı göz önüne alındığında, bu davranış kristallerine ışık tutularak tetiklenebilir. ⓘ
- 2 AgN
3 (s) → 3 N
2 (g) + 2 Ag (s) ⓘ
Koordinasyon bileşikleri
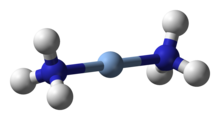
Gümüş kompleksleri, daha hafif homologu olan bakırınkilere benzer olma eğilimindedir. Gümüş(III) kompleksleri nadir olma eğilimindedir ve bakır(III) komplekslerinden biraz daha kararlı olmalarına rağmen daha kararlı olan düşük oksidasyon durumlarına çok kolay indirgenirler. Örneğin, kare düzlemsel periodat [Ag(IO5OH)2]5- ve tellürat [Ag{TeO4(OH)2}2]5- kompleksleri, gümüş(I)'in alkali peroksodisülfat ile oksitlenmesiyle hazırlanabilir. Sarı diamanyetik [AgF4]- çok daha az kararlıdır, nemli havada duman çıkarır ve camla reaksiyona girer. ⓘ
Gümüş(II) kompleksleri daha yaygındır. Değerlik izoelektronik bakır(II) kompleksleri gibi, genellikle kare düzlemsel ve paramanyetiktirler, bu da 4d elektronlar için 3d elektronlardan daha büyük alan bölünmesi ile artar. Ag+ 'nin ozon tarafından oksidasyonu ile üretilen sulu Ag2+, asidik çözeltilerde bile çok güçlü bir oksitleyici ajandır: kompleks oluşumu nedeniyle fosforik asitte stabilize olur. Peroksodisülfat oksidasyonu genellikle [Ag(py)4]2+ ve [Ag(bipy)2]2+ gibi heterosiklik aminlerle daha kararlı kompleksler vermek için gereklidir: karşı iyon gümüşü +1 oksidasyon durumuna geri indiremediği sürece bunlar kararlıdır. [AgF4]2-, piridin karboksilatlar gibi N- veya O-donör ligandlı bazı gümüş(II) kompleksleri gibi mor baryum tuzu olarak da bilinir. ⓘ
Komplekslerdeki gümüş için en önemli oksidasyon durumu +1'dir. Ag+ katyonu, homologları Cu+ ve Au+ gibi diyamanyetiktir, çünkü her üçü de eşleşmemiş elektron içermeyen kapalı kabuk elektron konfigürasyonlarına sahiptir: ligandlar I- gibi çok kolay polarize olmadıkları sürece kompleksleri renksizdir. Ag+ çoğu anyonla tuz oluşturur, ancak oksijenle koordine olmakta isteksizdir ve bu nedenle bu tuzların çoğu suda çözünmez: istisnalar nitrat, perklorat ve florürdür. Tetrakoordinat tetrahedral sulu iyon [Ag(H2O)4]+ bilinmektedir, ancak Ag+ katyonu için karakteristik geometri 2-koordinatlı doğrusaldır. Örneğin, gümüş klorür [Ag(NH3)2]+ oluşturmak için fazla sulu amonyakta kolayca çözünür; gümüş tuzları tiyosülfat kompleksi [Ag(S2O3)2]3- oluşumu nedeniyle fotoğrafçılıkta çözülür; ve gümüş (ve altın) için siyanür ekstraksiyonu [Ag(CN)2]- kompleksinin oluşumu ile çalışır. Gümüş siyanür doğrusal polimer {Ag-C≡N→Ag-C≡N→} oluşturur; gümüş tiyosiyanat benzer bir yapıya sahiptir, ancak sp3-hibridize sülfür atomu nedeniyle bunun yerine bir zikzak oluşturur. Şelatlama ligandları doğrusal kompleksler oluşturamaz ve bu nedenle onlarla gümüş (I) kompleksleri polimerler oluşturma eğilimindedir; yakın-tetrahedral difosfin ve diarsin kompleksleri [Ag(L-L)2]+ gibi birkaç istisna mevcuttur. ⓘ
Organometalik
Standart koşullar altında gümüş, Ag-C bağının zayıflığı nedeniyle basit karboniller oluşturmaz. Muhtemelen Ag-Ag bağları oluşturarak 25-30 K'de dimerize olan yeşil, düzlemsel paramanyetik Ag(CO)3 gibi 6-15 K civarındaki çok düşük sıcaklıklarda birkaç tanesi bilinmektedir. Ayrıca, gümüş karbonil [Ag(CO)] [B(OTeF5)4] bilinmektedir. Alkenler ve alkinler ile polimerik AgLX kompleksleri bilinmektedir, ancak bağları termodinamik olarak platin komplekslerinkinden bile daha zayıftır (benzer altın komplekslerinkinden daha kolay oluşmalarına rağmen): ayrıca grup 11'deki zayıf π bağını gösteren oldukça simetrik değildirler. Ag-C σ bağları, bakır(I) ve altın(I) gibi gümüş(I) tarafından da oluşturulabilir, ancak gümüş(I)'in basit alkilleri ve arilleri bakır(I)'inkilerden bile daha az kararlıdır (ortam koşulları altında patlama eğilimindedir). Örneğin, zayıf termal kararlılık AgMe (-50 °C) ve CuMe'nin (-15 °C) yanı sıra PhAg (74 °C) ve PhCu'nun (100 °C) bağıl bozunma sıcaklıklarına da yansımaktadır. ⓘ
C-Ag bağı, örneğin AgCF(CF3)2'de olduğu gibi perfloroalkil ligandlar tarafından stabilize edilir. Alkenilgümüş bileşikleri de alkilgümüş muadillerine göre daha kararlıdır. Gümüş-NHC kompleksleri kolayca hazırlanır ve genellikle kararsız ligandların yerini alarak diğer NHC komplekslerini hazırlamak için kullanılır. Örneğin, bis(NHC)gümüş(I) kompleksinin bis(asetonitril)paladyum diklorür veya klorido(dimetil sülfür)altın(I) ile reaksiyonu:
İntermetalik

Gümüş periyodik tablodaki diğer elementlerin çoğuyla alaşımlar oluşturur. Hidrojen, lityum ve berilyum hariç 1-3 gruplarındaki elementler yoğunlaĢmıĢ fazda gümüĢle çok karıĢabilir ve metaller arası bileĢikler oluĢturur; 4-9 gruplarındakiler çok az karıĢabilir; 10-14 gruplarındaki elementler (bor ve karbon hariç) çok karmaĢık Ag-M faz diyagramlarına sahiptir ve ticari açıdan en önemli alaĢımları oluĢturur; ve periyodik tablodaki diğer elementlerin Ag-M faz diyagramlarında tutarlılık yoktur. Bu tür alaşımların en önemlileri bakır ile olanlardır: sikke ve mücevherat için kullanılan gümüşün çoğu gerçekte gümüş-bakır alaşımıdır ve ötektik karışım vakum lehimlemede kullanılır. İki metal sıvı olarak tamamen karışabilir ancak katı olarak karışamaz; endüstrideki önemleri, özelliklerinin gümüş ve bakır konsantrasyonunda geniş bir varyasyon aralığında uygun olma eğiliminde olmasından kaynaklanır, ancak en kullanışlı alaşımlar gümüş açısından ötektik karışımdan daha zengin olma eğilimindedir (ağırlık olarak %71,9 gümüş ve %28,1 bakır ve atom olarak %60,1 gümüş ve %28,1 bakır). ⓘ
Diğer ikili alaşımların çoğu pek kullanışlı değildir: örneğin, gümüş-altın alaşımları çok yumuşaktır ve gümüş-kadmiyum alaşımları çok zehirlidir. Üçlü alaşımlar çok daha büyük öneme sahiptir: Diş amalgamları genellikle gümüş-kalay-civa alaşımlarıdır, gümüş-bakır-altın alaşımları mücevheratta çok önemlidir (genellikle altın açısından zengin tarafta) ve çok çeşitli sertlik ve renklere sahiptir, gümüş-bakır-çinko alaşımları düşük erime noktalı lehim alaşımları olarak kullanışlıdır ve gümüş-kadmiyum-indiyum (periyodik tabloda üç komşu elementi içerir) yüksek termal nötron yakalama kesiti, iyi ısı iletimi, mekanik stabilite ve sıcak suda korozyona karşı direnci nedeniyle nükleer reaktörlerde kullanışlıdır. ⓘ
Etimoloji
"Gümüş" kelimesi Eski İngilizcede seolfor ve siolfor gibi çeşitli yazılışlarda görülür. Eski Yüksek Almanca silabar; Gotik silubr; veya Eski İskandinav silfr ile akrabadır, hepsi de nihayetinde Proto-Germence *silubra'dan türemiştir. Gümüş için kullanılan Balto-Slavca sözcükler Cermence olanlara oldukça benzer (örneğin Rusça серебро [serebró], Lehçe srebro, Litvanca sidãbras), Keltiberce silabur biçimi gibi. Ortak bir Hint-Avrupa kökenine sahip olabilirler, ancak morfolojileri Hint-Avrupa kökenli olmayan bir Wanderwort'a işaret etmektedir. Bu nedenle bazı akademisyenler Baskça zilharr formunu kanıt olarak göstererek Paleo-Hispanik bir köken önermişlerdir. ⓘ
Kimyasal sembol Ag, Latince "gümüş" anlamına gelen argentum (Eski Yunanca ἄργυρος, árgyros ile karşılaştırınız) kelimesinden, Proto-Hint-Avrupa kökü *h₂erǵ- (eskiden *arǵ- olarak yeniden yapılandırılmıştı), "beyaz" veya "parlayan" anlamına gelmektedir. Bu, Cermen ve Balto-Slav dillerinde refleksleri eksik olan metal için kullanılan olağan Proto-Hint-Avrupa sözcüğüydü. ⓘ
Tarih

Gümüş, tarih öncesi insanlar tarafından bilinen ve bu nedenle keşfi tarihe karışan yedi antik metalden biriydi. Özellikle 11. gruptaki üç metal, bakır, gümüş ve altın, doğada element halinde bulunur ve muhtemelen basit takasın aksine ilk ilkel para biçimleri olarak kullanılmışlardır. Ancak bakırın aksine gümüş, düşük yapısal gücü nedeniyle metalürjinin gelişmesine yol açmamış ve daha çok süs eşyası ya da para olarak kullanılmıştır. Gümüş altından daha reaktif olduğu için, yerli gümüş kaynakları altından çok daha sınırlıydı. Örneğin, gümüş MÖ on beşinci yüzyıla kadar Mısır'da altından daha pahalıydı: Mısırlıların metalleri tuzla ısıtarak ve ardından üretilen gümüş klorürü metale indirgeyerek altını gümüşten ayırdıkları düşünülmektedir. ⓘ
Bu durum, gümüş metalinin cevherlerinden çıkarılmasını sağlayan bir teknik olan kupelasyonun keşfiyle değişmiştir. Küçük Asya'da ve Ege Denizi adalarında bulunan cüruf yığınları, gümüşün kurşundan MÖ 4. binyıl gibi erken bir tarihte ayrıştırıldığını ve Avrupa'daki en eski gümüş çıkarma merkezlerinden birinin erken Kalkolitik dönemde Sardinya olduğunu gösterse de, bu teknikler daha sonraya kadar geniş çapta yayılmamıştır, Bölgeye ve ötesine yayıldığı zaman. Hindistan, Çin ve Japonya'da gümüş üretiminin kökenleri neredeyse aynı derecede eskidir, ancak büyük yaşları nedeniyle iyi belgelenmemiştir. ⓘ

Fenikeliler bugünkü İspanya'ya ilk geldiklerinde o kadar çok gümüş elde ettiler ki hepsini gemilerine sığdıramadılar ve sonuç olarak çapalarını ağırlaştırmak için kurşun yerine gümüş kullandılar. Yunan ve Roma uygarlıkları zamanında gümüş sikkeler ekonominin temelini oluşturuyordu: Yunanlılar MÖ 7. yüzyılda galenadan gümüş elde etmeye başlamışlardı ve Atina'nın yükselişi kısmen yakındaki Laurium'daki gümüş madenleri sayesinde mümkün oldu; bu madenlerden MÖ 600-300 yılları arasında yılda yaklaşık 30 ton gümüş çıkarılıyordu. Roma para biriminin istikrarı büyük ölçüde, Romalı madencilerin Yeni Dünya'nın keşfinden önce benzeri olmayan bir ölçekte ürettikleri, çoğunlukla İspanya'dan gelen külçe gümüş arzına dayanıyordu. Yılda 200 tonluk bir üretim zirvesine ulaşan Roma ekonomisinde MS ikinci yüzyılın ortalarında 10.000 tonluk bir gümüş stoku dolaşıyordu ki bu miktar MS 800 civarında Ortaçağ Avrupası ve Abbasi Halifeliği'nin toplam gümüş miktarından beş ila on kat daha fazlaydı. Romalılar aynı dönemde orta ve kuzey Avrupa'da da gümüş çıkarıldığını kaydetmişlerdir. Bu üretim Roma İmparatorluğu'nun çöküşüyle birlikte neredeyse tamamen durdu ve Şarlman dönemine kadar devam etmedi: o zamana kadar on binlerce ton gümüş çıkarılmıştı. ⓘ
Ortaçağ boyunca Orta Avrupa gümüş üretiminin merkezi haline geldi, çünkü eski uygarlıklar tarafından sömürülen Akdeniz yatakları tükenmişti. Bohemya, Saksonya, Erzgebirge, Alsace, Lahn bölgesi, Siegerland, Silezya, Macaristan, Norveç, Steiermark, Salzburg ve güney Kara Orman'da gümüş madenleri açıldı. Bu cevherlerin çoğu gümüş açısından oldukça zengindi ve kalan kayadan elle kolayca ayrılıp eritilebiliyordu; bazı doğal gümüş yataklarına da rastlandı. Bu madenlerin çoğu kısa sürede tükendi, ancak birkaç tanesi Sanayi Devrimi'ne kadar aktif kaldı, bu tarihten önce dünya gümüş üretimi yılda 50 ton civarındaydı. Amerika'da yüksek sıcaklıkta gümüş-kurşun kapellasyon teknolojisi İnka öncesi uygarlıklar tarafından MS 60-120 gibi erken bir tarihte geliştirilmiştir; Hindistan, Çin, Japonya ve Kolomb öncesi Amerika'daki gümüş yatakları bu süre zarfında çıkarılmaya devam etmiştir. ⓘ
Amerika'nın keşfi ve İspanyol fatihlerin gümüşü yağmalamasıyla Orta ve Güney Amerika, 18. yüzyılın başlarına kadar, özellikle Peru, Bolivya, Şili ve Arjantin olmak üzere, gümüşün baskın üreticileri haline geldi: bu ülkelerden sonuncusu daha sonra adını, maden zenginliğinin çoğunu oluşturan metalden aldı. Gümüş ticareti yerini küresel bir değişim ağına bıraktı. Bir tarihçinin deyişiyle, gümüş "dünyayı dolaştı ve dünyanın dönmesini sağladı." Bu gümüşün büyük bir kısmı Çinlilerin eline geçti. Portekizli bir tüccar 1621 yılında gümüşün "Çin'e akın etmeden önce tüm dünyayı dolaştığını ve sanki doğal merkezindeymiş gibi orada kaldığını" belirtmiştir. Yine de gümüşün büyük bir kısmı İspanya'ya gidiyor ve İspanyol yöneticilerin hem Avrupa'da hem de Amerika'da askeri ve siyasi hırslarını sürdürmelerine olanak sağlıyordu. "Birçok tarihçi "Yeni Dünya madenleri İspanyol imparatorluğunu destekledi" sonucuna varmıştır. ⓘ
19. yüzyılda gümüşün birincil üretimi Kuzey Amerika'ya, özellikle de Kanada, Meksika ve Amerika Birleşik Devletleri'nin Nevada eyaletine taşındı: Avrupa'da kurşun ve çinko cevherlerinden bazı ikincil üretimler de yapıldı ve Sibirya ve Rusya'nın Uzak Doğusu'nun yanı sıra Avustralya'daki yataklar da çıkarıldı. Polonya, gümüş açısından zengin bakır yataklarının keşfinden sonra 1970'lerde önemli bir üretici olarak ortaya çıktı ve sonraki on yılda üretimin merkezi Amerika'ya döndü. Günümüzde Peru ve Meksika hala başlıca gümüş üreticileri arasındadır, ancak gümüş üretiminin dünya genelindeki dağılımı oldukça dengelidir ve gümüş arzının yaklaşık beşte biri yeni üretim yerine geri dönüşümden gelmektedir. ⓘ
Neo-Rokoko kahve fincanı; 1845; toplam: 32 x 23,8 x 15,4 cm; Cleveland Sanat Müzesi (Cleveland, Ohio, ABD)
Gizemli saat; yaklaşık 1889; çap: 5,4 cm, derinlik: 1,8 cm; Musée d'Horlogerie of Le Locle, (İsviçre) ⓘ
Sembolik rol

Gümüş mitolojide belirli bir rol oynar ve bir metafor olarak ve folklorda çeşitli kullanımlar bulmuştur. Yunan şair Hesiod'un İşler ve Günler'inde (109-201. satırlar) insanlığın birbirini izleyen çağlarını açıklamak için altın, gümüş, bronz ve demir gibi metallerin adlarıyla anılan farklı insan çağları sıralanır. Ovid'in Metamorfozlar'ı, gümüşün bir serideki en iyi ikinci, bronzdan daha iyi ama altından daha kötü anlamına gelen metaforik kullanımının bir örneğini içeren hikayenin başka bir yeniden anlatımını içerir:
Ama iyi Satürn, yukarıdan kovulduğunda,
Cehenneme sürüklendi, dünya Jove'un altındaydı.
Sonraki zamanlar gümüş bir çağ,
Pirinçten üstündür, ama altından daha üstündür.- Ovid, Metamorphoses, Kitap I, çev. John Dryden
Folklorda gümüşün genellikle mistik güçlere sahip olduğu düşünülürdü: örneğin, gümüşten dökülmüş bir kurşunun bu tür folklorda kurt adam, cadı veya diğer canavarlara karşı etkili olan tek silah olduğu varsayılır. Buradan hareketle gümüş kurşun deyimi, çok tartışılan yazılım mühendisliği makalesi No Silver Bullet'te olduğu gibi, mecazi olarak çok yüksek etkili veya neredeyse mucizevi sonuçlara sahip herhangi bir basit çözüme atıfta bulunmaya dönüşmüştür. Gümüşe atfedilen diğer güçler arasında zehiri tespit etme ve perilerin efsanevi dünyasına geçişi kolaylaştırma sayılabilir. ⓘ
Gümüş üretimi mecazi dile de ilham vermiştir. Yeremya'nın Yahuda'yı azarlamasında olduğu gibi, Kutsal Kitap'ın Eski Ahit'i boyunca kupelasyona açık göndermeler vardır: "Körükler yandı, kurşun ateşte tükendi; kurucu boşuna eridi, çünkü kötüler koparılıp atılmadı. İnsanlar onlara iğrenç gümüş diyecek, Çünkü Rab onları reddetti." (Yeremya 6:19-20) Yeremya ayrıca metalin işlenebilirliğini ve sünekliğini örnekleyen gümüş levhaların da farkındaydı: "Levha haline getirilmiş gümüş Tarşiş'ten, altın Ufaz'dan getirildi, İşçinin ve kurucunun ellerinin işi, Mavi ve mor giysileri, Hepsi kurnaz adamların işi." (Yeremya 10:9) ⓘ
Gümüşün daha olumsuz kültürel anlamları da vardır: ihanet ödülü anlamına gelen otuz gümüş deyimi, Yeni Ahit'te Yahuda İskariyot'un Nasıralı İsa'yı başkâhin Kayafa'nın askerlerine teslim etmek için Kudüs'teki Yahudi liderlerden aldığı söylenen rüşvete atıfta bulunur. Etik açıdan gümüş açgözlülüğü ve bilincin bozulmasını da simgeler; bu olumsuz yönüdür, değerinin saptırılmasıdır. ⓘ
Oluşumu ve üretimi
Yerkabuğundaki gümüş bolluğu milyonda 0,08 parçadır ve neredeyse cıvanınkiyle aynıdır. Çoğunlukla sülfit cevherlerinde, özellikle akantit ve argentit, Ag2S'de bulunur. Argentit yatakları bazen indirgeyici ortamlarda oluştuklarında doğal gümüş de içerirler ve tuzlu su ile temas ettiklerinde Şili ve Yeni Güney Galler'de yaygın olan klorargirit (boynuz gümüşü dahil), AgCl'ye dönüşürler. Diğer gümüş minerallerinin çoğu gümüş pnictidler veya chalcogenidlerdir; bunlar genellikle parlak yarı iletkenlerdir. Diğer metallerin argentifer yataklarının aksine gerçek gümüş yataklarının çoğu Tersiyer dönemi vulkanizmasından gelmektedir. ⓘ
Başlıca gümüş kaynakları Peru, Bolivya, Meksika, Çin, Avustralya, Şili, Polonya ve Sırbistan'dan elde edilen bakır, bakır-nikel, kurşun ve kurşun-çinko cevherleridir. Peru, Bolivya ve Meksika 1546'dan beri gümüş madenciliği yapmaktadır ve halen dünyanın en büyük üreticileridir. En çok gümüş üreten madenler Cannington (Avustralya), Fresnillo (Meksika), San Cristóbal (Bolivya), Antamina (Peru), Rudna (Polonya) ve Penasquito'dur (Meksika). 2015'e kadar en önemli yakın vadeli maden geliştirme projeleri Pascua Lama (Şili), Navidad (Arjantin), Jaio (Meksika), Malku Khota (Bolivya) ve Hackett River'dır (Kanada). Orta Asya'da Tacikistan'ın dünyanın en büyük gümüş yataklarından bazılarına sahip olduğu bilinmektedir. ⓘ
Gümüş genellikle doğada diğer metallerle birlikte veya gümüş bileşikleri içeren minerallerde, genellikle galen (kurşun sülfit) veya serussit (kurşun karbonat) gibi sülfitler şeklinde bulunur. Bu nedenle gümüşün birincil üretimi, tarihsel olarak önemli bir süreç olan argentifer kurşun cevherlerinin eritilmesini ve ardından kapellasyonunu gerektirir. Kurşun 327 °C'de, kurşun oksit 888 °C'de ve gümüş 960 °C'de erir. Gümüşü ayırmak için alaşım, oksitleyici bir ortamda 960 °C ila 1000 °C arasındaki yüksek sıcaklıkta tekrar eritilir. Kurşun, daha sonra litarj olarak bilinen kurşun monoksite oksitlenir ve bu da mevcut diğer metallerden oksijeni yakalar. Sıvı kurşun oksit, kılcal hareketle ocak astarlarına alınır veya emilir.
- Ag(s) + 2Pb(s) + O
2(g) → 2PbO(absorbe) + Ag(l) ⓘ
Günümüzde gümüş metali esas olarak bakır, kurşun ve çinkonun elektrolitik rafinasyonunun ikincil bir yan ürünü olarak ve gümüş de içeren cevherden elde edilen külçe kurşuna Parkes işleminin uygulanmasıyla üretilmektedir. Bu tür işlemlerde gümüş, konsantrasyonu ve eritilmesi boyunca söz konusu demir dışı metali takip eder ve daha sonra saflaştırılır. Örneğin bakır üretiminde, saflaştırılmış bakır elektrolitik olarak katot üzerinde biriktirilirken, gümüş ve altın gibi daha az reaktif değerli metaller "anot balçığı" olarak adlandırılan anot altında toplanır. Bu balçık daha sonra sıcak havalandırılmış seyreltik sülfürik asitle muamele edilerek ve kireç veya silika akısı ile ısıtılarak baz metallerden ayrılır ve saflaştırılır, ardından gümüş nitrat çözeltisinde elektroliz yoluyla %99,9'un üzerinde saflığa getirilir. ⓘ
Ticari sınıf ince gümüş en az %99,9 saflıktadır ve %99,999'dan daha yüksek saflıklar mevcuttur. 2014 yılında Meksika en büyük gümüş üreticisi olurken (5.000 ton veya dünya toplamı olan 26.800 t'un %18,7'si), onu Çin (4.060 t) ve Peru (3.780 t) takip etmiştir. ⓘ
Deniz ortamlarında
Gümüş konsantrasyonu deniz suyunda düşüktür (pmol/L). Seviyeler derinliğe göre ve su kütleleri arasında değişiklik gösterir. Çözünmüş gümüş konsantrasyonları kıyı yüzey sularında 0,3 pmol/L'den pelajik derin sularda 22,8 pmol/L'ye kadar değişmektedir. Deniz ortamlarında gümüşün varlığını ve dinamiklerini analiz etmek, bu özellikle düşük konsantrasyonlar ve ortamdaki karmaşık etkileşimler nedeniyle zordur. Nadir bir eser metal olmasına rağmen, konsantrasyonlar akarsu, aeol, atmosferik ve akıntı girdilerinin yanı sıra deşarj, atık bertarafı ve endüstriyel şirketlerin emisyonları yoluyla antropojenik girdilerden büyük ölçüde etkilenir. Organik maddenin ayrışması gibi diğer iç süreçler, daha derin sularda çözünmüş gümüş kaynağı olabilir ve bu da yukarı akıntı ve dikey karışım yoluyla bazı yüzey sularına beslenir. ⓘ
Atlantik ve Pasifik'te gümüş konsantrasyonları yüzeyde minimum düzeydedir ancak derin sularda yükselir. Gümüş, fotik bölgedeki planktonlar tarafından alınır, derinlikle birlikte yeniden hareketlenir ve derin sularda zenginleşir. Gümüş Atlantik'ten diğer okyanus su kütlelerine taşınır. Kuzey Pasifik sularında gümüş, Atlantik'in derin sularına kıyasla daha yavaş bir oranda yeniden hareketlenir ve giderek zenginleşir. Gümüş, su ve besin maddelerini Kuzey Atlantik'ten Güney Atlantik'e ve oradan da Kuzey Pasifik'e taşıyan ana okyanus taşıyıcı bandını takip eden artan konsantrasyonlara sahiptir. ⓘ
Biyoakümülasyon, partikül maddelerle birleşme ve emilim yoluyla organizmalar üzerinde yaratabileceği olası zararlı etkilere rağmen, deniz yaşamının gümüşten nasıl etkilendiğine odaklanan kapsamlı miktarda veri bulunmamaktadır. Bilim insanları 1984 yılına kadar gümüşün kimyasal özelliklerini ve potansiyel toksisitesini anlamaya başlamamışlardır. Aslında, cıva gümüşün toksik etkilerini aşan diğer tek eser metaldir; ancak, reaktif olmayan biyolojik bileşiklere aktarılma kabiliyeti nedeniyle okyanus koşullarında gümüş toksisitesinin tam kapsamı beklenmemektedir. ⓘ
Bir çalışmada, aşırı iyonik gümüş ve gümüş nanopartiküllerinin varlığı zebra balığı organlarında biyoakümülasyon etkilerine neden olmuş ve solungaçlarındaki kimyasal yolları değiştirmiştir. Buna ek olarak, çok erken deneysel çalışmalar gümüşün toksik etkilerinin tuzluluk ve diğer parametrelerin yanı sıra yaşam evreleri ve yüzgeçli balıklar, yumuşakçalar ve kabuklular gibi farklı türler arasında nasıl dalgalandığını göstermiştir. Bir başka çalışmada yunus ve balinaların kas ve karaciğerlerinde yüksek gümüş konsantrasyonları bulunmuştur, bu da son yıllarda bu metalin kirliliğine işaret etmektedir. Gümüş, bir organizma için ortadan kaldırılması kolay bir metal değildir ve yüksek konsantrasyonlar ölüme neden olabilir. ⓘ
Parasal kullanım

Bilinen en eski sikkeler M.Ö. 600 yıllarında Küçük Asya'daki Lidya Krallığı'nda basılmıştır. Lidya sikkeleri, Lidya topraklarında bulunan ve doğal olarak oluşan bir altın ve gümüş alaşımı olan elektrumdan yapılmıştır. O zamandan beri, standart ekonomik hesap biriminin sabit bir gümüş ağırlığı olduğu gümüş standartları, 20. yüzyıla kadar tüm dünyada yaygındı. Yüzyıllar boyunca kayda değer gümüş sikkeler arasında Yunan drahmisi, Roma denariusu, İslam dirhemi, antik Hindistan'dan karshapana ve Babür İmparatorluğu zamanından rupi (trimetalik bir standart oluşturmak için bakır ve altın sikkelerle gruplandırılmıştır) ve İspanyol doları bulunmaktadır. ⓘ
Sikke basımı için kullanılan gümüş miktarı ile diğer amaçlar için kullanılan gümüş miktarı arasındaki oran zaman içinde büyük dalgalanmalar göstermiştir; örneğin savaş zamanında, savaşı finanse etmek için sikke basımında daha fazla gümüş kullanılma eğiliminde olmuştur. ⓘ
Günümüzde külçe gümüş ISO 4217 para birimi kodu XAG'ye sahiptir ve bu koda sahip olan dört değerli metalden biridir (diğerleri paladyum, platin ve altındır). Gümüş sikkeler dökme çubuklardan veya külçelerden üretilir, doğru kalınlığa kadar haddelenir, ısıl işlemden geçirilir ve daha sonra boşlukları kesmek için kullanılır. Bu boşluklar daha sonra bir sikke presinde öğütülür ve basılır; modern sikke presleri saatte 8000 gümüş sikke üretebilir. ⓘ
Fiyat
Gümüş fiyatları normalde troy ons cinsinden kote edilir. Bir troy ons 31,1034768 grama eşittir. Londra gümüş fiks fiyatı her iş günü Londra saatiyle öğlen yayınlanır. Bu fiyat birkaç büyük uluslararası banka tarafından belirlenir ve Londra külçe piyasası üyeleri tarafından o günkü ticaret için kullanılır. Fiyatlar en yaygın olarak Birleşik Devletler doları (USD), İngiliz sterlini (GBP) ve Euro (EUR) olarak gösterilir. ⓘ
Uygulamalar
Mücevher ve gümüş eşyalar


Tarihin büyük bir bölümünde gümüşün madeni para dışında en önemli kullanım alanı mücevher ve diğer genel kullanım eşyalarının imalatı olmuştur ve bu günümüzde de önemli bir kullanım alanı olmaya devam etmektedir. Örnek olarak, antibakteriyel özellikleri nedeniyle gümüşün son derece uygun olduğu çatal bıçak takımı için sofra gümüşü verilebilir. Batılı konser flütleri genellikle som gümüşle kaplanır ya da som gümüşten yapılır; aslında çoğu gümüş eşya saf gümüşten yapılmak yerine sadece gümüş kaplamadır; gümüş normalde elektrokaplama yoluyla yerleştirilir. Gümüş kaplamalı cam (metalin aksine) aynalar, vakumlu şişeler ve Noel ağacı süsleri için kullanılır. ⓘ
Saf gümüş çok yumuşak olduğundan, bu amaçlar için kullanılan gümüşün çoğu bakır ile alaşımlıdır ve 925/1000, 835/1000 ve 800/1000 incelikleri yaygındır. Bir dezavantajı, hidrojen sülfür ve türevlerinin varlığında gümüşün kolayca kararmasıdır. Paladyum, platin ve altın gibi değerli metallerin katılması kararmaya karşı direnç sağlar ancak oldukça maliyetlidir; çinko, kadmiyum, silikon ve germanyum gibi baz metaller korozyonu tamamen önlemez ve alaşımın parlaklığını ve rengini etkileme eğilimindedir. Elektrolitik olarak rafine edilmiş saf gümüş kaplama, kararmaya karşı direnci artırmada etkilidir. Kararmış gümüşün parlaklığını geri kazandırmak için kullanılan olağan çözümler gümüş sülfür yüzeyini metalik gümüşe indirgeyen daldırma banyoları ve kararmayı bir macunla temizlemektir; ikinci yaklaşım aynı zamanda gümüşü parlatmak gibi hoş bir yan etkiye de sahiptir. ⓘ
Tıp
Tıpta gümüş, yara örtülerine dahil edilir ve tıbbi cihazlarda antibiyotik kaplama olarak kullanılır. Gümüş sülfadiazin veya gümüş nanomalzemeler içeren yara örtüleri dış enfeksiyonları tedavi etmek için kullanılır. Gümüş ayrıca idrar kateterleri (geçici kanıtlar kateterle ilişkili idrar yolu enfeksiyonlarını azalttığını göstermektedir) ve endotrakeal solunum tüpleri (kanıtlar ventilatörle ilişkili pnömoniyi azalttığını göstermektedir) gibi bazı tıbbi uygulamalarda da kullanılmaktadır. Gümüş iyonu biyoaktiftir ve yeterli konsantrasyonda bakterileri in vitro olarak kolayca öldürür. Gümüş iyonları bakterilerde besinleri taşıyan, yapılar oluşturan ve hücre duvarlarını sentezleyen enzimlere müdahale eder; bu iyonlar ayrıca bakterinin genetik materyaliyle de bağ kurar. Gümüş ve gümüş nanoparçacıkları çeşitli endüstriyel, sağlık ve ev uygulamalarında antimikrobiyal olarak kullanılmaktadır: örneğin, giysilerin nanogümüş parçacıklarıyla aşılanması, böylece daha uzun süre kokusuz kalmalarını sağlar. Ancak bakteriler gümüşün antimikrobiyal etkisine karşı direnç geliştirebilir. Gümüş bileşikleri cıva bileşikleri gibi vücut tarafından alınır, ancak ikincisinin toksisitesinden yoksundur. Gümüş ve alaşımları kafatası cerrahisinde kemik yerine kullanılır ve gümüş-kalay-cıva amalgamları diş hekimliğinde kullanılır. Ag(NH3)2]F formülüne sahip bir koordinasyon kompleksinin florür tuzu olan gümüş diammin florür, diş çürüklerini (çürükler) tedavi etmek ve önlemek ve dentin aşırı hassasiyetini gidermek için kullanılan topikal bir ilaçtır (ilaç). ⓘ
Elektronik
Gümüş, karardığında bile yüksek elektrik iletkenliği nedeniyle elektronikte iletkenler ve elektrotlar için çok önemlidir. Dökme gümüş ve gümüş folyolar vakum tüplerinin yapımında kullanılmıştır ve günümüzde de yarı iletken cihazların, devrelerin ve bunların bileşenlerinin üretiminde kullanılmaya devam etmektedir. Örneğin, gümüş RF, VHF ve daha yüksek frekanslar için yüksek kaliteli konektörlerde, özellikle de iletkenlerin %6'dan fazla ölçeklendirilemediği boşluk filtreleri gibi ayarlı devrelerde kullanılır. Baskılı devreler ve RFID antenleri gümüş boyalarla yapılır, Toz gümüş ve alaşımları iletken katmanlar ve elektrotlar, seramik kapasitörler ve diğer seramik bileşenler için macun preparatlarında kullanılır. ⓘ
Lehim alaşımları
Gümüş içeren sert lehim alaşımları, çoğunlukla kobalt, nikel ve bakır bazlı alaşımlar, takım çelikleri ve değerli metaller olmak üzere metalik malzemelerin sert lehimlenmesinde kullanılır. Temel bileşenler gümüş ve bakırdır, diğer elementler istenen özel uygulamaya göre seçilir: örnekler arasında çinko, kalay, kadmiyum, paladyum, manganez ve fosfor bulunur. Gümüş, kullanım sırasında daha fazla işlenebilirlik ve korozyon direnci sağlar. ⓘ
Kimyasal ekipman
Gümüş, düşük kimyasal reaktivitesi, yüksek termal iletkenliği ve kolay işlenebilir olması nedeniyle kimyasal ekipman üretiminde kullanışlıdır. Gümüş potalar (metalin kırmızı ısıda yeniden kristalleşmesini önlemek için %0,15 nikel ile alaşımlandırılmıştır) alkalin füzyonu gerçekleştirmek için kullanılır. Flor ile kimya yaparken bakır ve gümüş de kullanılır. Yüksek sıcaklıklarda çalışmak için yapılan ekipman genellikle gümüş kaplamadır. Gümüş ve altın ile alaşımları oksijen kompresörleri ve vakum ekipmanları için tel veya halka conta olarak kullanılır. ⓘ
Kataliz
Gümüş metali oksidasyon reaksiyonları için iyi bir katalizördür; aslında çoğu amaç için biraz fazla iyidir, çünkü ince bölünmüş gümüş organik maddelerin karbondioksit ve suya tam oksidasyonuyla sonuçlanma eğilimindedir ve bu nedenle bunun yerine daha iri taneli gümüş kullanılma eğilimindedir. Örneğin, α-Al2O3 veya silikatlar üzerinde desteklenen %15 gümüş, 230-270 °C'de etilenin etilen okside oksidasyonu için bir katalizördür. Metanolün formaldehite dehidrojenasyonu, izopropanolün asetona dehidrojenasyonu gibi, katalizör olarak gümüş gazlı bez veya kristaller üzerinde 600-720 °C'de gerçekleştirilir. Gaz fazında, glikol glioksal ve etanol asetaldehit verirken, organik aminler nitrillere dehidre edilir. ⓘ
Fotoğrafçılık
Gümüş halojenürlerin ışığa duyarlılığı geleneksel fotoğrafçılıkta kullanılmalarına olanak sağlamıştır, ancak gümüş kullanmayan dijital fotoğrafçılık artık baskındır. Siyah-beyaz fotoğrafçılıkta kullanılan ışığa duyarlı emülsiyon, jelatin içindeki gümüş halojenür kristallerinin bir süspansiyonudur ve muhtemelen daha iyi ışığa duyarlılık, geliştirme ve ayarlama için bazı asil metal bileşiklerle karıştırılmıştır. Renkli fotoğrafçılık özel boya bileşenlerinin ve hassaslaştırıcıların eklenmesini gerektirir, böylece ilk siyah-beyaz gümüş görüntü farklı bir boya bileşeniyle eşleşir. Orijinal gümüş görüntüler ağartılır ve gümüş daha sonra geri kazanılır ve geri dönüştürülür. Gümüş nitrat her durumda başlangıç malzemesidir. ⓘ
Fotoğrafçılıkta gümüş nitrat ve gümüş halojenür kullanımı, dijital teknolojinin ortaya çıkmasıyla birlikte hızla azalmıştır. Fotoğraf gümüşüne yönelik 1999 yılındaki en yüksek küresel talepten (267.000.000 troy ons veya 8.304,6 ton) 2013 yılına gelindiğinde pazar neredeyse %70 oranında daralmıştır. ⓘ
Nanopartiküller
Boyutları 10 ila 100 nanometre arasında değişen nanogümüş parçacıkları birçok uygulamada kullanılmaktadır. Basılı elektronikler için iletken mürekkeplerde kullanılırlar ve mikrometre boyutundaki daha büyük gümüş parçacıklarından çok daha düşük bir erime noktasına sahiptirler. Ayrıca, daha büyük gümüş parçacıklarıyla aynı şekilde antibakteriyel ve antifungallerde tıbbi olarak kullanılırlar. Ayrıca, Avrupa Birliği Nanomalzemeler Gözlemevi'ne (EUON) göre, gümüş nanoparçacıklar hem pigmentlerde hem de kozmetikte kullanılmaktadır. ⓘ
Çeşitli bilgiler

Saf gümüş metali gıda boyası olarak kullanılır. E174 tanımına sahiptir ve Avrupa Birliği'nde onaylanmıştır. Geleneksel Hint ve Pakistan yemekleri bazen vark olarak bilinen dekoratif gümüş folyo içerir ve diğer çeşitli kültürlerde gümüş drajeler kekleri, kurabiyeleri ve diğer tatlıları süslemek için kullanılır. ⓘ
Fotokromik lensler gümüş halojenürler içerir, böylece doğal gün ışığındaki ultraviyole ışık metalik gümüşü serbest bırakarak lensleri koyulaştırır. Gümüş halojenürler daha düşük ışık yoğunluklarında yeniden oluşur. Renksiz gümüş klorür filmler radyasyon dedektörlerinde kullanılır. Ag+ iyonları içeren zeolit elekler, klorürü gümüş klorür olarak çökeltmek için gümüş iyonlarını kullanarak kurtarma çalışmaları sırasında deniz suyunu tuzdan arındırmak için kullanılır. Gümüş ayrıca antibakteriyel özellikleri nedeniyle su dezenfeksiyonu için de kullanılmaktadır, ancak bunun uygulaması gümüş tüketimindeki sınırlamalarla sınırlıdır. Kolloidal gümüş benzer şekilde kapalı yüzme havuzlarını dezenfekte etmek için kullanılır; hipoklorit tedavileri gibi koku yaymama avantajına sahip olsa da, kolloidal gümüş daha kirli açık yüzme havuzları için yeterince etkili değildir. Küçük gümüş iyodür kristalleri yağmur yağdırmak için bulut tohumlamada kullanılır. ⓘ
Önlemler
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Piktogramlar
|

|
Sinyal kelimesi
|
Uyarı |
Tehlike bildirimleri
|
H410 |
Önlem ifadeleri
|
P273, P391, P501 |
| NFPA 704 (yangın elması) | |
Gümüş bileşikleri diğer ağır metallerin çoğuna kıyasla düşük toksisiteye sahiptir, çünkü sindirildiklerinde insan vücudu tarafından zayıf bir şekilde emilirler ve emilenler hızla çözünmeyen gümüş bileşiklerine dönüştürülür veya metallothionein tarafından kompleks haline getirilir. Bununla birlikte, gümüş florür ve gümüş nitrat yakıcıdır ve gastroenterit, ishal, tansiyon düşmesi, kramplar, felç ve solunum durması ile sonuçlanan doku hasarına neden olabilir. Gümüş tuzları ile tekrar tekrar dozlanan hayvanlarda anemi, büyümede yavaşlama, karaciğerde nekroz, karaciğer ve böbreklerde yağlı dejenerasyon görülmüştür; gümüş folyo yerleştirilen veya kolloidal gümüş enjekte edilen sıçanlarda lokalize tümörler geliştiği gözlenmiştir. Parenteral olarak uygulanan kolloidal gümüş akut gümüş zehirlenmesine neden olur. Suda yaşayan bazı türler gümüş tuzlarına ve diğer değerli metallere karşı özellikle hassastır; ancak çoğu durumda gümüş ciddi çevresel tehlikeler oluşturmaz. ⓘ
Yüksek dozlarda, gümüş ve onu içeren bileşikler dolaşım sistemine emilebilir ve çeşitli vücut dokularında birikerek deride, gözlerde ve mukoza zarlarında mavi-grimsi bir pigmentasyonla sonuçlanan arjiriye yol açabilir. Argyria nadir görülür ve bilindiği kadarıyla kişinin sağlığına başka bir şekilde zarar vermez, ancak şekil bozucu ve genellikle kalıcıdır. Argyria'nın hafif formları bazen oksijen eksikliğinden kaynaklanan ciltte mavi bir renk olan siyanoz ile karıştırılır. ⓘ
Metalik gümüş, bakır gibi, eskiler tarafından bilinen ve ilk kez Carl Nägeli tarafından bilimsel olarak araştırılan ve oligodinamik etki olarak adlandırılan antibakteriyel bir maddedir. Gümüş iyonları, litre başına 0,01-0,1 miligram gibi düşük konsantrasyonlarda bile bakterilerin metabolizmasına zarar verir; metalik gümüş, gümüş oksit oluşumu nedeniyle benzer bir etkiye sahiptir. Bu etki, gümüş sülfürün aşırı çözünmezliği nedeniyle sülfür varlığında kaybolur. ⓘ
Azot bileşikleri gümüş azid, gümüş amid ve gümüş fulminatın yanı sıra gümüş asetilid, gümüş oksalat ve gümüş (II) oksit gibi bazı gümüş bileşikleri çok patlayıcıdır. Isıtıldığında, zorlandığında, kurutulduğunda, aydınlatıldığında veya bazen kendiliğinden patlayabilirler. Bu tür bileşiklerin oluşumunu önlemek için amonyak ve asetilen gümüş ekipmanlardan uzak tutulmalıdır. Gümüş klorat ve gümüş nitrat gibi güçlü oksitleyici asitlere sahip gümüş tuzları, organik bileşikler, sülfür ve kurum gibi kolayca oksitlenebilen malzemelerle temas ettiğinde patlayabilir. ⓘ
Ayrıca bakınız
- Gümüş para
- Gümüş madalya
- Ücretsiz gümüş
- Gümüş üretimine göre ülkelerin listesi
- Gümüş bileşiklerinin listesi
- Bir yatırım olarak gümüş
- Silverpoint çizim ⓘ
Yukarıda kullanılan kaynaklar
- Greenwood, Norman N.; Earnshaw, Alan (1997). Elementlerin Kimyası (2. baskı). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Elementlerin Keşfi. Easton, PA: Journal of Chemical Education. ISBN 978-0-7661-3872-8. LCCN 68-15217.
- Andreas Brumby, Peter Braumann, Klaus Zimmermann, Francis Van Den Broeck, Thierry Vandevelde, Dan Goia, Hermann Renner, Günther Schlamp, Klaus Zimmermann, Wolfgang Weise, Peter Tews, Klaus Dermann, Alfons Knödler, Karl-Heinz Schröder, Bernd Kempf, Hans Martin Lüschow, Cartrin Peter, Rainer Schiele. "Gümüş, Gümüş Bileşikleri ve Gümüş Alaşımları". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_107.pub2.: CS1 maint: uses authors parameter (link) ⓘ
Bulunuşu
Çok eskiden gümüş, dünyanın birçok yerlerinde az miktarda bulunan doğal gümüş kaynaklarından elde ediliyordu. Doğal gümüş; saf veya daha çok altın, bakır, cıva ve diğer metallerle alaşımlar halinde bulunuyordu. Norveç’te, Güney Peru’da, Colorado’da kazılarda işlenmiş büyük külçeler bulunmuştur. İspanya’da 1860’ta sekiz tonluk bir külçe çıkartılmıştır. Gümüş, daha çok yer kabuğuna dağılmış bileşikler halinde bulunur. En çok rastlanan gümüş filizleri; argentit (Ag2S) ve gümüş klorür (AgCl) olmaktadır. Arsenik veya antimonla karışmış sülfür filizleri de vardır. ⓘ
Özellikleri

Gümüş, ışığı çok iyi yansıtan, dövülebilen, sünek bir metaldir. Bir gram gümüşten 2 km uzunluğunda ince tel çekilebilir. Elektrik sistemde küp ve altıgen olarak kristallenir. Koordinasyon sayısı altı olduğu hallerde, yaklaşık atom çapı 1,444 angström değerini alır. ⓘ
Atmosferde oksitlenmeye karşı büyük bir mukavemet gösterir. Bakırdan daha zor, altından ise daha kolay oksitlenir. Standart elektrot potansiyeli 0,7978 V dur. Asitlere ve birkaç organik maddeye karşı dayanıklıdır. Fakat nitrik asit ve derişik sıcak sülfürik asitte kolayca eritilir. Ayrıca kükürt ve birçok kükürt bileşikleriyle hemen birleşir. Gümüş eşya üzerindeki kararmanın sebebi, havadaki hidrojen sülfür ve yumurta gibi bazı yiyeceklerde bulunan kükürttür. ⓘ
Periyodik tabloda ağır metaller grubu içinde yer alan gümüşün, çoğu özellikleri bakırın özelliklerine benzemekle beraber bakır, çoğu bileşiklerinde iki değerlikli olması ile gümüşten farklıdır. ⓘ
Alaşımları

Saf gümüş kolay paslanmaz. Elektrik ve ısıyı çok iyi iletir. Fakat, çok yumuşak olup, mekanik kuvvete karşı direnci azdır. Ayrıca atmosferde parlaklığını kaybederek donuklaşır. Bu sebepten daha sert diğer metallerle alaşımları halinde kullanılır. ⓘ
Gümüşün kadmiyum ve çinko ile yaptığı alaşımlar, parlaklığını çok daha yavaş kaybeder. Buna antimon ve kalay ilave edilirse, bu parlaklık ve dayanıklılık daha da artar. Gümüşün diğer metallerle yaptığı daha birçok alaşımları vardır. Bunlar endüstride saf gümüşten çok daha fazla kullanılır,çok pahalı olması bunun en büyük nedenlerindendir. ⓘ
Kullanıldığı yerler
Gümüş’ ün kullanıldığı alanları sıralayacak olursak; fotoğraf sanayii, elektronik, para imali, süs eşyası ve takı yapımı ,alaşımlar, dişçilik ‘tir. Ayrıca, yapay yağmur yağdırmakta, ayna sırlarının yapımında, bilgisayar röle kontaklarında, pil yapımında da kullanılmaktadır.Gümüş elektriği çok iyi geçirdiğinden ve kolayca tel haline geldiğinden, elektrik teli olarak kullanılmaktaydı. Fakat nadir bulunması ve kıymeti dolayısıyla, artık bu amaçla kullanılmamaktadır. Bugün daha ziyade süs eşyası üretiminde, ayna yapımında, fotoğrafçılıkta, bazı ilaçlar ve alaşımların hazırlanmasında kullanılır. Bazı gümüş paralar, %90 gümüş, %10 bakır alaşımından yapılmıştır. Gümüş eşyada (%92,5 gümüş + %7,5 bakır) kullanılır. ⓘ
Saf gümüş, aynı zamanda asetik asit, boyalar ve fotoğraf maddeleri elde etmede de kullanılır. Keza toz halinde gümüş, cam ve ahşabı elektrik iletkeni yapmak için yeni seramik tipi kaplama işlerinde kullanılmaktadır. ⓘ
Gümüş zeolitler, acil durumlarda, deniz suyundan içilebilir su elde etmek için kullanılabilmektedir. ⓘ
Gümüş kaplama
Gümüş kaplanacak parçalar, anodu gümüş olan elektrolitik banyoda katoda bağlanırlar. Banyodaki elektrolit, sodyum arjantisiyanür, NaAg(CN)2 veya benzeri bir kompleks gümüş tuzudur. Bu tür elektrolitler diğerlerine, mesela gümüş nitrata (AgNO3) göre kaplanacak yüzeyin daha düzgün kaplanmasını sağlarlar. ⓘ
Gümüş eşya nasıl temizlenir
Gümüş eşya yüzeyinde kararma meydana getiren gümüş sülfür (Ag2S), çoğu kez bir aşındırıcı toz kullanılarak temizlenir. Bu yöntemle yüzeyden gümüş aşınması, gümüş ve gümüş alaşımı eşya için pek zararlı görülmemekle birlikte, özellikle gümüş kaplamalar için uygun değildir. Temizleme, kimyasal yoldan basitleştirilerek: 3Ag2S + 2Al → Al2S3 + 6Ag ⓘ
şeklinde ifade edilebilen bir seri tepkimeden istifade edilerek gerçekleştirilebilmektedir. Bunun için şöyle hareket edilir: Suyun bir litresine bir yemek kaşığı çamaşır sodası ve bir kaşık sofra tuzu katılarak, emaye bir kap içinde hazırlanmış çözelti, kaynar sıcaklığa getirilir. Kabın dibine alüminyum bir tabak konulur. Bunun üzerine her tarafının çözelti içinde kalmasına dikkat edilerek gümüş eşya yerleştirilir. Üç dakika kaynatılır. Sonra gümüşler sıcak suda durulanır. Gümüşler temiz ve parlak hale gelir. Burada elektro-kimyasal bir reaksiyon meydana gelmekte, soda-tuz çözeltisi elektrolit görevi yapmaktadır. ⓘ
bir kap içerisine 5 ltre su ve 5 gram siyanür konulur kaynama noktasına gelince içine temizlenecek gümüş konur 20 saniyede istenilen parlaklık elde edilir ⓘ



















