Hemoglobin
| Hemoglobin ⓘ | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (heterotetramer, (αβ)2) | |||||||||||||
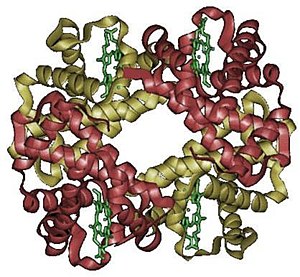
 İnsan hemoglobininin yapısı. α ve β alt birimleri sırasıyla kırmızı ve mavi, demir içeren hem grupları ise yeşil renktedir. PDB'den: 1GZX Proteopedia Hemoglobin | |||||||||||||
| Protein türü | metalloprotein, globulin | ||||||||||||
| Fonksiyon | oksi̇jen taşimaciliği | ||||||||||||
| Kofaktör(ler) | heme (4) | ||||||||||||
| |||||||||||||
Hemoglobin (hemoglobin BrE) (Yunanca αἷμα, haîma 'kan' + Latince globus 'top, küre' + -in sözcüğünden) (/ˌhiːməˈɡloʊbɪn, ˈhɛmoʊˌ-/), Hb veya Hgb olarak kısaltılır, neredeyse tüm omurgalıların (Channichthyidae balık ailesi istisnadır) kırmızı kan hücrelerinde (eritrositler) ve bazı omurgasızların dokularında bulunan demir içeren oksijen taşıma metaloproteinidir. Kandaki hemoglobin oksijeni solunum organlarından (örneğin akciğerler veya solungaçlar) vücudun geri kalanına (yani dokulara) taşır. Burada, metabolizma adı verilen süreçte bir organizmanın işlevlerini yerine getirmek için enerji sağlamak üzere aerobik solunuma izin vermek üzere oksijeni serbest bırakır. Sağlıklı bir insanda her 100 mL kanda 12 ila 20 gram hemoglobin bulunur. ⓘ
Memelilerde kromoprotein, kırmızı kan hücrelerinin kuru içeriğinin (ağırlık olarak) yaklaşık %96'sını ve toplam içeriğin (su dahil) yaklaşık %35'ini oluşturur. Hemoglobin, gram başına 1,34 mL O2 oksijen bağlama kapasitesine sahiptir ve bu da kandaki toplam oksijen kapasitesini kandaki çözünmüş oksijene kıyasla yetmiş kat artırır. Memeli hemoglobin molekülü dört oksijen molekülüne kadar bağlanabilir (taşıyabilir). ⓘ
Hemoglobin diğer gazların taşınmasında da rol oynar: Vücudun solunum yoluyla aldığı karbondioksitin bir kısmını (toplamın yaklaşık %20-25'i), CO2'nin hem proteinine bağlı olduğu karbaminohemoglobin olarak taşır. Molekül ayrıca globin proteinindeki bir tiyol grubuna bağlı önemli düzenleyici molekül nitrik oksidi de taşır ve oksijenle aynı anda serbest bırakır. ⓘ
Hemoglobin ayrıca kırmızı kan hücrelerinin ve onların progenitör hatlarının dışında da bulunur. Hemoglobin içeren diğer hücreler arasında substantia nigra'daki A9 dopaminerjik nöronlar, makrofajlar, alveolar hücreler, akciğerler, retina pigment epiteli, hepatositler, böbrekteki mezangial hücreler, endometrial hücreler, servikal hücreler ve vajinal epitel hücreleri yer alır. Bu dokularda hemoglobin, bir antioksidan ve demir metabolizmasının düzenleyicisi olarak oksijen taşımayan bir işleve sahiptir. Kişinin kanındaki aşırı glikoz hemoglobine bağlanabilir ve hemoglobin A1c seviyesini yükseltebilir. ⓘ
Hemoglobin ve hemoglobin benzeri moleküller birçok omurgasızda, mantarda ve bitkide de bulunur. Bu organizmalarda hemoglobinler oksijen taşıyabilir veya karbondioksit, nitrik oksit, hidrojen sülfür ve sülfür gibi diğer küçük molekülleri ve iyonları taşımak ve düzenlemek için hareket edebilirler. Leghemoglobin adı verilen molekülün bir çeşidi, oksijenin sistemi zehirlememesi (devre dışı bırakmaması) için baklagil bitkilerinin azot bağlayıcı nodülleri gibi anaerobik sistemlerden oksijeni uzaklaştırmak için kullanılır. ⓘ
Hemoglobinemi, kan plazmasında fazla miktarda hemoglobin bulunduğu tıbbi bir durumdur. Bu, hemoglobinin kırmızı kan hücrelerinden ayrıldığı intravasküler hemolizin bir etkisidir, bir anemi şeklidir. ⓘ
Hemoglobin, solunum organından dokulara oksijen, dokulardan solunum organına ise karbondioksit ve proton taşıyan protein. Eritrositlerin içerisinde bulunur. Oksijeni +2 değerlikli demir içeren hem molekülleri ile bağlar. Başlıca sentez yeri eritrosit üretimi sırasında kemik iliğidir. Yaş, cinsiyet ve türe göre küçük farklılıklarla da olsa kanda belli bir değerin altında bulunmasına Anemi, yüksek miktarda bulunmasına ise polisitemi denir. Hemoglobinin prostetik grubu hem, proteiniyse globulindir. ⓘ

Araştırma geçmişi

1825 yılında Johann Friedrich Engelhart, demirin proteine oranının çeşitli türlerin hemoglobinlerinde aynı olduğunu keşfetti. Demirin bilinen atomik kütlesinden hemoglobinin moleküler kütlesini n × 16000 olarak hesapladı (n = hemoglobin başına demir atomu sayısı, şimdi 4 olarak biliniyor), bu bir proteinin moleküler kütlesinin ilk belirlenmesiydi. Bu "aceleci sonuç", o dönemde herhangi bir molekülün bu kadar büyük olabileceğine inanamayan bilim insanlarının alay konusu oldu. Gilbert Smithson Adair, 1925 yılında hemoglobin çözeltilerinin ozmotik basıncını ölçerek Engelhart'ın sonuçlarını doğruladı. ⓘ
Kanın oksijen taşıdığı en az 1794 yılından beri bilinmesine rağmen, hemoglobinin oksijen taşıma özelliği 1840 yılında Hünefeld tarafından tanımlanmıştır. 1851 yılında Alman fizyolog Otto Funke, kırmızı kan hücrelerini saf su, alkol veya eter gibi bir çözücü ile ardışık olarak seyrelterek hemoglobin kristallerinin büyütülmesini ve ardından elde edilen protein çözeltisinden çözücünün yavaşça buharlaştırılmasını tarif ettiği bir dizi makale yayınladı. Hemoglobinin tersinir oksijenlenmesi birkaç yıl sonra Felix Hoppe-Seyler tarafından tanımlanmıştır. ⓘ
X-ışını kristalografisinin gelişmesiyle birlikte protein yapılarını dizilemek mümkün hale geldi. Max Perutz 1959 yılında hemoglobinin moleküler yapısını belirledi. Bu çalışmasıyla 1962 Nobel Kimya Ödülü'nü, küresel protein miyoglobini dizileyen John Kendrew ile paylaştı. ⓘ
Hemoglobinin kandaki rolü Fransız fizyolog Claude Bernard tarafından aydınlatılmıştır. Hemoglobin adı, hem ve globin kelimelerinden türetilmiştir ve hemoglobinin her bir alt biriminin gömülü bir hem grubuna sahip küresel bir protein olduğu gerçeğini yansıtmaktadır. Her bir heme grubu, iyon kaynaklı dipol kuvvetleri aracılığıyla bir oksijen molekülünü bağlayabilen bir demir atomu içerir. Memelilerdeki en yaygın hemoglobin türü bu tür dört alt birim içerir. ⓘ
Genetik
Hemoglobin protein alt birimlerinden (globin molekülleri) oluşur ve bu proteinler de polipeptit adı verilen çok sayıda farklı amino asitten oluşan katlanmış zincirlerdir. Bir hücre tarafından oluşturulan herhangi bir polipeptidin amino asit dizisi, gen adı verilen DNA uzantıları tarafından belirlenir. Tüm proteinlerde, proteinin kimyasal özelliklerini ve işlevini belirleyen amino asit dizisidir. ⓘ
Birden fazla hemoglobin geni vardır: insanlarda hemoglobin A (yetişkinlerde bulunan hemoglobinin ana formu) HBA1, HBA2 ve HBB genleri tarafından kodlanır. Hemoglobin alt birimi alfa 1 ve alfa 2, her ikisi de kromozom 16 üzerinde bulunan ve birbirine yakın olan sırasıyla HBA1 ve HBA2 genleri tarafından kodlanır. Hemoglobin alt birimi beta, kromozom 11 üzerinde bulunan HBB geni tarafından kodlanır. Hemoglobinlerdeki globin proteinlerinin amino asit dizileri genellikle türler arasında farklılık gösterir. Bu farklılıklar türler arasındaki evrimsel mesafe ile artar. Örneğin, insanlarda, bonobolarda ve şempanzelerde en yaygın hemoglobin dizileri tamamen aynıdır, ne alfa ne de beta globin protein zincirlerinde tek bir amino asit farkı bile yoktur. İnsan ve goril hemoglobini hem alfa hem de beta zincirlerinde bir amino asit farklılık gösterirken, bu farklılıklar daha az yakın akraba türler arasında daha da büyür. ⓘ
Türler içinde bile, her türde genellikle "en yaygın" olan bir dizilim olmasına rağmen, hemoglobin varyantları mevcuttur. Bir türdeki hemoglobin proteini genlerindeki mutasyonlar hemoglobin varyantları ile sonuçlanır. Bu mutant hemoglobin formlarının çoğu hiçbir hastalığa neden olmaz. Ancak bu mutant hemoglobin formlarından bazıları, hemoglobinopatiler olarak adlandırılan bir grup kalıtsal hastalığa neden olur. En iyi bilinen hemoglobinopati, mekanizması moleküler düzeyde anlaşılan ilk insan hastalığı olan orak hücre hastalığıdır. Talasemiler olarak adlandırılan (çoğunlukla) ayrı bir hastalık grubu, globin gen regülasyonundaki sorunlar ve mutasyonlar yoluyla normal ve bazen anormal hemoglobinlerin yetersiz üretimini içerir. Tüm bu hastalıklar anemi üretir. ⓘ

Hemoglobin amino asit dizilerindeki varyasyonlar, diğer proteinlerde olduğu gibi, adaptif olabilir. Örneğin, hemoglobinin yüksek rakımlara farklı şekillerde uyum sağladığı bulunmuştur. Yüksek rakımlarda yaşayan organizmalar, deniz seviyesindekilere kıyasla daha düşük kısmi oksijen basıncına maruz kalırlar. Bu, bu tür ortamlarda yaşayan organizmalar için bir zorluk teşkil eder çünkü normalde yüksek kısmi oksijen basınçlarında oksijeni bağlayan hemoglobin, daha düşük bir basınçta mevcut olduğunda oksijeni bağlayabilmelidir. Farklı organizmalar böyle bir zorluğa adapte olmuşlardır. Örneğin, son çalışmalar geyik farelerinde, dağlarda yaşayan geyik farelerinin yüksek rakımlara eşlik eden ince havada nasıl hayatta kalabildiklerini açıklamaya yardımcı olan genetik varyantlar öne sürmüştür. Nebraska-Lincoln Üniversitesi'nden bir araştırmacı, dört farklı gende, ova çayırlarında ve dağlarda yaşayan geyik fareleri arasındaki farklılıkları açıklayabilecek mutasyonlar buldu. Hem dağlık hem de ovalık bölgelerden yakalanan yabani farelerin incelenmesinin ardından, iki ırkın genlerinin "hemoglobinlerinin oksijen taşıma kapasitesini yönetenler dışında neredeyse aynı olduğu" tespit edildi. "Genetik farklılık, dağlık bölge farelerinin oksijenlerini daha verimli kullanmalarını sağlıyor", çünkü dağlar gibi daha yüksek rakımlarda daha az oksijen mevcut. Mamut hemoglobini, daha düşük sıcaklıklarda oksijen iletimine izin veren mutasyonlara sahipti, böylece mamutların Pleistosen sırasında daha yüksek enlemlere göç etmelerini sağladı. Bu durum And Dağları'nda yaşayan sinek kuşlarında da görülmüştür. Sinek kuşları zaten çok fazla enerji harcarlar ve bu nedenle yüksek oksijen talepleri vardır ve yine de And sinek kuşlarının yüksek rakımlarda geliştiği bulunmuştur. Yüksek rakımlarda yaşayan birçok türün (Oreotrochilus, A. castelnaudii, C. violifer, P. gigas ve A. viridicuada) hemoglobin genindeki eşanlamlı olmayan mutasyonlar, proteinin kuşlarda bulunan ve insanlarda 2,3-BPG ile benzer bir role sahip bir molekül olan inositol heksafosfata (IHP) daha az yakınlık duymasına neden olmuştur; bu da daha düşük kısmi basınçlarda oksijen bağlama yeteneği ile sonuçlanır. ⓘ
Kuşların benzersiz dolaşım akciğerleri de O2'nin düşük kısmi basınçlarında oksijenin verimli kullanımını teşvik eder. Bu iki adaptasyon birbirini güçlendirir ve kuşların olağanüstü yüksek irtifa performansını açıklar. ⓘ
Hemoglobin adaptasyonu insanlara da uzanmaktadır. Yüksek oksijen doygunluğu genotipine sahip olan ve 4.000 metrede yaşayan Tibetli kadınlar arasında yavruların hayatta kalma oranı daha yüksektir. Doğal seçilim bu gen üzerinde çalışan ana güç gibi görünmektedir çünkü hemoglobin-oksijen yakınlığı yüksek olan kadınların yavrularının ölüm oranı, hemoglobin-oksijen yakınlığı düşük olan kadınların yavrularının ölüm oranına kıyasla önemli ölçüde daha düşüktür. Bunun tam olarak hangi genotip ve mekanizma ile gerçekleştiği henüz net olmasa da, seçilim bu kadınların düşük kısmi basınçlarda oksijen bağlama kabiliyetleri üzerinde etkili oluyor ve bu da genel olarak önemli metabolik süreçleri daha iyi sürdürmelerini sağlıyor. ⓘ
Sentezi

Vücutta her gün yıkıma uğrayan hemoglobin miktarını yerine koymak üzere yaklaşık 5-6 gram kadar hemoglobin sentez edilir. Hemoglobin sentezi hücrenin mitokondri ve sitoplazmasında olur. Hemoglobin sentezi için protoporfirin IX, Fe2+ ve globuline ihtiyaç vardır. Pantotenik asit, piridoksal fosfat, B12 vitamini ve intrinsik faktör bu sentez için gereklidir. Proeritroblastlar hemoglobin sentezinin önemli kısmını gerçekleştirirler; retikülositte hemoglobin sentez etme oldukça düşmüştür. Olgun Eritrositler, hemoglobin sentez edemezler. Hemoglobin sentezi için protoporfirin IX endojen olarak vücutta sentez edilir. Eğer organizmaya protoporfirin şırınga edilirse veya besinlerle eksojen olarak verilirse organizma bundan yararlanamaz. Dışkı ve idrarla dışarı atar. Hemoglobin retiküloendeteryal sistemin ribozomlarında sentez edilir. ⓘ
Hemoglobin (Hb) karmaşık bir dizi adımda sentezlenir. Hem kısmı mitokondri ve olgunlaşmamış kırmızı kan hücrelerinin sitozolünde bir dizi adımda sentezlenirken, globin protein kısımları sitozoldeki ribozomlar tarafından sentezlenir. Hb üretimi, proeritroblasttan kemik iliğindeki retikülosite kadar erken gelişimi boyunca hücre içinde devam eder. Bu noktada, memeli kırmızı kan hücrelerinde çekirdek kaybolur, ancak kuşlarda ve diğer birçok türde kaybolmaz. Memelilerde çekirdeğin kaybından sonra bile, kalan ribozomal RNA, retikülosit damar sistemine girdikten kısa bir süre sonra RNA'sını kaybedene kadar Hb'nin daha fazla sentezlenmesine izin verir (bu hemoglobin-sentetik RNA aslında retikülosite ağsı görünümünü ve adını verir). ⓘ
Hem'in yapısı

Hemoglobin, birçok çok alt birimli globüler proteinin karakteristik dördüncül yapısına sahiptir. Hemoglobindeki amino asitlerin çoğu alfa heliksler oluşturur ve bu heliksler kısa sarmal olmayan bölümlerle birbirine bağlanır. Hidrojen bağları bu proteinin içindeki sarmal bölümleri stabilize ederek molekül içinde çekime neden olur ve bu da her bir polipeptit zincirinin belirli bir şekle katlanmasına neden olur. Hemoglobinin kuaterner yapısı, kabaca dört yüzlü bir düzenlemeye sahip dört alt biriminden gelir. ⓘ
Omurgalıların çoğunda hemoglobin molekülü dört küresel protein alt biriminin bir araya gelmesinden oluşur. Her bir alt birim, protein olmayan prostetik bir hem grubu ile sıkıca bağlanmış bir protein zincirinden oluşur. Her bir protein zinciri, globin kıvrımı düzeninde birbirine bağlanmış bir dizi alfa sarmal yapısal segment halinde düzenlenir. Böyle bir isim verilmiştir çünkü bu düzenleme miyoglobin gibi diğer hem/globin proteinlerinde kullanılan aynı katlanma motifidir. Bu katlanma modeli, hem grubunu güçlü bir şekilde bağlayan bir cep içerir. ⓘ
Bir hem grubu, porfirin olarak bilinen heterosiklik bir halkada tutulan bir demir (Fe) iyonundan oluşur. Bu porfirin halkası, merkezde bağlı demir iyonu ile döngüsel olarak birbirine bağlanmış (metin köprüleri ile) dört pirol molekülünden oluşur. Oksijenin bağlandığı yer olan demir iyonu, halkanın merkezinde bulunan ve hepsi bir düzlemde yer alan dört azot atomu ile koordinasyon halindedir. Hem, porfirin halkasının altındaki F8 histidin kalıntısının (proksimal histidin olarak da bilinir) imidazol halkasının N atomları aracılığıyla globüler proteine güçlü bir şekilde (kovalent olarak) bağlanır. Altıncı bir pozisyon, altı liganddan oluşan oktahedral grubu tamamlayan bir koordinat kovalent bağ ile oksijeni tersine çevrilebilir şekilde bağlayabilir. Oksijenle kurulan bu tersinir bağ, hemoglobinin oksijeni vücutta taşımak için bu kadar faydalı olmasının nedenidir. Oksijen, bir oksijen atomunun Fe'ye bağlandığı ve diğerinin bir açıyla çıkıntı yaptığı "uçtan uca bükülmüş" bir geometride bağlanır. Oksijen bağlanmadığında, çok zayıf bağlanmış bir su molekülü alanı doldurarak çarpık bir oktahedron oluşturur. ⓘ
Karbondioksit hemoglobin tarafından taşınsa da, demir bağlama pozisyonları için oksijenle rekabet etmez, ancak hem gruplarına bağlı protein zincirlerinin amin gruplarına bağlanır. ⓘ
Demir iyonu ya ferröz Fe2+ ya da ferrik Fe3+ durumunda olabilir, ancak ferrihemoglobin (methemoglobin) (Fe3+) oksijen bağlayamaz. Bağlanma sırasında oksijen geçici ve geri dönüşümlü olarak (Fe2+)'yi (Fe3+)'e oksitlerken, oksijen geçici olarak süperoksit iyonuna dönüşür, bu nedenle oksijeni bağlamak için demirin +2 oksidasyon durumunda bulunması gerekir. Fe3+ ile ilişkili süperoksit iyonu protonlanırsa, hemoglobin demiri oksitlenmiş olarak kalır ve oksijeni bağlayamaz. Bu gibi durumlarda, methemoglobin redüktaz enzimi demir merkezini indirgeyerek methemoglobini yeniden aktive edebilecektir. ⓘ
Yetişkin insanlarda en yaygın hemoglobin tipi, hemoglobin A adı verilen ve her biri sırasıyla 141 ve 146 amino asit kalıntısından oluşan iki α ve iki β alt biriminden oluşan bir tetramerdir (dört alt birim proteini içerir). Bu α2β2 olarak gösterilir. Alt birimler yapısal olarak benzerdir ve yaklaşık aynı boyuttadır. Her bir alt birimin moleküler ağırlığı yaklaşık 16.000 dalton, tetramerin toplam moleküler ağırlığı ise yaklaşık 64.000 dalton (64.458 g/mol)'dur. Dolayısıyla, 1 g/dL = 0,1551 mmol/L'dir. Hemoglobin A, hemoglobin molekülleri arasında en yoğun çalışılanıdır. ⓘ
İnsan bebeklerinde hemoglobin molekülü 2 α zinciri ve 2 γ zincirinden oluşur. Bebek büyüdükçe γ zincirlerinin yerini yavaş yavaş β zincirleri alır. ⓘ
Dört polipeptit zinciri birbirlerine tuz köprüleri, hidrojen bağları ve hidrofobik etki ile bağlanır. ⓘ
Oksijen doygunluğu
Genel olarak hemoglobin oksijen molekülleri ile doymuş (oksihemoglobin) veya oksijen molekülleri ile doymamış (deoksihemoglobin) olabilir. ⓘ
Oksihemoglobin
Oksihemoglobin, fizyolojik solunum sırasında oksijenin kırmızı kan hücrelerindeki protein hemoglobinin heme bileşenine bağlanmasıyla oluşur. Bu süreç akciğerlerin alveollerine bitişik pulmoner kılcal damarlarda gerçekleşir. Oksijen daha sonra oksidatif fosforilasyon süreci ile ATP üretiminde terminal elektron alıcısı olarak kullanılacağı hücrelere bırakılmak üzere kan akışı boyunca ilerler. Bununla birlikte, kan pH'ındaki düşüşü önlemeye yardımcı olmaz. Havalandırma ya da nefes alma, karbondioksiti uzaklaştırarak bu durumu tersine çevirebilir ve böylece pH'da bir artışa neden olabilir. ⓘ
Hemoglobin iki şekilde bulunur: gergin (taut) form (T) ve gevşemiş form (R). Dokular düzeyinde düşük pH, yüksek CO2 ve yüksek 2,3 BPG gibi çeşitli faktörler, düşük oksijen afinitesine sahip olan ve dokularda oksijeni serbest bırakan gergin formu tercih eder. Tersine, yüksek pH, düşük CO2 veya düşük 2,3 BPG, oksijeni daha iyi bağlayabilen gevşemiş formu destekler. Sistemin kısmi basıncı da O2 afinitesini etkiler; yüksek oksijen kısmi basınçlarında (alveollerde bulunanlar gibi), gevşemiş (yüksek afiniteli, R) durum tercih edilir. Tersine, düşük kısmi basınçlarda (solunum yapan dokularda bulunanlar gibi), (düşük afinite, T) gergin durum tercih edilir. Ayrıca, oksijenin demir(II) heme bağlanması demiri porfirin halkasının düzlemine çekerek hafif bir konformasyonel kaymaya neden olur. Bu kayma, oksijeni hemoglobin içinde kalan üç hem birimine bağlanmaya teşvik eder (böylece oksijen bağlanması kooperatiftir). ⓘ
Deoksijenlenmiş hemoglobin
Deoksijenlenmiş hemoglobin (deoksihemoglobin), hemoglobinin bağlı oksijen içermeyen formudur. Oksihemoglobin ve deoksihemoglobinin absorpsiyon spektrumları farklıdır. Oksihemoglobin 660 nm dalga boyunda deoksihemoglobinden önemli ölçüde daha düşük absorpsiyona sahipken, 940 nm'de absorpsiyonu biraz daha yüksektir. Bu fark, nabız oksimetresi adı verilen bir aletle hastanın kanındaki oksijen miktarının ölçülmesinde kullanılır. Bu fark aynı zamanda hipoksi sırasında dokuların maviden morumsu renge dönüştüğü siyanozun ortaya çıkışını da açıklar. ⓘ
Deoksijenlenmiş hemoglobin paramanyetiktir; manyetik alanlara zayıf bir şekilde çekilir. Buna karşılık, oksijenli hemoglobin manyetik alandan zayıf bir itme kuvveti olan diyamanyetizma sergiler. ⓘ
Omurgalı hemoglobinin evrimi
Bilim insanları, miyoglobini hemoglobinden ayıran olayın, lampreylerin çeneli omurgalılardan ayrılmasından sonra meydana geldiği konusunda hemfikirdir. Miyoglobin ve hemoglobinin bu şekilde ayrılması, iki molekülün farklı işlevlerinin ortaya çıkmasına ve gelişmesine olanak sağlamıştır: miyoglobin daha çok oksijen depolanmasıyla ilgiliyken, hemoglobin oksijen taşıma görevini üstlenmiştir. α- ve β-benzeri globin genleri, proteinin bireysel alt birimlerini kodlar. Bu genlerin öncülleri, yaklaşık 450-500 milyon yıl önce çenesiz balıklardan türeyen gnathosome ortak atasından sonra başka bir duplikasyon olayıyla ortaya çıkmıştır. Atasal yeniden yapılandırma çalışmaları, α ve β genlerinin duplikasyon öncesi atasının aynı globin alt birimlerinden oluşan bir dimer olduğunu ve duplikasyondan sonra tetramerik bir mimaride birleşecek şekilde evrimleştiğini göstermektedir. α ve β genlerinin gelişimi, hemoglobinin oksijen taşıma kabiliyetinin merkezinde yer alan fiziksel bir bileşim olan hemoglobinin birden fazla farklı alt birimden oluşma potansiyelini yaratmıştır. Birden fazla alt birime sahip olmak, hemoglobinin oksijeni işbirliği içinde bağlayabilmesine ve allosterik olarak düzenlenebilmesine katkıda bulunur. Daha sonra α geni de HBA1 ve HBA2 genlerini oluşturmak üzere bir duplikasyon olayına uğramıştır. Bu başka duplikasyonlar ve farklılıklar, gelişimin farklı aşamalarında belirli formların ortaya çıkmasını sağlayacak şekilde düzenlenen çeşitli α ve β benzeri globin genleri yaratmıştır. ⓘ
Channichthyidae familyasındaki buz balıklarının çoğu, soğuk suya adaptasyon olarak hemoglobin genlerini kaybetmiştir. ⓘ
Oksihemoglobinde demirin oksidasyon durumu
Oksijenli hemoglobinin oksidasyon durumunu belirlemek zordur çünkü deneysel ölçümlere göre oksihemoglobin (Hb-O2) diyamanyetiktir (net eşleşmemiş elektron yoktur), ancak hem oksijen hem de demirdeki en düşük enerjili (temel durum) elektron konfigürasyonları paramanyetiktir (komplekste en az bir eşleşmemiş elektron olduğunu gösterir). Oksijenin en düşük enerjili formu ve demirin ilgili oksidasyon durumlarının en düşük enerjili formları bunlardır:
- En düşük enerjili moleküler oksijen türü olan triplet oksijenin, π* moleküler orbitallerinde eşleşmemiş iki elektronu vardır.
- Demir(II), dört eşleşmemiş elektron ile yüksek spinli 3d6 konfigürasyonunda var olma eğilimindedir.
- Demir(III) (3d5) tek sayıda elektrona sahiptir ve bu nedenle herhangi bir enerji durumunda bir veya daha fazla eşleşmemiş elektrona sahip olmalıdır. ⓘ
Tüm bu yapılar paramanyetiktir (eşleşmemiş elektronlara sahiptir), diyamanyetik değildir. Dolayısıyla, gözlemlenen diyamanyetizmi ve eşleşmemiş elektronları açıklamak için demir ve oksijen kombinasyonunda sezgisel olmayan (örneğin, en az bir tür için daha yüksek enerjili) bir elektron dağılımı mevcut olmalıdır. ⓘ
Diyamanyetik (net spin yok) Hb-O2 üretmek için iki mantıksal olasılık şunlardır:
- Düşük spinli Fe2+ singlet oksijene bağlanır. Hem düşük spinli demir hem de tekli oksijen diyamanyetiktir. Ancak, oksijenin singlet formu molekülün daha yüksek enerjili formudur.
- Düşük spinli Fe3+, O2--'ye (süperoksit iyonu) bağlanır ve iki eşleşmemiş elektron antiferromanyetik olarak birleşerek gözlenen diyamanyetik özellikleri verir. Burada demir oksitlenmiş (bir elektron kaybetmiş) ve oksijen indirgenmiştir (bir elektron kazanmıştır). ⓘ
Düşük spinli Fe4+ 'ün peroksit, O22-'ye bağlandığı bir başka olası model, demir paramanyetik olduğu için (peroksit iyonu diyamanyetik olmasına rağmen) kendi başına göz ardı edilebilir. Burada demir iki elektronla oksitlenmiş ve oksijen iki elektronla indirgenmiştir. ⓘ
Doğrudan deneysel veriler:
- X-ışını fotoelektron spektroskopisi demirin yaklaşık 3.2 oksidasyon durumuna sahip olduğunu göstermektedir.
- O-O bağının kızılötesi titreşim frekansları, süperoksit ile uyumlu bir bağ uzunluğuna işaret etmektedir (yaklaşık 1,6'lık bir bağ mertebesi, süperoksit ise 1,5'tir).
- Demir K-kenarında Kenar Yapılarına Yakın X-ışını Absorpsiyonu. Deoksihemoglobin ve oksihemoglobin arasındaki 5 eV'luk enerji kayması, tüm methemoglobin türlerinde olduğu gibi, Fe3+'e Fe2+'den daha yakın gerçek bir yerel yükü güçlü bir şekilde göstermektedir.
Dolayısıyla, Hb-O2'deki demirin en yakın resmi oksidasyon durumu +3 durumudur ve oksijen -1 durumundadır (süperoksit .O2- olarak). Bu konfigürasyondaki diyamanyetizm, süperoksit üzerindeki tek eşleşmemiş elektronun demir üzerindeki tek eşleşmemiş elektronla (düşük spinli d5 durumunda) antiferromanyetik olarak hizalanmasından kaynaklanır ve deneydeki diyamanyetik oksihemoglobine uygun olarak tüm konfigürasyona net spin vermez. ⓘ
Diyamanyetik oksihemoglobin için yukarıdaki mantıksal olasılıklardan ikinci seçeneğin deney tarafından doğru bulunması şaşırtıcı değildir: singlet oksijen (olasılık #1) gerçekçi olmayan yüksek enerjili bir durumdur. Model 3, bir rezonans formu olarak küçük bir katkı yapabilmesine rağmen, olumsuz yük ayrımına yol açar (ve manyetik verilerle uyuşmaz). Demirin Hb-O2'de daha yüksek bir oksidasyon durumuna geçmesi atomun boyutunu azaltır ve porfirin halkasının düzlemine girmesine izin vererek koordine histidin kalıntısını çeker ve globulinlerde görülen allosterik değişiklikleri başlatır. ⓘ
Biyo-inorganik kimyacıların ilk varsayımları 1. olasılığın (yukarıda) doğru olduğunu ve demirin oksidasyon durumu II'de bulunması gerektiğini iddia ediyordu. Bu sonuç olası görünüyordu, çünkü methemoglobin olarak demir oksidasyon durumu III, oksidasyon elektronunu "tutmak" için süperoksit .O2- ile birlikte olmadığında, hemoglobini havada olduğu gibi normal üçlü O2'yi bağlayamaz hale getirdiği biliniyordu. Bu nedenle akciğerlerde oksijen gazı bağlandığında demirin Fe(II) olarak kaldığı varsayılmıştır. Bu önceki klasik modeldeki demir kimyası zarifti, ancak diamanyetik, yüksek enerjili, singlet oksijen molekülünün gerekli varlığı asla açıklanamadı. Klasik olarak, bir oksijen molekülünün bağlanmasının yüksek spinli demir(II)'yi güçlü alan ligandlarının oktahedral alanına yerleştirdiği; alandaki bu değişikliğin kristal alan bölme enerjisini artıracağı ve demirin elektronlarının Fe(II)'de diyamanyetik olan düşük spin konfigürasyonuna eşleşmesine neden olacağı savunuluyordu. Bu zorunlu düşük spinli eşleşmenin oksijen bağlandığında demirde gerçekleştiği düşünülmektedir, ancak demirin boyutundaki değişikliği açıklamak için yeterli değildir. Hem demirin daha küçük boyutunu ve gözlenen artan oksidasyon durumunu hem de oksijenin daha zayıf bağını açıklamak için oksijen tarafından demirden ek bir elektronun çıkarılması gerekir. ⓘ
Kovalent bağların tüm elektron transferini içeren mükemmel bağ düzenlerine sahip olması gerekmediğinden, tam sayı oksidasyon durumunun atanması bir formalizmdir. Dolayısıyla, paramanyetik Hb-O2 için her üç model de Hb-O2'nin gerçek elektronik konfigürasyonuna küçük bir dereceye kadar (rezonans yoluyla) katkıda bulunabilir. Bununla birlikte, Hb-O2'deki demirin Fe(III) olduğu modeli, Fe(II) olarak kaldığı klasik fikirden daha doğrudur. ⓘ
Kooperativite

Oksijen demir kompleksine bağlandığında, demir atomunun porfirin halkasının düzleminin merkezine doğru geri hareket etmesine neden olur (hareketli diyagrama bakın). Aynı zamanda, demirin diğer kutbunda etkileşime giren histidin kalıntısının imidazol yan zinciri porfirin halkasına doğru çekilir. Bu etkileşim halkanın düzlemini tetramerin dışına doğru yana doğru zorlar ve ayrıca demir atomuna yaklaştıkça histidin içeren protein sarmalında bir gerilmeye neden olur. Bu gerilme tetramerde kalan üç monomere iletilir ve burada diğer hem bölgelerinde benzer bir konformasyonel değişikliğe neden olur, böylece bu bölgelere oksijen bağlanması kolaylaşır. ⓘ
Oksijen bir hemoglobin monomerine bağlandığında, tetramerin konformasyonu T (gergin) durumundan R (rahat) durumuna kayar. Bu kayma, oksijenin kalan üç monomerin hem gruplarına bağlanmasını teşvik eder, böylece hemoglobin molekülü oksijenle doyurulur. ⓘ
Normal yetişkin hemoglobinin tetramerik formunda, oksijenin bağlanması bu nedenle işbirlikçi bir süreçtir. Hemoglobinin oksijene bağlanma afinitesi molekülün oksijen doygunluğuyla artar ve bağlanan ilk oksijen molekülleri bir sonrakiler için bağlanma bölgelerinin şeklini bağlanma için elverişli bir şekilde etkiler. Bu pozitif kooperatif bağlanma, yukarıda tartışıldığı gibi hemoglobin protein kompleksinin sterik konformasyonel değişiklikleri yoluyla elde edilir; yani, hemoglobindeki bir alt birim proteini oksijenlendiğinde, tüm komplekste konformasyonel veya yapısal bir değişiklik başlatılır ve diğer alt birimlerin oksijen için artan bir afinite kazanmasına neden olur. Sonuç olarak, hemoglobinin oksijen bağlanma eğrisi, kooperatif olmayan bağlanma ile ilişkili normal hiperbolik eğrinin aksine sigmoidal veya S şeklindedir. ⓘ
Hemoglobindeki işbirliğinin dinamik mekanizması ve bunun düşük frekanslı rezonans ile ilişkisi tartışılmıştır. ⓘ
Oksijen dışındaki ligandlar için bağlanma
Hemoglobine kooperatif bir şekilde bağlanan oksijen ligandının yanı sıra, hemoglobin ligandları karbon monoksit (CO) gibi rekabetçi inhibitörleri ve karbon dioksit (CO2) ve nitrik oksit (NO) gibi allosterik ligandları da içerir. Karbondioksit, globin proteinlerinin amino gruplarına bağlanarak karbaminohemoglobin oluşturur; bu mekanizmanın memelilerde karbondioksit taşınmasının yaklaşık %10'unu oluşturduğu düşünülmektedir. Nitrik oksit hemoglobin tarafından da taşınabilir; globin proteinindeki spesifik tiyol gruplarına bağlanarak bir S-nitrozotiyol oluşturur ve hemoglobin hem bölgesinden oksijeni serbest bırakırken serbest nitrik oksit ve tekrar tiyol olarak ayrışır. Periferik dokulara bu nitrik oksit taşınımının, oksijen seviyelerinin düşük olduğu dokulara vazodilatör nitrik oksit salgılayarak dokularda oksijen taşınımına yardımcı olduğu varsayılmaktadır. ⓘ
Rekabetçi
Oksijenin bağlanması karbon monoksit gibi moleküllerden etkilenir (örneğin, tütün içimi, egzoz gazı ve fırınlarda eksik yanma). CO, hem bağlanma bölgesinde oksijen ile rekabet eder. Hemoglobinin CO'ya bağlanma afinitesi oksijene olan afinitesinden 250 kat daha fazladır, yani küçük miktarlardaki CO hemoglobinin hedef dokuya oksijen iletme kabiliyetini önemli ölçüde azaltır. Karbon monoksit renksiz, kokusuz ve tatsız bir gaz olduğundan ve potansiyel olarak ölümcül bir tehdit oluşturduğundan, konutlardaki tehlikeli seviyeleri uyarmak için karbon monoksit dedektörleri ticari olarak kullanılabilir hale gelmiştir. Hemoglobin CO ile birleştiğinde, karboksihemoglobin adı verilen çok parlak kırmızı bir bileşik oluşturur ve bu da CO zehirlenmesi kurbanlarının cildinin beyaz veya mavi yerine pembe görünmesine neden olabilir. Solunan hava %0,02 kadar düşük CO seviyeleri içerdiğinde baş ağrısı ve mide bulantısı meydana gelir; CO konsantrasyonu %0,1'e çıkarılırsa, bunu bilinç kaybı izler. Ağır sigara içicilerinde oksijen aktif bölgelerin %20'si CO tarafından bloke edilebilir. ⓘ
Benzer şekilde, hemoglobin siyanür (CN-), sülfür monoksit (SO) ve hidrojen sülfür (H2S) dahil olmak üzere sülfür (S2-) için de rekabetçi bağlanma afinitesine sahiptir. Bunların tümü, oksidasyon durumunu değiştirmeden heme içindeki demire bağlanır, ancak yine de oksijen bağlanmasını engelleyerek ciddi toksisiteye neden olurlar. ⓘ
Hem grubundaki demir atomu, oksijen ve diğer gazların bağlanmasını ve taşınmasını desteklemek için başlangıçta demir (Fe2+) oksidasyon durumunda olmalıdır (yukarıda açıklandığı gibi oksijen bağlandığı süre boyunca geçici olarak ferrik hale geçer). Oksijen olmadan ferrik (Fe3+) duruma ilk oksidasyon, hemoglobini oksijen bağlayamayan "hemiglobin" veya methemoglobine dönüştürür. Normal kırmızı kan hücrelerindeki hemoglobin, bunun olmasını engellemek için bir indirgeme sistemi tarafından korunur. Nitrik oksit, kırmızı kan hücrelerinde hemoglobinin küçük bir kısmını methemoglobine dönüştürebilir. Bu son reaksiyon, globinlerin daha eski nitrik oksit dioksijenaz fonksiyonunun bir kalıntı aktivitesidir. ⓘ
Allosterik
Karbondioksit hemoglobin üzerinde farklı bir bağlanma bölgesini işgal eder. Karbondioksit konsantrasyonunun daha yüksek olduğu dokularda, karbondioksit hemoglobinin allosterik bölgesine bağlanarak oksijenin hemoglobinden boşaltılmasını ve nihayetinde oksijen metabolizma sürecindeki dokulara salındıktan sonra vücuttan uzaklaştırılmasını kolaylaştırır. Venöz kanın karbondioksite olan bu artan ilgisi Bohr etkisi olarak bilinir. Karbonik anhidraz enzimi aracılığıyla karbondioksit su ile reaksiyona girerek karbonik asit oluşturur ve bu da bikarbonat ve protonlara ayrışır:
- CO2 + H2O → H2CO3 → HCO3- + H+ ⓘ
Bu nedenle, yüksek karbondioksit seviyelerine sahip kanın pH değeri de daha düşüktür (daha asidik). Hemoglobin protonları ve karbondioksiti bağlayabilir, bu da proteinde konformasyonel bir değişikliğe neden olur ve oksijenin salınmasını kolaylaştırır. Protonlar proteinin çeşitli yerlerine bağlanırken, karbondioksit α-amino grubuna bağlanır. Karbondioksit hemoglobine bağlanır ve karbaminohemoglobin oluşturur. Karbondioksit ve asidin bağlanmasıyla hemoglobinin oksijene olan afinitesindeki bu azalma Bohr etkisi olarak bilinir. Bohr etkisi, R durumundan ziyade T durumunu tercih eder. (O2-doygunluk eğrisini sağa kaydırır). Tersine, kandaki karbondioksit seviyeleri düştüğünde (yani akciğer kılcal damarlarında), karbondioksit ve protonlar hemoglobinden salınarak proteinin oksijen afinitesini artırır. Düşük pH nedeniyle hemoglobinin oksijene toplam bağlanma kapasitesindeki azalmaya (yani eğrinin sadece sağa değil aşağı kaymasına) kök etkisi denir. Bu durum kemikli balıklarda görülür. ⓘ
Hemoglobinin bağladığı oksijeni serbest bırakması gereklidir; aksi takdirde oksijeni bağlamanın bir anlamı kalmaz. Hemoglobinin sigmoidal eğrisi onu bağlama (akciğerlerde O2 alma) ve boşaltma (dokularda O2 boşaltma) konusunda verimli kılar. ⓘ
Yüksek rakımlara alışmış kişilerde kandaki 2,3-Bisfosfogliserat (2,3-BPG) konsantrasyonu artar, bu da bu kişilerin daha düşük oksijen gerilimi koşulları altında dokulara daha fazla miktarda oksijen vermesini sağlar. Y molekülünün X molekülünün Z taşıma molekülüne bağlanmasını etkilediği bu olaya heterotropik allosterik etki denir. Yüksek irtifalardaki organizmalarda bulunan hemoglobin de 2,3-BPG'ye karşı daha az afiniteye sahip olacak şekilde adapte olmuştur ve bu nedenle protein R durumuna doğru daha fazla kayacaktır. R durumunda hemoglobin oksijeni daha kolay bağlar, böylece düşük kısmi basınçlarda oksijen mevcut olduğunda organizmaların gerekli metabolik süreçleri gerçekleştirmesine izin verir. ⓘ
İnsanlar dışındaki hayvanlar hemoglobine bağlanmak ve elverişsiz koşullar altında O2 afinitesini değiştirmek için farklı moleküller kullanırlar. Balıklar hem ATP hem de GTP kullanır. Bunlar balık hemoglobin molekülü üzerindeki bir fosfat "cebine" bağlanır, bu da gergin durumu stabilize eder ve dolayısıyla oksijen afinitesini azaltır. GTP, hemoglobin oksijen afinitesini ATP'den çok daha fazla azaltır, bunun da gergin durumu daha da stabilize eden ekstra bir hidrojen bağı oluşmasından kaynaklandığı düşünülmektedir. Hipoksik koşullar altında, oksijen afinitesini artırmak için balık kırmızı kan hücrelerinde hem ATP hem de GTP konsantrasyonu azalır. ⓘ
Fetal hemoglobin (HbF, α2γ2) adı verilen bir varyant hemoglobin, gelişmekte olan fetüste bulunur ve oksijeni yetişkin hemoglobinden daha fazla afinite ile bağlar. Bu, fetal hemoglobin için oksijen bağlama eğrisinin, yetişkin hemoglobininkine kıyasla sola kaydırılmış olduğu (yani, hemoglobinin daha yüksek bir yüzdesinin daha düşük oksijen geriliminde kendisine oksijen bağladığı) anlamına gelir. Sonuç olarak, plasentadaki fetal kan anne kanından oksijen alabilir. ⓘ
Hemoglobin ayrıca molekülün globin kısmında nitrik oksit (NO) taşır. Bu, periferdeki oksijen iletimini iyileştirir ve solunumun kontrolüne katkıda bulunur. NO, globindeki spesifik bir sistein kalıntısına geri dönüşümlü olarak bağlanır; bağlanma hemoglobinin durumuna (R veya T) bağlıdır. Ortaya çıkan S-nitrozillenmiş hemoglobin, vasküler direnç, kan basıncı ve solunumun kontrolü gibi NO ile ilgili çeşitli faaliyetleri etkiler. NO kırmızı kan hücrelerinin sitoplazmasında salınmaz, ancak AE1 adı verilen bir anyon değiştirici tarafından dışarı taşınır. ⓘ
İnsanlardaki türleri
Hemoglobin varyantları normal embriyonik ve fetal gelişimin bir parçasıdır. Bunlar aynı zamanda bir popülasyonda genetik varyasyonların neden olduğu patolojik mutant hemoglobin formları da olabilir. Orak hücreli anemi gibi iyi bilinen bazı hemoglobin varyantları hastalıklardan sorumludur ve hemoglobinopatiler olarak kabul edilir. Diğer varyantlar tespit edilebilir bir patolojiye neden olmaz ve bu nedenle patolojik olmayan varyantlar olarak kabul edilir. ⓘ
Embriyoda:
- Gower 1 (ζ2ε2)
- Gower 2 (α2ε2) (PDB: 1A9W)
- Hemoglobin Portland I (ζ2γ2)
- Hemoglobin Portland II (ζ2β2). ⓘ
Fetüste:
Doğumdan sonra:
- Hemoglobin A (yetişkin hemoglobini) (α2β2) (PDB: 1BZ0) - %95'in üzerinde normal miktarla en yaygın olanı
- Hemoglobin A2 (α2δ2) - δ zinciri sentezi üçüncü trimesterin sonlarında başlar ve yetişkinlerde normal aralığı %1,5-3,5'tir
- Hemoglobin F (fetal hemoglobin) (α2γ2) - Yetişkinlerde Hemoglobin F, F hücreleri adı verilen sınırlı bir kırmızı hücre popülasyonuyla sınırlıdır. Ancak orak hücre hastalığı ve beta-talasemisi olan kişilerde Hb F seviyesi yükselebilir. ⓘ

Hastalığa neden olan varyant formlar:
- Hemoglobin D-Punjab - (α2βD2) - Hemoglobinin bir varyant formu.
- Hemoglobin H (β4) - α talasemi varyantlarında bulunabilen, β zincirlerinin tetramerinden oluşan bir hemoglobin varyant formu.
- Hemoglobin Barts (γ4) - α talasemi varyantlarında bulunabilen, γ zincirlerinin tetramerinden oluşan bir hemoglobin varyant formu.
- Hemoglobin S (α2βS2) - Orak hücre hastalığı olan kişilerde bulunan bir hemoglobin çeşididir. Hemoglobinin özelliklerinde bir değişikliğe neden olan β-zinciri geninde bir varyasyon vardır ve bu da kırmızı kan hücrelerinin oraklaşmasına neden olur.
- Hemoglobin C (α2βC2) - β-zincir genindeki bir varyasyondan kaynaklanan başka bir varyant. Bu varyant hafif bir kronik hemolitik anemiye neden olur.
- Hemoglobin E (α2βE2) - β-zinciri genindeki bir varyasyona bağlı başka bir varyant. Bu varyant hafif bir kronik hemolitik anemiye neden olur.
- Hemoglobin AS - Bir yetişkin geni ve bir orak hücre hastalığı geni ile orak hücre özelliğine neden olan heterozigot bir form
- Hemoglobin SC hastalığı - Bir orak geni ve Hemoglobin C'yi kodlayan başka bir geni içeren bileşik heterozigot form.
- Hemoglobin Hopkins-2 - Orak hücre hastalığı oluşturmak için bazen Hemoglobin S ile birlikte görülen bir varyant hemoglobin formu. ⓘ
Omurgalı hayvanlarda bozunma
Kırmızı kan hücreleri yaşlanma veya kusurlar nedeniyle ömürlerinin sonuna ulaştıklarında, dalak veya karaciğerdeki makrofajların fagositik aktivitesi ile dolaşımdan uzaklaştırılır veya dolaşım içinde hemolize olurlar. Serbest hemoglobin daha sonra sadece monositler veya makrofajlar üzerinde eksprese edilen hemoglobin taşıyıcı CD163 aracılığıyla dolaşımdan temizlenir. Bu hücreler içinde hemoglobin molekülü parçalanır ve demir geri dönüştürülür. Bu süreç aynı zamanda parçalanan her hem molekülü için bir molekül karbon monoksit üretir. Hem parçalanması insan vücudundaki tek doğal karbon monoksit kaynağıdır ve normal hava soluyan kişilerde kandaki normal karbon monoksit seviyelerinden sorumludur. ⓘ
Hem yıkımının diğer önemli nihai ürünü bilirubindir. Kırmızı kan hücreleri normalden daha hızlı bir şekilde yıkılıyorsa kanda bu kimyasalın seviyelerinde artış tespit edilir. Uygunsuz şekilde parçalanan hemoglobin proteini veya kan hücrelerinden çok hızlı salınan hemoglobin küçük kan damarlarını, özellikle de böbreklerin hassas kan filtreleme damarlarını tıkayarak böbrek hasarına neden olabilir. Demir hemden uzaklaştırılır ve daha sonra kullanılmak üzere kurtarılır, dokularda hemosiderin veya ferritin olarak depolanır ve plazmada beta globulinler tarafından transferrinler olarak taşınır. Porfirin halkası parçalandığında, parçalar normalde safra olarak bağırsaklara salgılanan bilirubin adı verilen sarı bir pigment olarak salgılanır. Bağırsaklar bilirubini ürobilinojene metabolize eder. Ürobilinojen, stercobilin adı verilen bir pigment halinde dışkı ile vücudu terk eder. Globulin, daha sonra dolaşıma salınan amino asitlere metabolize olur. ⓘ
Hemoglobin ile ilgili hastalıklar
Hemoglobin eksikliği, anemide olduğu gibi hemoglobin moleküllerinin miktarının azalmasından ya da her bir molekülün aynı kısmi oksijen basıncında oksijen bağlama yeteneğinin azalmasından kaynaklanabilir. Hemoglobinopatiler (hemoglobin molekülünün anormal yapısıyla sonuçlanan genetik kusurlar) her ikisine de neden olabilir. Her durumda, hemoglobin eksikliği kanın oksijen taşıma kapasitesini azaltır. Hemoglobin eksikliği, genel olarak, kandaki kısmi oksijen basıncının azalması olarak tanımlanan hipoksemiden kesin olarak ayırt edilir, ancak her ikisi de hipoksinin (dokulara yetersiz oksijen sağlanması) nedenidir. ⓘ
Düşük hemoglobinin diğer yaygın nedenleri arasında kan kaybı, beslenme yetersizliği, kemik iliği sorunları, kemoterapi, böbrek yetmezliği veya anormal hemoglobin (orak hücre hastalığı gibi) yer alır. ⓘ
Her bir hemoglobin molekülünün oksijen taşıma kabiliyeti normalde değişen kan pH'ı veya CO2 ile değiştirilerek oksijen-hemoglobin ayrışma eğrisinin değişmesine neden olur. Bununla birlikte, örneğin karbon monoksit zehirlenmesinde patolojik olarak da değişebilir. ⓘ
Kırmızı kan hücrelerinde mutlak bir azalma olsun ya da olmasın hemoglobin azalması anemi semptomlarına yol açar. Aneminin birçok farklı nedeni olmakla birlikte, demir eksikliği ve bunun sonucu olan demir eksikliği anemisi Batı dünyasında en yaygın nedenlerdir. Demir eksikliği hem sentezini azalttığından, demir eksikliği anemisinde kırmızı kan hücreleri hipokromik (kırmızı hemoglobin pigmentinden yoksun) ve mikrositiktir (normalden küçük). Diğer anemiler daha nadirdir. Hemolizde (kırmızı kan hücrelerinin hızlandırılmış parçalanması), ilişkili sarılık hemoglobin metaboliti bilirubinden kaynaklanır ve dolaşımdaki hemoglobin böbrek yetmezliğine neden olabilir. ⓘ
Globin zincirindeki bazı mutasyonlar orak hücre hastalığı ve talasemi gibi hemoglobinopatilerle ilişkilidir. Makalenin başında tartışıldığı gibi diğer mutasyonlar iyi huyludur ve sadece hemoglobin varyantları olarak adlandırılır. ⓘ
Porfiriler olarak bilinen ve hem sentezinin metabolik yollarındaki hatalarla karakterize edilen bir grup genetik bozukluk vardır. Birleşik Krallık Kralı George III muhtemelen en ünlü porfiri hastasıydı. ⓘ
Hemoglobin A, her bir β zincirinin terminal valininde (bir alfa aminoasit) yavaşça glikoz ile birleşir. Ortaya çıkan molekül genellikle Hb A1c, yani glikozlanmış hemoglobin olarak adlandırılır. Glikozun hemoglobindeki amino asitlere bağlanması birçok proteinde kendiliğinden (bir enzimin yardımı olmadan) gerçekleşir ve yararlı bir amaca hizmet ettiği bilinmemektedir. Ancak kandaki glikoz konsantrasyonu arttıkça Hb A1c'ye dönüşen Hb A yüzdesi de artar. Glikozu genellikle yüksek seyreden diyabet hastalarında Hb A1c yüzdesi de yüksek seyreder. Hb A'nın glikozla birleşmesinin yavaş olması nedeniyle Hb A1c yüzdesi, kırmızı hücrelerin yaklaşık 120 gün olan ömrü boyunca kan glikoz seviyelerinin ağırlıklı ortalamasını yansıtır. Bu nedenle glikozlu hemoglobin seviyeleri, tip 2 diabetes mellitus (T2DM) kronik hastalığının uzun vadeli kontrolünü izlemek için ölçülür. T2DM'nin kötü kontrolü, kırmızı kan hücrelerinde yüksek glikozlu hemoglobin seviyelerine neden olur. Normal referans aralığı yaklaşık %4,0-5,9'dur. Elde edilmesi zor olsa da, T2DM'li kişiler için %7'den düşük değerler önerilmektedir. 9'dan yüksek seviyeler glikozlu hemoglobinin kötü kontrolüyle, %12'den yüksek seviyeler ise çok kötü kontrolle ilişkilidir. Glikozlu hemoglobin seviyelerini %7'ye yakın tutan diyabet hastalarının diyabete eşlik edebilecek komplikasyonlardan kaçınma şansı (seviyeleri %8 veya daha yüksek olanlara kıyasla) çok daha yüksektir. Buna ek olarak, hemoglobin glikasyonunun artması oksijene olan afinitesini artırır, dolayısıyla dokuda salınımını önler ve aşırı durumlarda bir hipoksi seviyesine neden olur. ⓘ
Yüksek hemoglobin seviyeleri, polisitemi olarak adlandırılan kırmızı kan hücrelerinin sayılarının veya boyutlarının artmasıyla ilişkilidir. Bu yüksekliğe konjenital kalp hastalığı, kor pulmonale, pulmoner fibrozis, çok fazla eritropoietin veya polisitemi vera neden olabilir. Yüksek hemoglobin seviyeleri ayrıca yüksek rakımlara maruz kalma, sigara içme, dehidrasyon (yapay olarak Hb konsantrasyonu sağlayarak), ilerlemiş akciğer hastalığı ve bazı tümörlerden de kaynaklanabilir. ⓘ
Hindistan, Pondicherry'de yapılan yeni bir çalışma, koroner arter hastalığındaki önemini göstermektedir. ⓘ
Teşhis amaçlı kullanımlar

Hemoglobin konsantrasyonu ölçümü, genellikle tam kan sayımının bir parçası olarak en sık yapılan kan testleri arasındadır. Örneğin, tipik olarak kan bağışından önce veya sonra test edilir. Sonuçlar g/L, g/dL veya mol/L olarak rapor edilir. 1 g/dL yaklaşık 0,6206 mmol/L'ye eşittir, ancak molekülün polimerik durumuna ilişkin belirsizlik nedeniyle ikinci birimler çok sık kullanılmamaktadır. Tek globin birimi moleküler ağırlığı olan 16.000 Da'yı kullanan bu dönüştürme faktörü kandaki hemoglobin konsantrasyonu için daha yaygındır. MCHC (ortalama korpusküler hemoglobin konsantrasyonu) için 64.500 Da tetramer ağırlığını kullanan 0,155 dönüştürme faktörü daha yaygındır. Normal seviyeler şunlardır:
- Erkekler: 13.8 ila 18.0 g/dL (138 ila 180 g/L veya 8.56 ila 11.17 mmol/L)
- Kadınlar: 12,1 ila 15,1 g/dL (121 ila 151 g/L veya 7,51 ila 9,37 mmol/L)
- Çocuklar: 11 ila 16 g/dL (110 ila 160 g/L veya 6,83 ila 9,93 mmol/L)
- Hamile kadınlar: 11 ila 14 g/dL (110 ila 140 g/L veya 6,83 ila 8,69 mmol/L) (hamilelik sırasında 9,5 ila 15 normal değer) ⓘ
Hamile kadınların 1. ve 3. trimesterdeki normal hemoglobin değerleri en az 11 g/dL ve 2. trimesterde en az 10,5 g/dL olmalıdır. ⓘ
Dehidrasyon veya hiperhidrasyon ölçülen hemoglobin seviyelerini büyük ölçüde etkileyebilir. Albümin hidrasyon durumunu gösterebilir. ⓘ
Konsantrasyon normalin altındaysa buna anemi denir. Anemiler, omurgalılarda hemoglobin içeren hücreler olan kırmızı kan hücrelerinin boyutuna göre sınıflandırılır. Kırmızı hücreler küçükse anemi "mikrositik", büyükse "makrositik", aksi takdirde "normositik" olarak adlandırılır. ⓘ
Kırmızı kan hücreleri tarafından işgal edilen kan hacminin oranı olan hematokrit, tipik olarak g/dL cinsinden ölçülen hemoglobin konsantrasyonunun yaklaşık üç katıdır. Örneğin, hemoglobin 17 g/dL olarak ölçülürse, bu %51'lik bir hematokrit ile karşılaştırılır. ⓘ
Laboratuvar hemoglobin test yöntemleri kan örneği (arteriyel, venöz veya kapiller) alınmasını ve hematoloji analizörü ve CO-oksimetre ile analiz edilmesini gerektirir. Ayrıca, invaziv yöntemlerle karşılaştırılabilir doğrulukta Pulse CO-Oksimetri adı verilen yeni bir noninvaziv hemoglobin (SpHb) test yöntemi de mevcuttur. ⓘ
Oksi- ve deoksihemoglobin konsantrasyonları NIRS kullanılarak sürekli, bölgesel ve noninvaziv olarak ölçülebilir. NIRS hem kafada hem de kaslarda kullanılabilir. Bu teknik genellikle elit spor eğitimi, ergonomi, rehabilitasyon, hasta izleme, yenidoğan araştırmaları, fonksiyonel beyin izleme, beyin-bilgisayar arayüzü, üroloji (mesane kasılması), nöroloji (Nörovasküler bağlantı) ve daha birçok alanda araştırma için kullanılmaktadır. ⓘ
Kan şekeri konsantrasyonunun uzun vadeli kontrolü Hb A1c konsantrasyonu ile ölçülebilir. Kan şekeri seviyeleri gün içinde büyük farklılıklar gösterdiğinden doğrudan ölçülmesi için çok sayıda numune alınması gerekir. Hb A1c, hemoglobin A'nın glikoz ile geri dönüşümsüz reaksiyonunun ürünüdür. Daha yüksek glikoz konsantrasyonu daha fazla Hb A1c ile sonuçlanır. Reaksiyon yavaş olduğu için, Hb A1c oranı, kırmızı kan hücrelerinin yarı ömrü boyunca ortalama kandaki glikoz seviyesini temsil eder, tipik olarak ~120 gündür. Hb A1c oranının %6,0 veya daha düşük olması uzun vadeli glikoz kontrolünün iyi olduğunu gösterirken, %7,0'nin üzerindeki değerler yüksektir. Bu test özellikle diyabet hastaları için yararlıdır. ⓘ
Fonksiyonel manyetik rezonans görüntüleme (fMRI) cihazı, paramanyetik olduğu için manyetik alanlara duyarlı olan deoksihemoglobinden gelen sinyali kullanır. NIRS ile kombine ölçüm, BOLD sinyaline kıyasla hem oksi hem de deoksihemoglobin sinyali ile iyi bir korelasyon gösterir. ⓘ
Atletik takip ve kendi kendine takip kullanımları
Hemoglobin, spor performansı ve antrenmanın daha iyi anlaşılması için günlük aktivitelerin hemokonsantrasyon ve hemodilüsyon etkilerini izleyen bireysel bir veri seti oluşturmak üzere noninvaziv olarak izlenebilir. Sporcular genellikle dayanıklılık ve egzersiz yoğunluğu konusunda endişe duyarlar. Sensör, dokudan bir ışık dedektörüne kırmızı ve kızılötesi ışık yayan ışık yayan diyotlar kullanır ve daha sonra hemoglobin proteini tarafından ışığın emilimini hesaplamak için bir işlemciye bir sinyal gönderir. Bu sensör, parmağa tutturulan küçük bir algılama cihazından oluşan nabız oksimetresine benzer. ⓘ
Omurgalı olmayan organizmalardaki analoglar
Hayvanlar ve bitkiler alemindeki organizmalarda çeşitli oksijen taşıma ve bağlama proteinleri mevcuttur. Bakteriler, protozoanlar ve mantarlar dahil olmak üzere tüm organizmalar, bilinen ve tahmin edilen rolleri gaz halindeki ligandların geri dönüşümlü olarak bağlanmasını içeren hemoglobin benzeri proteinlere sahiptir. Bu proteinlerin çoğu globin ve hem parçası (düz bir porfirin desteğindeki demir) içerdiğinden, genel üçüncül yapıları omurgalı hemoglobininkinden çok farklı olsa bile, genellikle hemoglobinler olarak adlandırılırlar. Özellikle, aşağı hayvanlarda "miyoglobin" ve hemoglobin ayrımı genellikle imkansızdır, çünkü bu organizmaların bazıları kas içermez. Ya da, tanınabilir ayrı bir dolaşım sistemine sahip olabilirler, ancak oksijen taşınmasıyla ilgilenen bir dolaşım sistemi olmayabilir (örneğin, birçok böcek ve diğer eklembacaklılar). Tüm bu gruplarda, gaz bağlama ile ilgilenen heme/globin içeren moleküller (hatta monomerik globin olanlar) oksihemoglobinler olarak adlandırılır. Oksijenin taşınması ve algılanması ile ilgilenmenin yanı sıra, NO, CO2, sülfit bileşikleri ve hatta anaerobik olması gereken ortamlarda O2 atma ile de ilgilenebilirler. Hatta heme içeren P450 enzimleri ve peroksidazlara benzer bir şekilde klorlu maddelerin detoksifikasyonu ile de ilgilenebilirler. ⓘ

Hemoglobinlerin yapısı türler arasında farklılık gösterir. Hemoglobin tüm organizma alemlerinde bulunur, ancak tüm organizmalarda bulunmaz. Bakteriler, protozoa, algler ve bitkiler gibi ilkel türler genellikle tek globinli hemoglobinlere sahiptir. Birçok nematod solucanı, yumuşakçalar ve kabuklular omurgalılardan çok daha büyük çok alt birimli moleküller içerir. Özellikle, mantarlarda ve dev annelidlerde bulunan kimerik hemoglobinler hem globin hem de diğer protein türlerini içerebilir. ⓘ
Organizmalarda hemoglobinin en çarpıcı oluşumlarından ve kullanımlarından biri, 2,4 metre uzunluğa ulaşabilen ve okyanus volkanik bacalarını dolduran dev tüp solucanında (Riftia pachyptila, Vestimentifera olarak da adlandırılır) görülür. Bu solucanlar sindirim sistemi yerine, organizmanın ağırlığının yarısını oluşturan bir bakteri popülasyonu içerir. Bakteriler, H2O ve CO2'den yiyecek yapmak üzere enerji üretmek için havalandırmadan gelen H2S'yi sudan gelen O2 ile okside eder. Solucanların üst ucu, suyun içine uzanan ve bakteriler için H2S ve O2'yi ve fotosentetik bitkilere benzer sentetik hammadde olarak kullanılmak üzere CO2'yi emen koyu kırmızı yelpaze benzeri bir yapıdır ("tüy"). Yapılar, her biri ilişkili hem yapıları içeren 144'e kadar globin zincirine sahip olağanüstü karmaşık hemoglobin içerikleri nedeniyle parlak kırmızıdır. Bu hemoglobinler, sülfür varlığında oksijen taşıyabilmeleri ve hatta diğer türlerin çoğundaki hemoglobinler gibi sülfür tarafından tamamen "zehirlenmeden" veya inhibe edilmeden sülfür taşıyabilmeleri bakımından dikkat çekicidir. ⓘ
Diğer oksijen bağlayıcı proteinler
- Miyoglobin
- İnsanlar da dahil olmak üzere birçok omurgalı hayvanın kas dokusunda bulunur ve kas dokusuna belirgin bir kırmızı veya koyu gri renk verir. Yapı ve sekans olarak hemoglobine çok benzer, ancak bir tetramer değildir; bunun yerine, kooperatif bağlanmadan yoksun bir monomerdir. Oksijeni taşımak yerine depolamak için kullanılır. ⓘ
- Hemosiyanin
- Doğada bulunan en yaygın ikinci oksijen taşıyıcı protein olup birçok eklembacaklı ve yumuşakçanın kanında bulunur. Demir heme grupları yerine bakır prostetik grupları kullanır ve oksijenlendiğinde mavi renklidir. ⓘ
- Hemeritrin
- Bazı deniz omurgasızları ve birkaç annelid türü, kanlarında oksijen taşımak için bu demir içeren hem olmayan proteini kullanır. Oksijenli olduğunda pembe/mor, oksijensiz olduğunda berrak görünür. ⓘ
- Klorokruorin
- Birçok annelidde bulunur, eritrokruorine çok benzer, ancak hem grubu yapı olarak önemli ölçüde farklıdır. Deoksijenlendiğinde yeşil, oksijenlendiğinde kırmızı görünür. ⓘ
- Vanabinler
- Vanadyum kromajenleri olarak da bilinen bu maddeler deniz börtü böceğinin kanında bulunur. Bir zamanlar metal vanadyumu oksijen bağlayıcı bir prostetik grup olarak kullandıkları varsayılmıştır. Bununla birlikte, tercihen vanadyum içermelerine rağmen, görünüşe göre çok az oksijen bağlarlar ve bu nedenle açıklanamayan başka bir işleve sahiptirler (deniz fıskiyeleri de bir miktar hemoglobin içerir). Toksin olarak hareket edebilirler. ⓘ
- Eritrokruorin
- Toprak solucanları da dahil olmak üzere birçok annelidde bulunan bu protein, 3,5 milyon daltondan daha büyük bir moleküler kütleye sahip tek bir protein kompleksi halinde birbirine bağlanmış düzinelerce -muhtemelen yüzlerce- demir ve hem taşıyan protein alt birimi içeren, serbest yüzen dev bir kan proteinidir. ⓘ
- Pinnaglobin
- Sadece yumuşakça Pinna nobilis'te görülür. Kahverengi manganez bazlı porfirin proteini. ⓘ
- Leghemoglobin
- Yonca veya soya fasulyesi gibi baklagil bitkilerinde, köklerdeki azot sabitleyici bakteriler, oksijen bağlayıcı protein içeren bu demir heme tarafından oksijenden korunur. Korunan spesifik enzim, serbest oksijen varlığında azot gazını indirgeyemeyen nitrojenazdır. ⓘ
- Koboglobin
- Sentetik kobalt bazlı bir porfirin. Koboprotein oksijenlendiğinde renksiz, damarlardayken sarı görünür. ⓘ
Eritroid olmayan hücrelerde varlığı
Bazı eritroid olmayan hücreler (yani kırmızı kan hücresi hattı dışındaki hücreler) hemoglobin içerir. Beyinde bunlar arasında substantia nigra'daki A9 dopaminerjik nöronlar, serebral korteks ve hipokampustaki astrositler ve tüm olgun oligodendrositler bulunur. Bu hücrelerdeki beyin hemoglobininin "anoksik koşullarda homeostatik bir mekanizma sağlamak için oksijen depolanmasını sağlayabileceği, bunun da özellikle enerji üretimi için yüksek gereksinimi olan yüksek bir metabolizmaya sahip A9 DA nöronları için önemli olduğu" öne sürülmüştür. Ayrıca, "A9 dopaminerjik nöronların yüksek mitokondriyal aktivitelerine ek olarak, otoksidasyon ve/veya monoamin oksidaz (MAO) aracılı dopamin deaminasyonu yoluyla hidrojen peroksit üretimi ve ardından erişilebilir demirli demirin yüksek derecede toksik hidroksil radikalleri oluşturmak üzere reaksiyona girmesi nedeniyle yoğun oksidatif stres altında olduklarından özellikle risk altında olabilecekleri" belirtilmiştir. Bu durum, Parkinson hastalığında bu hücrelerin dejenerasyon riskini açıklayabilir. Bu hücrelerdeki hemoglobin türevi demir, bu hücrelerin ölüm sonrası karanlığının nedeni değildir (Latince substantia nigra isminin kökeni), daha ziyade nöromelaninden kaynaklanmaktadır. ⓘ
Beyin dışında, hemoglobinin antioksidan ve makrofajlarda, alveolar hücrelerde ve böbrekteki mesangial hücrelerde demir metabolizmasının düzenleyicisi olarak oksijen taşımayan işlevleri vardır. ⓘ
Tarihte, sanatta ve müzikte

Tarihsel olarak, kan ve pas rengi arasındaki ilişki, Mars gezegeninin Roma savaş tanrısı ile ilişkilendirilmesinde ortaya çıkmaktadır, çünkü gezegen eskilere kanı hatırlatan turuncu-kırmızı bir renktedir. Gezegenin rengi Mars toprağındaki oksijenle birlikte demir bileşiklerinden kaynaklansa da, hemoglobin ve oksitlerinde bulunan demirin kana kırmızı rengini verdiği yaygın bir yanılgıdır. Renk aslında demirin kendisinden değil, demirin bağlı olduğu hemoglobinin porfirin parçasından kaynaklanmaktadır, ancak demirin ligasyonu ve redoks durumu porfirinin pi'den pi'ye* veya n'den pi'ye* elektronik geçişlerini ve dolayısıyla optik özelliklerini etkileyebilir. ⓘ
Sanatçı Julian Voss-Andreae 2005 yılında proteinin omurgasından yola çıkarak Çelikten Kalp (Hemoglobin) adlı bir heykel yarattı. Heykel cam ve yıpranmış çelikten yapılmıştır. Başlangıçta parlak olan sanat eserinin kasıtlı olarak paslandırılması, hemoglobinin demire oksijen bağlama şeklindeki temel kimyasal reaksiyonunu yansıtmaktadır. ⓘ
Montrealli sanatçı Nicolas Baier, hemoglobin molekülünün yapısını gösteren paslanmaz çelikten bir heykel olan Lustre'ı (Hémoglobine) yarattı. Heykel McGill Üniversitesi Sağlık Merkezi'nin Montreal'deki araştırma merkezinin atriumunda sergilenmektedir. Heykel yaklaşık 10 metre × 10 metre × 10 metre boyutlarındadır. ⓘ
İşlev mekanizması ve çeşitleri
Hemoglobin O2 taşınmasında görevlidir ve vücudun en önemli tamponudur. Hemoglobindeki Fe2+'in koordinasyon sayısı 6 olup bu koordinasyon yerlerinden dördüne pirol halkasının azotu, beşincisine globin molekülünün histidininin imidozol grubunun azotu, altıncısına ise su molekülü bağlanarak hemoglobin teşekkül eder. Suyun yerine O2 geçerse bu hemoglobine oksihemoglobin adı verilir. Hemoglobin molekülünde dört hem grubu bulunduğuna göre oksijen için dört birleşme yeri vardır. Hemoglobinin oksijen yerine CO2 ile birleşmesine karbaminohemoglobin (karbhemoglobin) adı verilir. Dayanıksız bir bileşiktir. Hemoglobinin altıncı koordinasyon yerine CO gelirse buna da karboksihemoglobin adı verilir. Hemoglobinin CO'e ilgisi O2'den daha fazladır. Hemoglobindeki demirin Fe3+ haline yükseltgenmesiyle elde edilen maddeye hemin adı verilir ve bu hemoglobin çeşidine de methemoglobin adı verilir. Hemoglobindeki altıncı koordinasyon yerine CN- bağlanırsa buna da siyanohemoglobin adı verilir ve bu tür zehirlenme gören kimselere sodyum tiyosülfat acil olarak verilmelidir. ⓘ
Yıkımı
Hemoglobin Eritrositlerin kemik iliğinden dolaşıma geçişinin 120-130. günü retiküloendeteryal sistem hücrelerini ihtiva eden dalak, karaciğer ve kemik iliğinde yıkılıma uğrar. Hemoglobinin iki yolla yıkıma uğradığı düşünülmektedir. ⓘ
- Hem + globin
- Verdoglobin ⓘ
Fetus hemoglobini
Fetus hemoglobini erişkin insan hemoglobininden farklıdır. Fetusta hemoglobin sentezi proeritroblast, normoblast ve retikülositlerde olur. 12. haftadan önceki hemoglobin gower tip 1 ve gower tip 2 ve Hb Portland'dır. 2. ve 3. trimestır boyunca fetuste ana hemoglobinolarak HbF bulunurur. HbF iki alfa ve iki gama alt zincirinden oluşur. HbF'in oksijene aflinitesi erişkin tip hemoglobinden yani HbA'dan %50 daha fazladır. ⓘ
