Makrofaj
| Makrofaj ⓘ | |
|---|---|
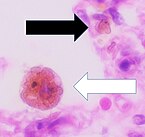
 Bir farede muhtemelen patojen olan iki parçacığı yutmak için "kollarını" (filopodia) uzatan bir makrofaj (tripan mavisi dışlama boyaması) | |
| Detaylar | |
| Telaffuz | /ˈmakrə(ʊ)feɪdʒ/ |
| Sistem | Bağışıklık sistemi |
| Fonksiyon | Fagositoz |
| Tanımlayıcılar | |
| Latince | Macrophagocytus |
| Kısaltma(lar) | Mφ, MΦ |
| Mikroanatominin anatomik terimleri [Vikiveri'de düzenle] | |
Makrofajlar (Mφ, MΦ veya MP olarak kısaltılır) (Yunanca: büyük yiyiciler, Yunanca μακρός (makrós) = büyük, φαγεῖν (phagein) = yemek), yüzeylerinde sağlıklı vücut hücrelerine özgü proteinler bulunmayan kanser hücreleri, mikroplar, hücresel artıklar ve yabancı maddeler gibi patojenleri yutup sindiren bağışıklık sisteminin bir tür beyaz kan hücresidir. Bu süreç fagositoz olarak adlandırılır ve konakçıyı enfeksiyon ve yaralanmalara karşı savunur. ⓘ
Bu büyük fagositler esasen tüm dokularda bulunur ve burada amoeboid hareketle potansiyel patojenleri ararlar. Vücutta çeşitli şekillerde (çeşitli isimlerle) bulunurlar (örneğin histiyositler, Kupffer hücreleri, alveolar makrofajlar, mikroglia ve diğerleri), ancak hepsi mononükleer fagosit sisteminin bir parçasıdır. Fagositozun yanı sıra, spesifik olmayan savunmada (doğuştan gelen bağışıklık) kritik bir rol oynarlar ve ayrıca lenfositler gibi diğer bağışıklık hücrelerini işe alarak spesifik savunma mekanizmalarının (adaptif bağışıklık) başlatılmasına yardımcı olurlar. Örneğin, T hücrelerine antijen sunucuları olarak önemlidirler. İnsanlarda, işlevsiz makrofajlar sık enfeksiyonlarla sonuçlanan kronik granülomatöz hastalık gibi ciddi hastalıklara neden olur. ⓘ
Enflamasyonu artırmanın ve bağışıklık sistemini uyarmanın ötesinde, makrofajlar aynı zamanda önemli bir anti-enflamatuar rol oynar ve sitokin salınımı yoluyla bağışıklık reaksiyonlarını azaltabilir. Enflamasyonu teşvik eden makrofajlar M1 makrofajları olarak adlandırılırken, enflamasyonu azaltan ve doku onarımını teşvik eden makrofajlar M2 makrofajları olarak adlandırılır. Bu farklılık metabolizmalarına da yansır; M1 makrofajları arginin'i "öldürücü" molekül nitrik okside metabolize etme konusunda benzersiz bir yeteneğe sahipken, M2 makrofajları arginin'i "onarım" molekülü ornitine metabolize etme konusunda benzersiz bir yeteneğe sahiptir. Bununla birlikte, bu ikilik son zamanlarda daha fazla karmaşıklığın keşfedilmesiyle sorgulanmaktadır. ⓘ
İnsan makrofajları yaklaşık 21 mikrometre (0,00083 inç) çapındadır ve dokulardaki monositlerin farklılaşmasıyla üretilir. Akış sitometrisi veya immünohistokimyasal boyama kullanılarak CD14, CD40, CD11b, CD64, F4/80 (fare)/EMR1 (insan), lizozim M, MAC-1/MAC-3 ve CD68 gibi proteinlerin spesifik ekspresyonu ile tanımlanabilirler. ⓘ
Makrofajlar ilk olarak 1884 yılında Rus zoolog Élie Metchnikoff tarafından keşfedilmiş ve adlandırılmıştır. ⓘ
Yapıları
Türleri
Makrofajların büyük bir kısmı mikrobiyal istilanın veya yabancı partiküllerin birikmesinin muhtemel olduğu stratejik noktalarda konuşlanmıştır. Bu hücreler bir grup olarak mononükleer fagosit sistemi olarak bilinir ve daha önce retiküloendotelyal sistem olarak bilinmekteydi. Bulunduğu yere göre belirlenen her makrofaj türünün özel bir adı vardır:
| Hücre Adı | Anatomik Konum ⓘ |
| Adipoz doku makrofajları | Adipoz doku (yağ) |
| Monositler | Kemik iliği / kan |
| Kupffer hücreleri | Karaciğer |
| Sinüs histiyositleri | Lenf düğümleri |
| Alveolar makrofajlar (toz hücreleri) | Pulmoner alveoller |
| Dev hücrelere yol açan doku makrofajları (histiositler) | Bağ dokusu |
| Mikroglia | Merkezi sinir sistemi |
| Hofbauer hücreleri | Plasenta |
| İntraglomerüler mezangial hücreler | Böbrek |
| Osteoklastlar | Kemik |
| Langerhans hücreleri | Cilt |
| Epiteloid hücreler | Granülomlar |
| Kırmızı pulpa makrofajları (sinüzoidal astar hücreleri) | Dalakta kırmızı pulpa |
| Peritoneal makrofajlar | Periton boşluğu |
| LysoMac | Peyer Yaması |
Kupffer hücreleriyle ilgili araştırmalar engellenmektedir çünkü insanlarda Kupffer hücrelerine sadece biyopsilerden veya otopsilerden immünohistokimyasal analiz için erişilebilir. Sıçan ve farelerden izole edilmeleri zordur ve saflaştırma işleminden sonra bir fareden sadece yaklaşık 5 milyon hücre elde edilebilmektedir. ⓘ
Makrofajlar, organlar içinde o organın işlevine özgü parakrin işlevler ifade edebilir. Örneğin testiste makrofajların, komşu Leydig hücreleri tarafından testosterona dönüştürülebilen bir oksisterol olan 25-hidroksikolesterol salgılayarak Leydig hücreleriyle etkileşime girebildiği gösterilmiştir. Ayrıca, testiküler makrofajlar testiste bağışıklık açısından ayrıcalıklı bir ortam yaratılmasına ve testis iltihabı sırasında kısırlığa aracılık etmeye katılabilir. ⓘ
Kardiyak yerleşik makrofajlar, kardiyak miyositlerle gap junction iletişimi yoluyla elektrik iletimine katılır. ⓘ
Makrofajlar temel işlev ve aktivasyon temelinde sınıflandırılabilir. Bu gruplandırmaya göre klasik olarak aktive olan (M1) makrofajlar, yara iyileştirici makrofajlar (alternatif olarak aktive olan (M2) makrofajlar olarak da bilinir) ve düzenleyici makrofajlar (Mregs) vardır. ⓘ
Gelişim
Yetişkin sağlıklı dokularda bulunan makrofajlar ya dolaşımdaki monositlerden türer ya da doğumdan önce kurulur ve daha sonra yetişkin yaşamı boyunca monositlerden bağımsız olarak korunur. Buna karşın, hastalıklı bölgelerde biriken makrofajların çoğu tipik olarak dolaşımdaki monositlerden türemiştir. Bir monosit, lökosit ekstravazasyonu olarak bilinen bir süreçle bir kan damarının endotelinden hasarlı dokuya girdiğinde, makrofaj haline gelmek için bir dizi değişikliğe uğrar. Monositler, hasarlı hücreler, patojenler ve zaten bölgede bulunan makrofajlar tarafından salınan sitokinler de dahil olmak üzere bir dizi uyaran tarafından tetiklenen kemotaksis yoluyla kimyasal maddeler tarafından hasarlı bir bölgeye çekilir. Testis gibi bazı bölgelerde makrofajların proliferasyon yoluyla organı doldurduğu gösterilmiştir. Kısa ömürlü nötrofillerin aksine, makrofajlar vücutta birkaç aya kadar daha uzun süre hayatta kalır. ⓘ
Fonksiyon

a. Fagositoz yoluyla sindirim, bir fagozom oluşur
b. Lizozomların fagozom ile birleşmesi bir fagolizozom oluşturur; patojen enzimler tarafından parçalanır
c. Atık maddeler dışarı atılır veya asimile edilir (ikincisi resmedilmemiştir)
Parçalar:
1. Patojenler
2. Fagozom
3. Lizozomlar
4. Atık malzeme
5. Sitoplazma
6. Hücre zarı ⓘ
Fagositoz
Makrofajlar profesyonel fagositlerdir ve ölmekte olan veya ölü hücrelerin ve hücresel artıkların uzaklaştırılmasında oldukça uzmanlaşmışlardır. Bu rol kronik enflamasyonda önemlidir, çünkü enflamasyonun erken aşamalarında nötrofiller baskındır ve yaşlandıklarında makrofajlar tarafından yutulurlar (bu sürecin açıklaması için CD31'e bakınız). ⓘ
Nötrofiller, kendileri ya da nötrofil hücre dışı tuzakları makrofajlar tarafından fagosite edilmeden önce, ilk olarak işlevlerini yerine getirecekleri ve ölecekleri bir bölgeye çekilirler. Bölgeye ulaşan ilk nötrofil dalgası, yaşlanma sürecinden sonra ve ilk 48 saatin ardından makrofajların ortaya çıkmasını uyarır ve bu makrofajlar daha sonra yaşlanmış nötrofilleri yutar. ⓘ
Ölen hücrelerin uzaklaştırılması büyük ölçüde, akciğerler, karaciğer, sinir dokusu, kemik, dalak ve bağ dokusu gibi stratejik yerlerde kalarak patojenler gibi yabancı maddeleri yutan ve gerektiğinde ek makrofajlar toplayan sabit makrofajlar tarafından gerçekleştirilir. ⓘ
Bir makrofaj bir patojeni yuttuğunda, patojen bir fagozom içinde hapsolur ve daha sonra bir lizozom ile birleşir. Fagolizozom içinde enzimler ve toksik peroksitler patojeni sindirir. Ancak Mycobacterium tuberculosis gibi bazı bakteriler bu sindirim yöntemlerine karşı dirençli hale gelmiştir. Tifoidal Salmonella'lar in vivo olarak konak makrofajları tarafından kendi fagositozlarını indükler ve lizozomal etki ile sindirimi inhibe eder, böylece makrofajları kendi replikasyonları için kullanır ve makrofaj apoptozuna neden olur. Makrofajlar, kendi sindirim bileşikleri nedeniyle nihayet ölmeden önce 100'den fazla bakteriyi sindirebilir. ⓘ
Adaptif bağışıklıktaki rolü
Makrofajlar birçok rol oynayan çok yönlü hücrelerdir. Çöpçü olarak vücuttaki yıpranmış hücreleri ve diğer kalıntıları temizlerler. Dendritik hücrelerle birlikte, bir bağışıklık tepkisinin başlatılmasında çok önemli bir rol oynayan antijenleri sunan hücreler arasında en önde gelirler. Salgı hücreleri olarak monositler ve makrofajlar, bağışıklık tepkilerinin düzenlenmesi ve iltihap gelişiminde hayati öneme sahiptir; enzimler, kompleman proteinleri ve interlökin-1 gibi düzenleyici faktörler de dahil olmak üzere çok çeşitli güçlü kimyasal maddeler (monokinler) üretirler. Aynı zamanda, mikropların ve tümör hücrelerinin peşine düşmek üzere "aktive" edilmelerini sağlayan lenfokinlere yönelik reseptörler taşırlar. ⓘ
Bir makrofaj bir patojeni sindirdikten sonra, patojenin antijenini (çoğunlukla patojenin yüzeyinde bulunan ve bağışıklık sistemi tarafından tanımlama için kullanılan bir molekül, bir protein) ilgili yardımcı T hücresine sunacaktır. Sunum, hücre zarına entegre edilerek ve bir MHC sınıf II molekülüne (MHCII) bağlı olarak gösterilerek yapılır ve diğer beyaz kan hücrelerine yüzeyinde antijen olmasına rağmen makrofajın bir patojen olmadığını gösterir. ⓘ
Nihayetinde antijen sunumu, patojenlerin antijenlerine yapışan antikorların üretilmesiyle sonuçlanır ve bu da makrofajların hücre zarlarıyla yapışmalarını ve fagositoz yapmalarını kolaylaştırır. Bazı durumlarda, patojenler makrofajlar tarafından yapışmaya karşı çok dirençlidir. ⓘ
Bir lenf düğümündeki enfekte makrofajların yüzeyindeki antijen sunumu (MHC sınıf II bağlamında) TH1'in (tip 1 yardımcı T hücreleri) çoğalmasını uyarır (esas olarak makrofajdan IL-12 salgılanması nedeniyle). Lenf düğümündeki bir B hücresi, yüzeye bağlı antikoru ile bakteri üzerindeki aynı işlenmemiş yüzey antijenini tanıdığında, antijen endositoz edilir ve işlenir. İşlenen antijen daha sonra B hücresinin yüzeyindeki MHCII'de sunulur. Antijen-MHCII kompleksini tanıyan T hücre reseptörünü ifade eden T hücreleri (CD40 ve CD40L gibi yardımcı uyarıcı faktörlerle birlikte) B hücresinin antijenin opsonizasyonuna yardımcı olan antikorlar üretmesine neden olur, böylece bakteri fagositler tarafından daha iyi temizlenebilir. ⓘ
Makrofajlar tümör hücrelerine ve mantar ya da parazitlerle enfekte olmuş somatik hücrelere karşı başka bir savunma hattı sağlar. Bir T hücresi anormal bir hücrenin yüzeyindeki özel antijeni tanıdığında, T hücresi makrofajları daha agresif bir forma sokan lenfokinler olarak bilinen kimyasal aracılar üreten aktif bir efektör hücre haline gelir. ⓘ
Makrofaj alt tipleri
Makrofajların çeşitli aktif formları vardır. Makrofajları aktive etmenin çeşitli yolları olmasına rağmen, M1 ve M2 olarak adlandırılan iki ana grup vardır. M1 makrofajlar: daha önce de belirtildiği gibi (daha önce klasik olarak aktive edilmiş makrofajlar olarak adlandırılmıştı), M1 "katil" makrofajlar LPS ve IFN-gama tarafından aktive edilir ve yüksek düzeyde IL-12 ve düşük düzeyde IL-10 salgılar. M1 makrofajları pro-enflamatuar, bakterisidal ve fagositik işlevlere sahiptir. Buna karşılık, M2 "onarım" tanımı (alternatif olarak aktive edilmiş makrofajlar olarak da adlandırılır) genel olarak yara iyileşmesi ve doku onarımı gibi yapıcı süreçlerde işlev gören ve IL-10 gibi anti-enflamatuar sitokinler üreterek zarar verici bağışıklık sistemi aktivasyonunu kapatan makrofajları ifade eder. M2, yerleşik doku makrofajlarının fenotipidir ve IL-4 ile daha da yükseltilebilir. M2 makrofajları yüksek düzeyde IL-10, TGF-beta ve düşük düzeyde IL-12 üretir. Tümörle ilişkili makrofajlar esas olarak M2 fenotipindedir ve tümör büyümesini aktif olarak destekliyor gibi görünmektedir. ⓘ
Makrofajlar, yara olgunlaşmasında oynadıkları role göre belirlenen çeşitli fenotiplerde bulunur. Fenotipler ağırlıklı olarak iki ana kategoriye ayrılabilir; M1 ve M2. M1 makrofajları enflamasyonun erken aşamalarında gözlenen baskın fenotiptir ve dört temel aracı tarafından aktive edilir: interferon-γ (IFN-γ), tümör nekroz faktörü (TNF) ve hasarla ilişkili moleküler paternler (DAMP'ler). Bu aracı moleküller, karşılığında İnterlökin-6 ve TNF gibi pro-inflamatuar sitokinleri üreten pro-inflamatuar bir yanıt oluşturur. M1 makrofajlarının aksine, M2 makrofajları İnterlökin-4 veya İnterlökin-13 ilavesiyle anti-inflamatuar bir yanıt salgılar. Ayrıca yara iyileşmesinde de rol oynarlar ve revaskülarizasyon ve reepitelizasyon için gereklidirler. M2 makrofajlar rollerine göre dört ana tipe ayrılır: M2a, M2b, M2c ve M2d. M2 fenotiplerinin nasıl belirlendiği hala tartışma konusudur, ancak çalışmalar, çevrelerinin yarayı etkili bir şekilde iyileştirmek için en uygun fenotipe uyum sağlamalarına izin verdiğini göstermiştir. ⓘ
M2 makrofajları vasküler stabilite için gereklidir. Vasküler endotelyal büyüme faktörü-A ve TGF-β1 üretirler. Akut yaralarda M1'den M2 makrofajlara doğru bir fenotip kayması vardır, ancak bu kayma kronik yaralarda bozulur. Bu düzensizlik, yetersiz M2 makrofajları ve yara onarımına yardımcı olan ilgili büyüme faktörleri ile sonuçlanır. Bu büyüme faktörlerinin/anti-inflamatuar sitokinlerin eksikliği ve M1 makrofajlarından gelen pro-inflamatuar sitokinlerin fazlalığı ile kronik yaralar zamanında iyileşemez. Normalde, nötrofiller debris/patojenleri yedikten sonra apoptozis gerçekleştirir ve uzaklaştırılırlar. Bu noktada, enflamasyona ihtiyaç duyulmaz ve M1, M2'ye (anti-enflamatuar) geçiş yapar. Ancak, M1 makrofajları apoptoz geçiren nötrofilleri fagosite edemediğinden/edemediğinden makrofaj göçünün ve inflamasyonun artmasına yol açan düzensizlik meydana gelir. ⓘ
Hem M1 hem de M2 makrofajları aterosklerozun ilerlemesinde rol oynar. M1 makrofajları inflamasyon yoluyla aterosklerozu teşvik eder. M2 makrofajları kolesterolü kan damarlarından uzaklaştırabilir, ancak kolesterol oksitlendiğinde, M2 makrofajları aterosklerozun ateromatöz plağına katkıda bulunan apoptotik köpük hücreleri haline gelir. ⓘ
Kas rejenerasyonundaki rolü
Makrofajların kas onarımı, büyümesi ve rejenerasyonundaki önemini anlamanın ilk adımı, hasarlı kas kullanımının başlamasıyla birlikte iki makrofaj "dalgası" olmasıdır - kas onarımında doğrudan etkisi olan ve olmayan alt popülasyonlar. İlk dalga, kas membran lizisine ve membran enflamasyonuna neden olmak için yeterli olan artan kas kullanımı dönemlerinde ortaya çıkan ve yaralı kas liflerinin içeriğine girip bozabilen fagositik bir popülasyondur. Bu erken istilacı, fagositik makrofajlar, bir tür kas hücresi yaralanması veya yeniden yüklemenin başlamasından yaklaşık 24 saat sonra en yüksek konsantrasyonlarına ulaşır. Konsantrasyonları 48 saat sonra hızla azalır. İkinci grup, rejeneratif liflerin yakınında dağılmış olan fagositik olmayan tiplerdir. Bunlar iki ila dört gün arasında zirve yapar ve kas dokusu yeniden inşa edilirken birkaç gün boyunca yüksek kalır. İlk alt popülasyonun kas onarımına doğrudan bir faydası yokken, ikinci fagositik olmayan grubun vardır. ⓘ
Makrofajların kasın çoğalmasını, farklılaşmasını, büyümesini, onarımını ve rejenerasyonunu etkileyen çözünebilir maddeler salgıladığı düşünülmektedir, ancak şu anda bu etkilere aracılık etmek için üretilen faktör bilinmemektedir. Makrofajların doku onarımını desteklemedeki rolünün kaslara özgü olmadığı bilinmektedir; yaralanmayı takiben iyileşme süreci aşamasında çok sayıda dokuda birikirler. ⓘ
Yara iyileşmesindeki rolü
Makrofajlar yara iyileşmesi için gereklidir. Yaralanmadan sonraki ikinci günde yaradaki baskın hücreler olarak polimorfonükleer nötrofillerin yerini alırlar. Trombositler ve diğer hücreler tarafından salınan büyüme faktörleri tarafından yara bölgesine çekilen kan dolaşımındaki monositler, kan damarı duvarlarından bölgeye girer. Yaradaki monosit sayısı, yaralanma meydana geldikten bir ila bir buçuk gün sonra en yüksek seviyeye ulaşır. Monositler yara bölgesine girdikten sonra olgunlaşarak makrofajlara dönüşürler. Dalak, vücudun monositlerinin yarısını yaralı dokuya gönderilmek üzere yedekte tutar. ⓘ
Makrofajın ana rolü bakterileri ve hasarlı dokuyu fagosite etmektir ve ayrıca proteazlar salgılayarak hasarlı dokuyu debride ederler. Makrofajlar ayrıca, özellikle yara sonrası üçüncü ve dördüncü günlerde büyüme faktörleri ve diğer sitokinler gibi bir dizi faktör salgılar. Bu faktörler iyileşmenin proliferasyon aşamasında yer alan hücreleri bölgeye çeker. Makrofajlar ayrıca kasılma aşamasını da kısıtlayabilir. Makrofajlar, anjiyogenezi indükleyen ve hızlandıran faktörleri üretmek için çevrelerindeki düşük oksijen içeriği tarafından uyarılırlar ve ayrıca yarayı yeniden epitelize eden, granülasyon dokusu oluşturan ve yeni bir ekstraselüler matriks döşeyen hücreleri de uyarırlar. Makrofajlar bu faktörleri salgılayarak yara iyileşme sürecinin bir sonraki aşamaya geçmesine katkıda bulunurlar. ⓘ
Uzuv rejenerasyonundaki rolü
Bilim insanları, makrofajların materyal kalıntılarını yemenin yanı sıra semenderdeki tipik uzuv rejenerasyonunda da rol oynadığını ortaya çıkardı. Bir semenderden makrofajların çıkarılmasının uzuv rejenerasyonunda başarısızlığa ve yara izi tepkisine yol açtığını buldular. ⓘ
Demir homeostazındaki rolü
Yukarıda açıklandığı gibi, makrofajlar ölmekte olan veya ölü hücrelerin ve hücresel artıkların uzaklaştırılmasında kilit bir rol oynar. Eritrositlerin ortalama 120 günlük bir ömrü vardır ve bu nedenle dalak ve karaciğerdeki makrofajlar tarafından sürekli olarak yok edilirler. Makrofajlar makromolekülleri de yutar ve bu nedenle parenteral demirlerin farmakokinetiğinde önemli bir rol oynar. ⓘ
Hemoglobinden salınan demir ya ferritinde dahili olarak depolanır ya da ferroportin yoluyla dolaşıma salınır. Sistemik demir seviyelerinin yükseldiği veya enflamasyonun mevcut olduğu durumlarda, yüksek hepsidin seviyeleri makrofaj ferroportin kanalları üzerinde etkili olarak demirin makrofajlar içinde kalmasına yol açar. ⓘ
Pigment tutulumundaki rolü

Melanofajlar, organizmaya özgü ya da dış kaynaklı (dövme gibi) pigmentleri hücre dışı alandan emebilen, dokuda yerleşik makrofajların bir alt kümesidir. Melanozomları sentezleyen ve gelişimlerinin çeşitli aşamalarını içeren dendritik junkional melanositlerin aksine, melanofajlar sadece fagosite edilmiş melanini lizozom benzeri fagozomlarda biriktirir. Bu durum, ölü dermal makrofajlardan gelen pigmentin halefleri tarafından fagosite edilmesiyle tekrar tekrar meydana gelir ve dövmeyi aynı yerde korur. ⓘ
Doku homeostazındaki rolü
Her doku, stroma ve fonksiyonel doku ile karşılıklı bağlantıları olan kendi özelleşmiş yerleşik makrofaj popülasyonunu barındırır. Bu yerleşik makrofajlar sapsızdır (göç etmez), dokunun fizyolojik işlevini desteklemek için gerekli büyüme faktörlerini sağlar (örneğin bağırsaklardaki makrofaj-nöronal çapraz iletişim) ve dokuyu enflamatuar hasardan aktif olarak koruyabilir. ⓘ
Sinirle İlişkili Makrofajlar
Sinirle ilişkili makrofajlar veya NAM'ler, sinirlerle ilişkili olduğu bilinen doku yerleşimli makrofajlardır. Bazılarının 200um'a kadar uzamış bir morfolojiye sahip olduğu bilinmektedir. ⓘ
Klinik önemi
Fagositozdaki rolleri nedeniyle makrofajlar bağışıklık sisteminin birçok hastalığında rol oynar. Örneğin, çok sayıda hastalığın neden olabileceği enflamatuar lezyonlar olan granülomların oluşumuna katılırlar. Örneğin, etkisiz fagositoz ve makrofaj fonksiyonunun çoğunlukla nadir görülen bazı bozuklukları tanımlanmıştır. ⓘ
Hücre içi patojenler için bir konakçı olarak
Fagositik bağışıklık hücresi olarak makrofajlar, patojenleri yok etmek için yutmaktan sorumludur. Bazı patojenler bu süreci alt üst eder ve bunun yerine makrofajın içinde yaşar. Bu, patojenin bağışıklık sisteminden gizlendiği bir ortam sağlar ve çoğalmasına izin verir. ⓘ
Bu tür davranışlara sahip hastalıklar arasında tüberküloz (Mycobacterium tuberculosis'in neden olduğu) ve leishmaniasis (Leishmania türlerinin neden olduğu) yer almaktadır. ⓘ
Makrofajlar, hücre içi bir bakteriye ev sahipliği yapma olasılığını en aza indirmek için, mikroplar için toksik olan nitrik oksit ve reaktif oksijen ara ürünlerinin indüksiyonu gibi savunma mekanizmaları geliştirmiştir. Makrofajlar ayrıca mikrobun besin kaynağını kısıtlama ve otofajiyi indükleme yeteneğini de geliştirmiştir. ⓘ
Tüberküloz
Bir makrofaj tarafından yutulduktan sonra, tüberküloz etkeni Mycobacterium tuberculosis hücresel savunmadan kaçınır ve hücreyi çoğalmak için kullanır. Son kanıtlar, Mycobacterium tuberculosis'in pulmoner enfeksiyonuna yanıt olarak, periferik makrofajların M1 fenotipine olgunlaştığını göstermektedir. Makrofaj M1 fenotipi, pro-enflamatuar sitokinlerin (IL-1β, TNF-α ve IL-6) salgılanmasının artması ve enfeksiyonun temizlenmesi için gerekli olan glikolitik aktivitelerin artması ile karakterize edilir. ⓘ
Leishmaniasis
Bir makrofaj tarafından fagositozun ardından Leishmania paraziti kendini fagositik bir vakuol içinde bulur. Normal şartlar altında, bu fagositik vakuol bir lizozoma dönüşecek ve içeriği sindirilecektir. Leishmania bu süreci değiştirir ve yok edilmekten kaçınır; bunun yerine vakuolün içinde bir yuva yaparlar. ⓘ
Chikungunya
Eklemlerdeki makrofajların enfeksiyonu, Chikungunya'nın (CHIKV veya Chikungunya virüsünün neden olduğu) akut fazı sırasında ve sonrasında lokal enflamasyonla ilişkilidir. ⓘ
Diğerleri
Adenovirüs (göz nezlesinin en yaygın nedeni) konak makrofajında latent olarak kalabilir ve ilk enfeksiyondan 6-18 ay sonra viral dökülme devam eder. ⓘ
Brucella spp. fagozom-lizozom füzyonunun inhibisyonu yoluyla bir makrofajda latent kalabilir; bruselloza (undulant ateş) neden olur. ⓘ
Lejyoner hastalığının etkeni olan Legionella pneumophila da makrofajlarda yerleşik hale gelir. ⓘ
Kalp hastalığı
Makrofajlar, aterosklerozun ilerleyici plak lezyonlarının oluşumunda rol oynayan baskın hücrelerdir. ⓘ
Makrofajların fokal olarak toplanması akut miyokard enfarktüsünün başlamasından sonra gerçekleşir. Bu makrofajlar debris ve apoptotik hücreleri uzaklaştırma ve doku rejenerasyonu için hazırlama işlevi görür. Makrofajlar hipokalemik farelerde iskemi kaynaklı ventriküler taşikardiye karşı koruma sağlar. ⓘ
HIV enfeksiyonu
Makrofajlar insan immün yetmezlik virüsü (HIV) enfeksiyonunda da rol oynar. T hücreleri gibi makrofajlar da HIV ile enfekte olabilir ve hatta vücutta devam eden virüs replikasyonunun rezervuarı haline gelebilir. HIV, gp120'nin CD4'e ve ikinci membran reseptörü olan CCR5'e (bir kemokin reseptörü) bağlanması yoluyla makrofaja girebilir. Hem dolaşımdaki monositler hem de makrofajlar virüs için bir rezervuar görevi görür. HIV enfeksiyonuna duyarlılık makrofaj alt tipleri arasında farklılık gösterse de, makrofajlar HIV-1 enfeksiyonuna CD4+ T hücrelerinden daha iyi direnç gösterebilmektedir. ⓘ
Kanser
Makrofajlar, tümör hücresi çoğalmasını ve istilasını destekleyerek, tümör anjiyogenezini teşvik ederek ve antitümör bağışıklık hücrelerini baskılayarak tümör büyümesine ve ilerlemesine katkıda bulunabilir. Oksijensiz (hipoksik) ve nekrotik tümör hücrelerine çekilerek kronik enflamasyonu teşvik ederler. Makrofajlar tarafından salınan tümör nekroz faktörü (TNF)-alfa gibi enflamatuar bileşikler nükleer faktör-kappa B gen anahtarını aktive eder. NF-κB daha sonra bir tümör hücresinin çekirdeğine girer ve apoptozu durduran ve hücre çoğalmasını ve enflamasyonu teşvik eden proteinlerin üretimini başlatır. Ayrıca makrofajlar, vasküler endotelyal faktör (VEGF), tümör nekroz faktörü-alfa (TNF-alfa), makrofaj koloni uyarıcı faktör (M-CSF/CSF1) ve tümör büyümesine daha fazla katkıda bulunan IL-1 ve IL-6 dahil olmak üzere birçok pro-anjiyojenik faktör için bir kaynak görevi görür. Makrofajların bir dizi tümöre sızdığı gösterilmiştir. Sayıları meme, serviks, mesane, beyin ve prostat kanserleri de dahil olmak üzere bazı kanserlerde kötü prognoz ile ilişkilidir. Tümörle ilişkili makrofajların (TAM'lar) M2 fenotipi kazanarak tümör büyümesine ve ilerlemesine katkıda bulunduğu düşünülmektedir. Bazı tümörler, tümörlerde makrofajların amplifikasyonunu ve mobilizasyonunu tetikleyen M-CSF/CSF1, MCP-1/CCL2 ve Angiotensin II gibi faktörler de üretebilir. Çeşitli çalışma modellerinde yapılan araştırmalar, makrofajların bazen anti-tümör işlevleri kazanabileceğini göstermektedir. Örneğin, makrofajlar tümör hücrelerini doğrudan öldürmek için sitotoksik aktiviteye sahip olabilir; ayrıca T-hücreleri ve makrofajların işbirliği tümörleri baskılamak için önemlidir. Bu işbirliği sadece T-hücresi ve makrofajın antijen sunumu ile doğrudan temasını değil, aynı zamanda T-hücresi antitümör aktivitesini artıran uygun sitokin kombinasyonlarının salgılanmasını da içerir. Son çalışma bulguları, tümör infiltre eden makrofajlarda IFN-α ekspresyonunu zorlayarak, doğuştan gelen protumoral aktivitelerini köreltmenin ve tümör mikroçevresini daha etkili dendritik hücre aktivasyonu ve immün efektör hücre sitotoksisitesine doğru yeniden programlamanın mümkün olduğunu göstermektedir. Ayrıca, tümör boşaltıcı lenf düğümlerindeki subkapsüler sinüs makrofajları, tümör kaynaklı materyallerin yayılmasını engelleyerek kanserin ilerlemesini baskılayabilir. ⓘ
Kanser tedavisi
Deneysel çalışmalar makrofajların cerrahi, kemoterapi, radyoterapi, immünoterapi ve hedefe yönelik tedavi dahil olmak üzere tüm tedavi yöntemlerini etkileyebileceğini göstermektedir. Makrofajlar tedavi sonuçlarını hem olumlu hem de olumsuz yönde etkileyebilir. Makrofajlar farklı şekillerde koruyucu olabilir: bu hücreleri öldüren tedavileri takiben ölü tümör hücrelerini (fagositoz adı verilen bir süreçte) uzaklaştırabilirler; bazı antikanser ilaçlar için ilaç depoları olarak hizmet edebilirler; ayrıca antitümör bağışıklığı teşvik etmek için bazı tedaviler tarafından aktive edilebilirler. Makrofajlar aynı zamanda çeşitli şekillerde zararlı da olabilir: örneğin çeşitli kemoterapileri, radyoterapileri ve immünoterapileri baskılayabilirler. Makrofajlar tümör ilerlemesini düzenleyebildiğinden, bu hücrelerin sayısını azaltmaya veya fenotiplerini manipüle etmeye yönelik terapötik stratejiler şu anda kanser hastalarında test edilmektedir. Bununla birlikte, makrofajlar antikor aracılı sitotoksisitede (ADCC) de rol oynamaktadır ve bu mekanizmanın belirli kanser immünoterapi antikorları için önemli olduğu öne sürülmüştür. ⓘ
Obezite
Obez yağ dokusu içindeki pro-inflamatuar makrofajların sayısının artmasının, insülin direnci ve tip 2 diyabet gibi obezite komplikasyonlarına katkıda bulunduğu gözlemlenmiştir. ⓘ
Bu nedenle, yağ dokusu makrofajlarının enflamatuar durumunun modülasyonu, obezite ile ilişkili hastalıkları tedavi etmek için olası bir terapötik hedef olarak kabul edilmiştir. Yağ dokusu makrofajları sempatik innervasyon ile anti-enflamatuar homeostatik kontrole tabi olsa da, ADRB2 geni nakavt fareler kullanılarak yapılan deneyler, bu etkinin doğrudan Beta-2 adrenerjik reseptör aktivasyonu yoluyla değil, adiposit fonksiyonunun modülasyonu yoluyla dolaylı olarak uygulandığını göstermektedir; bu da makrofajların adrenerjik uyarımının obezitede yağ dokusu enflamasyonunu veya fonksiyonunu etkilemek için yetersiz olabileceğini düşündürmektedir. ⓘ
CCR2 eksikliği olan farelerin yağ (adipoz) dokusunda, eozinofil sayısında artış, daha fazla alternatif makrofaj aktivasyonu ve tip 2 sitokin ekspresyonuna doğru bir eğilim vardır. Dahası, fareler yüksek yağlı bir diyetle obez hale geldiklerinde bu etki abartılmıştır. Bu durum kısmen yağ hücrelerinin (adipositler) nekrozu ile indüklenen makrofajların fenotip değişiminden kaynaklanmaktadır. Obez bir bireyde bazı adipositler patlar ve nekrotik ölüme uğrar, bu da yerleşmiş M2 makrofajlarının M1 fenotipine geçmesine neden olur. Bu, obezite ile ilişkili düşük dereceli sistemik kronik enflamatuar durumun nedenlerinden biridir. ⓘ
Bağırsak makrofajları
Yapı olarak doku makrofajlarına çok benzemekle birlikte, bağırsak makrofajları sindirim sistemindeki doğal ortamları göz önüne alındığında spesifik özellikler ve işlevler geliştirmiştir. Makrofajlar ve bağırsak makrofajları, fenotiplerinin çevreleri tarafından değiştirilmesine neden olan yüksek plastisiteye sahiptir. Makrofajlar gibi bağırsak makrofajları da farklılaşmış monositlerdir, ancak bağırsak makrofajlarının bağırsaklardaki mikrobiyom ile bir arada bulunması gerekir. Bağırsakta bulunan bakterilerin "öz" olarak tanınmadığı ve makrofaj tarafından fagositoz için potansiyel hedefler olabileceği düşünüldüğünde bu bir zorluktur. ⓘ
Bağırsak bakterilerinin yok edilmesini önlemek için bağırsak makrofajları diğer makrofajlara kıyasla önemli farklılıklar geliştirmiştir. Öncelikle, bağırsak makrofajları enflamatuar yanıtları indüklemez. Doku makrofajları IL-1, IL-6 ve TNF-α gibi çeşitli enflamatuar sitokinleri salgılarken, bağırsak makrofajları enflamatuar sitokinleri üretmez veya salgılamaz. Bu değişiklik doğrudan bağırsak makrofajlarının bulunduğu ortamdan kaynaklanmaktadır. Çevredeki bağırsak epitel hücreleri, proinflamatuar makrofajdan noninflamatuar makrofaja geçişi tetikleyen TGF-β salgılar. ⓘ
Bağırsak makrofajlarında enflamatuar yanıt azalsa da fagositoz hala devam etmektedir. Bağırsak makrofajları S. typhimurium ve E. coli bakterilerini etkili bir şekilde fagosite edebildiği için fagositoz verimliliğinde bir düşüş yoktur, ancak bağırsak makrofajları fagositozdan sonra bile sitokin salgılamaz. Ayrıca, bağırsak makrofajları lipopolisakkarit (LPS), IgA veya IgG reseptörlerini ifade etmez. Bağırsak makrofajları bağırsak mikrobiyomunun mikropla ilişkili moleküler kalıplarını (MAMPS/PAMPS) tespit etmediğinden, LPS reseptörlerinin eksikliği bağırsak için önemlidir. IL-2 ve IL-3 büyüme faktörü reseptörlerini de ifade etmezler. ⓘ
Hastalıktaki rolü
Bağırsak makrofajlarının Crohn hastalığı (CD) ve ülseratif kolit (UC) gibi inflamatuar bağırsak hastalığında (IBD) rol oynadığı gösterilmiştir. Sağlıklı bir bağırsakta, bağırsak makrofajları bağırsaktaki enflamatuar yanıtı sınırlar, ancak hastalık durumunda bağırsak makrofaj sayıları ve çeşitliliği değişir. Bu da bağırsak iltihabına ve İBH'nin hastalık semptomlarına yol açar. Bağırsak makrofajları bağırsak homeostazının korunmasında kritik öneme sahiptir. Enflamasyon veya patojen varlığı bu homeostazı değiştirir ve eş zamanlı olarak bağırsak makrofajlarını da değiştirir. Bağırsak makrofajlarının yeni monositlerin katılımı veya mevcut bağırsak makrofajlarındaki değişiklikler yoluyla değiştirilmesi için henüz belirlenmiş bir mekanizma yoktur. ⓘ
Medya
Aktif bir J774 makrofajının işbirliği içinde dört konidi aldığı görülmektedir. J774 hücreleri konidilerle filme alınmadan bir gece önce 5 ng/ml interferon-γ ile muamele edilmiştir. Gözlemler 2,5 saatlik bir süre boyunca her 30 saniyede bir yapılmıştır.
Oldukça aktif iki alveolar makrofaj konidileri yutarken görülebilir. Zaman atlaması 2,5 saat boyunca kare başına 30 saniyedir. ⓘ
Tarihçe
Makrofajlar ilk olarak 19. yüzyılın sonlarında Élie Metchnikoff tarafından keşfedilmiştir. ⓘ
Köken
Makrofajlar monositlerden türer. Monositler kemik iliğinde büyür ve daha sonra kan dolaşımına girerler. Dolaşımdaki monositler enflamasyonun (iltihaplanma) kimyasal aracılarına (medyatörlerine) yanıt verirler. Bu aracılar (medyatörler) tarafından aktive edildiklerinde monositler endotelin içinden geçerler. Endoteli geçtikten sonra, monositlere makrofaj denir. (Bazı monositler özelleşmiş hücrelere farklılaşırlar, dendritik hücreler veya mikrogliya gibi). ⓘ