Homeostaz
| Üzerine bir serinin parçası ⓘ |
| Biyoloji |
|---|
|
|
Biyolojide homeostaz, canlı sistemler tarafından sürdürülen istikrarlı içsel, fiziksel ve kimyasal koşulların durumudur. Bu, organizma için en uygun işleyiş koşuludur ve vücut sıcaklığı ve sıvı dengesi gibi birçok değişkenin önceden belirlenmiş belirli sınırlar (homeostatik aralık) içinde tutulmasını içerir. Diğer değişkenler arasında hücre dışı sıvının pH'ı, sodyum, potasyum ve kalsiyum iyonlarının konsantrasyonları ve kan şekeri seviyesi yer alır ve bunların çevre, diyet veya aktivite seviyesindeki değişikliklere rağmen düzenlenmesi gerekir. Bu değişkenlerin her biri, birlikte yaşamı sürdüren bir veya daha fazla düzenleyici veya homeostatik mekanizma tarafından kontrol edilir. ⓘ
Homeostaz, halihazırda en uygun koşullardayken değişime karşı doğal bir dirençle ortaya çıkar ve denge birçok düzenleyici mekanizma tarafından korunur. Tüm homeostatik kontrol mekanizmaları, düzenlenen değişken için birbirine bağlı en az üç bileşene sahiptir: bir reseptör, bir kontrol merkezi ve bir efektör. Reseptör, dış ya da iç ortamdaki değişiklikleri izleyen ve bunlara yanıt veren algılama bileşenidir. Reseptörler arasında termoreseptörler ve mekanoreseptörler bulunur. Kontrol merkezleri arasında solunum merkezi ve renin-anjiyotensin sistemi bulunur. Bir efektör, normal duruma geri dönüşü sağlamak için üzerinde hareket edilen hedeftir. Hücresel düzeyde, efektörler, yukarı veya aşağı düzenleme yoluyla gen ifadesinde değişiklikler meydana getiren ve negatif geri besleme mekanizmalarında hareket eden nükleer reseptörleri içerir. Bunun bir örneği karaciğerdeki safra asitlerinin kontrolüdür. ⓘ
Renin-anjiyotensin sistemi gibi bazı merkezler birden fazla değişkeni kontrol eder. Reseptör bir uyarıcı algıladığında, bir kontrol merkezine aksiyon potansiyelleri göndererek tepki verir. Kontrol merkezi, sıcaklık gibi belirli bir değişken için bakım aralığını (kabul edilebilir üst ve alt sınırlar) belirler. Kontrol merkezi, uygun bir yanıt belirleyerek ve bir veya daha fazla kas, bir organ veya bir bez olabilen bir efektöre sinyaller göndererek sinyale yanıt verir. Sinyal alındığında ve harekete geçildiğinde, reseptöre daha fazla sinyal gönderme ihtiyacını durduran negatif geri bildirim sağlanır. ⓘ
Presinaptik nöronda bulunan kannabinoid reseptör tip 1 (CB1), postsinaptik nörona stresli nörotransmitter salınımını durdurabilen bir reseptördür; anandamid (N-araşidonoiletanolamid; AEA) ve 2-araşidonoilgliserol (2-AG) gibi endokannabinoidler (EC'ler) tarafından, bu bileşiklerin postsinaptik nöronlar tarafından sentezlendiği ve bunlardan salındığı ve homeostaz elde etmek için nörotransmitter salınımının modülasyonu için CB1 reseptörüne bağlanmak üzere presinaptik terminale geri döndüğü retrograd bir sinyal süreci yoluyla aktive edilir. ⓘ
Çoklu doymamış yağ asitleri (PUFA'lar) omega-3 (dokosaheksaenoik asit, DHA ve eikosapentaenoik asit, EPA) veya omega-6 (araşidonik asit, ARA) lipid türevleridir ve membran fosfolipidlerinden sentezlenir ve endokannabinoidler (EC'ler) için bir öncü olarak kullanılır ve vücut homeostazının ince ayarının yapılmasında önemli etkilere aracılık eder. ⓘ
Homeostaz (homeostasis) veya dengeleşim, çevresinde gerçekleşen olumsuzluklar karşısında hücrenin kendi dengelerini koruma çabası, değişen koşullarda iç dengenin aktif düzenlemesidir. Fransız bilim insanı Claude Bernard'ın tanımlandığı hemostaz sürecinin amacı, fiziksel ve kimyasal tüm dengelerin yerinde olduğu dingin durumunu korumaktır. ⓘ
Hücrelerin (canlıların) yaşamlarını sürdürebilmesi, çevreye ve içine bulunduğu koşullara uyumuyla olanaklıdır. Uyum sağlayabilmek evrim olgusuyla gerçekleşir. Isı değişiklikleri, ortamdaki oksijen düzeyi, güneş ışınlarının yoğunluğu, beslenme kaynakları gibi koşullara en iyi uyumu sağlayan canlı türü insandır. Örneğin, haltercilerdeki ağırlık kaldırma stresinden zarar gören hücrelerin onarımı ve strese dayanıklılığı arttırmak için yoğun protein (myoglobulin) sentezi gerçekleşir. ⓘ
Canlı organizmayı oluşturan hücrelerin yaşamının sürmesi için düzenleyici sistemler yardımıyla uygun ortamın sağlanması, normal işlevlerini yapabilmeleri, fizyolojik gereksinmelerinin yeterince karşılanması ile yapısal ve metabolik dengelerinin bozulmamasını gerektirir. Homeostazın bozulmasındaki en önemli etmenler ekzojen (dış) ya da endojen (iç) kaynaklı olumsuz etkileridir. Dengelerden birinde bile oluşabilecek aksama homeostazı bozabilir. Canlı organizma, homeostaz durumunu bozan tüm etkileri savaşarak yok etmek ya da yeni koşullara uyum sağlamak zorundadır. Çevresel dinamikler değiştiğinde tüm hücrelerde dengeyi koruma çabası izlenir: "heat-shock protein (HSP)" üretiminin yanı sıra yeni koşullara göre iyon kanalları açılması/kapanması, zararlı kimyasal maddelerin etkisizleştirilmesi, yağ ve glikojen depolarının mobilize olması, hücre içi değişimler “savunma” çabalarının başlıcalarıdır. Ilımlı streslerle karşılaşan hücreler bu tür bir uyarana karşı işlevsel niteliklerini değiştirerek tepki gösterirler. Kendilerine zarar verebilecek düzeydeki streslerle karşılaştıklarında verecekleri tepkiler, zedelenmenin niteliklerine göre farklılıklar gösterir. Olumsuz etkiler giderilemediğinde ya da uyum sağlanamadığında ise hücrenin ölümüne dek gidebilen dejenerasyonlar belirir. ⓘ
Etimoloji
Homeostasis (/ˌhoʊmioʊˈsteɪsɪs/) kelimesi, Yunanca ὅμοιος homoios, "benzer" ve στάσις stasis, "sabit durmak", "aynı kalmak" fikrini veren Yeni Latince homeo- ve -stasis'in birleşik formlarını kullanır. ⓘ
Tarih
İç ortamın düzenlenmesi kavramı 1849 yılında Fransız fizyolog Claude Bernard tarafından tanımlanmış ve homeostaz kelimesi 1926 yılında Walter Bradford Cannon tarafından ortaya atılmıştır. 1932 yılında İngiliz fizyolog Joseph Barcroft, yüksek beyin fonksiyonlarının en istikrarlı iç ortamı gerektirdiğini söyleyen ilk kişi olmuştur. Dolayısıyla Barcroft'a göre homeostaz sadece beyin tarafından organize edilmiyordu, homeostaz beyne hizmet ediyordu. Homeostaz neredeyse tamamen biyolojik bir terimdir ve Bernard ve Cannon tarafından tanımlanan, vücut hücrelerinin içinde yaşadığı ve hayatta kaldığı iç ortamın sabitliğine ilişkin kavramlara atıfta bulunur. Sibernetik terimi, homeostatik mekanizmalar olarak işlev gören termostatlar gibi teknolojik kontrol sistemlerine uygulanır, ancak genellikle biyolojik homeostaz teriminden çok daha geniş bir şekilde tanımlanır. ⓘ
Genel bakış
Tüm organizmaların metabolik süreçleri yalnızca çok özel fiziksel ve kimyasal ortamlarda gerçekleşebilir. Bu koşullar her organizmaya ve kimyasal süreçlerin hücre içinde mi yoksa hücreleri yıkayan interstisyel sıvıda mı gerçekleştiğine göre değişir. İnsanlarda ve diğer memelilerde en iyi bilinen homeostatik mekanizmalar, özellikle sıcaklık, pH, osmolalite ve sodyum, potasyum, glikoz, karbondioksit ve oksijen konsantrasyonları açısından hücre dışı sıvının (veya "iç ortamın") bileşimini sabit tutan düzenleyicilerdir. Bununla birlikte, insan fizyolojisinin birçok yönünü kapsayan çok sayıda başka homeostatik mekanizma da vücuttaki diğer varlıkları kontrol eder. Değişkenlerin seviyeleri ihtiyaç duyulandan daha yüksek veya daha düşük olduğunda, genellikle hipertermi ve hipotermi veya hipertansiyon ve hipotansiyon gibi sırasıyla hiper- ve hipo- ile ön ek alırlar. ⓘ

Bir varlığın homeostatik olarak kontrol ediliyor olması, değerinin sağlık durumunda mutlaka sabit olacağı anlamına gelmez. Örneğin çekirdek vücut sıcaklığı, diğerlerinin yanı sıra beynin hipotalamusunda bulunan sıcaklık sensörleriyle homeostatik bir mekanizma tarafından düzenlenir. Bununla birlikte, regülatörün ayar noktası düzenli olarak sıfırlanır. Örneğin, insanlarda çekirdek vücut sıcaklığı gün boyunca değişir (yani sirkadiyen bir ritme sahiptir), en düşük sıcaklıklar geceleri ve en yüksek sıcaklıklar öğleden sonraları meydana gelir. Diğer normal sıcaklık değişimleri adet döngüsüyle ilgili olanları içerir. Sıcaklık düzenleyicisinin ayar noktası, enfeksiyonlar sırasında ateş üretmek için sıfırlanır. Organizmalar, aklimatizasyon süreci ile sıcaklık değişiklikleri veya irtifadaki oksijen seviyeleri gibi çeşitli koşullara bir şekilde uyum sağlayabilir. ⓘ
Homeostaz vücuttaki her faaliyeti yönetmez. Örneğin, sensörden efektöre giden sinyal (ister nöronlar ister hormonlar aracılığıyla olsun), sensör tarafından tespit edilen hatanın yönü ve büyüklüğü hakkında bilgi iletmek için zorunlu olarak oldukça değişkendir. Benzer şekilde efektörün tepkisinin de hatayı tersine çevirmek için son derece ayarlanabilir olması gerekir - aslında iç ortamı tehdit eden hatayla neredeyse orantılı (ancak ters yönde) olmalıdır. Örneğin, memelilerde arteriyel kan basıncı homeostatik olarak kontrol edilir ve iç karotid arterlerin başlangıçlarında aortik ark ve karotid sinüslerin duvarlarındaki gerilme reseptörleri tarafından ölçülür. Sensörler duyu sinirleri aracılığıyla beyindeki medulla oblongata'ya kan basıncının düşüp düşmediğini ve ne kadar yükseldiğini gösteren mesajlar gönderir. Medulla oblongata daha sonra mesajları otonom sinir sistemine ait motor veya efferent sinirler aracılığıyla çok çeşitli efektör organlara dağıtır ve bu organların aktivitesi kan basıncındaki hatayı tersine çevirmek için değiştirilir. Efektör organlardan biri, arteriyel kan basıncı düştüğünde hızının artması (taşikardi) veya basınç ayarlanan noktanın üzerine çıktığında yavaşlaması (bradikardi) için uyarılan kalptir. Dolayısıyla kalp atış hızı (vücutta sensörü bulunmayan) homeostatik olarak kontrol edilmez, ancak arteriyel kan basıncındaki hatalara verilen efektör yanıtlardan biridir. Bir başka örnek de terleme hızıdır. Bu, vücut ısısının homeostatik kontrolündeki efektörlerden biridir ve bu nedenle, beynin hipotalamusunda bir sensör bulunan vücudun çekirdek ısısını dengesizleştirmekle tehdit eden ısı yüküyle kaba orantılı olarak oldukça değişkendir. ⓘ
Değişkenlerin kontrolü
Çekirdek sıcaklığı

Memeliler, hipotalamus, beyin, omurilik, iç organlar ve büyük damarlardaki termoreseptörlerden gelen girdileri kullanarak çekirdek sıcaklıklarını düzenler. Sıcaklığın dahili olarak düzenlenmesinin yanı sıra, allostaz adı verilen ve aşırı sıcak veya soğuğa (ve diğer zorluklara) uyum sağlamak için davranışları ayarlayan bir süreç devreye girebilir. Bu ayarlamalar arasında gölge aramak ve aktiviteyi azaltmak veya daha sıcak koşullar aramak ve aktiviteyi artırmak veya toplanmak yer alabilir. Davranışsal termoregülasyon fizyolojik termoregülasyona göre önceliklidir çünkü gerekli değişiklikler daha hızlı bir şekilde etkilenebilir ve fizyolojik termoregülasyonun aşırı sıcaklıklara yanıt verme kapasitesi sınırlıdır. ⓘ
Çekirdek sıcaklığı düştüğünde, yoğun vazokonstriksiyon nedeniyle deriye giden kan akımı azalır. Geniş bir yüzey alanına sahip olan uzuvlara giden kan akışı da benzer şekilde azalır ve arterlerin yanında uzanan derin damarlar (venae comitantes) yoluyla gövdeye geri döner. Bu, arteriyel kandaki sıcaklığı doğrudan gövdeye dönen venöz kana kısa devre yaptıran ve soğuk havalarda ekstremitelerden minimum ısı kaybına neden olan bir karşı akım değişim sistemi görevi görür. Deri altı uzuv venleri sıkıca daraltılarak sadece bu kaynaktan ısı kaybını azaltmakla kalmaz, aynı zamanda venöz kanı uzuvların derinliklerindeki karşı akım sistemine zorlar. ⓘ
Metabolizma hızı, başlangıçta titremeyen termojenez ile artar, daha önceki reaksiyonlar hipotermiyi düzeltmek için yetersiz kalırsa bunu titreyen termojenez takip eder. ⓘ
Çekirdek sıcaklığındaki artışlar termoreseptörler tarafından tespit edildiğinde, derideki ter bezleri kolinerjik sempatik sinirler aracılığıyla uyarılır ve deriye ter salgılanır, bu ter buharlaştığında deriyi ve içinden akan kanı soğutur. Birçok omurgalıda alternatif bir efektör olan nefes nefese kalmak da vücudu suyun buharlaşmasıyla soğutur, ancak bu kez boğaz ve ağızdaki mukoza zarlarından. ⓘ
Kan glikozu

Kan şekeri seviyeleri oldukça dar sınırlar içinde düzenlenir. Memelilerde bunun için birincil sensörler pankreas adacıklarının beta hücreleridir. Beta hücreleri kan şekeri seviyesindeki artışa kana insülin salgılayarak ve aynı zamanda komşu alfa hücrelerinin kana glukagon salgılamasını engelleyerek yanıt verir. Bu kombinasyon (yüksek kan insülin seviyeleri ve düşük glukagon seviyeleri), başta karaciğer, yağ hücreleri ve kas hücreleri olmak üzere efektör dokular üzerinde etkili olur. Karaciğerin glikoz üretmesi engellenir, bunun yerine glikoz alınır ve glikojen ve trigliseritlere dönüştürülür. Glikojen karaciğerde depolanır, ancak trigliseritler çok düşük yoğunluklu lipoprotein (VLDL) partikülleri olarak kana salgılanır ve yağ dokusu tarafından alınarak orada yağ olarak depolanır. Yağ hücreleri, bu hücreler üzerinde etkili olan insülinin doğrudan bir etkisi olarak hücre duvarındaki sayıları artan özel glikoz taşıyıcıları (GLUT4) aracılığıyla glikozu alır. Bu şekilde yağ hücrelerine giren glikoz trigliseritlere dönüştürülür (karaciğer tarafından kullanılan aynı metabolik yollarla) ve daha sonra karaciğerde yapılan VLDL türevi trigliseritlerle birlikte bu yağ hücrelerinde depolanır. Kas hücreleri de insüline duyarlı GLUT4 glikoz kanalları aracılığıyla glikozu alır ve kas glikojenine dönüştürür. ⓘ
Kan glikozundaki bir düşüş, insülin salgılanmasının durmasına ve glukagonun alfa hücrelerinden kana salgılanmasına neden olur. Bu da karaciğer, yağ hücreleri ve kaslar tarafından kandan glikoz alımını engeller. Bunun yerine karaciğer, glikojen (glikojenoliz yoluyla) ve karbonhidrat olmayan kaynaklardan (laktat ve de-aminasyonlu amino asitler gibi) glukoneogenez olarak bilinen bir süreçle glukoz üretmesi için güçlü bir şekilde uyarılır. Bu şekilde üretilen glikoz kana karışarak tespit edilen hatayı (hipoglisemi) düzeltir. Kaslarda depolanan glikojen kaslarda kalır ve sadece egzersiz sırasında glikoz-6-fosfata ve oradan da sitrik asit döngüsüne beslenmek veya laktata dönüştürülmek üzere piruvata parçalanır. Kana geri verilen sadece laktat ve sitrik asit döngüsünün atık ürünleridir. Karaciğer sadece laktatı alabilir ve enerji tüketen glukoneogenez süreci ile onu tekrar glukoza dönüştürebilir. ⓘ
Bakır düzenlemesi
Bakır vücutta karmaşık homeostatik süreçlere göre emilir, taşınır, dağıtılır, depolanır ve atılır; bu süreçler mikro besin maddesinin sürekli ve yeterli miktarda tedarik edilmesini sağlarken aynı zamanda aşırı seviyelerden kaçınır. Kısa bir süre için yetersiz miktarda bakır alınırsa, karaciğerdeki bakır depoları tükenecektir. Bu tükenme devam ederse, bakır sağlık eksikliği durumu gelişebilir. Çok fazla bakır alınırsa, aşırı bir durum ortaya çıkabilir. Bu durumların her ikisi de, eksiklik ve fazlalık, doku hasarına ve hastalığa yol açabilir. Bununla birlikte, homeostatik düzenleme nedeniyle, insan vücudu sağlıklı bireylerin ihtiyaçları için çok çeşitli bakır alımlarını dengeleme yeteneğine sahiptir. ⓘ
Bakır homeostazının birçok yönü moleküler düzeyde bilinmektedir. Bakırın vazgeçilmezliği, oksidasyon durumu Cu1+(bakır) ve Cu2+(bakır) arasında değişirken bir elektron vericisi veya alıcısı olarak hareket etme kabiliyetinden kaynaklanmaktadır. Yaklaşık bir düzine kuproenzimin bir bileşeni olarak bakır, mitokondriyal solunum, melanin sentezi ve kolajenin çapraz bağlanması gibi temel metabolik süreçlerde anahtar redoks (yani, oksidasyon-redüksiyon) reaksiyonlarında yer alır. Bakır, antioksidan enzim bakır-çinko süperoksit dismutazın ayrılmaz bir parçasıdır ve seruloplazminde bir kofaktör olarak demir homeostazında bir role sahiptir. ⓘ
Kan gazı seviyeleri
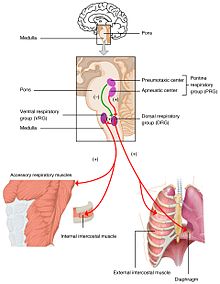
Oksijen, karbondioksit ve plazma pH seviyelerindeki değişiklikler beyin sapındaki solunum merkezine gönderilir ve burada düzenlenir. Arteriyel kandaki kısmi oksijen ve karbondioksit basıncı, karotid arter ve aortik arktaki periferik kemoreseptörler (PNS) tarafından izlenir. Kısmi karbondioksit basıncındaki bir değişiklik, beyin sapının medulla oblongatasındaki merkezi kemoreseptörler (CNS) tarafından beyin omurilik sıvısında değişen pH olarak algılanır. Bu sensör setlerinden gelen bilgiler, efektör organları (diyafram ve diğer solunum kasları) aktive eden solunum merkezine gönderilir. Kandaki karbondioksit seviyesinin artması veya oksijen seviyesinin azalması, daha derin bir nefes alma düzenine ve kan gazlarını dengeye getirmek için solunum hızının artmasına neden olur. ⓘ
Kanda çok az karbondioksit ve daha az oranda da çok fazla oksijen bulunması solunumu geçici olarak durdurabilir; bu durum apne olarak bilinir ve serbest dalıcıların su altında kalabilecekleri süreyi uzatmak için kullandıkları bir yöntemdir. ⓘ
Karbondioksitin kısmi basıncı pH'ın izlenmesinde daha belirleyici bir faktördür. Ancak, yüksek irtifada (2500 m'nin üzerinde) kısmi oksijen basıncının izlenmesi öncelik kazanır ve hiperventilasyon oksijen seviyesini sabit tutar. Düşük karbondioksit seviyesi ile pH'ı 7,4'te tutmak için böbrekler kana hidrojen iyonları salgılar ve idrarla bikarbonat atar. Bu, yüksek irtifaya alışma sürecinde önemlidir. ⓘ
Homeostazı etkileyen faktörler
Hücrelere zarar veren etkenler -ne türden olursa olsun- önce hücrelerin işlevlerini daha sonra da morfolojik yapılarını bozarak hastalıklara yol açarlar. Kimi olgularda etyolojik faktörleri ve patogenez sürecini bilemeyiz; bu tür hastalıklara “primer” ya da “idiopatik” nitelemesi yapılır. ⓘ
• Oksijen yoksunluğu sendromları (hipoksi, iskemi) ⓘ
Oksijen yoksunluğunun hücrelerdeki ilk etkisi aerobik işlevlerin bozulması sonucu ATP (adenosine triphosphate) üretiminin aksamasıdır. Özellikle oksijensizlik durumunun tam olduğu olgularda hücre ölümü genellikle kaçınılmazdır. Örnekler; ⓘ
İskemi: hücrelerin, yerel dolaşım bozukluğu nedeniyle ortaya çıkan oksijensizliği ⓘ
Dolaşım ve/veya solunum sistemi yetmezliği kökenli oksijen açlığı: hücrelerin oksijenlenmesinde genel yetersizlik ⓘ
Eritrosit kökenli oksijen açlığı: eritrositlerin oksijen taşıma kapasitesinin azalması/yitirilmesi (anemi, CO zehirlenmesi) ⓘ
• Fiziksel nedenler: travmalar, mekanik yüklenmeler, ısı değişiklikleri (soğuk/sıcak etkisi), radyasyon, elektrik akımı ⓘ
• Kimyasal maddeler: tıbbi ilaçlar, zehirler, alkol, narkotik maddeler, tütün ürünleri, çevre kirlenmesi ⓘ
• Canlı etkenler: bakteriler, virüsler, mantarlar, parazitler ⓘ
• İmmunolojik reaksiyonlar: otoimmun hastalıklar, canlı etkenlere karşı gelişen immunolojik tepkiler, aşırıduyarlık tepkileri ⓘ
• Genetik bozukluklar: kromozom etkilenmeleri, özgün gen mutasyonları ⓘ
• Beslenme bozuklukları: protein-kalori yetmezliği, vitamin eksiklikleri, dengesiz beslenme (obezite) ⓘ
Böbrekler, arteriyel kandaki kısmi oksijen basıncı yerine oksijen içeriğini ölçer. Kanın oksijen içeriği kronik olarak düşük olduğunda, oksijene duyarlı hücreler kana eritropoietin (EPO) salgılar. Efektör doku, kırmızı kan hücreleri (RBC'ler) (eritrositler) üreten kırmızı kemik iliğidir. RBC'lerdeki artış, kandaki hematokritin artmasına ve ardından oksijen taşıma kapasitesini artıran hemoglobin artışına neden olur. Bu, yüksek irtifada yaşayanların deniz seviyesinde yaşayanlara göre daha yüksek hematokrit değerlerine sahip olmasının ve ayrıca akciğer yetmezliği veya kalpte sağdan sola şant (venöz kanın akciğerleri by-pass ederek doğrudan sistemik dolaşıma geçtiği) olan kişilerin benzer şekilde yüksek hematokrit değerlerine sahip olmasının mekanizmasıdır. ⓘ
Kandaki kısmi oksijen basıncı ne olursa olsun, taşınabilen oksijen miktarı hemoglobin içeriğine bağlıdır. Örneğin anemide kısmi oksijen basıncı yeterli olabilir, ancak hemoglobin içeriği yetersiz olacak ve ardından oksijen içeriği de azalacaktır. Yeterli miktarda demir, B12 vitamini ve folik asit verildiğinde, EPO RBC üretimini uyarabilir ve hemoglobin ve oksijen içeriği normale döner. ⓘ
Arteriyel kan basıncı
Beyin, arterlerin vazokonstriksiyonu ve vazodilatasyonu yoluyla bir dizi kan basıncı değerinde kan akışını düzenleyebilir. ⓘ
Aortik ark ve karotis sinüs (iç karotis arterinin başlangıcında) duvarlarındaki baroreseptör adı verilen yüksek basınç reseptörleri arteriyel kan basıncını izler. Kan hacmindeki artış nedeniyle arterlerin duvarları gerildiğinde yükselen basınç algılanır. Bu da kalp kası hücrelerinin kana atriyal natriüretik peptid (ANP) hormonu salgılamasına neden olur. Bu hormon böbreklere etki ederek renin ve aldosteron salgılanmasını engeller, sodyum ve beraberindeki suyun idrara salınmasına neden olur ve böylece kan hacmini azaltır. Bu bilgi daha sonra afferent sinir lifleri aracılığıyla medulla oblongata'daki soliter çekirdeğe iletilir. Buradan otonom sinir sistemine ait motor sinirler uyarılarak başta kalp olmak üzere arteriyol adı verilen en küçük çaplı arterlerin aktivitesini etkiler. Arteriyoller arter ağacındaki ana direnç damarlarıdır ve çaplarındaki küçük değişiklikler içlerinden geçen akıma karşı dirençte büyük değişikliklere neden olur. Arteriyel kan basıncı yükseldiğinde arteriyoller genişlemek üzere uyarılır, böylece kanın arterleri terk etmesi kolaylaşır, böylece arterlerin havası iner ve kan basıncı normale döner. Aynı zamanda, kalp kolinerjik parasempatik sinirler aracılığıyla daha yavaş atması için uyarılır (bradikardi olarak adlandırılır), bu da arterlere kan girişinin azalmasını sağlar, böylece basınçtaki azalmaya ve orijinal hatanın düzeltilmesine katkıda bulunur. ⓘ
Arterlerdeki düşük basınç, arteriyollerin daralması ve kalp atış hızının artması (taşikardi olarak adlandırılır) gibi ters bir reflekse neden olur. Kan basıncındaki düşüş çok hızlı veya aşırı ise, medulla oblongata "preganglionik" sempatik sinirler aracılığıyla adrenal medullayı uyararak kana epinefrin (adrenalin) salgılamasını sağlar. Bu hormon taşikardiyi artırır ve vücuttaki temel organlar (özellikle kalp, akciğerler ve beyin) hariç tüm arteriyollerde ciddi vazokonstriksiyona neden olur. Bu reaksiyonlar genellikle düşük arteriyel kan basıncını (hipotansiyon) çok etkili bir şekilde düzeltir. ⓘ
Kalsiyum seviyeleri

Plazma iyonize kalsiyum (Ca2+) konsantrasyonu bir çift homeostatik mekanizma tarafından çok sıkı bir şekilde kontrol edilir. Birincisinin sensörü paratiroid bezlerinde bulunur ve burada baş hücreler membranlarındaki özel kalsiyum reseptörleri aracılığıyla Ca2+ seviyesini algılar. İkincisinin sensörleri ise tiroid bezindeki parafoliküler hücrelerdir. Paratiroid baş hücreleri plazma iyonize kalsiyum seviyesindeki düşüşe yanıt olarak paratiroid hormonu (PTH) salgılar; tiroid bezinin parafoliküler hücreleri ise plazma iyonize kalsiyum seviyesindeki artışa yanıt olarak kalsitonin salgılar. ⓘ
İlk homeostatik mekanizmanın efektör organları kemikler, böbrek ve kandaki yüksek PTH seviyelerine yanıt olarak böbrek tarafından kana salınan bir hormon aracılığıyla duodenum ve jejunumdur. Paratiroid hormonu (kanda yüksek konsantrasyonlarda) kemik rezorpsiyonuna neden olarak plazmaya kalsiyum salar. Bu, tehdit edici bir hipokalsemiyi dakikalar içinde düzeltebilen çok hızlı bir eylemdir. Yüksek PTH konsantrasyonları idrar yoluyla fosfat iyonlarının atılmasına neden olur. Fosfatlar kalsiyum iyonlarıyla birleşerek çözünmeyen tuzlar oluşturduğundan (ayrıca bkz. kemik minerali), kandaki fosfat seviyesinin düşmesi, plazma iyonize kalsiyum havuzuna serbest kalsiyum iyonlarının salınmasını sağlar. PTH'nin böbrekler üzerinde ikinci bir etkisi vardır. Böbrekler tarafından kalsitriol üretimini ve kana salınımını uyarır. Bu steroid hormon üst ince bağırsağın epitel hücrelerine etki ederek bağırsak içeriğinden kana kalsiyum emme kapasitelerini artırır. ⓘ
İkinci homeostatik mekanizma, tiroid bezindeki sensörleriyle, kandaki iyonize kalsiyum yükseldiğinde kana kalsitonin salgılar. Bu hormon öncelikle kemik üzerinde etki göstererek kalsiyumun kandan hızla uzaklaştırılmasına ve çözünmez formda kemiklerde birikmesine neden olur. ⓘ
Bir yandan PTH ve diğer yandan kalsitonin aracılığıyla çalışan iki homeostatik mekanizma, plazma iyonize kalsiyum seviyesindeki herhangi bir yaklaşan hatayı ya kalsiyumu kandan alıp iskelette biriktirerek ya da iskeletten kalsiyumu uzaklaştırarak çok hızlı bir şekilde düzeltebilir. İskelet, plazma kalsiyum deposuna (yaklaşık 180 mg) kıyasla son derece büyük bir kalsiyum deposu (yaklaşık 1 kg) görevi görür. Daha uzun vadeli düzenleme, kalsiyum emilimi veya bağırsaktan kayıp yoluyla gerçekleşir. ⓘ
Bir başka örnek de, CB1 ve/veya CB2 ve bitişik reseptörlerin aktivasyonu yoluyla hücre büyümesini ve göçünü önleyen varsayılan koruyucu mekanizmalar yoluyla homeostazı sağlamak ve tümör gelişimini önlemek için hücre içi kalsiyum seviyelerindeki artışa yanıt olarak aktive edilen bir dizi hücre içi enzimin etkisiyle sentezi gerçekleşen anandamid (N-araşidonoiletanolamid; AEA) ve 2-araşidonoilgliserol (2-AG) gibi en iyi karakterize edilen endokannabinoidlerdir. ⓘ
Sodyum konsantrasyonu
Plazma sodyum konsantrasyonunu kontrol eden homeostatik mekanizma, bu sayfada açıklanan diğer homeostatik mekanizmaların çoğundan daha karmaşıktır. ⓘ
Sensör, plazma sodyum konsantrasyonunu şaşırtıcı derecede dolaylı bir şekilde algılayan böbreklerin juxtaglomerular aparatında yer alır. Bu hücreler doğrudan jukstaglomerüler hücrelerden geçen kandaki sodyum konsantrasyonunu ölçmek yerine, proksimal kıvrımlı tübül ve Henle halkasında belirli bir miktar değişikliğe uğradıktan sonra renal tübüler sıvıdaki sodyum konsantrasyonuna yanıt verir. Bu hücreler aynı zamanda normal şartlar altında arteriyel kan basıncıyla doğru orantılı olan ve bu dokuyu yardımcı bir arteriyel kan basıncı sensörü haline getiren juxtaglomerular aparattan geçen kan akış hızına da yanıt verir. ⓘ
Plazma sodyum konsantrasyonunun düşmesine veya arteriyel kan basıncının azalmasına yanıt olarak jukstaglomerüler hücreler kana renin salgılar. Renin, anjiyotensinojen adı verilen bir plazma α-2-globulininden bir dekapeptidi (10 amino asit uzunluğunda kısa bir protein zinciri) parçalayan bir enzimdir. Bu dekapeptit anjiyotensin I olarak bilinir ve bilinen bir biyolojik aktivitesi yoktur. Ancak kan akciğerlerde dolaşırken anjiyotensin dönüştürücü enzim (ACE) adı verilen bir pulmoner kapiller endotelyal enzim anjiyotensin I'den iki amino asit daha ayırarak anjiyotensin II olarak bilinen bir oktapeptit oluşturur. Anjiyotensin II, adrenal korteks üzerinde etkili olan ve steroid hormonu aldosteronun kana salınmasına neden olan bir hormondur. Anjiyotensin II ayrıca arteriyollerin duvarlarındaki düz kaslara etki ederek bu küçük çaplı damarların daralmasına neden olur, böylece arter ağacından kan çıkışını kısıtlayarak arteriyel kan basıncının yükselmesine neden olur. Dolayısıyla bu, yukarıda ("Arteriyel kan basıncı" başlığı altında) açıklanan ve arteriyel kan basıncını değişikliklere, özellikle de hipotansiyona karşı koruyan önlemleri güçlendirir. ⓘ
Böbreküstü bezlerinin zona glomerulozasından salınan anjiyotensin II ile uyarılmış aldosteron, özellikle distal kıvrımlı tübüllerin epitel hücreleri ve böbreklerin toplayıcı kanalları üzerinde etkilidir. Burada, idrar yoluyla vücuttan çıkmak üzere kan plazmasından tübüler sıvıya salgılanan potasyum iyonları karşılığında renal tübüler sıvıdan sodyum iyonlarının geri emilimine neden olur. Böbrek tübüler sıvısından sodyum iyonlarının geri emilimi vücuttan daha fazla sodyum iyonu kaybını durdurur ve böylece hiponatreminin kötüleşmesini önler. Hiponatremi sadece diyette tuz tüketimi ile düzeltilebilir. Ancak hiponatreminin bir "tuz açlığını" başlatıp başlatmayacağı ya da bunun hangi mekanizma ile ortaya çıkabileceği kesin değildir. ⓘ
Plazma sodyum iyonu konsantrasyonu normalden yüksek olduğunda (hipernatremi), juxtaglomerular aparattan renin salınımı durur, anjiyotensin II üretimi ve bunun sonucunda kana aldosteron salınımı durur. Böbrekler sodyum iyonlarını idrarla atarak yanıt verir ve böylece plazma sodyum iyonu konsantrasyonunu normalleştirir. Kandaki düşük anjiyotensin II seviyeleri, kaçınılmaz olarak eşlik eden bir yanıt olarak arteriyel kan basıncını düşürür. ⓘ
Kandaki yüksek aldosteron seviyelerinin bir sonucu olarak tübüler sıvıdan sodyum iyonlarının geri emilimi, kendi başına böbrek tübüler suyunun distal kıvrımlı tübüllerden veya toplayıcı kanallardan kana geri dönmesine neden olmaz. Bunun nedeni sodyumun potasyum karşılığında geri emilmesi ve bu nedenle kan ile tübüler sıvı arasındaki ozmotik gradyanda yalnızca mütevazı bir değişikliğe neden olmasıdır. Ayrıca, distal kıvrımlı tübüllerin ve toplayıcı kanalların epiteli, kanda antidiüretik hormon (ADH) yokluğunda suya karşı geçirimsizdir. ADH sıvı dengesinin kontrolünün bir parçasıdır. Kandaki seviyeleri, beynin hipotalamusunda ölçülen plazmanın osmolalitesine göre değişir. Aldosteronun böbrek tübülleri üzerindeki etkisi hücre dışı sıvıya (ECF) sodyum kaybını önler. Dolayısıyla ECF'nin ozmolalitesinde bir değişiklik olmaz ve dolayısıyla plazmanın ADH konsantrasyonunda da bir değişiklik olmaz. Bununla birlikte, düşük aldosteron seviyeleri ECF'den sodyum iyonlarının kaybına neden olur, bu da potansiyel olarak hücre dışı ozmolalitede ve dolayısıyla kandaki ADH seviyelerinde bir değişikliğe neden olabilir. ⓘ
Potasyum konsantrasyonu
Plazmadaki yüksek potasyum konsantrasyonları, adrenal korteksin dış tabakasındaki zona glomerulosa hücrelerinin membranlarının depolarizasyonuna neden olur. Bu da aldosteronun kana salınmasına neden olur. ⓘ
Aldosteron öncelikle böbreklerin distal kıvrımlı tübüllerine ve toplayıcı kanallarına etki ederek potasyum iyonlarının idrarla atılımını uyarır. Ancak bunu, tübüler epitel hücrelerinin bazolateral Na+/K+ pompalarını aktive ederek yapar. Bu sodyum/potasyum değiştiriciler üç sodyum iyonunu hücre dışına, interstisyel sıvıya ve iki potasyum iyonunu da interstisyel sıvıdan hücre içine pompalar. Bu, sodyum (Na+) iyonlarının tübüler sıvıdan kana geri emilimiyle ve potasyum (K+) iyonlarının kandan idrara (toplayıcı kanal lümeni) salgılanmasıyla sonuçlanan bir iyonik konsantrasyon gradyanı oluşturur. ⓘ
Sıvı dengesi
Vücuttaki toplam su miktarının dengede tutulması gerekir. Sıvı dengesi, sıvı hacminin sabit tutulmasını ve ayrıca hücre dışı sıvıdaki elektrolit seviyelerinin sabit tutulmasını içerir. Sıvı dengesi osmoregülasyon süreci ve davranışlarla sağlanır. Osmotik basınç, hipotalamustaki medyan preoptik çekirdekteki osmoreseptörler tarafından tespit edilir. Vücudun su içeriğinin bir göstergesi olarak plazma osmolalitesinin ölçümü, vücuttan su kayıplarının (tamamen su geçirmez olmayan ve bu nedenle her zaman hafif nemli olan deriden kaçınılmaz su kaybı, solunan havadaki su buharı, terleme, kusma, normal dışkı ve özellikle ishal yoluyla) hepsinin hipotonik olduğu, yani vücut sıvılarından daha az tuzlu olduğu gerçeğine dayanır (örneğin tükürüğün tadını gözyaşınınkiyle karşılaştırın. İkincisi hücre dışı sıvıyla neredeyse aynı tuz içeriğine sahipken, ilki plazmaya göre hipotoniktir. Tükürüğün tadı tuzlu değildir, oysa gözyaşları kesinlikle tuzludur). Bu nedenle neredeyse tüm normal ve anormal vücut suyu kayıpları hücre dışı sıvının hipertonik hale gelmesine neden olur. Tersine, aşırı sıvı alımı hücre dışı sıvıyı seyrelterek hipotalamusun hipotonik hiponatremi durumlarını kaydetmesine neden olur. ⓘ
Hipotalamus hipertonik bir hücre dışı ortam tespit ettiğinde, bu durumda böbrek olan efektör organ üzerinde etkili olan vazopressin adı verilen bir antidiüretik hormonun (ADH) salgılanmasına neden olur. Vazopressinin böbrek tübülleri üzerindeki etkisi, distal kıvrımlı tübüllerden ve toplayıcı kanallardan suyu geri emmek ve böylece idrar yoluyla su kaybının artmasını önlemektir. Hipotalamus aynı anda yakındaki susuzluk merkezini uyararak neredeyse karşı konulamaz (hipertonisite yeterince şiddetliyse) bir su içme dürtüsüne neden olur. İdrar akışının kesilmesi hipovolemi ve hipertonisitenin daha da kötüleşmesini önler; su içmek kusuru düzeltir. ⓘ
Hipo-osmolalite çok düşük plazma ADH seviyeleri ile sonuçlanır. Bu da böbrek tübüllerinden su geri emiliminin engellenmesine yol açarak yüksek hacimlerde çok seyreltik idrar atılmasına ve böylece vücuttaki fazla suyun atılmasına neden olur. ⓘ
Vücut su homeostatı sağlam olduğunda idrarla su kaybı, vücuttaki su fazlalığını düzelten telafi edici bir su kaybıdır. Bununla birlikte, böbrekler su üretemediğinden, susama refleksi vücut su homeostatının çok önemli ikinci efektör mekanizmasıdır ve vücuttaki herhangi bir su açığını düzeltir. ⓘ
Kan pH'ı
Plazma pH'ı, kısmi karbondioksit basıncındaki solunum değişiklikleri ile değiştirilebilir; veya karbonik asit-bikarbonat iyonu oranındaki metabolik değişikliklerle değiştirilebilir. Bikarbonat tampon sistemi karbonik asidin bikarbonata oranını 1:20'ye eşit olacak şekilde düzenler, bu oranda kan pH'ı 7,4'tür (Henderson-Hasselbalch denkleminde açıklandığı gibi). Plazma pH'sındaki bir değişiklik asit-baz dengesizliği yaratır. Asit-baz homeostazında pH'ın düzenlenmesine yardımcı olabilecek iki mekanizma vardır. Solunum merkezinin bir mekanizması olan solunum kompanzasyonu, pH'ı normale döndürmek için solunum hızını ve derinliğini değiştirerek kısmi karbondioksit basıncını ayarlar. Karbondioksitin kısmi basıncı karbonik asit konsantrasyonunu da belirler ve bikarbonat tampon sistemi de devreye girebilir. Renal kompanzasyon bikarbonat tampon sistemine yardımcı olabilir. Plazma bikarbonat konsantrasyonu için sensör kesin olarak bilinmemektedir. Distal kıvrımlı tübüllerin renal tübüler hücrelerinin plazma pH'ına duyarlı olması çok muhtemeldir. Bu hücrelerin metabolizması karbondioksit üretir ve bu da karbonik anhidrazın etkisiyle hızla hidrojen ve bikarbonata dönüştürülür. ECF pH'ı düştüğünde (daha asidik hale geldiğinde) renal tübüler hücreler hidrojen iyonlarını idrar yoluyla vücudu terk etmek üzere tübüler sıvıya salgılar. Bikarbonat iyonları aynı anda kana salgılanarak karbonik asidi azaltır ve sonuç olarak plazma pH'ını yükseltir. Plazma pH'ı normalin üzerine çıktığında ise tam tersi olur: bikarbonat iyonları idrarla atılır ve hidrojen iyonları plazmaya salınır. ⓘ
Hidrojen iyonları idrarla, bikarbonat ise kanla atıldığında, böbrekleri bu işlemi gerçekleştirmeleri için uyaran plazmadaki fazla hidrojen iyonlarıyla birleşir. Plazmada ortaya çıkan reaksiyon, karbondioksitin plazma kısmi basıncı ile dengede olan karbonik asit oluşumudur. Bu, aşırı karbonik asit veya bikarbonat birikimi olmamasını sağlamak için sıkı bir şekilde düzenlenir. Dolayısıyla genel etki, plazma pH'ı düştüğünde hidrojen iyonlarının idrarla kaybedilmesidir. Plazma bikarbonatındaki eşzamanlı artış, artan hidrojen iyonlarını (plazma pH'sındaki düşüşün neden olduğu) temizler ve ortaya çıkan fazla karbonik asit, akciğerlerde karbondioksit olarak atılır. Bu da bikarbonat ile kısmi karbondioksit basıncı ve dolayısıyla plazma pH'ı arasındaki normal oranı geri getirir. Yüksek plazma pH'ı böbrekleri kana hidrojen iyonları salgılamaları ve idrarla bikarbonat atmaları için uyardığında ise tam tersi olur. Hidrojen iyonları plazmadaki fazla bikarbonat iyonlarıyla birleşerek bir kez daha fazla karbonik asit oluşturur ve bu da akciğerlerde karbondioksit olarak dışarı atılarak plazma bikarbonat iyonu konsantrasyonunu, kısmi karbondioksit basıncını ve dolayısıyla plazma pH'ını sabit tutar. ⓘ
Beyin omurilik sıvısı
Beyin omurilik sıvısı (BOS), beyin hücreleri arasındaki madde dağılımının ve nöroendokrin faktörlerin düzenlenmesini sağlar; bu faktörlerdeki küçük değişiklikler sinir sisteminde sorunlara veya hasara neden olabilir. Örneğin, yüksek glisin konsantrasyonu sıcaklık ve kan basıncı kontrolünü bozar ve yüksek BOS pH'ı baş dönmesi ve senkopa neden olur. ⓘ
Nörotransmisyon
Merkezi sinir sistemindeki inhibitör nöronlar, uyarma ve inhibisyon arasındaki nöronal aktivite dengesinde homeostatik bir rol oynar. GABA kullanan inhibitör nöronlar, nöronal ağlarda telafi edici değişiklikler yaparak aşırı uyarım seviyelerini önler. Uyarma ve inhibisyon arasındaki dengesizliğin bir dizi nöropsikiyatrik bozuklukta rol oynadığı görülmektedir. ⓘ
Nöroendokrin sistem
Nöroendokrin sistem, hipotalamusun homeostazı koruduğu, metabolizmayı, üremeyi, yeme ve içme davranışını, enerji kullanımını, osmolariteyi ve kan basıncını düzenlediği mekanizmadır. ⓘ
Metabolizmanın düzenlenmesi, diğer bezlerle hipotalamik bağlantılar tarafından gerçekleştirilir. Hipotalamik-hipofiz-gonadal eksenin (HPG ekseni) üç endokrin bezi genellikle birlikte çalışır ve önemli düzenleyici işlevlere sahiptir. Diğer iki düzenleyici endokrin eksen hipotalamik-hipofiz-adrenal eksen (HPA ekseni) ve hipotalamik-hipofiz-tiroid eksenidir (HPT ekseni). ⓘ
Karaciğerin ayrıca metabolizmayı düzenleyici birçok işlevi vardır. Önemli bir işlev safra asitlerinin üretimi ve kontrolüdür. Çok fazla safra asidi hücreler için toksik olabilir ve sentezi bir nükleer reseptör olan FXR'nin aktivasyonu ile inhibe edilebilir. ⓘ
Gen düzenlemesi
Hücresel düzeyde homeostaz, değişikliklere yanıt olarak genlerin aktivitesini değiştirebilen transkripsiyonel düzenleme de dahil olmak üzere çeşitli mekanizmalarla gerçekleştirilir. ⓘ
Enerji dengesi
Beslenme yoluyla alınan enerji miktarının kullanılan enerji miktarıyla eşleşmesi gerekir. Enerji homeostazını sağlamak için iştah, grehlin ve leptin olmak üzere iki hormon tarafından düzenlenir. Grehlin açlığı ve gıda alımını uyarır, leptin ise tokluk (tokluk) sinyali verir. ⓘ
Diyet, egzersiz ve aşırı yeme dahil olmak üzere kilo değiştirme müdahalelerine ilişkin 2019 yılında yapılan bir inceleme, vücut ağırlığı homeostazının kısa vadede "enerjik hataları", yani kalori kaybını veya kazanımını tam olarak düzeltemediğini ortaya koymuştur. ⓘ
Klinik önemi
Birçok hastalık homeostatik bir bozukluğun sonucudur. Neredeyse tüm homeostatik bileşenler, kalıtsal bir kusur, doğuştan gelen bir metabolizma hatası veya edinilmiş bir hastalık sonucu arızalanabilir. Bazı homeostatik mekanizmalar, bir bileşenin arızalanması halinde yaşamın hemen tehdit altına girmemesini sağlayan dahili fazlalıklara sahiptir; ancak bazen homeostatik bir arıza, tedavi edilmezse ölümcül olabilen ciddi hastalıklarla sonuçlanabilir. Homeostatik arızanın iyi bilinen bir örneği tip 1 diabetes mellitus'ta görülmektedir. Burada pankreas adacıklarının beta hücreleri tahrip olduğu ve gerekli insülini üretemediği için kan şekeri regülasyonu işlevini yerine getiremez. Kan şekeri hiperglisemi olarak bilinen bir durumda yükselir. ⓘ
Plazma iyonize kalsiyum homeostatı, bir paratiroid adenomu tarafından sürekli, değişmeyen, aşırı paratiroid hormonu üretimi ile bozulabilir ve hiperparatiroidizmin tipik özellikleri olan yüksek plazma iyonize Ca2+ seviyeleri ve spontan kırıklara yol açabilen kemik erimesi ile sonuçlanabilir. Anormal derecede yüksek plazma iyonize kalsiyum konsantrasyonları birçok hücre yüzeyi proteininde (özellikle iyon kanalları ve hormon veya nörotransmitter reseptörleri) konformasyonel değişikliklere neden olarak letarji, kas güçsüzlüğü, anoreksi, kabızlık ve kararsız duygulara yol açar. ⓘ
Vücut su homeostatı, solunan hava, dışkı ve duyarsız terleme yoluyla normal günlük su kayıplarına bile yanıt olarak ADH salgılayamama nedeniyle tehlikeye girebilir. Sıfır kan ADH sinyali alındığında, böbrekler değişmeyen büyük hacimlerde çok seyreltik idrar üretir ve tedavi edilmezse dehidrasyona ve ölüme neden olur. ⓘ
Organizmalar yaşlandıkça, kontrol sistemlerinin verimliliği azalır. Yetersizlikler giderek hastalık riskini artıran ve yaşlanmayla ilişkili fiziksel değişikliklere yol açan dengesiz bir iç ortamla sonuçlanır. ⓘ
Çeşitli kronik hastalıklar, bir sorunu başka bir şekilde telafi ederek (telafi ederek) maskeleyen homeostatik telafi ile kontrol altında tutulur. Ancak, telafi mekanizmaları eninde sonunda yıpranır veya yeni bir komplikasyon faktörü (eş zamanlı bir akut viral enfeksiyonun ortaya çıkması gibi) tarafından bozulur ve bu da vücudu yeni bir olaylar dizisi ile sarsar. Bu tür bir dekompansasyon altta yatan hastalığın maskesini düşürerek semptomlarını kötüleştirir. Yaygın örnekler arasında dekompanse kalp yetmezliği, böbrek yetmezliği ve karaciğer yetmezliği yer alır. ⓘ
Biyosfer
Gaia hipotezinde James Lovelock, Dünya'daki (veya yaşam olan herhangi bir gezegendeki) tüm canlı madde kütlesinin, kendi hayatta kalması için gerekli çevresel koşulları üretmek üzere gezegensel çevresini aktif olarak değiştiren geniş bir homeostatik süper organizma olarak işlev gördüğünü belirtmiştir. Bu görüşe göre, tüm gezegen çeşitli homeostazları sürdürmektedir (birincisi sıcaklık homeostazıdır). Bu tür bir sistemin Dünya'da mevcut olup olmadığı tartışmaya açıktır. Bununla birlikte, bazı nispeten basit homeostatik mekanizmalar genel olarak kabul görmektedir. Örneğin, bazen atmosferik karbondioksit seviyeleri yükseldiğinde, bazı bitkilerin daha iyi büyüyebileceği ve böylece atmosferden daha fazla karbondioksit uzaklaştırmak için hareket edebileceği iddia edilmektedir. Ancak, ısınma kuraklıkları şiddetlendirerek suyu karadaki asıl sınırlayıcı faktör haline getirmiştir. Güneş ışığı bol olduğunda ve atmosferik sıcaklık yükseldiğinde, küresel güneş ışığı ve dolayısıyla ısı sensörleri olarak hareket eden okyanus yüzey sularındaki fitoplanktonların gelişebileceği ve daha fazla dimetil sülfür (DMS) üretebileceği iddia edilmiştir. DMS molekülleri, daha fazla bulut üreten bulut yoğunlaşma çekirdekleri olarak hareket eder ve böylece atmosferik albedoyu arttırır ve bu da atmosferin sıcaklığını düşürmek için geri beslenir. Ancak artan deniz sıcaklığı okyanusları tabakalaştırarak sıcak, güneşli suları serin, besin açısından zengin sulardan ayırmıştır. Böylece, besinler sınırlayıcı faktör haline geldi ve plankton seviyeleri son 50 yılda yükselmek yerine düştü. Bilim insanları Dünya hakkında daha fazla şey keşfettikçe, bazen çok geniş bir çevresel koşullar aralığında, birlikte metastabil bir durumu sürdüren çok sayıda pozitif ve negatif geri besleme döngüsü keşfedilmektedir. ⓘ
Tahmini
Öngörüsel homeostaz, bir yemeğe yanıt olarak kana karışan bağırsak hormonları tarafından insülin salgılanmasının uyarılması gibi, gelecekte beklenen bir zorluğa karşı öngörüsel bir yanıttır. Bu insülin salgılanması, kan şekeri seviyesi yükselmeden önce gerçekleşir ve bağırsaktaki karbonhidratların sindiriminden kaynaklanan büyük bir glikoz akışının beklentisiyle kan şekeri seviyesini düşürür. Bu tür öngörüsel tepkiler, esasen "tahmine" dayanan ve kendi kendini düzeltmeyen açık döngü sistemlerdir. Beklenti tepkileri, beklenti sistemlerinin eğilimli olduğu 'aşırı çekim' ve 'düşük çekim' durumlarını düzeltmek için her zaman bir kapalı döngü negatif geri besleme sistemi gerektirir. ⓘ
Diğer alanlar
Bu terim, örneğin diğer alanlarda da kullanılmaya başlanmıştır: ⓘ
Risk
Bir aktüer, (örneğin) kilitlenmeyi önleyici frenleri olan kişilerin, kilitlenmeyi önleyici frenleri olmayanlardan daha iyi bir güvenlik siciline sahip olmadıkları, çünkü birincisinin daha güvenli aracı daha az güvenli sürüş alışkanlıklarıyla bilinçsizce telafi ettiği risk homeostazına atıfta bulunabilir. Kilitlenmeyi önleyici frenlerin inovasyonundan önce, belirli manevralar korku ve kaçınma uyandıran küçük patinajlar içeriyordu: Şimdi ise kilitlenme önleyici sistem bu tür geri bildirimlerin sınırını değiştirmekte ve davranış kalıpları artık cezalandırıcı olmayan alana doğru genişlemektedir. Ekolojik krizlerin, belirli bir davranışın tehlikeli olduğu kanıtlanana veya dramatik sonuçlar ortaya çıkana kadar devam ettiği bir risk homeostazı örneği olduğu da öne sürülmüştür. ⓘ
Stres
Sosyologlar ve psikologlar stres homeostazından, bir nüfusun ya da bireyin belirli bir stres seviyesinde kalma eğiliminden, "doğal" stres seviyesinin yeterli olmaması durumunda genellikle yapay stresler üretmesinden bahsedebilirler. ⓘ
Postmodern bir kuramcı olan Jean-François Lyotard bu terimi, Postmodern Durum'da "homeostaz ilkesiyle yönetilen" olarak tanımladığı toplumsal "güç merkezlerine", örneğin daha önce kabul edilmiş normları istikrarsızlaştırdığı için bazen radikal yeni bir keşfi yıllarca görmezden gelen bilimsel hiyerarşiye uygulamıştır. ⓘ
Teknoloji
Bilinen teknolojik homeostatik mekanizmalar şunlardır:
- Bir termostat, bir sıcaklık sensörünün çıkışına yanıt olarak ısıtıcıları veya klimaları açıp kapatarak çalışır.
- Hız sabitleyici, hızdaki değişikliklere yanıt olarak bir arabanın gaz kelebeğini ayarlar.
- Bir otopilot, önceden ayarlanmış bir pusula yönünden veya rotadan sapmaya yanıt olarak bir uçağın veya geminin direksiyon kontrollerini çalıştırır.
- Bir kimya tesisi veya petrol rafinerisindeki proses kontrol sistemleri, ısıtıcıları, pompaları ve vanaları kontrol ederek sıvı seviyelerini, basınçları, sıcaklığı, kimyasal bileşimi vb. korur.
- James Watt tarafından 1788 yılında tasarlanan bir buhar makinesinin santrifüj regülatörü, motor hızındaki artışlara yanıt olarak gaz kelebeği valfini azaltır veya hız önceden ayarlanan oranın altına düşerse valfi açar. ⓘ
Toplum ve Kültür
Egemen gücün kullanımı, davranış kuralları, dini ve kültürel uygulamalar ve bir toplumdaki diğer dinamik süreçler, yaşamı düzenleyen ve bütünün güvenliğini iç ve dış dengesizliklerden veya tehlikelerden koruyan genel bir dengeyi sürdüren evrimleşmiş bir homeostatik sistemin parçası olarak tanımlanabilir. Sağlıklı yurttaşlık kültürlerinin, bireysel haklara saygı ile kamu yararı kaygısı ya da hükümetin etkinliği ile yurttaşların çıkarlarına duyarlılık arasındaki gerilimde olduğu gibi, birbiriyle çelişen çoklu kaygılar arasında optimal bir homeostatik denge sağladığı söylenebilir. ⓘ
Değişkenler
Hücre dengelerinin bozulmasında zedelenmesinin gücünü belirleyen değişkenler şunlardır:
- Etkene özgü değişkenler: etkenin türü, etki süresi, etkenin gücü
- Hücreye özgü değişkenler: hücrenin türü, hücrenin içinde bulunduğu evre, hücrenin uyum yeteneği ⓘ
Hücrelerin tepkileri
Homeostazın etkilendiği ortamlarda, hücrelerin verdikleri tepkiler 3 temel grupta toplanır:
