Kükürt
 | |||||||||||||||||||||||||||||||
| Görünüş | limon sarısı | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Standart atom ağırlığı Ar, std(S) | [32.059, 32.076] geleneksel: 32.06 | ||||||||||||||||||||||||||||||
| Periyodik tabloda kükürt | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Atom numarası (Z) | 16 | ||||||||||||||||||||||||||||||
| Grup | 16. grup (kalkojenler) | ||||||||||||||||||||||||||||||
| Periyot | 3. periyot | ||||||||||||||||||||||||||||||
| Blok | P bloku | ||||||||||||||||||||||||||||||
| Kategori | Reaktif ametal | ||||||||||||||||||||||||||||||
| Elektron dizilimi | [[[Neon|Ne]]] 3s2 3p4 | ||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 6 | ||||||||||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||||||||||
| Faz (SSB'de) | Katı | ||||||||||||||||||||||||||||||
| Erime noktası | 388,36 K (115,21 °C, 239,38 °F) | ||||||||||||||||||||||||||||||
| Kaynama noktası | 717,8 K (444,6 °C, 832,3 °F) | ||||||||||||||||||||||||||||||
| Yoğunluk (OS) |
Alfa: 2,07 g/cm3 Beta: 1,96 g/cm3 Gama: 1,92 g/cm3 | ||||||||||||||||||||||||||||||
| Yoğunluk sıvıyken (en'de) | 1,819 g/cm3 | ||||||||||||||||||||||||||||||
| Kritik nokta | 1314 K, 20,7 MPa | ||||||||||||||||||||||||||||||
| Erime ısısı | Mono: 1,727 kJ/mol | ||||||||||||||||||||||||||||||
| Buharlaşma ısısı | Mono: 45 kJ/mol | ||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 22,75 J/(mol·K) | ||||||||||||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||||||||||||
| Yükseltgenme durumları | -2, -1, 0, +1, +2, +3, +4, +5, +6 güçlü asidik | ||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2,58 | ||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 105±3 pm | ||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 180 pm | ||||||||||||||||||||||||||||||
| Elementin spektrum çizgileri | |||||||||||||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||||||||||||
| Kristal yapı | Ortorombik | ||||||||||||||||||||||||||||||
| Isı iletkenliği | 0,205 W/(m·K) (amorf) | ||||||||||||||||||||||||||||||
| Elektrik direnci | 2×1015 Ω·m (20 °C'de) (amorf) | ||||||||||||||||||||||||||||||
| Manyetik düzen | Diyamanyetik | ||||||||||||||||||||||||||||||
| Manyetik alınganlık | (α) -155×10-6 cm3/mol (298 K) | ||||||||||||||||||||||||||||||
| Hacim modülü | 7,7 GPa | ||||||||||||||||||||||||||||||
| Mohs setliği | 2,0 | ||||||||||||||||||||||||||||||
| CAS Numarası | 7704-34-9 | ||||||||||||||||||||||||||||||
| Tarihi | |||||||||||||||||||||||||||||||
| Keşif | Antik Çin'de (MÖ 2000 öncesi) | ||||||||||||||||||||||||||||||
| Element olarak tanınması | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||
| Ana izotopları | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Kükürt, simgesi S olan, limon sarısında ametal, yalın katı bir elementtir. ⓘ
Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en önemli kükürt yataklarının yer aldığı Sicilya, Louisiana ve Japonya'da eski volkanların yakınında, alçı taşı ya da kireç taşı katmanları arasında doğal halde bulunur. Çoğunlukla metallerle birleşmiş olarak görülür. Demir, bakır, kurşun ve çinko sülfürler, bu metallerin en önemli cevridir. Kalsiyum sülfatı ya da başka deyişle alçıtaşını saymak gerekir. ⓘ
Doğada çeşitli bileşikler halinde bulunan kükürt dahilen hafif laksatif olarak kullanılır. Dıştan sürüldüğü zaman (losyonlar, merhemler) asalakları öldürücü seboreyi giderici ve keratin eritici nitelikler gösterir. Pek çok maddelerin moleküllerinde bir ya da birçok kükürt atomu bulunur. Kükürdün varlığı bu maddelere sülfamit örneğinde olduğu gibi bakteri öldürücü özellikler kazandırır. ⓘ
Kükürt gidermek bir maddeyi bileşiminde bulunan kükürtten ya da bir sülfürden arındırmak (dökme demirde bulunan kükürt kireç ferromanganez ya da sodyum karbonat katılarak giderilir). Kükürt sütü bir asidin hiposültid üzerine etkimesi sonunda oluşan kolodal kükürt asıltısıdır. Çubuk kükürt, silindir biçiminde dökülmüş kükürttür. ⓘ
Hidrojenle kükürt giderme bir benzinin bir mazotun kükürdünü bir katalizör eşliğinde gidermek için hidrojen kullanan arıtma yöntemidir. Kükürt taşı aşırı derecede kükürtlenmiş şaraplarda duyulan hoşa gitmeyen taddır. ⓘ
Kükürt, antikçağda bilinen dokuz yalın cisimden biriydi. Kükürdün kimyasal bir element olduğu 1777'de Lavoisier'dan ortaya attı. 1810'a doğru Gay Lussac ile Thenard tarafından deneysel olarak doğrulandı. Kükürt tatsız, kokusuz bir katıdır, ısı ve elektriği iyi iletmez. Sıcak suya bir parça kükürt atıldığında hafif çatırtılar çıkar ısıtıldığında 113° dereceye doğru eriyerek açık sarı bir sıvı verir, bu sıvı daha yüksek sıcaklıkta ağdalı bir kıvama erişerek esmerleşir. 220° dereceye doğru kararır ve akışkanlığını yitirir. Daha sonra akışkanlığını yeniden kazanmasına karşın rengini korur ve 446,6° derecede kaynar buharının yoğunluğu sıcaklığa göre değişir. Kükürt molekülündeki atom sayısının değiştiğini de gösterir. Suda çözünmemesine karşın benzende hafifçe çözünür ama en önemli çözücüsü karbon sülfürdür. ⓘ
Kükürt kimyasal olarak oksijenle birçok benzerlik gösterir ve bileşmelerde oksijenin yerine geçer. Ama daha az elektronegatifdir; Metaller, oksijenle olduğu gibi kükürt buharında yanarak sülfürleri meydana getirir. Nitekim demir talaşı ve kükürt çiçeği hafifçe ısıtıldığında akkor hale gelerek yapay demir sülfürüne dönüşür. Kükürt oksijen ve halojenlere karşı elektropozitiftir. ⓘ

Kükürdün birçok kullanım alanı vardır. Ham kükürdün büyük bölümü, kükürt dioksit gazı, sülfürik asit, karbon sülfür, tiyosülfat vb. üretiminde kullanılır. Arı kükürt, kara barut ve havai fişeklerin bileşimine girer. Kükürtten ayrıca kibrit yapımında, kauçuğun kükürtlenmesinde, ebonit üretiminde yararlanılır. Bu aralarda bağlarda görülen külleme hastalığına karşı yapılan kükürtleme ile deri hastalıklarının tedavisinde kullanılan pomat ve şampuanların hazırlanmasında kükürtten yararlanıldığını özellikle belirtmek gerekir. Kükürt dioksit, amfizemin ve süreğen bronşitlerin oluşumunda önemli rol oynar, çocuklarda solunum hastalıklarının sayısını artırır. Bitkilerde oldukça kısa süreli temaslarda yaprak nekrozlarına neden olur. Daha düşük yoğunlukta, ama daha uzun süreli temaslarda metabolizma etkinliğinde azalma yapar. ⓘ
Kükürt, hem dahilen hem de haricen kullanılan bir halk ilacıdır. Uyuz ve egzamada mangal külüyle karıştırılan kükürt, zeytin yağıyla pomat yapılarak hasta bölgeye sürülür. Alerjiye karşı toz kükürt, leblebi unu ya da balla karıştırılarak hastaya yedirilir. Yanıklarda bir miktar kükürt kireçle karıştırılıp pomat haline getirilerek deriye sürülür. Kulak hastalıklarını sağaltmak için, çocuk düşürmek içinde kullanılır. Anadolu'nun bazı yörelerinde hayvan uyuzunda ve hayvanların mide bağırsak parazitlerini düşürmek üzere de dahilen kükürt kullanılır. ⓘ
Kükürt (veya İngiliz İngilizcesinde sülfür), S sembolüne ve 16 atom numarasına sahip kimyasal bir elementtir. Bol miktarda bulunur, çok değerlidir ve metalik değildir. Normal koşullar altında kükürt atomları, kimyasal formülü S8 olan döngüsel sekiz atomlu moleküller oluşturur. Elementel sülfür oda sıcaklığında parlak sarı, kristal bir katıdır. ⓘ
Kükürt, evrende kütlece en bol bulunan onuncu, Dünya'da ise en çok bulunan beşinci elementtir. Bazen saf, doğal formda bulunmasına rağmen, Dünya'daki kükürt genellikle sülfür ve sülfat mineralleri olarak ortaya çıkar. Doğal formda bol miktarda bulunan kükürt, antik çağlarda bilinmekteydi ve antik Hindistan, antik Yunan, Çin ve antik Mısır'daki kullanımlarından bahsedilmekteydi. Tarihsel olarak ve literatürde sülfür aynı zamanda "yanan taş" anlamına gelen kükürt olarak da adlandırılır. Günümüzde elementel sülfürün neredeyse tamamı, doğal gaz ve petrolden sülfür içeren kirleticilerin uzaklaştırılmasının bir yan ürünü olarak üretilmektedir. Elementin en büyük ticari kullanımı, sülfat ve fosfat gübreleri ve diğer kimyasal işlemler için sülfürik asit üretimidir. Kükürt kibritlerde, böcek ilaçlarında ve mantar ilaçlarında kullanılır. Birçok sülfür bileşiği kokuludur ve kokulu doğal gaz, kokarca kokusu, greyfurt ve sarımsak kokuları organosülfür bileşiklerinden kaynaklanmaktadır. Hidrojen sülfür, çürüyen yumurtalara ve diğer biyolojik süreçlere karakteristik kokuyu verir. ⓘ
Sülfür tüm yaşam için gerekli bir elementtir, ancak neredeyse her zaman organosülfür bileşikleri veya metal sülfürler şeklindedir. Amino asitler (iki proteinojenik: sistein ve metiyonin ve diğer birçok kodlanmamış: sistin, taurin, vb) ve iki vitamin (biyotin ve tiamin) yaşam için çok önemli organosülfür bileşikleridir. Glutatyon ve demir-sülfür proteinleri de dahil olmak üzere birçok kofaktör de sülfür içerir. Disülfitler, S-S bağları, dış deri, saç ve tüylerde bulunan (diğerlerinin yanı sıra) protein keratine mekanik güç ve çözünmezlik kazandırır. Kükürt, biyokimyasal işleyiş için gerekli olan temel kimyasal elementlerden biridir ve tüm canlı organizmalar için temel bir makro besin maddesidir. ⓘ
Özellikleri

Fiziksel özellikler
Kükürt birkaç poliatomik molekül oluşturur. En iyi bilinen allotrop oktasülfür, siklo-S8'dir. Siklo-S8'in nokta grubu D4d'dir ve dipol momenti 0 D'dir. Oktasülfür kokusuz, yumuşak, parlak sarı bir katıdır, ancak saf olmayan numuneler kibrit kokusuna benzer bir kokuya sahiptir. 115,21 °C'de (239,38 °F) erir, 444,6 °C'de (832,3 °F) kaynar ve kolayca süblimleşir. Erime sıcaklığının altında 95,2 °C'de (203,4 °F) siklo-oktasülfür, α-oktasülfürden β-polimorfuna dönüşür. S8 halkasının yapısı, moleküller arası etkileşimleri etkileyen bu faz değişimi ile neredeyse hiç değişmez. Erime ve kaynama sıcaklıkları arasında, oktasülfür tekrar allotropunu değiştirerek β-oktasülfürden γ-sülfüre dönüşür, buna yine daha düşük bir yoğunluk eşlik eder ancak polimer oluşumu nedeniyle viskozite artar. Daha yüksek sıcaklıklarda, depolimerizasyon gerçekleştikçe viskozite azalır. Erimiş sülfür 200 °C'nin (392 °F) üzerinde koyu kırmızı bir renk alır. Sülfürün yoğunluğu allotropa bağlı olarak yaklaşık 2 g/cm3'tür; kararlı allotropların tümü mükemmel elektrik yalıtkanlarıdır. ⓘ
Kükürt suda çözünmez ancak karbon disülfürde ve daha az oranda benzen ve toluen gibi polar olmayan diğer organik çözücülerde çözünür. ⓘ
Kimyasal özellikleri
Normal koşullar altında sülfür çok yavaş bir şekilde hidrolize olarak hidrojen sülfür ve sülfürik asit oluşturur:
- 1⁄2 S
8 + 4 H
2O → 3 H
2S + H
2SO
4
Reaksiyon protonların S üzerine adsorpsiyonunu içerir
8 kümeleri, ardından reaksiyon ürünlerine orantısızlık. ⓘ
Normal koĢullarda kükürt özellikle aktif maddelerle (flor) reaksiyona girer. ⓘ
Kükürtle ilişkili olarak oksidatif özelliklere sahip ametallerle (flor hariç) ve metallerin çoğuyla reaksiyonlar için, başlangıçta veya sürekli ısı girişi gereklidir. ⓘ
Kükürt havada mavi bir alevle yanar ve boğucu ve tahriş edici bir kokuya sahip olan kükürt dioksit oluşturur. ⓘ
Kükürt, konsantre güçlü asitler ve erimiş alkaliler ile sabit ısıtmada reaksiyona girer. ⓘ
Sülfürün ikinci, dördüncü ve altıncı iyonlaşma enerjileri sırasıyla 2252 kJ/mol-1, 4556 kJ/mol-1 ve 8495,8 kJ/mol-1'dir. Sülfürün oksidanlarla reaksiyonlarının ürünlerinin bileşimi (ve oksidasyon durumu), bir reaksiyondan açığa çıkan enerjinin bu eşikleri aşıp aşmadığına bağlıdır. Katalizörlerin uygulanması ve/veya dış enerji temini, kükürdün oksidasyon durumunu ve reaksiyon ürünlerinin bileşimini değiştirebilir. Normal koşullarda sülfür ve oksijen arasındaki reaksiyon sülfür dioksit (oksidasyon durumu +4) verirken, sülfür trioksit (oksidasyon durumu +6) oluşumu için 400 - 600 °C sıcaklık ve bir katalizörün varlığı gerekir. ⓘ
Kükürt nitrürler, oksitler, florürler, klorürler, bromürler (hepsi farklı bileşimde) ve kükürt iyodür (oksidasyon durumu +2) oluşturur. ⓘ
Elektronegatifliği kükürtten daha az olan elementlerle reaksiyona girdiğinde oksidan olarak ortaya çıkar ve oksidasyon durumu -2 olan sülfitler oluşturur. ⓘ
Kükürt, soy gazlar hariç neredeyse tüm diğer elementlerle, hatta reaktif olmadığı bilinen iridyum metaliyle bile (iridyum disülfür verir) reaksiyona girer. Bu reaksiyonlardan bazıları yüksek sıcaklıklara ihtiyaç duyar. ⓘ
İzotoplar
Sülfürün bilinen 23 izotopu vardır ve bunlardan dördü kararlıdır: 32S (%94,99±%0,26), 33S (%0,75±%0,02), 34S (%4,25±%0,24) ve 36S (%0,01±%0,01). Yarı ömrü 87 gün olan ve 40Ar'ın kozmik ışınlarla parçalanması sonucu oluşan 35S dışındaki radyoaktif kükürt izotoplarının yarı ömürleri 3 saatten azdır. ⓘ
Sülfit mineralleri çökeldiğinde, katılar ve sıvılar arasındaki izotopik dengelenme, eş genetik minerallerin δ34S değerlerinde küçük farklılıklara neden olabilir. Mineraller arasındaki farklar, dengelenme sıcaklığını tahmin etmek için kullanılabilir. Birlikte bulunan karbonat mineralleri ve sülfürlerin δ13C ve δ34S değerleri, cevher oluşumu sırasında cevher taşıyan sıvının pH ve oksijen fugasitesini belirlemek için kullanılabilir. ⓘ
Çoğu orman ekosisteminde, sülfat çoğunlukla atmosferden elde edilir; cevher minerallerinin ve evaporitlerin ayrışması bir miktar kükürt katkısı sağlar. Farklı bir izotopik bileşime sahip kükürt, kirlilik kaynaklarını belirlemek için kullanılmış ve zenginleştirilmiş kükürt hidrolojik çalışmalarda izleyici olarak eklenmiştir. Doğal bolluklardaki farklılıklar, ekosistem bileşenlerinin 34S'lerinde yeterli çeşitliliğin olduğu sistemlerde kullanılabilir. Atmosferik sülfat kaynaklarının baskın olduğu düşünülen Rocky Mountain göllerinin, havza sülfat kaynaklarının baskın olduğuna inanılan göllerden karakteristik 34S değerlerine sahip olduğu bulunmuştur. ⓘ
Doğal oluşum




32S, büyük yıldızların içinde, sıcaklığın 2,5×109 K'yi aştığı derinlikte, bir silikon çekirdeği ile bir helyum çekirdeğinin füzyonu ile oluşur. Bu nükleer reaksiyon, bol miktarda element üreten alfa sürecinin bir parçası olduğundan, sülfür evrendeki en yaygın 10. elementtir. ⓘ
Sülfür, genellikle sülfür olarak, birçok meteorit türünde bulunur. Sıradan kondritler ortalama %2,1 kükürt içerir ve karbonlu kondritler %6,6'ya kadar kükürt içerebilir. Normalde troilit (FeS) olarak bulunur, ancak serbest sülfür, sülfatlar ve diğer sülfür bileşikleri içeren karbonlu kondritler ile istisnalar vardır. Jüpiter'in volkanik uydusu Io'nun ayırt edici renkleri erimiş, katı ve gaz halindeki sülfürün çeşitli formlarına bağlanmaktadır. ⓘ
Dünya'da kütle olarak en yaygın beşinci elementtir. Elementel sülfür, dünyanın birçok yerinde, özellikle Pasifik Ateş Çemberi boyunca, kaplıcaların ve volkanik bölgelerin yakınında bulunabilir; bu tür volkanik yataklar şu anda Endonezya, Şili ve Japonya'da çıkarılmaktadır. Bu yataklar polikristal yapıdadır ve belgelenmiş en büyük tek kristal 22×16×11 cm ölçülerindedir. Tarihsel olarak Sicilya, Sanayi Devrimi'nde önemli bir sülfür kaynağıydı. Deniz tabanında, suyun kaynama noktasının sülfürün erime noktasından daha yüksek olduğu derinliklerde, denizaltı volkanlarıyla ilişkili olarak ~200 m çapa kadar erimiş sülfür gölleri bulunmuştur. ⓘ
Doğal sülfür, tuz domlarındaki jips gibi sülfat mineralleri üzerinde etkili olan anaerobik bakteriler tarafından sentezlenir. Meksika Körfezi kıyıları boyunca ve Doğu Avrupa ile Batı Asya'daki evaporitlerde tuz kubbelerinde önemli birikimler meydana gelir. Yerli kükürt yalnızca jeolojik süreçlerle üretilebilir. Tuz domlarından elde edilen fosil bazlı kükürt yatakları bir zamanlar Amerika Birleşik Devletleri, Rusya, Türkmenistan ve Ukrayna'da ticari üretimin temelini oluşturmuştur. Halen Polonya'daki Osiek madeninde ticari üretim yapılmaktadır. Bu tür kaynaklar artık ikincil ticari öneme sahiptir ve çoğu artık işletilmemektedir. ⓘ
Doğal olarak oluşan yaygın kükürt bileşikleri arasında pirit (demir sülfit), cinnabar (cıva sülfit), galen (kurşun sülfit), sfalerit (çinko sülfit) ve stibnit (antimon sülfit) gibi sülfit mineralleri ve jips (kalsiyum sülfat), alunit (potasyum alüminyum sülfat) ve barit (baryum sülfat) gibi sülfat mineralleri bulunur. Jüpiter'in uydusu Io'da olduğu gibi Dünya'da da elementel sülfür, hidrotermal bacalardan kaynaklanan emisyonlar da dahil olmak üzere volkanik emisyonlarda doğal olarak bulunur. ⓘ
Sülfürün ana endüstriyel kaynağı artık petrol ve doğal gazdır. ⓘ
Kükürt, doğada bol bulunan bir elementtir; taş kürenin %0,06'sını oluşturur. Özellikle en önemli kükürt yataklarının yer aldığı Sicilya, Luisiana ve Japonya'da eski volkanların yakınlarında, alçı taşı, kireç taşı katmanları arasında doğal halde bulunur. Türkiye'de Keçiborlu'da Etibank tarafından kapatılan ocaklar 2008 yılında tekrar açılmıştır. ⓘ
Bileşikler
Kükürt aralığının yaygın oksidasyon durum’ları -2 ile +6 arasındadır. Kükürt, soy gaz’lar hariç tüm elementlerle kararlı bileşikler yapar. ⓘ
Allotroplar

Sülfür, diğer elementlerden daha fazla olmak üzere 30'dan fazla katı allotrop oluşturur. S8'in yanı sıra birkaç halka daha bilinmektedir. Taçtan bir atom çıkarıldığında S8'den daha koyu sarı olan S7 elde edilir. "Elementel sülfür "ün HPLC analizi, esas olarak S8'den oluşan, ancak S7 ve az miktarda S6 içeren bir denge karışımı ortaya koymaktadır. S12 ve S18 de dahil olmak üzere daha büyük halkalar hazırlanmıştır. ⓘ
Amorf veya "plastik" sülfür, erimiş sülfürün hızlı soğutulmasıyla, örneğin soğuk suya dökülmesiyle üretilir. X-ışını kristalografi çalışmaları, amorf formun her turda sekiz atom içeren sarmal bir yapıya sahip olabileceğini göstermektedir. Uzun sarmal polimerik moleküller kahverengimsi maddeyi elastik hale getirir ve toplu halde bu form ham kauçuk hissine sahiptir. Bu form oda sıcaklığında metastabildir ve yavaş yavaş artık elastik olmayan kristalin moleküler allotropa dönüşür. Bu süreç birkaç saat ila birkaç gün içinde gerçekleşir, ancak hızlı bir şekilde katalize edilebilir. ⓘ
Polikasyonlar ve polianyonlar
Kükürt kuvvetli asidik çözeltide hafif oksitleyici maddelerle reaksiyona girdiğinde S82+, S42+ ve S16 2+ kükürt polikatyonları üretilir. Oleum içinde sülfürün çözülmesiyle üretilen renkli çözeltiler ilk olarak 1804 gibi erken bir tarihte C.F. Bucholz tarafından raporlandı ancak ilgili polikatyonların renginin ve yapısının nedeni ancak 1960'ların sonlarında bulundu. S82+ koyu mavi, S42+ sarı ve S162+ kırmızıdır. ⓘ
Radikal anyon S3−, lapis lazuli mineralinin mavi rengini verir. ⓘ

Sülfitler
Sülfürün hidrojen ile muamelesi hidrojen sülfür verir. Suda çözündüğünde, hidrojen sülfür hafif asidiktir:
- H2S ⇌ HS- + H+ ⓘ
Hidrojen sülfür gazı ve hidrosülfür anyonu, siyanür ve azide benzer bir şekilde hemoglobin ve bazı sitokromların oksijen taşıma kapasitesini inhibe etmeleri nedeniyle memeliler için son derece toksiktir (bkz. aşağıda, önlemler). ⓘ
Elementel sülfürün indirgenmesi, S- merkezleri ile sonlanan sülfür atomları zincirlerinden oluşan polisülfürleri verir:
- 2 Na + S8 → Na2S8
Bu reaksiyon sülfürün ayırt edici bir özelliğini vurgular: katatlama (zincir oluşturarak kendine bağlanma) yeteneği. Bu polisülfit anyonlarının protonlanması polisülfanları üretir, H2Sx burada x= 2, 3 ve 4'tür. Nihayetinde, sülfürün indirgenmesi sülfür tuzları üretir:
- 16 Na + S8 → 8 Na2S
Bu türlerin birbirine dönüşümü sodyum-sülfür bataryasında kullanılmaktadır. ⓘ
Oksitler, oksoasitler ve oksoanyonlar
Başlıca sülfür oksitler sülfürün yakılmasıyla elde edilir:
- S + O2 → SO2 (sülfür dioksit)
- 2 SO2 + O2 → 2 SO3 (sülfür trioksit)
Çoklu kükürt oksitler bilinmektedir; kükürt bakımından zengin oksitler arasında kükürt monoksit, disülfür monoksit, disülfür dioksitler ve perokso grupları içeren daha yüksek oksitler bulunur. ⓘ
Sülfür, bazıları izole edilemeyen ve sadece tuzları aracılığıyla bilinen sülfür oksoasitleri oluşturur. Kükürt dioksit ve sülfitler (SO2-
3) kararsız sülfürlü asit (H2SO3) ile ilişkilidir. Sülfür trioksit ve sülfatlar (SO2-
4) sülfürik asit (H2SO4) ile ilişkilidir. Sülfürik asit ve SO3 birleşerek sülfürik asit içinde pirosülfürik asit (H2S2O7) çözeltisi olan oleum verir. ⓘ
Tiyosülfat tuzları (S
2O2-
3), bazen "hiposülfitler" olarak adlandırılan, fotoğrafik sabitlemede (hipo) ve indirgeyici maddeler olarak kullanılan, iki oksidasyon durumunda sülfür içerir. Sodyum ditiyonit (Na
2S
2O
4), daha yüksek oranda indirgeyici ditiyonit anyonu (S
2O2-
4). ⓘ
Halidler ve oksihalidler
Modern endüstri için birkaç kükürt halojenür önemlidir. Sülfür hekzaflorür, yüksek gerilim transformatörlerinde yalıtkan gaz olarak kullanılan yoğun bir gazdır; ayrıca basınçlı kaplar için reaktif olmayan ve toksik olmayan bir itici gazdır. Sülfür tetraflorür nadiren kullanılan ve oldukça zehirli olan organik bir reaktiftir. Sülfür diklorür ve disülfür diklorür önemli endüstriyel kimyasallardır. Sülfüril klorür ve klorosülfürik asit sülfürik asit türevleridir; tiyonil klorür (SOCl2) organik sentezde yaygın bir reaktiftir. ⓘ
Piktidler
Önemli bir S-N bileşiği kafes tetrasülfür tetranitrürdür (S4N4). Bu bileşiğin ısıtılması polimerik sülfür nitrür (SN
x), herhangi bir metal atomu içermemesine rağmen metalik özelliklere sahiptir. Tiyosiyanatlar SCN- grubu içerir. Tiyosiyanatın oksidasyonu NCS-SCN bağlantısı ile tiyosiyanojen, (SCN)2 verir. Fosfor sülfürler çok sayıdadır, ticari olarak en önemlileri P4S10 ve P4S3 kafesleridir. ⓘ
Metal sülfürler
Bakır, çinko, nikel, kobalt, molibden ve diğer metallerin ana cevherleri sülfürlerdir. Bu malzemeler, su ve hatta birçok asit tarafından kolayca saldırıya uğramayan koyu renkli yarı iletkenler olma eğilimindedir. Hem jeokimyasal olarak hem de laboratuvarda hidrojen sülfürün metal tuzlarıyla reaksiyona girmesiyle oluşurlar. Galen (PbS) minerali ilk gösterilen yarı iletkendir ve ilk kristal radyoların kedi bıyıklarında sinyal doğrultucu olarak kullanılmıştır. "Aptal altını" olarak adlandırılan pirit adlı demir sülfit FeS2 formülüne sahiptir. Bu cevherlerin işlenmesi, genellikle kavurma yoluyla, maliyetli ve çevre açısından tehlikelidir. Sülfür birçok metali kararma yoluyla aşındırır. ⓘ
Organik bileşikler
- Açıklayıcı organosülfür bileşikleri
Sülfür içeren organik bileşiklerin ana sınıflarından bazıları aşağıdakileri içerir:
- Tiyoller veya merkaptanlar (cıvayı şelatör olarak yakaladıkları için böyle adlandırılırlar) alkollerin sülfür analoglarıdır; tiyollerin baz ile muamelesi tiyolat iyonlarını verir.
- Tiyoeterler, eterlerin sülfür analoglarıdır.
- Sülfonyum iyonları, katyonik bir sülfür merkezine bağlı üç gruba sahiptir. Dimetilsülfoniopropiyonat (DMSP), deniz organik sülfür döngüsünde önemli olan böyle bir bileşiktir.
- Sülfoksitler ve sülfonlar, sülfür atomuna sırasıyla bir ve iki oksijen atomu bağlı tiyoeterlerdir. En basit sülfoksit olan dimetil sülfoksit yaygın bir çözücüdür; yaygın bir sülfon ise sülfolandır.
- Sülfonik asitler birçok deterjanda kullanılır. ⓘ
Karbon-sülfür çoklu bağlarına sahip bileşikler nadirdir, bunun bir istisnası yapısal olarak karbon dioksite benzeyen uçucu renksiz bir sıvı olan karbon disülfürdür. Polimer suni ipek ve birçok organosülfür bileşiği yapmak için bir reaktif olarak kullanılır. Karbon monoksitin aksine, karbon monosülfür sadece güneş sistemleri arasında bulunan aşırı seyreltik bir gaz olarak kararlıdır. ⓘ
Organosülfür bileşikleri, çürüyen organik maddelerin hoş olmayan kokularının bazılarından sorumludur. Yaygın olarak evsel doğal gaz, sarımsak kokusu ve kokarca spreyindeki koku verici olarak bilinirler. Tüm organik sülfür bileşikleri her konsantrasyonda kötü kokmaz: küçük konsantrasyonlarda sülfür içeren monoterpenoid (greyfurt merkaptan) greyfurtun karakteristik kokusudur, ancak daha büyük konsantrasyonlarda genel bir tiyol kokusuna sahiptir. Güçlü bir vezikant olan sülfür hardalı, I. Dünya Savaşı'nda etkisiz hale getirici bir ajan olarak kullanılmıştır. ⓘ
Kükürt-sülfür bağları, proteinleri sertleştiren disülfit köprülerine benzer şekilde kauçuğu sertleştirmek için kullanılan yapısal bir bileşendir (bkz. aşağıda biyolojik). En yaygın endüstriyel "kürleme" veya doğal kauçuğun sertleştirilmesi ve güçlendirilmesi işleminde, elementel kükürt kauçukla birlikte kimyasal reaksiyonların polimerin izopren birimleri arasında disülfit köprüleri oluşturacağı noktaya kadar ısıtılır. Patenti 1843 yılında alınan bu süreç, kauçuğu özellikle otomobil lastiklerinde kullanılan önemli bir endüstriyel ürün haline getirmiştir. Isı ve sülfür nedeniyle sürece, Roma'nın demirci ve volkanizma tanrısından sonra vulkanizasyon adı verilmiştir. ⓘ
Tarih
Antik Çağ

Doğal halde bol miktarda bulunan kükürt, eski çağlarda biliniyordu ve Tevrat'ta (Yaratılış) adı geçmektedir. Hıristiyan İncil'inin İngilizce çevirilerinde yanan kükürtten genellikle "kükürt" olarak bahsedilmiş, bu da dinleyicilere inançsız ve tövbe etmeyenleri bekleyen sonsuz lanet kaderinin hatırlatıldığı "ateş ve kükürt" vaazları teriminin ortaya çıkmasına neden olmuştur. İncil'in bu bölümünde Cehennem'in "kükürt koktuğu" ima edilir (muhtemelen volkanik faaliyetlerle ilişkisi nedeniyle). Ebers Papirüsü'ne göre, eski Mısır'da tanecikli göz kapaklarını tedavi etmek için kükürt merhemi kullanılırdı. Kükürt, klasik öncesi Yunanistan'da tütsüleme için kullanılmıştır; Odysseia'da bundan bahsedilmektedir. Yaşlı Plinius, Doğa Tarihi'nin 35. kitabında kükürtten bahsetmekte ve en iyi bilinen kaynağının Melos adası olduğunu söylemektedir. Tütsüleme, ilaç ve kumaş ağartma için kullanımından bahseder. ⓘ
Shiliuhuang (石硫黄) olarak bilinen doğal bir kükürt formu Çin'de MÖ 6. yüzyıldan beri biliniyordu ve Hanzhong'da bulunuyordu. 3. yüzyıla gelindiğinde Çinliler kükürdün piritten elde edilebileceğini keşfetmişlerdi. Çinli Taoistler kükürdün yanıcılığı ve bazı metallerle olan reaktivitesiyle ilgilenmişlerdir, ancak ilk pratik kullanımları geleneksel Çin tıbbında bulunmuştur. MS 1044 tarihli bir Song hanedanı askeri incelemesi, potasyum nitrat (KNO) ve kükürt karışımı olan Çin kara barutu için çeşitli formüller tanımlamıştır.
3), odun kömürü ve sülfür. Siyah barutun bir bileşeni olmaya devam etmektedir.
Merkez: Üçlü Birlik işaretinin 2/3'ü, ters çevrilmiş/ters fosfor işareti
Sağda: Kükürtün eski/arkaik bir adı olan kükürdün simyasal işareti."Kimyasallar bilimi" (Sanskritçe: रसशास्त्र, romanize: rasaśāstra) uygulayıcıları olan Hint simyacıları, MS sekizinci yüzyıldan itibaren cıva ile simya işlemlerinde kükürt kullanımı hakkında kapsamlı bir şekilde yazmışlardır. Rasaśāstra geleneğinde sülfür "kokulu" (गन्धक, gandhaka) olarak adlandırılır. ⓘ
Erken dönem Avrupalı simyacılar kükürde bir haçın tepesindeki üçgen (🜍) olan eşsiz bir simya sembolü vermişlerdir. Çapraz mızrak (⚴) olan 2 Pallas'ın astrolojik sembolü, sülfür sembolüne benzeyen bir sembol de dahil olmak üzere çeşitli şekillerde yayınlanmıştır. Geleneksel cilt tedavisinde elementel sülfür (çoğunlukla kremlerde) uyuz, saçkıran, sedef hastalığı, egzama ve akne gibi durumları hafifletmek için kullanılmıştır. Etki mekanizması bilinmemekle birlikte, elementel kükürt yavaşça sülfüröz aside oksitlenir, bu da (sülfitin etkisiyle) hafif bir indirgeyici ve antibakteriyel ajandır. ⓘ
Modern zamanlar
Doğru: Günümüzde kükürdün antifungal, antibakteriyel ve keratolitik aktiviteye sahip olduğu bilinmektedir; geçmişte akne vulgaris, rosacea, seboreik dermatit, kepek, pityriasis versicolor, uyuz ve siğillere karşı kullanılmıştır. 1881 tarihli bu reklamda romatizma, gut, kellik ve saç beyazlamasına karşı etkili olduğu asılsız bir şekilde iddia edilmektedir.
Kükürt, 1718 tarihli bir kimyasal tabloda sabit (asidik olmayan) alkali sütununda yer almaktadır. Antoine Lavoisier yanma deneylerinde sülfür kullanmış ve bunlardan bazılarını 1777'de yazmıştır. ⓘ
Sicilya'daki kükürt yatakları bir yüzyıldan uzun bir süre boyunca baskın kaynak olmuştur. 18. yüzyılın sonlarında, Leblanc sürecinde kullanılmak üzere sülfürik asit üretimi için Fransa'nın Marsilya kentine yılda yaklaşık 2.000 ton kükürt ithal ediliyordu. Sanayileşmekte olan Britanya'da, 1824 yılında tuz üzerindeki gümrük vergilerinin kaldırılmasıyla Sicilya'dan gelen kükürt talebi arttı. Kükürt madenciliği, rafine edilmesi ve nakliyesi üzerinde artan İngiliz kontrolü ve sömürüsü, bu kârlı ihracatın Sicilya'nın geri kalmış ve yoksul ekonomisini dönüştürmedeki başarısızlığıyla birleşince, Kral Ferdinand II'nin 1816'da İngiltere ile yapılan ticaret anlaşmasını ihlal ederek kükürt endüstrisinin tekelini bir Fransız firmasına verdiği 1840 Kükürt Krizi'ne yol açtı. Sonunda Fransa tarafından barışçıl bir çözüm müzakere edildi. ⓘ
1867'de Louisiana ve Teksas'taki yeraltı yataklarında elementel sülfür keşfedildi. Bu kaynağı çıkarmak için son derece başarılı Frasch süreci geliştirildi. ⓘ
18. yüzyılın sonlarında mobilya yapımcıları dekoratif kakmalar üretmek için erimiş kükürt kullandılar. Erimiş sülfür bazen hala zemine monte edilen ekipman bağlantı noktaları için yüksek şok direncinin istendiği delinmiş beton deliklere çelik cıvataları yerleştirmek için kullanılmaktadır. Saf toz kükürt tıbbi tonik ve müshil olarak kullanılmıştır. ⓘ
Temas sürecinin ortaya çıkmasıyla birlikte günümüzde sülfürün büyük bir kısmı, başta gübre olmak üzere çok çeşitli kullanımlar için sülfürik asit yapımında kullanılmaktadır. ⓘ
Son zamanlarda, ana kükürt kaynağı petrol ve doğal gaz haline gelmiştir. Bunun nedeni, asit yağmurlarını önlemek için yakıtlardan kükürdün uzaklaştırılması gerekliliğidir ve kükürt fazlalığı ile sonuçlanmıştır. ⓘ
Yazım ve etimoloji
Sülfür, Latince sulpur kelimesinden türetilmiş olup, Latince kelimenin Yunancadan geldiğine dair yanlış bir inançla Hellenleştirilerek sülfür haline getirilmiştir. Bu yazım daha sonra /f/ sesini temsil ettiği şeklinde yeniden yorumlanmış ve Klasik dönemin sonlarına doğru Latincede ortaya çıkan sülfür yazımıyla sonuçlanmıştır. Sülfür için kullanılan gerçek Yunanca kelime olan θεῖον, uluslararası kimyasal önek olan thio-'nun kaynağıdır. 12. yüzyıl Anglo-Fransızcasında sulfre idi. 14. yüzyılda, hatalı bir şekilde Helenleştirilmiş Latince -ph- Orta İngilizce sulphre'de restore edilmiştir. 15. yüzyıla gelindiğinde, hem tam Latince yazım varyantları sülfür hem de sülfür İngilizcede yaygınlaştı. Paralel f~ph yazımları İngiltere'de kelimenin sülfür olarak standartlaştırıldığı 19. yüzyıla kadar devam etmiştir. Öte yandan, Amerika Birleşik Devletleri'nde sülfür tercih edilirken, Kanada'da her ikisi de kullanılmaktadır. IUPAC, atıfta bulunulan kaynağa bağlı olarak 1990 veya 1971'de sülfür yazımını benimsemiş, Kraliyet Kimya Derneği İsimlendirme Komitesi de 1992'de sülfür yazımını İngiltere'ye geri getirmiştir. Oxford Dictionaries, "kimya ve diğer teknik kullanımlarda ... -f- yazımının artık hem İngiliz hem de ABD bağlamlarında bu ve ilgili sözcükler için standart biçim olduğunu ve genel bağlamlarda da giderek daha fazla kullanıldığını" belirtmektedir. ⓘ
Üretim

Sülfür kendi başına bulunabilir ve tarihsel olarak genellikle bu şekilde elde edilmiştir; pirit de bir sülfür kaynağı olmuştur. Sicilya'daki volkanik bölgelerde, eski zamanlarda, Dünya yüzeyinde bulunurdu ve "Sicilya süreci" kullanılırdı: kükürt yatakları, aralarında hava boşlukları olan eğimli yamaçlara inşa edilmiş tuğla fırınlarda yığılır ve istiflenirdi. Daha sonra bir miktar sülfür toz haline getirilerek istiflenmiş cevherin üzerine yayılıyor ve ateşlenerek serbest sülfürün tepeleri eritmesine neden oluyordu. Sonunda yüzeydeki yataklar tükendi ve madenciler, Sicilya manzarasını labirent gibi madenlerle süsleyen damarları kazdı. Madencilik makineleşmemiş ve yoğun emek gerektiren bir işti; toplayıcılar cevheri kayadan kurtarıyor, madenci çocuklar ya da carusi'ler de cevher sepetlerini genellikle bir mil ya da daha fazla tünelden geçerek yüzeye taşıyordu. Cevher yüzeye çıktıktan sonra eritme fırınlarında indirgenir ve çıkarılırdı. Sicilya sülfür madenlerindeki koşullar korkunçtu ve Booker T. Washington'un "Şu anda öteki dünyada fiziksel bir cehenneme ne kadar inandığımı söylemeye hazır değilim, ancak Sicilya'daki bir sülfür madeni bu hayatta görmeyi umduğum cehenneme en yakın şey" diye yazmasına neden oldu. ⓘ

Elementel kükürt, 20. yüzyılın sonlarına kadar tuz kubbelerinden (bazen neredeyse saf halde bulunduğu) çıkarılıyordu. Kükürt artık petrol rafinasyonu gibi kükürdün istenmediği diğer endüstriyel süreçlerin bir yan ürünü olarak üretilmektedir. Bir mineral olarak, tuz kubbeleri altındaki doğal kükürdün, anaerobik bakterilerin sülfat yatakları üzerindeki etkisiyle üretilen fosil bir mineral kaynağı olduğu düşünülmektedir. Bu tür tuz kubbesi madenlerinden esas olarak Frasch işlemi ile çıkarılmıştır. Bu yöntemde, sülfürü eritmek için doğal bir sülfür yatağına aşırı ısıtılmış su pompalanır ve ardından basınçlı hava %99,5 saflıkta erimiş ürünü yüzeye geri gönderir. Bu prosedür 20. yüzyıl boyunca daha fazla saflaştırma gerektirmeyen elementel sülfür üretmiştir. Bu tür kükürt yataklarının sınırlı sayıda olması ve bunları işletmenin yüksek maliyeti nedeniyle, kükürt madenciliği için bu işlem 2002'den beri dünyanın hiçbir yerinde önemli bir şekilde kullanılmamaktadır. ⓘ
Günümüzde kükürt petrol, doğal gaz ve ilgili fosil kaynaklardan üretilmekte ve bu kaynaklardan esas olarak hidrojen sülfür olarak elde edilmektedir. Petrolde istenmeyen safsızlıklar olan organosülfür bileşikleri, C-S bağlarını ayıran hidrodesülfürizasyona tabi tutularak yükseltilebilir:
- R-S-R + 2 H2 → 2 RH + H2S
Bu işlem sonucunda ortaya çıkan ve doğal gazda da bulunan hidrojen sülfür, Claus işlemi ile elementel sülfüre dönüştürülür. Bu süreç, bir miktar hidrojen sülfürün sülfür dioksite oksidasyonunu ve ardından ikisinin oranlanmasını gerektirir:
- 3 O2 + 2 H2S → 2 SO2 + 2 H2O
- SO2 + 2 H2S → 3 S + 2 H2O ⓘ

Athabasca Petrol Kumlarının yüksek sülfür içeriği nedeniyle, bu işlemden elde edilen elementel sülfür stokları şu anda Alberta, Kanada'da bulunmaktadır. Kükürdü depolamanın bir başka yolu da beton için bağlayıcı olarak kullanmaktır ve elde edilen ürün birçok istenen özelliğe sahiptir (bkz. kükürtlü beton). Kükürt hala Endonezya gibi yanardağların bulunduğu yoksul ülkelerde yüzey yataklarından çıkarılmaktadır ve Booker T. Washington'un günlerinden bu yana işçi koşulları pek iyileşmemiştir. ⓘ
2011'de dünya kükürt üretimi 69 milyon tona (Mt) ulaşmış olup, 15'ten fazla ülkenin her biri 1 Mt'den fazla üretim yapmıştır. Çin (9.6), ABD (8.8), Kanada (7.1) ve Rusya (7.1) 5 Mt'den fazla üretim yapan ülkelerdir. Üretim 1900'den 2010'a kadar yavaşça artmıştır; fiyat 1980'lerde ve 2010 civarında istikrarsızdı. ⓘ
Uygulamalar
Sülfürik asit
Elementel sülfür esas olarak diğer kimyasalların öncüsü olarak kullanılır. Yaklaşık %85'i (1989) sülfürik aside (H2SO4) dönüştürülür:
- 2 S + 3 O2 + 2 H2O → 2 H2SO4 ⓘ
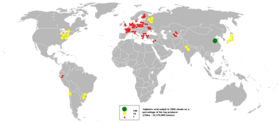
2010 yılında Amerika Birleşik Devletleri diğer tüm inorganik endüstriyel kimyasallardan daha fazla sülfürik asit üretmiştir. Asidin başlıca kullanım alanı gübre üretimi için fosfat cevherlerinin çıkarılmasıdır. Sülfürik asidin diğer uygulamaları arasında petrol arıtma, atık su işleme ve mineral çıkarma yer alır. ⓘ
Diğer önemli sülfür kimyası
Kükürt, selofan ve suni ipek üretiminde kullanılan karbon disülfürü vermek için doğrudan metan ile reaksiyona girer. Elementel sülfürün kullanım alanlarından biri de polisülfit zincirlerinin organik polimerleri çapraz bağladığı kauçuk vulkanizasyonudur. Kağıdı ağartmak ve kurutulmuş meyveleri korumak için büyük miktarlarda sülfit kullanılır. Birçok yüzey aktif madde ve deterjan (örneğin sodyum lauril sülfat) sülfat türevleridir. Kalsiyum sülfat, alçıtaşı, (CaSO4-2H2O) Portland çimentosu ve gübrelerde kullanılmak üzere her yıl 100 milyon ton ölçeğinde çıkarılmaktadır. ⓘ
Gümüş bazlı fotoğrafçılık yaygınlaştığında, sodyum ve amonyum tiyosülfat "sabitleyici maddeler" olarak yaygın bir şekilde kullanılmıştır. Sülfür barutun ("kara barut") bir bileşenidir. ⓘ
Gübre
Kükürt, gübrelerin bir bileşeni olarak giderek daha fazla kullanılmaktadır. Gübre için en önemli kükürt formu mineral kalsiyum sülfattır. Elementel kükürt hidrofobiktir (suda çözünmez) ve bitkiler tarafından doğrudan kullanılamaz. Zamanla, toprak bakterileri onu çözünebilir türevlere dönüştürebilir ve bu da bitkiler tarafından kullanılabilir. Kükürt, başta azot ve fosfor olmak üzere diğer temel bitki besin maddelerinin verimliliğini artırır. Biyolojik olarak üretilen kükürt partikülleri, biyopolimer kaplama nedeniyle doğal olarak hidrofiliktir ve seyreltilmiş bulamaç spreyi ile araziye daha kolay dağılır, bu da daha hızlı bir alımla sonuçlanır. ⓘ
Kükürt için botanik gereksinim fosfor gereksinimine eşit veya daha fazladır. Bitki büyümesi, baklagillerin kök nodülü oluşumu, bağışıklık ve savunma sistemleri için temel bir besin maddesidir. Kükürt eksikliği Avrupa'daki birçok ülkede yaygınlaşmıştır. Atmosferik kükürt girdileri azalmaya devam ettiğinden, kükürtlü gübreler kullanılmadığı sürece kükürt girdi/çıktısındaki açığın artması muhtemeldir. Asit yağmurlarını sınırlamak için alınan önlemler nedeniyle atmosferik kükürt girdileri azalmaktadır. ⓘ
Fungisit ve pestisit

Elementel kükürt en eski fungisit ve pestisitlerden biridir. "Toz kükürt", toz halindeki elementel kükürt, üzüm, çilek, birçok sebze ve diğer bazı ürünler için yaygın bir fungisittir. Kara lekenin yanı sıra çok çeşitli külleme hastalıklarına karşı iyi bir etkinliğe sahiptir. Organik üretimde kükürt en önemli fungisittir. Soğuk koşullarda ana hastalık olan elma kabuğuna karşı organik olarak yetiştirilen elma üretiminde kullanılan tek fungisittir. Biyosülfür (biyolojik olarak üretilen hidrofilik özellikli elementel kükürt) de bu uygulamalar için kullanılabilir. ⓘ
Standart formülasyonlu toz kükürt, ürünlere bir kükürt pülverizatörü ile veya bir tozlama uçağından uygulanır. Islanabilir kükürt, suyla karışabilir hale getirmek için ek bileşenlerle formüle edilmiş toz kükürdün ticari adıdır. Benzer uygulamalara sahiptir ve küf ve diğer küfle ilgili bitki ve toprak sorunlarına karşı bir mantar ilacı olarak kullanılır. ⓘ
Elemental kükürt tozu, kene ve akarlara karşı "organik" (yani "yeşil") bir böcek ilacı (aslında bir akarisit) olarak kullanılır. Yaygın bir uygulama yöntemi, giysilerin veya uzuvların kükürt tozu ile tozlanmasıdır. ⓘ
Seyreltilmiş bir kireç sülfür çözeltisi (kalsiyum hidroksit ile elementel sülfürün suda birleştirilmesiyle yapılır), saçkıran (mantar), uyuz ve diğer dermatoz ve parazitleri yok etmek için evcil hayvanlar için bir daldırma olarak kullanılır. ⓘ
Neredeyse saf sülfürden oluşan sülfür mumları yapıları ve şarap fıçılarını tütsülemek için yakılırdı, ancak artık konutlar için çok zehirli kabul edilmektedir. ⓘ
İlaçlar
Sülfür (özellikle oktasülfür, S8) akne ve diğer durumların tedavisi için farmasötik cilt preparatlarında kullanılır. Keratolitik bir ajan olarak hareket eder ve ayrıca bakterileri, mantarları, uyuz akarlarını ve diğer parazitleri öldürür. Çöktürülmüş sülfür ve kolloidal sülfür, akne vulgaris, akne rosacea ve seboreik dermatit tedavisinde losyon, krem, toz, sabun ve banyo katkı maddeleri şeklinde kullanılır. ⓘ
Birçok ilaç sülfür içerir; ilk örnekler sülfa ilaçları olarak bilinen antibakteriyel sülfonamidlerdir, günümüzdeki bir örnek ise asetilsisteindir. Sülfür birçok bakteriyel savunma molekülünün bir parçasıdır. Penisilinler, sefalosporinler ve monobaktamlar dahil olmak üzere çoğu β-laktam antibiyotik sülfür içerir. ⓘ
Piller
Yüksek enerji yoğunlukları ve sülfürün mevcudiyeti nedeniyle, şarj edilebilir lityum-sülfür pillerin oluşturulması konusunda araştırmalar devam etmektedir. Şimdiye kadar, karbonat elektrolitler bu tür pillerde tek bir döngüden sonra arızalara neden olmuştur. Şubat 2022'de, Drexel Üniversitesi'ndeki araştırmacılar sadece 4000 şarj döngüsü süren prototip bir pil yaratmakla kalmadı, aynı zamanda 95 santigrat derecenin altında stabil kalan ilk monoklinik gama sülfürü buldular. ⓘ
Biyolojik rolü
Sülfür, tüm canlı hücrelerin temel bir bileşenidir. Ağırlık olarak insan vücudunda en çok bulunan sekizinci elementtir, potasyumla yaklaşık eşit bolluktadır ve sodyum ve klordan biraz daha fazladır. 70 kg (150 lb) ağırlığındaki bir insan vücudu yaklaşık 140 gram sülfür içerir. İnsülin, keratin ve kolajen üretimi için hayati önem taşır. ⓘ
İnorganik ve biyomoleküller arasında sülfür aktarımı
1880'lerde Sergei Winogradsky, Beggiatoa'yı (sülfür açısından zengin bir ortamda yaşayan bir bakteri) incelerken, hidrojen sülfürü (H2S) bir enerji kaynağı olarak oksitlediğini ve hücre içi sülfür damlacıkları oluşturduğunu keşfetti. Winogradsky bu metabolizma biçimini inorgoxidation (inorganik bileşiklerin oksidasyonu) olarak adlandırdı. Bu konuda çalışmaya devam eden bir başka katılımcı da Selman Waksman'dır. Robert Ballard tarafından keşfedildiği üzere, derin okyanuslardaki volkanik bacaların çevresinde yaşayan ilkel bakteriler beslenmek için hidrojen sülfürü oksitlemektedir. ⓘ
Sülfür oksitleyiciler enerji kaynağı olarak hidrojen sülfür, elementel sülfür, sülfit, tiyosülfat ve çeşitli politiyonatlar (örn. tetratiyonat) dahil olmak üzere indirgenmiş sülfür bileşiklerini kullanabilir. Sülfürü sülfata oksitlemek için sülfür oksijenaz ve sülfit oksidaz gibi enzimlere bağlıdırlar. Bazı litotroflar, kemosentez olarak bilinen bir süreç olan şeker üretmek için sülfür bileşiklerinde bulunan enerjiyi bile kullanabilir. Bazı bakteri ve arkeler kemosentezde elektron vericisi olarak su yerine hidrojen sülfür kullanır; bu, şeker üreten ve elektron alıcısı olarak oksijen kullanan fotosenteze benzer bir süreçtir. Sülfür bazlı kemosentez, fotosentez ile basitçe karşılaştırılabilir: H2S +CO2 → şekerler + S ⓘ
H2O + CO2 → şekerler + O2 ⓘ
Bu iki beslenme şeklini birleştiren bakteriler vardır: yeşil sülfür bakterileri ve mor sülfür bakterileri. Ayrıca sülfür oksitleyici bakteriler daha büyük organizmalarla simbiyoza girebilir ve daha sonra hidrojen sülfürün oksitlenecek besin olarak kullanılmasını sağlayabilir. Örnek: dev tüp solucanı. ⓘ
Bunun aksine, oksijen yerine "sülfat soluyan" sülfat indirgeyici bakteriler de vardır. Enerji kaynağı olarak organik bileşikler veya moleküler hidrojen kullanırlar. Elektron alıcısı olarak sülfür kullanırlar ve çeşitli oksitlenmiş sülfür bileşiklerini tekrar sülfüre, genellikle de hidrojen sülfüre indirgerler. Diğer kısmen oksitlenmiş sülfür bileşikleri (örneğin tiyosülfatlar, tiyonatlar, polisülfürler, sülfitler) üzerinde büyüyebilirler. Bu bakteriler tarafından üretilen hidrojen sülfürün bağırsak gazlarının (flatus) ve ayrışma ürünlerinin kokusunun bir kısmından sorumlu olduğuna dair yaygın bir efsane vardır. Genellikle flatus hidrojen sülfürden farklı kokar (çürük yumurta kokusu vardır ve insan bağırsağında hala mevcuttur), ancak bu bakterilerin varlığı demir takviyesi kullanımından kaynaklanan bir yan etkiye, dişlerin ve dışkının kararmasına neden olur, bu da bu bakteriler tarafından üretilen demir sülfürden kaynaklanır. ⓘ
Eski okyanusların dibinde bulunan birçok doğal sülfür birikintisinin biyolojik kökenli olduğuna işaret eden çalışmalar bulunmaktadır. Bu çalışmalar, bu doğal sülfürün biyolojik aktivite yoluyla elde edildiğini göstermektedir, ancak bundan neyin sorumlu olduğu (sülfür oksitleyici bakteriler veya sülfat indirgeyici bakteriler) hala kesin olarak bilinmemektedir. ⓘ
Kükürt, bitki kökleri tarafından topraktan sülfat olarak emilir ve fosfat esteri olarak taşınır. Sülfat, sistein ve diğer organosülfür bileşiklerine dahil edilmeden önce sülfit yoluyla sülfüre indirgenir.
- SO42- → SO32- → H2S → sistein → metiyonin
Bitkilerin sülfürün besin zincirleri yoluyla hayvanlara aktarılmasındaki rolü az çok anlaşılmış olsa da, sülfür bakterilerinin rolü yeni yeni araştırılmaktadır. ⓘ
Protein ve organik metabolitler
Tüm yaşam formlarında, sülfürün çoğu iki proteinojenik amino asitte (sistein ve metiyonin) bulunur, dolayısıyla element bu amino asitleri içeren tüm proteinlerde ve ilgili peptitlerde mevcuttur. Sülfürün bir kısmı, çoğu kofaktör olan belirli metabolitlerde ve bağ dokusunun sülfatlanmış polisakkaritlerinde (kondroitin sülfatlar, heparin) bulunur. ⓘ

Proteinlerin biyolojik işlevlerini yerine getirebilmeleri için belirli bir uzay geometrisine sahip olmaları gerekir. Bu geometrinin oluşumu, protein katlanması adı verilen bir süreçte gerçekleştirilir ve molekül içi ve moleküller arası bağlarla sağlanır. Sürecin birkaç aşaması vardır. İlk aşamalarda bir polipeptit zinciri hidrojen bağları sayesinde katlanırken, daha sonraki aşamalarda katlanma (hidrojen bağları dışında) bir zincirin farklı yerlerindeki iki sistein kalıntısının iki sülfür atomu arasındaki (disülfit köprüleri olarak adlandırılır) kovalent bağlar (üçüncül protein yapısı) ve iki ayrı protein alt birimindeki iki sistein kalıntısı arasındaki (dördüncül protein yapısı) ile sağlanır. Her iki yapı da insülinde kolayca görülebilir. Kovalent disülfid köprüsünün bağ enerjisi, koordinat bağının veya hidrofilik ya da hidrofobik etkileşimin enerjisinden daha yüksek olduğundan, disülfid köprülerinin içeriği arttıkça protein denatürasyonu için gereken enerji de artar. Disülfit bağlarının hücresel alan dışında işlev gören proteinlerde gerekli olduğu ve proteinlerin konformasyonunu (geometrisini) değiştirmediği, ancak stabilize edici olarak hizmet ettiği yönünde bir görüş vardır. Sitoplazma içinde proteinlerin sistein kalıntıları tiyoredoksinler tarafından indirgenmiş durumda (yani -SH formunda) tutulur. ⓘ
Bu özellik aşağıdaki örneklerde ortaya çıkmaktadır. Lizozim ilaç olarak kullanılabilecek kadar kararlıdır. Tüyler ve saçlar göreceli olarak güçlüdür ve bunlardan oluşan keratin çoğu organizma tarafından sindirilemez olarak kabul edilir. Bununla birlikte, keratinaz içeren mantarlar ve bakteriler vardır ve keratini yok edebilirler. ⓘ
Birçok önemli hücresel enzim, açil içeren biyokimyasalları içeren reaksiyonları idare etmek için -SH bağları ile biten prostetik gruplar kullanır: temel metabolizmadan iki yaygın örnek koenzim A ve alfa-lipoik asittir. Sisteinle ilişkili metabolitler homosistein ve taurin, yapı olarak benzer olan ancak DNA tarafından kodlanmayan ve proteinlerin birincil yapısının bir parçası olmayan, memeli fizyolojisinin çeşitli yerlerinde yer alan diğer sülfür içeren amino asitlerdir. 13 klasik vitaminden ikisi, biyotin ve tiamin, sülfür içerir ve çeşitli enzimlere kofaktör olarak hizmet eder. ⓘ
Hücre içi kimyada kükürt, oksidasyonun hücresel onarımı için indirgen hidrojen ve elektronlarının taşıyıcısı olarak çalışır. Sülfür içeren bir tripeptid olan indirgenmiş glutatyon, sisteinden türetilen sülfhidril (-SH) kısmı aracılığıyla indirgeyici bir ajandır. ⓘ
Dünyadaki metanın çoğunun elde edildiği yol olan metanojenez, karbondioksitin çok adımlı bir biyokimyasal dönüşümüdür. Bu dönüşüm birkaç organosülfür kofaktörü gerektirir. Bunlar arasında metanın ilk öncüsü olan koenzim M, CH3SCH2CH2SO3- bulunur. ⓘ
Metaloproteinler ve inorganik kofaktörler
Aktif bölgenin genellikle sistein kalıntılarının kükürt atomları tarafından koordine edilen bir geçiş metali iyonu (veya metal-sülfür kümesi) olduğu metaloproteinler, elektron transfer süreçlerinde yer alan enzimlerin temel bileşenleridir. Örnekler arasında plastosiyanin (Cu2+) ve nitröz oksit redüktaz (Cu-S) sayılabilir. Bu enzimlerin işlevi, geçiş metali iyonunun redoks reaksiyonlarına girebilmesine bağlıdır. Diğer örnekler arasında birçok çinko proteininin yanı sıra demir-sülfür kümeleri de bulunmaktadır. En yaygın olanları, hücrelerde elektron mekiği olarak görev yapan ferrodoksinlerdir. Bakterilerde, önemli nitrojenaz enzimleri bir Fe-Mo-S kümesi içerir ve atmosferik nitrojeni mikroorganizmalar ve bitkiler tarafından protein, DNA, RNA, alkaloidler ve yaşam için gerekli diğer organik nitrojen bileşiklerini yapmak için kullanılabilecek amonyağa dönüştürerek nitrojen fiksasyonunun önemli işlevini yerine getiren bir katalizördür.
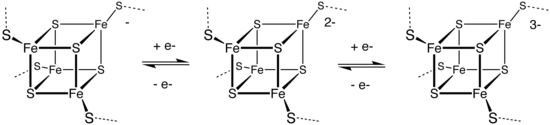 Bir kümedeki elektron akışının kolaylığı, ilgili enzimin katalitik etkisini sağlar. ⓘ
Bir kümedeki elektron akışının kolaylığı, ilgili enzimin katalitik etkisini sağlar. ⓘ
Eksiklik
İnsanlarda metiyonin esansiyel bir amino asittir, sistein ise şartlı olarak esansiyeldir ve esansiyel olmayan serinden sentezlenebilir (bu durumda sülfür verici metiyonin olacaktır). ⓘ
Genel koşullarda diyet eksikliği nadiren görülür. Yapay metiyonin eksikliği kanser tedavisinde uygulanmaya çalışılmaktadır, ancak yöntem hala potansiyel olarak tehlikelidir. ⓘ
Kükürt içeren amino asitleri metabolize eden bir enzim olan sülfit oksidaz bozukluğu ile bağlantılı nadir görülen ölümcül bir genetik hastalık vardır. ⓘ
Önlemler
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Piktogramlar
|

|
Sinyal kelimesi
|
Uyarı |
Tehlike bildirimleri
|
H315 |
| NFPA 704 (yangın elması) | |

Elementel sülfür, Epsom tuzları gibi çözünebilir sülfat tuzlarının çoğu gibi toksik değildir. Çözünebilir sülfat tuzları az emilir ve müshil yapıcıdır. Parenteral olarak enjekte edildiklerinde, böbrekler tarafından serbestçe süzülürler ve çok gramlı miktarlarda çok az toksisite ile elimine edilirler. Alüminyum sülfat içme suyunun arıtılmasında, atık su arıtma tesislerinde ve kağıt yapımında kullanılır. ⓘ
Sülfür havada yandığında sülfür dioksit üretir. Bu gaz suda kükürtlü asit ve sülfit üretir; sülfitler aerobik bakterilerin büyümesini engelleyen antioksidanlardır ve küçük miktarlarda yararlı bir gıda katkı maddesidir. Yüksek konsantrasyonlarda bu asitler akciğerlere, gözlere veya diğer dokulara zarar verir. Böcekler veya bitkiler gibi akciğerleri olmayan organizmalarda, yüksek konsantrasyondaki sülfit solunumu engeller. ⓘ
Sülfür trioksit (sülfür dioksitten kataliz yoluyla yapılır) ve sülfürik asit benzer şekilde yüksek derecede asidiktir ve su varlığında aşındırıcıdır. Sülfürik asit, mevcut su moleküllerini ve su bileşenlerini şeker ve organik dokudan sıyırabilen güçlü bir dehidrasyon ajanıdır. ⓘ
Kömür ve/veya petrolün sanayi ve enerji santralleri tarafından yakılması sülfürik asit (H2SO4) ve sülfüröz asit (H2SO3) üretmek için atmosferik su ve oksijen ile reaksiyona giren sülfür dioksit (SO2) üretir. Bu asitler asit yağmurunun bileşenleridir, toprağın ve tatlı su kütlelerinin pH'ını düşürür, bazen çevreye önemli zararlar verir ve heykellerin ve yapıların kimyasal olarak ayrışmasına neden olur. Yakıt standartları, asit yağmuru oluşumunu önlemek için yakıt üreticilerinin fosil yakıtlardan sülfür çıkarmasını giderek daha fazla gerektirmektedir. Bu çıkarılan ve rafine edilen kükürt, kükürt üretiminin büyük bir bölümünü temsil etmektedir. Kömürle çalışan enerji santrallerinde baca gazları bazen arıtılır. Sentez gazı kullanan daha modern enerji santralleri, gazı yakmadan önce sülfürü çıkarır. ⓘ
Hidrojen sülfür, hidrojen siyanür kadar zehirlidir ve aynı mekanizma ile öldürür (solunum enzimi sitokrom oksidazın inhibisyonu), ancak hidrojen sülfürün hoş olmayan kokusu nedeniyle küçük miktarlarda solunduğunda sürpriz zehirlenmelere neden olma olasılığı daha düşüktür. Hidrojen sülfür koku alma duyusunu hızla köreltir ve kurban, şiddetli semptomlar ölüme neden olana kadar artışın farkına varmadan artan miktarlarda soluyabilir. Çözünmüş sülfür ve hidrosülfür tuzları aynı mekanizma ile toksiktir. ⓘ
Kükürt ve insan vücudu
Kükürt Minerali’ nin Görevi: Bağ dokusu, deri, tırnak üretimi, kan şekeri seviyesinin kontrolü, vücudun zehirlerden temizlenmesi, safra üretimi. Sağlıklı saç, cilt ve tırnaklar için gereklidir. Oksijen dengesinin muhafazasına yardımcı olur, bu da beyin fonksiyonları için çok önemlidir. Sülfür aynı zamanda B-grubu vitaminlerinin işlevlerini yerine getirmesine ve karaciğerde safranın salgılanmasına yardımcı olur. ⓘ
Kükürt izotopları
Kükürtün 23 bilinen izotopları vardır. Bunların dördü kararlıdır: 32S (% 95,02), 33S (% 0,75), 34S (% 4,21) ve 36S (% 0,02). 35S dışında, kükürtün radyoaktif izotopları oldukça kısa ömürlüdür. 35S atmosferde 40Ar'un kozmik ışınlarla parçalanmasıyla oluşur. Bunun yarılanma süresi 87 gündür. Bir sonraki uzun ömürlü radyoizotop, 170 dakikalık bir yarılanma süresi ile, kükürt-38'dir. Yarılanma süresi 200 nanosaniye ile en kısa ömürlü radyoizotop, kükürt-49'dur. ⓘ
| İzotop | Yarılanma süresi | Çürüme enerjisi (MeV) | Spin / Eşlem | Çürüme modları (%) | Doğal bolluk (%) ⓘ |
|---|---|---|---|---|---|
| 26S | 10 ms | 0+ | 2p (% 100) | ||
| 27S | 21 ms | 18,26 (K/β+) | 5/2+ | K/β+ (%98), K2p (%2), Kp = ? | |
| 28S | 125 ms | 11,23 (K/β+), 9,17 (Kp) | 0+ | K/β(%79), Kp(%21) | |
| 29S | 187 ms | 13,79 | 5/2+ | K/β+ (%53), Kp (%47) | |
| 30S | 1,178 s | 6,138 | 0+ | K/β+ (%100) | |
| 31S | 2,572 s | 5,396 | 1/2+ | K/β+ (%100) | |
| 32S | kararlı | 0+ | 95,02 | ||
| 33S | kararlı | 3/2+ | 0,75 | ||
| 34S | kararlı | 0+ | 4,21 | ||
| 35S | 87,32 gün | 0,167 | 3/2+ | β− (%100) | |
| 36S | kararlı | 0+ | 0,02 | ||
| 37S | 5,05 dk. | 4,865 | 7/2− | β− (%100) | |
| 38S | 170,3 dk. | 2,937 | 0+ | β− (%100) | |
| 39S | 11,5 s | 6,64 | (3/2,5/2,7/2) - | β− (%100) | |
| 40S | 8,8 s | 4,71 | 0+ | β− (%100) | |
| 41S | 1,99 s | 7/2− | β−(> %99,9), β− (< %0,1) | ||
| 42S | 0,56 s | 7,7 (β−), 2,0 (β−n) | 0+ | β− (%96), β− (%4) | |
| 43S | 220 ms | 11,5 (β−), 4,4 (β−n) | β−(%60), β−(%40) | ||
| 44S | 123 ms | 9,1 (β−), 5,1 (β−n) | 0+ | β− (%82), β− (%18) | |
| 45S | 82 ms | 14,1 (β−), 7,1 (β−n) | β− (%46), β− (%54) | ||
| 46S | 50 ms | 0+ | β− (%100) | ||
| 48S | <200 ns | 0+ | β− (%100) | ||
| 49S | <200 ns | n (%100) |