Kurşun
 | ||||||||||||||||||||||||||
| Kurşun | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | /ˈlɛd/ (led) | |||||||||||||||||||||||||
| Görünüş | metalik gri | |||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Pb) |
| |||||||||||||||||||||||||
| Periyodik tabloda kurşun | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Atom numarası (Z) | 82 | |||||||||||||||||||||||||
| Grup | grup 14 (karbon grubu) | |||||||||||||||||||||||||
| Dönem | dönem 6 | |||||||||||||||||||||||||
| Blok | p-blok | |||||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Ksenon|Xe]]] 4f14 5d10 6s2 6p2 | |||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||||||||||
| STP'de Faz | katı | |||||||||||||||||||||||||
| Erime noktası | 600,61 K (327,46 °C, 621,43 °F) | |||||||||||||||||||||||||
| Kaynama noktası | 2022 K (1749 °C, 3180 °F) | |||||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 11,34 g/cm3 | |||||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 10,66 g/cm3 | |||||||||||||||||||||||||
| Füzyon ısısı | 4,77 kJ/mol | |||||||||||||||||||||||||
| Buharlaşma ısısı | 179,5 kJ/mol | |||||||||||||||||||||||||
| Molar ısı kapasitesi | 26.650 J/(mol-K) | |||||||||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||||||||
| Oksidasyon durumları | -4, -2, -1, +1, +2, +3, +4 (amfoterik bir oksit) | |||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2,33 (+4'te), 1,87 (+2'de) | |||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 175 pm | |||||||||||||||||||||||||
| Kovalent yarıçap | 146±5 pm | |||||||||||||||||||||||||
| Van der Waals yarıçapı | 202 pm | |||||||||||||||||||||||||
| Kurşunun spektral çizgileri | ||||||||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||||||||||||
| Kristal yapı | yüz merkezli kübik (fcc) a=495.08 pm | |||||||||||||||||||||||||
| Ses hızı ince çubuk | 1190 m/s (r.t.'de) (tavlanmış) | |||||||||||||||||||||||||
| Termal genleşme | 28,9 µm/(m⋅K) (25 °C'de) | |||||||||||||||||||||||||
| Termal iletkenlik | 35,3 W/(m⋅K) | |||||||||||||||||||||||||
| Elektriksel direnç | 208 nΩ⋅m (20 °C'de) | |||||||||||||||||||||||||
| Manyetik sipariş | diamanyetik | |||||||||||||||||||||||||
| Molar manyetik duyarlılık | -23,0×10-6 cm3/mol (298 K'de) | |||||||||||||||||||||||||
| Young modülü | 16 GPa | |||||||||||||||||||||||||
| Kayma modülü | 5,6 GPa | |||||||||||||||||||||||||
| Yığın modülü | 46 GPa | |||||||||||||||||||||||||
| Poisson oranı | 0.44 | |||||||||||||||||||||||||
| Mohs sertliği | 1.5 | |||||||||||||||||||||||||
| Brinell sertliği | 38-50 MPa | |||||||||||||||||||||||||
| CAS Numarası | 7439-92-1 | |||||||||||||||||||||||||
| Tarih | ||||||||||||||||||||||||||
| Keşif | Orta Doğu (MÖ 7000) | |||||||||||||||||||||||||
| Sembol | "Pb": Latince plumbum'dan | |||||||||||||||||||||||||
| Kurşunun ana izotopları | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| İzotopik bolluklar numuneye göre büyük farklılıklar gösterir | ||||||||||||||||||||||||||
Kurşun, sembolü Pb (Latince plumbum'dan) ve atom numarası 82 olan kimyasal bir elementtir. Çoğu yaygın malzemeden daha yoğun olan ağır bir metaldir. Kurşun yumuşak ve dövülebilirdir ve ayrıca nispeten düşük bir erime noktasına sahiptir. Yeni kesildiğinde kurşun gümüşi ve mavi renktedir; havaya maruz kaldığında donuk gri bir renge dönüşür. Kurşun, herhangi bir kararlı elementin en yüksek atom numarasına sahiptir ve izotoplarından üçü, daha ağır elementlerin ana nükleer bozunma zincirlerinin uç noktalarıdır. ⓘ
Kurşun nispeten reaktif olmayan bir geçiş sonrası metalidir. Zayıf metalik karakteri amfoterik doğası ile gösterilir; kurşun ve kurşun oksitler asitler ve bazlarla reaksiyona girer ve kovalent bağlar oluşturma eğilimindedir. Kurşun bileşikleri genellikle karbon grubunun daha hafif üyeleriyle ortak olan +4 durumundan ziyade +2 oksidasyon durumunda bulunur. İstisnalar çoğunlukla organolead bileşikleriyle sınırlıdır. Grubun daha hafif üyeleri gibi kurşun da kendi kendine bağlanma eğilimindedir; zincirler ve çok yüzlü yapılar oluşturabilir. ⓘ
Kurşun, cevherlerinden kolayca çıkarılabildiği için Yakın Doğu'daki tarih öncesi insanlar bunun farkındaydı. Galen, genellikle gümüş içeren başlıca kurşun cevheridir. Gümüşe olan ilgi, antik Roma'da kurşunun yaygın olarak çıkarılmasına ve kullanılmasına yardımcı olmuştur. Kurşun üretimi Roma'nın çöküşünden sonra azalmış ve Sanayi Devrimi'ne kadar karşılaştırılabilir seviyelere ulaşamamıştır. Kurşun oynadığı rol matbaanın geliştirilmesinde çok önemli bir rol oynamıştır, çünkü hareketli yazılar kurşun alaşımlarından nispeten kolay bir şekilde dökülebilmiştir. 2014 yılında, yıllık küresel kurşun üretimi yaklaşık on milyon tondu ve bunun yarısından fazlası geri dönüşümden elde edildi. Kurşunun yüksek yoğunluğu, düşük erime noktası, sünekliği ve oksidasyona karşı göreceli eylemsizliği onu kullanışlı kılmaktadır. Bu özellikleri, görece bolluğu ve düşük maliyetiyle birleşince inşaat, sıhhi tesisat, piller, mermi ve saçmalar, ağırlıklar, lehimler, kalaylar, eriyebilir alaşımlar, beyaz boyalar, kurşunlu benzin ve radyasyon kalkanında yaygın olarak kullanılmasına neden olmuştur. ⓘ
Kurşunun toksisitesi 19. yüzyılın sonlarında yaygın olarak kabul görmüştür, ancak iyi eğitimli bazı antik Yunan ve Roma yazarları bu gerçeğin farkındaydı ve hatta kurşun zehirlenmesinin bazı belirtilerini biliyorlardı. Kurşun, yumuşak dokularda ve kemiklerde biriken bir nörotoksindir; sinir sistemine zarar verir ve biyolojik enzimlerin işlevini engelleyerek davranış sorunlarından beyin hasarına kadar değişen nörolojik bozukluklara neden olur ve ayrıca genel sağlık, kardiyovasküler ve böbrek sistemlerini de etkiler. ⓘ
Kurşun (Pb) atom numarası 82, atom kütlesi 207,19 olan mavi-gümüş rengi karışımı bir elementtir. 327,5 °C'ta erir ve 1740 °C'ta kaynar. Doğada, kütle numaraları 208, 206, 207 ve 204 olmak üzere 4 kararlı izotopu vardır. ⓘ
Kurşunun son katmanında 4 açık elektron olmasına rağmen, genellikle bileşiklerinde +4 yerine +2 değerlik alır. Çünkü kalan son 2 elektron kolayca iyonize olabilir. Nitrattan ve klorattan farklı olarak kurşun (II) tuzları suda çok daha az çözünür. ⓘ
Kurşunun kararlı bileşiklerinde (kurşun tetra-etil veya tetramethylead gibi) kurşun direkt olarak bir karbon atomuna bağlanmıştır. Bu bileşikler kaynama noktaları, sırasıyla 110 °C ve 200 °C olan renksiz sıvılardır. ⓘ
Yer kabuğunda bulunma sıklığı 12,5 g/t'dur. Nabit (doğal) olarak bulunabilen metaller arasında yer alır. Kurşunun en çok rastlanılan cevherleri, sülfür minerali galen (PbS) ve onun oksitlenmiş ürünleri olan serüsit (PbCO3) ve anglezittir (PbSO4). Bu mineraller arasında en önemli olanı galendir. Genel olarak sfalerit (ZnS), gümüş ve pirit (FeS2) ile birleşik halde bulunur. ⓘ
Fiziksel özellikler
Atomik
Bir kurşun atomu, [[[Ksenon|Xe]]]4f145d106s26p2 elektron konfigürasyonunda düzenlenmiş 82 elektrona sahiptir. Kurşunun birinci ve ikinci iyonlaşma enerjilerinin toplamı (iki 6p elektronunu çıkarmak için gereken toplam enerji), kurşunun karbon grubundaki üst komşusu olan kalayınkine yakındır. Bu alışılmadık bir durumdur; bir elementin dış elektronları çekirdekten daha uzak hale geldikçe ve daha küçük orbitaller tarafından daha fazla korundukça, iyonlaşma enerjileri genellikle bir gruptan aşağıya doğru düşer. ⓘ
İyonlaşma enerjilerinin benzerliği lantanit daralmasından kaynaklanır - lantandan (atom numarası 57) lütetyuma (71) kadar element yarıçaplarındaki azalma ve hafniyumdan (72) itibaren elementlerin nispeten küçük yarıçapları. Bu, çekirdeğin lantanit 4f elektronları tarafından zayıf bir şekilde korunmasından kaynaklanmaktadır. Kurşunun ilk dört iyonlaşma enerjisinin toplamı, periyodik eğilimlerin öngördüğünün aksine, kalayınkini aşar. Daha ağır atomlarda önemli hale gelen rölativistik etkiler bu davranışa katkıda bulunur. Bu etkilerden biri de inert çift etkisidir: Kurşunun 6s elektronları bağlanmaya katılma konusunda isteksiz hale gelir ve kristal kurşunda en yakın atomlar arasındaki mesafeyi alışılmadık derecede uzun hale getirir. ⓘ
Kurşunun daha hafif karbon grubu türleri, tetrahedral olarak koordine edilmiş ve kovalent olarak bağlanmış elmas kübik yapı ile kararlı veya metastabil allotroplar oluşturur. Dış s- ve p-orbitallerinin enerji seviyeleri, dört hibrit sp3 orbitaline karışmaya izin verecek kadar yakındır. Kurşunda, inert çift etkisi s- ve p-orbitalleri arasındaki ayrımı artırır ve boşluk, hibridizasyonun ardından ekstra bağlar tarafından salınacak enerji ile aşılamaz. Kurşun, elmas kübik bir yapıya sahip olmak yerine, sadece p-elektronlarının delokalize olduğu ve Pb2+ iyonları arasında paylaşıldığı metalik bağlar oluşturur. Sonuç olarak kurşun, benzer büyüklükteki iki değerli metaller kalsiyum ve stronsiyum gibi yüz merkezli kübik bir yapıya sahiptir. ⓘ
Dökme
Saf kurşunun parlak, gümüşi bir görünümü vardır ve mavi bir ipucu içerir. Nemli hava ile temas ettiğinde kararır ve tonu mevcut koşullara bağlı olan donuk bir görünüm alır. Kurşunun karakteristik özellikleri arasında yüksek yoğunluk, dövülebilirlik, süneklik ve pasivasyon nedeniyle korozyona karşı yüksek direnç yer alır. ⓘ

Kurşunun yakın paketlenmiş yüz merkezli kübik yapısı ve yüksek atom ağırlığı, demir (7,87 g/cm3), bakır (8,93 g/cm3) ve çinko (7,14 g/cm3) gibi yaygın metallerden daha yüksek olan 11,34 g/cm3'lük bir yoğunluğa neden olur. Bu yoğunluk, kurşun balon gibi uçmak deyiminin kökenidir. Bazı nadir metaller daha yoğundur: tungsten ve altının her ikisi de 19,3 g/cm3'tür ve bilinen en yoğun metal olan osmiyum 22,59 g/cm3 ile kurşunun neredeyse iki katı yoğunluğa sahiptir. ⓘ
Kurşun, Mohs sertliği 1,5 olan çok yumuşak bir metaldir; tırnakla çizilebilir. Oldukça yumuşak ve biraz da sünektir. Kurşunun yığın modülü -sıkıştırılabilirliğinin kolaylığının bir ölçüsü- 45,8 GPa'dır. Buna karşılık alüminyumunki 75,2 GPa; bakırınki 137,8 GPa ve yumuşak çeliğinki 160-169 GPa'dır. Kurşunun 12-17 MPa olan gerilme mukavemeti düşüktür (alüminyumunki 6 kat, bakırınki 10 kat ve yumuşak çeliğinki 15 kat daha yüksektir); az miktarda bakır veya antimon eklenerek güçlendirilebilir. ⓘ
Kurşunun erime noktası - 327,5 °C (621,5 °F) - çoğu metale kıyasla çok düşüktür. Kaynama noktası olan 1749 °C (3180 °F) karbon grubu elementleri arasında en düşük olanıdır. Kurşunun 20 °C'deki elektrik direnci 192 nanoohm-metre olup, diğer endüstriyel metallerinkinden (15,43 nΩ-m bakır; 20,51 nΩ-m altın; ve 24,15 nΩ-m alüminyum) neredeyse bir kat daha yüksektir. Kurşun 7,19 K'den daha düşük sıcaklıklarda bir süper iletkendir; bu, tüm tip-I süper iletkenler arasında en yüksek ve elementel süper iletkenler arasında üçüncü en yüksek kritik sıcaklıktır. ⓘ
İzotopik bolluklar numuneye göre büyük farklılıklar gösterir | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Pb) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
İzotoplar
Doğal kurşun, kütle numaraları 204, 206, 207 ve 208 olan dört kararlı izotoptan ve beş kısa ömürlü radyoizotopun izlerinden oluşur. Yüksek izotop sayısı, kurşunun atom numarasının çift olmasıyla tutarlıdır. Kurşun, nükleer kabuk modelinin özellikle kararlı bir çekirdeği doğru bir şekilde öngördüğü sihirli bir proton sayısına (82) sahiptir. Kurşun-208'in 126 nötronu vardır, bu da kurşun-208'in neden olağanüstü kararlı olduğunu açıklayabilecek bir başka sihirli sayıdır. ⓘ
Yüksek atom numarasıyla kurşun, doğal izotopları kararlı olarak kabul edilen en ağır elementtir; kurşun-208 en ağır kararlı çekirdektir. (Bu ayrım, 2003 yılında tek ilkel izotopu olan bizmut-209'un çok yavaş bozunduğu bulunana kadar, atom numarası 83 olan bizmut için geçerliydi). Kurşunun dört kararlı izotopu teorik olarak enerji salınımı ile cıva izotoplarına alfa bozunmasına uğrayabilir, ancak bu hiçbiri için gözlemlenmemiştir; öngörülen yarı ömürleri 1035 ila 10189 yıl arasında değişmektedir (evrenin mevcut yaşının en az 1025 katı). ⓘ
Kararlı izotoplardan üçü dört ana bozunma zincirinin üçünde bulunur: kurşun-206, kurşun-207 ve kurşun-208 sırasıyla uranyum-238, uranyum-235 ve toryum-232'nin son bozunma ürünleridir. Bu bozunma zincirleri uranyum zinciri, aktinyum zinciri ve toryum zinciri olarak adlandırılır. Doğal bir kaya örneğindeki izotopik konsantrasyonları büyük ölçüde bu üç ana uranyum ve toryum izotopunun varlığına bağlıdır. Örneğin, kurşun-208'in göreceli bolluğu normal örneklerde %52'den toryum cevherlerinde %90'a kadar değişebilir; bu nedenle kurşunun standart atom ağırlığı yalnızca bir ondalık basamakta verilir. Zaman geçtikçe kurşun-206 ve kurşun-207'nin kurşun-204'e oranı artar, çünkü ilk ikisi daha ağır elementlerin radyoaktif bozunmasıyla desteklenirken sonuncusu desteklenmez; bu da kurşun-kurşun tarihlemesine olanak sağlar. Uranyum kurşuna dönüştükçe, göreceli miktarları değişir; bu da uranyum-kurşun tarihlemesinin temelini oluşturur. Kurşun-207, insan vücudu da dahil olmak üzere çözelti ve katı haldeki bileşiklerini incelemek için kullanılan bir özellik olan nükleer manyetik rezonans sergiler. ⓘ

Doğal olarak var olan kurşunun neredeyse tamamını oluşturan kararlı izotopların yanı sıra, eser miktarda birkaç radyoaktif izotop da bulunmaktadır. Bunlardan biri kurşun-210'dur; sadece 22,2 yıllık bir yarı ömre sahip olmasına rağmen, kurşun-210 uranyum-238 (Dünya'da milyarlarca yıldır mevcut olan) ile başlayan uzun bir bozunma serisi tarafından üretildiği için doğada küçük miktarlarda bulunur. Kurşun-211, -212 ve -214 sırasıyla uranyum-235, toryum-232 ve uranyum-238'in bozunma zincirlerinde bulunur, bu nedenle bu kurşun izotoplarının üçünün de izleri doğal olarak bulunur. Kurşun-209'un küçük izleri, doğal uranyum-235'in yan ürünlerinden biri olan radyum-223'ün çok nadir görülen küme bozunmasından ve uranyum cevherlerinde nötron yakalama yoluyla izleri üretilen neptünyum-237'nin bozunma zincirinden kaynaklanır. Kurşun-210, kurşun-206'ya oranını ölçerek örneklerin yaşlarını belirlemeye yardımcı olmak için özellikle yararlıdır (her iki izotop da tek bir bozunma zincirinde bulunur). ⓘ
Toplamda, kütle numaraları 178-220 olan 43 kurşun izotopu sentezlenmiştir. Kurşun-205, yaklaşık 1,73×107 yıllık yarı ömrü ile en kararlı radyoizotoptur. İkinci en kararlı radyoizotop olan kurşun-202'nin yarı ömrü yaklaşık 52.500 yıldır ve bu süre doğal iz radyoizotoplarının hepsinden daha uzundur. ⓘ
Kimya

Nemli havaya maruz kalan dökme kurşun, çeşitli bileşimlerde koruyucu bir tabaka oluşturur. Kurşun (II) karbonat yaygın bir bileşendir; sülfat veya klorür de kentsel veya deniz ortamlarında mevcut olabilir. Bu tabaka, dökme kurşunu havada etkili bir şekilde kimyasal olarak inert hale getirir. İnce toz halindeki kurşun, birçok metalde olduğu gibi piroforiktir ve mavimsi beyaz bir alevle yanar. ⓘ
Flor oda sıcaklığında kurşun ile reaksiyona girerek kurşun(II) florür oluşturur. Klor ile reaksiyon benzerdir ancak ortaya çıkan klorür tabakası elementlerin reaktivitesini azalttığı için ısıtma gerektirir. Erimiş kurşun kalkojenlerle reaksiyona girerek kurşun(II) kalkojenitleri verir. ⓘ
Kurşun metali sülfürik ve fosforik aside direnç gösterir ancak hidroklorik veya nitrik aside direnç göstermez; sonuç çözünmezliğe ve ürün tuzunun sonraki pasivasyonuna bağlıdır. Asetik asit gibi organik asitler oksijen varlığında kurşunu çözer. Konsantre alkaliler kurşunu çözer ve plumbit oluşturur. ⓘ
İnorganik bileşikler
Kurşun iki ana oksidasyon durumu gösterir: +4 ve +2. Dört değerlikli durum karbon grubu için yaygındır. İki değerlikli durum karbon ve silikon için nadirdir, germanyum için önemsizdir, kalay için önemlidir (ancak baskın değildir) ve kurşun için iki oksidasyon durumundan daha önemlidir. Bu durum rölativistik etkilere, özellikle de kurşun ile oksit, halojenür veya nitrür anyonları arasında elektronegatiflik açısından büyük bir fark olduğunda kendini gösteren ve kurşun üzerinde önemli bir kısmi pozitif yüke yol açan inert çift etkisine bağlanabilir. Sonuç, kurşun 6s orbitalinin 6p orbitaline göre daha güçlü bir şekilde daralması ve iyonik bileşiklerde oldukça inert hale gelmesidir. İnert çift etkisi, kurşunun organolead bileşiklerindeki karbon gibi benzer elektronegatiflikteki elementlerle kovalent bağlar oluşturduğu bileşikler için daha az geçerlidir. Bunlarda, 6s ve 6p orbitalleri benzer büyüklükte kalır ve sp3 hibridizasyonu hala enerjetik olarak elverişlidir. Kurşun, karbon gibi, bu tür bileşiklerde ağırlıklı olarak tetravalenttir. ⓘ
Kurşun(II)'nin elektronegatifliğinde 1.87 ve kurşun(IV)'ün 2.33 ile nispeten büyük bir fark vardır. Bu fark, karbon grubunda aşağıya doğru inildikçe +4 oksidasyon durumunun artan kararlılığı eğilimindeki tersine dönüşü işaret eder; kalay, karşılaştırıldığında, +2 oksidasyon durumunda 1.80 ve +4 durumunda 1.96 değerlerine sahiptir. ⓘ
Kurşun (II)
Kurşun(II) bileşikleri, kurşunun inorganik kimyasının karakteristik özelliğidir. Flor ve klor gibi güçlü oksitleyici maddeler bile kurşunla reaksiyona girerek sadece PbF2 ve PbCl2 verir. Kurşun(II) iyonları çözeltide genellikle renksizdir ve kısmen hidrolize olarak Pb(OH)+ ve son olarak [Pb4(OH)4]4+ (hidroksil iyonlarının köprü ligandları olarak hareket ettiği) oluşturur, ancak kalay(II) iyonları gibi indirgeyici maddeler değildir. Sudaki Pb2+ iyonunun varlığını belirlemeye yönelik teknikler genellikle seyreltik hidroklorik asit kullanılarak kurşun(II) klorürün çökeltilmesine dayanır. Klorür tuzu suda az çözünür olduğundan, çok seyreltik çözeltilerde kurşun(II) sülfürün çökelmesi bunun yerine çözeltiden hidrojen sülfür köpürtülerek elde edilir. ⓘ
Kurşun monoksit iki polimorfta bulunur, litharge α-PbO (kırmızı) ve massicot β-PbO (sarı), ikincisi sadece yaklaşık 488 °C'nin üzerinde kararlıdır. Litarj, kurşunun en yaygın kullanılan inorganik bileşiğidir. Kurşun(II) hidroksit yoktur; kurşun(II) tuzlarının çözeltilerinin pH'ını artırmak hidrolize ve yoğunlaşmaya yol açar. Kurşun genellikle daha ağır kalkojenler ile reaksiyona girer. Kurşun sülfür bir yarı iletken, bir fotoiletken ve son derece hassas bir kızılötesi radyasyon dedektörüdür. Diğer iki kalkogenid, kurşun selenid ve kurşun tellürid de aynı şekilde fotoiletkendir. Renklerinin gruptan aşağıya doğru daha açık hale gelmesi açısından sıra dışıdırlar. ⓘ
Kurşun dihalidler iyi karakterize edilmiştir; buna diastatid ve PbFCl gibi karışık halidler dahildir. Sonuncusunun göreceli çözünmezliği, florun gravimetrik tayini için yararlı bir temel oluşturur. Diflorür keşfedilen ilk katı iyonik iletken bileşiktir (1834 yılında Michael Faraday tarafından). Diğer dihalidler, özellikle diiyodid olmak üzere ultraviyole veya görünür ışığa maruz kaldıklarında ayrışırlar. Siyanür, siyanat ve tiyosiyanat gibi birçok kurşun(II) psödohalid bilinmektedir. Kurşun (II), [PbCl4]2-, [PbCl6]4- ve [Pb2Cl9]n5n- zincir anyonu gibi çok çeşitli halojenür koordinasyon kompleksleri oluşturur. ⓘ
Kurşun(II) sülfat, diğer ağır iki değerlikli katyonların sülfatları gibi suda çözünmez. Kurşun(II) nitrat ve kurşun(II) asetat çok çözünürdür ve bu durumdan diğer kurşun bileşiklerinin sentezinde yararlanılır. ⓘ
Kurşun (IV)
Çok az sayıda inorganik kurşun(IV) bileşiği bilinmektedir. Sadece yüksek oksitleyici çözeltilerde oluşurlar ve normalde standart koşullar altında bulunmazlar. Kurşun(II) oksit, daha fazla oksidasyonda karışık bir oksit verir, Pb3O4. Kurşun (II,IV) oksit veya yapısal olarak 2PbO-PbO2 olarak tanımlanır ve en iyi bilinen karışık değerlikli kurşun bileşiğidir. Kurşun dioksit, hidroklorik asidi klor gazına oksitleyebilen güçlü bir oksitleyici maddedir. Bunun nedeni, üretilmesi beklenen PbCl4'ün kararsız olması ve kendiliğinden PbCl2 ve Cl2'ye ayrışmasıdır. Kurşun monoksite benzer şekilde, kurşun dioksit de plumbat anyonları oluşturabilir. Kurşun disülfür ve kurşun diselenid sadece yüksek basınçlarda kararlıdır. Sarı kristal bir toz olan kurşun tetraflorür kararlıdır, ancak diflorürden daha az kararlıdır. Kurşun tetraklorür (sarı bir yağ) oda sıcaklığında ayrışır, kurşun tetrabromür daha az kararlıdır ve kurşun tetraiodürün varlığı şüphelidir. ⓘ
Diğer oksidasyon durumları

Bazı kurşun bileşikleri +4 veya +2 dışındaki biçimsel oksidasyon durumlarında bulunur. Kurşun(III), daha büyük organolead komplekslerinde kurşun(II) ve kurşun(IV) arasında bir ara madde olarak elde edilebilir; hem kurşun(III) iyonu hem de onu içeren daha büyük kompleksler radikal olduğundan bu oksidasyon durumu kararlı değildir. Aynı durum, bu tür radikal türlerde bulunabilen kurşun(I) için de geçerlidir. ⓘ
Çok sayıda karışık kurşun(II,IV) oksit bilinmektedir. PbO2 havada ısıtıldığında 293 °C'de Pb12O19, 351 °C'de Pb12O17, 374 °C'de Pb3O4 ve son olarak 605 °C'de PbO haline gelir. Yüksek basınçta, birkaç stokiyometrik olmayan faz ile birlikte bir başka seskioksit, Pb2O3 elde edilebilir. Bunların çoğu, bazı oksijen atomlarının boşluklar ile yer değiştirdiği kusurlu florit yapıları gösterir: PbO, her alternatif oksijen atomu katmanının bulunmadığı böyle bir yapıya sahip olarak düşünülebilir. ⓘ
Negatif oksidasyon durumları Zintl fazları olarak, Ba2Pb'de olduğu gibi serbest kurşun anyonları olarak, kurşunun resmi olarak kurşun(-IV) olduğu veya iki kurşun atomunun kurşun(-I) ve üçünün kurşun(0) olduğu trigonal bipiramidal Pb52- iyonu gibi oksijene duyarlı halka şekilli veya çok yüzlü küme iyonları olarak ortaya çıkabilir. Bu tür anyonlarda, her atom çok yüzlü bir tepe noktasındadır ve sp3 hibrit orbitallerinden bir kenar boyunca her kovalent bağa iki elektron katkıda bulunur, diğer ikisi harici bir yalnız çifttir. Kurşunun sodyum tarafından indirgenmesi yoluyla sıvı amonyak içinde yapılabilirler. ⓘ
Organolead
Kurşun, karbon grubundaki daha hafif homologlarıyla paylaştığı bir özellik olan çoklu bağlı zincirler oluşturabilir. Bunu yapabilme kapasitesi çok daha azdır çünkü Pb-Pb bağ enerjisi C-C bağ enerjisinden üç buçuk kat daha düşüktür. Kurşun kendisiyle üçe kadar metal-metal bağları kurabilir. Kurşun, karbon ile tipik organik bileşiklere benzer, ancak genellikle daha az kararlı organolead bileşikleri oluşturur (Pb-C bağının oldukça zayıf olması nedeniyle). Bu durum, kurşunun organometalik kimyasını kalayınkinden çok daha az geniş kapsamlı hale getirir. Kurşun, inorganik kurşun(II) reaktanları ile başlasa bile ağırlıklı olarak organolead(IV) bileşikleri oluşturur; çok az organolead(II) bileşiği bilinmektedir. En iyi karakterize edilmiş istisnalar Pb[CH(SiMe3)2]2 ve Pb(η5-C5H5)2'dir. ⓘ
En basit organik bileşik olan metanın kurşun analoğu plumbandır. Plumbane, metalik kurşun ve atomik hidrojen arasındaki bir reaksiyonda elde edilebilir. İki basit türev, tetrametilkurşun ve tetraetilkurşun, en iyi bilinen organolead bileşikleridir. Bu bileşikler nispeten kararlıdır: tetraetil kurşun yalnızca ısıtıldığında veya güneş ışığına ya da ultraviyole ışığa maruz kaldığında ayrışmaya başlar. Sodyum metali ile kurşun, tetraetilkurşun gibi organometalik bileşikler oluşturmak üzere alkil halojenürlerle reaksiyona giren eşitolar bir alaşım oluşturur. Birçok organolead bileşiğinin oksitleyici doğasından yararlanılır: kurşun tetraasetat organik sentezde oksidasyon için önemli bir laboratuvar reaktifidir. Bir zamanlar benzine eklenen tetraetil kurşun, diğer organometalik bileşiklerden daha büyük miktarlarda üretilmiştir. Diğer organolead bileşikleri kimyasal olarak daha az kararlıdır. Birçok organik bileşik için kurşun analoğu mevcut değildir. ⓘ
Kökeni ve oluşumu
| Atomik sayı |
Element | Göreceli miktar ⓘ |
|---|---|---|
| 42 | Molibden | 0.798 |
| 46 | Paladyum | 0.440 |
| 50 | Kalay | 1.146 |
| 78 | Platin | 0.417 |
| 80 | Merkür | 0.127 |
| 82 | Kurşun | 1 |
| 90 | Toryum | 0.011 |
| 92 | Uranyum | 0.003 |
Uzayda
Kurşunun Güneş Sistemi'ndeki partikül başına bolluğu 0,121 ppb'dir (milyarda bir parça). Bu rakam platinden iki buçuk kat, cıvadan sekiz kat ve altından on yedi kat daha fazladır. Evrendeki kurşun miktarı, daha ağır atomların çoğu (hepsi kararsızdır) yavaş yavaş kurşuna dönüştükçe yavaş yavaş artmaktadır. Kurşunun Güneş Sistemi'ndeki bolluğu 4,5 milyar yıl önceki oluşumundan bu yana yaklaşık %0,75 oranında artmıştır. Güneş Sistemi bolluk tablosu, kurşunun nispeten yüksek atom numarasına rağmen, atom numarası 40'tan büyük olan diğer elementlerin çoğundan daha yaygın olduğunu göstermektedir. ⓘ
Kurşun-204, kurşun-206, kurşun-207 ve kurşun-208 izotoplarını içeren ilkel kurşun, çoğunlukla yıldızlarda meydana gelen tekrarlayan nötron yakalama süreçlerinin bir sonucu olarak yaratılmıştır. İki ana yakalama modu s- ve r-süreçleridir. ⓘ
S-sürecinde (s "yavaş" anlamına gelir), yakalamalar yıllar veya on yıllar boyunca birbirinden ayrılarak daha az kararlı çekirdeklerin beta bozunumuna uğramasına izin verir. Kararlı bir talyum-203 çekirdeği bir nötron yakalayabilir ve talyum-204'e dönüşebilir; bu da beta bozunmasına uğrayarak kararlı kurşun-204'ü verir; başka bir nötron yakaladığında, yarı ömrü yaklaşık 15 milyon yıl olan kurşun-205'e dönüşür. Daha sonraki yakalamalar kurşun-206, kurşun-207 ve kurşun-208 ile sonuçlanır. Başka bir nötron yakalandığında, kurşun-208 kurşun-209'a dönüşür ve bu da hızla bizmut-209'a bozunur. Başka bir nötron yakalandığında, bizmut-209 bizmut-210'a dönüşür ve bu beta polonyum-210'a bozunur, bu da alfa bozunarak kurşun-206'ya dönüşür. Dolayısıyla döngü kurşun-206, kurşun-207, kurşun-208 ve bizmut-209 ile sona erer. ⓘ
r-sürecinde (r "hızlı" anlamına gelir), yakalanmalar çekirdeklerin bozunabileceğinden daha hızlı gerçekleşir. Bu, bir süpernova veya iki nötron yıldızının birleşmesi gibi yüksek nötron yoğunluğuna sahip ortamlarda meydana gelir. Söz konusu nötron akısı saniyede santimetrekare başına 1022 nötron mertebesinde olabilir. R süreci, s süreci kadar çok kurşun oluşturmaz. Nötron zengini çekirdekler 126 nötrona ulaştığında durma eğilimindedir. Bu noktada, nötronlar atom çekirdeğindeki tam kabuklarda düzenlenir ve enerjik olarak daha fazlasını barındırmak zorlaşır. Nötron akışı azaldığında, bu çekirdekler osmiyum, iridyum ve platinin kararlı izotoplarına beta bozunmasına uğrar. ⓘ
Dünya üzerinde
Kurşun, Goldschmidt sınıflandırması altında bir kalkofil olarak sınıflandırılır, yani genellikle kükürt ile birlikte bulunur. Nadiren doğal, metalik formda bulunur. Birçok kurşun minerali nispeten hafiftir ve Dünya'nın tarihi boyunca Dünya'nın iç kısımlarına doğru derinlere inmek yerine kabukta kalmıştır. Bu, kurşunun 14 ppm'lik nispeten yüksek kabuk bolluğunu açıklar; kabukta en bol bulunan 38. elementtir. ⓘ
Kurşun içeren ana mineral, çoğunlukla çinko cevherleriyle birlikte bulunan galenadır (PbS). Diğer kurşun minerallerinin çoğu bir şekilde galenle ilişkilidir; boulangerite, Pb5Sb4S11, galenden türetilmiş karışık bir sülfürdür; anglesite, PbSO4, galen oksidasyonunun bir ürünüdür; ve cerussite veya beyaz kurşun cevheri, PbCO3, galenin bir ayrışma ürünüdür. Arsenik, kalay, antimon, gümüş, altın, bakır ve bizmut kurşun minerallerindeki yaygın safsızlıklardır. ⓘ
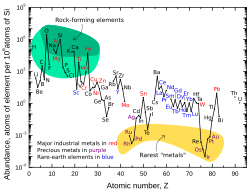
Dünya kurşun kaynakları iki milyar tonu aşmaktadır. Önemli yataklar Avustralya, Çin, İrlanda, Meksika, Peru, Portekiz, Rusya ve Amerika Birleşik Devletleri'nde bulunmaktadır. Küresel rezervler - ekonomik olarak çıkarılması mümkün olan kaynaklar - 2016 yılında toplam 88 milyon ton olup, bunun 35 milyonu Avustralya'da, 17 milyonu Çin'de ve 6,4 milyonu Rusya'da bulunmaktadır. ⓘ
Kurşunun tipik arka plan konsantrasyonları atmosferde 0,1 μg/m3; toprakta 100 mg/kg; bitki örtüsünde 4 mg/kg ve tatlı su ve deniz suyunda 5 μg/L'yi aşmamaktadır. ⓘ
Etimoloji
Modern İngilizce lead sözcüğü Germen kökenlidir; Orta İngilizce leed ve Eski İngilizce lēad ("e" harfinin üzerindeki makron o harfin ünlü sesinin uzun olduğunu gösterir) sözcüklerinden türetilmiştir. Eski İngilizce sözcük Proto-Germence varsayımsal olarak yeniden yapılandırılmış *lauda- ('lead') sözcüğünden türetilmiştir. Dilbilim teorisine göre, bu sözcük birden fazla Germen dilinde tamamen aynı anlama gelen torunlar doğurmuştur. ⓘ
Proto-Germence *lauda-'nın kökeni konusunda bir fikir birliği yoktur. Bir hipotez, Proto-Hint-Avrupa *lAudh- ('kurşun'; sesli harfin büyük harfle yazılması makrona eşdeğerdir) sözcüğünden türediğini öne sürer. Başka bir hipotez ise Proto-Keltçe *ɸloud-io- ('kurşun') sözcüğünden ödünçlendiğini öne sürer. Bu kelime, elemente kimyasal sembolü Pb'yi veren Latince plumbum ile ilişkilidir. Bu sözcüğün Proto-Germence *bliwa- ('kurşun' anlamına da gelir) sözcüğünün kökeni olduğu ve Almanca Blei sözcüğünün buradan geldiği düşünülmektedir. ⓘ
Kimyasal elementin adı, Proto-Germence *laidijan- ('kurşunlamak') fiilinden türeyen aynı yazılıştaki fiille ilgili değildir. ⓘ
Tarih
Tarih öncesi ve erken tarih
M.Ö. 7000-6500 yıllarına tarihlenen metalik kurşun boncuklar Küçük Asya'da bulunmuştur ve metal eritmenin ilk örneğini temsil ediyor olabilir. O dönemde kurşunun yumuşaklığı ve donuk görünümü nedeniyle çok az (varsa) kullanım alanı vardı. Kurşun üretiminin yaygınlaşmasının en önemli nedeni, galenin (yaygın bir kurşun minerali) yakılmasıyla elde edilebilen gümüşle olan ilişkisiydi. Kurşun mineralini kozmetikte ilk kullananlar Eski Mısırlılar olmuştur ve bu uygulama Eski Yunan'a ve ötesine yayılmıştır; Mısırlılar kurşunu balık ağlarında, sırlarda, camlarda, emayelerde ve süs eşyalarında kullanmış olabilirler. Bereketli Hilal'in çeşitli uygarlıkları kurşunu yazı malzemesi, sikke ve inşaat malzemesi olarak kullanmıştır. Kurşun, Antik Çin kraliyet sarayında uyarıcı, para birimi ve doğum kontrol hapı olarak; İndus Vadisi uygarlığı ve Mezoamerikalılar muska yapımında; doğu ve güney Afrika halkları ise tel çekmede kullanılmıştır. ⓘ
Klasik dönem
Gümüş dekoratif bir malzeme ve değişim aracı olarak yaygın bir şekilde kullanıldığından, M.Ö. 3000'den itibaren Küçük Asya'da kurşun yatakları işlenmeye başlandı; daha sonra Ege ve Laurion'da kurşun yatakları geliştirildi. Bu üç bölge, M.Ö. 1200'lere kadar madenden kurşun üretimine toplu olarak hakim olmuştur. M.Ö. 2000'lerden itibaren Fenikeliler İber yarımadasındaki yatakları işlettiler; M.Ö. 1600'lerde Kıbrıs, Yunanistan ve Sardunya'da kurşun madenciliği vardı. ⓘ

Roma'nın Avrupa ve Akdeniz'deki toprak genişlemesi ve madenciliği geliştirmesi, klasik dönem boyunca en büyük kurşun üreticisi olmasına yol açmış ve yıllık üretimin 80.000 tona ulaştığı tahmin edilmektedir. Selefleri gibi Romalılar da kurşunu çoğunlukla gümüş eritme işleminin bir yan ürünü olarak elde ediyorlardı. Kurşun madenciliği Orta Avrupa, Britanya, Balkanlar, Yunanistan, Anadolu ve Hispania'da yapılıyordu ve bu sonuncusu dünya üretiminin %40'ını oluşturuyordu. ⓘ
Kurşun tabletler yaygın olarak mektup malzemesi olarak kullanılmıştır. Antik Yahudiye'de, ölen kişinin inancına uygun olarak değiştirilebilir motiflere sahip, düz kum formlarında dökülmüş kurşun tabutlar kullanılmıştır. Kurşun, MÖ 5. yüzyıldan itibaren sapan mermisi yapımında kullanılmıştır. Roma döneminde kurşun sapan mermileri bolca kullanılmış ve 100 ila 150 metre mesafede etkili olmuştur. Kartaca ve Roma ordularında paralı asker olarak kullanılan Balearlı sapancılar atış mesafeleri ve isabetleriyle ünlüydü. ⓘ

Kurşun, Roma İmparatorluğu'nda su boruları yapımında kullanılmıştır; metalin Latince karşılığı olan plumbum, İngilizce "plumbing" kelimesinin kökenidir. Çalışma kolaylığı, tamamen su geçirmez kaynaklı bağlantıların kolayca imal edilmesini sağlayan düşük erime noktası ve korozyona karşı direnci, eczacılık, çatı kaplama, para birimi ve savaş dahil olmak üzere diğer uygulamalarda yaygın olarak kullanılmasını sağlamıştır. Yaşlı Cato, Columella ve Yaşlı Pliny gibi dönemin yazarları, şarap ve yiyeceklere eklenen tatlandırıcı ve koruyucuların hazırlanması için kurşun (veya kurşun kaplı) kapları tavsiye etmişlerdir. Kurşun, "kurşun şekeri" (kurşun (II) asetat) oluşumu nedeniyle hoş bir tat verirken, bakır veya bronz kaplar verdigris oluşumu yoluyla acı bir tat verebilirdi. ⓘ
Bu metal klasik antik dönemde açık ara en çok kullanılan malzemeydi ve (Roma) Kurşun Çağı olarak adlandırılması uygundur. Bizim için plastik neyse Romalılar için de kurşun oydu.
Heinz Eschnauer ve Markus Stoeppler
"Wine-An enological specimen bank", 1992 ⓘ
Romalı yazar Vitruvius kurşunun sağlığa zararlarını bildirmiş ve modern yazarlar kurşun zehirlenmesinin Roma İmparatorluğu'nun çöküşünde önemli bir rol oynadığını öne sürmüşlerdir. Diğer araştırmacılar bu tür iddiaları eleştirmiş, örneğin tüm karın ağrılarının kurşun zehirlenmesinden kaynaklanmadığına işaret etmişlerdir. Arkeolojik araştırmalara göre, Roma kurşun boruları musluk suyundaki kurşun seviyesini arttırmıştır ancak böyle bir etkinin "gerçekten zararlı olma ihtimali düşüktür". Kurşun zehirlenmesi meydana geldiğinde, kurbanlar tanrıların hortlak babası Satürn'e atfen karanlık ve alaycı "saturnine" olarak adlandırılıyordu. Kurşun, çağrışım yoluyla tüm metallerin babası olarak kabul edilirdi. Kolayca bulunabildiği ve ucuz olduğu için Roma toplumundaki statüsü düşüktü. ⓘ
Kalay ve antimon ile karıştırılması
Bronz Çağından beri metalürji uzmanları ve mühendisler, sert ve korozyona dayanıklı bronz üretmek için bakırla alaşım yapmak için gerekli olan nadir ve değerli kalay ile 'ucuz ve neşeli' kurşun arasındaki farkı anlamışlardır. Ancak bazı dillerdeki isimlendirmeler benzerdir. Romalılar kurşunu plumbum nigrum ("siyah kurşun") ve kalayı plumbum candidum ("parlak kurşun") olarak adlandırmıştır. Kurşun ve kalayın birlikteliği diğer dillerde de görülebilir: Çekçe'de olovo kelimesi "kurşun" anlamına gelir, ancak Rusça'da soydaşı олово (olovo) "kalay" anlamına gelir. Karışıklığa ek olarak, kurşunun antimon ile yakın bir ilişkisi vardı: her iki element de genellikle birlikte sülfitler (galen ve stibnit) olarak ortaya çıkar. Pliny yanlışlıkla stibnitin ısıtıldığında antimon yerine kurşun vereceğini yazmıştır. Türkiye ve Hindistan gibi ülkelerde, aslen Farsça olan surma ismi ya antimon sülfür ya da kurşun sülfür anlamına gelmiş ve Rusça gibi bazı dillerde antimon (сурьма) olarak adlandırılmıştır. ⓘ
Orta Çağ ve Rönesans

Batı Avrupa'da kurşun madenciliği Batı Roma İmparatorluğu'nun çöküşünden sonra azalmış, Arap İberya'sı önemli bir üretime sahip tek bölge olmuştur. En büyük kurşun üretimi Güney ve Doğu Asya'da, özellikle de kurşun madenciliğinin hızla büyüdüğü Çin ve Hindistan'da gerçekleşmiştir. ⓘ
Avrupa'da kurşun üretimi 11. ve 12. yüzyıllarda tekrar çatı kaplaması ve borular için kullanılmaya başlandığında artmaya başlamıştır. 13. yüzyıldan itibaren kurşun vitray yapımında kullanılmaya başlandı. Avrupa ve Arap simya geleneklerinde kurşun (sembolü ![]() Avrupa geleneğinde) saf olmayan bir ana metal olarak kabul edilirdi ve bu metal, kendisini oluşturan özlerin ayrıştırılması, saflaştırılması ve dengelenmesiyle saf ve bozulmayan altına dönüştürülebilirdi. Bu dönemde kurşun, şarabı katmak için giderek daha fazla kullanılıyordu. Bu tür şarapların Hıristiyan ayinlerinde kullanılması 1498'de bir papalık boğasıyla yasaklandı, ancak içilmeye devam edildi ve 18. yüzyılın sonlarına kadar kitlesel zehirlenmelere yol açtı. Kurşun, matbaanın parçalarında kullanılan önemli bir malzemeydi ve kurşun tozu matbaa işçileri tarafından yaygın olarak solunarak kurşun zehirlenmesine neden oluyordu. Kurşun aynı zamanda ateşli silahlar için mermi yapımında kullanılan başlıca malzeme haline geldi: ucuzdu, demir silah namlularına daha az zarar veriyordu, daha yüksek bir yoğunluğa sahipti (bu da hızın daha iyi korunmasını sağlıyordu) ve daha düşük erime noktası, odun ateşi kullanılarak yapılabildiği için mermi üretimini kolaylaştırıyordu. Kurşun, Venedik serüzeni formunda, Batı Avrupa aristokrasisi tarafından kozmetikte yaygın olarak kullanıldı, çünkü beyazlatılmış yüzler bir alçakgönüllülük işareti olarak kabul edildi. Bu uygulama daha sonra beyaz peruklara ve göz kalemlerine kadar genişledi ve ancak 18. yüzyılın sonlarında Fransız Devrimi ile birlikte ortadan kalktı. Benzer bir moda 18. yüzyılda Japonya'da geyşaların ortaya çıkmasıyla ortaya çıkmış ve bu uygulama 20. yüzyıla kadar devam etmiştir. Kadınların beyaz yüzleri "Japon kadınları olarak kadınsı erdemlerini temsil etmeye başladı" ve beyazlatıcıda yaygın olarak kurşun kullanıldı. ⓘ
Avrupa geleneğinde) saf olmayan bir ana metal olarak kabul edilirdi ve bu metal, kendisini oluşturan özlerin ayrıştırılması, saflaştırılması ve dengelenmesiyle saf ve bozulmayan altına dönüştürülebilirdi. Bu dönemde kurşun, şarabı katmak için giderek daha fazla kullanılıyordu. Bu tür şarapların Hıristiyan ayinlerinde kullanılması 1498'de bir papalık boğasıyla yasaklandı, ancak içilmeye devam edildi ve 18. yüzyılın sonlarına kadar kitlesel zehirlenmelere yol açtı. Kurşun, matbaanın parçalarında kullanılan önemli bir malzemeydi ve kurşun tozu matbaa işçileri tarafından yaygın olarak solunarak kurşun zehirlenmesine neden oluyordu. Kurşun aynı zamanda ateşli silahlar için mermi yapımında kullanılan başlıca malzeme haline geldi: ucuzdu, demir silah namlularına daha az zarar veriyordu, daha yüksek bir yoğunluğa sahipti (bu da hızın daha iyi korunmasını sağlıyordu) ve daha düşük erime noktası, odun ateşi kullanılarak yapılabildiği için mermi üretimini kolaylaştırıyordu. Kurşun, Venedik serüzeni formunda, Batı Avrupa aristokrasisi tarafından kozmetikte yaygın olarak kullanıldı, çünkü beyazlatılmış yüzler bir alçakgönüllülük işareti olarak kabul edildi. Bu uygulama daha sonra beyaz peruklara ve göz kalemlerine kadar genişledi ve ancak 18. yüzyılın sonlarında Fransız Devrimi ile birlikte ortadan kalktı. Benzer bir moda 18. yüzyılda Japonya'da geyşaların ortaya çıkmasıyla ortaya çıkmış ve bu uygulama 20. yüzyıla kadar devam etmiştir. Kadınların beyaz yüzleri "Japon kadınları olarak kadınsı erdemlerini temsil etmeye başladı" ve beyazlatıcıda yaygın olarak kurşun kullanıldı. ⓘ
Avrupa ve Asya dışında
Yeni Dünya'da kurşun üretimi Avrupalı yerleşimcilerin gelişinden kısa bir süre sonra kaydedilmiştir. En eski kayıt, kuruluşundan on dört yıl sonra İngiliz Virginia Kolonisi'nde 1621 yılına aittir. Avustralya'da, sömürgeciler tarafından kıtada açılan ilk maden 1841 yılında bir kurşun madeniydi. Afrika'da kurşun madenciliği ve eritme Benue Çukuru ve aşağı Kongo Havzası'nda bilinmekteydi; burada kurşun Avrupalılarla ticarette ve 17. yüzyılda, Afrika için yapılan mücadeleden çok önce bir para birimi olarak kullanılmaktaydı. ⓘ
Sanayi Devrimi

18'inci yüzyılın ikinci yarısında İngiltere ve daha sonra kıta Avrupası ve Amerika Birleşik Devletleri Sanayi Devrimi'ni yaşadı. Bu, kurşun üretim oranlarının Roma'nınkini aştığı ilk dönemdi. İngiltere önde gelen üreticiydi, 19. yüzyılın ortalarında madenlerinin tükenmesi ve Almanya, İspanya ve Amerika Birleşik Devletleri'nde kurşun madenciliğinin gelişmesiyle bu statüsünü kaybetti. 1900 yılına gelindiğinde Amerika Birleşik Devletleri küresel kurşun üretiminde liderdi ve Avrupa dışındaki diğer ülkeler -Kanada, Meksika ve Avustralya- önemli miktarda üretime başlamıştı; Avrupa dışındaki üretim Avrupa içindekini aşmıştı. Kurşuna olan talebin büyük bir kısmı sıhhi tesisat ve boyadan geliyordu - kurşun boyalar düzenli olarak kullanılıyordu. Bu dönemde daha fazla (işçi sınıfı) insan metale maruz kaldı ve kurşun zehirlenmesi vakaları arttı. Bu durum, kurşun alımının etkileri üzerine araştırmalar yapılmasına yol açtı. Kurşunun duman halindeyken katı bir metalden daha tehlikeli olduğu kanıtlandı. Kurşun zehirlenmesi ve gut hastalığı ilişkilendirildi; İngiliz doktor Alfred Baring Garrod gut hastalarının üçte birinin tesisatçı ve boyacı olduğunu kaydetti. Ruhsal bozukluklar da dahil olmak üzere kronik kurşun alımının etkileri de 19. yüzyılda incelenmiştir. Fabrikalarda kurşun zehirlenmesini azaltmayı amaçlayan ilk yasalar Birleşik Krallık'ta 1870'ler ve 1880'lerde yürürlüğe girmiştir. ⓘ
Modern dönem
Kurşunun insanlar için oluşturduğu tehdide dair daha fazla kanıt 19. yüzyılın sonlarında ve 20. yüzyılın başlarında keşfedilmiştir. Zarar mekanizmaları daha iyi anlaşıldı, kurşun körlüğü belgelendi ve element Amerika Birleşik Devletleri ve Avrupa'da kamu kullanımından aşamalı olarak çıkarıldı. Birleşik Krallık 1878'de zorunlu fabrika denetimlerini başlattı ve 1898'de ilk Fabrika Tıbbi Müfettişini atadı; sonuç olarak 1900'den 1944'e kadar kurşun zehirlenmesi vakalarında 25 kat azalma rapor edildi. Çoğu Avrupa ülkesi, opaklığı ve suya dayanıklılığı nedeniyle yaygın olarak kullanılan kurşun boyayı 1930 yılına kadar iç mekanlarda yasaklamıştır. ⓘ
İnsanların kurşuna maruz kaldığı son önemli olay, 1921 yılında Amerika Birleşik Devletleri'nde ortaya çıkan bir uygulama olan tetraetil kurşunun benzine antiknock maddesi olarak eklenmesiydi. Bu uygulama 2000 yılı itibariyle Amerika Birleşik Devletleri ve Avrupa Birliği'nde aşamalı olarak kaldırılmıştır. ⓘ
1970'lerde Amerika Birleşik Devletleri ve Batı Avrupa ülkeleri kurşun hava kirliliğini azaltmaya yönelik yasalar çıkarmıştır. Bunun etkisi önemliydi: ABD'de Hastalık Kontrol ve Önleme Merkezleri tarafından 1976-1980 yılları arasında yapılan bir araştırma, nüfusun %77,8'inin kan kurşun seviyesinin yüksek olduğunu gösterirken, 1991-1994 yılları arasında aynı enstitü tarafından yapılan bir araştırma, bu kadar yüksek seviyeye sahip kişilerin oranının %2,2'ye düştüğünü gösterdi. Yirminci yüzyılın sonunda kurĢundan yapılan ana ürün kurĢun-asit aküdür. ⓘ
1960'tan 1990'a kadar Batı Bloku'ndaki kurşun üretimi yaklaşık %31 oranında artmıştır. Doğu Bloku'nun dünya kurĢun üretimindeki payı 1950'den 1990'a kadar %10'dan %30'a çıkmıĢtır. 1970'lerin ortalarında ve 1980'lerde Sovyetler Birliği dünyanın en büyük üreticisi olmuĢ, Çin ise 20. yüzyılın sonlarında önemli bir kurĢun üretimine baĢlamıĢtır. Avrupa'daki komünist ülkelerin aksine, Çin 20. yüzyılın ortalarında büyük ölçüde sanayileşmemişti; 2004 yılında Çin en büyük kurşun üreticisi olarak Avustralya'yı geçti. Avrupa'nın sanayileşmesi sırasında olduğu gibi, kurşun Çin'de de sağlık üzerinde olumsuz bir etkiye sahip olmuştur. ⓘ
Üretim

2014 yılı itibariyle, kurşun-asit bataryalarda kullanılması nedeniyle kurşun üretimi dünya çapında artmaktadır. İki ana üretim kategorisi bulunmaktadır: maden cevherlerinden elde edilen birincil ve hurdadan elde edilen ikincil üretim. 2014 yılında 4,58 milyon metrik ton birincil üretimden, 5,64 milyon metrik ton ise ikincil üretimden elde edilmiştir. O yıl madenden çıkarılan kurşun konsantresinin ilk üç üreticisi Çin, Avustralya ve Amerika Birleşik Devletleri olmuştur. Rafine kurşunun ilk üç üreticisi ise Çin, Amerika Birleşik Devletleri ve Hindistan olmuştur. Uluslararası Kaynak Paneli'nin 2010 tarihli Toplumdaki Metal Stokları raporuna göre, küresel bazda kullanımda olan, stoklanan, atılan veya çevreye yayılan toplam kurşun miktarı kişi başına 8 kg'dır. Bunun büyük bir kısmı daha az gelişmiş ülkelerden (kişi başına 1-4 kg) ziyade daha gelişmiş ülkelerdedir (kişi başına 20-150 kg). ⓘ
Birincil ve ikincil kurşun üretim süreçleri benzerdir. Bazı birincil üretim tesisleri artık faaliyetlerini hurda kurşun ile desteklemektedir ve bu eğilimin gelecekte artması muhtemeldir. Yeterli teknikler göz önüne alındığında, ikincil süreçlerle elde edilen kurşun, birincil süreçlerle elde edilen kurşundan ayırt edilemez. ĠnĢaat sektöründen gelen hurda kurĢun genellikle oldukça temizdir ve eritmeye gerek kalmadan yeniden eritilir, ancak bazen rafine edilmesi gerekir. Bu nedenle ikincil kurşun üretimi, enerji gereksinimleri açısından birincil üretime göre genellikle %50 veya daha fazla oranda daha ucuzdur. ⓘ
Birincil
Çoğu kurşun cevheri, ekstraksiyon için konsantre edilmesi gereken düşük oranda kurşun içerir (zengin cevherler tipik olarak %3-8 içeriğe sahiptir). İlk işleme sırasında cevherler tipik olarak kırma, yoğun-orta ayırma, öğütme, köpük flotasyonu ve kurutma işlemlerinden geçer. Elde edilen ve kütlece %30-80 (düzenli olarak %50-60) kurşun içeriğine sahip olan konsantre daha sonra (saf olmayan) kurşun metaline dönüştürülür. ⓘ
Bunu yapmanın iki ana yolu vardır: ayrı kaplarda gerçekleştirilen kavurma ve ardından yüksek fırın ekstraksiyonunu içeren iki aşamalı bir süreç; veya konsantrenin ekstraksiyonunun tek bir kapta gerçekleştiği doğrudan bir süreç. Birincisi hala önemli olsa da, ikincisi en yaygın yol haline gelmiştir.
| Ülke | Çıktı (bin ton) ⓘ |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Diğer ülkeler | 170 |
İki aşamalı süreç
İlk olarak, kurşun sülfürü oksitlemek için sülfür konsantresi havada kavrulur:
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑ ⓘ
Orijinal konsantre saf kurşun sülfür olmadığından, kavurma yalnızca istenen kurşun (II) oksidi değil, aynı zamanda kurşun ve cevherde bulunan diğer metallerin oksitleri, sülfatları ve silikatlarının bir karışımını da verir. Bu saf olmayan kurşun oksit, kok ateşlemeli bir yüksek fırında (yine saf olmayan) metale indirgenir:
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑ ⓘ
Safsızlıklar çoğunlukla arsenik, antimon, bizmut, çinko, bakır, gümüş ve altındır. Tipik olarak bir dizi pirometalurjik işlemle giderilirler. Eriyik, gümüş, altın ve bizmut dışındaki safsızlıkları oksitleyen hava, buhar ve kükürt içeren bir reverber fırınında işlenir. Oksitlenmiş kirleticiler eriyiğin üstüne çıkar ve sıyrılır. Metalik gümüş ve altın, kurşuna çinko ilave edilen Parkes prosesi ile ekonomik bir şekilde çıkarılır ve geri kazanılır. Kurşunla karışmayan çinko, gümüş ve altını çözer. Çinko çözeltisi kurĢundan ayrılabilir ve gümüĢ ve altın geri kazanılabilir. Gümüşü alınmış kurşun, metalik kalsiyum ve magnezyum ile muamele edilerek Betterton-Kroll işlemi ile bizmuttan arındırılır. Ortaya çıkan bizmut cürufu sıyrılabilir. ⓘ
Pirometalurjik süreçlere alternatif olarak, Betts süreci kullanılarak elektrolitik olarak eritilmiş kurşun işlenerek çok saf kurşun elde edilebilir. Saf olmayan kurşunun anotları ve saf kurşunun katotları kurşun florosilikat (PbSiF6) elektroliti içine yerleştirilir. Elektrik potansiyeli uygulandığında, anottaki saf olmayan kurşun çözünerek katot üzerine tabakalanır ve safsızlıkların çoğunu çözeltide bırakır. Bu yüksek maliyetli bir işlemdir ve bu nedenle çoğunlukla yüksek oranda safsızlık içeren külçelerin rafine edilmesi için ayrılmıştır. ⓘ
Doğrudan proses
Bu işlemde, kurşun konsantrelerinden doğrudan kurşun külçe ve cüruf elde edilir. Kurşun sülfür konsantresi bir fırında eritilir ve kurşun monoksit oluşturacak şekilde oksitlenir. Karbon (kok veya kömür gazı olarak) erimiş yüke eritici maddelerle birlikte eklenir. Kurşun monoksit böylece kurşun monoksit açısından zengin bir cürufun ortasında metalik kurşuna indirgenir. ⓘ
Eğer girdi kurşun açısından zenginse, orijinal kurşunun %80'i külçe olarak elde edilebilir; kalan %20'si ise kurşun monoksit açısından zengin bir cüruf oluşturur. Düşük dereceli bir besleme için, kurşunun tamamı yüksek kurşunlu bir cürufa oksitlenebilir. Metalik kurşun ayrıca yüksek kurşunlu (%25-40) cüruftan daldırılmış yakıt yakma veya enjeksiyon, elektrikli fırın destekli indirgeme veya her ikisinin bir kombinasyonu yoluyla elde edilir. ⓘ
Alternatifler
Daha temiz, daha az enerji tüketen bir kurĢun çıkarma süreci üzerine araĢtırmalar devam etmektedir; en büyük dezavantaj ya çok fazla kurĢunun atık olarak kaybedilmesi ya da alternatiflerin elde edilen kurĢun metalinde yüksek sülfür içeriğiyle sonuçlanmasıdır. Saf olmayan kurşun anotlarının bir elektrolit içine daldırıldığı ve saf kurşunun bir katot üzerinde biriktirildiği hidrometalurjik ekstraksiyon, potansiyeli olabilecek bir tekniktir, ancak elektriğin çok ucuz olduğu durumlar dışında şu anda ekonomik değildir. ⓘ
İkincil
Birincil üretimin önemli bir parçası olan eritme, ikincil üretim sırasında genellikle atlanır. Yalnızca metalik kurşun önemli ölçüde oksidasyona uğradığında gerçekleştirilir. Süreç, yüksek fırın ya da döner fırında yapılan birincil üretime benzer; temel fark, verimin daha değişken olmasıdır: yüksek fırınlar sert kurşun (%10 antimon) üretirken, reverber ve döner fırınlar yarı yumuşak kurşun (%3-4 antimon) üretir. ⓘ
ISASMELT süreci, birincil üretimin bir uzantısı olarak hareket edebilen daha yeni bir eritme yöntemidir; kullanılmış kurşun-asit bataryalardan (kurşun sülfat ve kurşun oksitler içeren) elde edilen batarya macunu, alkali ile muamele edilerek sülfattan arındırılır ve daha sonra oksijen varlığında kömür yakıtlı bir fırında işlenir, bu da en yaygın safsızlık olan antimon ile saf olmayan kurşun verir. İkincil kurşunun arıtılması birincil kurşunun arıtılmasına benzer; geri dönüştürülen malzemeye ve potansiyel kirliliğine bağlı olarak bazı arıtma işlemleri atlanabilir. ⓘ
Geri dönüşüm için kurşun kaynakları arasında kurşun-asit aküler en önemlisidir; kurşun boru, levha ve kablo kılıfları da önemlidir. ⓘ
Uygulamalar

Yaygın inanışın aksine, tahta kalemlerdeki kurşun kalem uçları hiçbir zaman kurşundan yapılmamıştır. Kurşun kalem sarılı grafit bir yazı aracı olarak ortaya çıktığında, kullanılan özel grafit türü plumbago (kelime anlamıyla, kurşun veya kurşun maketi için hareket) olarak adlandırılmıştır. ⓘ
Elemental form
Kurşun metali, yüksek yoğunluk, düşük erime noktası, süneklik ve göreceli inertlik dahil olmak üzere birçok yararlı mekanik özelliğe sahiptir. Birçok metal bu özelliklerin bazılarında kurşundan daha üstündür, ancak genellikle daha az yaygındır ve ana cevherlerden çıkarılması daha zordur. Kurşunun zehirli olması, bazı kullanım alanları için aşamalı olarak kullanımdan kaldırılmasına yol açmıştır. ⓘ
Kurşun, Orta Çağ'daki icadından bu yana mermiler için kullanılmaktadır. Ucuzdur; düşük erime noktası, küçük silah mühimmatının ve av tüfeği saçmalarının minimum teknik ekipmanla dökülebileceği anlamına gelir; ve diğer yaygın metallerden daha yoğundur, bu da hızın daha iyi korunmasını sağlar. Sertleştirici olarak diğer metallerle alaşımlandırılan mermiler için ana malzeme olmaya devam etmektedir. Avcılık için kullanılan kurşun mermilerin çevreye zarar verebileceğine dair endişeler dile getirilmiştir. ⓘ
Kurşunun yüksek yoğunluğundan ve korozyona karşı direncinden bir dizi ilgili uygulamada yararlanılmıştır. Yelkenli omurgalarında balast olarak kullanılır; yoğunluğu küçük bir hacim kaplamasına ve su direncini en aza indirmesine olanak tanır, böylece rüzgarın yelkenler üzerindeki savrulma etkisini dengeler. Dalgıcın kaldırma kuvvetini dengelemek için tüplü dalış ağırlık kemerlerinde kullanılır. 1993 yılında, Pisa Kulesi'nin tabanı 600 ton kurşun ile stabilize edilmiştir. Korozyon direnci nedeniyle kurşun, su altı kabloları için koruyucu kılıf olarak kullanılır. ⓘ

Kurşunun inşaat sektöründe birçok kullanımı vardır; kurşun levhalar çatı kaplama malzemesi, kaplama, flashing, oluk ve oluk bağlantılarında ve çatı parapetlerinde mimari metal olarak kullanılır. Kurşun, armatürler de dahil olmak üzere heykellerde ve heykellerde hala kullanılmaktadır. Geçmişte genellikle arabaların tekerleklerini dengelemek için kullanılırdı; çevresel nedenlerden dolayı bu kullanım diğer malzemeler lehine aşamalı olarak kaldırılmaktadır. ⓘ
Kurşun, pirinç ve bronz gibi bakır alaşımlarına işlenebilirliği artırmak ve yağlama özellikleri için eklenir. Bakırda pratik olarak çözünmeyen kurşun, alaşım boyunca tane sınırları gibi kusurlarda katı kürecikler oluşturur. Düşük konsantrasyonlarda, yağlayıcı olarak hareket etmenin yanı sıra, kürecikler alaşım işlenirken talaş oluşumunu engeller ve böylece işlenebilirliği artırır. Daha yüksek konsantrasyonlarda kurşun içeren bakır alaşımları rulmanlarda kullanılır. Kurşun yağlama, bakır ise yük taşıma desteği sağlar. ⓘ
Kurşunun yüksek yoğunluğu, atom numarası ve şekillendirilebilirliği, kurşunun ses, titreşim ve radyasyonu emen bir bariyer olarak kullanılmasının temelini oluşturur. Kurşunun doğal rezonans frekansları yoktur; sonuç olarak kurşun levha ses stüdyolarının duvarlarında, zeminlerinde ve tavanlarında ses yalıtım katmanı olarak kullanılır. Org boruları genellikle kurşun alaşımından yapılır ve her bir borunun tonunu kontrol etmek için çeşitli miktarlarda kalay ile karıştırılır. Kurşun, yoğunluğu ve yüksek zayıflama katsayısı nedeniyle nükleer bilimlerde ve röntgen odalarında radyasyondan koruyucu bir malzemedir. Erimiş kurşun, kurşun soğutmalı hızlı reaktörler için soğutucu olarak kullanılmıştır. ⓘ
Kurşunun 21. yüzyılın başlarındaki en büyük kullanım alanı kurşun-asit akülerdir. Akülerdeki kurşun insanlarla doğrudan temas etmez, bu nedenle toksisite endişeleri daha azdır. Kurşun akü üretim tesislerinde çalışan insanlar kurşun tozuna maruz kalabilir ve bu tozu soluyabilir.} Aküde kurşun, kurşun dioksit ve sülfürik asit arasındaki reaksiyonlar güvenilir bir voltaj kaynağı sağlar. Kurşun-asit bataryalar içeren süper kapasitörler Avustralya, Japonya ve Amerika Birleşik Devletleri'nde kilovat ve megavat ölçekli uygulamalarda frekans düzenlemesi, güneş yumuşatma ve kaydırma, rüzgar yumuşatma ve diğer uygulamalarda kullanılmaktadır. Bu bataryalar lityum-iyon bataryalara göre daha düşük enerji yoğunluğuna ve şarj-deşarj verimliliğine sahiptir, ancak önemli ölçüde daha ucuzdur. ⓘ
Kurşun, yüksek voltajlı güç kablolarında yalıtım içine su difüzyonunu önlemek için kılıf malzemesi olarak kullanılır; kurşun aşamalı olarak kullanımdan kaldırıldığı için bu kullanım azalmaktadır. Elektronik lehimlerde kullanımı da çevreye zararlı atık miktarını azaltmak için bazı ülkeler tarafından aşamalı olarak kaldırılmaktadır. Kurşun, müze malzemeleri için Oddy testinde kullanılan üç metalden biridir ve organik asitleri, aldehitleri ve asidik gazları tespit etmeye yardımcı olur. ⓘ
Bileşikler


Kurşun metal için ana uygulama olmasının yanı sıra, kurşun-asit aküler de kurşun bileşiklerinin ana tüketicisidir. Bu cihazlarda kullanılan enerji depolama/serbest bırakma reaksiyonu kurşun sülfat ve kurşun dioksit içerir:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l) ⓘ
Kurşun bileşiklerinin diğer uygulamaları çok özeldir ve genellikle solmaktadır. Kurşun bazlı renklendirici maddeler seramik sırlarında ve camlarda, özellikle kırmızı ve sarı tonları için kullanılmaktadır. Kurşun boyalar Avrupa ve Kuzey Amerika'da aşamalı olarak kaldırılırken, Çin, Hindistan veya Endonezya gibi daha az gelişmiş ülkelerde kullanılmaya devam etmektedir. Kurşun tetraasetat ve kurşun dioksit organik kimyada oksitleyici maddeler olarak kullanılır. Kurşun, elektrik kablolarının polivinil klorür kaplamasında sıklıkla kullanılır. Daha uzun, daha eşit bir yanma sağlamak için mum fitillerini işlemek için kullanılabilir. Zehirli olması nedeniyle Avrupalı ve Kuzey Amerikalı üreticiler çinko gibi alternatifler kullanmaktadır. Kurşun cam %12-28 kurşun oksitten oluşur, optik özelliklerini değiştirir ve katot ışınlı tüplere sahip eski TV'lerde ve bilgisayar monitörlerinde kullanılan bir özellik olan iyonlaştırıcı radyasyonun iletimini azaltır. Kurşun tellürid ve kurşun selenid gibi kurşun bazlı yarı iletkenler fotovoltaik hücrelerde ve kızılötesi dedektörlerde kullanılır. ⓘ
Biyolojik etkileri
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Piktogramlar
|
  
|
Sinyal kelimesi
|
Tehlike |
Tehlike bildirimleri
|
H302, H332, H351, H360Df, H373, H410 |
Önlem ifadeleri
|
P201, P261, P273, P304, P308, P312, P313, P340, P391 |
| NFPA 704 (yangın elması) | |
Kurşunun onaylanmış bir biyolojik rolü yoktur ve kurşuna maruz kalmanın onaylanmış güvenli bir seviyesi yoktur. 2009 yılında Kanada-Amerika'da yapılan bir araştırma, çok az risk oluşturduğu ya da hiç risk oluşturmadığı düşünülen seviyelerde bile kurşunun "olumsuz ruh sağlığı sonuçlarına" neden olabileceği sonucuna varmıştır. İnsan vücudundaki yaygınlığı - yetişkinlerde ortalama 120 mg - yine de ağır metaller arasında sadece çinko (2500 mg) ve demir (4000 mg) tarafından aşılmaktadır. Kurşun tuzları vücut tarafından çok etkili bir şekilde emilir. Kurşunun küçük bir miktarı (%1) kemiklerde depolanır; geri kalanı maruziyetten sonraki birkaç hafta içinde idrar ve dışkı ile atılır. Kurşunun sadece yaklaşık üçte biri bir çocuk tarafından atılır. Sürekli maruziyet kurşunun biyolojik birikimine neden olabilir. ⓘ
Zehirlilik
Kurşun, insan vücudundaki hemen hemen her organı ve sistemi etkileyen son derece zehirli bir metaldir (solunduğunda veya yutulduğunda). Havadaki 100 mg/m3 seviyelerinde, yaşam ve sağlık için hemen tehlikelidir. Yutulan kurşunun çoğu kan dolaşımına karışır. Toksisitesinin birincil nedeni, enzimlerin düzgün işleyişine müdahale etme tercihidir. Bunu, birçok enzimde bulunan sülfhidril gruplarına bağlanarak veya birçok enzimatik reaksiyonda kofaktör olarak görev yapan diğer metalleri taklit ederek ve yer değiştirerek yapar. Kurşunun etkileşime girdiği temel metaller arasında kalsiyum, demir ve çinko bulunur. Yüksek kalsiyum ve demir seviyeleri kurşun zehirlenmesine karşı bir miktar koruma sağlama eğilimindedir; düşük seviyeler ise duyarlılığın artmasına neden olur. ⓘ
Etkileri
Kurşun beyin ve böbreklerde ciddi hasara ve nihayetinde ölüme neden olabilir. Kurşun, kalsiyumu taklit ederek kan-beyin bariyerini geçebilir. Nöronların miyelin kılıflarını bozar, sayılarını azaltır, nörotransmisyon yollarına müdahale eder ve nöronal büyümeyi azaltır. İnsan vücudunda kurşun, porfobilinojen sentaz ve ferroşelatazı inhibe ederek hem porfobilinojen oluşumunu hem de demirin hem sentezindeki son adım olan protoporfirin IX'a katılmasını önler. Bu da etkisiz hem sentezine ve mikrositik anemiye neden olur. ⓘ

Kurşun zehirlenmesinin belirtileri arasında nefropati, kolik benzeri karın ağrıları ve muhtemelen parmaklarda, bileklerde veya ayak bileklerinde güçsüzlük yer alır. Özellikle orta yaşlı ve yaşlı kişilerde küçük kan basıncı artışları belirgin olabilir ve anemiye neden olabilir. Çoğunlukla kesitsel olan birkaç çalışma, artan kurşun maruziyeti ile kalp hızı değişkenliğinin azalması arasında bir ilişki bulmuştur. Hamile kadınlarda, yüksek düzeyde kurşuna maruz kalma düşüğe neden olabilir. Kronik, yüksek seviyeli maruziyetin erkeklerde doğurganlığı azalttığı gösterilmiştir. ⓘ
Kurşun, çocuğun gelişmekte olan beyninde, serebral kortekste sinaps oluşumuna, nörokimyasal gelişime (nörotransmitterler de dahil olmak üzere) ve iyon kanallarının organizasyonuna müdahale eder. Erken çocukluk döneminde maruz kalma, daha sonraki çocukluk döneminde artan uyku bozuklukları ve gündüz aşırı uyku hali riski ile ilişkilendirilmiştir. Yüksek kan seviyeleri kızlarda ergenliğin gecikmesi ile ilişkilidir. Tetraetil kurşunun 20. yüzyıl boyunca benzinde yanmasından kaynaklanan havadaki kurşuna maruziyetteki artış ve azalış, suç seviyelerindeki tarihsel artış ve azalışlarla ilişkilendirilmiştir. ⓘ
Maruziyet kaynakları
Kurşun madenciliği, eritme ve akü üretimi/bertarafı/geri dönüşümü birçok ülkede yaygın olduğu için kurşuna maruz kalma küresel bir sorundur. Kurşun vücuda solunum, sindirim veya deri emilimi yoluyla girer. Solunan kurşunun neredeyse tamamı vücuda emilir; sindirim için bu oran %20-70'tir ve çocuklar yetişkinlerden daha yüksek bir yüzdeyi emer. ⓘ
Zehirlenme tipik olarak kurşunla kirlenmiş gıda veya suyun yutulmasından ve daha az yaygın olarak da kirlenmiş toprak, toz veya kurşun bazlı boyanın kazara yutulmasından kaynaklanır. Deniz suyu ürünleri, yakındaki endüstriyel sulardan etkilenmişse kurşun içerebilir. Meyve ve sebzeler, yetiştirildikleri topraklardaki yüksek kurşun seviyeleri nedeniyle kirlenebilir. Toprak, borulardaki kurşundan, kurşun boyadan ve kurşunlu benzinden kaynaklanan artık emisyonlardan kaynaklanan partikül birikimi yoluyla kirlenebilir. ⓘ
Su borularında kurşun kullanımı, yumuşak veya asitli suya sahip bölgelerde bir sorundur. Sert su boruların iç yüzeyinde çözünmeyen koruyucu tabakalar oluştururken, yumuşak ve asidik su kurşun boruları çözer. Taşınan sudaki çözünmüş karbondioksit, çözünebilir kurşun bikarbonat oluşumuna neden olabilir; oksijenli su da benzer şekilde kurşunu kurşun (II) hidroksit olarak çözebilir. Bu tür suların içilmesi, zamanla, çözünmüş kurşunun toksisitesi nedeniyle sağlık sorunlarına neden olabilir. Su ne kadar sert olursa o kadar fazla kalsiyum bikarbonat ve sülfat içerecek ve boruların içi koruyucu bir kurşun karbonat veya kurşun sülfat tabakası ile kaplanacaktır. ⓘ

Uygulanmış kurşun bazlı boyanın yutulması çocuklar için başlıca maruziyet kaynağıdır: Doğrudan bir kaynak, eski boyalı pencere pervazlarını çiğnemektir. Alternatif olarak, uygulanan kuru boya bozuldukça soyulur, toz haline gelir ve daha sonra el-ağız teması veya kontamine gıda, su veya alkol yoluyla vücuda girer. Bazı ev ilaçlarının yutulması kurşun veya bileşiklerine maruz kalınmasına neden olabilir. ⓘ
Soluma, sigara içenleri ve özellikle kurşunla ilgili mesleklerde çalışanları etkileyen ikinci önemli maruziyet yoludur. Sigara dumanı, diğer toksik maddelerin yanı sıra radyoaktif kurşun-210 içerir. ⓘ
Organik kurşun bileşikleri ile çalışan kişiler için deri maruziyeti önemli olabilir. İnorganik kurşun için deri emilim oranı daha düşüktür. ⓘ
Plastik oyuncaklarda kurşun
Amerika Birleşik Devletleri Hastalık Kontrol Merkezi'ne göre, "plastiklerde kurşun kullanımı yasaklanmamıştır. Kurşun plastiği yumuşatır ve orijinal şekline geri dönebilmesi için daha esnek hale getirir. Ayrıca plastik oyuncaklarda molekülleri ısıya karşı stabilize etmek için de kullanılabilir. Plastik güneş ışığına, havaya ve kurşun ile plastik arasındaki kimyasal bağı parçalayan deterjanlara maruz kaldığında kurşun tozu oluşabilir. ⓘ
Tedavi
Kurşun zehirlenmesinin tedavisi normalde dimerkaprol ve süksimer verilmesini içerir. Akut vakalarda kalsiyum şelatı olan disodyum kalsiyum edetat ve etilendiamintetraasetik asidin (EDTA) disodyum tuzunun kullanılması gerekebilir. Kurşun için kalsiyumdan daha büyük bir afiniteye sahiptir, sonuç olarak kurşun şelatı değişim yoluyla oluşur ve idrarla atılır, geride zararsız kalsiyum bırakır. ⓘ
Çevresel etkiler

Kurşun ve ürünlerinin çıkarılması, üretimi, kullanımı ve bertarafı, Dünya'nın toprak ve sularının önemli ölçüde kirlenmesine neden olmuştur. Kurşunun atmosferik emisyonları Sanayi Devrimi sırasında ve yirminci yüzyılın ikinci yarısındaki kurşunlu benzin döneminde zirveye ulaşmıştır. ⓘ
Kurşun salınımları doğal kaynaklardan (yani doğal olarak oluşan kurşunun konsantrasyonu), endüstriyel üretimden, yakma ve geri dönüşümden ve daha önce gömülmüş olan kurşunun mobilizasyonundan kaynaklanmaktadır. Özellikle, kurşunun diğer kullanım alanlarından aşamalı olarak çıkarılmasıyla birlikte, Küresel Güney'de, küresel imalat için kullanılan ucuz kurşunu çıkarmak için tasarlanan kurşun geri dönüşüm işlemleri, iyi belgelenmiş bir maruziyet kaynağı haline gelmiştir. Sanayi sonrası ve kentsel alanlarda toprak ve tortularda yüksek kurşun konsantrasyonları devam etmektedir; kömür yakılmasından kaynaklananlar da dahil olmak üzere endüstriyel emisyonlar dünyanın birçok yerinde, özellikle de gelişmekte olan ülkelerde devam etmektedir. ⓘ
Kurşun, özellikle organik içeriği yüksek olan topraklarda birikebilir ve burada yüzlerce ila binlerce yıl kalabilir. Çevresel kurşun, bitki yüzeylerinde ve içinde bulunan diğer metallerle rekabet ederek potansiyel olarak fotosentezi engelleyebilir ve yeterince yüksek konsantrasyonlarda bitki büyümesini ve hayatta kalmasını olumsuz yönde etkileyebilir. Toprak ve bitkilerin kirlenmesi, kurşunun besin zincirinde yükselerek mikroorganizmaları ve hayvanları etkilemesine yol açabilir. Hayvanlarda kurşun birçok organda toksisite göstermekte, sindirim, soluma veya deri emilimi sonrasında sinir, böbrek, üreme, hematopoetik ve kardiyovasküler sistemlere zarar vermektedir. Balıklar hem sudan hem de tortudan kurşun alır; besin zincirindeki biyoakümülasyon balıklar, kuşlar ve deniz memelileri için tehlike oluşturur. ⓘ
Antropojenik kurşun, saçma ve platinlerden gelen kurşunu içerir. Bunlar, kurşun üretim sahaları ile birlikte kurşun kirliliğinin en güçlü kaynakları arasındadır. Kurşun, 2017 yılında Amerika Birleşik Devletleri'nde saçma ve platinler için yasaklanmıştır, ancak bu yasak yalnızca bir ay süreyle geçerli olmuştur ve Avrupa Birliği'nde de benzer bir yasak düşünülmektedir. ⓘ
Çevredeki kurşunun belirlenmesine yönelik analitik yöntemler arasında spektrofotometri, X-ışını floresansı, atomik spektroskopi ve elektrokimyasal yöntemler yer almaktadır. S,S'-metilenbis (N,N-diizobutilditiyokarbamat) iyonoforuna dayanan spesifik bir iyon seçici elektrot geliştirilmiştir. Kurşun zehirlenmesi için önemli bir biyomarker testi plazma, serum ve idrardaki δ-aminolevulinik asit seviyeleridir. ⓘ
Kısıtlama ve iyileştirme

1980'lerin ortalarına gelindiğinde, sanayide kurşun kullanımında önemli bir azalma olmuştur. Amerika Birleşik Devletleri'nde çevresel düzenlemeler benzin, boyalar, lehimler ve su sistemleri dahil olmak üzere akü dışı ürünlerde kurşun kullanımını azaltmış veya ortadan kaldırmıştır. Kurşun emisyonlarını yakalamak için kömürle çalışan enerji santrallerine partikül kontrol cihazları yerleştirilmiştir. 1992 yılında ABD Kongresi, Çevre Koruma Ajansı'ndan ülkedeki çocukların kan kurşun seviyelerini düşürmesini istedi. Kurşun kullanımı, Avrupa Birliği'nin 2003 tarihli Tehlikeli Maddelerin Kısıtlanması Direktifi ile daha da kısıtlandı. Hollanda'da 1993 yılında avcılık ve spor amaçlı atışlarda kurşun saçma kullanımının ulusal düzeyde yasaklanmasının ardından kurşun birikiminde büyük bir düşüş meydana gelmiştir: 1990 yılında 230 tondan 1995 yılında 47,5 tona düşmüştür. ⓘ
Amerika Birleşik Devletleri'nde, metalik kurşun, inorganik kurşun bileşikleri ve kurşun sabunlarını içeren işyerinde kurşun için izin verilen maruz kalma sınırı 2012 yılında 8 saatlik bir iş gününde 50 μg/m3 ve kandaki kurşun seviyesi sınırı 100 g kan başına 5 μg olarak belirlenmiştir. Kurşun, taş eşya, vinil (boru ve elektrik kablolarının yalıtımı için kullanılanlar gibi) ve Çin pirincinde hala zararlı miktarlarda bulunabilir. Eski evler hala kurşun boya içerebilir. Beyaz kurşun boya sanayileşmiş ülkelerde satıştan çekilmiştir, ancak sarı kurşun kromat gibi diğer pigmentlerin özel kullanımları devam etmektedir. Eski boyanın zımparalanarak sıyrılması, solunabilecek toz üretir. Küçük çocukların yaşadığı mülklerde bazı yetkililer tarafından kurşun azaltma programları zorunlu kılınmıştır. ⓘ
Kurşun atıkları, yargı yetkisine ve atığın niteliğine bağlı olarak, evsel atık (kurşun azaltma faaliyetlerini kolaylaştırmak için) veya özel işlem veya depolama gerektiren potansiyel olarak tehlikeli atık olarak değerlendirilebilir. Kurşun, çekim yapılan yerlerde çevreye salınır ve kurşun kirliliğine karşı koymak için bir dizi kurşun yönetimi uygulaması geliştirilmiştir. Kurşun göçü asidik topraklarda artabilir; buna karşı koymak için, toprakları nötralize etmek ve kurşunun sızmasını önlemek için toprakların kireçle işlenmesi tavsiye edilir. ⓘ
Kurşunun biyolojik yollarla biyosistemlerden nasıl uzaklaştırılacağı konusunda araştırmalar yapılmıştır: Balık kemikleri, kirlenmiş topraktaki kurşunu biyoremediate etme yetenekleri açısından araştırılmaktadır. Aspergillus versicolor mantarı, su kaynaklarına salınmadan önce endüstriyel atıklardan kurşun iyonlarını absorbe etmede etkilidir. Sülfat indirgeyen bakteriler Desulfovibrio ve Desulfotomaculum da dahil olmak üzere, her ikisi de sulu çözeltilerde oldukça etkili olan çeşitli bakteriler, kurşunu çevreden uzaklaştırma yetenekleri açısından araştırılmıştır. ⓘ
Bulunuşu

Kullanılmakta olan en eski metallerden biridir. Simyacılar kurşunu, en eski metal olarak düşünüp Satürn gezegeniyle özdeşleştirmişler ve onun simgesiyle göstermişlerdir. Abidos antik şehrinde bulunan bir figür MÖ 3000 yılına aittir. İlk üretim yapılan kurşun madenlerinden en iyi bilineni Balıkesir'de Balya-Karaaydın madenidir. Mısır'da eski Mısır medeniyetine ait kurşun borular bulunmuş ve kurşun lehimlerin çeşitli alanlarda kullanıldığı saptanmıştır. Fenikeliler Kıbrıs, Sardinya ve İspanya'da kurşun madenleri işletmişlerdir. ⓘ
Elde edilişi
Kurşun cevherleri yer altından kazma, patlatma, kırma ve öğütme aşamalarından geçirilerek çıkarılır ve daha sonra ekstraktif metalurji yöntemleriyle işlenirler. Köpük flotasyonu prosesi, kurşunun, beraberinde bulunan kaya ve toprak parçalarından ayrılarak, %65-80 Pb içeren bir konsantrede toplanmasını sağlar. Kurşun konsantresi kurutulduktan sonra pirometalurjik işlemlerle önce sinterlenir ve sonra da %97 Pb içerecek şekilde ergitilir. Ürün aşamalı bir şekilde soğutularak, kurşundan daha hafif empüritelerin (safsızlıklar) dross tabakası oluşturacak şekilde yüzeyde toplanması ve uzaklaştırılmaları sağlanır. Ergimiş kurşun bulyonunda kalan empüritelerin de bir sonraki aşamada, üzerinden hava geçirilen bir ergitme işlemiyle curuf fazında toplanarak ayrışmaları ve kurşunun safiyetinin de %99,9'a çıkması sağlanır. ⓘ
Kullanım alanları
- Akü imali
- Kablo izolasyonu
- Madde ve diğer ürünler
- Mühimmat
- Alaşımlar
- Kimyasal maddeler ve pigmentler
- Radyasyon yalıtımları
- Benzin katkısı ⓘ
Çevre (kurşun zehirlenmesi)
Kurşunun kolay işlenebilen, yaygın bir metal olması ve ergime derecesinin düşüklüğü (327,5 °C) nedeniyle iş yaşamında çok yaygın olarak kullanılır.
- 550 °C'un üstünde ortam havasında buharlaşır ve kondanse olmuş, kurşun oksit partikülleri olarak yayılır. ⓘ
Kurşun, hava, su ve toprak yoluyla, solunumla ve besinlere karışarak biyolojik sistemlere giren son derece zehirleyici özelliklere sahip bir metaldir. Yüzbinlerce ton kurşun, kurşunlu petrolden elde edilen ve kurşun tetra-etil ((CH3CH2)4Pb) eklenerek oktan sayısı arttırılan yakıtlarla çalışan içten yanmalı motorlardan çıkan gazlarla dünya atmosferine boşaltılmaktadır. Atmosferden kurşun (büyük oranda metal oksitleri ve tuzları şeklinde) yağmurla tekrar yeryüzüne inerek çevremize her geçen gün daha fazla yayılmaktadır. Kurşun madenleri ve metal endüstrileri, akü ve pil fabrikaları, petrol rafinerileri, boya endüstrisi ve patlayıcı sanayii atık sularında da istenmeyen konsantrasyonlarda kurşun kirliliğine rastlanır. Pil fabrikası atık sularında 5,66 mg/l, asidik maden drenajlarında 0,02-2,5 mg/l, tetraetil kurşun üreten fabrika atık sularında 120–150 mg/l organik, 66–85 mg/l inorganik kurşun kirliliğine rastlanmıştır. ⓘ
Seruzit (PbCO3) minerali. ⓘ










