Kemoterapi
| Kemoterapi ⓘ | |
|---|---|
 Meme kanseri nedeniyle docetaxel kemoterapisi gören bir kadın. Tırnaklarının zarar görmesini azaltmak için ellerine ve ayaklarına soğuk eldivenler ve soğuk patikler yerleştirilir. | |
| Diğer isimler | kemo, CTX, CTx |
Kemoterapi (genellikle kemo ve bazen CTX veya CTx olarak kısaltılır), standartlaştırılmış bir kemoterapi rejiminin parçası olarak bir veya daha fazla anti-kanser ilacı (kemoterapötik ajanlar) kullanan bir kanser tedavisi türüdür. Kemoterapi küratif bir amaçla verilebilir (neredeyse her zaman ilaç kombinasyonlarını içerir) veya yaşamı uzatmayı veya semptomları azaltmayı (palyatif kemoterapi) amaçlayabilir. Kemoterapi, özellikle tıbbi onkoloji olarak adlandırılan kanser için farmakoterapiye adanmış tıp disiplininin ana kategorilerinden biridir. ⓘ
Kemoterapi terimi, mitozu (hücre bölünmesi) inhibe etmek veya DNA hasarını indüklemek için hücre içi zehirlerin spesifik olmayan kullanımını çağrıştırmaya başlamıştır, bu nedenle DNA onarımının inhibisyonu kemoterapiyi artırabilir. Kemoterapi kelimesinin çağrışımı, hücre dışı sinyalleri (sinyal iletimi) bloke eden daha seçici ajanları hariç tutmaktadır. Klasik endokrin hormonlardan (öncelikle meme kanseri için östrojenler ve prostat kanseri için androjenler) gelen büyümeyi teşvik edici sinyalleri engelleyen spesifik moleküler veya genetik hedefleri olan tedavilerin geliştirilmesi artık hormonal tedaviler olarak adlandırılmaktadır. Buna karşın, reseptör tirozin kinazlarla ilişkili olanlar gibi büyüme sinyallerinin diğer inhibisyonları hedefe yönelik tedavi olarak adlandırılmaktadır. ⓘ
Daha da önemlisi, ilaçların kullanımı (kemoterapi, hormonal terapi veya hedefe yönelik terapi), kan dolaşımına girmeleri ve bu nedenle prensipte vücuttaki herhangi bir anatomik lokasyondaki kanseri ele alabilmeleri nedeniyle kanser için sistemik tedavi oluşturur. Sistemik tedavi genellikle radyasyon tedavisi, cerrahi veya hipertermi tedavisi gibi kanser için lokal tedavi (yani etkinliği uygulandıkları anatomik alanla sınırlı olan tedaviler) oluşturan diğer modalitelerle birlikte kullanılır. ⓘ
Geleneksel kemoterapötik ajanlar hücre bölünmesine (mitoz) müdahale ederek sitotoksik etki gösterirler ancak kanser hücrelerinin bu ajanlara karşı duyarlılıkları büyük ölçüde farklılık gösterir. Kemoterapi büyük ölçüde hücrelere zarar vermenin veya onları strese sokmanın bir yolu olarak düşünülebilir; bu da apoptoz başlatılırsa hücre ölümüne yol açabilir. Kemoterapinin yan etkilerinin çoğu, hızlı bölünen ve bu nedenle anti-mitotik ilaçlara duyarlı olan normal hücrelere verilen hasara bağlanabilir: kemik iliği, sindirim sistemi ve saç foliküllerindeki hücreler. Bu da kemoterapinin en yaygın yan etkilerine yol açar: miyelosupresyon (kan hücrelerinin üretiminin azalması, dolayısıyla bağışıklık sisteminin baskılanması), mukozit (sindirim sistemi zarının iltihaplanması) ve alopesi (saç dökülmesi). Bağışıklık hücreleri (özellikle lenfositler) üzerindeki etkisi nedeniyle, kemoterapi ilaçları genellikle bağışıklık sisteminin kendine karşı zararlı aşırı aktivitesinden (otoimmünite olarak adlandırılır) kaynaklanan bir dizi hastalıkta kullanım alanı bulur. Bunlar arasında romatoid artrit, sistemik lupus eritematozus, multipl skleroz, vaskülit ve diğerleri yer almaktadır. ⓘ
Kemoterapi, "ilaçla (Sitotoksik) tedavi" anlamına gelmekle birlikte, daha çok kanser hücrelerini etkileyen kanser ilaçları kullanılarak yapılan tedavi için kullanılan terimdir. Bunun için kullanılan ilaçlara "antikanser" ilaçlar da denmektedir. Kanserin türüne göre kemoterapinin amaçları farklılaşabilmektedir. ⓘ
Başlıca amaçlar:
- Kanseri tedavi etmek. Kanser hücrelerine ait izler tümüyle ortadan kalktığında kanser tedavi edilmiş sayılmaktadır.
- Kanseri kontrol etmek. Genel olarak kanserin yayılımını önlemek ve büyümesini yavaşlatmak, kanserin kontrol altında tutulması olarak kabul edilmektedir.
- Kanserin yol açtığı belirtileri gidermek. Bazı kemoterapi uygulamalarının temel amacı hastanın yaşam niteliğini yükseltebilmek için ağrı ve benzeri belirtileri ortadan kaldırmak ya da hafifletmektir. ⓘ
Kemoterapi ilaçlarının her zaman istenilen faydayı sağlaması mümkün olmayabilir. Kanser tümörleri tedavi ile yok edilemiyorsa veya tedavide geç kalındı ise, kanser hücreleri kan damarları ya da lenfler yoluyla vücuda yayılabilir. Bu durumda metastaz (yayılma) denilen durum meydana gelmiş olur. ⓘ
Tedavi stratejileri
| Kanser türü | İlaçlar | Kısaltma ⓘ |
|---|---|---|
| Meme kanseri | Siklofosfamid, metotreksat, 5-florourasil, vinorelbin | CMF |
| Doksorubisin, siklofosfamid | AC | |
| Hodgkin lenfoma | Docetaxel, doxorubicin, cyclophosphamide | TAC |
| Doksorubisin, bleomisin, vinblastin, dakarbazin | ABVD | |
| Mustine, vinkristin, prokarbazin, prednizolon | MOPP | |
| Hodgkin dışı lenfoma | Siklofosfamid, doksorubisin, vinkristin, prednizolon | CHOP, R-CVP |
| Eşey hücreli tümör | Bleomisin, etoposid, sisplatin | BEP |
| Mide kanseri | Epirubisin, sisplatin, 5-fluorourasil | ECF |
| Epirubisin, sisplatin, kapesitabin | ECX | |
| Mesane kanseri | Methotrexate, vincristine, doxorubicin, cisplatin | MVAC |
| Akciğer kanseri | Siklofosfamid, doksorubisin, vinkristin, vinorelbin | CAV |
| Kolorektal kanser | 5-fluorourasil, folinik asit, oksaliplatin | FOLFOX |
| Pankreas kanseri | Gemsitabin, 5-fluorourasil | FOLFOX |
| Kemik kanseri | Doksorubisin, Sisplatin, Metotreksat, İfosfamid, Etoposid | MAP/MAPIE |
Günümüzde kemoterapötik ilaçların uygulanmasında kullanılan bir dizi strateji vardır. Kemoterapi küratif bir amaçla verilebileceği gibi yaşam süresini uzatmak veya semptomları hafifletmek amacıyla da verilebilir.
- İndüksiyon kemoterapisi, kanserin kemoterapötik bir ilaçla ilk basamak tedavisidir. Bu tür kemoterapi küratif amaç için kullanılır.
- Kombine modalite kemoterapisi, ilaçların cerrahi, radyasyon tedavisi veya hipertermi tedavisi gibi diğer kanser tedavileriyle birlikte kullanılmasıdır.
- Konsolidasyon kemoterapisi, genel hastalıksız süreyi uzatmak ve genel sağkalımı iyileştirmek için remisyondan sonra verilir. Uygulanan ilaç, remisyonu sağlayan ilaçla aynıdır.
- Yoğunlaştırma kemoterapisi konsolidasyon kemoterapisi ile aynıdır ancak indüksiyon kemoterapisinden farklı bir ilaç kullanılır.
- Kombinasyon kemoterapisi, bir kişinin aynı anda bir dizi farklı ilaçla tedavi edilmesini içerir. İlaçlar mekanizmaları ve yan etkileri bakımından farklılık gösterir. En büyük avantajı, herhangi bir ajana karşı direnç gelişme olasılığını en aza indirmektir. Ayrıca, ilaçlar genellikle daha düşük dozlarda kullanılabilir ve toksisiteyi azaltır.
- Neoadjuvan kemoterapi, ameliyat gibi lokal bir tedaviden önce verilir ve primer tümörü küçültmek için tasarlanmıştır. Ayrıca mikrometastatik hastalık riski yüksek olan kanserler için de verilir.
- Adjuvan kemoterapi lokal bir tedaviden (radyoterapi veya cerrahi) sonra verilir. Çok az kanser kanıtı mevcut olduğunda, ancak nüks riski olduğunda kullanılabilir. Ayrıca vücudun diğer bölgelerine yayılmış olan kanserli hücrelerin öldürülmesinde de faydalıdır. Bu mikrometastazlar adjuvan kemoterapi ile tedavi edilebilir ve bu yayılmış hücrelerin neden olduğu nüks oranlarını azaltabilir.
- İdame kemoterapisi, remisyonu uzatmak için tekrarlanan düşük dozlu bir tedavidir.
- Kurtarma kemoterapisi veya palyatif kemoterapi, küratif amaç olmaksızın, sadece tümör yükünü azaltmak ve yaşam beklentisini artırmak için verilir. Bu rejimler için genel olarak daha iyi bir toksisite profili beklenir. ⓘ
Tüm kemoterapi rejimleri, alıcının tedaviye devam edebilecek durumda olmasını gerektirir. Performans durumu genellikle bir kişinin kemoterapi alıp alamayacağını veya doz azaltımı gerekip gerekmediğini belirlemek için bir ölçü olarak kullanılır. Her tedavide tümördeki hücrelerin sadece bir kısmı öldüğünden (fraksiyonel öldürme), tümörün boyutunu küçültmeye devam etmek için tekrarlanan dozlar uygulanmalıdır. Mevcut kemoterapi rejimleri ilaç tedavisini döngüler halinde uygular ve tedavilerin sıklığı ve süresi toksisite ile sınırlıdır. ⓘ
Verimlilik
Kemoterapinin etkinliği kanserin türüne ve evresine bağlıdır. Genel etkinlik, bazı lösemiler gibi bazı kanserler için iyileştirici olmaktan, bazı beyin tümörlerinde olduğu gibi etkisiz olmaya ve çoğu melanom dışı cilt kanseri gibi diğerlerinde gereksiz olmaya kadar değişir. ⓘ
Dozaj

Kemoterapinin dozajını belirlemek zor olabilir: Doz çok düşükse tümöre karşı etkisiz olacaktır, aşırı dozlarda ise toksisite (yan etkiler) alan kişi için tahammül edilemez olacaktır. Kemoterapi dozajını belirlemenin standart yöntemi, hesaplanan vücut yüzey alanına (BSA) dayanmaktadır. BSA genellikle vücut alanının doğrudan ölçümü yerine alıcının kilosu ve boyu kullanılarak matematiksel bir formül veya bir nomogram ile hesaplanır. Bu formül ilk olarak 1916 yılında yapılan bir çalışmada türetilmiş ve laboratuvar hayvanları için belirlenen ilaç dozlarını insanlar için eşdeğer dozlara çevirmeye çalışmıştır. Çalışmaya sadece dokuz insan denek dahil edilmiştir. Kemoterapi 1950'lerde kullanılmaya başlandığında, daha iyi bir seçenek olmadığı için BSA formülü kemoterapi dozajı için resmi standart olarak kabul edilmiştir. ⓘ
Bu yöntemin tek tip dozların hesaplanmasındaki geçerliliği sorgulanmıştır çünkü formül sadece bireyin kilosunu ve boyunu dikkate almaktadır. İlaç emilimi ve klirensi yaş, cinsiyet, metabolizma, hastalık durumu, organ fonksiyonu, ilaç-ilaç etkileşimleri, genetik ve obezite gibi birçok faktörden etkilenir ve bu faktörler ilacın kişinin kan dolaşımındaki gerçek konsantrasyonu üzerinde önemli etkilere sahiptir. Sonuç olarak, BSA tarafından dozlanan kişilerde sistemik kemoterapi ilaç konsantrasyonunda yüksek değişkenlik vardır ve bu değişkenliğin birçok ilaç için on kattan fazla olduğu gösterilmiştir. Başka bir deyişle, iki kişi BSA'ya göre belirli bir ilaçtan aynı dozu alırsa, bu ilacın bir kişinin kan dolaşımındaki konsantrasyonu diğer kişininkine kıyasla 10 kat daha yüksek veya daha düşük olabilir. Bu değişkenlik, BSA'ya göre dozlanan birçok kemoterapi ilacı için tipiktir ve aşağıda gösterildiği gibi, 14 yaygın kemoterapi ilacı üzerinde yapılan bir çalışmada gösterilmiştir. ⓘ
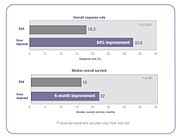
İnsanlar arasındaki bu farmakokinetik değişkenliğin sonucu, birçok insanın toksik yan etkileri en aza indirilmiş optimal tedavi etkinliğini elde etmek için doğru dozu almamasıdır. Bazı kişilere aşırı doz verilirken, bazılarına da düşük doz verilmektedir. Örneğin, randomize bir klinik çalışmada, araştırmacılar 5-florourasil (5-FU) ile tedavi edilen metastatik kolorektal kanser hastalarının %85'inin BSA standardına göre dozlandığında optimal terapötik dozu almadığını, %68'inin düşük doz aldığını ve %17'sinin aşırı doz aldığını tespit etmiştir. ⓘ
Obez kişilerde kemoterapi dozlarını hesaplamak için BSA'nın kullanımı konusunda tartışmalar olmuştur. Yüksek BSA değerleri nedeniyle, klinisyenler genellikle aşırı doz korkusuyla BSA formülüne göre reçete edilen dozu keyfi olarak azaltmaktadır. Çoğu durumda bu, optimal olmayan tedaviyle sonuçlanabilir. ⓘ
Birçok klinik çalışma, kemoterapi dozunun optimal sistemik ilaç maruziyetine ulaşmak için bireyselleştirildiğinde, tedavi sonuçlarının iyileştiğini ve toksik yan etkilerin azaldığını göstermiştir. Yukarıda bahsedilen 5-FU klinik çalışmasında, önceden belirlenmiş bir hedef maruziyete ulaşmak için dozu ayarlanan kişiler, BSA ile dozlananlara kıyasla tedavi yanıt oranında %84'lük bir iyileşme ve genel sağkalımda (OS) altı aylık bir iyileşme gerçekleştirmiştir. ⓘ

Aynı çalışmada araştırmacılar, dozu ayarlanmış kişiler ile BSA başına doz uygulanan kişiler arasında yaygın 5-FU ile ilişkili derece 3/4 toksisite insidansını karşılaştırmıştır. Zayıflatıcı diyare derecelerinin görülme sıklığı BSA'ya göre dozlanan grupta %18'den doza göre ayarlanan grupta %4'e düşmüş ve ciddi hematolojik yan etkiler ortadan kalkmıştır. Azalan toksisite nedeniyle, dozu ayarlanmış hastalar daha uzun süre tedavi edilebilmiştir. BSA dozu uygulanan kişiler toplam 680 ay tedavi görürken, dozu ayarlanan gruptaki kişiler toplam 791 ay tedavi görmüştür. Tedavi sürecinin tamamlanması, daha iyi tedavi sonuçları elde edilmesinde önemli bir faktördür. ⓘ
Popüler FOLFOX rejimi ile tedavi edilen kolorektal kanserli kişileri içeren bir çalışmada da benzer sonuçlar bulunmuştur. Ciddi diyare insidansı BSA uygulanan hasta grubunda %12'den doz ayarlı grupta %1,7'ye, ciddi mukozit insidansı ise %15'ten %0,8'e düşmüştür. ⓘ
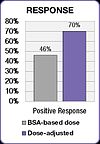
FOLFOX çalışması da tedavi sonuçlarında bir iyileşme olduğunu göstermiştir. Pozitif yanıt BSA uygulanan grupta %46'dan doza göre ayarlanmış grupta %70'e yükselmiştir. Doz ayarlı grupta medyan progresyonsuz sağkalım (PFS) ve genel sağkalım (OS) altı ay iyileşmiştir. ⓘ
Klinisyenlerin kemoterapi dozunu bireyselleştirmelerine yardımcı olabilecek bir yaklaşım, zaman içinde kan plazmasındaki ilaç seviyelerini ölçmek ve optimal maruziyeti elde etmek için dozu bir formül veya algoritmaya göre ayarlamaktır. En aza indirgenmiş toksisitelerle optimize edilmiş tedavi etkinliği için belirlenmiş bir hedef maruziyetle, dozlama her bir kişi için hedef maruziyet ve optimum sonuçlar elde etmek üzere kişiselleştirilebilir. Böyle bir algoritma yukarıda bahsedilen klinik çalışmalarda kullanılmış ve tedavi sonuçlarının önemli ölçüde iyileşmesini sağlamıştır. ⓘ
Onkologlar halihazırda bazı kanser ilaçlarının dozajını maruziyete dayalı olarak bireyselleştirmektedir. Karboplatin ve busulfan dozajı, her bir kişi için en uygun dozu hesaplamak için kan testlerinden elde edilen sonuçlara dayanmaktadır. Metotreksat, 5-FU, paklitaksel ve dosetaksel doz optimizasyonu için basit kan testleri de mevcuttur. ⓘ
Kemoterapi uygulamasından hemen önceki serum albümin düzeyi, çeşitli kanser türlerinde sağkalımın bağımsız bir prognostik belirleyicisidir. ⓘ
Türler

Alkilleyici ajanlar
Alkilleyici ajanlar günümüzde kullanılan en eski kemoterapötik grubudur. İlk olarak I. Dünya Savaşı'nda kullanılan hardal gazından türetilen alkilleyici ajanların şu anda kullanımda olan birçok türü vardır. Proteinler, RNA ve DNA dahil olmak üzere birçok molekülü alkilleme yetenekleri nedeniyle bu şekilde adlandırılırlar. Alkil grupları aracılığıyla DNA'ya kovalent olarak bağlanma yetenekleri, anti-kanser etkilerinin birincil nedenidir. DNA iki sarmaldan oluşur ve moleküller DNA'nın bir sarmalına iki kez bağlanabilir (sarmal içi çapraz bağ) ya da her iki sarmala bir kez bağlanabilir (sarmallar arası çapraz bağ). Hücre, hücre bölünmesi sırasında çapraz bağlı DNA'yı çoğaltmaya veya onarmaya çalışırsa, DNA iplikleri kırılabilir. Bu da apoptoz adı verilen bir tür programlanmış hücre ölümüne yol açar. Alkilleyici ajanlar hücre döngüsünün herhangi bir noktasında etki gösterirler ve bu nedenle hücre döngüsünden bağımsız ilaçlar olarak bilinirler. Bu nedenle hücre üzerindeki etki doza bağlıdır; ölen hücrelerin oranı ilaç dozuyla doğru orantılıdır. ⓘ
Alkilleyici ajanların alt türleri nitrojen mustardlar, nitrosourealar, tetrazinler, aziridinler, sisplatinler ve türevleri ve klasik olmayan alkilleyici ajanlardır. Azot mustardları arasında mekloretamin, siklofosfamid, melfalan, klorambusil, ifosfamid ve busulfan bulunur. Nitrosoüreler arasında N-Nitroso-N-metilüre (MNU), karmustin (BCNU), lomustin (CCNU) ve semustin (MeCCNU), fotemustin ve streptozotosin bulunur. Tetrazinler dakarbazin, mitozolomid ve temozolomidi içerir. Aziridinler tiyotepa, miktomisin ve diaziquone (AZQ) içerir. Sisplatin ve türevleri sisplatin, karboplatin ve oksaliplatini içerir. Biyolojik olarak önemli moleküllerdeki amino, karboksil, sülfhidril ve fosfat grupları ile kovalent bağlar oluşturarak hücre fonksiyonunu bozarlar. Klasik olmayan alkilleyici ajanlar arasında prokarbazin ve hekzametilmelamin bulunur. ⓘ
Antimetabolitler

Anti-metabolitler DNA ve RNA sentezini engelleyen bir grup moleküldür. Birçoğu DNA ve RNA'nın yapı taşlarına benzer bir yapıya sahiptir. Yapı taşları nükleotidlerdir; bir nükleobaz, bir şeker ve bir fosfat grubundan oluşan bir moleküldür. Nükleobazlar pürinler (guanin ve adenin) ve pirimidinler (sitozin, timin ve urasil) olarak ikiye ayrılır. Anti-metabolitler ya nükleobazlara ya da nükleozitlere (fosfat grubu olmayan bir nükleotit) benzer, ancak kimyasal grupları değişmiştir. Bu ilaçlar etkilerini ya DNA sentezi için gerekli enzimleri bloke ederek ya da DNA veya RNA'ya dahil olarak gösterirler. DNA sentezinde yer alan enzimleri inhibe ederek mitoz bölünmeyi önlerler çünkü DNA kendini kopyalayamaz. Ayrıca, moleküllerin DNA'ya yanlış dahil olmasından sonra, DNA hasarı meydana gelebilir ve programlanmış hücre ölümü (apoptoz) indüklenir. Alkilleyici ajanların aksine, anti-metabolitler hücre döngüsüne bağımlıdır. Bu, hücre döngüsünün yalnızca belirli bir bölümünde, bu durumda S fazında (DNA sentez fazı) çalıştıkları anlamına gelir. Bu nedenle, belirli bir dozda, etki plato yapar ve artan dozlarla orantılı olarak daha fazla hücre ölümü meydana gelmez. Anti-metabolitlerin alt tipleri anti-folatlar, floropirimidinler, deoksinükleozid analogları ve tiyopürinlerdir. ⓘ
Anti-folatlar metotreksat ve pemetreksed içerir. Metotreksat, dihidrofolattan tetrahidrofolatı yeniden üreten bir enzim olan dihidrofolat redüktazı (DHFR) inhibe eder. Enzim metotreksat tarafından inhibe edildiğinde, folat koenzimlerinin hücresel seviyeleri azalır. Bunlar, her ikisi de DNA sentezi ve hücre bölünmesi için gerekli olan timidilat ve pürin üretimi için gereklidir. Pemetreksed, pürin ve pirimidin üretimini etkileyen ve dolayısıyla DNA sentezini de inhibe eden başka bir anti-metabolittir. Öncelikle timidilat sentaz enzimini inhibe eder, ancak DHFR, aminoimidazol karboksamid ribonükleotid formiltransferaz ve glisinamid ribonükleotid formiltransferaz üzerinde de etkileri vardır. Floropirimidinler florourasil ve kapesitabini içerir. Florourasil, hücrelerde en az iki aktif ürün oluşturmak üzere metabolize edilen bir nükleobaz analoğudur; 5-florouridin monofosfat (FUMP) ve 5-floro-2'-deoksiüridin 5'-fosfat (fdUMP). FUMP RNA'ya dahil olur ve fdUMP timidilat sentaz enzimini inhibe eder; her ikisi de hücre ölümüne yol açar. Kapesitabin, aktif ilacı üretmek için hücrelerde parçalanan bir 5-florourasil ön ilacıdır. Deoksinükleozid analogları arasında sitarabin, gemsitabin, desitabin, azasitidin, fludarabin, nelarabin, kladribin, klofarabin ve pentostatin bulunur. Tiyopurinler tiyoguanin ve merkaptopurini içerir. ⓘ
Anti-mikrotubül ajanlar

Anti-mikrotübül ajanlar, mikrotübül işlevini önleyerek hücre bölünmesini engelleyen bitki kaynaklı kimyasallardır. Mikrotübüller, α-tubulin ve β-tubulin olmak üzere iki proteinden oluşan önemli bir hücresel yapıdır. Diğer hücresel işlevlerin yanı sıra hücre bölünmesi için gerekli olan içi boş, çubuk şeklindeki yapılardır. Mikrotübüller dinamik yapılardır, yani sürekli olarak birleşme ve ayrılma durumundadırlar. Vinca alkaloidleri ve taksanlar iki ana anti-mikrotübül ajan grubudur ve bu ilaç gruplarının her ikisi de mikrotübül işlev bozukluğuna neden olsa da, etki mekanizmaları tamamen zıttır: Vinka alkaloidleri mikrotübüllerin toplanmasını önlerken, taksanlar bunların dağılmasını önler. Böylece kanser hücrelerinin mitozu tamamlamasını engellerler. Bunu takiben, programlanmış hücre ölümünü (apoptoz) indükleyen hücre döngüsü durması meydana gelir. Bu ilaçlar aynı zamanda tümörlerin büyümek ve metastaz yapmak için kullandıkları temel bir süreç olan kan damarı büyümesini de etkileyebilir. ⓘ
Vinca alkaloidleri, eskiden Vinca rosea olarak bilinen Madagaskar Cezayir menekşesi Catharanthus roseus'tan elde edilir. Tubulin üzerindeki belirli bölgelere bağlanarak tubulinin mikrotübüller halinde toplanmasını engellerler. Orijinal vinka alkaloidleri vinkristin ve vinblastin içeren doğal ürünlerdir. Bu ilaçların başarısının ardından yarı sentetik vinka alkaloidleri üretilmiştir: vinorelbin (küçük hücreli olmayan akciğer kanserinin tedavisinde kullanılır), vindesine ve vinflunine. Bu ilaçlar hücre döngüsüne özgüdür. S fazındaki tubulin moleküllerine bağlanırlar ve M fazı için gerekli olan uygun mikrotübül oluşumunu önlerler. ⓘ
Taksanlar doğal ve yarı sentetik ilaçlardır. Sınıflarının ilk ilacı olan paklitaksel, ilk olarak Pasifik porsuk ağacı olan Taxus brevifolia'dan elde edilmiştir. Şimdi bu ilaç ve bu sınıftaki bir diğer ilaç olan docetaxel, başka bir porsuk ağacı olan Taxus baccata'nın kabuğunda bulunan bir kimyasaldan yarı sentetik olarak üretilmektedir. ⓘ
Podofilotoksin, öncelikle Amerikan mayıs elması (Podophyllum peltatum) ve Himalaya mayıs elmasından (Sinopodophyllum hexandrum) elde edilen antineoplastik bir lignandır. Anti-mikrotübül aktiviteye sahiptir ve mekanizması, tubuline bağlanarak mikrotübül oluşumunu inhibe etmeleri bakımından vinka alkaloidlerinkine benzer. Podofilotoksin, farklı etki mekanizmalarına sahip diğer iki ilacı üretmek için kullanılır: etoposid ve teniposid. ⓘ
Topoizomeraz inhibitörleri

Topoizomeraz inhibitörleri iki enzimin aktivitesini etkileyen ilaçlardır: topoizomeraz I ve topoizomeraz II. Örneğin DNA replikasyonu veya transkripsiyonu sırasında DNA çift sarmalı çözüldüğünde, bitişikteki açılmamış DNA, bükülmüş bir ipin ortasının açılması gibi daha sıkı sarılır (süper sarmallar). Bu etkinin neden olduğu strese kısmen topoizomeraz enzimleri yardımcı olur. Bu enzimler DNA'da tek ya da çift sarmal kırılmaları oluşturarak DNA sarmalındaki gerilimi azaltır. Bu, replikasyon veya transkripsiyon sırasında DNA'nın normal çözülmesinin gerçekleşmesini sağlar. Topoizomeraz I veya II'nin inhibisyonu bu süreçlerin her ikisine de müdahale eder. ⓘ
İki topoizomeraz I inhibitörü, irinotekan ve topotekan, Çin süs ağacı Camptotheca acuminata'dan elde edilen kamptotesinden yarı sentetik olarak türetilmiştir. Topoizomeraz II'yi hedef alan ilaçlar iki gruba ayrılabilir. Topoizomeraz II zehirleri, DNA'ya bağlı enzim seviyelerinin artmasına neden olur. Bu durum DNA replikasyonunu ve transkripsiyonunu engeller, DNA iplikçik kırılmalarına neden olur ve programlanmış hücre ölümüne (apoptoz) yol açar. Bu ajanlar etoposid, doksorubisin, mitoksantron ve teniposidi içerir. İkinci grup, katalitik inhibitörler, topoizomeraz II'nin aktivitesini bloke eden ve bu nedenle DNA sentezini ve translasyonunu önleyen ilaçlardır, çünkü DNA düzgün bir şekilde çözülemez. Bu grupta novobiyosin, merbaron ve aklarubisin yer alır ve bunların başka önemli etki mekanizmaları da vardır. ⓘ
Sitotoksik antibiyotikler
Sitotoksik antibiyotikler, çeşitli etki mekanizmalarına sahip çeşitli bir ilaç grubudur. Kemoterapi endikasyonlarında paylaştıkları ortak tema, hücre bölünmesini kesintiye uğratmalarıdır. En önemli alt grup antrasiklinler ve bleomisinlerdir; diğer önemli örnekler arasında mitomisin C ve aktinomisin sayılabilir. ⓘ
Antrasiklinler arasında doksorubisin ve daunorubisin ilktir ve Streptomyces peucetius bakterisinden elde edilmiştir. Bu bileşiklerin türevleri arasında epirubisin ve idarubisin bulunmaktadır. Antrasiklin grubunda klinik olarak kullanılan diğer ilaçlar pirarubisin, aklarubisin ve mitoksantrondur. Antrasiklinlerin mekanizmaları arasında DNA interkalasyonu (moleküller DNA'nın iki ipliği arasına girer), hücreler arası moleküllere zarar veren yüksek reaktif serbest radikallerin oluşumu ve topoizomeraz inhibisyonu yer alır. ⓘ
Aktinomisin, DNA'yı interkalize eden ve RNA sentezini önleyen kompleks bir moleküldür. ⓘ
Streptomyces verticillus'tan izole edilen bir glikopeptid olan bleomisin de DNA'yı interkalize eder, ancak DNA'ya zarar veren serbest radikaller üretir. Bu, bleomisin bir metal iyonuna bağlandığında, kimyasal olarak indirgendiğinde ve oksijenle reaksiyona girdiğinde meydana gelir. ⓘ
Mitomisin, DNA'yı alkilleme yeteneğine sahip sitotoksik bir antibiyotiktir. ⓘ
Teslimat

Kemoterapinin çoğu intravenöz olarak verilir, ancak bazı ajanlar oral yoldan da uygulanabilir (örn. melfalan, busulfan, kapesitabin). Yakın tarihli (2016) bir sistematik incelemeye göre, oral tedaviler hastalar ve bakım ekipleri için tedavi planlarına uyumu sürdürmek ve desteklemek için ek zorluklar ortaya çıkarmaktadır. ⓘ
Vasküler erişim cihazları olarak bilinen birçok intravenöz ilaç verme yöntemi vardır. Bunlar arasında kanatlı infüzyon cihazı, periferik venöz kateter, orta hat kateteri, periferik olarak yerleştirilmiş santral kateter (PICC), santral venöz kateter ve implante edilebilir port yer almaktadır. Cihazlar kemoterapi tedavisinin süresi, uygulama yöntemi ve kemoterapötik ajan türleri açısından farklı uygulamalara sahiptir. ⓘ
Kişiye, kansere, kanserin evresine, kemoterapinin türüne ve dozajına bağlı olarak, intravenöz kemoterapi yatarak veya ayakta tedavi bazında verilebilir. Sürekli, sık veya uzun süreli intravenöz kemoterapi uygulaması için, erişimi sağlamak amacıyla damar sistemine cerrahi olarak çeşitli sistemler yerleştirilebilir. Yaygın olarak kullanılan sistemler Hickman hattı, Port-a-Cath ve PICC hattıdır. Bunlar daha düşük enfeksiyon riskine sahiptir, flebit veya ekstravazasyona çok daha az eğilimlidir ve periferik kanüllerin tekrar tekrar yerleştirilmesi ihtiyacını ortadan kaldırır. ⓘ
Bazı tümörleri tedavi etmek için izole uzuv perfüzyonu (genellikle melanomda kullanılır) veya karaciğer ya da akciğere izole kemoterapi infüzyonu kullanılmıştır. Bu yaklaşımların temel amacı, aşırı sistemik hasara yol açmadan tümör bölgelerine çok yüksek dozda kemoterapi vermektir. Bu yaklaşımlar soliter veya sınırlı metastazları kontrol etmeye yardımcı olabilir, ancak tanım gereği sistemik değildirler ve bu nedenle dağılmış metastazları veya mikrometastazları tedavi etmezler. ⓘ
5-fluorourasil gibi topikal kemoterapiler, bazı melanom dışı cilt kanseri vakalarını tedavi etmek için kullanılır. ⓘ
Kanserde merkezi sinir sistemi tutulumu veya meningeal hastalık varsa intratekal kemoterapi uygulanabilir. ⓘ
Yan etkiler
Kemoterapötik tekniklerin, kullanılan ilaçların türüne bağlı olan bir dizi yan etkisi vardır. En yaygın ilaçlar esas olarak kan hücreleri ve ağız, mide ve bağırsakları kaplayan hücreler gibi vücudun hızlı bölünen hücrelerini etkiler. Kemoterapiye bağlı toksisiteler, uygulamadan sonra saatler veya günler içinde akut olarak veya haftalar ile yıllar arasında kronik olarak ortaya çıkabilir. ⓘ
Birçok vakada, hem insan hem de hayvan deneylerinde, tedavi günlerinde kısa süreli açlık yoluyla tolere edilebilirlikte artış/yan etkilerde azalma ve terapötik etkinlikte artış gözlenmiştir. ⓘ
İmmünosupresyon ve miyelosupresyon
Neredeyse tüm kemoterapötik rejimler, genellikle kemik iliğini felç ederek ve beyaz kan hücrelerinin, kırmızı kan hücrelerinin ve trombositlerin azalmasına yol açarak bağışıklık sisteminin depresyonuna neden olabilir. Anemi ve trombositopeni kan transfüzyonu gerektirebilir. Nötropeni (nötrofil granülosit sayısının 0,5 x 109/litrenin altına düşmesi) sentetik G-CSF (granülosit-koloni uyarıcı faktör, örn. filgrastim, lenograstim) ile iyileştirilebilir. ⓘ
Bazı rejimlerde ortaya çıkan çok şiddetli miyelosupresyonda, neredeyse tüm kemik iliği kök hücreleri (beyaz ve kırmızı kan hücrelerini üreten hücreler) yok olur, bu da allojenik veya otolog kemik iliği hücre nakillerinin gerekli olduğu anlamına gelir. (Otolog KİT'lerde hücreler tedaviden önce kişiden alınır, çoğaltılır ve daha sonra yeniden enjekte edilir; allojenik KİT'lerde ise kaynak bir donördür). Ancak bazı kişilerde kemik iliğine yapılan bu müdahale nedeniyle yine de hastalıklar gelişmektedir. ⓘ
Kemoterapi alan kişiler ellerini yıkamaya, hasta kişilerden uzak durmaya ve diğer enfeksiyon azaltıcı adımları atmaya teşvik edilse de, enfeksiyonların yaklaşık %85'i kişinin kendi gastrointestinal sisteminde (ağız boşluğu dahil) ve cildinde doğal olarak oluşan mikroorganizmalardan kaynaklanmaktadır. Bu durum sepsis gibi sistemik enfeksiyonlar ya da Herpes simpleks, zona veya Herpesviridea'nın diğer üyeleri gibi lokalize salgınlar şeklinde ortaya çıkabilir. Hastalık ve ölüm riski, herhangi bir ateş veya enfeksiyon belirtisi ortaya çıkmadan önce kinolonlar veya trimetoprim/sülfametoksazol gibi yaygın antibiyotiklerin alınmasıyla azaltılabilir. Kinolonlar özellikle hematolojik kanserde etkili profilaksi göstermektedir. Ancak genel olarak, kemoterapi sonrası bağışıklığı baskılanan ve antibiyotik alan her beş kişi için bir ateş önlenebilir; antibiyotik alan her 34 kişi için bir ölüm önlenebilir. Bazen kemoterapi tedavileri ertelenir çünkü bağışıklık sistemi kritik derecede düşük bir seviyeye kadar baskılanmıştır. ⓘ
Japonya'da hükümet, Trametes versicolor gibi bazı tıbbi mantarların kemoterapi gören kişilerde bağışıklık sistemindeki depresyona karşı kullanılmasını onaylamıştır. ⓘ
Trilaciclib, kemoterapinin neden olduğu miyelosupresyonun önlenmesi için onaylanmış bir siklin bağımlı kinaz 4/6 inhibitörüdür. İlaç, kemik iliği fonksiyonunu korumak için kemoterapiden önce verilir. ⓘ
Nötropenik enterokolit
Bağışıklık sisteminin baskılanması nedeniyle nötropenik enterokolit (tiflit) "kemoterapinin hayatı tehdit eden gastrointestinal bir komplikasyonudur." Tiflit, bulantı, kusma, ishal, şişkin karın, ateş, titreme veya karın ağrısı ve hassasiyeti gibi semptomlarla kendini gösterebilen bir bağırsak enfeksiyonudur. ⓘ
Tiflit tıbbi bir acil durumdur. Prognozu çok kötüdür ve derhal fark edilip agresif bir şekilde tedavi edilmezse genellikle ölümcüldür. Başarılı tedavi, yüksek şüphe indeksi ve BT taramasının kullanımıyla sağlanan erken tanıya, komplike olmayan vakalar için ameliyatsız tedaviye ve bazen nüksü önlemek için elektif sağ hemikolektomiye bağlıdır. ⓘ
Gastrointestinal sıkıntı
Bulantı, kusma, iştahsızlık, ishal, karın krampları ve kabızlık, hızlı bölünen hücreleri öldüren kemoterapötik ilaçların yaygın yan etkileridir. Alıcı yeterince yiyip içmediğinde ya da gastrointestinal hasar nedeniyle kişi sık sık kustuğunda malnütrisyon ve dehidrasyon ortaya çıkabilir. Bu durum hızlı kilo kaybına ya da kişi bulantı veya mide yanmasını yatıştırmak için çok fazla yerse bazen kilo alımına neden olabilir. Kilo alımına bazı steroid ilaçlar da neden olabilir. Bu yan etkiler antiemetik ilaçlarla sıklıkla azaltılabilir veya ortadan kaldırılabilir. Düşük kesinlikli kanıtlar, probiyotiklerin tek başına kemoterapi ve radyoterapi ile ilişkili ishali önleyici ve tedavi edici bir etkiye sahip olabileceğini de göstermektedir. Bununla birlikte, ishal ve şişkinlik aynı zamanda acil tedavi gerektiren çok ciddi ve potansiyel olarak hayatı tehdit eden bir tıbbi acil durum olan tiflit semptomları olduğundan, yüksek bir şüphe endeksi uygundur. ⓘ
Anemi
Anemi, miyelosupresif kemoterapinin ve kanama, kan hücresi yıkımı (hemoliz), kalıtsal hastalık, böbrek fonksiyon bozukluğu, beslenme bozukluğu gibi kansere bağlı olası nedenlerin neden olduğu kombine bir sonuç olabilir. eksiklikleri veya kronik hastalık anemisi. Anemiyi hafifletmek için uygulanan tedaviler arasında kan üretimini artıran hormonlar (eritropoietin), demir takviyeleri ve kan nakli yer alır. Miyelosupresif tedavi kolay kanama eğilimine neden olarak anemiye yol açabilir. Hızla bölünen hücreleri veya kan hücrelerini öldüren ilaçlar kandaki trombosit sayısını azaltabilir, bu da morluklara ve kanamaya neden olabilir. Aşırı düşük trombosit sayıları trombosit transfüzyonları ile geçici olarak artırılabilir ve kemoterapi sırasında trombosit sayılarını artırmak için yeni ilaçlar geliştirilmektedir. Bazen kemoterapi tedavileri, trombosit sayılarının iyileşmesine izin vermek için ertelenir. ⓘ
Yorgunluk kanserin veya tedavisinin bir sonucu olabilir ve tedaviden sonra aylarca veya yıllarca sürebilir. Yorgunluğun fizyolojik nedenlerinden biri kemoterapi, cerrahi, radyoterapi, primer ve metastatik hastalık veya besinsel tükenmeden kaynaklanabilen anemidir. Aerobik egzersizin solid tümörü olan kişilerde yorgunluğu azaltmada faydalı olduğu bulunmuştur. ⓘ
Bulantı ve kusma
Bulantı ve kusma, kanserli kişiler ve aileleri için kanser tedavisine bağlı en korkulan yan etkilerden ikisidir. 1983 yılında Coates ve arkadaşları kemoterapi alan kişilerin bulantı ve kusmayı sırasıyla birinci ve ikinci en ciddi yan etkiler olarak sıraladıklarını tespit etmiştir. Bu dönemde yüksek derecede emetojenik ajanlar alan kişilerin %20'si potansiyel olarak iyileştirici tedavileri ertelemiş, hatta reddetmiştir. Kemoterapiye bağlı bulantı ve kusma (CINV) birçok tedavide ve bazı kanser türlerinde yaygındır. 1990'lardan bu yana, kemoterapi rejimlerinde neredeyse evrensel bir standart haline gelen ve birçok insanda bu semptomların başarılı bir şekilde yönetilmesine yardımcı olan birkaç yeni antiemetik sınıfı geliştirilmiş ve ticarileştirilmiştir. Bu nahoş ve bazen felç edici semptomların etkili bir şekilde yönetilmesi, daha iyi tolerans ve daha iyi genel sağlık nedeniyle tedavinin daha az durması nedeniyle alıcı için yaşam kalitesinin artmasına ve daha verimli tedavi döngülerine neden olur. ⓘ
Saç dökülmesi
Saç dökülmesine (alopesi) hızla bölünen hücreleri öldüren kemoterapi neden olabilir; diğer ilaçlar saçın incelmesine neden olabilir. Bunlar çoğunlukla geçici etkilerdir: saçlar genellikle son tedaviden birkaç hafta sonra yeniden çıkmaya başlar, ancak bazen renk, doku, kalınlık veya stilde bir değişiklik olur. Bazen saçlar yeniden uzadıktan sonra kıvrılma eğilimi gösterir ve bu da "kemo bukleleri" ile sonuçlanır. Ciddi saç dökülmesi en sık doksorubisin, daunorubisin, paklitaksel, dosetaksel, siklofosfamid, ifosfamid ve etoposid gibi ilaçlarla ortaya çıkar. Kalıcı incelme veya saç dökülmesi bazı standart kemoterapi rejimlerinden kaynaklanabilir. ⓘ
Kemoterapiye bağlı saç dökülmesi androjenik olmayan bir mekanizma ile meydana gelir ve alopesi totalis, telogen effluvium veya daha az sıklıkla alopesi areata olarak ortaya çıkabilir. Saç foliküllerinin yüksek mitotik oranı nedeniyle genellikle sistemik tedaviyle ilişkilidir ve kalıcı vakalar meydana gelebilmesine rağmen androjenik saç dökülmesinden daha geri dönüşümlüdür. Kemoterapi kadınlarda erkeklerden daha sık saç dökülmesine neden olur. ⓘ
Saç derisinin soğutulması hem kalıcı hem de geçici saç dökülmesini önlemek için bir araç sunar; ancak bu yöntemle ilgili endişeler dile getirilmiştir. ⓘ
İkincil neoplazm
Başarılı kemoterapi veya radyoterapi tedavisinden sonra ikincil neoplazi gelişimi meydana gelebilir. En yaygın ikincil neoplazma, öncelikle alkilleyici ajanlar veya topoizomeraz inhibitörleri ile tedaviden sonra gelişen ikincil akut miyeloid lösemidir. Çocukluk çağı kanserinden kurtulanların tedaviden sonraki 30 yıl içinde ikincil bir neoplaziye yakalanma olasılığı genel nüfusa göre 13 kat daha fazladır. Bu artışın tamamı kemoterapiye atfedilemez. ⓘ
Kısırlık
Bazı kemoterapi türleri gonadotoksiktir ve infertiliteye neden olabilir. Yüksek riskli kemoterapiler arasında prokarbazin ve siklofosfamid, ifosfamid, busulfan, melfalan, klorambusil ve klormetin gibi diğer alkilleyici ilaçlar bulunur. Orta riskli ilaçlar arasında doksorubisin ve sisplatin ve karboplatin gibi platin analogları yer alır. Öte yandan, gonadotoksisite riski düşük olan tedaviler arasında vinkristin ve vinblastin gibi bitki türevleri, bleomisin ve daktinomisin gibi antibiyotikler ve metotreksat, merkaptopürin ve 5-florourasil gibi antimetabolitler yer almaktadır. ⓘ
Kemoterapiye bağlı kadın infertilitesi, primordial foliküllerin kaybı ile erken yumurtalık yetmezliğine ikincil olarak ortaya çıkmaktadır. Bu kayıp mutlaka kemoterapötik ajanların doğrudan bir etkisi değildir, ancak hasarlı gelişmekte olan foliküllerin yerini almak için artan bir büyüme başlatma oranından kaynaklanıyor olabilir. ⓘ
İnsanlar kemoterapi öncesinde semen, yumurtalık dokusu, oosit veya embriyoların kriyoprezervasyonu da dahil olmak üzere çeşitli doğurganlık koruma yöntemleri arasında seçim yapabilir. Kanser hastalarının yarısından fazlası yaşlı olduğundan, bu olumsuz etki yalnızca hastaların azınlığı için geçerlidir. Fransa'da 1999 ve 2011 yılları arasında yapılan bir çalışmada, kadınlara gonadotoksik ajanların uygulanmasından önce embriyo dondurulmasının vakaların %34'ünde tedavinin gecikmesine ve hayatta kalan ve hamile kalmak isteyen vakaların %27'sinde canlı doğuma neden olduğu ve takip süresinin 1 ila 13 yıl arasında değiştiği sonucuna varılmıştır. ⓘ
Potansiyel koruyucu veya zayıflatıcı ajanlar arasında, birkaç çalışmanın insanlarda in vivo koruyucu bir etki gösterdiği, ancak bazı çalışmaların böyle bir etki göstermediği GnRH analogları yer almaktadır. Sfingozin-1-fosfat (S1P) benzer etki göstermiştir, ancak sfingomiyelin apoptotik yolunu inhibe etme mekanizması kemoterapi ilaçlarının apoptoz etkisine de müdahale edebilir. ⓘ
Hematopoetik kök hücre transplantasyonunda kondisyonlama rejimi olarak kemoterapide, şiddetli aplastik anemi için tek başına siklofosfamid ile kondisyonlanan kişiler üzerinde yapılan bir çalışmada, transplantasyon sırasında 26 yaşından küçük tüm kadınlarda yumurtalık iyileşmesinin meydana geldiği, ancak 26 yaşından büyük 16 kadından sadece beşinde iyileşme olduğu sonucuna varılmıştır. ⓘ
Teratojenite
Kemoterapi gebelik sırasında, özellikle ilk trimesterde teratojeniktir, öyle ki kemoterapi sırasında bu dönemde gebelik tespit edilirse genellikle kürtaj önerilir. İkinci ve üçüncü trimester maruziyeti genellikle teratojenik riski ve bilişsel gelişim üzerindeki olumsuz etkileri artırmaz, ancak gebeliğin çeşitli komplikasyonları ve fetal miyelosupresyon riskini artırabilir. ⓘ
Daha önce kemoterapi veya radyoterapi görmüş erkeklerde, tedaviden sonra gebe kalan çocuklarında genetik kusurlar veya konjenital malformasyonlarda artış görülmemektedir. Yardımcı üreme teknolojilerinin ve mikromanipülasyon tekniklerinin kullanılması bu riski artırabilir. Daha önce kemoterapi görmüş kadınlarda, sonraki gebeliklerde düşük ve konjenital malformasyonlarda artış görülmemektedir. Bununla birlikte, tedavi arasında veya tedaviden kısa bir süre sonra in vitro fertilizasyon ve embriyo kriyoprezervasyonu uygulandığında, büyüyen oositler için olası genetik riskler mevcuttur ve bu nedenle bebeklerin taranması önerilmiştir. ⓘ
Periferik nöropati
Kemoterapi gören kişilerin yüzde 30 ila 40'ı, ellerde ve ayaklarda başlayan ve bazen kollara ve bacaklara ilerleyen ağrı, karıncalanma, uyuşma ve soğuğa karşı hassasiyete neden olan, ilerleyici, kalıcı ve genellikle geri döndürülemez bir durum olan kemoterapiye bağlı periferik nöropati (CIPN) yaşamaktadır. CIPN ile ilişkili kemoterapi ilaçları arasında talidomid, epotilonlar, vinka alkaloidleri, taksanlar, proteazom inhibitörleri ve platin bazlı ilaçlar bulunmaktadır. CIPN'nin ortaya çıkıp çıkmayacağı ve ne derecede ortaya çıkacağı ilacın seçimi, kullanım süresi, tüketilen toplam miktar ve kişide halihazırda periferik nöropati olup olmadığına göre belirlenir. Belirtiler çoğunlukla duyusal olsa da, bazı durumlarda motor sinirler ve otonom sinir sistemi de etkilenir. CIPN genellikle ilk kemoterapi dozunu takip eder ve tedavi devam ettikçe şiddeti artar, ancak bu ilerleme genellikle tedavi tamamlandığında düzleşir. Platin bazlı ilaçlar istisnadır; bu ilaçlarla duyu, tedavinin bitiminden sonra birkaç ay boyunca kötüleşmeye devam edebilir. Bazı CIPN'ler geri döndürülemez gibi görünmektedir. Ağrı genellikle ilaç veya diğer tedavilerle kontrol altına alınabilir ancak uyuşukluk genellikle tedaviye dirençlidir. ⓘ
Bilişsel bozukluk
Kemoterapi alan bazı kişiler yorgunluk veya konsantre olamama gibi spesifik olmayan nörobilişsel sorunlar bildirmektedir; bu bazen kemoterapi sonrası bilişsel bozukluk olarak adlandırılır ve popüler ve sosyal medyada "kemo beyin" olarak adlandırılır. ⓘ
Tümör lizis sendromu
Özellikle büyük tümörlerde ve lenfomalar, teratomlar ve bazı lösemiler gibi yüksek beyaz hücre sayısına sahip kanserlerde, bazı kişilerde tümör lizis sendromu gelişir. Kanser hücrelerinin hızla parçalanması, hücrelerin içinden kimyasalların salınmasına neden olur. Bunu takiben kanda yüksek seviyelerde ürik asit, potasyum ve fosfat bulunur. Yüksek fosfat seviyeleri ikincil hipoparatiroidizmi tetikleyerek kanda düşük kalsiyum seviyelerine neden olur. Bu durum böbrek hasarına neden olur ve yüksek potasyum seviyeleri kardiyak aritmiye yol açabilir. Profilaksi mevcut olmasına ve genellikle büyük tümörleri olan kişilerde başlatılmasına rağmen, bu tedavi edilmezse ölüme yol açabilecek tehlikeli bir yan etkidir. ⓘ
Organ hasarı
Kardiyotoksisite (kalp hasarı) özellikle antrasiklin ilaçların (doksorubisin, epirubisin, idarubisin ve lipozomal doksorubisin) kullanımında öne çıkmaktadır. Bunun nedeni büyük olasılıkla hücrede serbest radikallerin üretilmesi ve ardından DNA hasarının oluşmasıdır. Kardiyotoksisiteye neden olan, ancak daha düşük insidansa sahip diğer kemoterapötik ajanlar siklofosfamid, dosetaksel ve klofarabindir. ⓘ
Hepatotoksisiteye (karaciğer hasarı) birçok sitotoksik ilaç neden olabilir. Bir bireyin karaciğer hasarına yatkınlığı, kanserin kendisi, viral hepatit, immünosupresyon ve beslenme yetersizliği gibi diğer faktörler tarafından değiştirilebilir. Karaciğer hasarı karaciğer hücrelerinde hasar, hepatik sinüzoidal sendrom (karaciğerdeki damarların tıkanması), kolestaz (safranın karaciğerden bağırsağa akmaması) ve karaciğer fibrozisinden oluşabilir. ⓘ
Nefrotoksisite (böbrek hasarı) tümör lizis sendromundan kaynaklanabileceği gibi ilacın böbrekler tarafından temizlenmesinin doğrudan etkilerine de bağlı olabilir. Farklı ilaçlar böbreğin farklı kısımlarını etkiler ve toksisite asemptomatik olabilir (sadece kan veya idrar testlerinde görülür) veya akut böbrek hasarına neden olabilir. ⓘ
Ototoksisite (iç kulak hasarı) platin bazlı ilaçların yaygın bir yan etkisidir ve baş dönmesi ve vertigo gibi semptomlara neden olabilir. Platin analogları ile tedavi edilen çocukların işitme kaybı geliştirme riski altında olduğu bulunmuştur. ⓘ
Diğer yan etkiler
Daha az görülen yan etkiler arasında kırmızı cilt (eritem), kuru cilt, hasar görmüş tırnaklar, ağız kuruluğu (kserostomi), su tutma ve cinsel iktidarsızlık yer alır. Bazı ilaçlar alerjik veya psödoalerjik reaksiyonları tetikleyebilir. ⓘ
Belirli kemoterapötik ajanlar, kardiyovasküler hastalık (örn. doksorubisin), interstisyel akciğer hastalığı (örn. bleomisin) ve bazen ikincil neoplazm (örn. Hodgkin hastalığı için MOPP tedavisi) dahil olmak üzere organa özgü toksisitelerle ilişkilidir. ⓘ
El-ayak sendromu sitotoksik kemoterapinin bir diğer yan etkisidir. ⓘ
Kanser hastalarında tanı sırasında ve kemoterapi tedavisi boyunca beslenme sorunları da sıklıkla görülür. Araştırmalar, kanser tedavisi gören çocuklarda ve gençlerde parenteral beslenmenin enteral beslenmeye kıyasla kilo alımına ve kalori ve protein alımının artmasına yardımcı olabileceğini göstermektedir. ⓘ
Sınırlamalar
Kemoterapi her zaman işe yaramaz ve yararlı olduğu durumlarda bile kanseri tamamen yok etmeyebilir. İnsanlar sıklıkla bunun sınırlarını anlamakta başarısız olmaktadır. Tedavisi olmayan, 4. evre kanser teşhisi konmuş kişiler üzerinde yapılan bir çalışmada, akciğer kanseri olan kişilerin üçte ikisinden fazlası ve kolorektal kanseri olan kişilerin beşte dördünden fazlası hala kemoterapinin kanserlerini iyileştirebileceğine inanmaktadır. ⓘ
Kan-beyin bariyeri kemoterapinin beyne ulaştırılmasında bir engel teşkil etmektedir. Bunun nedeni, beynin kendisini zararlı kimyasallardan korumak için kapsamlı bir sisteme sahip olmasıdır. İlaç taşıyıcıları ilaçları beyinden ve beynin kan damarı hücrelerinden beyin omurilik sıvısına ve kan dolaşımına pompalayabilir. Bu taşıyıcılar çoğu kemoterapi ilacını dışarı pompalar, bu da beyin tümörlerinin tedavisinde etkinliklerini azaltır. Sadece lomustin veya temozolomid gibi küçük lipofilik alkilleyici ajanlar bu kan-beyin bariyerini geçebilir. ⓘ
Tümörlerdeki kan damarları normal dokularda görülenlerden çok farklıdır. Bir tümör büyüdükçe, kan damarlarından en uzaktaki tümör hücrelerinin oksijeni azalır (hipoksik). Buna karşı koymak için yeni kan damarlarının büyümesi için sinyal verirler. Yeni oluşan tümör vaskülatürü kötü şekillenir ve tümörün tüm bölgelerine yeterli kan akışı sağlamaz. Bu durum ilaç dağıtımında sorunlara yol açar çünkü birçok ilaç dolaşım sistemi tarafından tümöre iletilecektir. ⓘ
Direnç
Direnç, kemoterapötik ilaçlarda tedavi başarısızlığının önemli bir nedenidir. Kanserde direncin birkaç olası nedeni vardır; bunlardan biri, kanser hücrelerinin yüzeyinde kemoterapiyi aktif olarak hücre içinden dışarıya taşıyan küçük pompaların varlığıdır. Kanser hücreleri kendilerini kemoterapötiklerden korumak için p-glikoprotein olarak bilinen bu pompalardan yüksek miktarda üretir. P-glikoprotein ve diğer kemoterapi efluks pompaları üzerine araştırmalar halen devam etmektedir. P-glikoproteinin işlevini engelleyen ilaçlar araştırılmaktadır, ancak toksisiteler ve anti-kanser ilaçlarıyla etkileşimler nedeniyle bunların geliştirilmesi zor olmuştur. Bir başka direnç mekanizması da, kanser hücreleri tarafından bir genin birden fazla kopyasının üretildiği bir süreç olan gen amplifikasyonudur. Bu, replikasyonda yer alan genlerin ifadesini azaltan ilaçların etkisinin üstesinden gelir. Genin daha fazla kopyasıyla, ilaç genin tüm ifadesini önleyemez ve bu nedenle hücre çoğalma yeteneğini geri kazanabilir. Kanser hücreleri ayrıca apoptozun (programlı hücre ölümü) hücresel yollarında da kusurlara neden olabilir. Kemoterapi ilaçlarının çoğu kanser hücrelerini bu şekilde öldürdüğünden, kusurlu apoptoz bu hücrelerin hayatta kalmasına izin vererek onları dirençli hale getirir. Birçok kemoterapi ilacı ayrıca DNA hasarına neden olur ve bu hasar hücrede DNA onarımını gerçekleştiren enzimler tarafından onarılabilir. Bu genlerin yukarı regülasyonu DNA hasarının üstesinden gelebilir ve apoptozun indüklenmesini önleyebilir. Tübülin gibi ilaç hedef proteinlerini üreten genlerde, ilaçların proteine bağlanmasını engelleyen mutasyonlar meydana gelebilir ve bu da bu tür ilaçlara karşı dirence yol açabilir. Kemoterapide kullanılan ilaçlar bir kanser hücresini öldürebilen hücre stresini indükleyebilir; ancak, belirli koşullar altında, hücre stresi, çeşitli ilaç türlerine direnç sağlayan gen ekspresyonunda değişikliklere neden olabilir. Akciğer kanserinde, transkripsiyon faktörü NFκB'nin enflamatuar yollar aracılığıyla kemoterapiye dirençte rol oynadığı düşünülmektedir. ⓘ
Sitotoksikler ve hedefe yönelik tedaviler
Hedefe yönelik tedaviler, sitotoksiklerin kullanımında görülen birçok sorunun üstesinden gelebilen nispeten yeni bir kanser ilacı sınıfıdır. İki gruba ayrılırlar: küçük molekül ve antikorlar. Sitotoksiklerin kullanımında görülen büyük toksisite, ilaçların hücre özgüllüğünün olmamasından kaynaklanmaktadır. Tümör ya da normal, hızla bölünen herhangi bir hücreyi öldüreceklerdir. Hedefe yönelik tedaviler, kanser hücreleri tarafından kullanılan hücresel proteinleri veya süreçleri etkilemek üzere tasarlanmıştır. Bu sayede kanser dokularına yüksek doz verilirken diğer dokulara nispeten düşük doz verilir. Yan etkiler genellikle sitotoksik kemoterapötiklerde görülenden daha az şiddetli olsa da, yaşamı tehdit eden etkiler ortaya çıkabilir. Başlangıçta, hedefe yönelik terapötiklerin yalnızca bir protein için seçici olması gerekiyordu. Artık ilacın bağlanabileceği bir dizi protein hedefi olduğu açıktır. Hedefe yönelik tedavi için örnek bir hedef, kronik miyelojenöz lösemide ve bazı akut lenfoblastik lösemili hastalarda yaygın olarak bulunan genetik bir lezyon olan Philadelphia kromozomundan üretilen BCR-ABL1 proteinidir. Bu füzyon proteini, küçük moleküllü bir ilaç olan imatinib tarafından inhibe edilebilen enzim aktivitesine sahiptir. ⓘ
Etki mekanizması

Kanser, kötü huylu davranışlarla birlikte hücrelerin kontrolsüz büyümesidir: invazyon ve metastaz (diğer özelliklerin yanı sıra). Genetik yatkınlık ve çevresel faktörler arasındaki etkileşimden kaynaklanır. Bu faktörler onkogenlerde (hücrelerin büyüme hızını kontrol eden genler) ve tümör baskılayıcı genlerde (kanseri önlemeye yardımcı olan genler) genetik mutasyonların birikmesine yol açarak kanser hücrelerine kontrolsüz büyüme gibi kötü huylu özelliklerini kazandırır. ⓘ
Geniş anlamda, kemoterapötik ilaçların çoğu mitozu (hücre bölünmesi) bozarak hızlı bölünen hücreleri etkili bir şekilde hedef alarak çalışır. Bu ilaçlar hücrelere zarar verdiği için sitotoksik olarak adlandırılırlar. DNA'ya zarar vermek ve hücre bölünmesine dahil olan hücresel mekanizmaların inhibisyonu gibi çeşitli mekanizmalarla mitozu önlerler. Bu ilaçların kanser hücrelerini neden öldürdüğüne dair bir teori, apoptoz olarak bilinen programlanmış bir hücre ölümü biçimini indükledikleridir. ⓘ
Kemoterapi hücre bölünmesini etkilediğinden, yüksek büyüme oranına sahip tümörler (akut miyelojenöz lösemi ve Hodgkin hastalığı dahil agresif lenfomalar gibi) kemoterapiye daha duyarlıdır, çünkü hedeflenen hücrelerin daha büyük bir kısmı herhangi bir zamanda hücre bölünmesi geçirmektedir. İndolent lenfomalar gibi daha yavaş büyüme hızına sahip maligniteler kemoterapiye çok daha mütevazı yanıt verme eğilimindedir. Heterojenik tümörler de tümör içindeki subklonal popülasyonlara bağlı olarak kemoterapi ajanlarına karşı farklı hassasiyetler gösterebilir. ⓘ
Bağışıklık sistemi hücreleri de kemoterapinin antitümör etkilerine önemli katkılarda bulunur. Örneğin, kemoterapötik ilaçlar oksaliplatin ve siklofosfamid, tümör hücrelerinin bağışıklık sistemi tarafından tespit edilebilecek şekilde ölmesine neden olabilir (immünojenik hücre ölümü olarak adlandırılır), bu da antitümör işlevleri olan bağışıklık hücrelerini harekete geçirir. Kanser immünojenik tümör hücresi ölümüne neden olan kemoterapötik ilaçlar, yanıt vermeyen tümörleri immün kontrol noktası tedavisine duyarlı hale getirebilir. ⓘ
Diğer kullanımlar
Bazı kemoterapi ilaçları, otoimmün bozukluklar ve kanserli olmayan plazma hücre diskrazisi gibi kanser dışındaki hastalıklarda da kullanılır. Bazı durumlarda genellikle daha düşük dozlarda kullanılırlar, bu da yan etkilerin en aza indirildiği anlamına gelirken, diğer durumlarda kanser tedavisinde kullanılanlara benzer dozlar kullanılır. Metotreksat romatoid artrit (RA), sedef hastalığı, ankilozan spondilit ve multipl skleroz tedavisinde kullanılır. RA'da görülen anti-enflamatuar yanıtın, immünosupresyona neden olan adenozin artışı, immüno-düzenleyici siklooksijenaz-2 enzim yolakları üzerindeki etkiler, pro-enflamatuar sitokinlerde azalma ve anti-proliferatif özelliklere bağlı olduğu düşünülmektedir. Metotreksat hem multipl skleroz hem de ankilozan spondilit tedavisinde kullanılmasına rağmen, bu hastalıklardaki etkinliği hala belirsizdir. Siklofosfamid bazen sistemik lupus eritematozusun yaygın bir semptomu olan lupus nefritini tedavi etmek için kullanılır. Deksametazon, bortezomib veya melfalan ile birlikte AL amiloidoz tedavisinde yaygın olarak kullanılmaktadır. Son zamanlarda, siklofosfamid ve deksametazon ile kombinasyon halinde bortezomid de AL amiloidozu için bir tedavi olarak umut vaat etmektedir. Lenalidomid gibi miyelom tedavisinde kullanılan diğer ilaçlar da AL amiloidoz tedavisinde umut vaat etmektedir. ⓘ
Kemoterapi ilaçları kemik iliği naklinden (hematopoetik kök hücre nakli) önce kondisyonlama rejimlerinde de kullanılır. Şartlandırma rejimleri, bir naklin aşılanmasına izin vermek için alıcının bağışıklık sistemini bastırmak için kullanılır. Siklofosfamid bu şekilde kullanılan yaygın bir sitotoksik ilaçtır ve genellikle tüm vücut ışınlaması ile birlikte kullanılır. Kemoterapötik ilaçlar, alıcının kemik iliği hücrelerini kalıcı olarak ortadan kaldırmak için yüksek dozlarda (miyeloablatif şartlandırma) veya kalıcı kemik iliği kaybını önleyecek daha düşük dozlarda (miyeloablatif olmayan ve yoğunluğu azaltılmış şartlandırma) kullanılabilir. Kanser dışı ortamlarda kullanıldığında, tedavi hala "kemoterapi" olarak adlandırılır ve genellikle kanserli insanlar için kullanılan aynı tedavi merkezlerinde yapılır. ⓘ
Mesleki maruziyet ve güvenli kullanım
1970'lerde antineoplastik (kemoterapi) ilaçlar tehlikeli olarak tanımlanmış ve Amerikan Sağlık Sistemi Eczacıları Derneği (ASHP) 1983 yılında tehlikeli ilaçların kullanımına ilişkin bir tavsiye yayınladıktan sonra tehlikeli ilaç kavramını ortaya atmıştır. Federal düzenlemelerin uyarlanması, ABD İş Güvenliği ve Sağlığı İdaresi'nin (OSHA) ilk olarak 1986'da kılavuzlarını yayınlaması ve ardından bunları 1996, 1999 ve en son 2006'da güncellemesiyle gerçekleşti. ⓘ
Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH) o zamandan beri bu ilaçlarla ilgili olarak işyerinde bir değerlendirme yürütmektedir. Antineoplastik ilaçlara mesleki maruziyet, kısırlık ve olası kanserojen etkiler de dahil olmak üzere birçok sağlık etkisiyle ilişkilendirilmiştir. NIOSH uyarı raporunda, bir kadın eczacıya papiller transizyonel hücreli karsinom teşhisi konulması gibi birkaç vaka bildirilmiştir. Eczacıya bu teşhisin konulmasından on iki yıl önce, 20 ay boyunca çok sayıda antineoplastik ilacın hazırlanmasından sorumlu olduğu bir hastanede çalışmıştır. Eczacının kanser için başka bir risk faktörü yoktu ve bu nedenle, literatürde bir neden-sonuç ilişkisi kurulmamış olmasına rağmen, kanseri antineoplastik ilaçlara maruz kalmasına bağlandı. Bir başka vaka, biyogüvenlik kabinindeki bir arızanın hemşirelik personelini antineoplastik ilaçlara maruz bıraktığına inanıldığı zaman meydana gelmiştir. İncelemeler, bu maruziyetten iki ve dokuz ay sonra genotoksik biyobelirteçlere dair kanıtlar ortaya koymuştur. ⓘ
Maruz kalma yolları
Antineoplastik ilaçlar genellikle intravenöz, intramüsküler, intratekal veya subkutanöz uygulama yoluyla verilir. Çoğu durumda, ilaç hastaya uygulanmadan önce birkaç çalışan tarafından hazırlanması ve kullanılması gerekir. İlaçların taşınması, hazırlanması veya uygulanmasında ya da antineoplastik ilaçlarla temas etmiş nesnelerin temizlenmesinde görev alan her çalışan potansiyel olarak tehlikeli ilaçlara maruz kalmaktadır. Sağlık çalışanları, eczacılar ve eczane teknisyenleri antineoplastik ilaçları hazırlarken ve kullanırken ve hemşireler ve doktorlar ilaçları hastalara uygularken olduğu gibi farklı durumlarda ilaçlara maruz kalmaktadır. Ayrıca, sağlık tesislerinde antineoplastik ilaçların imhasından sorumlu olanlar da maruz kalma riski altındadır. ⓘ
Antineoplastik ajanları hazırlayan, kullanan ve uygulayan sağlık çalışanlarının giydiği eldivenlerde önemli miktarda antineoplastik ajan bulunması nedeniyle dermal maruziyetin ana maruziyet yolu olduğu düşünülmektedir. Bir diğer kayda değer maruziyet yolu da ilaç buharlarının solunmasıdır. Çok sayıda çalışma inhalasyonu bir maruziyet yolu olarak araştırmıştır ve hava örneklemesi herhangi bir tehlikeli seviye göstermemiş olsa da, yine de potansiyel bir maruziyet yoludur. Elden ağıza yutma, sağlık kurumlarında uygulanan hijyenik standartlar nedeniyle diğerlerine kıyasla daha az olası bir maruziyet yoludur. Ancak yine de, özellikle sağlık kuruluşu dışındaki işyerlerinde potansiyel bir yoldur. Bu tehlikeli ilaçlara iğne batması yoluyla da maruz kalınabilir. Bu alanda yapılan araştırmalar, sağlık çalışanlarından alınan çoklu idrar örneklerindeki kanıtları inceleyerek mesleki maruziyetin gerçekleştiğini ortaya koymuştur. ⓘ
Tehlikeler
Tehlikeli ilaçlar sağlık çalışanlarını ciddi sağlık risklerine maruz bırakmaktadır. Birçok çalışma, antineoplastik ilaçların üreme sistemi üzerinde fetal kayıp, konjenital malformasyon ve infertilite gibi birçok yan etkisi olabileceğini göstermektedir. Birçok kez antineoplastik ilaçlara maruz kalan sağlık çalışanları spontan düşükler, ölü doğumlar ve konjenital malformasyonlar gibi olumsuz üreme sonuçlarına sahiptir. Ayrıca, çalışmalar bu ilaçlara maruz kalmanın adet döngüsü düzensizliklerine yol açtığını göstermiştir. Antineoplastik ilaçlar, bu tehlikeli maddelere maruz kalan sağlık çalışanlarının çocukları arasında öğrenme güçlüğü riskini de artırabilir. ⓘ
Dahası, bu ilaçların kanserojen etkileri vardır. Son elli yılda, çok sayıda çalışma antineoplastik ilaçlara maruz kalmanın kanserojen etkilerini göstermiştir. Benzer şekilde, alkilleyici ajanları insanlarda lösemi gelişimi ile ilişkilendiren araştırmalar yapılmıştır. Çalışmalar, bu ilaçlara maruz kalan hemşireler arasında meme kanseri, melanom dışı cilt kanseri ve rektum kanseri riskinin arttığını bildirmiştir. Diğer araştırmalar, anti-neoplastik ilaçların sağlık bakım ortamlarında çalışanlara potansiyel bir genotoksik etkisi olduğunu ortaya koymuştur. ⓘ
Sağlık hizmetleri ortamlarında güvenli kullanım
2018 yılı itibariyle, antineoplastik ilaçlar için belirlenmiş herhangi bir mesleki maruziyet sınırı bulunmamaktadır, yani OSHA veya Amerikan Devlet Endüstriyel Hijyenistler Konferansı (ACGIH) işyeri güvenlik kılavuzları belirlememiştir. ⓘ
Hazırlık
NIOSH, çalışanların maruziyetini azaltmak için tasarlanmış havalandırmalı bir kabin kullanılmasını önermektedir. Ayrıca, tüm personelin eğitilmesini, dolapların kullanılmasını, güvenlik programı tekniğinin ilk değerlendirmesinin yapılmasını ve ilaç ambalajını açarken, flakonları tutarken veya etiketleme yaparken koruyucu eldiven ve önlük giyilmesini önermektedir. Kişisel koruyucu ekipman giyerken, eldivenler kullanılmadan önce fiziksel kusurlar açısından incelenmeli ve her zaman çift eldiven ve koruyucu önlük giyilmelidir. Sağlık çalışanlarının ayrıca antineoplastik ilaçlarla çalışmadan önce ve sonra ellerini su ve sabunla yıkamaları, eldivenleri her 30 dakikada bir veya delindiğinde değiştirmeleri ve hemen bir kemoterapi atık kabına atmaları gerekmektedir. ⓘ
Kullanılan önlükler polietilen kaplı polipropilenden yapılmış tek kullanımlık önlükler olmalıdır. Bireyler önlük giyerken önlüklerin kapalı ve uzun kollu olmasına dikkat etmelidir. Hazırlık tamamlandığında, nihai ürün plastik bir torba içinde tamamen kapatılmalıdır. ⓘ
Sağlık çalışanı ayrıca havalandırmalı kabin içindeki tüm atık kaplarını kabinden çıkarmadan önce silmelidir. Son olarak, çalışanlar tüm koruyucu giysileri çıkarmalı ve havalandırmalı kabinin içinde atılmak üzere bir torbaya koymalıdır. ⓘ
Yönetim
İlaçlar yalnızca iğne listeleri ve kapalı sistemler gibi koruyucu tıbbi cihazlar kullanılarak ve IV tüplerin eczane personeli tarafından havalandırmalı bir kabin içinde hazırlanması gibi tekniklerle uygulanmalıdır. Çalışanlar, dış torbayı açarken ve ilacı hastaya ulaştırmak için dağıtım sistemini monte ederken ve ilaçların uygulanmasında kullanılan tüm malzemeleri atarken her zaman çift eldiven, gözlük ve koruyucu önlük gibi kişisel koruyucu ekipmanlar giymelidir. ⓘ
Hastane çalışanları antineoplastik ilaç içeren bir IV torbadan hortumları asla çıkarmamalı ve sistemdeki hortumların bağlantısını keserken hortumların iyice yıkandığından emin olmalıdır. IV torbasını çıkardıktan sonra, çalışanlar bunu diğer tek kullanımlık malzemelerle birlikte kapağı kapalı olarak doğrudan sarı kemoterapi atık konteynerine koymalıdır. Koruyucu ekipman çıkarılmalı ve tek kullanımlık kemoterapi atık konteynerine konulmalıdır. Bu yapıldıktan sonra, kişi iç eldivenlerini çıkarmadan önce veya çıkardıktan sonra kemoterapi atığını iki kez poşetlemelidir. Ayrıca, ilaç uygulama alanından ayrılmadan önce eller her zaman su ve sabunla yıkanmalıdır. ⓘ
Çalışan eğitimi
Sağlık tesislerinde işleri gereği tehlikeli ilaçlara maruz kalan tüm çalışanlar eğitim almalıdır. Eğitim, sevkiyat ve teslim alma personelini, temizlik görevlilerini, eczacıları, asistanları ve antineoplastik ilaçların taşınması ve depolanmasında yer alan tüm bireyleri içermelidir. Bu kişiler, çalışma alanlarında bulunan ilaçların tehlikeleri hakkında bilgi ve eğitim almalıdır. Çalışma alanlarında tehlikelerle karşılaşabilecekleri operasyonlar ve prosedürler, tehlikeli ilaçların varlığını tespit etmek için kullanılan farklı yöntemler ve tehlikelerin nasıl açığa çıktığı, üreme ve kanserojen tehlike potansiyelleri de dahil olmak üzere ilaçların fiziksel ve sağlık tehlikeleri hakkında bilgilendirilmeli ve eğitilmelidirler. Ayrıca, bu tehlikelerden kaçınmak ve kendilerini korumak için almaları gereken önlemler konusunda bilgilendirilmeli ve eğitilmelidirler. Bu bilgiler, sağlık çalışanları ilaçlarla temas ettiğinde, yani tehlikeli ilaçların bulunduğu bir çalışma alanında ilk görevlerini yerine getirdiklerinde verilmelidir. Ayrıca, yeni tehlikeler ortaya çıktığında ve yeni ilaçlar, prosedürler veya ekipmanlar kullanılmaya başlandığında da eğitim verilmelidir. ⓘ
Temizlik ve atık bertarafı
Antineoplastik ilaçların kullanıldığı çalışma alanını temizlerken ve dekontamine ederken, havadaki ilaç konsantrasyonlarının birikmesini önlemek için yeterli havalandırma olduğundan emin olunmalıdır. Çalışma yüzeyini temizlerken, hastane çalışanları her faaliyetten önce ve sonra ve vardiyalarının sonunda deaktivasyon ve temizlik maddeleri kullanmalıdır. Temizlik her zaman çift koruyucu eldiven ve tek kullanımlık önlük kullanılarak yapılmalıdır. Çalışanlar temizliği bitirdikten sonra, koruyucu eldivenlerini giymeye devam ederken faaliyette kullanılan maddeleri sarı kemoterapi atık konteynerine atmalıdır. Eldivenleri çıkardıktan sonra ellerini su ve sabunla iyice yıkamalıdırlar. İğneler, boş şişeler, şırıngalar, önlükler ve eldivenler gibi antineoplastik ilaçlarla temas eden veya bu ilaçların izini taşıyan her şey kemoterapi atık konteynerine atılmalıdır. ⓘ
Dökülme kontrolü
Antineoplastik ürünlerin dökülmesi durumunda yazılı bir politikanın yürürlükte olması gerekir. Politika, çeşitli boyutlarda dökülme olasılığının yanı sıra her boyut için gerekli prosedür ve kişisel koruyucu ekipmanı ele almalıdır. Eğitimli bir çalışan büyük bir dökülmeyi ele almalı ve tüm temizlik malzemelerini sarı kemoterapi atık konteynerine değil, EPA yönetmeliklerine uygun olarak kimyasal atık konteynerine atmalıdır. ⓘ
Mesleki izleme
Bir tıbbi gözetim programı oluşturulmalıdır. Maruziyet durumunda, iş sağlığı uzmanları ayrıntılı bir öykü almalı ve kapsamlı bir fiziksel muayene yapmalıdır. Bazı antineoplastik ilaçların mesane hasarına neden olduğu bilindiğinden, potansiyel olarak maruz kalan çalışanın idrarını idrar çubuğu veya mikroskobik inceleme yaparak test etmeli, özellikle kan aramalıdırlar. ⓘ
Üriner mutajenite, ilk kez 1979 yılında Falck ve arkadaşları tarafından kullanılan ve bakteriyel mutajenite deneylerini kullanan antineoplastik ilaçlara maruz kalmanın bir göstergesidir. Spesifik olmamasının yanı sıra, test diyet alımı ve sigara kullanımı gibi dış faktörlerden etkilenebilir ve bu nedenle az kullanılır. Ancak test, antineoplastik ilaçların hazırlanması sırasında yatay akışlı kabinlerin kullanımının dikey akışlı biyolojik güvenlik kabinlerine dönüştürülmesinde önemli bir rol oynamıştır çünkü eski kabinlerde sağlık çalışanları yüksek düzeyde ilaca maruz kalmaktadır. Bu, ilaçların kullanımını değiştirdi ve çalışanların antineoplastik ilaçlara maruziyetini etkili bir şekilde azalttı. ⓘ
Antineoplastik ilaçlara maruz kalmanın biyobelirteçleri genellikle idrar platini, metotreksat, idrar siklofosfamid ve ifosfamid ve 5-florourasilin idrar metabolitini içerir. Buna ek olarak, nadiren kullanılsa da ilaçları doğrudan idrarda ölçmek için kullanılan başka ilaçlar da vardır. Bu ilaçların doğrudan kişinin idrarında ölçülmesi, yüksek maruziyet seviyelerinin ve ilaçların inhalasyon veya dermal yolla alımının gerçekleştiğinin bir işaretidir. ⓘ
Yan etkileri
Kemoterapi ilaçları hastanın bağışıklık sistemini de etkilediğinden, kemoterapi sırasında hastanın bulaşıcı hastalıklara karşı direnci düşmektedir. Bu etkinin en fazla görüldüğü dönem kemoterapiden sonraki 5-15. günler arasındadır. Bu nedenle kemoterapi tedavisi gören hastaların özellikle bu dönemde bulaşıcı hastalığı olanlardan uzak durmaları, hijyen kurallarına daha fazla dikkat etmeleri gerekmektedir. ⓘ
Ayrıca bazı kemoterapi ilaçları bazı hastalarda yorgunluk, bulantı, kusma ve saç dökülmesine de yol açabilir. Bulantı ve kusmayı önlemek için oldukça etkili ilaçlar geliştirilmiştir. Kemoterapiye bağlı olarak dökülen saçlar tedavi kesildikten sonra geri gelmektedir.Kemoterapi gören hasta stresli olmaktadır fakat açlıkla siniri ve stresi azaltabileceği söylenmektedir. Bazı hastalarda Raynaud fenomeni rahatsızlığı da geliştiği gözlemlenmiştir.
| Onkoloji veya kanser ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |
| Tedavi ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |
Antineoplastik ajanların geniş bir listesi vardır. Kanser için kullanılan ilaçları birkaç farklı türe ayırmak için çeşitli sınıflandırma şemaları kullanılmıştır. ⓘ
Tarihçe
Kanseri tedavi etmek için küçük moleküllü ilaçların ilk kullanımı 20. yüzyılın başlarında olmuştur, ancak ilk kullanılan belirli kimyasallar başlangıçta bu amaç için tasarlanmamıştır. Hardal gazı I. Dünya Savaşı sırasında kimyasal savaş ajanı olarak kullanılmış ve hematopoezin (kan üretimi) güçlü bir baskılayıcısı olduğu keşfedilmiştir. Azot hardalları olarak bilinen benzer bir bileşik ailesi, İkinci Dünya Savaşı sırasında Yale Tıp Fakültesi'nde daha fazla incelenmiştir. Hızla büyüyen beyaz kan hücrelerine zarar veren bir ajanın kanser üzerinde de benzer bir etkiye sahip olabileceği düşünülmüştür. Bu nedenle, Aralık 1942'de, ilerlemiş lenfomaları (lenfatik sistem ve lenf düğümleri kanserleri) olan birkaç kişiye tahriş edici gazı solumak yerine damar yoluyla ilaç verildi. Geçici de olsa iyileşmeleri dikkate değerdi. Aynı zamanda, İkinci Dünya Savaşı'ndaki bir askeri operasyon sırasında, İtalya'nın Bari limanına yapılan bir Alman hava saldırısının ardından, birkaç yüz kişi yanlışlıkla, Almanların kimyasal savaş kullanması durumunda olası misillemeye hazırlanmak için Müttefik kuvvetler tarafından oraya taşınan hardal gazına maruz kalmıştır. Hayatta kalanların daha sonra akyuvar sayılarının çok düşük olduğu tespit edildi. İkinci Dünya Savaşı sona erdikten ve raporların gizliliği kaldırıldıktan sonra, deneyimler bir araya geldi ve araştırmacıları kansere karşı benzer etkileri olabilecek başka maddeler aramaya yöneltti. Bu araştırma sonucunda geliştirilen ilk kemoterapi ilacı mustine oldu. O zamandan beri, kanseri tedavi etmek için birçok başka ilaç geliştirildi ve ilaç geliştirme milyarlarca dolarlık bir endüstriye dönüştü, ancak ilk araştırmacılar tarafından keşfedilen kemoterapinin ilkeleri ve sınırlamaları hala geçerlidir. ⓘ
Kemoterapi terimi
Değiştirici olmadan kemoterapi kelimesi genellikle kanser tedavisini ifade eder, ancak tarihsel anlamı daha geniştir. Terim 1900'lerin başında Paul Ehrlich tarafından, antibiyotik kullanımı (antibakteriyel kemoterapi) gibi herhangi bir hastalığı (kemo- + -terapi) tedavi etmek için kimyasalların kullanımı anlamında kullanılmıştır. Ehrlich, kanser tedavisi için etkili kemoterapi ilaçlarının bulunacağı konusunda iyimser değildi. İlk modern kemoterapötik ajan, 1907 yılında keşfedilen ve frengi tedavisinde kullanılan bir arsenik bileşiği olan arsphenamine idi. Bunu daha sonra sülfonamidler (sülfa ilaçları) ve penisilin izlemiştir. Günümüz kullanımında, "hastalığın ilaçlarla tedavisi" anlamı genellikle farmakoterapi kelimesiyle ifade edilmektedir. ⓘ
Satış
2013 yılının en çok satan (gelir açısından) ilk 10 kanser ilacı:
| No. | 2013 Küresel Satışlar | INN | Ticari isimler | Pazarlama izni sahibi | Endikasyonlar ⓘ |
|---|---|---|---|---|---|
| 1 | 7.78 milyar dolar | Rituximab | Rituxan, MabThera | Roche, Pharmstandard | Hodgkin dışı lenfoma, KLL |
| 2 | 6.75 milyar dolar | Bevacizumab | Avastin | Roche | Kolorektal, akciğer, yumurtalık ve beyin kanseri |
| 3 | 6.56 milyar dolar | Trastuzumab | Herceptin | Roche | Meme, özofagus ve mide kanseri |
| 4 | 4.69 milyar dolar | İmatinib | Gleevec | Novartis | Lösemi, GI kanseri |
| 5 | 1.09 milyar dolar | Lenalidomid | Revlimid | Celgene, Pharmstandard | Multipl miyelom, mantle hücreli lenfoma |
| 6 | 2.7 milyar dolar | Pemetreksed | Alimta | Eli Lilly | Akciğer kanseri |
| 7 | 2.6 milyar dolar | Bortezomib | Velcade | Johnson & Johnson, Takeda, Pharmstandard | Multipl miyelom |
| 8 | 1.87 milyar dolar | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | Kolon ve baş-boyun kanseri |
| 9 | 1.73 milyar dolar | Leuprorelin | Lupron, Eligard | AbbVie ve Takeda; Sanofi ve Astellas Pharma | Prostat ve yumurtalık kanseri |
| 10 | 1.7 milyar dolar | Abirateron | Zytiga | Johnson & Johnson | Prostat kanseri |
Araştırma

Hedefe yönelik tedaviler
Özel olarak hedeflenmiş iletim araçları, diğer hücreler için etkili seviyeleri azaltırken tümör hücreleri için etkili kemoterapi seviyelerini artırmayı amaçlamaktadır. Bu da tümörün öldürülmesinde artış veya toksisitede azalma ya da her ikisiyle birden sonuçlanmalıdır. ⓘ
Antikor-ilaç konjugatları
Antikor-ilaç konjugatları (ADC'ler) bir antikor, ilaç ve bunlar arasında bir bağlayıcıdan oluşur. Antikor, tümör hücrelerinde (tümör antijeni olarak bilinir) tercihli olarak ifade edilen bir proteini veya kan damarı endotel hücreleri gibi tümörün kullanabileceği hücreleri hedef alacaktır. Tümör antijenine bağlanırlar ve bağlayıcının ilacı hücre içine bıraktığı yerde içselleştirilirler. Bu özel hedefli iletim araçları stabiliteleri, seçicilikleri ve hedef seçimleri bakımından farklılık gösterir, ancak özünde hepsi de tümör hücrelerine verilebilecek maksimum etkili dozu artırmayı amaçlar. Azaltılmış sistemik toksisite, daha hasta olan kişilerde de kullanılabilecekleri ve geleneksel sistemik yaklaşımlarla iletilemeyecek kadar toksik olan yeni kemoterapötik ajanları taşıyabilecekleri anlamına gelmektedir. ⓘ
Bu türde onaylanan ilk ilaç Wyeth (şimdi Pfizer) tarafından piyasaya sürülen gemtuzumab ozogamicin (Mylotarg) olmuştur. İlaç akut miyeloid lösemi tedavisi için onaylanmıştır. Diğer iki ilaç, trastuzumab emtansine ve brentuximab vedotin, geç klinik denemelerdedir ve ikincisine refrakter Hodgkin lenfoma ve sistemik anaplastik büyük hücreli lenfoma tedavisi için hızlandırılmış onay verilmiştir. ⓘ
Nanopartiküller
Nanopartiküller, tümör seçiciliğini artırabilen ve düşük çözünürlüklü ilaçların verilmesine yardımcı olan 1-1000 nanometre (nm) boyutundaki partiküllerdir. Nanopartiküller pasif veya aktif olarak hedeflenebilir. Pasif hedefleme, tümör kan damarları ile normal kan damarları arasındaki farktan yararlanır. Tümörlerdeki kan damarları "sızıntılıdır" çünkü 200 ila 2000 nm arasında boşlukları vardır ve bu da nanopartiküllerin tümöre kaçmasına izin verir. Aktif hedefleme, nanopartikülleri tercihli olarak tümör hücrelerine hedeflemek için biyolojik moleküller (antikorlar, proteinler, DNA ve reseptör ligandları) kullanır. Silika, polimerler, lipozomlar ve manyetik partiküller gibi birçok nanopartikül iletim sistemi türü vardır. Manyetik malzemeden yapılmış nanopartiküller, harici olarak uygulanan bir manyetik alan kullanarak ajanları tümör bölgelerinde yoğunlaştırmak için de kullanılabilir. Paklitaksel gibi az çözünen ajanlar için manyetik ilaç dağıtımında yararlı bir araç olarak ortaya çıkmışlardır. ⓘ
Elektrokemoterapi
Elektrokemoterapi, kemoterapötik bir ilacın enjeksiyonunu takiben tümöre lokal olarak yüksek voltajlı elektrik darbelerinin uygulandığı kombine tedavidir. Bu tedavi, aksi takdirde hücrelerin zarından geçemeyen veya zor geçen kemoterapötik ilaçların (bleomisin ve sisplatin gibi) kanser hücrelerine girmesini sağlar. Böylece antitümör tedavinin daha etkili olması sağlanır. ⓘ
Klinik elektrokemoterapi, histolojik kökenlerine bakılmaksızın deri ve deri altı tümörlerin tedavisinde başarıyla kullanılmaktadır. Elektrokemoterapinin klinik kullanımına ilişkin tüm raporlarda yöntemin güvenli, basit ve oldukça etkili olduğu bildirilmiştir. ESOPE projesine (Avrupa Elektrokemoterapi Standart Çalışma Prosedürleri) göre, Avrupa'nın önde gelen kanser merkezlerinin elektrokemoterapi konusundaki deneyimlerine dayanarak elektrokemoterapi için Standart Çalışma Prosedürleri (SOP) hazırlanmıştır. Son zamanlarda, tedavi alanına erişim sağlamak için cerrahi prosedürler, endoskopik yollar veya perkütan yaklaşımlar kullanılarak dahili tümörlerin tedavisi için yeni elektrokemoterapi modaliteleri geliştirilmiştir. ⓘ
Hipertermi tedavisi
Hipertermi tedavisi, çeşitli kanserlerin kontrolü için kemoterapi (termokemoterapi) veya radyasyon ile birlikte kullanıldığında güçlü bir araç olabilen kanser için ısı tedavisidir. Isı tümör bölgesine lokal olarak uygulanabilir, bu da tümöre giden kan damarlarını genişleterek daha fazla kemoterapötik ilacın tümöre girmesini sağlar. Ayrıca, tümör hücresi zarı daha gözenekli hale gelecek ve kemoterapötik ilacın tümör hücresine daha fazla girmesine izin verecektir. ⓘ
Hiperterminin "kemo-direnci" önlemeye veya tersine çevirmeye yardımcı olduğu da gösterilmiştir. Kemoterapi direnci bazen tümörler uyum sağladıkça ve kemo ilacının toksisitesinin üstesinden gelebildikçe zaman içinde gelişir. "Kemorezistansın üstesinden gelinmesi, özellikle CDDP'ye dirençli hücreler kullanılarak geçmişte kapsamlı bir şekilde incelenmiştir. Kemoterapiyi hipertermi ile birleştirerek ilaca dirençli hücrelerin etkili bir tedavi için işe alınabilmesinin potansiyel faydası açısından, CDDP dahil olmak üzere çeşitli antikanser ilaçlara (örn. mitomisin C, antrasiklinler, BCNU, melfalan) karşı kemorezistansın ısı ilavesiyle en azından kısmen tersine çevrilebileceğini göstermek önemliydi. ⓘ
Diğer hayvanlar
Kemoterapi, veteriner hekimlikte insan hekimliğinde kullanıldığına benzer şekilde kullanılır. ⓘ