Etilen

| |||
|
| |||
| İsimler | |||
|---|---|---|---|
| IUPAC adı
Etilen
| |||
| Tercih edilen IUPAC adı
Ethene | |||
| Tanımlayıcılar | |||
CAS Numarası
|
|||
3D model (JSmol)
|
|||
Beilstein Referans
|
1730731 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Numarası |
| ||
Gmelin Referans
|
214 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 1962 1038 | ||
InChI
| |||
GÜLÜMSEMELER
| |||
| Özellikler | |||
Kimyasal formül
|
C 2H 4 | ||
| Molar kütle | 28.054 g-mol-1 | ||
| Görünüş | renksiz gaz | ||
| Yoğunluk | 15 °C'de 1.178 kg/m3, gaz | ||
| Erime noktası | -169,2 °C (-272,6 °F; 104,0 K) | ||
| Kaynama noktası | -103,7 °C (-154,7 °F; 169,5 K) | ||
Suda çözünürlük
|
0,131 mg/mL (25 °C); 2,9 mg/L | ||
| Etanol içinde çözünürlük | 4,22 mg/L | ||
| Dietil eter içinde çözünürlük | iyi | ||
| Asitlik (pKa) | 44 | ||
| Konjugat asit | Ethenium | ||
Manyetik duyarlılık (χ)
|
-15,30-10-6 cm3/mol | ||
| Viskozite | 10,28 μPa-s | ||
| Yapı | |||
Moleküler şekil
|
D2h | ||
Dipol moment
|
sıfır | ||
| Termokimya | |||
Std molar
entropi (S |
219,32 J-K-1-mol-1 | ||
Std entalpi
oluşumu (ΔfH⦵298) |
+52,47 kJ/mol | ||
| Tehlikeler | |||
| GHS etiketlemesi: | |||
Piktogramlar
|
 
| ||
Sinyal kelimesi
|
Tehlike | ||
Tehlike bildirimleri
|
H220, H336 | ||
Önlem ifadeleri
|
P210, P261, P271, P304+P340, P312, P377, P381, P403, P403+P233, P405, P501 | ||
| NFPA 704 (yangın elması) | |||
| Parlama noktası | -136 °C (-213 °F; 137 K) | ||
Otomatik ateşleme
sıcaklık |
542,8 °C (1.009,0 °F; 815,9 K) | ||
| Güvenlik bilgi formu (SDS) | ICSC 0475 | ||
| İlgili bileşikler | |||
İlgili bileşikler
|
Etan Asetilen Propene | ||
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da).
Bilgi kutusu referansları
| |||
Etilen (IUPAC adı: eten), C formülüne sahip bir hidrokarbondur
2H
4 veya H2C=CH2. Saf olduğunda hafif bir "tatlı ve misk" kokusuna sahip renksiz yanıcı bir gazdır. En basit alken (karbon-karbon çift bağları olan bir hidrokarbon) dir. ⓘ
Etilen kimya endüstrisinde yaygın olarak kullanılmaktadır ve dünya çapındaki üretimi (2016'da 150 milyon tonun üzerinde) diğer organik bileşiklerin üretimini aşmaktadır. Bu üretimin büyük bir kısmı, çeşitli zincir uzunluklarında etilen birimlerinden oluşan polimer zincirleri içeren ve yaygın olarak kullanılan bir plastik olan polietilene yöneliktir. Etilen aynı zamanda önemli bir doğal bitki hormonudur ve tarımda meyvelerin olgunlaşmasını zorlamak için kullanılır. Etilenin hidratı etanoldür. ⓘ

Etilen (eten), alken sınıfından renksiz bir gaz. Doymamış hidrokarbon olup, karbonlar arasında, çift bağ vardır. Formülü C2H4, kaynama noktası -69,4 °C, erime noktası -103,3 °C ve yoğunluğu 0,978 g/dm³ olan yanıcı bir gazdır. Etilen, suda orta derecede çözünür. Fakat alkol, eter, aseton ve benzende çok çözünür. Etilenin reaksiyon verme kabiliyeti oldukça yüksektir. Halojenlerle, sülfürik asit ve diğer çift bağ ile reaksiyon verebilen maddelerle hemen reaksiyon verdiği gibi polimerize polietileni meydana getirir. % 3 ile % 34 oranında etilen ihtiva eden hava karışımı patlayıcıdır. Zehir etkisi azdır. Fakat çok yüksek dozu şuursuzluk (bilinç kaybı) meydana getirir. ⓘ
Yapısı ve özellikleri

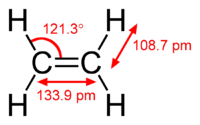
Bu hidrokarbon, çift bağ ile bağlanmış bir çift karbon atomuna bağlı dört hidrojen atomuna sahiptir. Etileni oluşturan altı atomun tamamı eş düzlemlidir. H-C-H açısı 117,4°'dir ve ideal sp² hibridize karbon için 120°'ye yakındır. Molekül aynı zamanda nispeten zayıftır: C-C bağı etrafında dönme, 50°C'de ısı sağlayarak π-bağının kırılmasını gerektiren çok düşük enerjili bir süreçtir. ⓘ
Etilen molekülündeki π bağı, yararlı reaktivitesinden sorumludur. Çift bağ yüksek elektron yoğunluğuna sahip bir bölgedir, bu nedenle elektrofillerin saldırısına karşı hassastır. Etilenin birçok reaksiyonu, hem π hem de π* orbitallerini kullanarak etilene geçici olarak bağlanan geçiş metalleri tarafından katalize edilir. ⓘ
Basit bir molekül olan etilen, spektroskopik olarak da basittir. UV-vis spektrumu hala teorik yöntemlerin bir testi olarak kullanılmaktadır. ⓘ
Kullanım Alanları
Etilenin başlıca endüstriyel reaksiyonları ölçek sırasına göre şunlardır: 1) polimerizasyon, 2) oksidasyon, 3) halojenasyon ve hidrohalojenasyon, 4) alkilasyon, 5) hidrasyon, 6) oligomerizasyon ve 7) hidroformilasyon. Amerika Birleşik Devletleri ve Avrupa'da etilenin yaklaşık %90'ı etilen oksit, etilen diklorür, etilbenzen ve polietilen üretmek için kullanılmaktadır. Etilen ile gerçekleşen reaksiyonların çoğu elektrofilik katılmadır. ⓘ

Polimerizasyon
Polietilen, dünyadaki etilen arzının yarısından fazlasını tüketmektedir. Polieten ve politen olarak da adlandırılan polietilen, dünyada en yaygın kullanılan plastiktir. Öncelikle ambalajlarda, taşıma çantalarında ve çöp astarlarında film yapımında kullanılır. Oligomerizasyon (kısa polimerlerin oluşumu) ile üretilen lineer alfa-olefinler, öncü maddeler, deterjanlar, plastikleştiriciler, sentetik yağlayıcılar, katkı maddeleri ve ayrıca polietilen üretiminde ko-monomer olarak kullanılır. ⓘ
Oksidasyon
Etilen, etoksilasyon yoluyla yüzey aktif maddelerin ve deterjanların üretiminde önemli bir hammadde olan etilen oksit üretmek için oksitlenir. Etilen oksit ayrıca, otomotiv antifrizi olarak yaygın şekilde kullanılan etilen glikolün yanı sıra daha yüksek moleküler ağırlıklı glikoller, glikol eterler ve polietilen tereftalat üretmek için hidrolize edilir. ⓘ
Etilen, asetaldehit vermek için paladyum tarafından oksidasyona uğrar. Bu dönüşüm önemli bir endüstriyel süreç olmaya devam etmektedir (10 milyon kg/y). Süreç, etilenin bir Pd(II) merkezine ilk kompleksleşmesi yoluyla ilerler. ⓘ
Halojenasyon ve hidrohalojenasyon
Etilenin halojenasyonu ve hidrohalojenasyonundan elde edilen başlıca ara ürünler arasında etilen diklorür, etil klorür ve etilen dibromür bulunur. Klor ilavesi "oksiklorinasyon" gerektirir, yani klorun kendisi kullanılmaz. Bu gruptan elde edilen bazı ürünler polivinil klorür, trikloretilen, perkloretilen, metil kloroform, poliviniliden klorür ve kopolimerleri ve etil bromürdür. ⓘ
Alkilasyon
Etilen ile alkilasyondan elde edilen başlıca kimyasal ara ürünler, stirenin öncüsü olan etilbenzendir. Stiren esas olarak ambalaj ve yalıtım için polistirende ve lastikler ve ayakkabılar için stiren-bütadien kauçukta kullanılır. Daha küçük ölçekte, etiltoluen, etilanilinler, 1,4-hekzadien ve alüminyum alkiller. Bu ara ürünlerin ürünleri arasında polistiren, doymamış polyesterler ve etilen-propilen terpolimerleri bulunmaktadır. ⓘ
Okso reaksiyonu
Etilenin hidroformilasyonu (okso reaksiyonu) propiyonik asit ve n-propil alkolün öncüsü olan propiyonaldehit ile sonuçlanır. ⓘ
Hidrasyon
Etilen uzun zamandır etanolün fermentatif olmayan başlıca öncülünü temsil etmektedir. Orijinal yöntem dietil sülfata dönüştürülmesini ve ardından hidrolizi gerektiriyordu. 1990'ların ortalarından beri uygulanan ana yöntem, katı asit katalizörleri tarafından katalize edilen etilenin doğrudan hidrasyonudur:
- C2H4 + H2O → CH3CH2OH ⓘ
Bütenlere dimerizasyon
Etilen, Lummus veya IFP tarafından lisanslanan süreçler kullanılarak n-bütenler elde etmek için hidrovinilasyon yoluyla dimerleştirilir. Lummus prosesi karışık n-bütenler (esas olarak 2-bütenler) üretirken IFP prosesi 1-büten üretir. 1-Büten, belirli polietilen türlerinin üretiminde komonomer olarak kullanılır. ⓘ
Meyve ve çiçeklenme
Etilen, birçok bitkinin olgunlaşmasını ve çiçeklenmesini etkileyen bir hormondur. Bahçecilikte ve meyvelerde tazeliği kontrol etmek için yaygın olarak kullanılır. ⓘ
Niş kullanımlar
Niş kullanımına örnek olarak anestezik madde (%85 etilen/%15 oksijen oranında) verilebilir. Bir diğer kullanım alanı ise kaynak gazıdır. ⓘ
Üretim
Küresel etilen üretimi 2005 yılında 107 milyon ton, 2006 yılında 109 milyon ton, 2010 yılında 138 milyon ton ve 2011 yılında 141 milyon ton olmuştur. 2013 yılı itibariyle etilen 32 ülkede en az 117 şirket tarafından üretilmektedir. Etilene yönelik sürekli artan talebi karşılamak için, özellikle Ortadoğu ve Çin'de olmak üzere, dünya genelinde üretim tesislerinde keskin artışlar yaşanmaktadır. ⓘ
Endüstriyel süreç
Etilen, petrokimya endüstrisinde çeşitli yöntemlerle üretilmektedir. Birincil yöntem, hidrokarbonların ve buharın 750-950 °C'ye ısıtıldığı buhar krakingidir (SC). Bu işlem büyük hidrokarbonları daha küçük hidrokarbonlara dönüştürür ve doymamışlık sağlar. Hammadde etan olduğunda, ürün etilendir. Etilen, tekrarlanan sıkıştırma ve damıtma ile elde edilen karışımdan ayrılır. Avrupa ve Asya'da etilen esas olarak propilen, C4 olefinler ve aromatiklerin (piroliz benzini) ortak üretimi ile nafta, gaz yağı ve kondensatların kırılmasından elde edilir. Etilen üretimi için kullanılan diğer teknolojiler arasında metanın oksidatif bağlanması, Fischer-Tropsch sentezi, metanol-olefin (MTO) ve katalitik dehidrojenasyon yer almaktadır. ⓘ
Laboratuvar sentezi
Endüstriyel olarak çok değerli olmasına rağmen, etilen laboratuvarda nadiren sentezlenir ve normalde satın alınır. Etanolün sülfürik asit ile dehidrasyonu yoluyla veya gaz fazında alüminyum oksit ile üretilebilir. ⓘ
Biyosentez
Etilen doğada metiyoninden üretilir. İlk öncüsü 1-aminosiklopropan-1-karboksilik asittir. ⓘ
Ligand

Etilen, geçiş metali alken komplekslerinde temel bir liganddır. İlk organometalik bileşiklerden biri olan Zeise tuzu bir etilen kompleksidir. Etilen içeren faydalı reaktifler arasında Pt(PPh3)2(C2H4) ve Rh2Cl2(C2H4)4 bulunur. Etilenin Rh katalizli hidroformilasyonu, propiyonaldehit elde etmek için endüstriyel ölçekte gerçekleştirilir. ⓘ
Tarihçe
Bazı jeologlar ve akademisyenler, Delphi'deki ünlü Yunan Kahin'in (Pythia) trans benzeri bir duruma geçmesinin, yer faylarından yükselen etilenin bir etkisi olduğuna inanmaktadır. ⓘ
Etilen, etanolü sülfürik asitle ısıtarak elde eden Johann Joachim Becher tarafından keşfedilmiş gibi görünmektedir; Becher, Physica Subterranea (1669) adlı eserinde bu gazdan bahsetmiştir. Joseph Priestley de Experiments and observations relating to the various branches of natural philosophy: with a continuation of the observations on air (1779) adlı eserinde bu gazdan bahseder; burada Jan Ingenhousz'un 1777'de Amsterdam'da Bay Enée tarafından aynı şekilde etilen sentezlendiğini gördüğünü ve Ingenhousz'un daha sonra gazı kendisinin ürettiğini bildirir. Etilenin özellikleri 1795 yılında Johann Rudolph Deimann, Adrien Paets van Troostwyck, Anthoni Lauwerenburgh ve Nicolas Bondt adlı dört Hollandalı kimyager tarafından incelenmiş ve hidrojen gazından farklı olduğu ve hem karbon hem de hidrojen içerdiği bulunmuştur. Bu grup aynı zamanda etilenin klor ile birleştirilerek Hollandalı kimyagerlerin petrolü olan 1,2-dikloroetan üretilebileceğini keşfetmiştir; bu keşif etilene o dönemde kullanılan olefiant gaz (petrol yapıcı gaz) adını vermiştir. Olefiant gaz terimi, etilenin ilk üyesi olduğu hidrokarbonlar sınıfı olan modern "olefin" kelimesinin etimolojik kökenidir. ⓘ
19. yüzyılın ortalarında, -ene eki (kadın isimlerinin sonuna eklenen ve "kızı" anlamına gelen bir Antik Yunan kökü), değiştirilen molekülden daha az hidrojen atomu içeren bir molekülü veya onun bir parçasını ifade etmek için yaygın olarak kullanılıyordu. Böylece, etilen (C
2H
4) "etilin kızı" (C
2H
5). Etilen adı bu anlamda 1852 gibi erken bir tarihte kullanılmıştır. ⓘ
1866'da Alman kimyager August Wilhelm von Hofmann, ana alkanlarından 0, 2, 4, 6 ve 8 daha az hidrojene sahip hidrokarbonları belirtmek için -ane, -ene, -ine, -one ve -une son eklerinin kullanıldığı bir hidrokarbon isimlendirme sistemi önerdi. Bu sistemde etilen, etene dönüşmüştür. Hofmann'ın sistemi sonunda 1892'de Uluslararası Kimyagerler Kongresi tarafından onaylanan ve IUPAC isimlendirmesinin temelini oluşturan Cenevre isimlendirmesinin temeli haline geldi. Ancak o zamana kadar etilen adı iyice yerleşmişti ve bugün de özellikle kimya endüstrisinde yaygın olarak kullanılmaya devam ediyor. ⓘ
Luckhardt, Crocker ve Carter tarafından Chicago Üniversitesi'nde yapılan deneylerin ardından etilen anestezik olarak kullanılmaya başlandı. Kloroform aşamalı olarak kullanımdan kaldırılırken bile 1940'lara kadar kullanımda kalmıştır. Keskin kokusu ve patlayıcı yapısı günümüzde kullanımını sınırlamaktadır. ⓘ
İsimlendirme
1979 IUPAC isimlendirme kuralları, sistematik olmayan etilen ismini korumak için bir istisna yapmıştır; ancak bu karar 1993 kurallarında tersine çevrilmiştir ve en yeni 2013 tavsiyelerinde değişmeden kalmıştır, bu nedenle IUPAC adı artık etendir. IUPAC sisteminde etilen adı -CH2CH2- iki değerlikli grubu için ayrılmıştır. Bu nedenle, etilen oksit ve etilen dibromür gibi isimlere izin verilir, ancak iki karbonlu alken için etilen isminin kullanılmasına izin verilmez. Bununla birlikte, H2C=CH2 için etilen (ve H2C=CHCH3 için propilen) adının kullanımı Kuzey Amerika'daki kimyagerler arasında hala yaygındır. ⓘ
Güvenlik
Tüm hidrokarbonlar gibi etilen de yanıcı bir boğucudur. İnsanlarda kansere neden olduğuna dair mevcut bir kanıt bulunmadığından IARC sınıf 3 kanserojen olarak listelenmiştir. ⓘ
Bitkisel hormon olarak etilen
Olgunlaşmakta olan meyvelerin dokularında,kök nodüllerinde,yaşlanan yapraklarda ve çiçeklerde bulunan bitkisel hormondur.Gaz halinde bulunan tek hormondur.
- Meyve olgunlaşmasını sağlar.
- Nişastanın şekere dönüşmesini sağlar.
- Yaprak dökümünü etkiler.
- Tohum çimlenmesi ve tomurcuklanmada etkilidir.
- Sadece salgılandığı bölgede etkili değildir gaz halinde olduğu için çevre bitkiler üzerinde de etkisi vardır. ⓘ



