Manganez
 | ||||||||||||||||||||||||||||||||
| Manganez | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz | /ˈmæŋɡəniːz/ (MANG-gə-neez) | |||||||||||||||||||||||||||||||
| Görünüş | gümüşi metalik | |||||||||||||||||||||||||||||||
| Standart atom ağırlığı Ar°(Mn) |
| |||||||||||||||||||||||||||||||
| Periyodik tabloda manganez | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Atom numarası (Z) | 25 | |||||||||||||||||||||||||||||||
| Grup | Grup 7 | |||||||||||||||||||||||||||||||
| Dönem | dönem 4 | |||||||||||||||||||||||||||||||
| Blok | d-blok | |||||||||||||||||||||||||||||||
| Elektron konfigürasyonu | [[[Argon|Ar]]] 3d5 4s2 | |||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 13, 2 | |||||||||||||||||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||||||||||||||||
| STP'de Faz | katı | |||||||||||||||||||||||||||||||
| Erime noktası | 1519 K (1246 °C, 2275 °F) | |||||||||||||||||||||||||||||||
| Kaynama noktası | 2334 K (2061 °C, 3742 °F) | |||||||||||||||||||||||||||||||
| Yoğunluk (r.t.'ye yakın) | 7,21 g/cm3 | |||||||||||||||||||||||||||||||
| sıvı olduğunda (m.p.'de) | 5,95 g/cm3 | |||||||||||||||||||||||||||||||
| Füzyon ısısı | 12,91 kJ/mol | |||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 221 kJ/mol | |||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 26,32 J/(mol-K) | |||||||||||||||||||||||||||||||
Buhar basıncı
| ||||||||||||||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||||||||||||||
| Oksidasyon durumları | -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7 (oksidasyon durumuna bağlı olarak asidik, bazik veya amfoterik oksit) | |||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1.55 | |||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||||||||
| Atomik yarıçap | ampi̇ri̇k: 127 pm | |||||||||||||||||||||||||||||||
| Kovalent yarıçap | Düşük dönüş: 139±5 pm Yüksek dönüş: 161±8 pm | |||||||||||||||||||||||||||||||
| Manganezin spektral çizgileri | ||||||||||||||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||||||||||||||||||
| Kristal yapı | gövde merkezli kübik (bcc) | |||||||||||||||||||||||||||||||
| Ses hızı ince çubuk | 5150 m/s (20 °C'de) | |||||||||||||||||||||||||||||||
| Termal genleşme | 21,7 µm/(m⋅K) (25 °C'de) | |||||||||||||||||||||||||||||||
| Termal iletkenlik | 7,81 W/(m⋅K) | |||||||||||||||||||||||||||||||
| Elektriksel direnç | 1,44 µΩ⋅m (20 °C'de) | |||||||||||||||||||||||||||||||
| Manyetik sıralama | paramanyetik | |||||||||||||||||||||||||||||||
| Molar manyetik duyarlılık | (α) +529,0×10-6 cm3/mol (293 K) | |||||||||||||||||||||||||||||||
| Young modülü | 198 GPa | |||||||||||||||||||||||||||||||
| Yığın modülü | 120 GPa | |||||||||||||||||||||||||||||||
| Mohs sertliği | 6.0 | |||||||||||||||||||||||||||||||
| Brinell sertliği | 196 MPa | |||||||||||||||||||||||||||||||
| CAS Numarası | 7439-96-5 | |||||||||||||||||||||||||||||||
| Tarih | ||||||||||||||||||||||||||||||||
| Keşif | Carl Wilhelm Scheele (1774) | |||||||||||||||||||||||||||||||
| İlk izolasyon | Johann Gottlieb Gahn (1774) | |||||||||||||||||||||||||||||||
| Manganezin ana izotopları | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Manganez, Mn sembolüne ve 25 atom numarasına sahip kimyasal bir elementtir. Genellikle minerallerde demir ile birlikte bulunan sert, kırılgan, gümüşi bir metaldir. Manganez, özellikle paslanmaz çeliklerde olmak üzere çok yönlü endüstriyel alaşım kullanımlarına sahip bir geçiş metalidir. Mukavemeti, işlenebilirliği ve aşınmaya karşı direnci artırır. Manganez oksit, oksitleyici bir madde olarak; kauçuk katkı maddesi olarak; ve cam yapımında, gübrelerde ve seramiklerde kullanılır. Manganez sülfat mantar ilacı olarak kullanılabilir. ⓘ
Manganez ayrıca makro besin metabolizmasında, kemik oluşumunda ve serbest radikal savunma sistemlerinde önemli olan temel bir insan diyet elementidir. Düzinelerce protein ve enzimde kritik bir bileşendir. Çoğunlukla kemiklerde bulunur, ancak karaciğer, böbrekler ve beyinde de bulunur. İnsan beyninde manganez, özellikle astrositlerdeki glutamin sentetaz olmak üzere manganez metaloproteinlerine bağlanır. ⓘ
Manganez ilk olarak 1774 yılında izole edilmiştir. Laboratuvarda koyu mor tuz potasyum permanganat şeklinde bilinir. Bazı enzimlerin aktif bölgelerinde bulunur. Bitkiler tarafından oksijen üretiminde oksijen geliştirici kompleks olan Mn-O kümesinin kullanılması özellikle ilgi çekicidir. ⓘ

Mangan veya manganez, atom numarası 25 olan element. ⓘ
Simgesi Mndir. 1774 yılında keşfedilmiştir. Periyodik tablonun 7-B grubunda yer alır. Grimsi metal renklidir. Çeliğin dayanımını geliştiren bir alaşım elementidir. Bu özelliği içinde bulunan karbon miktarına bağlıdır. Yüksek karbonlu çeliklerde manganın etkisi sertlik ve dayanımı artırmaktadır. Elementler için kullanılan periyodik yapı A B olarak adlandırılmıştır. ⓘ
Özellikleri
Fiziksel özellikler

Manganez, demire benzeyen gümüşi gri bir metaldir. Sert ve çok kırılgandır, kaynaşması zordur, ancak oksitlenmesi kolaydır. Manganez metali ve yaygın iyonları paramanyetiktir. Manganez havada yavaşça kararır ve çözünmüş oksijen içeren suda demir gibi oksitlenir ("paslanır"). ⓘ
İzotoplar
Doğal olarak oluşan manganez, bir kararlı izotop olan 55Mn'den oluşur. Atom ağırlığı 44 u (44Mn) ile 69 u (69Mn) arasında değişen çeşitli radyoizotoplar izole edilmiş ve tanımlanmıştır. En kararlı olanları 3,7 milyon yıllık yarı ömre sahip 53Mn, 312,2 günlük yarı ömre sahip 54Mn ve 5,591 günlük yarı ömre sahip 52Mn'dir. Geri kalan tüm radyoaktif izotopların yarı ömürleri üç saatten, çoğunluğununki ise bir dakikadan azdır. En bol bulunan kararlı izotop olan 55Mn'den daha hafif izotoplardaki birincil bozunma modu elektron yakalama, daha ağır izotoplardaki birincil mod ise beta bozunmasıdır. Manganezin ayrıca üç meta durumu vardır. ⓘ
Manganez, süpernova patlamasından kısa bir süre önce büyük yıldızlarda sentezlendiği düşünülen demir grubu elementlerin bir parçasıdır. 53Mn, 3,7 milyon yıllık bir yarı ömürle 53Cr'ye bozunur. Nispeten kısa yarı ömrü nedeniyle, 53Mn nispeten nadirdir ve kozmik ışınların demir üzerindeki etkisiyle üretilir. Manganez izotopik içerikleri tipik olarak krom izotopik içerikleri ile birleştirilir ve izotop jeolojisi ve radyometrik tarihlemede uygulama alanı bulmuştur. Mn-Cr izotopik oranları, Güneş Sistemi'nin erken tarihi için 26Al ve 107Pd'den elde edilen kanıtları güçlendirmektedir. Çeşitli meteoritlerden elde edilen 53Cr/52Cr ve Mn/Cr oranlarındaki değişimler, Mn-Cr izotopik bileşiminin farklılaşmış gezegensel cisimlerde 53Mn'nin yerinde bozunmasından kaynaklanması gerektiğini gösteren bir başlangıç 53Mn/55Mn oranına işaret etmektedir. Dolayısıyla 53Mn, Güneş Sistemi'nin birleşmesinden hemen önceki nükleosentetik süreçler için ek kanıtlar sağlamaktadır. ⓘ
Oksidasyon durumları

Manganezin en yaygın oksidasyon durumları +2, +3, +4, +6 ve +7'dir, ancak -3'ten +7'ye kadar tüm oksidasyon durumları gözlemlenmiştir. Mn2+ genellikle biyolojik sistemlerde Mg2+ ile rekabet eder ve bu iyon aynı zamanda özellikleri bakımından Ca2+ ve Zn2+ ile çok benzerdir. Manganezin +7 oksidasyon durumunda olduğu manganez bileşikleri, ki bunlar çoğunlukla kararsız oksit Mn2O7, yoğun mor permanganat anyonu MnO4- bileşikleri ve birkaç oksihalid (MnO3F ve MnO3Cl) ile sınırlıdır, güçlü oksitleyici maddelerdir. Oksidasyon durumları +5 (mavi) ve +6 (yeşil) olan bileşikler güçlü oksitleyici maddelerdir ve orantısızlığa karşı savunmasızdırlar. ⓘ

Manganez için en kararlı oksidasyon durumu soluk pembe bir renge sahip olan +2'dir ve manganez(II) sülfat (MnSO4) ve manganez(II) klorür (MnCl2) gibi birçok manganez(II) bileşiği bilinmektedir. Bu oksidasyon durumu rodokrozit (manganez(II) karbonat) mineralinde de görülür. Manganez(II), manganez(II) için yüksek eşleşme enerjisi nedeniyle en yaygın olarak yüksek spinli, S = 5/2 temel durumunda bulunur. Bununla birlikte, birkaç düşük spinli, S =1/2 manganez(II) örneği vardır. Manganez(II)'de spine izin verilen d-d geçişleri yoktur, bu da manganez(II) bileşiklerinin neden tipik olarak soluk ila renksiz olduğunu açıklar. ⓘ
| Manganezin oksidasyon durumları ⓘ | |
|---|---|
| 0 | Mn 2(CO) 10 |
| +1 | MnC 5H 4CH 3(CO) 3 |
| +2 | MnCl 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2O 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | KMnO 4, Mn 2O 7 |
| Yaygın oksidasyon durumları kalın harflerle gösterilmiştir. | |
3 oksidasyon durumu manganez(III) asetat gibi bileşiklerde bilinmektedir, ancak bunlar oldukça güçlü oksitleyici maddelerdir ve ayrıca çözeltide manganez(II) ve manganez(IV) oluşturarak orantısızlaşmaya eğilimlidir. Manganez(III)'ün katı bileşikleri, güçlü mor-kırmızı rengi ve Jahn-Teller etkisinden kaynaklanan çarpık oktahedral koordinasyon tercihi ile karakterize edilir. ⓘ
Oksidasyon durumu +5, manganez dioksitin erimiş sodyum nitrit içinde çözülmesiyle üretilebilir. Manganat(VI) tuzları, manganez dioksit gibi Mn bileşiklerinin erimiş alkali içinde havaya maruz bırakılarak çözülmesiyle üretilebilir. ⓘ
Permanganat (+7 oksidasyon durumu) bileşikleri mor renktedir ve cama menekşe rengi verebilir. Potasyum permanganat, sodyum permanganat ve baryum permanganat güçlü oksitleyicilerdir. Condy kristalleri olarak da adlandırılan potasyum permanganat, oksitleyici özellikleri nedeniyle yaygın olarak kullanılan bir laboratuvar reaktifidir; topikal bir ilaç olarak kullanılır (örneğin, balık hastalıklarının tedavisinde). Potasyum permanganat çözeltileri, elektron mikroskobu için biyolojik hücrelerin ve dokuların hazırlanmasında kullanılan ilk boyalar ve fiksatifler arasındaydı. ⓘ
Nadir oksidasyon durumu +1, yukarıdaki tabloda belirtilen MnC5H4CH3(CO)3 bileşiği gibi bazı organomangan bileşiklerinde mevcuttur. ⓘ
Tarih
Manganez adının kökeni karmaşıktır. Eski zamanlarda, Magnetes bölgelerinde (modern Yunanistan'da bulunan Magnesia veya modern Türkiye'de bulunan Magnesia ad Sipylum) iki siyah mineral tespit edilmiştir. Her ikisi de bulundukları yerden dolayı magnes olarak adlandırılmış, ancak cinsiyetlerinin farklı olduğu düşünülmüştür. Erkek magnes demiri çekiyordu ve şu anda lodestone veya manyetit olarak bilinen ve muhtemelen bize mıknatıs terimini veren demir cevheriydi. Dişi magnez cevheri demiri çekmezdi ama camın rengini açmak için kullanılırdı. Bu dişi magnez daha sonra magnezya olarak adlandırıldı ve modern zamanlarda pirolusit veya manganez dioksit olarak biliniyordu. Ne bu mineral ne de elementel manganez manyetiktir. 16. yüzyılda manganez dioksit cam yapımcıları tarafından manganesum (bir yerine iki N'ye dikkat edin) olarak adlandırıldı, muhtemelen iki kelimenin bozulması ve birleştirilmesi olarak, çünkü simyacılar ve cam yapımcıları sonunda bir magnesia nigra'yı (siyah cevher) magnesia alba'dan (yine Magnesia'dan, cam yapımında da yararlı olan beyaz bir cevher) ayırmak zorunda kaldılar. Michele Mercati magnesia nigra'yı manganesa olarak adlandırdı ve sonunda ondan izole edilen metal manganez (Almanca: Mangan) olarak bilinmeye başladı. Magnezya adı daha sonra sadece beyaz magnezya alba (magnezyum oksit) için kullanılmış ve bu da çok daha sonra izole edildiğinde serbest element için magnezyum adını sağlamıştır. ⓘ
Manganezin çeşitli renkli oksitleri, örneğin manganez dioksit, doğada bol miktarda bulunur ve Taş Devri'nden beri pigment olarak kullanılmıştır. Gargas'taki 30.000 ila 24.000 yıllık mağara resimleri manganez pigmentleri içermektedir. ⓘ
Manganez bileşikleri Mısırlı ve Romalı cam yapımcıları tarafından cama renk katmak ya da camdan renk çıkarmak için kullanılmıştır. "Camcı sabunu" olarak kullanımı Orta Çağ'dan modern zamanlara kadar devam etmiştir ve 14. yüzyıl Venedik camlarında görülmektedir. ⓘ

Cam yapımında kullanıldığı için manganez dioksit ilk kimyagerler olan simyacılar tarafından deneylerde kullanılabiliyordu. Ignatius Gottfried Kaim (1770) ve Johann Glauber (17. yüzyıl) manganez dioksitin yararlı bir laboratuvar reaktifi olan permanganata dönüştürülebileceğini keşfetti. 18. yüzyılın ortalarında İsveçli kimyager Carl Wilhelm Scheele manganez dioksiti klor üretmek için kullandı. İlk olarak, hidroklorik asit veya seyreltik sülfürik asit ve sodyum klorür karışımı manganez dioksit ile reaksiyona sokuldu ve daha sonra Leblanc işleminden elde edilen hidroklorik asit kullanıldı ve manganez dioksit Weldon işlemi ile geri dönüştürüldü. Klor ve hipoklorit ağartma maddelerinin üretimi manganez cevherlerinin büyük bir tüketicisiydi. ⓘ
18. yüzyılın ortalarında Carl Wilhelm Scheele klor üretmek için pirolusit kullanmıştır. Scheele ve diğerleri pirolusitin (şimdi manganez dioksit olduğu biliniyor) yeni bir element içerdiğinin farkındaydı. Johan Gottlieb Gahn, 1774 yılında manganez metalinin saf olmayan bir örneğini izole eden ilk kişiydi ve bunu dioksiti karbonla indirgeyerek yaptı. ⓘ
Yunanistan'da kullanılan bazı demir cevherlerinin manganez içeriği, bu cevherden üretilen çeliğin ilave manganez içerdiği ve Sparta çeliğini olağanüstü sert hale getirdiği spekülasyonlarına yol açtı. Manganez 19. yüzyılın başlarında çelik yapımında kullanılmaya başlanmış ve birkaç patent alınmıştır. 1816'da manganezle alaşımlandırılmış demirin daha sert olduğu ancak daha kırılgan olmadığı belgelenmiştir. 1837'de İngiliz akademisyen James Couper, madencilerin yoğun manganez maruziyeti ile bir tür Parkinson hastalığı arasında bir ilişki olduğunu kaydetti. 1912 yılında, ateşli silahları pas ve korozyona karşı manganez fosfat elektrokimyasal dönüşüm kaplamaları ile korumak için Amerika Birleşik Devletleri patentleri verildi ve süreç o zamandan beri yaygın olarak kullanıldı. ⓘ
1866'da Leclanché hücresinin icadı ve ardından katodik depolarizör olarak manganez dioksit içeren pillerin geliştirilmesi manganez dioksite olan talebi artırmıştır. Nikel-kadmiyum ve lityum içeren pillerin geliştirilmesine kadar, çoğu pil manganez içeriyordu. Çinko-karbon pil ve alkalin pil normalde endüstriyel olarak üretilen manganez dioksit kullanır çünkü doğal olarak oluşan manganez dioksit safsızlıklar içerir. 20. yüzyılda manganez dioksit, hem standart (çinko-karbon) hem de alkalin tipteki ticari tek kullanımlık kuru piller için katodik olarak yaygın bir şekilde kullanılmıştır. ⓘ
Oluşumu ve üretimi
Manganez, yerkabuğunun yaklaşık 1000 ppm'sini (%0,1) oluşturur ve yerkabuğu elementleri arasında en bol bulunan 12. elementtir. Toprak, ortalama 440 ppm olmak üzere 7-9000 ppm manganez içerir. Atmosfer 0,01 μg/m3 içerir. Manganez esas olarak pirolusit (MnO2), braunit, (Mn2+Mn3+6)(SiO12), psilomelan (Ba,H2O)2Mn5O10 ve daha az oranda rodokrozit (MnCO3) olarak bulunur. ⓘ
| Manganez cevheri | Psilomelane (manganez cevheri) | Spiegeleisen, yaklaşık %15 manganez içeriğine sahip bir demir alaşımıdır | Solnhofen, Almanya'dan kireçtaşı üzerinde manganez oksit dendritleri - bir tür sahte fosil. Ölçek mm cinsindendir | Rodokrozit minerali (manganez(II) karbonat) |

En önemli manganez cevheri pirolusittir (MnO2). Ekonomik açıdan önemli diğer manganez cevherleri genellikle sfalerit gibi demir cevherleriyle yakın bir mekansal ilişki gösterir. Kara kökenli kaynaklar büyüktür ancak düzensiz dağılmıştır. Bilinen dünya manganez kaynaklarının yaklaşık %80'i Güney Afrika'dadır; diğer önemli manganez yatakları Ukrayna, Avustralya, Hindistan, Çin, Gabon ve Brezilya'dadır. 1978 tahminlerine göre okyanus tabanında 500 milyar ton manganez yumrusu bulunmaktadır. Manganez yumrularının çıkarılması için ekonomik olarak uygulanabilir yöntemler bulma girişimleri 1970'lerde terk edilmiştir. ⓘ
Güney Afrika'da, tespit edilen yatakların çoğu Kuzey Cape Eyaletindeki Hotazel yakınlarında bulunmaktadır ve 2011 tahmini 15 milyar tondur. Güney Afrika 2011 yılında 3,4 milyon ton üreterek diğer tüm ülkelerin önüne geçmiştir. ⓘ
Manganez ağırlıklı olarak Güney Afrika, Avustralya, Çin, Gabon, Brezilya, Hindistan, Kazakistan, Gana, Ukrayna ve Malezya'da çıkarılmaktadır. ⓘ
Ferromanganez üretimi için manganez cevheri demir cevheri ve karbon ile karıştırılır ve daha sonra ya yüksek fırında ya da elektrik ark fırınında indirgenir. Elde edilen ferromanganez %30 ila 80 arasında manganez içeriğine sahiptir. Demir içermeyen alaşımların üretimi için kullanılan saf manganez, manganez cevherinin sülfürik asit ile liç edilmesi ve ardından bir elektrowinning işlemi ile üretilir. ⓘ
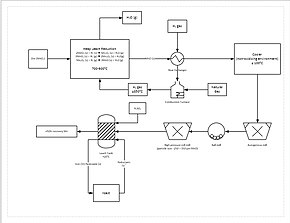
Daha aşamalı bir ekstraksiyon süreci, manganez cevherinin bir yığın liçinde doğrudan indirgenmesini içerir. Bu, doğal gazın yığının altından süzülmesiyle yapılır; doğal gaz ısıyı (en az 850 °C olması gerekir) ve indirgeyici maddeyi (karbon monoksit) sağlar. Bu işlem, manganez cevherinin tamamını manganez okside (MnO) indirger ve bu da liç edilebilir bir formdur. Cevher daha sonra, cevherin parçacık boyutunu 150 ila 250 μm arasına düşürmek için bir öğütme devresinden geçer ve liç işlemine yardımcı olmak için yüzey alanını arttırır. Cevher daha sonra 1,6:1 oranında sülfürik asit ve demir (Fe2+) içeren bir liç tankına eklenir. Demir, manganez dioksit ile reaksiyona girerek demir hidroksit ve elementel manganez oluşturur. Bu işlem manganezin yaklaşık %92 oranında geri kazanılmasını sağlar. Daha fazla saflaştırma için manganez daha sonra bir elektrowinning tesisine gönderilebilir. ⓘ
1972 yılında CIA'in Azorian Projesi, milyarder Howard Hughes aracılığıyla Hughes Glomar Explorer gemisini deniz tabanından manganez yumruları toplamak için görevlendirdi. Bu, aslında pratik olmayan manganez yumrularını toplamak için bir faaliyet telaşını tetikledi. Hughes Glomar Explorer'ın gerçek görevi, Sovyet kod kitaplarını geri almak amacıyla batık bir Sovyet denizaltısı olan K-129'u çıkarmaktı. ⓘ
Okyanus tabanında Mn nodülleri şeklinde bol miktarda manganez kaynağı bulunur. 29'u manganezden oluşan bu nodüller okyanus tabanı boyunca yer almaktadır ve bu nodüllerin madenciliğinin potansiyel etkisi araştırılmaktadır. Bu nodül madenciliğinin deniz tabanını bozması ve tortu bulutlarının oluşmasına neden olması nedeniyle fiziksel, kimyasal ve biyolojik çevresel etkiler meydana gelebilir. Bu süspansiyon metalleri ve inorganik besin maddelerini içerir, bu da çözünmüş toksik bileşiklerden dibe yakın suların kirlenmesine yol açabilir. Mn nodülleri aynı zamanda endo ve epifaunal sistemler için otlak, yaşam alanı ve korumadır. Bu nodüller kaldırıldığında, bu sistemler doğrudan etkilenir. Genel olarak bu durum türlerin bölgeyi terk etmesine ya da tamamen yok olmasına neden olabilir. Madenciliğin başlamasından önce, Birleşmiş Milletler'e bağlı kuruluşlar ve devlet destekli şirketler tarafından çevresel etkileri tam olarak anlamak ve bu etkileri hafifletmek amacıyla araştırmalar yürütülmektedir. ⓘ
Okyanus çevresi
Okyanustaki birçok eser element, hidrotermal bacalardan gelen metal bakımından zengin hidrotermal partiküllerden kaynaklanır. Çözünmüş manganez (dMn) dünya okyanuslarının tamamında bulunur ve bunun %90'ı hidrotermal bacalardan kaynaklanır. Partikül halindeki Mn, aktif bir baca kaynağı üzerinde yüzer halde gelişirken, dMn muhafazakar davranır. Mn konsantrasyonları okyanusun su sütunları arasında değişiklik gösterir. Yüzeyde, dMn nehirler, toz ve şelf çökeltileri gibi dış kaynaklardan gelen girdilere bağlı olarak yükselir. Kıyı sedimanları normalde daha düşük Mn konsantrasyonlarına sahiptir, ancak nehir girdilerinden okyanusa giren madencilik ve çelik üretimi gibi endüstrilerden kaynaklanan antropojenik deşarjlar nedeniyle artabilir. Yüzey dMn konsantrasyonları ayrıca fotosentez yoluyla biyolojik olarak ve kıyıdaki kabarma ve rüzgar kaynaklı yüzey akıntıları nedeniyle fiziksel olarak da yükselebilir. UV radyasyonundan kaynaklanan foto-indirgeme gibi iç döngüler de Mn-oksitlerin çözünmesini hızlandırarak ve oksidatif süpürme ile Mn'nin daha derin sulara batmasını önleyerek seviyeleri yükseltebilir. Orta derinliklerdeki yüksek seviyeler okyanus ortası sırtları ve hidrotermal bacaların yakınında meydana gelebilir. Hidrotermal bacalar dMn ile zenginleştirilmiş sıvıyı suya bırakır. Daha sonra dMn, mevcut mikrobiyal kapsüller nedeniyle 4.000 km'ye kadar seyahat edebilir, parçacıklarla alışverişi önleyerek batma oranlarını düşürür. Oksijen seviyeleri düşük olduğunda çözünmüş Mn konsantrasyonları daha da yüksektir. Genel olarak, dMn konsantrasyonları normalde kıyı bölgelerinde daha yüksektir ve denizden uzaklaştıkça azalır. ⓘ
Topraklar
Manganez toprakta üç oksidasyon durumunda bulunur: iki değerli katyon, Mn2+ ve kahverengimsi-siyah oksitler ve MnOOH ve MnO2 gibi Mn (III,IV) içeren hidroksitler. Toprak pH'ı ve oksidasyon-redüksiyon koşulları, belirli bir toprakta bu üç Mn formundan hangisinin baskın olduğunu etkiler. 6'dan düşük pH değerlerinde veya anaerobik koşullar altında Mn(II) baskınken, daha alkali ve aerobik koşullar altında Mn(III,IV) oksitler ve hidroksitler baskındır. Toprak asitliği ve havalandırma durumunun Mn formu üzerindeki bu etkileri mikrobiyal aktivite ile değiştirilebilir veya kontrol edilebilir. Mikrobiyal solunum hem Mn2+ 'nin oksitlere oksidasyonuna hem de oksitlerin iki değerlikli katyona indirgenmesine neden olabilir. ⓘ
Mn(III,IV) oksitler kum, silt ve kil parçacıkları üzerinde kahverengimsi-siyah lekeler ve küçük nodüller halinde bulunur. Diğer toprak parçacıkları üzerindeki bu yüzey kaplamaları yüksek yüzey alanına sahiptir ve negatif yük taşır. Yüklü bölgeler çeşitli katyonları, özellikle de ağır metalleri (örneğin Cr3+, Cu2+, Zn2+ ve Pb2+) adsorbe edebilir ve tutabilir. Ayrıca oksitler organik asitleri ve diğer bileşikleri de adsorbe edebilir. Metallerin ve organik bileşiklerin adsorpsiyonu daha sonra Mn(III,IV) oksitler Mn2+'ya indirgenirken oksitlenmelerine neden olabilir (örneğin Cr3+'dan Cr(VI)'ya ve renksiz hidrokinondan çay renkli kinon polimerlerine). ⓘ
Uygulamalar
Manganez, metalurjideki ana uygulamalarında memnuin edici bir yerine geçen malzeme yoktur. Küçük uygulamalarda (örneğin, manganez fosfatlama) ise çinko ve bazen de vanadyum uygun ikamelerdir. ⓘ
Çelik

Manganez, sülfür sabitleme, oksijen giderme ve alaşım oluşturma özellikleri sayesinde demir ve çelik üretimi için elzemdir. 1856 yılında İngiliz metalürji uzmanı Robert Forester Mushet (1811-1891) tarafından ilk kez fark edilen manganez, Spiegeleisen formunda, çeliğin işlenebilirliğini arttırmak için fazla çözünmüş oksijen, sülfür ve fosforu gidermek amacıyla çeliğe katılmıştır. Demir üretimi bileşeni de dahil olmak üzere çelik üretimi, şu anda toplam talebin %85 ila %90'ı aralığında olan manganez talebinin çoğunu oluşturmaktadır. Manganez, düşük maliyetli paslanmaz çeliğin önemli bir bileşenidir. Genellikle ferromanganez (genellikle yaklaşık %80 manganez) modern süreçlerde ara üründür. ⓘ
Az miktarda manganez, yüksek erime noktalı bir sülfür oluşturarak ve tane sınırlarında sıvı demir sülfür oluşumunu önleyerek çeliğin yüksek sıcaklıklarda işlenebilirliğini artırır. Manganez içeriği %4'e ulaşırsa, çeliğin gevrekleşmesi baskın bir özellik haline gelir. Gevrekleşme daha yüksek manganez konsantrasyonlarında azalır ve %8'de kabul edilebilir bir seviyeye ulaşır. 8 ila %15 manganez içeren çelik 863 MPa'ya kadar yüksek bir çekme dayanımına sahiptir. 12 manganez içeren çelik 1882 yılında Robert Hadfield tarafından keşfedilmiştir ve halen Hadfield çeliği (mangalloy) olarak bilinmektedir. İngiliz askeri çelik miğferleri için ve daha sonra ABD ordusu tarafından kullanılmıştır. ⓘ
Alüminyum alaşımları
Manganez için ikinci büyük uygulama alüminyum alaşımlarındadır. Kabaca %1.5 manganlı alüminyum, galvanik korozyona yol açabilecek yabancı maddeleri emen tanecikler yoluyla korozyona karşı direnci artırmıştır. Korozyona dayanıklı alüminyum alaşımları 3004 ve 3104 (%0.8 ila 1.5 manganez) çoğu içecek kutuları için kullanılır. 2000'den önce, bu alaşımların 1.6 milyondan ton'undan fazlası kullanıldı; %1 manganezde bu miktar 16,000 ton manganez 'e karşılık gelir. ⓘ
| Element veya periyodik tablo ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |
Diğer kullanım alanları
Metilsiklopentadienil manganez trikarbonil, oktan değerini artırmak ve motor vuruntusunu azaltmak için kurşunsuz benzinde katkı maddesi olarak kullanılır. Bu sıra dışı organometalik bileşikteki manganez +1 oksidasyon durumundadır. ⓘ
Manganez (IV) oksit (manganez dioksit, MnO2) organik kimyada benzilik alkollerin (hidroksil grubunun aromatik bir halkaya bitişik olduğu) oksidasyonu için bir reaktif olarak kullanılır. Manganez dioksit, antik çağlardan beri eser miktardaki demir kirliliğinden kaynaklanan camdaki yeşilimsi rengi oksitlemek ve nötralize etmek için kullanılmaktadır. MnO2 ayrıca oksijen ve klor üretiminde ve siyah boyaların kurutulmasında kullanılır. Bazı preparatlarda, boya için kahverengi bir pigmenttir ve doğal umberin bir bileşenidir. ⓘ
Tetravalent manganez, kırmızı yayan fosforlarda bir aktivatör olarak kullanılır. Lüminesans gösteren birçok bileşik bilinmekle birlikte, çoğunluğu düşük verimlilik veya koyu kırmızı emisyon nedeniyle ticari uygulamalarda kullanılmamaktadır. Bununla birlikte, sıcak beyaz LED'ler için potansiyel kırmızı yayan fosforlar olarak birkaç Mn4+ ile aktive edilmiş florür rapor edilmiştir. Ancak bugüne kadar sadece K2SiF6:Mn4+ sıcak-beyaz LED'lerde kullanılmak üzere ticari olarak mevcuttur. ⓘ
Piller
Manganez (IV) oksit, orijinal kuru hücreli pil tipinde çinkodan elektron alıcısı olarak kullanılmıştır ve karbon-çinko tipi el feneri hücrelerindeki siyahımsı malzemedir. Manganez dioksit, deşarj sırasında manganez oksit-hidroksit MnO(OH)'ye indirgenerek pilin anodunda hidrojen oluşumunu önler. ⓘ
- MnO2 + H2O + e- → MnO(OH) + OH- ⓘ
Aynı malzeme, aynı temel reaksiyonu, ancak farklı bir elektrolit karışımını kullanan yeni alkalin pillerde (genellikle pil hücreleri) de işlev görür. 2002 yılında 230.000 tondan fazla manganez dioksit bu amaçla kullanılmıştır. ⓘ

Dirençler
Manganin gibi manganez bakır alaşımları, nispeten büyük miktarlarda akım ölçmek için kullanılan metal eleman şönt dirençlerinde yaygın olarak bulunur. Bu alaşımlar çok düşük sıcaklık direnç katsayısına sahiptir ve sülfüre karşı dayanıklıdır. Bu da alaşımları özellikle zorlu otomotiv ve endüstriyel ortamlarda kullanışlı hale getirir. ⓘ
Minting
Metal zaman zaman madeni paralarda kullanılır; 2000 yılına kadar manganez kullanılan tek Birleşik Devletler madeni parası 1942'den 1945'e kadar kullanılan "savaş zamanı" nikeliydi. Nikel sikkelerin üretiminde geleneksel olarak %75 bakır ve %25 nikel alaşımı kullanılmaktaydı. Ancak, savaş sırasında nikel metalinin kıtlığı nedeniyle, daha uygun olan gümüş ve manganez ile ikame edilmiş ve böylece %56 bakır, %35 gümüş ve %9 manganezden oluşan bir alaşım elde edilmiştir. 2000 yılından bu yana, örneğin Sacagawea doları ve Başkanlık 1 doları gibi dolar madeni paralar, saf bakır çekirdekli %7 manganez içeren bir pirinçten yapılmaktadır. Her iki nikel ve dolar örneğinde de, madeni parada manganez kullanımı, otomatların mekanizmalarında daha önce aynı boyutta ve değerde olan bir madeni paranın elektromanyetik özelliklerini kopyalamak içindi. Daha sonraki ABD doları madeni paralarında ise manganez alaşımının bir önceki Susan B. Anthony dolarında kullanılan bakır/nikel alaşımının özelliklerini kopyalaması amaçlanmıştır. ⓘ
Seramik renklendirme
Manganez bileşikleri pigment olarak ve seramik ve camın renklendirilmesinde kullanılmıştır. Seramiğin kahverengi rengi bazen manganez bileşiklerinin bir sonucudur. Cam endüstrisinde, manganez bileşikleri iki etki için kullanılır. Manganez(III) demir(II) ile reaksiyona girerek daha az renkli demir(III) ve hafif pembe manganez(II) oluşturarak camdaki güçlü yeşil rengi azaltır ve demir(III)'ün artık rengini telafi eder. Pembe renkli cam üretmek için daha büyük miktarlarda manganez kullanılır. 2009 yılında Oregon Eyalet Üniversitesi'nden Profesör Mas Subramanian ve arkadaşları, manganezin itriyum ve indiyum ile birleştirilerek yoğun mavi, toksik olmayan, inert, solmaya dayanıklı bir pigment olan YInMn mavisi oluşturabileceğini keşfetmişlerdir. 200 yıl içinde keşfedilen ilk yeni mavi pigmenttir. ⓘ
Biyolojik rolü

Biyokimya
Manganez kofaktörlerine sahip enzim sınıfları arasında oksidoredüktazlar, transferazlar, hidrolazlar, liyazlar, izomerazlar ve ligazlar bulunur. Manganez içeren diğer enzimler arginaz ve Mn içeren süperoksit dismutazdır (Mn-SOD). Ayrıca birçok retrovirüsün (HIV gibi lentivirüsler olmasa da) ters transkriptaz enzim sınıfı manganez içerir. Manganez içeren polipeptitler difteri toksini, lektinler ve integrinlerdir. ⓘ
İnsanlardaki biyolojik rolü
Manganez insan beslenmesinde önemli bir elementtir. Makro besin metabolizması, kemik oluşumu ve serbest radikal savunma sistemlerini içeren çeşitli biyolojik süreçlerde koenzim olarak bulunur. Düzinelerce protein ve enzimde kritik bir bileşendir. İnsan vücudu, çoğunlukla kemiklerde olmak üzere yaklaşık 12 mg manganez içerir. Yumuşak doku kalıntısı karaciğer ve böbreklerde yoğunlaşmıştır. İnsan beyninde manganez, özellikle astrositlerdeki glutamin sentetaz olmak üzere manganez metaloproteinlerine bağlıdır. ⓘ
Beslenme
Beslenme önerileri
| Erkekler | Kadın | ||
|---|---|---|---|
| Yaş | AI (mg/gün) | Yaş | AI (mg/gün) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| hamile: 2 | |||
| Emziren: 2,6 | |||
ABD Tıp Enstitüsü (IOM) 2001 yılında mineraller için Tahmini Ortalama Gereksinimleri (EAR'lar) ve Önerilen Diyet Miktarlarını (RDA'lar) güncellemiştir. Manganez için EAR ve RDA'ları belirlemek için yeterli bilgi yoktu, bu nedenle ihtiyaçlar Yeterli Alım (AI) için tahminler olarak tanımlanmıştır. Güvenlik konusunda ise IOM, kanıtlar yeterli olduğunda vitamin ve mineraller için tolere edilebilir üst alım seviyeleri (UL'ler) belirlemektedir. Manganez söz konusu olduğunda yetişkin UL değeri 11 mg/gün olarak belirlenmiştir. EAR'lar, RDA'lar, AI'lar ve UL'ler toplu olarak Diyet Referans Alımları (DRI'ler) olarak adlandırılır. Manganez eksikliği nadir görülür. ⓘ
Avrupa Gıda Güvenliği Otoritesi (EFSA), RDA yerine Popülasyon Referans Alımı (PRI) ve EAR yerine Ortalama Gereksinim kullanarak, toplu bilgi setini Diyet Referans Değerleri olarak adlandırmaktadır. AI ve UL, Amerika Birleşik Devletleri'ndeki ile aynı şekilde tanımlanmıştır. 15 yaş ve üzeri kişiler için AI 3.0 mg/gün olarak belirlenmiştir. Hamilelik ve emzirme dönemi için AI 3.0 mg/gündür. 1-14 yaş arası çocuklar için AI'ler yaşla birlikte 0,5 ila 2,0 mg/gün arasında artar. Yetişkin Aİ'leri ABD RDA'larından daha yüksektir. EFSA aynı güvenlik sorusunu incelemiş ve bir UL belirlemek için yeterli bilgi olmadığına karar vermiştir. ⓘ
ABD gıda ve besin takviyesi etiketleme amaçları için bir porsiyondaki miktar Günlük Değerin yüzdesi (%DV) olarak ifade edilir. Manganez etiketleme amaçları için Günlük Değerin %100'ü 2.0 mg idi, ancak 27 Mayıs 2016 itibariyle RDA ile uyumlu hale getirmek için 2.3 mg olarak revize edildi. Eski ve yeni yetişkin günlük değerlerinin bir tablosu Referans Günlük Alım adresinde verilmiştir. ⓘ
Toksisite
Aşırı maruz kalma veya alım, dopaminerjik nöronal ölüme ve Parkinson hastalığına benzer semptomlara neden olan nörodejeneratif bir bozukluk olan manganizm olarak bilinen bir duruma yol açabilir. ⓘ
Eksiklik
İnsanlarda manganez eksikliği bir dizi tıbbi soruna yol açmaktadır. Birçok yaygın vitamin ve mineral takviyesi ürününün bileşiminde manganez bulunmamaktadır. Demir, magnezyum ve kalsiyum gibi diğer minerallerin diyetle nispeten yüksek oranda alınması, manganezin uygun şekilde alınmasını engelleyebilir. Manganez eksikliği hayvanlarda iskelet deformasyonuna neden olur ve yara iyileşmesinde kolajen üretimini engeller. ⓘ
Deniz yaşamında toksisite
Birçok enzimatik sistem çalışmak için Mn'ye ihtiyaç duyar, ancak yüksek seviyelerde Mn toksik hale gelebilir. Deniz suyunda Mn seviyelerinin artmasının çevresel nedenlerinden biri hipoksik dönemlerin meydana gelmesidir. 1990 yılından bu yana balıklar, kabuklular, yumuşakçalar ve ekinodermler dahil olmak üzere deniz organizmalarında Mn birikimine dair raporlar bulunmaktadır. Solungaçlar, beyin, kan, böbrek ve karaciğer/hepatopankreas dahil olmak üzere farklı türlerde belirli dokular hedeftir. Bu türlerde fizyolojik etkiler rapor edilmiştir. Mn, immünositlerin yenilenmesini ve fagositoz ve pro-fenoloksidaz aktivasyonu gibi işlevlerini etkileyerek organizmaların bağışıklık sistemlerini baskılayabilir. Bu da organizmaların enfeksiyonlara karşı daha duyarlı olmasına neden olur. İklim değişikliği meydana geldikçe, patojen dağılımları artar ve organizmaların hayatta kalabilmeleri ve kendilerini bu patojenlere karşı savunabilmeleri için sağlıklı, güçlü bir bağışıklık sistemine ihtiyaçları vardır. Yüksek Mn seviyeleri nedeniyle sistemleri tehlikeye girerse, bu patojenlerle savaşamayacak ve öleceklerdir. ⓘ
Bakterilerdeki biyolojik rolü
Mn-SOD, ökaryotik mitokondrilerde ve ayrıca çoğu bakteride bulunan SOD türüdür (bu gerçek, mitokondrinin bakteriyel kökenli teorisiyle uyumludur). Mn-SOD enzimi muhtemelen en eski enzimlerden biridir, çünkü oksijen varlığında yaşayan neredeyse tüm organizmalar süperoksitin toksik etkileriyle başa çıkmak için onu kullanır (O-
2), dioksijenin 1 elektronlu indirgenmesinden oluşur. Tümü bakteri olan istisnalar arasında Lactobacillus plantarum ve polifosfat ile kompleks oluşturmuş manganez (Mn2+) iyonları ile enzimatik olmayan farklı bir mekanizma kullanan ve aerobik yaşamda bu işlev için bir evrim yolu öneren ilgili laktobasiller yer alır. ⓘ
Bitkilerdeki biyolojik rolü
Manganez, bitkilerdeki kloroplastlarda fotosentetik oksijen evriminde de önemlidir. Oksijen geliştirici kompleks (OEC), kloroplastların tilakoid membranlarında bulunan fotosistem II'nin bir parçasıdır; fotosentezin ışık reaksiyonları sırasında suyun terminal fotooksidasyonundan sorumludur ve dört manganez atomu içeren bir metaloenzim çekirdeğine sahiptir. Bu gereksinimi karşılamak için, çoğu geniş spektrumlu bitki gübresi manganez içerir. ⓘ
Önlemler
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Tehlike beyanları
|
H401 |
Önlem ifadeleri
|
P273, P501 |
| NFPA 704 (yangın elması) | |
Manganez bileşikleri nikel ve bakır gibi diğer yaygın metallere göre daha az toksiktir. Bununla birlikte, toksisite seviyesi nedeniyle manganez tozlarına ve dumanlarına maruz kalma, kısa süreler için bile 5 mg/m3 tavan değerini aşmamalıdır. Manganez zehirlenmesi motor becerilerde bozulma ve bilişsel bozukluklarla ilişkilendirilmiştir. ⓘ
Permanganat, manganez(II) bileşiklerinden daha yüksek bir toksisite sergiler. Ölümcül doz yaklaşık 10 g'dır ve birkaç ölümcül zehirlenme meydana gelmiştir. Güçlü oksidatif etki mukoza zarının nekrozuna yol açar. Örneğin, permanganat yutulursa yemek borusu etkilenir. Bağırsaklar tarafından sadece sınırlı bir miktar emilir, ancak bu küçük miktar böbrekler ve karaciğer üzerinde ciddi etkiler gösterir. ⓘ
Amerika Birleşik Devletleri'nde manganez maruziyeti Mesleki Güvenlik ve Sağlık İdaresi (OSHA) tarafından düzenlenmektedir. İnsanlar işyerinde soluyarak ya da yutarak manganeze maruz kalabilirler. OSHA, işyerinde manganez maruziyeti için yasal sınırı (izin verilen maruziyet sınırı) 8 saatlik bir iş günü boyunca 5 mg/m3 olarak belirlemiştir. Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH), 8 saatlik bir iş gününde 1 mg/m3 tavsiye edilen maruz kalma sınırı (REL) ve 3 mg/m3 kısa vadeli bir sınır belirlemiştir. 500 mg/m3 seviyelerinde, manganez yaşam ve sağlık için hemen tehlikelidir. ⓘ
Genel olarak, 5 μg Mn/m3'ü aşan ortam Mn hava konsantrasyonlarına maruz kalmak Mn kaynaklı semptomlara yol açabilir. İnsan embriyonik böbrek (HEK293) hücrelerinde artan ferroportin protein ifadesi, Mn ile azaltılmış glutamat alımının tersine çevrilmesi ve laktat dehidrojenaz sızıntısının azalması ile karakterize edilen azalmış hücre içi Mn konsantrasyonu ve zayıflatılmış sitotoksisite ile ilişkilidir. ⓘ
Çevresel sağlık endişeleri
İçme suyunda
Suyla taşınan manganez, diyetle alınan manganeze kıyasla daha yüksek biyoyararlanıma sahiptir. 2010'da yapılan bir çalışmanın sonuçlarına göre, içme suyunda yüksek düzeyde manganeze maruz kalma, okul çağındaki çocuklarda artan zihinsel bozukluk ve azalan zeka bölümleri ile ilişkilidir. Duş suyunda doğal olarak oluşan manganezin solunması nedeniyle uzun süreli maruziyetin 8,7 milyon Amerikalıyı risk altına soktuğu varsayılmaktadır. Ancak veriler, maruziyetin durdurulması ve vücudun fazlalığı temizleyebilmesi halinde insan vücudunun manganeze aşırı maruz kalmanın bazı olumsuz etkilerinden kurtulabileceğini göstermektedir. ⓘ
Benzin içinde

Metilsiklopentadienil manganez trikarbonil (MMT), düşük oktanlı petrol distilatlarının oktan derecesini iyileştirmek için kurşunsuz benzinler için kurşun bileşiklerinin yerine kullanılan bir benzin katkısıdır. Karbonil gruplarının etkisiyle motor vuruntusunu azaltır. Manganez içeren yakıtlar, egzoz valflerine zarar veren manganez karbürler oluşturma eğilimindedir. 1953 yılına kıyasla havadaki manganez seviyeleri düşmüştür. ⓘ
Tütün dumanında
Tütün bitkisi, çevresindeki topraktan manganez gibi ağır metalleri kolayca emer ve yapraklarında biriktirir. Bunlar daha sonra tütün içimi sırasında solunur. Manganez tütün dumanının bir bileşeni olsa da, çalışmalar büyük ölçüde konsantrasyonların insan sağlığı için tehlikeli olmadığı sonucuna varmıştır. ⓘ
Nörolojik bozukluklardaki rolü
Manganizm
Manganez aşırı maruziyeti en sık olarak, aşırı manganez yutulması veya solunması ile ilişkili nadir bir nörolojik bozukluk olan manganizm ile ilişkilidir. Tarihsel olarak, manganez alaşımlarının üretiminde veya işlenmesinde çalışan kişiler manganizm geliştirme riski altında olmuştur; ancak mevcut sağlık ve güvenlik düzenlemeleri gelişmiş ülkelerdeki işçileri korumaktadır. Hastalık ilk olarak 1837 yılında İngiliz akademisyen John Couper tarafından tanımlanmış ve manganez hastası olan iki hasta üzerinde çalışılmıştır. ⓘ
Manganizm bifazik bir hastalıktır. Erken evrelerinde, sarhoş bir kişi depresyon, ruh hali değişimleri, kompulsif davranışlar ve psikoz yaşayabilir. Erken nörolojik semptomlar yerini Parkinson hastalığına benzeyen geç evre manganizme bırakır. Belirtiler arasında güçsüzlük, monoton ve yavaş konuşma, ifadesiz bir yüz, titreme, öne eğik yürüyüş, düşmeden geriye doğru yürüyememe, katılık ve el becerisi, yürüyüş ve denge ile ilgili genel sorunlar yer alır. Parkinson hastalığının aksine, manganizm koku alma duyusunun kaybıyla ilişkili değildir ve hastalar tipik olarak L-DOPA ile tedaviye yanıt vermezler. Geç evre manganizm semptomları, maruziyet kaynağı ortadan kaldırılsa ve beyin manganez seviyeleri normale dönse bile zamanla daha şiddetli hale gelir. ⓘ
Kronik manganez maruziyetinin hareket anormallikleriyle karakterize parkinsonizm benzeri bir hastalığa yol açtığı gösterilmiştir. Bu durum, PH tedavisinde kullanılan tipik tedavilere yanıt vermemekte ve substantia nigra içindeki tipik dopaminerjik kayıptan alternatif bir yol olduğunu düşündürmektedir. Manganez bazal gangliyonlarda birikerek anormal hareketlere yol açabilir. Hücre içi Mn'nin azaltılması için gerekli bir manganez çıkış taşıyıcısı olan SLC30A10 geninin mutasyonu, bu Parkinsonizm benzeri hastalığın gelişimi ile ilişkilendirilmiştir. PH için tipik olan Lewy cisimcikleri Mn ile indüklenen parkinsonizmde görülmez. ⓘ
Hayvan deneyleri, kontrollü koşullar altında aşırı manganez maruziyetinin sonuçlarını inceleme fırsatı vermiştir. (Agresif olmayan) sıçanlarda, manganez fare öldürme davranışına neden olur. ⓘ
Çocukluk çağı gelişim bozuklukları
Yakın zamanda yapılan birkaç çalışma, kronik düşük doz manganez aşırı maruziyetinin çocuk gelişimi üzerindeki etkilerini incelemeye çalışmıştır. En eski çalışma Çin'in Shanxi eyaletinde gerçekleştirilmiştir. Buradaki içme suyu uygunsuz kanalizasyon sulaması nedeniyle kirlenmişti ve 240-350 μg Mn/L içeriyordu. Çalışma sırasında 300 μg Mn/L veya altındaki Mn konsantrasyonları ABD EPA ve 400 μg Mn/L Dünya Sağlık Örgütü tarafından güvenli kabul edilmesine rağmen, bu eyaletten örneklenen 92 çocuk (11 ila 13 yaş arası), kirlenmemiş bir bölgedeki çocuklara kıyasla el becerisi ve hızlılık, kısa süreli hafıza ve görsel tanımlama testlerinde daha düşük performans göstermiştir. Daha yakın zamanda, Bangladeş'te 10 yaşındaki çocuklar üzerinde yapılan bir çalışma, kuyu suyundaki Mn konsantrasyonu ile IQ puanlarındaki düşüş arasında bir ilişki olduğunu göstermiştir. Quebec'te yapılan üçüncü bir çalışmada, 610 μg Mn/L içeren bir kuyudan su alan evlerde yaşayan 6 ila 15 yaş arasındaki okul çocukları incelenmiştir; kontroller 160 μg Mn/L'lik bir kuyudan su alan evlerde yaşamaktadır. Deney grubundaki çocuklar hiperaktif ve muhalif davranışlarda artış göstermiştir. ⓘ
EPA kuralları uyarınca mevcut maksimum güvenli konsantrasyon 50 μg Mn/L'dir. ⓘ
Nörodejeneratif hastalıklar
DMT1 adı verilen bir protein, bağırsaktan manganez emiliminde ana taşıyıcıdır ve kan-beyin bariyeri boyunca manganezin ana taşıyıcısı olabilir. DMT1 ayrıca solunan manganezi burun epiteli boyunca da taşır. Manganez toksisitesi için önerilen mekanizma, düzensizliğin oksidatif stres, mitokondriyal disfonksiyon, glutamat aracılı eksitotoksisite ve proteinlerin agregasyonuna yol açmasıdır. ⓘ
Vücut metabolizması üzerine etkileri
Vücutta protein sentezlenmesinde, sindirimde ve besinlerden enerji üretilmesinde görev alan önemli minerallerin içinde bulunan etkili bir elementtir. Eksikliğinde sürekli yorgunluk, hafıza problemleri, kısırlık, kilo kaybı, özellikle çocuklarda ve bebeklerde büyüme geriliği gibi belirtiler görülür. Mangan bitkiler için de çok önemli bir elementtir ve günümüz modern tarım sektöründe vazgeçilmez bir gübre içeriğidir. ⓘ








