Flor
 Sıvı flor (son derece düşük sıcaklıklarda) | ||||||||||||||||||
| Flor | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Telaffuz |
| |||||||||||||||||
| Allotroplar | alfa, beta (bkz. Flor Allotropları) | |||||||||||||||||
| Görünüş | gaz: çok soluk sarı sıvı: parlak sarı katı: alfa opak, beta saydamdır | |||||||||||||||||
| Standart atom ağırlığı Ar°(F) |
| |||||||||||||||||
| Periyodik tabloda flor | ||||||||||||||||||
| ||||||||||||||||||
| Atom numarası (Z) | 9 | |||||||||||||||||
| Grup | grup 17 (halojenler) | |||||||||||||||||
| Dönem | dönem 2 | |||||||||||||||||
| Blok | p-blok | |||||||||||||||||
| Elektron konfigürasyonu | [[[Helyum|He]]] 2s2 2p5 | |||||||||||||||||
| Kabuk başına elektron | 2, 7 | |||||||||||||||||
| Fiziksel özellikler | ||||||||||||||||||
| STP'de Faz | gaz | |||||||||||||||||
| Erime noktası | (F2) 53,48 K (-219,67 °C, -363,41 °F) | |||||||||||||||||
| Kaynama noktası | (F2) 85,03 K (-188,11 °C, -306,60 °F) | |||||||||||||||||
| Yoğunluk (STP'de) | 1.696 g/L | |||||||||||||||||
| sıvı olduğunda (b.p.'de) | 1.505 g/cm3 | |||||||||||||||||
| Üçlü nokta | 53,48 K, 90 kPa | |||||||||||||||||
| Kritik nokta | 144,41 K, 5,1724 MPa | |||||||||||||||||
| Buharlaşma ısısı | 6,51 kJ/mol | |||||||||||||||||
| Molar ısı kapasitesi | Cp: 31 J/(mol-K) (21,1 °C'de) Cv: 23 J/(mol-K) (21,1 °C'de) | |||||||||||||||||
Buhar basıncı
| ||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||
| Oksidasyon durumları | -1, 0 (oksijeni okside eder) | |||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 3.98 | |||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||
| Kovalent yarıçap | 64 pm | |||||||||||||||||
| Van der Waals yarıçapı | 135 pm | |||||||||||||||||
| Florun spektral çizgileri | ||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||
| Doğal oluşum | ilkel | |||||||||||||||||
| Kristal yapı | kübik | |||||||||||||||||
| Termal iletkenlik | 0,02591 W/(m⋅K) | |||||||||||||||||
| Manyetik sıralama | diamanyetik (-1,2×10-4) | |||||||||||||||||
| CAS Numarası | 7782-41-4 | |||||||||||||||||
| Tarih | ||||||||||||||||||
| İsimlendirme | adını Latince fluo (eritme işleminde akmak) kelimesinden alan florit mineralinden almıştır | |||||||||||||||||
| Keşif | André-Marie Ampère (1810) | |||||||||||||||||
| İlk izolasyon | Henri Moissan (26 Haziran 1886) | |||||||||||||||||
| İsimlendiren |
| |||||||||||||||||
| Florun ana izotopları | ||||||||||||||||||
| ||||||||||||||||||
Flor, sembolü F ve atom numarası 9 olan kimyasal bir elementtir. En hafif halojendir ve standart koşullarda oldukça zehirli, soluk sarı renkli diyatomik bir gaz olarak bulunur. En elektronegatif element olarak, argon, neon ve helyum hariç diğer tüm elementlerle reaksiyona girdiği için son derece reaktiftir. ⓘ
Elementler arasında flor, evrensel bollukta 24. sırada, karasal bollukta ise 13. sırada yer alır. Elemente adını veren florun birincil mineral kaynağı olan florit ilk olarak 1529 yılında tanımlanmıştır; eritme için erime noktalarını düşürmek amacıyla metal cevherlerine eklendiğinden, Latince 'akmak' anlamına gelen fluo fiili minerale adını vermiştir. 1810'da element olarak önerilen florun bileşiklerinden ayrıştırılmasının zor ve tehlikeli olduğu kanıtlanmış ve ilk deneycilerin birçoğu bu girişimleri nedeniyle ölmüş ya da yaralanmıştır. Ancak 1886'da Fransız kimyager Henri Moissan, modern üretim için hala kullanılan bir işlem olan düşük sıcaklıkta elektroliz kullanarak elementel florini izole etti. En büyük uygulaması olan uranyum zenginleştirme için flor gazının endüstriyel üretimi, İkinci Dünya Savaşı'ndaki Manhattan Projesi sırasında başladı. ⓘ
Saf florun rafine edilmesinin masraflı olması nedeniyle, çoğu ticari uygulamada flor bileşikleri kullanılmakta ve çıkarılan floritin yaklaşık yarısı çelik yapımında kullanılmaktadır. Floritin geri kalanı, çeşitli organik florürlere giden yolda aşındırıcı hidrojen florüre veya alüminyum rafinasyonunda önemli bir rol oynayan kriyolite dönüştürülür. Karbon-flor bağı içeren moleküller genellikle çok yüksek kimyasal ve termal kararlılığa sahiptir; başlıca kullanım alanları soğutucu akışkanlar, elektrik yalıtımı ve pişirme kapları ve PTFE'dir (Teflon). Atorvastatin ve fluoksetin gibi farmasötikler C-F bağları içerir. Çözünmüş florür tuzlarından gelen florür iyonu diş çürüklerini engeller ve bu nedenle diş macunu ve su floridasyonunda kullanım alanı bulur. Küresel florokimyasal satışları yılda 69 milyar ABD dolarından fazladır. ⓘ
Florokarbon gazları genellikle karbondioksitin 100 ila 23.500 katı küresel ısınma potansiyeline sahip sera gazlarıdır ve SF6 bilinen tüm maddeler arasında en yüksek küresel ısınma potansiyeline sahiptir. Organoflorin bileşikleri, karbon-florin bağının gücü nedeniyle genellikle çevrede kalıcıdır. Florun memelilerde bilinen bir metabolik rolü yoktur; birkaç bitki ve deniz süngeri, avlanmayı caydırmaya yardımcı olan organoflorin zehirleri (çoğunlukla monofloroasetatlar) sentezler. ⓘ
|
Flor (F) ⓘ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temel özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atom numarası | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element serisi | Halojenler | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, periyot, blok | 17, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüş | Sarımsı gaz 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kütle numarası | 18,9984 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron dizilimi | 1s2 2s2 2p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enerji seviyesi başına Elektronlar |
2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS kayıt numarası | 7782-41-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel Özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Maddenin hâli | Gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yoğunluk | (0 °C, 101.325 kPa)
1.696 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sıvı hâldeki yoğunluğu | ? g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ergime noktası | 53,53 °K -219,62 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 85,03 °K -188,12 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ergime ısısı | {{{Ergime_ısısı}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | 6,62 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isı kapasitesi | 31,304 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal yapısı | Kübik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yükseltgenme seviyeleri | -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatifliği | 3,98 Pauling ölçeği | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjisi | 1. İ.E.: 1681,0 2. İ.E.: 3374,2 3. İ.E.: 6050,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı | 50 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı (hes.) | 42 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 71 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 147 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrik direnci | ? nΩ·m (20°C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isıl iletkenlik | 27,7 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isıl genleşme | ? µm/(m·K) (25°C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ses hızı | ? m/s (?'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers sertliği | ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell sertliği | ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Flor (Fransızca: fluor), atom numarası 9, atom ağırlığı 19, yoğunluğu 1,265 olan, kokusu ozonu andıran, kahverengimsi sarı renkte, halojenler grubunun ilk elementidir (simgesi F). 1529 yılında Georigius Agricola, kalsiyum florür bileşiğini tanımlamıştır. İlk defa 1886 yılında Henri Moissan tarafından izole edilmiştir. ⓘ
Özellikleri

En önemli minerali fluorit veya florspati denilen CaF2 dir. Florun saf olarak eldesi (1:2) oranında sıcak erimiş KF, HF bileşiklerinin elektrolizi ile gerçekleşir. ⓘ
Flor en reaktif element olup argon, neon ve helyum hariç tüm elementlerle tepkimeye girer. Fazla reaktif olmasının nedeni F-F bağının kolay kopması yani dissiyasyon enerjisinin az olmasıdır. Sadece (-1) oksidasyon sayısına sahiptir, yani tek bağ yapabilir. Fakat ortaklanmamış elektronları sayesinde metallerle –F şeklinde köprülü bileşikler yapabilir. Bir içme suyunda 1 ppm'den fazla flor olursa dişlerde sarı plaklar olur. Ayrıca Flor asal gazlardan Ksenonla bile tepkimeye girmiştir. Diş macunları ve deodorantların yapısında bulunur. ⓘ
Halojenler arasında en az polarize olabilen elementtir. ⓘ
Periyodik sıralamada bulunmaktadır. ⓘ
Pek çok kimyasalın yapısında bulunur ⓘ
Elektron konfigürasyonu
Flor atomları neondan bir eksik olmak üzere dokuz elektrona ve 1s22s22p5 elektron konfigürasyonuna sahiptir: dolu bir iç kabukta iki elektron ve bir tane daha doldurulması gereken bir dış kabukta yedi elektron. Dış elektronlar nükleer kalkanlamada etkisizdir ve 9 - 2 = 7 gibi yüksek bir etkin nükleer yüke sahiptir; bu da atomun fiziksel özelliklerini etkiler. ⓘ
Florun ilk iyonlaşma enerjisi tüm elementler arasında helyum ve neondan sonra üçüncü en yüksek enerjidir, bu da nötr flor atomlarından elektronların uzaklaştırılmasını zorlaştırır. Ayrıca klordan sonra ikinci sırada yüksek bir elektron ilgisine sahiptir ve soy gaz neon ile izoelektronik olmak için bir elektron yakalama eğilimindedir; herhangi bir elementin en yüksek elektronegatifliğine sahiptir. Flor atomları, dönem komşuları oksijen ve neonunkine benzer şekilde yaklaşık 60 pikometrelik küçük bir kovalent yarıçapa sahiptir. ⓘ
Reaktivite
| Harici video ⓘ | |
|---|---|

Difluorinin bağ enerjisi Cl'un bağ enerjisinden çok daha düşüktür.
2 veya Br
2 ve kolayca bölünen peroksit bağına benzer; bu, yüksek elektronegatiflik ile birlikte florun kolay ayrışmasını, yüksek reaktivitesini ve flor olmayan atomlara güçlü bağlarını açıklar. Tersine, florun yüksek elektronegatifliği nedeniyle diğer atomlara olan bağları çok güçlüdür. Toz çelik, cam parçaları ve asbest lifleri gibi reaktif olmayan maddeler soğuk flor gazı ile hızlı bir şekilde reaksiyona girer; ahşap ve su flor jeti altında kendiliğinden yanar. ⓘ
Elementel florun metallerle reaksiyonları farklı koşullar gerektirir. Alkali metaller patlamalara neden olur ve toprak alkali metaller yığın halinde güçlü aktivite gösterir; metal florür tabakalarının oluşumundan kaynaklanan pasivasyonu önlemek için alüminyum ve demir gibi diğer metallerin çoğu toz haline getirilmelidir ve soy metaller 300-450 °C'de (575-850 °F) saf flor gazı gerektirir. Bazı katı ametaller (sülfür, fosfor) sıvı flor içinde şiddetli reaksiyona girer. Hidrojen sülfür ve sülfür dioksit flor ile kolayca birleşir, ikincisi bazen patlayıcıdır; sülfürik asit çok daha az aktivite gösterir ve yüksek sıcaklıklar gerektirir. ⓘ
Hidrojen, bazı alkali metaller gibi, flor ile patlayıcı reaksiyona girer. Karbon, lamba siyahı gibi, oda sıcaklığında reaksiyona girerek florometan verir. Grafit, 400 °C'nin (750 °F) üzerinde flor ile birleşerek stokiyometrik olmayan karbon monoflorür üretir; daha yüksek sıcaklıklar, bazen patlamalarla gaz halinde florokarbonlar üretir. Karbon dioksit ve karbon monoksit oda sıcaklığında veya hemen üzerinde reaksiyona girerken, parafinler ve diğer organik kimyasallar güçlü reaksiyonlar oluşturur: normalde yanmayan karbon tetraklorür gibi tamamen ikame edilmiş haloalkanlar bile patlayabilir. Azot triflorür kararlı olmasına rağmen, elementel azottaki çok güçlü üçlü bağ nedeniyle azotun flor ile reaksiyona girmesi için yüksek sıcaklıklarda elektrik deşarjı gerekir; amonyak patlayıcı reaksiyona girebilir. Oksijen ortam koşullarında flor ile birleşmez, ancak düşük sıcaklık ve basınçlarda elektrik deşarjı kullanılarak reaksiyona girmesi sağlanabilir; ürünler ısıtıldığında kendilerini oluşturan elementlere ayrılma eğilimindedir. Daha ağır halojenler, asal gaz radon gibi flor ile kolayca reaksiyona girer; diğer asal gazlardan sadece ksenon ve kripton reaksiyona girer ve bu da sadece özel koşullar altında gerçekleşir. ⓘ
Fazlar

2 molekül herhangi bir açı alabilir. Diğer moleküller düzlemlerle sınırlandırılmıştır. ⓘ

Oda sıcaklığında flor, iki atomlu moleküllerden oluşan bir gazdır, saf olduğunda soluk sarıdır (bazen sarı-yeşil olarak tanımlanır). Karakteristik halojen benzeri keskin ve ısırıcı bir kokusu vardır ve 20 ppb'de tespit edilebilir. Flor, oksijen ve nitrojeninkine benzer bir geçiş sıcaklığı olan -188 °C'de (-306 °F) parlak sarı bir sıvıya dönüşür. ⓘ
Florun α- ve β-flor olmak üzere iki katı formu vardır. İkincisi -220 °C'de (-364 °F) kristalleşir ve diğer katı halojenlerin ortorombik sistemlerinden farklı olarak taze kristalleşmiş katı oksijenle aynı düzensiz kübik yapıya sahip şeffaf ve yumuşaktır. 228 °C'ye (-378 °F) daha fazla soğutma, yoğun, açılı molekül katmanlarına sahip monoklinik bir yapıya sahip opak ve sert α-florine bir faz geçişine neden olur. β-'dan α-florine geçiş, florin yoğunlaşmasından daha ekzotermiktir ve şiddetli olabilir. ⓘ
İzotoplar
Florun sadece bir izotopu doğal olarak bol miktarda bulunur, kararlı izotop 19
F. Yüksek bir manyetojik orana ve manyetik alanlara karşı olağanüstü bir duyarlılığa sahiptir; aynı zamanda tek kararlı izotop olduğu için manyetik rezonans görüntülemede kullanılır. Kütle numaraları 13 ila 31 arasında değişen on sekiz radyoizotop sentezlenmiştir ve bunlardan 18'i
F, 109,77 dakikalık yarı ömrü ile en kararlı olanıdır. Diğer radyoizotopların yarı ömürleri 70 saniyeden daha azdır; çoğu yarım saniyeden daha kısa sürede bozunur. İzotoplar 17
F ve 18
F β+ bozunmasına ve elektron yakalamaya uğrar, daha hafif izotoplar proton emisyonu ile bozunur ve 19'dan ağır olanlar
F, β- bozunmasına uğrar (gecikmeli nötron emisyonuna sahip en ağır olanlar). Florun iki metastabil izomeri bilinmektedir, 18m
F, yarı ömrü 162(7) nanosaniye ve 26m
F, yarı ömrü 2,2(1) milisaniyedir. ⓘ
Oluşum
Evren
| Atomik numara |
Element | Göreceli miktar ⓘ |
|---|---|---|
| 6 | Karbon | 4,800 |
| 7 | Azot | 1,500 |
| 8 | Oksijen | 8,800 |
| 9 | Flor | 1 |
| 10 | Neon | 1,400 |
| 11 | Sodyum | 24 |
| 12 | Magnezyum | 430 |
Hafif elementler arasında florun 400 ppb'lik (milyarda bir parça) bolluk değeri - evrendeki elementler arasında 24. sırada - son derece düşüktür: karbondan magnezyuma kadar diğer elementler yirmi veya daha fazla kat daha yaygındır. Bunun nedeni, yıldız nükleosentez süreçlerinin florini atlaması ve aksi takdirde oluşan herhangi bir flor atomunun yüksek nükleer çapraz kesitlere sahip olması ve hidrojen veya helyum ile çarpışmaların sırasıyla oksijen veya neon üretmesine izin vermesidir. ⓘ
Bu geçici varlığın ötesinde, florin varlığı için üç açıklama önerilmiştir:
- Tip II süpernovalar sırasında neon atomlarının nötrinolar tarafından bombardıman edilmesi onları florine dönüştürebilir;
- Wolf-Rayet yıldızlarının güneş rüzgarı florini herhangi bir hidrojen veya helyum atomundan uzaklaştırabilir; veya
- florin, asimptotik dev dal yıldızlarındaki füzyondan kaynaklanan konveksiyon akımları üzerinde ortaya çıkmıştır. ⓘ
Dünya
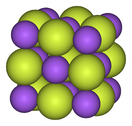
Flor, yerkabuğunda kütlece 600-700 ppm (milyonda bir parça) ile en yaygın on üçüncü elementtir. Doğal olarak oluşmadığına inanılmakla birlikte, elementel florun, floritin bir çeşidi olan antozonitte bir oklüzyon olarak mevcut olduğu gösterilmiştir. Florun çoğu florür içeren mineraller olarak bulunur. Florit, florapatit ve kriyolit endüstriyel açıdan en önemli olanlarıdır. Florit (CaF
2), aynı zamanda fluorspar olarak da bilinir ve dünya çapında bol miktarda bulunur, florürün ve dolayısıyla florun ana kaynağıdır. Çin ve Meksika başlıca tedarikçilerdir. Dünyadaki florürün çoğunu içeren florapatit (Ca5(PO4)3F), gübre üretiminin bir yan ürünü olarak istemeden de olsa florür kaynağıdır. Kriyolit (Na
3AlF
6), alüminyum üretiminde kullanılan, flor bakımından en zengin mineraldir. Ekonomik olarak uygulanabilir doğal kriyolit kaynakları tükenmiştir ve çoğu artık ticari olarak sentezlenmektedir. ⓘ
Kriyolit: İki katman halinde düzenlenmiş diyatomik moleküllere sahip paralelkenar şekilli bir taslak ⓘ
Topaz gibi diğer mineraller flor içerir. Florürler, diğer halojenürlerin aksine, çözünmezler ve tuzlu sularda ticari olarak uygun konsantrasyonlarda bulunmazlar. Volkanik patlamalarda ve jeotermal kaynaklarda kaynağı belirsiz eser miktarda organoflorin tespit edilmiştir. Ezilmiş antozonitin kokusuyla öne sürülen kristallerde gaz halindeki florun varlığı tartışmalıdır; 2012 yılında yapılan bir çalışmada %0,04 F
2 oranında uranyum içerdiğini tespit etmiş ve bu kalıntıları az miktarda uranyumun varlığından kaynaklanan radyasyona bağlamıştır. ⓘ
Tarih
İlk keşifler

1529 yılında Georgius Agricola, floriti eritme sırasında metallerin erime noktasını düşürmek için kullanılan bir katkı maddesi olarak tanımlamıştır. Florit kayaları için Latince fluorēs (fluor, akış) kelimesini kaleme aldı. Bu isim daha sonra fluorspar (halen yaygın olarak kullanılmaktadır) ve ardından fluorite dönüşmüştür. Floritin bileşiminin daha sonra kalsiyum diflorür olduğu belirlenmiştir. ⓘ
Hidroflorik asit 1720'den itibaren cam aşındırmada kullanılmıştır. Andreas Sigismund Marggraf ilk olarak 1764 yılında floriti sülfürik asitle ısıttığında ve ortaya çıkan çözelti cam kabını aşındırdığında bunu karakterize etmiştir. İsveçli kimyager Carl Wilhelm Scheele 1771 yılında deneyi tekrarlamış ve asidik ürüne fluss-spats-syran (fluorspar asidi) adını vermiştir. 1810 yılında Fransız fizikçi André-Marie Ampère, hidrojen ve klora benzer bir elementin hidroflorik asidi oluşturduğunu öne sürdü. Ayrıca Sir Humphry Davy'ye yazdığı 26 Ağustos 1812 tarihli bir mektupta, o zamanlar bilinmeyen bu maddenin florik asitten ve diğer halojenlerin -ine ekinden flor olarak adlandırılabileceğini öne sürmüştür. Bu kelime çoğu Avrupa dilinde, genellikle değişikliklerle birlikte kullanılır; ancak Yunanca, Rusça ve Ampère'in daha sonraki önerisini takip eden diğer bazı diller Yunanca φθόριος (phthorios, yıkıcı) kelimesinden gelen ftor veya türevlerini kullanır. Yeni Latince adı fluorum elemente şimdiki sembolü F'yi verdi; ilk makalelerde Fl kullanıldı. ⓘ
İzolasyon

Flor üzerine yapılan ilk çalışmalar o kadar tehlikeliydi ki, 19. yüzyıldaki birkaç deneyci hidroflorik asitle yaşadıkları talihsizliklerden sonra "flor şehitleri" olarak anıldı. Elementel florun izolasyonu, hem elementel florun kendisinin hem de hidrojen florürün aşırı aşındırıcılığının yanı sıra basit ve uygun bir elektrolitin bulunmaması nedeniyle engellenmiştir. Edmond Frémy, flor üretmek için saf hidrojen florürün elektrolizinin mümkün olduğunu varsaydı ve asitlendirilmiş potasyum biflorürden susuz örnekler üretmek için bir yöntem tasarladı; bunun yerine, elde edilen (kuru) hidrojen florürün elektriği iletmediğini keşfetti. Frémy'nin eski öğrencisi Henri Moissan sebat etti ve birçok deneme ve yanılmadan sonra potasyum biflorür ve kuru hidrojen florür karışımının iletken olduğunu ve elektrolizi mümkün kıldığını buldu. Elektrokimyasal hücrelerindeki platinin hızla korozyona uğramasını önlemek için, reaksiyonu özel bir banyoda son derece düşük sıcaklıklara soğuttu ve daha dayanıklı bir platin ve iridyum karışımından hücreler dövdü ve florit tıpalar kullandı. 1886 yılında, birçok kimyagerin 74 yıllık çabasının ardından Moissan elementel florini izole etti. ⓘ
Moissan 1906 yılında, ölümünden iki ay önce, aşağıdaki alıntıyla Nobel Kimya Ödülü'nü aldı:
[I]Flor elementinin araştırılması ve izolasyonu konusunda yaptığı büyük hizmetlerden dolayı ... Tüm dünya, elementler arasındaki bu vahşi canavarı incelediğiniz büyük deneysel becerinize hayranlık duymuştur. ⓘ
Daha sonraki kullanımlar

General Motors'un (GM) Frigidaire bölümü 1920'lerin sonlarında kloroflorokarbon soğutucu akışkanlarla denemeler yaptı ve Kinetic Chemicals, 1930 yılında GM ve DuPont arasında Freon-12 (CCl
2F
2) bu tür bir soğutucu akışkan olarak. Daha önceki ve daha zehirli bileşiklerin yerini aldı, mutfak buzdolaplarına olan talebi artırdı ve karlı hale geldi; 1949'da DuPont Kinetic'i satın aldı ve diğer birkaç Freon bileşiğini pazarladı. Politetrafloroetilen (Teflon) 1938 yılında Roy J. Plunkett tarafından Kinetic'te soğutucu akışkanlar üzerinde çalışırken tesadüfen keşfedildi ve üstün kimyasal ve termal direnci sayesinde 1941 yılına kadar hızla ticarileşti ve seri üretime geçti. ⓘ
Elementel florun büyük ölçekli üretimi İkinci Dünya Savaşı sırasında başladı. Almanya planlanan yangın çıkarıcı klor triflorürden tonlarca üretmek için yüksek sıcaklıkta elektroliz kullandı ve Manhattan Projesi uranyum zenginleştirme için uranyum heksaflorür üretmek üzere büyük miktarlarda kullandı. UF'den beri
6 flor kadar aşındırıcı olduğundan, gazlı difüzyon tesisleri özel malzemeler gerektirmiştir: membranlar için nikel, contalar için floropolimerler ve soğutucu ve yağlayıcı olarak sıvı florokarbonlar. Bu gelişen nükleer endüstri daha sonra savaş sonrası florokimyasal gelişmeyi yönlendirdi. ⓘ
Bileşikler
Flor, organik ve inorganik alanları kapsayan zengin bir kimyaya sahiptir. Metallerle, ametallerle, metaloidlerle ve çoğu soy gazlarla birleşir ve neredeyse sadece -1 oksidasyon durumunu alır. Florun yüksek elektron ilgisi, iyonik bağ tercihine neden olur; kovalent bağlar oluşturduğunda bunlar polardır ve neredeyse her zaman tektir. ⓘ
Metaller
Alkali metaller iyonik ve yüksek oranda çözünür monoflorürler oluşturur; bunlar sodyum klorür ve benzer klorürlerin kübik düzenine sahiptir. Alkali toprak diflorürler güçlü iyonik bağlara sahiptir, ancak bir miktar kovalent karakter sergileyen ve kuvars benzeri bir yapıya sahip olan berilyum diflorür haricinde suda çözünmezler. Nadir toprak elementleri ve diğer birçok metal çoğunlukla iyonik triflorürler oluşturur. ⓘ
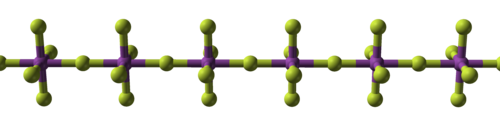
Kovalent bağ ilk olarak tetraflorürlerde ön plana çıkar: zirkonyum, hafniyum ve çeşitli aktinitlerden olanlar iyoniktir ve yüksek erime noktalarına sahiptir; titanyum, vanadyum ve niyobyumdan olanlar ise polimeriktir ve en fazla 350 °C'de (660 °F) erir veya ayrışır. Pentaflorürler doğrusal polimerleri ve oligomerik kompleksleri ile bu eğilimi sürdürmektedir. Hepsi oktahedral olan ve çoğunlukla uçucu katılar olan on üç metal hekzaflorür bilinmektedir, ancak sıvı MoF
6 ve ReF
6 ve gaz halindeki WF
6. Karakterize edilmiş tek metal heptaflorür olan renyum heptaflorür, beşgen bipiramidal moleküler geometriye sahip düşük erime noktalı bir moleküler katıdır. Daha fazla flor atomuna sahip metal florürler özellikle reaktiftir. ⓘ
| Metal florürlerin yapısal gelişimi ⓘ | ||
|
|

|
| Sodyum florür, iyonik | Bizmut pentaflorür, polimerik | Renyum heptaflorür, moleküler |
Hidrojen

Hidrojen ve flor birleşerek hidrojen klorürden daha çok suya benzeyen, hidrojen bağı ile ayrı moleküllerin kümeler oluşturduğu hidrojen florürü verir. Daha ağır hidrojen halojenürlerden çok daha yüksek bir sıcaklıkta kaynar ve onlardan farklı olarak su ile karışabilir. Hidrojen florür su ile temas ettiğinde kolayca hidratlaşarak hidroflorik asit olarak da bilinen sulu hidrojen florür oluşturur. Güçlü olan diğer hidrohalik asitlerin aksine, hidroflorik asit düşük konsantrasyonlarda zayıf bir asittir. Bununla birlikte, diğer asitlerin yapamadığı bir şey olarak cama saldırabilir. ⓘ
Diğer reaktif ametaller

Metaloidlerin ve p-blok ametallerin ikili florürleri genellikle kovalent ve uçucudur, reaktiviteleri değişkendir. Periyot 3 ve daha ağır ametaller hipervalent florürler oluşturabilir. ⓘ
Bor triflorür düzlemseldir ve tamamlanmamış bir oktete sahiptir. Bir Lewis asidi olarak işlev görür ve amonyak gibi Lewis bazları ile birleşerek eklentiler oluşturur. Karbon tetraflorür tetrahedral ve inerttir; grup analogları olan silikon ve germanyum tetraflorür de tetrahedraldir ancak Lewis asitleri gibi davranırlar. Piktojenler, daha yüksek molekül ağırlığı ile reaktivite ve baziklikte artan triflorürler oluşturur, ancak nitrojen triflorür hidrolize direnç gösterir ve bazik değildir. Fosfor, arsenik ve antimon pentaflorürleri, ilgili triflorürlerinden daha reaktiftir ve antimon pentaflorür bilinen en güçlü nötr Lewis asididir. ⓘ
Kalkojenlerin çeşitli florürleri vardır: oksijen (oksijeni +2 oksidasyon durumunda olan bilinen tek bileşik), kükürt ve selenyum için kararsız diflorürler rapor edilmiştir; kükürt, selenyum ve tellür için tetraflorürler ve heksaflorürler mevcuttur. Sonuncusu daha fazla flor atomu ve daha hafif merkezi atomlar tarafından stabilize edilir, bu nedenle kükürt hekzaflorür özellikle inerttir. Klor, brom ve iyodun her biri mono-, tri- ve pentaflorürler oluşturabilir, ancak olası interhalojen heptaflorürler arasında sadece iyot heptaflorür karakterize edilmiştir. Bunların birçoğu güçlü flor atomu kaynaklarıdır ve klor triflorür kullanan endüstriyel uygulamalar flor kullananlara benzer önlemler gerektirir. ⓘ
Soy gazlar
Tam elektron kabuklarına sahip soy gazlar, Neil Bartlett'in ksenon hekzafloroplatinat sentezini rapor ettiği 1962 yılına kadar diğer elementlerle reaksiyona girmemiştir; o zamandan beri ksenon diflorür, tetraflorür, hekzaflorür ve çoklu oksiflorürler izole edilmiştir. Diğer asal gazlar arasında kripton bir diflorür oluşturur ve radon ve flor, radon diflorür olduğundan şüphelenilen bir katı oluşturur. Daha hafif soy gazların ikili florürleri son derece kararsızdır: argon ve hidrojen florür aşırı koşullar altında birleşerek argon florohidrür verir. Helyum ve neonun uzun ömürlü florürleri yoktur ve şimdiye kadar neon florür gözlenmemiştir; helyum florohidrit yüksek basınçlarda ve düşük sıcaklıklarda milisaniyeler boyunca tespit edilmiştir. ⓘ
Organik bileşikler


Karbon-flor bağı organik kimyanın en güçlü bağıdır ve organoflorinlere kararlılık kazandırır. Doğada neredeyse hiç bulunmaz, ancak yapay bileşiklerde kullanılır. Bu alandaki araştırmalar genellikle ticari uygulamalar tarafından yönlendirilir; ilgili bileşikler çeşitlidir ve organik kimyanın doğasında var olan karmaşıklığı yansıtır. ⓘ
Ayrık moleküller
Bir alkan içindeki hidrojen atomlarının giderek daha fazla flor atomu ile yer değiştirmesi çeşitli özellikleri kademeli olarak değiştirir: erime ve kaynama noktaları düşer, yoğunluk artar, hidrokarbonlardaki çözünürlük azalır ve genel kararlılık artar. Tüm hidrojen atomlarının ikame edildiği perflorokarbonlar, çoğu organik çözücüde çözünmez ve ortam koşullarında yalnızca sıvı amonyaktaki sodyum ile reaksiyona girer. ⓘ
Perflorlu bileşik terimi, genellikle bir karboksilik asit olan fonksiyonel bir grubun varlığı olmasaydı perflorokarbon olacak bileşikler için kullanılır. Bu bileşikler, stabilite ve hidrofobiklik gibi birçok özelliği perflorokarbonlarla paylaşırken, fonksiyonel grup reaktivitelerini artırarak yüzeylere yapışmalarını veya yüzey aktif madde olarak hareket etmelerini sağlar; Özellikle florosürfaktanlar, suyun yüzey gerilimini hidrokarbon bazlı analoglarından daha fazla düşürebilir. Fonksiyonel grubun yakınında bazı florlanmamış karbon atomlarına sahip olan florotelomerler de perflorlanmış olarak kabul edilir. ⓘ
Polimerler
Polimerler, ayrık moleküllerde (hidrojen yerine) flor ikamesinin sağladığı aynı kararlılık artışlarını sergiler; erime noktaları da genellikle artar. Politetrafloroetilen (PTFE), en basit floropolimer ve yapısal birimi -CF olan polietilenin perfloro analoğudur.
2-, beklendiği gibi bu değişimi gösterir, ancak çok yüksek erime noktası kalıplanmasını zorlaştırır. Çeşitli PTFE türevleri sıcaklığa daha az toleranslıdır ancak kalıplanması daha kolaydır: florlu etilen propilen bazı flor atomlarını triflorometil gruplarıyla değiştirir, perfloroalkoksi alkanlar aynı şeyi triflorometoksi gruplarıyla yapar ve Nafion sülfonik asit gruplarıyla kaplanmış perfloroeter yan zincirleri içerir. Diğer floropolimerler bazı hidrojen atomlarını muhafaza eder; poliviniliden florür PTFE'nin yarısı kadar flor atomuna, polivinil florür ise dörtte biri kadar flor atomuna sahiptir, ancak her ikisi de perflorlu polimerler gibi davranır. ⓘ
Üretim
Elementel flor ve neredeyse tüm flor bileşikleri hidrojen florürden veya sulu çözeltilerinden, hidroflorik asitten üretilir. Hidrojen florür, fırınlarda floritin (CaF2) sülfürik asit ile endotermik reaksiyonu sonucu üretilir:
- CaF2 + H2SO4 → 2 HF(g) + CaSO4 ⓘ
Gaz halindeki HF daha sonra suda emilebilir veya sıvılaştırılabilir. ⓘ
Üretilen HF'nin yaklaşık %20'si, HF'yi termal olarak ve hidroliz yoluyla serbest bırakmak için parçalanabilen hekzaflorosilik asit (H2SiF6) üreten gübre üretiminin bir yan ürünüdür:
- H2SiF6 → 2 HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2 ⓘ
F2'ye giden endüstriyel yollar

Moissan'ın yöntemi, bir potasyum florür/hidrojen florür karışımının elektrolizi yoluyla endüstriyel miktarlarda flor üretmek için kullanılır: hidrojen ve florür iyonları, sırasıyla hidrojen ve flor gazı üretmek için 8-12 volt altında çelik bir kap katotta ve bir karbon blok anotta indirgenir ve oksitlenir. Sıcaklıklar yükseltilir, KF-2HF 70 °C'de (158 °F) erir ve 70-130 °C'de (158-266 °F) elektroliz edilir. Elektrik iletkenliği sağlayan KF, saf HF neredeyse iletken olmadığı için elektroliz edilemediğinden çok önemlidir. Flor, 200 °C'nin (392 °F) altındaki sıcaklıklarda pasifleştirilmiş iç kısımlara sahip çelik silindirlerde depolanabilir; aksi takdirde nikel kullanılabilir. Regülatör vanaları ve boru tesisatı nikelden yapılır, ikincisi muhtemelen bunun yerine Monel kullanır. Su ve greslerin kesinlikle hariç tutulmasıyla birlikte sık sık pasivasyon yapılmalıdır. Laboratuvarda, cam eşyalar düşük basınç ve susuz koşullar altında flor gazı taşıyabilir; bazı kaynaklar bunun yerine nikel-Monel-PTFE sistemleri önermektedir. ⓘ
Laboratuvar rotaları
Karl O. Christe, Moissan'ın başarısının yüzüncü yılını kutlamak için 1986'da düzenlenen bir konferansa hazırlanırken, bazı metal florür anyonlarının kararlı nötr muadilleri olmadığı için kimyasal flor üretiminin mümkün olması gerektiğini düşündü; bunların asitlenmesi potansiyel olarak oksidasyonu tetikler. Floru yüksek verim ve atmosferik basınçta geliştiren bir yöntem geliştirdi:
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑ ⓘ
Christe daha sonra reaktanların "100 yıldan uzun bir süredir bilindiğini ve Moissan'ın bile bu şemayı bulabileceğini" söylemiştir. 2008 gibi geç bir tarihte, bazı kaynaklar hala florun herhangi bir kimyasal izolasyon için fazla reaktif olduğunu iddia ediyordu. ⓘ
Endüstriyel uygulamalar
Küresel florun çoğunu sağlayan florit madenciliği, 1989 yılında 5,6 milyon metrik ton cevher çıkarılmasıyla zirveye ulaşmıştır. Kloroflorokarbon kısıtlamaları bu rakamı 1994 yılında 3.6 milyon tona düşürmüştür; üretim o zamandan beri artmaktadır. 2003 yılında yaklaşık 4,5 milyon ton cevher ve 550 milyon ABD doları gelir elde edilmiştir; daha sonraki raporlar 2011 küresel florokimyasal satışlarını 15 milyar dolar olarak tahmin etmiş ve 2016-18 üretim rakamlarını 3,5 ila 5,9 milyon ton ve en az 20 milyar dolar gelir olarak öngörmüştür. Köpük flotasyonu, çıkarılan floriti eşit oranda iki ana metalürjik kaliteye ayırır: 60-85 saflıktaki metsparın neredeyse tamamı demir eritme işleminde kullanılırken, %97+ saflıktaki asitspar esas olarak temel endüstriyel ara ürün olan hidrojen florüre dönüştürülür.

Her yıl en az 17.000 metrik ton flor üretilmektedir. Uranyum veya sülfür hekzaflorür olarak kilogram başına sadece 5-8 dolar maliyete sahiptir, ancak kullanım zorlukları nedeniyle element olarak çok daha fazladır. Büyük miktarlarda serbest flor kullanan çoğu proses, dikey entegrasyon altında yerinde üretim kullanır. ⓘ
Yılda 7.000 metrik tona kadar tüketilen flor gazının en büyük uygulaması UF'nin hazırlanmasıdır.
6 nükleer yakıt döngüsü için. Flor, kendisi de uranyum dioksit ve hidroflorik asitten oluşan uranyum tetraflorürü florlamak için kullanılır. Flor monoizotopiktir, bu nedenle UF ile uranyum tetraflorür arasındaki kütle farkları
6 molekülleri 235'in varlığından kaynaklanmaktadır.
U veya 238
U, gaz difüzyonu veya gaz santrifüjü yoluyla uranyum zenginleştirmeye olanak sağlar. Yılda yaklaşık 6.000 metrik ton inert dielektrik SF üretilmektedir.
6 yüksek voltaj transformatörleri ve devre kesiciler için, yağ dolu cihazlarla ilişkili tehlikeli poliklorlu bifenillere olan ihtiyacı ortadan kaldırır. Elektronikte çeşitli flor bileşikleri kullanılmaktadır: kimyasal buhar biriktirmede renyum ve tungsten hekzaflorür, plazma aşındırmada tetraflorometan ve temizleme ekipmanında nitrojen triflorür. Flor aynı zamanda organik florürlerin sentezinde de kullanılır, ancak reaktivitesi genellikle önce daha yumuşak olan ClF
3, BrF
3, veya EĞER
5, birlikte kalibre edilmiş florlamaya izin verir. Florlu farmasötikler bunun yerine sülfür tetraflorür kullanır. ⓘ
İnorganik florürler

Diğer demir alaşımlarında olduğu gibi, her bir metrik ton çeliğe yaklaşık 3 kg (6,5 lb) metspar eklenir; florür iyonları erime noktasını ve viskozitesini düşürür. Emaye ve kaynak çubuğu kaplamaları gibi malzemelerde katkı maddesi olarak rolünün yanı sıra, çoğu asitspar, çelik asitleme, cam aşındırma ve alkan kırmada kullanılan hidroflorik asidi oluşturmak için sülfürik asit ile reaksiyona girer. HF'nin üçte biri, alüminyum ekstraksiyonu için Hall-Héroult prosesinde kullanılan kriyolit ve alüminyum triflorür sentezine gitmektedir; bunların eritme aparatıyla zaman zaman reaksiyona girmesi nedeniyle yenilenmesi gerekmektedir. Her bir metrik ton alüminyum için yaklaşık 23 kg (51 lb) flaks gerekir. Florosilikatlar ikinci en büyük kısmı tüketir; sodyum florosilikat su floridasyonunda ve çamaşır atığı arıtımında ve kriyolit ve silikon tetraflorür yolunda bir ara madde olarak kullanılır. Diğer önemli inorganik florürler arasında kobalt, nikel ve amonyum florürler bulunmaktadır. ⓘ
Organik florürler
Organoflorürler, çıkarılan floritin %20'sinden fazlasını ve hidroflorik asidin %40'ından fazlasını tüketmektedir; soğutucu gazlar baskındır ve floropolimerler pazar paylarını artırmaktadır. Yüzey aktif maddeler küçük bir uygulamadır ancak yıllık 1 milyar doların üzerinde gelir getirmektedir. 150°C'nin (-240°F) üzerindeki doğrudan hidrokarbon-flor reaksiyonlarından kaynaklanan tehlike nedeniyle, endüstriyel florokarbon üretimi, çoğunlukla Swarts florinasyonu gibi halojen değişim reaksiyonları yoluyla dolaylıdır; burada klorokarbon klorları, katalizörler altında hidrojen florür ile florinlerle ikame edilir. Elektrokimyasal florlama, hidrokarbonları hidrojen florür içinde elektrolize tabi tutar ve Fowler işlemi bunları kobalt triflorür gibi katı flor taşıyıcılarla işler. ⓘ
Soğutucu gazlar
Resmi olmayan bağlamlarda Freon olarak adlandırılan halojenli soğutucu akışkanlar, mevcut flor, klor, karbon ve hidrojen miktarını gösteren R numaraları ile tanımlanır. R-11, R-12 ve R-114 gibi kloroflorokarbonlar (CFC'ler) bir zamanlar organoflorinleri domine etmiş ve 1980'lerde üretimde zirveye ulaşmıştır. Klima sistemleri, itici gazlar ve çözücüler için kullanılan bu gazların üretimi, yaygın uluslararası yasaklamanın ardından 2000'li yılların başında bu zirvenin onda birinin altına düşmüştür. Hidrokloroflorokarbonlar (HCFC'ler) ve hidroflorokarbonlar (HFC'ler) ikame olarak tasarlanmıştır; sentezleri organik endüstrideki florun %90'ından fazlasını tüketmektedir. Önemli HCFC'ler arasında R-22, klorodiflorometan ve R-141b bulunmaktadır. Ana HFC R-134a'dır ve yeni bir molekül türü olan HFO-1234yf, bir Hidrofloroolefin (HFO), HFC-134a'nın %1'inden daha az olan küresel ısınma potansiyeli nedeniyle ön plana çıkmaktadır. ⓘ
Polimerler

2006 ve 2007 yıllarında yaklaşık 180.000 metrik ton floropolimer üretilmiş ve yılda 3,5 milyar doların üzerinde gelir elde edilmiştir. Küresel pazarın 2011 yılında 6 milyar doların biraz altında olduğu tahmin edilmekte ve 2016 yılına kadar yılda %6,5 oranında büyüyeceği öngörülmektedir. Floropolimerler sadece serbest radikallerin polimerleştirilmesiyle oluşturulabilir. ⓘ
Bazen DuPont tarafından Teflon adıyla anılan politetrafloroetilen (PTFE), dünya floropolimer üretiminin kütle olarak %60-80'ini temsil etmektedir. PTFE mükemmel bir dielektrik olduğundan en büyük uygulama elektrik yalıtımındadır. Ayrıca korozyon direncine ihtiyaç duyulan kimya endüstrisinde, boruların, tüplerin ve contaların kaplanmasında kullanılır. Bir diğer önemli kullanım alanı ise stadyum çatıları için PFTE kaplı fiberglas bezdir. Başlıca tüketici uygulaması yapışmaz pişirme kapları içindir. Sarsılmış PTFE film, bazen Gore-Tex markasıyla anılan ve yağmurluk, koruyucu giysiler ve filtreler için kullanılan ince gözenekli bir membran olan genişletilmiş PTFE (ePTFE) haline gelir; ePTFE lifleri conta ve toz filtreleri haline getirilebilir. Florlanmış etilen propilen de dahil olmak üzere diğer floropolimerler PTFE'nin özelliklerini taklit eder ve onun yerine kullanılabilir; daha kalıplanabilir, ancak aynı zamanda daha maliyetli ve daha düşük termal stabiliteye sahiptirler. İki farklı floropolimerden elde edilen filmler güneş pillerinde camın yerini almaktadır. ⓘ
Kimyasal olarak dirençli (ancak pahalı) florlu iyonomerler elektrokimyasal hücre membranları olarak kullanılır; bunların ilk ve en önemli örneği Nafion'dur. 1960'larda geliştirilen bu malzeme başlangıçta uzay araçlarında yakıt hücresi malzemesi olarak kullanılmış ve daha sonra cıva bazlı kloralkali proses hücrelerinin yerini almıştır. Son zamanlarda, yakıt hücresi uygulaması otomobillere proton değişim membranı yakıt hücreleri yerleştirme çabalarıyla yeniden ortaya çıkmıştır. Viton gibi floroelastomerler, çoğunlukla O-ringlerde kullanılan çapraz bağlı floropolimer karışımlarıdır; perflorobütan (C4F10) yangın söndürme maddesi olarak kullanılır. ⓘ
Yüzey Aktif Maddeler
Florosürfaktanlar su ve lekeleri uzaklaştırmak için kullanılan küçük organoflorin molekülleridir. Pahalı olmalarına rağmen (kilogram başına 200-2000 $ ile ilaçlarla karşılaştırılabilir), 2006 yılına kadar yıllık 1 milyar $'ın üzerinde gelir elde etmişlerdir; sadece Scotchgard 2000 yılında 300 milyon $'ın üzerinde gelir elde etmiştir. Florosürfaktanlar genel yüzey aktif madde pazarında azınlıktadır ve bu pazarın büyük bir kısmını çok daha ucuz hidrokarbon bazlı ürünler kaplamaktadır. Boyalardaki uygulamalar bileşik maliyetler nedeniyle yük altındadır; bu kullanım 2006 yılında sadece 100 milyon $ değerindeydi. ⓘ
Tarımsal Kimyasallar
Tarımsal kimyasalların yaklaşık %30'u flor içerir, bunların çoğu herbisit ve fungisit ile birkaç ürün düzenleyicidir. Genellikle tek bir atom veya en fazla bir triflorometil grubundan oluşan flor ikamesi, florlu farmasötiklere benzer etkilere sahip sağlam bir modifikasyondur: artan biyolojik kalış süresi, membran geçişi ve moleküler tanımanın değiştirilmesi. Trifluralin, ABD'de yabani ot öldürücü olarak geniş ölçekte kullanılan önemli bir örnektir, ancak şüpheli bir kanserojendir ve birçok Avrupa ülkesinde yasaklanmıştır. Sodyum monofloroasetat (1080), iki asetik asit hidrojeninin flor ve sodyum ile yer değiştirdiği bir memeli zehiridir; sitrik asit döngüsünde asetatın yerini alarak hücre metabolizmasını bozar. İlk olarak 19. yüzyılın sonlarında sentezlenmiş, 20. yüzyılın başlarında bir böcek ilacı olarak tanınmış ve daha sonra günümüzdeki kullanımına geçilmiştir. 1080'in en büyük tüketicisi olan Yeni Zelanda, kivileri istilacı Avustralya yaygın brushtail possum'dan korumak için kullanıyor. Avrupa ve ABD 1080'i yasaklamıştır. ⓘ
Tıbbi uygulamalar
Diş bakımı
20'nci yüzyılın ortalarından itibaren yapılan popülasyon çalışmaları topikal florürün diş çürüklerini azalttığını göstermektedir. Bu durum ilk olarak diş minesi hidroksiapatitinin daha dayanıklı olan florapatite dönüşmesine bağlanmıştır, ancak önceden florlanmış dişler üzerinde yapılan çalışmalar bu hipotezi çürütmüştür ve mevcut teoriler florürün küçük çürüklerde mine büyümesine yardımcı olduğunu içermektedir. Florürün içme suyunda doğal olarak bulunduğu bölgelerdeki çocuklar üzerinde yapılan çalışmalardan sonra, 1940'larda diş çürümesiyle mücadele etmek için kontrollü kamu su kaynağı florlaması başladı ve şu anda Amerikalıların üçte ikisi de dahil olmak üzere küresel nüfusun yüzde 6'sını besleyen suya uygulanmaktadır. Bilimsel literatürde 2000 ve 2007 yıllarında yapılan incelemeler, su florlamasının çocuklarda diş çürümesini önemli ölçüde azalttığını ortaya koymuştur. Bu onaylara ve çoğunlukla iyi huylu diş florozisi dışında herhangi bir olumsuz etkiye dair kanıt bulunmamasına rağmen, etik ve güvenlik gerekçeleriyle muhalefet devam etmektedir. Florlamanın faydaları, muhtemelen diğer florür kaynakları nedeniyle azalmıştır, ancak düşük gelirli gruplarda hala ölçülebilir düzeydedir. Sodyum monoflorofosfat ve bazen sodyum veya kalay (II) florür, ilk olarak 1955 yılında ABD'de piyasaya sürülen ve günümüzde gelişmiş ülkelerde her yerde bulunan florürlü diş macunlarında ve florürlü gargaralarda, jellerde, köpüklerde ve verniklerde sıklıkla bulunmaktadır. ⓘ
İlaçlar
Modern ilaçların yüzde yirmisi flor içermektedir. Bunlardan biri olan kolesterol düşürücü atorvastatin (Lipitor), 2011 yılında jenerik hale gelene kadar diğer tüm ilaçlardan daha fazla gelir elde etmiştir. 2000'li yılların ortalarında ilk onda yer alan astım ilacı Seretide, biri flutikazon olmak üzere iki aktif bileşen içermektedir. Birçok ilaç inaktivasyonu geciktirmek ve dozaj sürelerini uzatmak için florlanır çünkü karbon-flor bağı çok stabildir. Florlama aynı zamanda lipofilikliği de artırır çünkü bağ karbon-hidrojen bağından daha hidrofobiktir ve bu genellikle hücre membranı penetrasyonuna ve dolayısıyla biyoyararlanıma yardımcı olur. ⓘ
Trisiklikler ve 1980'ler öncesi diğer antidepresanlar, serotonin hedefi dışındaki nörotransmitterlerle seçici olmayan etkileşimleri nedeniyle çeşitli yan etkilere sahipti; florlanmış fluoksetin seçiciydi ve bu sorunu önleyen ilk ilaçlardan biriydi. Seçici serotonin geri alım inhibitörleri olan sitalopram, izomeri essitalopram ve fluvoksamin ve paroksetin de dahil olmak üzere birçok güncel antidepresan aynı muameleyi görmektedir. Kinolonlar, etkilerini artırmak için genellikle florlanan yapay geniş spektrumlu antibiyotiklerdir. Bunlara siprofloksasin ve levofloksasin dahildir. Flor ayrıca steroidlerde de kullanılır: fludrokortizon kan basıncını yükselten bir mineralokortikoiddir ve triamsinolon ve deksametazon güçlü glukokortikoidlerdir. İnhale anesteziklerin çoğu yoğun şekilde florlanmıştır; prototip halotan çağdaşlarından çok daha inert ve güçlüdür. Florlu eterler sevofluran ve desfluran gibi daha sonraki bileşikler halotandan daha iyidir ve kanda neredeyse çözünmezler, bu da daha hızlı uyanma sürelerine izin verir. ⓘ
PET taraması
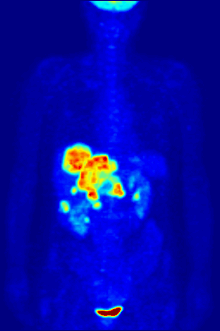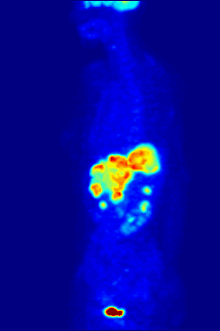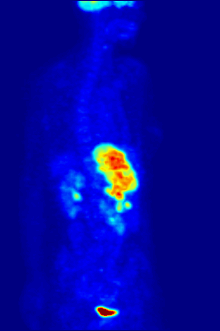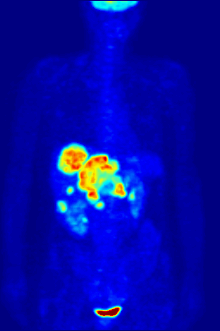
Radyoaktif flor-18 ile etiketlenmiş glikoz ile F PET taraması. Normal beyin ve böbrekler görüntülenecek kadar glikoz alır. Karnın üst kısmında kötü huylu bir tümör görülüyor. Radyoaktif flor mesanedeki idrarda görülür. ⓘ
Flor-18 genellikle pozitron emisyon tomografisi için radyoaktif izleyicilerde bulunur, çünkü neredeyse iki saatlik yarı ömrü, üretim tesislerinden görüntüleme merkezlerine taşınmasına izin verecek kadar uzundur. En yaygın izleyici, intravenöz enjeksiyondan sonra beyin ve çoğu kötü huylu tümör gibi glikoz gerektiren dokular tarafından alınan florodeoksiglukozdur; daha sonra ayrıntılı görüntüleme için bilgisayar destekli tomografi kullanılabilir. ⓘ
Oksijen taşıyıcıları
Sıvı florokarbonlar kandan daha fazla miktarda oksijen veya karbondioksit tutabilir ve yapay kan ve sıvı solunumda olası kullanımları nedeniyle dikkat çekmiştir. Florokarbonlar normalde suyla karışmadığından, kan olarak kullanılabilmeleri için emülsiyonlar (suda asılı küçük perflorokarbon damlacıkları) halinde karıştırılmaları gerekir. Böyle bir ürün olan Oxycyte, ilk klinik denemelerden geçmiştir. Bu maddeler dayanıklılık sporcularına yardımcı olabilir ve spordan yasaklanmıştır; 1998'de bir bisikletçinin neredeyse ölmesi, kötüye kullanımlarına ilişkin bir soruşturma başlatılmasına neden olmuştur. Saf perflorokarbon sıvı solunumu uygulamaları (su emülsiyonu değil saf perflorokarbon sıvı kullanılır) yanık kurbanlarına ve akciğerleri yetersiz prematüre bebeklere yardım etmeyi içerir. Kısmi ve tam akciğer dolumu düşünülmüştür, ancak sadece birincisinin insanlarda önemli testleri olmuştur. Alliance Pharmaceuticals'ın bir çalışması klinik deneylere ulaşmış ancak sonuçlar normal tedavilerden daha iyi olmadığı için terk edilmiştir. ⓘ
Biyolojik rol

Flor insanlar ve diğer memeliler için gerekli değildir, ancak küçük miktarlarının diş minesinin güçlendirilmesi için faydalı olduğu bilinmektedir (florapatit oluşumu, mineyi şekerlerin bakteriyel fermantasyonu ile üretilen asitlerin saldırısına karşı daha dirençli hale getirir). Az miktarda flor kemik gücü için faydalı olabilir, ancak bu sonuncusu kesin olarak belirlenmemiştir. Hem DSÖ hem de ABD Ulusal Akademileri Tıp Enstitüsü, yaşa ve cinsiyete göre değişen tavsiye edilen günlük ödenek (RDA) ve tolere edilen üst flor alımını yayınlamaktadır. ⓘ
Doğal organoflorinler mikroorganizmalarda ve bitkilerde bulunmuş ancak hayvanlarda bulunmamıştır. En yaygın olanı, Afrika, Avustralya ve Brezilya'da en az 40 bitki tarafından otçullara karşı savunma olarak kullanılan floroasetattır. Diğer örnekler arasında terminal olarak florlanmış yağ asitleri, floroaseton ve 2-florositrat yer alır. Floru karbona bağlayan bir enzim - adenozil-florür sentaz - 2002 yılında bakterilerde keşfedilmiştir. ⓘ
Toksisite
Elementel flor canlı organizmalar için oldukça toksiktir. İnsanlardaki etkileri hidrojen siyanürün 50 ppm'lik değerinden daha düşük konsantrasyonlarda başlar ve klorunkine benzer: flor için yaşam ve sağlık için hemen tehlikeli değer olan 25 ppm'in üzerinde gözlerde ve solunum sisteminde önemli tahrişlerin yanı sıra karaciğer ve böbrek hasarı meydana gelir. Gözler ve burun 100 ppm'de ciddi hasar görür ve hidrojen siyanür için 270 ppm'e kıyasla 1.000 ppm flor solunması dakikalar içinde ölüme neden olur. ⓘ
| Tehlikeler | |
|---|---|
| GHS etiketlemesi: | |
Piktogramlar
|
   
|
Sinyal kelimesi
|
Tehlike |
Tehlike bildirimleri
|
H270, H314, H330 |
| NFPA 704 (yangın elması) | |
Hidroflorik asit

Hidroflorik asit hidrohalik asitlerin en zayıfıdır ve 25 °C'de 3,2 pKa değerine sahiptir. Hidrojen bağının varlığı nedeniyle uçucu bir sıvıdır (diğer hidrohalik asitler gazdır). Cam, beton, metaller ve organik maddelere saldırabilir. ⓘ
Hidroflorik asit, zayıf olmasına rağmen sülfürik asit gibi birçok güçlü asitten daha büyük tehlikelere sahip bir temas zehiridir: sulu çözeltide nötr kalır ve bu nedenle soluma, yutma veya cilt yoluyla dokuya daha hızlı nüfuz eder ve 1984'ten 1994'e kadar en az dokuz ABD işçisi bu tür kazalarda öldü. Kandaki kalsiyum ve magnezyum ile reaksiyona girerek hipokalsemiye ve kardiyak aritmi yoluyla olası ölüme yol açar. Çözünmeyen kalsiyum florür oluşumu şiddetli ağrıyı tetikler ve 160 cm2'den (25 inç2) büyük yanıklar ciddi sistemik toksisiteye neden olabilir. ⓘ
Maruziyet, %50 HF için sekiz saat boyunca belirgin olmayabilir, daha düşük konsantrasyonlar için 24 saate kadar çıkabilir ve hidrojen florür sinir fonksiyonunu etkilediğinden yanık başlangıçta ağrısız olabilir. Cilt HF'ye maruz kaldıysa, 10-15 dakika boyunca bir su jeti altında durulanarak ve kirlenmiş giysiler çıkarılarak hasar azaltılabilir. Daha sonra genellikle kalsiyum glukonat uygulanır ve kalsiyum iyonlarının florür ile bağlanmasını sağlar; cilt yanıkları %2,5 kalsiyum glukonat jel veya özel durulama solüsyonları ile tedavi edilebilir. Hidroflorik asit emilimi daha ileri tıbbi tedavi gerektirir; kalsiyum glukonat enjekte edilebilir veya intravenöz olarak uygulanabilir. Kalsiyum glukonat yerine yaygın bir laboratuvar reaktifi olan kalsiyum klorür kullanılması kontrendikedir ve ciddi komplikasyonlara yol açabilir. Etkilenen kısımların eksizyonu veya ampütasyonu gerekebilir. ⓘ
Florür iyonu
Çözünür florürler orta derecede toksiktir: 5-10 g sodyum florür veya vücut kütlesinin kilogramı başına 32-64 mg florür iyonu, yetişkinler için ölümcül bir dozu temsil eder. Öldürücü dozun beşte biri olumsuz sağlık etkilerine neden olabilir ve kronik aşırı tüketim Asya ve Afrika'da milyonları etkileyen iskelet florozisine yol açabilir. Yutulan florür midede hidroflorik asit oluşturur ve bu asit bağırsaklar tarafından kolayca emilir, burada hücre zarlarını geçer, kalsiyum ile bağlanır ve idrarla atılmadan önce çeşitli enzimlerle etkileşime girer. Maruz kalma sınırları, vücudun florür iyonlarını temizleme kabiliyetinin idrarla test edilmesiyle belirlenir. ⓘ
Tarihsel olarak, florür zehirlenmesi vakalarının çoğu inorganik florür içeren böcek öldürücülerin kazara yutulmasından kaynaklanmıştır. Günümüzde olası florür zehirlenmeleri için zehir kontrol merkezlerine yapılan aramaların çoğu florür içeren diş macunlarının yutulması sonucu meydana gelmektedir. Su florlama ekipmanının arızalı olması da bir başka nedendir: Alaska'da meydana gelen bir olay yaklaşık 300 kişiyi etkilemiş ve bir kişinin ölümüne neden olmuştur. Diş macunundan kaynaklanan tehlikeler küçük çocuklar için daha da artmaktadır ve Hastalık Kontrol ve Önleme Merkezleri altı yaşından küçük çocukların diş macununu yutmamaları için dişlerini fırçalarken gözetim altında tutulmalarını tavsiye etmektedir. Bölgesel bir çalışmada, bir yıl boyunca, biri böcek ilacı yutmaktan kaynaklanan ölüm olmak üzere toplam 87 vakayı içeren ergenlik öncesi florür zehirlenmesi raporları incelenmiştir. Çoğunda herhangi bir belirti görülmemiştir, ancak yaklaşık %30'unda mide ağrısı görülmüştür. ABD genelinde yapılan daha büyük bir çalışmada da benzer bulgulara rastlanmıştır: Vakaların %80'i altı yaşından küçük çocuklarda görülmüş ve çok az ciddi vaka yaşanmıştır. ⓘ
Çevresel kaygılar
Atmosfer
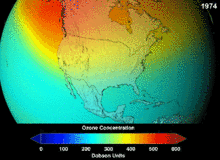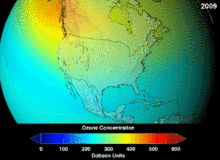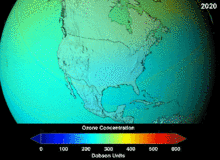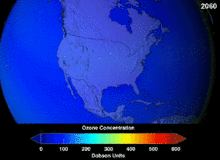
1987'de imzalanan Montreal Protokolü, ozon tabakasına zarar verme potansiyelleri (ODP) nedeniyle kloroflorokarbonlar (CFC'ler) ve bromoflorokarbonlar üzerinde katı düzenlemeler getirmiştir. Orijinal uygulamalarına uygun olan yüksek stabiliteleri, serbest kalan klor ve brom atomlarının ozon moleküllerine saldırdığı yüksek irtifalara ulaşana kadar ayrışmadıkları anlamına da geliyordu. Yasak ve etkinliğine dair ilk belirtiler olsa bile, tahminler tam iyileşmeden önce birkaç nesil geçeceği konusunda uyarıyordu. CFC'lerin ODP'sinin onda birine sahip olan hidrokloroflorokarbonlar (HCFC'ler) mevcut ikamelerdir ve 2030-2040 yılları arasında klor içermeyen ve sıfır ODP'ye sahip hidroflorokarbonlarla (HFC'ler) ikame edilmeleri planlanmaktadır. Bu tarih 2007 yılında gelişmiş ülkeler için 2020'ye çekilmiştir; Çevre Koruma Ajansı 2003 yılında bir HCFC'nin üretimini yasaklamış ve diğer ikisinin üretimini de sınırlandırmıştır. Florokarbon gazları genellikle küresel ısınma potansiyelleri (GWP) yaklaşık 100 ila 10.000 olan sera gazlarıdır; sülfür hekzaflorür yaklaşık 20.000 değerine sahiptir. Hidrofloroolefin (HFO) olarak adlandırılan yeni bir soğutucu akışkan türü olan HFO-1234yf, mevcut soğutucu akışkan standardı HFC-134a için 1.430 olan GWP'ye kıyasla 1'den daha düşük GWP'si nedeniyle küresel talep görmüştür. ⓘ
Biyopersistans
Organoflorinler, karbon-flor bağının gücü nedeniyle biyolojik kalıcılık sergilerler. Asidik fonksiyonel grupları sayesinde suda az çözünen perfloroalkil asitler (PFAA'lar) kalıcı organik kirleticiler olarak bilinmektedir; en sık araştırılanlar perflorooktanesülfonik asit (PFOS) ve perflorooktanoik asittir (PFOA). PFAA'lar kutup ayılarından insanlara kadar dünya çapında eser miktarlarda bulunmuştur; PFOS ve PFOA'nın anne sütünde ve yeni doğan bebeklerin kanında bulunduğu bilinmektedir. 2013 yılında yapılan bir inceleme, yeraltı suyu ve toprak PFAA seviyeleri ile insan faaliyetleri arasında hafif bir korelasyon olduğunu göstermiştir; bir kimyasalın baskın olduğu net bir model yoktur ve daha yüksek PFOS miktarları daha yüksek PFOA miktarlarıyla ilişkilendirilmiştir. PFAA'lar vücutta serum albümini gibi proteinlere bağlanır; böbrekler yoluyla atılmadan önce insanlarda karaciğer ve kanda yoğunlaşma eğilimindedirler. Vücutta kalma süresi türlere göre büyük farklılıklar gösterir; kemirgenlerde günlerce, insanlarda ise yıllarca süren yarı ömürleri vardır. Yüksek dozlarda PFOS ve PFOA yeni doğan kemirgenlerde kansere ve ölüme neden olur, ancak insan çalışmaları mevcut maruziyet seviyelerinde bir etki oluşturmamıştır. ⓘ