Amfetamin
 | |
 | |
| Klinik veriler | |
|---|---|
| Telaffuz | /æmˈfɛtəmiːn/ ( |
| Ticari isimler | Evekeo, Adderall, diğerleri |
| Diğer isimler | α-metilfenetilamin |
| AHFS/Drugs.com | Monografi |
| MedlinePlus | a616004 |
| Lisans verileri |
|
| Bağımlılık sorumluluk | Orta düzeyde |
| Bağımlılık sorumluluk | Orta düzeyde |
| Güzergahları YÖNETİM | Tıbbi: oral, intravenöz Rekreasyonel: oral, insüflasyon, rektal, intravenöz, intramüsküler |
| İlaç sınıfı | MSS uyarıcı, anorektik |
| ATC kodu |
|
| Yasal statü | |
| Yasal statü |
|
| Farmakokinetik veriler | |
| Biyoyararlanım | Ağızdan: %75-100 |
| Protein bağlama | 20% |
| Metabolizma | CYP2D6, DBH, FMO3 |
| Metabolitler | 4-hidroksiamfetamin, 4-hidroksinorefedrin, 4-hidroksifenilaseton, benzoik asit, hippürik asit, norefedrin, fenilaseton |
| Etki başlangıcı | IR dozlama: 30-60 dakika XR dozajı: 1,5-2 saat |
| Eliminasyon yarı ömrü | D-amph: 9-11 saat L-amfi: 11-14 saat pH'a bağlı: 7-34 saat |
| Etki süresi | IR dozlama: 3-6 saat XR dozajı: 8-12 saat |
| Boşaltım | Öncelikle renal; pH'a bağlı aralık: 1-75% |
| Tanımlayıcılar | |
IUPAC adı
| |
| CAS Numarası | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| Kimyasal ve fiziksel veriler | |
| Formül | C9H13N |
| Molar kütle | 135.210 g-mol-1 |
| 3D model (JSmol) | |
| Kiralite | Rasemik karışım |
| Yoğunluk | 25 °C'de .936 g/cm3 |
| Erime noktası | 11,3 °C (52,3 °F) (öngörülen) |
| Kaynama noktası | 760 mmHg'de 203 °C (397 °F) |
GÜLÜMSEMELER
| |
InChI
| |
| (doğrulayın) | |
Amfetamin (alfa-metilfenetilaminden türetilmiştir) dikkat eksikliği hiperaktivite bozukluğu (DEHB), narkolepsi ve obezite tedavisinde kullanılan bir merkezi sinir sistemi (MSS) uyarıcısıdır. Amfetamin 1887 yılında keşfedilmiştir ve iki enantiyomer olarak bulunmaktadır: levoamfetamin ve dekstroamfetamin. Amfetamin, saf amin formlarındaki iki enantiyomerin eşit kısımları olan rasemik serbest baz olan belirli bir kimyasal maddeyi ifade eder. Bu terim sıklıkla gayri resmi olarak enantiyomerlerin herhangi bir kombinasyonuna veya tek başına herhangi birine atıfta bulunmak için kullanılır. Tarihsel olarak burun tıkanıklığı ve depresyon tedavisinde kullanılmıştır. Amfetamin ayrıca atletik performans arttırıcı ve bilişsel güçlendirici olarak ve rekreasyonel olarak afrodizyak ve öfori olarak kullanılır. Birçok ülkede reçeteli bir ilaçtır ve eğlence amaçlı kullanımla ilişkili önemli sağlık riskleri nedeniyle amfetaminin izinsiz bulundurulması ve dağıtımı genellikle sıkı bir şekilde kontrol edilmektedir. ⓘ
İlk amfetamin farmasötiği, çeşitli durumları tedavi etmek için kullanılan bir marka olan Benzedrine idi. Günümüzde farmasötik amfetamin, rasemik amfetamin, Adderall, dekstroamfetamin veya inaktif ön ilaç lisdexamfetamin olarak reçete edilmektedir. Amfetamin beyinde monoamin ve uyarıcı nörotransmisyonu artırır, en belirgin etkileri norepinefrin ve dopamin nörotransmitter sistemlerini hedef alır. ⓘ
Terapötik dozlarda, amfetamin öfori, seks arzusunda değişiklik, uyanıklıkta artış ve bilişsel kontrolde iyileşme gibi duygusal ve bilişsel etkilere neden olur. Reaksiyon süresinde iyileşme, yorgunluğa karşı direnç ve kas gücünde artış gibi fiziksel etkilere neden olur. Daha yüksek amfetamin dozları bilişsel işlevi bozabilir ve hızlı kas yıkımına neden olabilir. Bağımlılık, ağır eğlence amaçlı amfetamin kullanımında ciddi bir risktir, ancak terapötik dozlarda uzun süreli tıbbi kullanımdan kaynaklanması olası değildir. Çok yüksek dozlar psikoza (örn. sanrılar ve paranoya) yol açabilir; bu durum uzun süreli kullanımda bile terapötik dozlarda nadiren görülür. Rekreasyonel dozlar genellikle reçete edilen terapötik dozlardan çok daha yüksektir ve ciddi yan etki riski çok daha yüksektir. ⓘ
Amfetamin fenetilamin sınıfına aittir. Aynı zamanda bupropion, katinon, MDMA ve metamfetamin gibi önemli maddeleri içeren kendi yapısal sınıfı olan ikame edilmiş amfetaminlerin ana bileşiğidir. Fenetilamin sınıfının bir üyesi olan amfetamin aynı zamanda doğal olarak oluşan eser amin nöromodülatörleri, özellikle de her ikisi de insan vücudunda üretilen fenetilamin ve N-metilfenetilamin ile kimyasal olarak ilişkilidir. Fenetilamin amfetaminin ana bileşiğidir, N-metilfenetilamin ise amfetaminin sadece metil grubunun yerleşiminde farklılık gösteren konumsal bir izomeridir. ⓘ
| Amfetamin ⓘ | |
|---|---|
 | |
 | |
| Sistematik (IUPAC) adı | |
| (±)-1-phenylpropan-2-amine | |
| Kimlik belirteçleri | |
| CAS numarası | 300-62-9 |
| ATC kodu | N06 BA01 |
| PubChem | 300999 |
| DrugBank | APRD00480 |
| Kimyasal özellikler | |
| Kimyasal formül | C9H13N |
| Moleküler ağırlık | 135.208 g/mol g/mol |
| Farmakokinetik özellikler | |
| Biyoyararlanım | % |
| Proteine bağlanma | %20 |
| Metabolizma | Hepatik |
| Yarılanma ömrü | 10-13 saat |
| Atılma | Renal |
| Tedavi bilgileri | |
| Gebelik kategorisi | ABD - C |
| Uygulama yolu | Oral, intravenöz, buğu şeklinde, rektal, sublingual |
Amfetamin, genellikle uzun yol araç kullananlarca uyku kaçırmak ve konsantrasyon gerektiren sporlarda (atıcılık, okçuluk, vb) doping amacıyla da kullanılabilmektedir (amfetamin istismarı). ⓘ
Kullanım Alanları
Tıbbi
Amfetamin dikkat eksikliği hiperaktivite bozukluğu (DEHB), narkolepsi (bir uyku bozukluğu) ve obezite tedavisinde kullanılır ve bazen geçmiş tıbbi endikasyonları, özellikle depresyon ve kronik ağrı için etiket dışı reçete edilir. Bazı hayvan türlerinde yeterince yüksek dozlarda uzun süreli amfetamin maruziyetinin anormal dopamin sistemi gelişimi veya sinir hasarı oluşturduğu bilinmektedir, ancak DEHB olan insanlarda, terapötik dozlarda farmasötik amfetaminlerin beyin gelişimini ve sinir büyümesini iyileştirdiği görülmektedir. Manyetik rezonans görüntüleme (MRI) çalışmalarının incelemeleri, amfetamin ile uzun süreli tedavinin DEHB'li deneklerde bulunan beyin yapısı ve işlevindeki anormallikleri azalttığını ve bazal gangliyonların sağ kaudat çekirdeği gibi beynin çeşitli bölümlerindeki işlevi iyileştirdiğini göstermektedir. ⓘ
Klinik uyarıcı araştırmalarının gözden geçirilmesi, DEHB tedavisi için uzun süreli sürekli amfetamin kullanımının güvenliğini ve etkinliğini ortaya koymuştur. DEHB tedavisi için 2 yılı kapsayan sürekli stimülan tedavisinin randomize kontrollü çalışmaları tedavinin etkinliğini ve güvenliğini göstermiştir. İki inceleme, DEHB için uzun süreli sürekli uyarıcı tedavisinin DEHB'nin temel semptomlarını (yani hiperaktivite, dikkatsizlik ve dürtüsellik) azaltmada, yaşam kalitesini ve akademik başarıyı artırmada ve akademisyenler, antisosyal davranış, araba kullanma, tıbbi olmayan ilaç kullanımı, obezite, meslek, benlik saygısı, hizmet kullanımı (yani akademik, mesleki, sağlık, mali ve yasal hizmetler) ve sosyal işlevle ilgili 9 sonuç kategorisinde çok sayıda işlevsel sonuçta iyileşme sağlamada etkili olduğunu göstermiştir. Bir derleme, çocuklarda DEHB için amfetamin tedavisinin dokuz aylık randomize kontrollü bir çalışmasını vurgulamış ve ortalama 4,5 IQ puanı artış, dikkatte sürekli artış ve yıkıcı davranışlar ve hiperaktivitede sürekli azalma bulmuştur. Başka bir inceleme, bugüne kadar yapılan en uzun takip çalışmalarına dayanarak, çocukluk döneminde başlayan yaşam boyu uyarıcı tedavisinin DEHB semptomlarını kontrol etmede sürekli etkili olduğunu ve yetişkin olarak madde kullanım bozukluğu geliştirme riskini azalttığını göstermiştir. ⓘ
DEHB'nin mevcut modelleri, beynin bazı nörotransmitter sistemlerindeki işlevsel bozukluklarla ilişkili olduğunu öne sürmektedir; bu işlevsel bozukluklar mezokortikolimbik projeksiyonda bozulmuş dopamin nörotransmisyonunu ve locus coeruleus'tan prefrontal kortekse noradrenerjik projeksiyonlarda norepinefrin nörotransmisyonunu içerir. Metilfenidat ve amfetamin gibi psikostimülanlar DEHB tedavisinde etkilidir çünkü bu sistemlerdeki nörotransmitter aktivitesini arttırırlar. Bu uyarıcıları kullananların yaklaşık %80'i DEHB semptomlarında iyileşme görmektedir. Uyarıcı ilaç kullanan DEHB'li çocuklar genellikle akranları ve aile üyeleriyle daha iyi ilişkiler kurmakta, okulda daha iyi performans göstermekte, daha az dikkat dağıtıcı ve dürtüsel olmakta ve daha uzun dikkat sürelerine sahip olmaktadır. Çocuklarda, ergenlerde ve yetişkinlerde DEHB'nin farmasötik amfetaminlerle tedavisine ilişkin Cochrane incelemeleri, kısa süreli çalışmaların bu ilaçların semptomların şiddetini azalttığını gösterdiğini, ancak olumsuz yan etkileri nedeniyle uyarıcı olmayan ilaçlara göre daha yüksek bırakma oranlarına sahip olduklarını belirtmiştir. Tourette sendromu gibi tik bozukluğu olan çocuklarda DEHB tedavisine ilişkin bir Cochrane incelemesi, uyarıcıların genel olarak tikleri kötüleştirmediğini, ancak yüksek doz dekstroamfetaminin bazı kişilerde tikleri şiddetlendirebileceğini belirtmiştir. ⓘ
Performans artırma
Bilişsel performans
2015 yılında, yüksek kaliteli klinik çalışmaların sistematik bir incelemesi ve meta-analizi, düşük (terapötik) dozlarda kullanıldığında, amfetaminin normal sağlıklı yetişkinlerde çalışma belleği, uzun süreli epizodik bellek, inhibitör kontrol ve dikkatin bazı yönleri dahil olmak üzere bilişte mütevazı ancak kesin gelişmeler sağladığını ortaya koymuştur; amfetaminin bu biliş artırıcı etkilerine kısmen prefrontal kortekste hem dopamin reseptörü D1 hem de adrenoseptör α2'nin dolaylı aktivasyonunun aracılık ettiği bilinmektedir. 2014'te yapılan sistematik bir inceleme, düşük doz amfetaminin hafıza konsolidasyonunu da iyileştirdiğini ve bunun da bilginin daha iyi hatırlanmasına yol açtığını ortaya koymuştur. Terapötik amfetamin dozları, tüm bireylerde çalışma belleğindeki gelişmelere aracılık eden bir etki olan kortikal ağ verimliliğini de artırır. Amfetamin ve diğer DEHB uyarıcıları ayrıca görev belirginliğini (bir görevi yerine getirme motivasyonu) geliştirir ve uyarılmayı (uyanıklık) artırarak hedefe yönelik davranışı teşvik eder. Amfetamin gibi uyarıcılar zor ve sıkıcı görevlerde performansı artırabilir ve bazı öğrenciler tarafından ders çalışma ve sınava girme yardımı olarak kullanılır. Kendi kendine bildirilen yasadışı uyarıcı kullanımı çalışmalarına dayanarak, üniversite öğrencilerinin %5-35'i, öncelikle eğlence amaçlı uyuşturucudan ziyade akademik performansı artırmak için kullanılan saptırılmış DEHB uyarıcılarını kullanmaktadır. Bununla birlikte, terapötik aralığın üzerindeki yüksek amfetamin dozları, çalışma belleğine ve bilişsel kontrolün diğer yönlerine müdahale edebilir. ⓘ
Fiziksel performans
Amfetamin bazı sporcular tarafından artan dayanıklılık ve uyanıklık gibi psikolojik ve atletik performansı artırıcı etkileri için kullanılmaktadır; ancak, üniversite, ulusal ve uluslararası anti-doping ajansları tarafından düzenlenen spor etkinliklerinde tıbbi olmayan amfetamin kullanımı yasaktır. Sağlıklı kişilerde oral terapötik dozlarda amfetaminin kas gücünü, hızlanmayı, anaerobik koşullarda atletik performansı ve dayanıklılığı (yani yorgunluğun başlamasını geciktirir) artırdığı ve reaksiyon süresini iyileştirdiği gösterilmiştir. Amfetamin, dayanıklılığı ve reaksiyon süresini esas olarak merkezi sinir sisteminde dopaminin geri alım inhibisyonu ve salınımı yoluyla geliştirir. Amfetamin ve diğer dopaminerjik ilaçlar aynı zamanda bir "güvenlik anahtarını" geçersiz kılarak, normalde sınırların dışında olan bir yedek kapasiteye erişmek için çekirdek sıcaklık sınırının artmasına izin vererek sabit algılanan efor seviyelerinde güç çıkışını artırır. Terapötik dozlarda, amfetaminin yan etkileri atletik performansı engellemez; ancak, çok daha yüksek dozlarda amfetamin, hızlı kas yıkımı ve yüksek vücut ısısı gibi performansı ciddi şekilde bozan etkilere neden olabilir. ⓘ
Kontrendikasyonlar
Uluslararası Kimyasal Güvenlik Programı (IPCS) ve Amerika Birleşik Devletleri Gıda ve İlaç Dairesi'ne (USFDA) göre, amfetamin, uyuşturucu kullanımı, kardiyovasküler hastalık, şiddetli ajitasyon veya şiddetli anksiyete öyküsü olan kişilerde kontrendikedir. Ayrıca ileri derecede damar sertliği (arterlerin sertleşmesi), glokom (göz tansiyonunun artması), hipertiroidizm (tiroid hormonunun aşırı üretimi) veya orta ila şiddetli hipertansiyonu olan kişilerde de kontrendikedir. Bu ajanslar, amfetamin ve monoamin oksidaz inhibitörlerinin güvenli eşzamanlı kullanımı belgelenmiş olmasına rağmen, diğer uyarıcılara karşı alerjik reaksiyonlar yaşamış veya monoamin oksidaz inhibitörleri (MAOI'ler) alan kişilerin amfetamin almaması gerektiğini belirtmektedir. Bu kurumlar ayrıca anoreksiya nervoza, bipolar bozukluk, depresyon, hipertansiyon, karaciğer veya böbrek sorunları, mani, psikoz, Raynaud fenomeni, nöbetler, tiroid sorunları, tikler veya Tourette sendromu olan kişilerin amfetamin alırken semptomlarını izlemeleri gerektiğini belirtmektedir. İnsan çalışmalarından elde edilen kanıtlar, terapötik amfetamin kullanımının fetüste veya yeni doğanlarda gelişimsel anormalliklere neden olmadığını (yani, bir insan teratojeni olmadığını), ancak amfetamin kötüye kullanımının fetüs için risk oluşturduğunu göstermektedir. Amfetaminin anne sütüne geçtiği de gösterilmiştir, bu nedenle IPCS ve USFDA annelere bu ilacı kullanırken emzirmekten kaçınmalarını tavsiye etmektedir. Geri dönüşümlü büyüme bozuklukları potansiyeli nedeniyle USFDA, amfetamin ilacı reçete edilen çocukların ve ergenlerin boy ve kilolarının izlenmesini tavsiye etmektedir. ⓘ
Yan etkiler
Amfetamin/metamfetamin kullananlarda beyin kanamaları sık görülür; beyin kanamaları felçlere (hemorajik stroke) neden olabilir. Süreç yüksek ateşle başlar; bir süre sonra tabloya hipertansiyon ve kalpte ritim bozuklukları (aritmiler) eklenir. Hastaların bir bölümü hızla gelişen beyin sapı kanaması sonrasında felç bulguları gelişemeden ölebilirler (ansızın ölüm).
| Farmakoloji ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. ⓘ |
Amfetaminin yan etkileri çok sayıda ve çeşitlidir ve kullanılan amfetamin miktarı yan etkilerin olasılığını ve şiddetini belirlemede birincil faktördür. Adderall, Dexedrine gibi amfetamin ürünleri ve bunların jenerik eşdeğerleri şu anda USFDA tarafından uzun süreli terapötik kullanım için onaylanmıştır. Amfetaminin eğlence amaçlı kullanımı genellikle çok daha büyük dozlar içerir ve bu dozlar tedavi amaçlı kullanılan dozajlara kıyasla ciddi advers ilaç etkileri açısından daha büyük risk taşır. ⓘ
Fiziksel
Kardiyovasküler yan etkiler arasında vazovagal yanıttan kaynaklanan hipertansiyon veya hipotansiyon, Raynaud fenomeni (ellere ve ayaklara kan akışının azalması) ve taşikardi (kalp atış hızının artması) yer alabilir. Erkeklerde cinsel yan etkiler erektil disfonksiyon, sık ereksiyon veya uzun süreli ereksiyonları içerebilir. Gastrointestinal yan etkiler karın ağrısı, kabızlık, ishal ve mide bulantısını içerebilir. Diğer potansiyel fiziksel yan etkiler arasında iştah kaybı, bulanık görme, ağız kuruluğu, aşırı diş gıcırdatma, burun kanaması, aşırı terleme, rinitis medicamentosa (ilaca bağlı burun tıkanıklığı), nöbet eşiğinde azalma, tikler (bir tür hareket bozukluğu) ve kilo kaybı sayılabilir. Tipik farmasötik dozlarda tehlikeli fiziksel yan etkiler nadirdir. ⓘ
Amfetamin, medüller solunum merkezlerini uyararak daha hızlı ve daha derin nefesler üretir. Terapötik dozlarda normal bir insanda bu etki genellikle fark edilmez, ancak solunum zaten tehlikeye girdiğinde belirgin olabilir. Amfetamin ayrıca idrarı kontrol eden kas olan idrar kesesi sfinkterinde kasılmaya neden olarak idrar yapma zorluğuna yol açabilir. Bu etki, yatak ıslatma ve mesane kontrolü kaybının tedavisinde faydalı olabilir. Amfetaminin gastrointestinal sistem üzerindeki etkileri öngörülemez. Bağırsak aktivitesi yüksekse, amfetamin gastrointestinal motiliteyi (içeriğin sindirim sistemi boyunca hareket etme hızı) azaltabilir; ancak, amfetamin kanalın düz kası gevşediğinde motiliteyi artırabilir. Amfetamin ayrıca hafif bir analjezik etkiye sahiptir ve opioidlerin ağrı kesici etkilerini artırabilir. ⓘ
USFDA tarafından 2011 yılında yapılan çalışmalar çocuklarda, genç yetişkinlerde ve yetişkinlerde ciddi advers kardiyovasküler olaylar (ani ölüm, kalp krizi ve inme) ile amfetamin veya diğer DEHB uyarıcılarının tıbbi kullanımı arasında bir ilişki olmadığını göstermektedir. Bununla birlikte, amfetamin ilaçları kardiyovasküler hastalığı olan bireylerde kontrendikedir. ⓘ
Psikolojik
Normal terapötik dozlarda, amfetaminin en yaygın psikolojik yan etkileri arasında uyanıklık, endişe, konsantrasyon, inisiyatif, özgüven ve sosyallik artışı, ruh hali dalgalanmaları (sevinçli ruh halini hafif depresif ruh hali izler), uykusuzluk veya uyanıklık ve yorgunluk hissinde azalma yer alır. Daha az görülen yan etkiler arasında anksiyete, libido değişikliği, büyüklenme, sinirlilik, tekrarlayıcı veya takıntılı davranışlar ve huzursuzluk yer alır; bu etkiler kullanıcının kişiliğine ve mevcut zihinsel durumuna bağlıdır. Ağır kullanıcılarda amfetamin psikozu (örn. sanrılar ve paranoya) ortaya çıkabilir. Çok nadir olmakla birlikte, bu psikoz uzun süreli tedavi sırasında terapötik dozlarda da ortaya çıkabilir. USFDA'ya göre, uyarıcıların agresif davranış veya düşmanlık ürettiğine dair "sistematik bir kanıt yoktur". ⓘ
Amfetaminin ayrıca terapötik dozlar alan insanlarda koşullu bir yer tercihi ürettiği gösterilmiştir, yani bireyler daha önce amfetamin kullandıkları yerlerde zaman geçirmeyi tercih ederler. ⓘ
Pekiştirme bozuklukları
Bağımlılık
| Bağımlılık ve bağımlılık sözlüğü ⓘ | |
|---|---|
| |
| Transkripsiyon faktörü sözlüğü ⓘ | |
|---|---|
| |
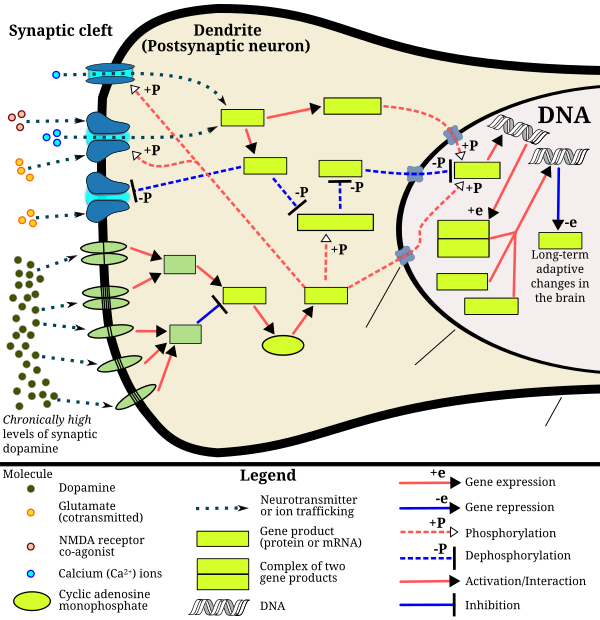
Amfetamin bağımlılığına yol açan çekirdek akumbensindeki sinyal kaskadı
Bu diyagram, beynin ödül merkezinde, amfetamin, metamfetamin ve fenetilamin gibi sinaptik dopamin konsantrasyonunu artıran psikostimülanlara kronik yüksek dozda maruz kalmanın neden olduğu sinyal olaylarını tasvir etmektedir. Bu tür psikostimülanlar tarafından presinaptik dopamin ve glutamatın birlikte salınımını takiben, bu nörotransmiterler için postsinaptik reseptörler, sonuçta CREB fosforilasyonunun artmasıyla sonuçlanan cAMP'ye bağlı bir yol ve kalsiyuma bağlı bir yol aracılığıyla dahili sinyal olaylarını tetikler. Fosforile CREB, ΔFosB seviyelerini artırır ve bu da corepressors yardımıyla c-Fos genini baskılar; c-Fos baskısı, nöronda ΔFosB birikimini sağlayan moleküler bir anahtar görevi görür. Nöronlarda 1-2 ay boyunca kalıcı olan oldukça kararlı (fosforlanmış) bir ΔFosB formu, bu süreç yoluyla uyarıcılara tekrar tekrar yüksek dozda maruz kalmanın ardından yavaşça birikir. ΔFosB, beyinde bağımlılıkla ilgili yapısal değişiklikler üreten "ana kontrol proteinlerinden biri" olarak işlev görür ve yeterli birikimin ardından, aşağı akış hedeflerinin (örneğin, nükleer faktör kappa B) yardımıyla bağımlılık yaratan bir duruma neden olur. ⓘ
|
Bağımlılık, ağır eğlence amaçlı amfetamin kullanımında ciddi bir risktir, ancak terapötik dozlarda uzun süreli tıbbi kullanımdan kaynaklanması olası değildir; aslında, çocukluk döneminde başlayan DEHB için ömür boyu uyarıcı tedavi, yetişkin olarak madde kullanım bozuklukları geliştirme riskini azaltır. Ventral tegmental alanı nükleus akumbens'e bağlayan bir dopamin yolu olan mezolimbik yolun patolojik aşırı aktivasyonu, amfetamin bağımlılığında merkezi bir rol oynar. Sıklıkla yüksek dozda amfetamini kendi kendine uygulayan bireylerin amfetamin bağımlılığı geliştirme riski yüksektir, çünkü yüksek dozlarda kronik kullanım, bağımlılık için bir "moleküler anahtar" ve "ana kontrol proteini" olan accumbal ΔFosB seviyesini kademeli olarak artırır. Nucleus accumbens ΔFosB yeterince aşırı eksprese edildiğinde, ekspresyonunda daha fazla artışla bağımlılık davranışının şiddetini (yani, kompulsif ilaç arayışı) artırmaya başlar. Şu anda amfetamin bağımlılığını tedavi etmek için etkili bir ilaç bulunmamakla birlikte, düzenli olarak sürekli aerobik egzersiz yapmanın böyle bir bağımlılık geliştirme riskini azalttığı görülmektedir. Düzenli olarak sürdürülen aerobik egzersiz de amfetamin bağımlılığı için etkili bir tedavi gibi görünmektedir; egzersiz terapisi klinik tedavi sonuçlarını iyileştirir ve bağımlılık için davranışsal tedavilere ek bir tedavi olarak kullanılabilir. ⓘ
Biyomoleküler mekanizmalar
Aşırı dozlarda amfetaminin kronik kullanımı, mezokortikolimbik projeksiyonda transkripsiyonel ve epigenetik mekanizmalar yoluyla ortaya çıkan gen ifadesinde değişikliklere neden olur. Bu değişiklikleri üreten en önemli transkripsiyon faktörleri Delta FBJ murin osteosarkom viral onkogen homolog B (ΔFosB), cAMP yanıt elemanı bağlayıcı protein (CREB) ve nükleer faktör-kappa B'dir (NF-κB). ΔFosB bağımlılıktaki en önemli biyomoleküler mekanizmadır çünkü nükleus akumbens'teki D1 tipi orta dikenli nöronlarda ΔFosB aşırı ekspresyonu (yani, belirgin bir genle ilişkili fenotip üreten anormal derecede yüksek bir gen ekspresyonu seviyesi) nöral adaptasyonların çoğu için gerekli ve yeterlidir ve bağımlılıkta yer alan çoklu davranışsal etkileri (örneğin, ödül duyarlılığı ve artan ilaç kendi kendine yönetimi) düzenler. ΔFosB yeterince aşırı eksprese edildiğinde, ΔFosB ekspresyonunda daha fazla artışla giderek daha şiddetli hale gelen bağımlılık yaratan bir duruma neden olur. Diğerlerinin yanı sıra alkol, kannabinoidler, kokain, metilfenidat, nikotin, opioidler, fensiklidin, propofol ve ikame edilmiş amfetaminlere bağımlılıkla ilişkilendirilmiştir. ⓘ
Bir transkripsiyon faktörü olan ΔJunD ve bir histon metiltransferaz enzimi olan G9a, hem ΔFosB'nin işlevine karşı çıkar hem de ifadesinin artmasını engeller. Çekirdekte ΔJunD'nin viral vektörlerle yeterince aşırı eksprese edilmesi, kronik uyuşturucu kullanımında görülen sinirsel ve davranışsal değişikliklerin çoğunu tamamen engelleyebilir (yani, ΔFosB'nin aracılık ettiği değişiklikler). Benzer şekilde, accumbal G9a hiperekspresyonu, histon 3 lizin kalıntısı 9 dimetilasyonunun (H3K9me2) belirgin şekilde artmasına neden olur ve ΔFosB için transkripsiyon faktörlerinin H3K9me2 aracılı baskılanması ve çeşitli ΔFosB transkripsiyon hedeflerinin (örneğin CDK5) H3K9me2 aracılı baskılanması yoluyla meydana gelen kronik ilaç kullanımıyla ΔFosB aracılı nöral ve davranışsal plastisitenin indüksiyonunu bloke eder. ΔFosB ayrıca lezzetli yiyecekler, seks ve egzersiz gibi doğal ödüllere verilen davranışsal tepkilerin düzenlenmesinde de önemli bir rol oynar. Hem doğal ödüller hem de bağımlılık yapan ilaçlar ΔFosB ifadesini indüklediğinden (yani, beynin daha fazla üretmesine neden olduklarından), bu ödüllerin kronik olarak elde edilmesi benzer bir patolojik bağımlılık durumuna neden olabilir. Sonuç olarak, ΔFosB hem amfetamin bağımlılığında hem de aşırı cinsel aktivite ve amfetamin kullanımından kaynaklanan zorlayıcı cinsel davranışlar olan amfetamin kaynaklı cinsel bağımlılıklarda yer alan en önemli faktördür. Bu cinsel bağımlılıklar, dopaminerjik ilaçlar alan bazı hastalarda ortaya çıkan dopamin düzensizliği sendromu ile ilişkilidir. ⓘ
Amfetaminin gen düzenlemesi üzerindeki etkileri hem doza hem de yola bağlıdır. Gen düzenlemesi ve bağımlılık üzerine yapılan araştırmaların çoğu, çok yüksek dozlarda intravenöz amfetamin uygulaması ile yapılan hayvan çalışmalarına dayanmaktadır. Eşdeğer (ağırlığa göre ayarlanmış) insan terapötik dozları ve oral uygulama kullanan az sayıdaki çalışma, bu değişikliklerin, eğer meydana geliyorlarsa, nispeten küçük olduğunu göstermektedir. Bu, amfetaminin tıbbi kullanımının gen düzenlemesini önemli ölçüde etkilemediğini göstermektedir. ⓘ
Farmakolojik tedaviler
Aralık 2019 itibarıyla, amfetamin bağımlılığı için etkili bir farmakoterapi bulunmamaktadır. 2015 ve 2016 yıllarında yapılan incelemeler, TAAR1-seçici agonistlerin psikostimülan bağımlılıkları için bir tedavi olarak önemli bir terapötik potansiyele sahip olduğunu göstermiştir; ancak Şubat 2016 itibariyle, TAAR1-seçici agonist olarak işlev gördüğü bilinen tek bileşikler deneysel ilaçlardır. Amfetamin bağımlılığına büyük ölçüde dopamin reseptörlerinin ve çekirdek akumbensindeki birlikte lokalize NMDA reseptörlerinin artan aktivasyonu aracılık eder; magnezyum iyonları reseptör kalsiyum kanalını bloke ederek NMDA reseptörlerini inhibe eder. Bir inceleme, hayvanlar üzerinde yapılan testlere dayanarak, patolojik (bağımlılık yaratan) psikostimülan kullanımının beyindeki hücre içi magnezyum seviyesini önemli ölçüde azalttığını öne sürmüştür. Ek magnezyum tedavisinin insanlarda amfetamin kendi kendine uygulamasını (yani kendi kendine verilen dozları) azalttığı gösterilmiştir, ancak amfetamin bağımlılığı için etkili bir monoterapi değildir. ⓘ
2019'da yapılan sistematik bir inceleme ve meta-analiz, amfetamin ve metamfetamin bağımlılığı için randomize kontrollü çalışmalarda (RKÇ) kullanılan 17 farklı farmakoterapinin etkinliğini değerlendirmiş; metilfenidatın amfetamin veya metamfetamin kendi kendine uygulamasını azaltabileceğine dair yalnızca düşük güçlü kanıtlar bulmuştur. Antidepresanları (bupropion, mirtazapin, sertralin) içeren RKÇ'lerde kullanılan diğer ilaçların çoğu için fayda sağlamadığına dair düşük ila orta güçte kanıtlar vardı, antipsikotikler (aripiprazol), antikonvülzanlar (topiramat, baklofen, gabapentin), naltrekson, vareniklin, sitikolin, ondansetron, prometa, riluzol, atomoksetin, dekstroamfetamin ve modafinil. ⓘ
Davranışsal tedaviler
Amfetamin, metamfetamin veya kokain bağımlılığı için 12 farklı psikososyal müdahaleyi içeren 50 çalışmanın 2018 sistematik incelemesi ve ağ meta-analizi, hem durumsallık yönetimi hem de toplum pekiştirme yaklaşımı ile kombinasyon tedavisinin en yüksek etkinliğe (yani, yoksunluk oranı) ve kabul edilebilirliğe (yani, en düşük bırakma oranı) sahip olduğunu bulmuştur. Analizde incelenen diğer tedavi yöntemleri arasında durumsallık yönetimi veya toplum pekiştirme yaklaşımı ile monoterapi, bilişsel davranışçı terapi, 12 adımlı programlar, durumsal olmayan ödül temelli terapiler, psikodinamik terapi ve bunları içeren diğer kombinasyon terapileri yer almaktadır. ⓘ
Ayrıca, fiziksel egzersizin nörobiyolojik etkileri üzerine yapılan araştırmalar, günlük aerobik egzersizin, özellikle de dayanıklılık egzersizinin (örneğin maraton koşusu) uyuşturucu bağımlılığının gelişmesini önlediğini ve amfetamin bağımlılığı için etkili bir yardımcı tedavi (yani tamamlayıcı bir tedavi) olduğunu göstermektedir. Egzersiz, özellikle psikostimülan bağımlılıkları için ek tedavi olarak kullanıldığında daha iyi tedavi sonuçlarına yol açmaktadır. Özellikle aerobik egzersiz, psikostimülan kendi kendine uygulamayı azaltır, uyuşturucu arayışının eski haline dönmesini (yani nüksetmesini) azaltır ve striatumda dopamin reseptörü D2 (DRD2) yoğunluğunun artmasına neden olur. Bu, striatal DRD2 yoğunluğunun azalmasına neden olan patolojik uyarıcı kullanımının tam tersidir. Bir derleme, egzersizin striatumda veya ödül sisteminin diğer bölümlerinde ΔFosB veya c-Fos immünoreaktivitesini değiştirerek uyuşturucu bağımlılığının gelişmesini de önleyebileceğini belirtmiştir. ⓘ
| Nöroplastisite biçimi veya davranışsal plastisite |
Pekiştireç türü | Kaynaklar ⓘ | |||||
|---|---|---|---|---|---|---|---|
| Opiatlar | Psikostimülanlar | Yüksek yağlı veya şekerli yiyecekler | Cinsel ilişki | Fiziksel egzersiz (aerobik) |
Çevresel zengi̇nleşti̇rme | ||
| ΔFosB ekspresyonu nucleus accumbens D1 tipi MSN'ler |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Davranışsal esneklik | |||||||
| Alım miktarının artması | Evet | Evet | Evet | ||||
| Psikostimülan çapraz duyarlılaştırma |
Evet | Geçerli değil | Evet | Evet | Zayıflatılmış | Zayıflatılmış | |
| Psikostimülan kendi kendine yönetim |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Psikostimülan koşullu yer tercihi |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| Uyuşturucu arama davranışının eski haline dönmesi | ↑ | ↑ | ↓ | ↓ | |||
| Nörokimyasal plastisite | |||||||
| CREB fosforilasyonu çekirdek akumbensinde |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Hassaslaştırılmış dopamin yanıtı çekirdek akumbensinde |
Hayır | Evet | Hayır | Evet | |||
| Değişmiş striatal dopamin sinyali | ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD2 | ↑DRD2 | ||
| Değişmiş striatal opioid sinyali | Değişiklik yok veya ↑μ-opioid reseptörleri |
↑μ-opioid reseptörleri ↑κ-opioid reseptörleri |
↑μ-opioid reseptörleri | ↑μ-opioid reseptörleri | Değişiklik yok | Değişiklik yok | |
| Striatal opioid peptidlerdeki değişiklikler | ↑dynorphin Değişiklik yok: enkefalin |
↑dynorphin | ↓enkephalin | ↑dynorphin | ↑dynorphin | ||
| Mezokortikolimbik sinaptik plastisite | |||||||
| Nucleus accumbens'teki dendrit sayısı | ↓ | ↑ | ↑ | ||||
| Dendritik omurga yoğunluğu nucleus accumbens |
↓ | ↑ | ↑ | ||||
Bağımlılık ve yoksunluk
Amfetamin kötüye kullanımında (yani eğlence amaçlı amfetamin kullanımında) ilaç toleransı hızla gelişir, bu nedenle uzun süreli kötüye kullanım dönemleri aynı etkiyi elde etmek için giderek daha yüksek dozda ilaç gerektirir. Zorunlu olarak amfetamin ve metamfetamin kullanan bireylerde yoksunluk üzerine yapılan bir Cochrane incelemesine göre, "kronik ağır kullanıcılar amfetamin kullanımını aniden bıraktığında, birçoğu son dozlarından sonraki 24 saat içinde ortaya çıkan zaman sınırlı bir yoksunluk sendromu bildirmektedir." Bu inceleme, kronik, yüksek doz kullanıcılarında yoksunluk belirtilerinin sık görüldüğünü, vakaların yaklaşık %88'inde ortaya çıktığını ve ilk hafta boyunca belirgin bir "çökme" aşamasıyla birlikte 3-4 hafta devam ettiğini belirtmiştir. Amfetamin yoksunluk belirtileri arasında anksiyete, uyuşturucu özlemi, depresif ruh hali, yorgunluk, iştah artışı, hareket artışı veya hareket azalması, motivasyon eksikliği, uykusuzluk veya uykululuk ve berrak rüyalar yer alabilir. İnceleme, yoksunluk belirtilerinin şiddetinin bireyin yaşı ve bağımlılığının derecesi ile pozitif ilişkili olduğunu göstermiştir. Terapötik dozlarda amfetamin tedavisinin kesilmesinden kaynaklanan hafif yoksunluk semptomları, dozun azaltılmasıyla önlenebilir. ⓘ
Aşırı doz
Amfetamin doz aşımı birçok farklı belirtiye yol açabilir, ancak uygun bakımla nadiren ölümcüldür. Doz aşımı semptomlarının şiddeti dozajla birlikte artar ve amfetamine karşı ilaç toleransı ile azalır. Toleranslı bireylerin günde 5 grama kadar amfetamin aldığı bilinmektedir, bu da maksimum günlük terapötik dozun yaklaşık 100 katıdır. Orta ve aşırı doz aşımının belirtileri aşağıda listelenmiştir; ölümcül amfetamin zehirlenmesi genellikle konvülsiyon ve komayı da içerir. 2013 yılında, amfetamin, metamfetamin ve "amfetamin kullanım bozukluğu" ile ilişkili diğer bileşiklerin aşırı dozda alınması dünya çapında tahmini 3.788 ölümle sonuçlanmıştır (3.425-4.145 ölüm, %95 güven). ⓘ
| Sistem | Hafif veya orta derecede aşırı doz | Şiddetli doz aşımı ⓘ |
|---|---|---|
| Kardiyovasküler |
|
|
| Merkezi sinir sistem |
|
|
| Kas İskelet Sistemi |
|
|
| Solunum |
|
|
| İdrar |
|
|
| Diğer |
|
|
Toksisite
Kemirgenlerde ve primatlarda, yeterince yüksek amfetamin dozları dopaminerjik nörotoksisiteye veya dopamin terminal dejenerasyonu ve azalmış taşıyıcı ve reseptör fonksiyonu ile karakterize edilen dopamin nöronlarında hasara neden olur. Amfetaminin insanlarda doğrudan nörotoksik olduğuna dair bir kanıt yoktur. Bununla birlikte, yüksek dozda amfetamin hiperpireksi, reaktif oksijen türlerinin aşırı oluşumu ve dopaminin artan otoksidasyonu sonucunda dolaylı olarak dopaminerjik nörotoksisiteye neden olabilir. Yüksek doz amfetamin maruziyetinden kaynaklanan nörotoksisitenin hayvan modelleri, amfetamin kaynaklı nörotoksisitenin gelişmesi için hiperpireksi (yani, çekirdek vücut sıcaklığı ≥ 40 °C) oluşumunun gerekli olduğunu göstermektedir. Beyin sıcaklığının 40 °C'nin üzerinde uzun süreli yükselmesi, reaktif oksijen türlerinin üretimini kolaylaştırarak, hücresel protein işlevini bozarak ve kan-beyin bariyeri geçirgenliğini geçici olarak artırarak laboratuvar hayvanlarında amfetamin kaynaklı nörotoksisitenin gelişimini muhtemelen teşvik eder. ⓘ
Psikoz
Amfetamin doz aşımı, sanrılar ve paranoya gibi çeşitli semptomları içerebilen uyarıcı bir psikozla sonuçlanabilir. Amfetamin, dekstroamfetamin ve metamfetamin psikozu tedavisine ilişkin bir Cochrane incelemesi, kullanıcıların yaklaşık %5-15'inin tamamen iyileşemediğini belirtmektedir. Aynı derlemeye göre, antipsikotik ilaçların akut amfetamin psikozu semptomlarını etkili bir şekilde çözdüğünü gösteren en az bir çalışma vardır. Psikoz nadiren terapötik kullanımdan kaynaklanır. ⓘ
İlaç etkileşimleri
Birçok madde türünün amfetamin ile etkileşime girdiği bilinmektedir, bu da amfetaminin, etkileşime giren maddenin veya her ikisinin ilaç etkisinin veya metabolizmasının değişmesine neden olur. Amfetamini metabolize eden enzimlerin (örn. CYP2D6 ve FMO3) inhibitörleri, amfetaminin eliminasyon yarı ömrünü uzatacak, yani etkileri daha uzun sürecektir. Amfetamin ayrıca MAOI'lerle, özellikle monoamin oksidaz A inhibitörleriyle etkileşime girer, çünkü hem MAOI'ler hem de amfetamin plazma katekolaminlerini (yani norepinefrin ve dopamin) artırır; bu nedenle, her ikisinin aynı anda kullanılması tehlikelidir. Amfetamin çoğu psikoaktif ilacın aktivitesini modüle eder. Özellikle amfetamin, sakinleştirici ve depresanların etkilerini azaltabilir ve uyarıcıların ve antidepresanların etkilerini artırabilir. Amfetamin ayrıca sırasıyla kan basıncı ve dopamin üzerindeki etkileri nedeniyle antihipertansiflerin ve antipsikotiklerin etkilerini azaltabilir. Çinko takviyesi, DEHB tedavisi için kullanıldığında amfetaminin minimum etkili dozunu azaltabilir. ⓘ
Genel olarak, amfetamin gıda ile tüketildiğinde önemli bir etkileşim yoktur, ancak gastrointestinal içeriğin ve idrarın pH'ı sırasıyla amfetaminin emilimini ve atılımını etkiler. Asidik maddeler amfetaminin emilimini azaltır ve idrarla atılımını artırır, alkali maddeler ise tam tersini yapar. Amfetamin, pH'ın emilim üzerindeki etkisi nedeniyle, gastrointestinal pH'ı artıran (yani daha az asidik hale getiren) proton pompası inhibitörleri ve H2 antihistaminikler gibi gastrik asit azaltıcılarla da etkileşime girer. ⓘ
Farmakoloji
Farmakodinamik
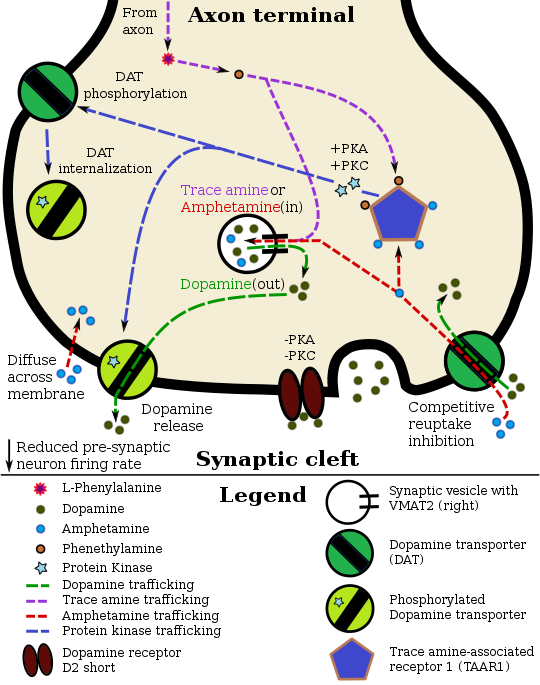
Bir dopamin nöronunda amfetaminin farmakodinamiği
Amfetamin presinaptik nörona nöronal membran boyunca veya DAT yoluyla girer. İçeri girdikten sonra TAAR1'e bağlanır veya VMAT2 aracılığıyla sinaptik veziküllere girer. Amfetamin VMAT2 yoluyla sinaptik veziküllere girdiğinde, veziküler pH gradyanını çökertir ve bu da dopaminin VMAT2 yoluyla sitozole (açık ten rengi alan) salınmasına neden olur. Amfetamin TAAR1'e bağlandığında, potasyum kanalları yoluyla dopamin nöronunun ateşleme hızını azaltır ve protein kinaz A (PKA) ve protein kinaz C'yi (PKC) aktive eder, bu da daha sonra DAT'ı fosforile eder. PKA-fosforilasyonu DAT'ın presinaptik nöron içine çekilmesine (internalize olmasına) ve taşınmayı durdurmasına neden olur. PKC-fosforlanmış DAT ya ters yönde çalışabilir ya da PKA-fosforlanmış DAT gibi içselleşip taşınmayı durdurabilir. Amfetaminin ayrıca CAMKIIα'ya bağlı bir yol aracılığıyla DAT fosforilasyonu ile ilişkili bir etki olan hücre içi kalsiyumu artırdığı ve bunun sonucunda dopamin çıkışı ürettiği bilinmektedir. ⓘ
|
Amfetamin davranışsal etkilerini, monoaminlerin beyindeki nöronal sinyaller olarak kullanımını değiştirerek, öncelikle beynin ödül ve yürütme işlevi yollarındaki katekolamin nöronlarında gösterir. Ödül devresinde ve yürütme işlevinde yer alan ana nörotransmitterler olan dopamin ve norepinefrin konsantrasyonları, monoamin taşıyıcıları üzerindeki etkileri nedeniyle amfetamin tarafından doza bağlı bir şekilde önemli ölçüde artar. Amfetaminin pekiştirici ve motivasyonel belirginliği artırıcı etkileri çoğunlukla mezolimbik yoldaki dopaminerjik aktivitenin artmasından kaynaklanmaktadır. Amfetaminin öforik ve lokomotor uyarıcı etkileri, striatumdaki sinaptik dopamin ve norepinefrin konsantrasyonlarını artırma büyüklüğüne ve hızına bağlıdır. ⓘ
Amfetamin, 2001 yılında keşfedilen ve beyin monoaminlerinin düzenlenmesi için önemli olan Gs-bağlı ve Gq-bağlı bir G protein-bağlı reseptör (GPCR) olan iz amin-bağlı reseptör 1'in (TAAR1) güçlü bir tam agonisti olarak tanımlanmıştır. TAAR1'in aktivasyonu, adenilil siklaz aktivasyonu yoluyla cAMP üretimini artırır ve monoamin taşıyıcı fonksiyonunu inhibe eder. Monoamin otoreseptörleri (örn. kısa D2, presinaptik α2 ve presinaptik 5-HT1A) TAAR1'in zıt etkisine sahiptir ve bu reseptörler birlikte monoaminler için düzenleyici bir sistem sağlar. Özellikle, amfetamin ve eser aminler TAAR1 için yüksek bağlanma afinitelerine sahiptir, ancak monoamin otoreseptörleri için değildir. Görüntüleme çalışmaları, amfetamin ve eser aminler tarafından monoamin geri alım inhibisyonunun bölgeye özgü olduğunu ve ilişkili monoamin nöronlarında TAAR1 ko-lokalizasyonunun varlığına bağlı olduğunu göstermektedir. ⓘ
Nöronal monoamin taşıyıcılarına ek olarak, amfetamin ayrıca hem veziküler monoamin taşıyıcılarını, VMAT1 ve VMAT2'yi hem de SLC1A1, SLC22A3 ve SLC22A5'i inhibe eder. SLC1A1, nöronlarda bulunan bir glutamat taşıyıcısı olan eksitatör amino asit taşıyıcısı 3 (EAAT3), SLC22A3 astrositlerde bulunan bir ekstranöronal monoamin taşıyıcısı ve SLC22A5 yüksek afiniteli bir karnitin taşıyıcısıdır. Amfetaminin, beslenme davranışı, stres ve ödülle ilgili bir nöropeptid olan kokain ve amfetaminle düzenlenen transkript (CART) gen ekspresyonunu güçlü bir şekilde indüklediği ve in vitro nöronal gelişim ve sağkalımda gözlemlenebilir artışlara neden olduğu bilinmektedir. CART reseptörü henüz tanımlanmamıştır, ancak CART'ın benzersiz bir Gi/Go-bağlı GPCR'ye bağlandığına dair önemli kanıtlar vardır. Amfetamin ayrıca çok yüksek dozlarda monoamin oksidazları inhibe ederek daha az monoamin ve eser amin metabolizmasına ve dolayısıyla daha yüksek sinaptik monoamin konsantrasyonlarına neden olur. İnsanlarda, amfetaminin bağlandığı bilinen tek post-sinaptik reseptör 5-HT1A reseptörüdür ve burada düşük mikromolar afiniteye sahip bir agonist olarak hareket eder. ⓘ
Amfetaminin insanlardaki kısa vadeli uyuşturucu etkilerinin tam profili, çoğunlukla CART, 5-HT1A, EAAT3, TAAR1, VMAT1, VMAT2 ve muhtemelen diğer biyolojik hedeflerle etkileşimler yoluyla etkilediği dopamin, serotonin, norepinefrin, epinefrin, histamin, CART peptidleri, endojen opioidler, adrenokortikotropik hormon, kortikosteroidler ve glutamatın artan hücresel iletişimi veya nörotransmisyonu yoluyla elde edilir. Amfetamin ayrıca, birçoğu insan beyninde ifade edilen yedi insan karbonik anhidraz enzimini aktive eder. ⓘ
Dekstroamfetamin, TAAR1'in levoamfetamine göre daha güçlü bir agonistidir. Sonuç olarak, dekstroamfetamin levoamfetaminden daha fazla, yaklaşık üç ila dört kat daha fazla MSS uyarımı üretir, ancak levoamfetamin biraz daha güçlü kardiyovasküler ve periferik etkilere sahiptir. ⓘ
Dopamin
Belirli beyin bölgelerinde, amfetamin sinaptik yarıktaki dopamin konsantrasyonunu artırır. Amfetamin presinaptik nörona ya DAT yoluyla ya da doğrudan nöronal membran boyunca difüze olarak girebilir. DAT alımının bir sonucu olarak, amfetamin taşıyıcıda rekabetçi geri alım inhibisyonu oluşturur. Amfetamin, presinaptik nörona girdikten sonra, protein kinaz A (PKA) ve protein kinaz C (PKC) sinyalleri yoluyla DAT fosforilasyonuna neden olan TAAR1'i aktive eder. Her iki protein kinaz tarafından fosforilasyon, DAT'ın içselleştirilmesine (rekabetçi olmayan geri alım inhibisyonu) neden olabilir, ancak PKC aracılı fosforilasyon tek başına DAT yoluyla dopamin taşınmasının tersine çevrilmesine neden olur (yani, dopamin çıkışı). Amfetaminin ayrıca, tanımlanamayan bir Ca2+/kalmodulin bağımlı protein kinaz (CAMK)-bağımlı yol aracılığıyla DAT fosforilasyonu ile ilişkili bir etki olan hücre içi kalsiyumu arttırdığı ve bunun sonucunda dopamin çıkışı ürettiği bilinmektedir. TAAR1, G proteinine bağlı içe doğru düzeltici potasyum kanallarının doğrudan aktivasyonu yoluyla, dopamin nöronlarının ateşleme hızını azaltarak hiper-dopaminerjik bir durumu önler. ⓘ
Amfetamin ayrıca presinaptik veziküler monoamin taşıyıcı VMAT2 için de bir substrattır. VMAT2'de amfetamin alımını takiben, amfetamin veziküler pH gradyanının çökmesine neden olur, bu da dopamin moleküllerinin sinaptik veziküllerden VMAT2 yoluyla dopamin çıkışı yoluyla sitozole salınmasına neden olur. Daha sonra, sitozolik dopamin molekülleri presinaptik nörondan DAT'ta ters taşıma yoluyla sinaptik yarığa salınır. ⓘ
Norepinefrin
Dopamine benzer şekilde, amfetamin de epinefrinin doğrudan öncüsü olan sinaptik norepinefrin seviyesini doza bağlı olarak artırır. Nöronal TAAR1 mRNA ekspresyonuna dayanarak, amfetaminin norepinefrini dopamine benzer şekilde etkilediği düşünülmektedir. Başka bir deyişle, amfetamin fosforile NET'te TAAR1 aracılı akış ve rekabetçi olmayan geri alım inhibisyonunu, rekabetçi NET geri alım inhibisyonunu ve VMAT2'den norepinefrin salınımını indükler. ⓘ
Serotonin
Amfetamin, dopamin ve norepinefrin üzerinde olduğu gibi serotonin üzerinde de benzer, ancak daha az belirgin etkiler gösterir. Amfetamin serotonini VMAT2 yoluyla etkiler ve norepinefrin gibi SERT'i TAAR1 yoluyla fosforile ettiği düşünülmektedir. Dopamin gibi, amfetamin de insan 5-HT1A reseptöründe düşük, mikromolar afiniteye sahiptir. ⓘ
Diğer nörotransmitterler, peptidler, hormonlar ve enzimler
| Enzim | KA (nM) | Kaynaklar ⓘ |
|---|---|---|
| hCA4 | 94 | |
| hCA5A | 810 | |
| hCA5B | 2560 | |
| hCA7 | 910 | |
| hCA12 | 640 | |
| hCA13 | 24100 | |
| hCA14 | 9150 |
İnsanlarda akut amfetamin uygulaması, ödül sistemindeki çeşitli beyin yapılarında endojen opioid salınımını artırır. Beyindeki birincil uyarıcı nörotransmitter olan glutamatın hücre dışı seviyelerinin, amfetamine maruz kaldıktan sonra striatumda arttığı gösterilmiştir. Hücre dışı glutamattaki bu artış muhtemelen dopamin nöronlarında bir glutamat geri alım taşıyıcısı olan EAAT3'ün amfetaminle indüklenen içselleştirilmesi yoluyla gerçekleşir. Amfetamin ayrıca mast hücrelerinden seçici histamin salınımını ve VMAT2 yoluyla histaminerjik nöronlardan çıkışı indükler. Akut amfetamin uygulaması ayrıca hipotalamik-hipofiz-adrenal ekseni uyararak kan plazmasındaki adrenokortikotropik hormon ve kortikosteroid seviyelerini artırabilir. ⓘ
Aralık 2017'de, amfetamin ve insan karbonik anhidraz enzimleri arasındaki etkileşimi değerlendiren ilk çalışma yayınlanmıştır; incelenen on bir karbonik anhidraz enziminden, amfetaminin, dördü insan beyninde yüksek oranda ifade edilen yedi tanesini, düşük nanomolar ile düşük mikromolar aktive edici etkilerle güçlü bir şekilde aktive ettiği bulunmuştur. Klinik öncesi araştırmalara dayanarak, serebral karbonik anhidraz aktivasyonunun bilişi artırıcı etkileri vardır; ancak, karbonik anhidraz inhibitörlerinin klinik kullanımına dayanarak, diğer dokulardaki karbonik anhidraz aktivasyonu, glokomu şiddetlendiren oküler aktivasyon gibi olumsuz etkilerle ilişkili olabilir. ⓘ
Farmakokinetik
Amfetaminin oral biyoyararlanımı gastrointestinal pH ile değişir; bağırsaktan iyi emilir ve biyoyararlanım dekstroamfetamin için tipik olarak %75'in üzerindedir. Amfetamin, pKa değeri 9,9 olan zayıf bir bazdır; sonuç olarak, pH bazik olduğunda, ilacın daha fazlası lipitte çözünebilen serbest baz formundadır ve bağırsak epitelinin lipit bakımından zengin hücre membranlarından daha fazlası emilir. Tersine, asidik bir pH ilacın ağırlıklı olarak suda çözünen katyonik (tuz) formda olduğu ve daha az emildiği anlamına gelir. Kan dolaşımında dolaşan amfetaminin yaklaşık %20'si plazma proteinlerine bağlıdır. Emilimi takiben, amfetamin vücuttaki çoğu dokuya kolayca dağılır ve yüksek konsantrasyonlar beyin omurilik sıvısı ve beyin dokusunda meydana gelir. ⓘ
Amfetamin enantiyomerlerinin yarı ömürleri farklıdır ve idrar pH'ına göre değişir. Normal idrar pH'ında dekstroamfetamin ve levoamfetaminin yarı ömürleri sırasıyla 9-11 saat ve 11-14 saattir. Yüksek asidik idrar enantiyomer yarı ömürlerini 7 saate düşürür; yüksek alkali idrar ise yarı ömürleri 34 saate kadar artırır. Her iki izomerin tuzlarının hemen salınan ve uzatılmış salınan varyantları, dozdan sonra sırasıyla 3 saat ve 7 saatte pik plazma konsantrasyonlarına ulaşır. Amfetamin böbrekler yoluyla atılır ve normal idrar pH'ında ilacın %30-40'ı değişmeden atılır. İdrar pH'ı bazik olduğunda, amfetamin serbest baz formundadır, bu nedenle daha az atılır. İdrar pH'ı anormal olduğunda, amfetaminin idrarla geri kazanımı, çoğunlukla idrarın sırasıyla çok bazik veya asidik olmasına bağlı olarak, %1'den %75'e kadar değişebilir. Oral uygulamayı takiben, amfetamin idrarda 3 saat içinde görülür. Yutulan amfetaminin yaklaşık %90'ı son oral dozdan 3 gün sonra atılır. ⓘ
Lisdexamfetamin dekstroamfetaminin bir ön ilacıdır. Gastrointestinal sistemde emilirken pH'a amfetamin kadar duyarlı değildir. Kan dolaşımına emilimini takiben, lisdexamfetamin kırmızı kan hücreleri tarafından belirlenemeyen aminopeptidaz enzimleri aracılığıyla hidroliz yoluyla tamamen dekstroamfetamin ve amino asit L-lizine dönüştürülür. Bu, lisdexamfetaminin biyoaktivasyonunda hız sınırlayıcı adımdır. Lisdexamfetaminin eliminasyon yarı ömrü genellikle 1 saatten azdır. Lisdexamfetaminin dekstroamfetamine gerekli dönüşümü nedeniyle, lisdexamfetamin ile dekstroamfetamin seviyeleri, eşdeğer dozda hemen salınan dekstroamfetamine göre yaklaşık bir saat sonra pik yapar. Muhtemelen kırmızı kan hücreleri tarafından sınırlı aktivasyonu nedeniyle, lisdexamfetaminin intravenöz uygulaması, eşdeğer bir dekstroamfetamin dozunun intravenöz uygulamasına kıyasla büyük ölçüde gecikmiş pik zamanı ve düşük pik seviyeleri gösterir. Lisdexamfetaminin farmakokinetiği, oral, intranazal veya intravenöz olarak uygulanmasına bakılmaksızın benzerdir. Bu nedenle, dekstroamfetaminin aksine, parenteral kullanım lisdexamfetaminin subjektif etkilerini artırmaz. Bir ön ilaç olarak davranışı ve farmakokinetik farklılıkları nedeniyle lisdexamfetamin, hemen salınımlı dekstroamfetamine göre daha uzun bir terapötik etki süresine sahiptir ve daha düşük kötüye kullanım potansiyeli gösterir. ⓘ
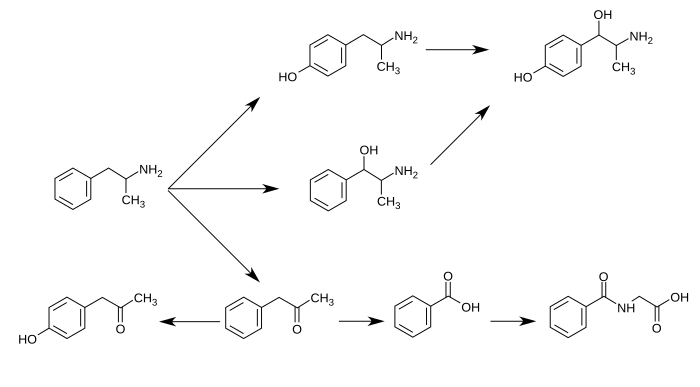
CYP2D6, dopamin β-hidroksilaz (DBH), flavin içeren monooksijenaz 3 (FMO3), bütirat-CoA ligaz (XM-ligaz) ve glisin N-açiltransferaz (GLYAT) insanlarda amfetamin veya metabolitlerini metabolize ettiği bilinen enzimlerdir. Amfetamin, 4-hidroksiamfetamin, 4-hidroksinorefedrin, 4-hidroksifenilaseton, benzoik asit, hippurik asit, norefedrin ve fenilaseton dahil olmak üzere çeşitli metabolik ürünlere sahiptir. Bu metabolitler arasında aktif sempatomimetikler 4-hidroksiamfetamin, 4-hidroksinorefedrin ve norefedrindir. Ana metabolik yollar aromatik para-hidroksilasyon, alifatik alfa ve beta-hidroksilasyon, N-oksidasyon, N-dealkilasyon ve deaminasyonu içerir. İnsanlarda bilinen metabolik yollar, tespit edilebilir metabolitler ve metabolize edici enzimler aşağıdakileri içerir:
İnsanlarda amfetaminin metabolik yolları
Amfetaminin birincil aktif metabolitleri 4-hidroksiamfetamin ve norefedrindir; normal idrar pH'ında amfetaminin yaklaşık %30-40'ı değişmeden atılır ve kabaca %50'si inaktif metabolitler olarak atılır (alt sıra). Kalan %10-20'si aktif metabolitler olarak atılır. Benzoik asit, XM-ligaz tarafından bir ara ürün olan benzoil-CoA'ya metabolize edilir ve bu da GLYAT tarafından hippurik aside metabolize edilir. ⓘ
|
Farmakomikrobiyomik
İnsan metagenomu (yani, bir bireyin genetik bileşimi ve bireyin vücudunda veya içinde bulunan tüm mikroorganizmalar) bireyler arasında önemli ölçüde farklılık gösterir. İnsan vücudundaki mikrobiyal ve viral hücrelerin toplam sayısı (100 trilyondan fazla) insan hücrelerinden (onlarca trilyon) çok daha fazla olduğundan, ilaçlar ve bir bireyin mikrobiyomu arasında, insan mikrobiyomunun bileşimini değiştiren ilaçlar, ilacın farmakokinetik profilini değiştiren mikrobiyal enzimler tarafından ilaç metabolizması ve bir ilacın klinik etkinliğini ve toksisite profilini etkileyen mikrobiyal ilaç metabolizması gibi etkileşimler için önemli bir potansiyel vardır. Bu etkileşimleri inceleyen alan farmakomikrobiyomik olarak bilinir. ⓘ
Çoğu biyomolekül ve ağızdan verilen diğer ksenobiyotiklere (yani ilaçlara) benzer şekilde, amfetaminin kan dolaşımına emilmeden önce insan gastrointestinal mikrobiyotası (öncelikle bakteriler) tarafından karışık metabolizmaya uğrayacağı tahmin edilmektedir. İlk amfetamin metabolize edici mikrobiyal enzim olan ve insan bağırsağında yaygın olarak bulunan bir E. coli türünden tiramin oksidaz 2019 yılında tanımlanmıştır. Bu enzimin amfetamin, tiramin ve fenetilamini her üç bileşik için de kabaca aynı bağlanma afinitesi ile metabolize ettiği bulunmuştur. ⓘ
İlgili endojen bileşikler
Amfetamin, insan vücudunda ve beyninde doğal olarak oluşan nöromodülatör moleküller olan endojen eser aminlere çok benzer bir yapıya ve işleve sahiptir. Bu grup arasında en yakın ilişkili bileşikler, amfetaminin ana bileşiği olan fenetilamin ve amfetaminin bir izomeri olan N-metilfenetilamindir (yani, aynı moleküler formüle sahiptir). İnsanlarda fenetilamin, L-DOPA'yı da dopamine dönüştüren aromatik amino asit dekarboksilaz (AADC) enzimi tarafından doğrudan L-fenilalaninden üretilir. Buna karşılık, N-metilfenetilamin, norepinefrini epinefrine metabolize eden aynı enzim olan feniletanolamin N-metiltransferaz tarafından fenetilaminden metabolize edilir. Amfetamin gibi, hem fenetilamin hem de N-metilfenetilamin TAAR1 aracılığıyla monoamin nörotransmisyonunu düzenler; amfetaminden farklı olarak, bu maddelerin her ikisi de monoamin oksidaz B tarafından parçalanır ve bu nedenle amfetaminden daha kısa bir yarı ömre sahiptir. ⓘ
Kimya
Rasemik amfetamin
|
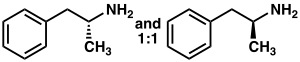
Amfetamin, C9H13N kimyasal formülüne sahip memeli nörotransmitteri fenetilaminin bir metil homologudur. Birincil amine bitişik karbon atomu stereojenik bir merkezdir ve amfetamin iki enantiyomerin rasemik 1:1 karışımından oluşur. Bu rasemik karışım optik izomerlerine ayrılabilir: levoamfetamin ve dekstroamfetamin. Oda sıcaklığında, amfetaminin saf serbest bazı, karakteristik olarak güçlü bir amin kokusuna ve keskin, yakıcı bir tada sahip, hareketli, renksiz ve uçucu bir sıvıdır. Sıklıkla hazırlanan katı amfetamin tuzları arasında amfetamin adipat, aspartat, hidroklorür, fosfat, sakarat, sülfat ve tannat bulunur. Dekstroamfetamin sülfat en yaygın enantiyopür tuzdur. Amfetamin aynı zamanda bir dizi psikoaktif türev içeren kendi yapısal sınıfının ana bileşiğidir. Organik kimyada amfetamin, 1,1'-bi-2-naftolün stereoselektif sentezi için mükemmel bir kiral liganddır. ⓘ
Sübstitüe türevler
Amfetaminin sübstitüe türevleri veya "sübstitüe amfetaminler", "omurga" olarak amfetamin içeren geniş bir kimyasal yelpazesidir; özellikle bu kimyasal sınıf, amfetamin çekirdek yapısındaki bir veya daha fazla hidrojen atomunun sübstitüentlerle değiştirilmesiyle oluşturulan türev bileşikleri içerir. Sınıf, diğer alt grupların yanı sıra amfetaminin kendisini, metamfetamin gibi uyarıcıları, MDMA gibi serotonerjik empatojenleri ve efedrin gibi dekonjestanları içerir. ⓘ
Sentez
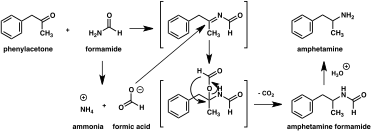
İlk preparatın 1887 yılında rapor edilmesinden bu yana, amfetamin için çok sayıda sentetik yol geliştirilmiştir. Hem yasal hem de yasadışı amfetamin sentezinin en yaygın yolu, Leuckart reaksiyonu olarak bilinen metal olmayan bir indirgeme kullanır (yöntem 1). İlk adımda, fenilaseton ve formamid arasındaki bir reaksiyon, ya ilave formik asit ya da formamidin kendisi bir indirgeyici ajan olarak kullanılarak, N-formilamfetamin verir. Bu ara ürün daha sonra hidroklorik asit kullanılarak hidrolize edilir ve ardından bazlaştırılır, organik çözücü ile ekstrakte edilir, konsantre edilir ve serbest baz elde etmek için damıtılır. Serbest baz daha sonra organik bir çözücü içinde çözülür, sülfürik asit eklenir ve amfetamin sülfat tuzu olarak çökelir. ⓘ
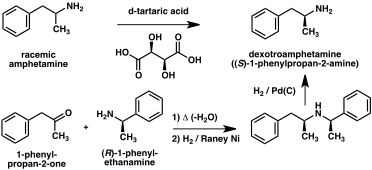
Amfetaminin iki enantiyomerini ayırmak için bir dizi kiral çözünürlük geliştirilmiştir. Örneğin, rasemik amfetamin, dekstroamfetamin elde etmek için fraksiyonel olarak kristalize edilen bir diastereoizomerik tuz oluşturmak üzere d-tartarik asit ile muamele edilebilir. Kiral çözünürlük, büyük ölçekte optik olarak saf amfetamin elde etmek için en ekonomik yöntem olmaya devam etmektedir. Buna ek olarak, birkaç enantiyoselektif amfetamin sentezi geliştirilmiştir. Bir örnekte, optik olarak saf (R)-1-fenil-etanamin, kiral bir Schiff bazı vermek için fenilaseton ile yoğunlaştırılır. Anahtar adımda, bu ara ürün, kiralitenin amino grubuna karbon atomu alfa transferiyle katalitik hidrojenasyon yoluyla indirgenir. Benzil amin bağının hidrojenasyonla koparılması optik olarak saf dekstroamfetamin verir. ⓘ
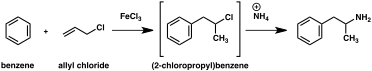
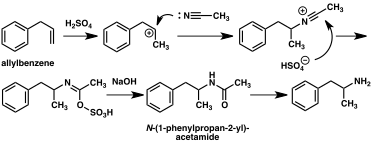
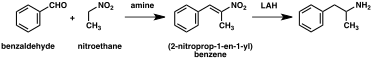
Klasik organik reaksiyonlara dayalı olarak amfetamine giden çok sayıda alternatif sentetik yol geliştirilmiştir. Buna bir örnek, benzenin alil klorür ile Friedel-Crafts alkilasyonu sonucu beta kloropropilbenzenin elde edilmesi ve ardından rasemik amfetamin üretmek için amonyak ile reaksiyona sokulmasıdır (yöntem 2). Bir başka örnekte Ritter reaksiyonu kullanılır (yöntem 3). Bu rotada, allilbenzen sülfürik asit içinde asetonitril ile reaksiyona sokularak bir organosülfat elde edilir ve bu da bir asetamid ara maddesi yoluyla amfetamin vermek için sodyum hidroksit ile muamele edilir. Üçüncü bir yol, metil iyodür ve ardından benzil klorür ile çift alkilasyon yoluyla 2-metil-3-fenil-propanoik aside dönüştürülebilen etil 3-oksobütanoat ile başlar. Bu sentetik ara ürün, Hofmann veya Curtius yeniden düzenlemesi kullanılarak amfetamine dönüştürülebilir (yöntem 4). ⓘ
Amfetamin sentezlerinin önemli bir kısmı nitro, imin, oksim veya diğer azot içeren fonksiyonel grupların indirgenmesini içerir. Böyle bir örnekte, benzaldehitin nitroetan ile Knoevenagel kondenzasyonu fenil-2-nitropropen verir. Bu ara maddenin çift bağı ve nitro grubu ya katalitik hidrojenasyon kullanılarak ya da lityum alüminyum hidrür ile muamele edilerek indirgenir (yöntem 5). Diğer bir yöntem ise fenilasetonun amonyak ile reaksiyona sokularak bir palladyum katalizörü veya lityum alüminyum hidrür üzerinde hidrojen kullanılarak birincil amine indirgenen bir imin ara ürününün üretilmesidir (yöntem 6). ⓘ
|
|
|
Vücut sıvılarında tespit
Amfetamin sıklıkla spor, istihdam, zehirlenme teşhisi ve adli tıp için uyuşturucu testinin bir parçası olarak idrarda veya kanda ölçülür. Amfetamin testinin en yaygın şekli olan immunoassay gibi teknikler, bir dizi sempatomimetik ilaçla çapraz reaksiyon gösterebilir. Yanlış pozitif sonuçları önlemek için amfetamine özgü kromatografik yöntemler kullanılmaktadır. Reçeteli amfetamin, reçeteli amfetamin ön ilaçları (örn. selegilin), levometamfetamin içeren reçetesiz satılan ilaç ürünleri veya yasadışı yollardan elde edilen ikame amfetaminler olsun, ilacın kaynağını ayırt etmeye yardımcı olmak için kiral ayırma teknikleri kullanılabilir. Benzphetamine, clobenzorex, famprofazone, fenproporex, lisdexamfetamine, mesocarb, methamphetamine, prenylamine ve selegiline gibi birçok reçeteli ilaç metabolit olarak amfetamin üretir. Bu bileşikler uyuşturucu testlerinde amfetamin için pozitif sonuçlar üretebilir. Amfetamin genellikle standart bir uyuşturucu testi ile yaklaşık 24 saat boyunca tespit edilebilir, ancak yüksek bir doz 2-4 gün boyunca tespit edilebilir. ⓘ
Tahliller için, bir çalışmada amfetamin ve metamfetamin için enzim çoğaltılmış immünoassay tekniği (EMIT) tahlilinin sıvı kromatografi-tandem kütle spektrometrisinden daha fazla yanlış pozitif üretebileceği belirtilmiştir. Türevlendirici ajan (S)-(-)-trifloroasetilprolil klorür ile amfetamin ve metamfetaminin gaz kromatografisi-kütle spektrometrisi (GC-MS), idrarda metamfetaminin tespit edilmesini sağlar. Amfetamin ve metamfetaminin kiral türevlendirici ajan Mosher asit klorür ile GC-MS'si idrarda hem dekstroamfetamin hem de dekstrometamfetaminin tespit edilmesini sağlar. Dolayısıyla, ikinci yöntem, uyuşturucunun çeşitli kaynaklarını ayırt etmeye yardımcı olmak için diğer yöntemlerle pozitif çıkan numunelerde kullanılabilir. ⓘ
Tarih, toplum ve kültür
| Madde | En iyisi tahmin |
Düşük tahmin |
Yüksek tahmin ⓘ |
|---|---|---|---|
| Amfetamin- tip uyarıcılar |
34.16 | 13.42 | 55.24 |
| Kenevir | 192.15 | 165.76 | 234.06 |
| Kokain | 18.20 | 13.87 | 22.85 |
| Ecstasy | 20.57 | 8.99 | 32.34 |
| Opiatlar | 19.38 | 13.80 | 26.15 |
| Opioidler | 34.26 | 27.01 | 44.54 |
Amfetamin tipi uyarıcılar ilk olarak amfetamin benzeri uyarıcı efedrin içeren Ephedra bitkisinden elde edilmiştir ve Çin'de tahminen 5.000 yıl öncesine dayanan etkileri için kullanılmıştır. Efedrin 1885 yılında Japonya'da Ephedra vulgaris'ten izole edilmiş ve 1920'lere kadar tıbbi özellikleri açısından incelenmiştir. Efedra bitkisinde az miktarda efedrin bulunması, efedrinin sentetik analoglarının araştırılmasına yol açmıştır. ⓘ
Amfetamin ilk olarak 1887 yılında Almanya'da Romanyalı kimyager Lazăr Edeleanu tarafından sentezlenmiş ve fenilizopropilamin olarak adlandırılmıştır; uyarıcı etkileri Gordon Alles tarafından bağımsız olarak yeniden sentezlendiği ve sempatomimetik özelliklere sahip olduğu rapor edildiği 1927 yılına kadar bilinmemekteydi. Amfetaminin, Smith, Kline ve French'in Benzedrine markası altında dekonjestan olarak bir inhaler olarak satmaya başladığı 1933 yılının sonlarına kadar tıbbi bir kullanımı yoktu. Benzedrin sülfat 3 yıl sonra piyasaya sürüldü ve narkolepsi, obezite, düşük tansiyon, düşük libido ve kronik ağrı gibi çok çeşitli tıbbi durumların tedavisinde kullanıldı. İkinci Dünya Savaşı sırasında amfetamin ve metamfetamin, uyarıcı ve performans artırıcı etkileri nedeniyle hem Müttefik hem de Mihver kuvvetleri tarafından yaygın olarak kullanılmıştır. İlacın bağımlılık yapıcı özellikleri bilindikçe, hükümetler amfetamin satışına sıkı kontroller getirmeye başlamıştır. Örneğin, 1970'lerin başında Amerika Birleşik Devletleri'nde amfetamin, Kontrollü Maddeler Yasası kapsamında II. program kontrollü bir madde haline geldi. Sıkı hükümet kontrollerine rağmen, amfetamin yazarlar, müzisyenler, matematikçiler ve sporcular da dahil olmak üzere çeşitli geçmişlerden gelen insanlar tarafından yasal veya yasadışı olarak kullanılmıştır. ⓘ
Amfetamin bugün hala gizli laboratuvarlarda yasadışı olarak sentezlenmekte ve başta Avrupa ülkeleri olmak üzere karaborsada satılmaktadır. Avrupa Birliği (AB) üye ülkeleri arasında 2018 yılında, 15-64 yaş arası 11,9 milyon yetişkin hayatlarında en az bir kez amfetamin veya metamfetamin kullanmıştır ve 1,7 milyonu son bir yıl içinde bunlardan birini kullanmıştır. 2012 yılında AB üyesi ülkelerde yaklaşık 5,9 metrik ton yasadışı amfetamin ele geçirilmiştir; aynı dönemde AB içinde yasadışı amfetaminin "sokak fiyatı" gram başına 6-38 Avro arasında değişmektedir. Avrupa dışında, yasadışı amfetamin pazarı metamfetamin ve MDMA pazarından çok daha küçüktür. ⓘ
Yasal statü
Birleşmiş Milletler 1971 Psikotropik Maddeler Sözleşmesi'nin bir sonucu olarak, amfetamin 183 taraf devletin tamamında, sözleşmede tanımlandığı üzere, II. derece kontrollü madde haline gelmiştir. Sonuç olarak, çoğu ülkede ağır bir şekilde düzenlenmektedir. Güney Kore ve Japonya gibi bazı ülkeler, tıbbi kullanım için bile ikame edilmiş amfetaminleri yasaklamıştır. Kanada (program I ilaç), Hollanda (Liste I ilaç), Amerika Birleşik Devletleri (program II ilaç), Avustralya (program 8), Tayland (kategori 1 narkotik) ve Birleşik Krallık (sınıf B ilaç) gibi diğer ülkelerde amfetamin, tıbbi tedavi olarak kullanılmasına izin veren kısıtlayıcı bir ulusal ilaç programında yer almaktadır. ⓘ
Farmasötik ürünler
Adderall, Adderall XR, Mydayis, Adzenys ER, Adzenys XR-ODT, Dyanavel XR, Evekeo ve Evekeo ODT markaları altında pazarlananlar da dahil olmak üzere, şu anda pazarlanan birkaç amfetamin formülasyonu her iki enantiyomeri de içermektedir. Bunlardan Evekeo (Evekeo ODT dahil) sadece rasemik amfetamin (amfetamin sülfat olarak) içeren tek üründür ve bu nedenle aktif kısmı doğru bir şekilde sadece "amfetamin" olarak adlandırılabilen tek üründür. Dexedrine ve Zenzedi markaları altında pazarlanan dekstroamfetamin, şu anda mevcut olan tek enantiyopür amfetamin ürünüdür. Dekstroamfetaminin bir ön ilaç formu olan lisdexamfetamin de mevcuttur ve Vyvanse markası altında pazarlanmaktadır. Bir ön ilaç olduğu için, lisdexamfetamin yapısal olarak dekstroamfetaminden farklıdır ve dekstroamfetamine metabolize olana kadar inaktiftir. Rasemik amfetaminin serbest bazı daha önce Benzedrine, Psychedrine ve Sympatedrine olarak mevcuttu. Levoamfetamin daha önce Cydril olarak mevcuttu. Serbest bazın nispeten yüksek uçuculuğu nedeniyle mevcut amfetamin farmasötiklerinin çoğu tuzdur. Bununla birlikte, serbest bazdan oluşan oral süspansiyon ve oral olarak parçalanan tablet (ODT) dozaj formları sırasıyla 2015 ve 2016 yıllarında piyasaya sürülmüştür. Mevcut markalardan bazıları ve jenerik eşdeğerleri aşağıda listelenmiştir. ⓘ
| Marka isim |
Birleşik Devletler Benimsenen İsim |
(D:L) oranı |
Dozaj form |
Pazarlama başlangıç tarihi |
ABD'li tüketici fiyat verileri |
Kaynaklar ⓘ |
|---|---|---|---|---|---|---|
| Adderall | – | 3:1 (tuzlar) | tablet | 1996 | GoodRx | |
| Adderall XR | – | 3:1 (tuzlar) | kapsül | 2001 | GoodRx | |
| Mydayis | – | 3:1 (tuzlar) | kapsül | 2017 | GoodRx | |
| Adzenys ER | amfetamin | 3:1 (baz) | askıya alma | 2017 | GoodRx | |
| Adzenys XR-ODT | amfetamin | 3:1 (baz) | ODT | 2016 | GoodRx | |
| Dyanavel XR | amfetamin | 3,2:1 (taban) | askıya alma | 2015 | GoodRx | |
| Evekeo | amfetamin sülfat | 1:1 (tuzlar) | tablet | 2012 | GoodRx | |
| Evekeo ODT | amfetamin sülfat | 1:1 (tuzlar) | ODT | 2019 | GoodRx | |
| Dexedrine | dekstroamfetamin sülfat | 1:0 (tuzlar) | kapsül | 1976 | GoodRx | |
| Zenzedi | dekstroamfetamin sülfat | 1:0 (tuzlar) | tablet | 2013 | GoodRx | |
| Vyvanse | lisdexamfetamine dimesylate | 1:0 (ön ilaç) | kapsül | 2007 | GoodRx | |
| tablet | ||||||
| Xelstrym | dekstroamfetamin | 1:0 (taban) | yama | 2022 | GoodRx |
| İlaç | formül | molar kütle |
amfetamin bazı |
amfetamin bazı eşit dozlarda |
ile dozlar eşit taban İçerik ⓘ | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| (g/mol) | (yüzde) | (30 mg doz) | ||||||||
| toplam | taban | toplam | dextro- | levo- | dextro- | levo- | ||||
| dekstroamfetamin sülfat | (C9H13N)2-H2SO4 | 368.49
|
270.41
|
73.38%
|
73.38%
|
—
|
22.0 mg
|
—
|
30.0 mg
| |
| amfetamin sülfat | (C9H13N)2-H2SO4 | 368.49
|
270.41
|
73.38%
|
36.69%
|
36.69%
|
11.0 mg
|
11.0 mg
|
30.0 mg
| |
| Adderall | 62.57%
|
47.49%
|
15.08%
|
14,2 mg
|
4,5 mg
|
35,2 mg
| ||||
| 25% | dekstroamfetamin sülfat | (C9H13N)2-H2SO4 | 368.49
|
270.41
|
73.38%
|
73.38%
|
—
|
|||
| 25% | amfetamin sülfat | (C9H13N)2-H2SO4 | 368.49
|
270.41
|
73.38%
|
36.69%
|
36.69%
|
|||
| 25% | dekstroamfetamin sakarat | (C9H13N)2-C6H10O8 | 480.55
|
270.41
|
56.27%
|
56.27%
|
—
|
|||
| 25% | amfetamin aspartat monohidrat | (C9H13N)-C4H7NO4-H2O | 286.32
|
135.21
|
47.22%
|
23.61%
|
23.61%
|
|||
| lisdexamfetamine dimesylate | C15H25N3O-(CH4O3S)2 | 455.49
|
135.21
|
29.68%
|
29.68%
|
—
|
8.9 mg
|
—
|
74,2 mg
| |
| amfetamin baz süspansiyon | C9H13N | 135.21
|
135.21
|
100%
|
76.19%
|
23.81%
|
22,9 mg
|
7.1 mg
|
22.0 mg
| |
Etki mekanizmaları
- Aminlerin re-uptake 1 ile nörona alınmasını inhibe ederler.
- Aminlerin vezikülden sinaptik aralığa salınmasını arttırırlar. ⓘ
Klinik kullanım
- Dikkat eksikliğinde ve hiperkinezide
- Latearl hipotalamustaki merkezi inhibe etmesi nedeniyle obezitede
- Dopaminerjik aktivite artışı nedeniyle parkinsonda
- REM dönemini kısalttıkları için narkolepside kullanılırlar. ⓘ